Общая химия
Общая химия
ОглавлениеВВЕДЕНИЕГлава I. АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ 4. Закон сохранения массы. 5. Основное содержание атомно-молекулярного учения. 6. Простое вещество и химический элемент. 7. Закон постоянства состава. 8. Закон объемных отношений. 9. Атомные и молекулярные массы. Моль. 10. Определение молекулярных масс веществ, находящихся в газообразном состоянии.  11. Парциальное давление газа. 12. Эквивалент. Закон эквивалентов. 13. Определение атомных масс. Валентность. 14. Химическая символика. 15. Важнейшие классы и номенклатура неорганических веществ. 16. Химические расчеты. Глава II ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА 17. Периодический закон Д. И. Менделеева. 18. Периодическая система элементов. 19. Значение периодической системы. Глава III СТРОЕНИЕ АТОМА. РАЗВИТИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА 20. Радиоктивность. 21. Ядерная модель атома. 22. Атомные спектры. 23. Квантовая теория света. 24. Строение электронной оболочки атома по Бору. 25. Исходные представления квантовой механики. 27. Энергетическое состояние электрона в атоме. 29. Орбитальное квантовое число. Формы электронных облаков. 30. Магнитное и спиновое квантовые числа. 31. Многоэлектронные атомы. 32. Принцип Паули. Электронная структура атомов и периодическая система элементов.  33. Размеры атомов и ионов. 34. Энергия ионизации и сродство к электрону. 35. Строение атомных ядер. Изотопы. 36. Радиоактивные элементы и их распад. 37. Искусственная радиоктивность. Ядерные реакции. Глава IV. ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ 38. Теория химического строения. 40. Неполярная и полярная ковалентная связь. 41. Способы образования ковалентной связи. 42. Направленность ковалентной связи. 43. Гибридизация атомных электронных орбиталей. 44. Многоцентровые связи. 45. Метод молекулярных орбиталей. 46. Ионная связь. 47. Водородная связь. Глава V. СТРОЕНИЕ ТВЕРДОГО ТЕЛА И ЖИДКОСТИ 48. Межмолекулярное взаимодействие. 49. Кристаллическое состояние вещества. 50. Внутреннее строение кристаллов. 51. Реальные кристаллы. 52. Аморфное состояние вещества. 53. Жидкости. Глава VI. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ  55. Термохимия. 56. Термохимические расчеты. 57. Скорость химической реакции. 59. Зависимость скорости реакции от температуры и от природы реагирующих веществ. 60. Катализ. 61. Скорость реакции в гетерогенных системах. 62. Цепные реакции. 63. Необратимые и обратимые реакции. Химическое равновесие. 64. Смещение химического равновесия. Принцип Ле Шателье. 65. Факторы, определяющие направление протекания химических реакций. 66. Термодинамические величины. Внутренняя энергия и энтальпия. 68. Стандартные термодинамические величины. Химико-термодинамические расчеты. Глава VII. ВОДА, РАСТВОРЫ 69. Вода в природе. 70. Физические свойства воды. 71. Диаграмма состояния воды. 72. Химические свойства воды. 73. Характеристика растворов. Процесс растворения. 74. Способы выражения состава растворов. 75. Гидраты и кристаллогидраты. 76. Растворимость. 77.  Пересыщенные растворы. Пересыщенные растворы.78. Осмос. 79. Давление пара растворов. 80. Замерзание и кипение растворов. Глава VIII. РАСТВОРЫ ЭЛЕКТРОЛИТОВ 82. Теория электролитической диссоциации. 83. Процесс диссоциации. 84. Степень диссоциации. Сила электролитов. 85. Константа диссоциации. 86. Сильные электролиты. 87. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации. 88. Ионно-молекулярные уравнения. 89. Произведение растворимости. 90. Диссоциация воды. Водородный показатель. 91. Смещение ионных равновесий. 92. Гидролиз солей. Глава IX. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. ОСНОВЫ ЭЛЕКТРОХИМИИ 93. Окисленность элементов. 94. Окислительно-восстановительные реакции. 95. Составление уравнений окислительно-восстановительных реакций. 97. Окислительно-восстановительная двойственность. 98.  Химические источники электрической энергии. Химические источники электрической энергии.99. Электродные потенциалы. 100. Ряд напряжений металлов. 101. Электролиз. 102. Законы электролиза. 103. Электролиз в промышленности. 104. Электрохимическая поляризация. Глава X. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДЫ 105. Дисперсное состояние вещества. 106. Состояние вещества на границе раздела фаз. 107. Коллоиды и коллоидные растворы. 109. Сорбция и сорбционные процессы. 110. Ионообменная адсорбция. 111. Хроматография. 112. Электрокинетические явления. 113. Устойчивость и коагуляция дисперсных систем. 114. Структурообразование в дисперсных системах. Глава XI. ВОДОРОД 115. Водород в природе. Получение водорода. 116. Свойства и применение водорода. 117. Пероксид водорода Глава XII. ГАЛОГЕНЫ 118. Галогены в природе. Физические свойства галогенов. 119. Химические свойства галогенов. 120. Получение и применение галогенов. 121.  122. Кислородсодержащие соединения галогенов. Глава XIII. ГЛАВНАЯ ПОДГРУППА ШЕСТОЙ ГРУППЫ 123. Кислород в природе. Воздух. 124. Получение и свойства кислорода. 125. Озон. 126. Сера в природе. Получение серы. 127. Свойства и применение серы. 128. Сероводород. Сульфиды. 129. Диоксид серы. Сернистая кислота. 130. Триоксид серы. Серная кислота. 131. Получение и применение серной кислоты. 132. Пероксодвусерная кислота. 133. Тиосерная кислота. 134. Соединения серы с галогенами. 135. Селен (Selenium). Теллур (Tellurium). Глава XIV. ГЛАВНАЯ ПОДГРУППА ПЯТОЙ ГРУППЫ 136. Азот в природе. Получение и свойства азота. 138. Фиксация атмосферного азота. Получение аммиака. 139. Гидразин. Гидроксиламин. Азидоводород. 140. Оксиды азота. 141. Азотистая кислота. 142. Азотная кислота. 143. Промышленное получение азотной кислоты. 144. Круговорот азота в природе.  145. Фосфор в природе. Получение и свойства фосфора. 146. Соединения фосфора с водородом и галогенами. 147. Оксиды и кислоты фосфора. 148. Минеральные удобрения. 149. Мышьяк (Arsenicum). 150. Сурьма (Stibium). 151. Висмут (Bismuthum). 152. Углерод в природе. 153. Аллотропия углерода. 154. Химические свойства углерода. Карбиды. 155. Диоксид углерода. Угольная кислота. 156. Оксид углерода (II). 157. Соединения углерода с серой и азотом. 158. Топливо и его виды. 159. Газообразное топливо. 160. Общая характеристика органических соединений. 161. Отличительные особенности органических соединений. 162. Теория химического строения органических соединений. 163. Классификация органических соединений. 164. Предельные (насыщенные) углеводороды. 165. Непредельные (ненасыщенные) углеводороды. 166. Предельные циклические углеводороды. 167. Ароматические углеводороды. 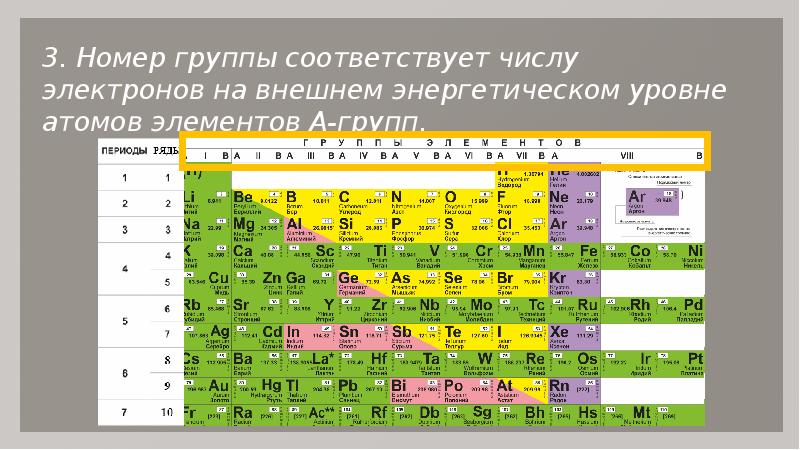 168. Галогенпроизводные углеводородов. 169. Спирты и фенолы. 170. Простые эфиры. 171. Альдегиды и кетоны. 172. Карбоновые кислоты. 173. Сложные эфиры карбоновых кислот. Жиры. 174. Углеводы. 175. Амины. 176. Аминокислоты и белки. 177. Природные и синтетические высокомолекулярные соединения (полимеры). 178. Кремний в природе. Получение и свойства кремния. 179. Соединения кремния с водородом и галогенами. 180. Диоксид кремния. 181. Кремниевые кислоты и их соли. 182. Стекло. 183. Керамика. 184. Цемент. 185. Кремнийорганические соединения. 187. Олово (Stannuin). 188. Свинец (Plumbum). 189. Свинцовый аккумулятор. Глава XVI. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ. СПЛАВЫ 190. Физические и химические свойства металлов. Электронное строение металлов, изоляторов и полупроводников. 191. Кристаллическое строение металлов. 192. Добывание металлов из руд. 193. Получение металлов высокой чистоты.  194. Сплавы. 195. Диаграммы состояния металлических систем. 196. Коррозия металлов. Глава XVII. ПЕРВАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ 197. Щелочные металлы в природе. 198. Натрий (Natrium). 199. Калий (Kalium). ПОДГРУППА МЕДИ 200. Медь. (Cuprum). 201. Серебро (Argentum). 202. Золото (Aurum). Глава XVIII. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ 203. Основные положения координационной теории. 204. Основные типы и номенклатура комплексных соединений. 205. Пространственное строение и изомерия комплексных соединений. 206. Природа химической связи в комплексных соединениях. 207. Диссоциация комплексных соединений в растворах. 208. Влияние координации на свойства лигандов и центрального атома. Глава XIX. ВТОРАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ 209. Бериллий (Beryllium). 210. Магний (Magnesium). 211. Кальций (Calcium). 212. Жесткость природных вод и ее устранение. 213. Стронций (Strontium). Барий (Barium). 214. Цинк (Zincum). 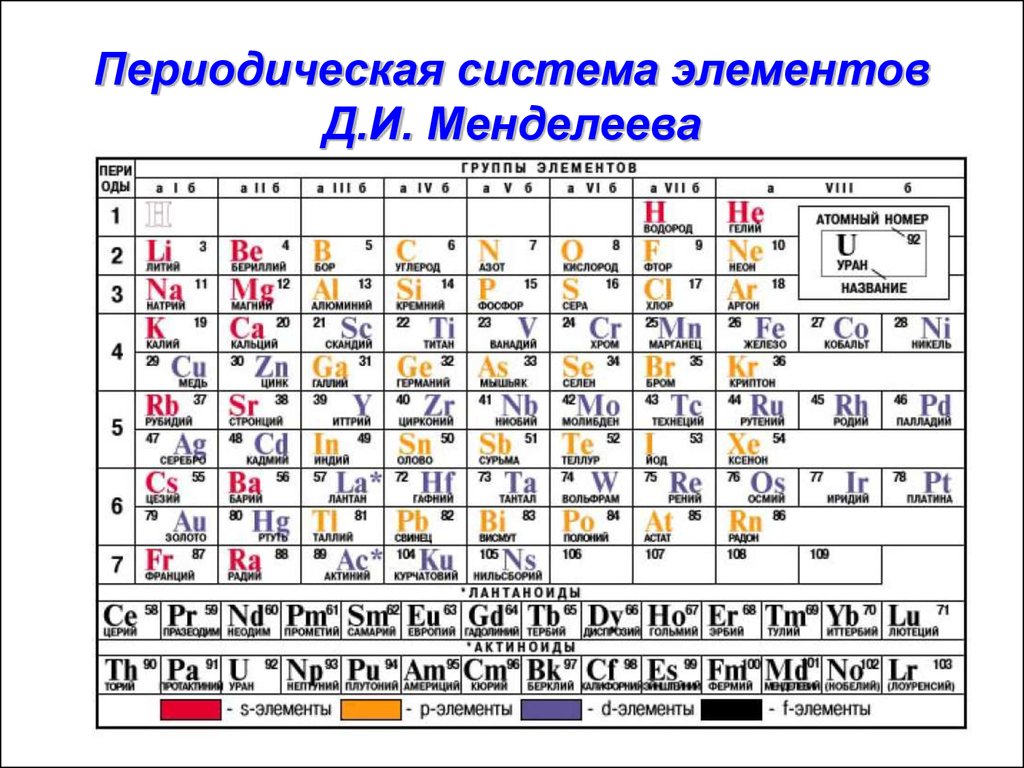 215. Кадмий (Cadmium). 216. Ртуть (Hydrargyrum). Глава XX. ТРЕТЬЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ 217. Бор (Borum). 218. Алюминий (Aluminium). 219. Галлий (Gallium). Иидий (Indium). Таллий (Thallium). ПОБОЧНАЯ ПОДГРУППА ТРЕТЬЕЙ ГРУППЫ. ЛАНТАНОИДЫ. АКТИНОИДЫ 220. Подгруппа скандия. 221. Лантаноиды. 222. Актиноиды. Глава XXI. ПОБОЧНЫЕ ПОДГРУППЫ ЧЕТВЕРТОЙ, ПЯТОЙ, ШЕСТОЙ И СЕДЬМОЙ ГРУПП ПОДГРУППА ТИТАНА 224. Титан (Titanium). 225. Цирконий (Zirconium). Гафний (Hafnium). ПОДГРУППА ВАНАДИЯ 226. Ванадий (Vanadium). 227. Ниобий (Niobium). Тантал (Tantalum). ПОДГРУППА ХРОМА 228. Хром (Chromium). 229. Молибден (Mollbdenium). 230. Вольфрам (Wolfram). ПОДГРУППА МАРГАНЦА 231. Марганец (Manganum). 232. Рений (Rhenium). Глава XXII. ВОСЬМАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ 233. Общая характеристика благородных газов. 234. Гелий (Helium). 235. Неон. Аргон. ПОБОЧНАЯ ПОДГРУППА ВОСЬМОЙ ГРУППЫ 236. 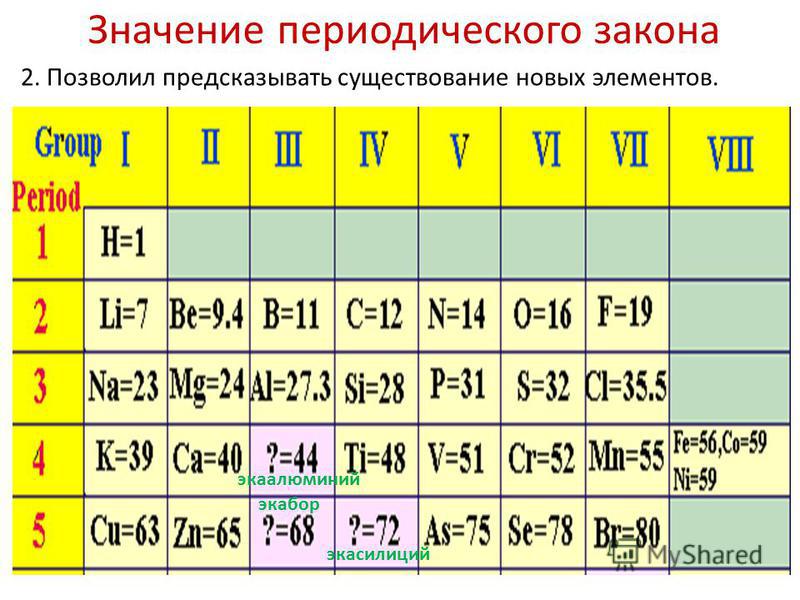 Железо (Ferrum). Железо (Ferrum).237. Значение железа и его сплавов в технике. Развитие металлургии в СССР. 238. Физические свойства железа. Диаграмма состояния системы железо — углерод. 239. Производство чугуна и стали. 240. Термическая обработка стали. 241. Сплавы железа. 242. Химические свойства железа. Соединения железа. 243. Кобальт (Cobaltum). 244. Никель (Niccolum). 245. Общая характеристика платиновых металлов. 246. Платина (Platinum). 247. Палладий (Palladium). Иридий (Iridium). ПРИЛОЖЕНИЕ Некоторые единицы СИ Множители и приставки для образования десятичных кратных и дольных единиц и их наименований Соотношения между некоторыми внесистемными единицами и единицами СИ Литература для углубленного изучения общей и неорганической химии |
история открытия и развитие, открытие свойств химических элементов
Химия
12.11.21
15 мин.
В развитии химии и других взаимосвязанных с ней наук отводится огромное значение периодическому закону и открытию периодической системы. На протяжении многих столетий ученые всего мира пытались найти и объяснить существующую закономерность и упорядочить элементы. Однако только в XIX веке великий ученый Дмитрий Менделеев сумел точно описать свойства химических элементов и на основании этого составить таблицу.
На протяжении многих столетий ученые всего мира пытались найти и объяснить существующую закономерность и упорядочить элементы. Однако только в XIX веке великий ученый Дмитрий Менделеев сумел точно описать свойства химических элементов и на основании этого составить таблицу.
История открытия
Многие ученые считают, что именно с открытием периодического закона начался современный этап развития химии и физики. Все известные химические элементы рассматривались в зависимости от того, на каком месте они расположены в периодической системе Менделеева. Наука перестала быть строго описательной и стала предсказательной, появилась возможность прогнозировать и предвидеть. Доказательством тому стало открытие предсказанных Д. Менделеевым скандия, галлия, германия и некоторых других элементов. Это способствовало основательному признанию периодического закона всем научным миром.
На момент составления таблицы далеко не все элементы уже были известны. Поэтому ученый намеренно пропускал незаполненные клетки. Пытаясь предсказать существование и открытие элементов, ученый назвал их предположительно экабор (в соответствии с тем, что свойства были схожи с бором), а также экасилиций и экаалюминий. Научное предположение химика подтвердилось уже в течение следующих 15 лет:
Поэтому ученый намеренно пропускал незаполненные клетки. Пытаясь предсказать существование и открытие элементов, ученый назвал их предположительно экабор (в соответствии с тем, что свойства были схожи с бором), а также экасилиций и экаалюминий. Научное предположение химика подтвердилось уже в течение следующих 15 лет:
- галлий был открыт французским ученым Лекоком де-Буабодраном;
- скандий обнаружил и исследовал шведский химик Нельсон;
- германий представлен миру науки в докладе немецкого специалиста Винклера.
Появление этих элементов стало настоящим триумфом и подтверждением правильности суждений Менделеева. К середине XIX столетия было известно всего 63 наименования, а попытку расположить их в соответствии с атомной массой предпринимал сначала Александр Эмиль Шанкуртуа в 1862 году, затем в 1866-м Джон Александр Ньюлендс, но выводимые ими закономерности не находили научного подтверждения и не имели научной силы.
В 1864 году появлялись сообщения о попытках систематизации элементов Юлиусом Лотаром Мейером, который основой периодичности считал валентность.
1869 год стал датой официального открытия периодического закона Менделеева. Впервые таблица была опубликована в популярном журнале Русского химического сообщества. Впоследствии ученые согласились с выводами химика, и опубликованная система стала общепризнанной во всем мире.
Работа ученого длилась более 20 лет. За это время Менделеев писал на карточках свойства известных элементов, неоднократно переставляя их и меняя порядок расположения, составлял конспекты и доклады. Основой упорядочивания стал атомный вес и химическое сходство, позволившие создать единую систему и открыть периодический закон.
Практический смысл
Формулировка периодического закона стала великим открытием для всего мира. Несмотря на все предпосылки и попытки других ученых опровергнуть исследования Менделеева, доказательства оправдали многолетний труд великого химика.
В науке периодический закон и ПСХЭ выполняют важные функции:
- систематизируют и обобщают всю информацию об элементах, веществах и соединениях в единое целое;
- обосновывают виды периодичности при изменении химических свойств и образовании сложных или простых веществ;
- позволяют прогнозировать появление неоткрытых элементов, охарактеризовать их предположительные свойства;
- создают базу для определения принципа строения электронных оболочек и атомного ядра.

Ученые всего мира единогласно признали огромное и важное значение периодического закона Менделеева и его периодической системы.
В наше время используется современная, отличающаяся от первоначальной, формулировка: свойства химических элементов и их соединений находятся в периодической зависимости от величины заряда ядер их атомов, выражающейся в периодической повторяемости структуры внешней валентной электронной оболочки.
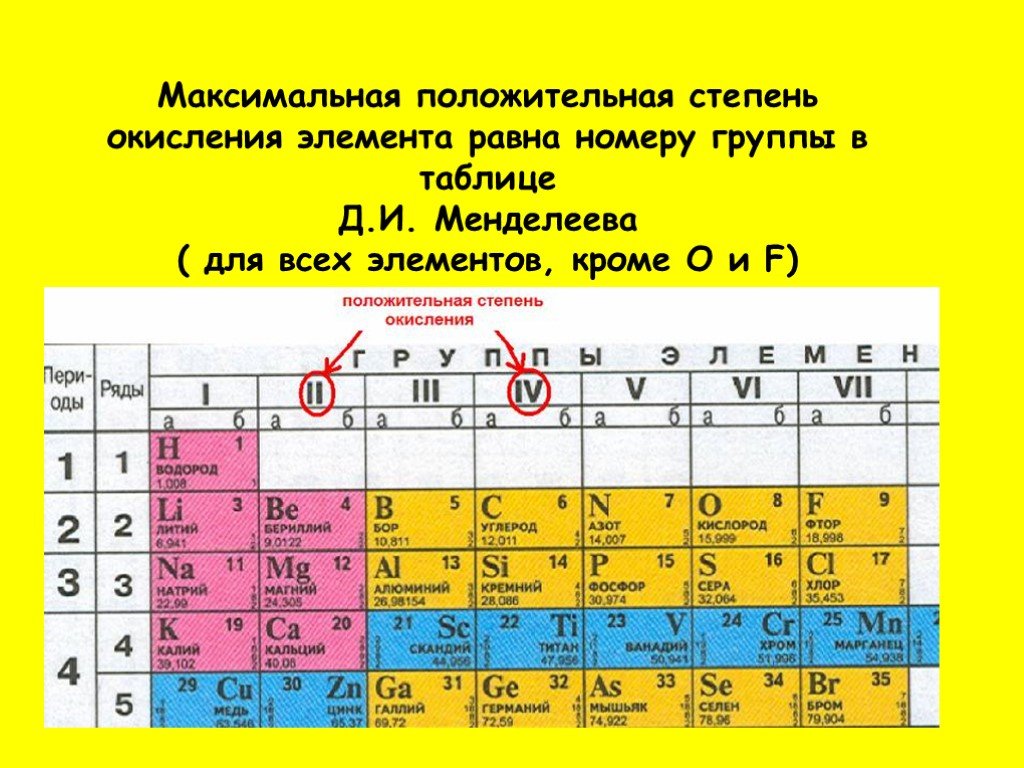
Величайшее достижение русского химика заключается не только в упорядочивании известных в природе элементов, но и в краткой характеристике, которая зашифрована в клетке с каждым названием. Например, заряд ядра обозначает число, соответствующее порядковому номеру. По мере увеличения заряда ядра растет и количество электронов, соответственно, изменяются и свойства. Согласно теории ученого, номер периода отображает количество электронных оболочек.
В познании элементов и их свойств особое значение в периодической системе Менделеева получил водород.
В таблице ему отведено две клетки — в 1-й и 7-й группах, в соответствии с количеством электронов на внешнем уровне и одним недостающим электроном для завершения галогенного внешнего уровня.
В XX столетии работа над дальнейшим созданием и дополнением таблицы продолжается. Современная химия решает вопросы не только науки, но и промышленности, фармацевтики и других сфер деятельности человека. На основании имеющихся сведений разрабатывается получение новейших полимеров и полупроводников, жаростойких сплавов и веществ с заданными изначально свойствами.
В развитии химии и других взаимосвязанных с ней наук отводится огромное значение периодическому закону и открытию периодической системы. На протяжении многих столетий ученые всего мира пытались найти и объяснить существующую закономерность и упорядочить элементы. Однако только в XIX веке великий ученый Дмитрий Менделеев сумел точно описать свойства химических элементов и на основании этого составить таблицу.
История открытия
Многие ученые считают, что именно с открытием периодического закона начался современный этап развития химии и физики. Все известные химические элементы рассматривались в зависимости от того, на каком месте они расположены в периодической системе Менделеева. Наука перестала быть строго описательной и стала предсказательной, появилась возможность прогнозировать и предвидеть. Доказательством тому стало открытие предсказанных Д. Менделеевым скандия, галлия, германия и некоторых других элементов. Это способствовало основательному признанию периодического закона всем научным миром.
На момент составления таблицы далеко не все элементы уже были известны. Поэтому ученый намеренно пропускал незаполненные клетки. Пытаясь предсказать существование и открытие элементов, ученый назвал их предположительно экабор (в соответствии с тем, что свойства были схожи с бором), а также экасилиций и экаалюминий. Научное предположение химика подтвердилось уже в течение следующих 15 лет:
- галлий был открыт французским ученым Лекоком де-Буабодраном;
- скандий обнаружил и исследовал шведский химик Нельсон;
- германий представлен миру науки в докладе немецкого специалиста Винклера.

Появление этих элементов стало настоящим триумфом и подтверждением правильности суждений Менделеева. К середине XIX столетия было известно всего 63 наименования, а попытку расположить их в соответствии с атомной массой предпринимал сначала Александр Эмиль Шанкуртуа в 1862 году, затем в 1866-м Джон Александр Ньюлендс, но выводимые ими закономерности не находили научного подтверждения и не имели научной силы.
В 1864 году появлялись сообщения о попытках систематизации элементов Юлиусом Лотаром Мейером, который основой периодичности считал валентность.
1869 год стал датой официального открытия периодического закона Менделеева. Впервые таблица была опубликована в популярном журнале Русского химического сообщества. Впоследствии ученые согласились с выводами химика, и опубликованная система стала общепризнанной во всем мире.
Работа ученого длилась более 20 лет. За это время Менделеев писал на карточках свойства известных элементов, неоднократно переставляя их и меняя порядок расположения, составлял конспекты и доклады. Основой упорядочивания стал атомный вес и химическое сходство, позволившие создать единую систему и открыть периодический закон.
Основой упорядочивания стал атомный вес и химическое сходство, позволившие создать единую систему и открыть периодический закон.
Практический смысл
Формулировка периодического закона стала великим открытием для всего мира. Несмотря на все предпосылки и попытки других ученых опровергнуть исследования Менделеева, доказательства оправдали многолетний труд великого химика.
В науке периодический закон и ПСХЭ выполняют важные функции:
- систематизируют и обобщают всю информацию об элементах, веществах и соединениях в единое целое;
- обосновывают виды периодичности при изменении химических свойств и образовании сложных или простых веществ;
- позволяют прогнозировать появление неоткрытых элементов, охарактеризовать их предположительные свойства;
- создают базу для определения принципа строения электронных оболочек и атомного ядра.
Ученые всего мира единогласно признали огромное и важное значение периодического закона Менделеева и его периодической системы.
В наше время используется современная, отличающаяся от первоначальной, формулировка: свойства химических элементов и их соединений находятся в периодической зависимости от величины заряда ядер их атомов, выражающейся в периодической повторяемости структуры внешней валентной электронной оболочки.
Величайшее достижение русского химика заключается не только в упорядочивании известных в природе элементов, но и в краткой характеристике, которая зашифрована в клетке с каждым названием. Например, заряд ядра обозначает число, соответствующее порядковому номеру. По мере увеличения заряда ядра растет и количество электронов, соответственно, изменяются и свойства. Согласно теории ученого, номер периода отображает количество электронных оболочек.
В познании элементов и их свойств особое значение в периодической системе Менделеева получил водород. В таблице ему отведено две клетки — в 1-й и 7-й группах, в соответствии с количеством электронов на внешнем уровне и одним недостающим электроном для завершения галогенного внешнего уровня.
В XX столетии работа над дальнейшим созданием и дополнением таблицы продолжается. Современная химия решает вопросы не только науки, но и промышленности, фармацевтики и других сфер деятельности человека. На основании имеющихся сведений разрабатывается получение новейших полимеров и полупроводников, жаростойких сплавов и веществ с заданными изначально свойствами.
Атомные свойства
Электроны
Для l = 0 существует только один тип орбитали (m = 0), s-орбиталь. Для l = 1, p существует 3 типа орбиталей (m = -1, 0, 1), которые мы знаем как p x , p y и p z орбиталей.  Для l = 2 существует 5 видов d-орбиталей (m = -2, -2, 0, 1, 2). Максимум два электрона могут занимать каждую орбиталь со спиновым квантовым числом 1/2 или -1/2. Формы простейших s-, p- и d-орбиталей показаны ниже. Для l = 2 существует 5 видов d-орбиталей (m = -2, -2, 0, 1, 2). Максимум два электрона могут занимать каждую орбиталь со спиновым квантовым числом 1/2 или -1/2. Формы простейших s-, p- и d-орбиталей показаны ниже.Орбитали отличаются количеством узлов . Узловая плоскость — это плоскость, в которой плотность электронов точно равна нулю. Посмотрите на синусоиду справа. Думайте об этом как о двухмерном представлении p-орбитали. Часть линии выше базовой линии заключает в себе математически положительную часть функции электронной плотности. Кривая ниже базовой линии охватывает математически отрицательную часть функции электронной плотности. Эта орбиталь имеет узловую плоскость, плоскость, в которой электронная плотность равна нулю, в ядре. 1s-орбиталь имеет 0 радиальных узлов, 2p-орбитали имеют по 1 узлу, 3d-орбитали имеют 2 узла и т. д. Когда на орбитали находятся 2 электрона, их спины (1/2, -1/2) сокращаются. Только когда на орбиталях есть неспаренные электроны, атом или молекула имеют чистый электронный спин. Окисление = потеря одного или нескольких электронов Восстановление = приобретение одного или нескольких электронов
|
Части периодической таблицы
Части периодической таблицыПериодические тенденции — электроотрицательность
| 1А | 2А | 3А | 4А | 5А | 6А | 7А | 8А | ||||||||||||
| (1) | (2) | (13) | (14) | (15) | (16) | (17) | (18) | ||||||||||||
| 3Б | 4Б | 5Б | 6Б | 7Б | — | 8Б | — | 1Б | 2Б | ||||||||||
| (3) | (4) | (5) | (6) | (7) | (8) | (9) | (10) | (11) | (12) | ||||||||||
| 1 | Х 2,20 | Он н. | |||||||||||||||||
| 2 | Ли 0,98 | Быть 1,57 | Б 2,04 | С 2,55 | Н 3,04 | О 3,44 | Ф 3,98 | Не н. | |||||||||||
| 3 | На 0,93 | мг 1,31 | Ал 1,61 | Си 1,90 | Р 2,19 | С 2,58 | Кл 3,16 | Ар н. | |||||||||||
| 4 | К 0,82 | Са 1,00 | Sc 1,36 | Ти 1,54 | В 1,63 | Кр 1,66 | Мн 1,55 | Фе 1,83 | Со 1,88 | Ni 1,91 | Медь 1,90 | Цинк 1,65 | Га 1,81 | Гэ 2,01 | Как 2,18 | Се 2,55 | Бр 2,96 | Кр 3,00 | |
| 5 | руб. 0,82 | Старший 0,95 | Д 1,22 | Зр 1,33 | № 1,60 | Пн 2,16 | ТК 1,90 | Ру 2,20 | Рх 2,28 | Pd 2,20 | Аг 1,93 | CD 1,69 | В 1,78 | Сн 1,96 | Сб 2,05 | Те 2. | я 2,66 | Хе 2,60 | |
| 6 | Cs 0,79 | Ба 0,89 | Ла 1,10 | Хф 1,30 | Та 1,50 | Вт 2,36 | Ре 1,90 | ОС 2,20 | Ир 2,20 | часть 2,28 | Золото 2,54 | рт. 2,00 | Тл 1,62 | Пб 2,33 | Би 2,02 | ПО 2,00 | В 2,20 | Р-н н.д. | |
| 7 | Пт 0,70 | Ра 0,89 | Ас 1,10 | РФ н.д. | Дб н. | Сг н.д. | Бх н.д. | Гс н.д. | Мт н.д. | Дс н.д. | № н.д. | Ууб н.д. | — | Уук н.д. | — | — | — | — | |
| 6 | Се 1,12 | Пр 1,13 | Нд 1,14 | вечера 1,13 | См 1,17 | ЕС 1,20 | Гд 1,20 | Тб 1,10 | Дай 1,22 | Хо 1,23 | Er 1,24 | Тм 1,25 | Ыб 1,10 | Лу 1,27 | |||||
| 7 | 1,30 | Па 1,50 | У 1,38 | Нп 1,36 | Пу 1,28 | Ам 1,30 | См 1,30 | Бк 1,30 | См. 1,30 | Эс 1,30 | Fm 1,30 | Мд 1,30 | № 1,30 | Лр 1,30 |
Электроотрицательность в единицах Полинга
Данные взяты у Джона Эмсли, The Elements , 3-е издание. Оксфорд: Clarendon Press, 1998.
.
Электроотрицательность относится к способности атома притягивать общие электронов в ковалентной связи. Чем выше значение электроотрицательность, тем сильнее этот элемент притягивает общие электроны.
Концепция электроотрицательности была введена Лайнусом Полингом. в 1932 году; по шкале Полинга фтору присваивается электроотрицательность 3,98, а остальные элементы масштабируются относительно этого значения. Другие шкалы электроотрицательности включают шкалу Малликена, предложенную Робертом С. Малликеном в 1919 году.34, в котором первая энергия ионизации и сродство к электрону усредняются вместе, и шкала Оллреда-Рохова, которая измеряет электростатическую притяжение между ядром атома и его валентными электронами.
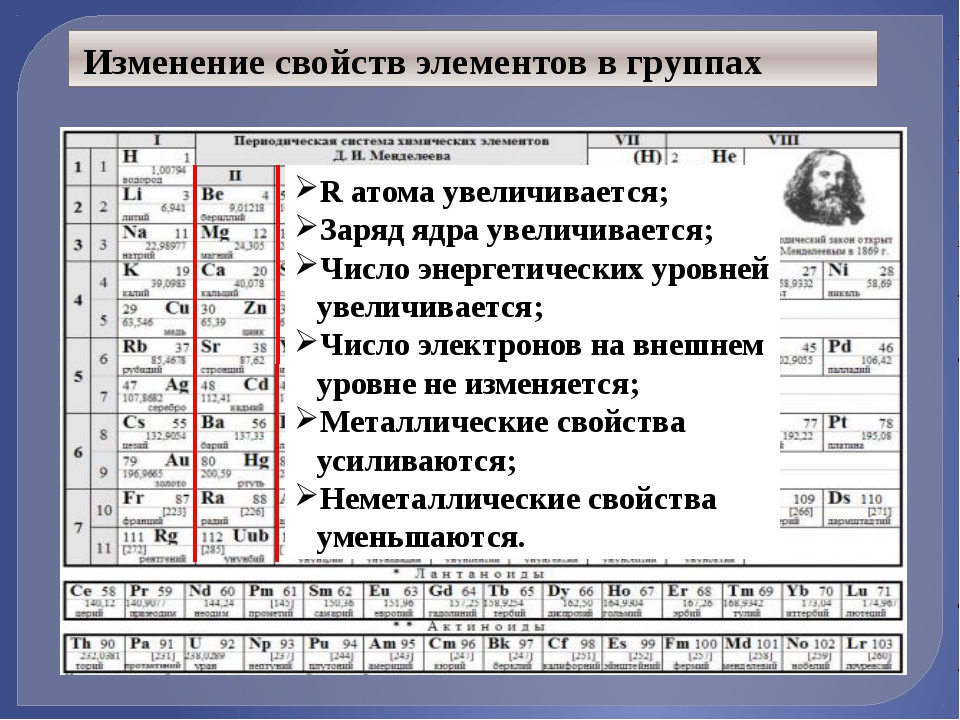
Электроотрицательность изменяется предсказуемым образом в периодическом стол. Электроотрицательность возрастает снизу вверх в группы и увеличиваются слева направо по периодам . Таким образом, фтор – самый электроотрицательный элемент, а франций – один из из наименее электроотрицательных. (Гелий, неон и аргон не перечислены в шкале электроотрицательности Полинга, хотя в По шкале Allred-Rochow гелий имеет самую высокую электроотрицательность.
) Тенденции не очень гладкие среди переходных металлов и внутренних переходных металлов, но достаточно регулярны для основных элементов группы, и их можно увидеть в диаграммы ниже.
Разница в электроотрицательности между двумя связанными элементами определяет, какой тип связи они образуют. Когда атомы с разницей электроотрицательностей больше чем две единицы соединены вместе, связь, которая образуется, ионная связь , в которой более электроотрицательный элемент имеет отрицательный заряд, а менее электроотрицательный элемент имеет положительный заряд. (В качестве аналогии вы можете думать об этом как игра в перетягивание каната, в которой одна команда достаточно сильна, чтобы тянуть веревку от другой команды.
) Например, натрий имеет электроотрицательность 0,93, а хлор имеет электроотрицательность 3,16, поэтому, когда натрий и хлор образуют ионное связь, при которой хлор отбирает электрон у натрия, образуя катион натрия, Na + и хлорид-анион, Кл – . Отдельные ионы натрия и хлора не «связаны» вместе, но очень сильно притягивают друг друга из-за противоположные заряды и образуют прочную кристаллическую решетку.
Когда атомы с разницей электроотрицательностей менее двух звенья соединяются вместе, образующаяся связь представляет собой ковалентную связь . связь , в которой электроны являются общими для обоих атомов. Когда два одинаковых атома делят электроны в ковалентной связи, между ними нет разницы в электроотрицательности, и электроны в ковалентной связи являются общими равно — тот то есть существует симметричное распределение электронов между связанными атомами.
Эти связи являются неполярными ковалентные связи . (В качестве аналогии вы можете думать об этом как игра в перетягивание каната между двумя одинаково сильными командами, в которой веревка не двигается.) Например, когда два хлора атомы соединены ковалентной связью, электроны проводят так же, как много времени близко к одним атомам хлора, как и к другим, и полученная молекула неполярна:
Когда разница электроотрицательностей находится в диапазоне от 0 до 2, более электроотрицательный элемент больше притягивает общий сильно, но недостаточно сильно, чтобы полностью удалить электроны. образуют ионное соединение. Электроны общие неравномерно — то есть есть несимметричный распределение электронов между связанными атомами. Эти связи называются полярными ковалентными связями.
Чем больше электроотрицательный атом имеет частичный отрицательный заряд , д – , потому что электроны проводят больше времени ближе к этому атому, в то время как меньше электроотрицательный атом имеет частичный положительный заряд , d + , потому что электроны частично (но не полностью) отрываются от этого атом. Например, в молекуле хлороводорода хлор электроотрицательнее водорода на 0,96 единицы электроотрицательности. Общие электроны проводят больше времени близко к атому хлора, что делает хлорный конец молекулы очень слабо отрицательное (обозначено на рисунке ниже синим цветом). заштрихованная область), в то время как водородный конец молекулы очень слегка положительный (обозначен красной заштрихованной областью), а полученная молекула полярна:
Для молекул с более чем одной ковалентной связью трехмерная форма молекулы и как устроены полярные связи ориентированы друг относительно друга, определяет, молекула полярна.



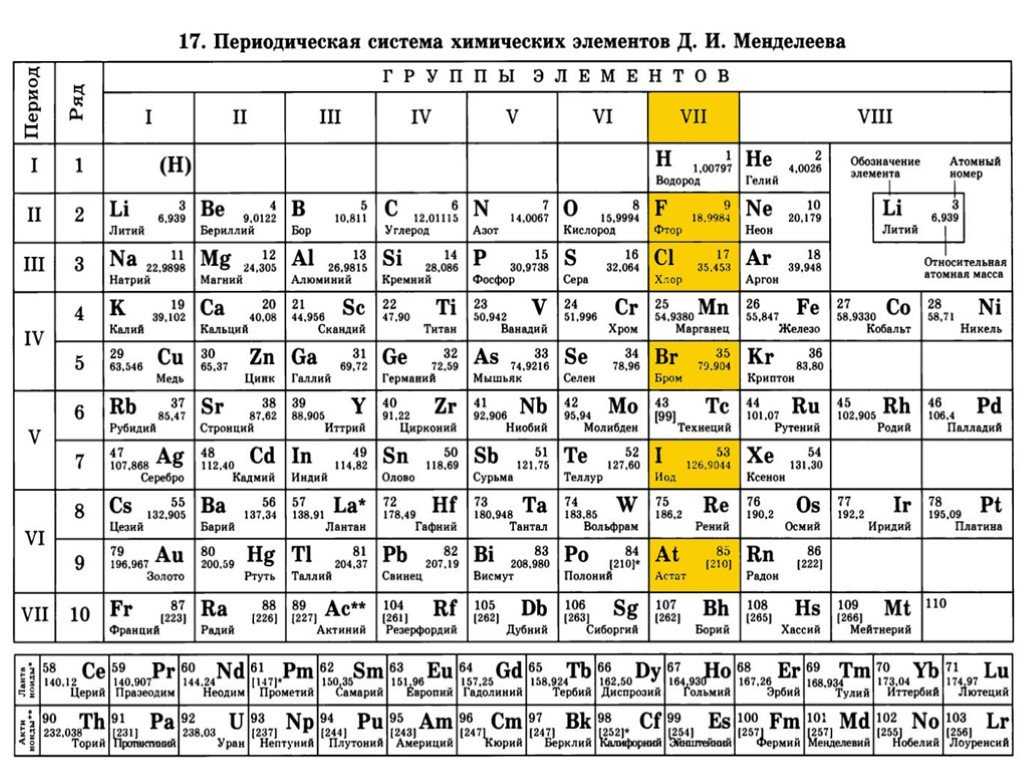 В таблице ему отведено две клетки — в 1-й и 7-й группах, в соответствии с количеством электронов на внешнем уровне и одним недостающим электроном для завершения галогенного внешнего уровня.
В таблице ему отведено две клетки — в 1-й и 7-й группах, в соответствии с количеством электронов на внешнем уровне и одним недостающим электроном для завершения галогенного внешнего уровня.
 Атомный номер углерода равен 6.
Атомный номер углерода равен 6.
 Титан расположен на 4 элемента слева и имеет 4 валентных электрона. Он находится в строке, соответствующей n=4, поэтому его электронная конфигурация нейтрального атома: [Ar]4s 2 4d 2 .
Титан расположен на 4 элемента слева и имеет 4 валентных электрона. Он находится в строке, соответствующей n=4, поэтому его электронная конфигурация нейтрального атома: [Ar]4s 2 4d 2 . д.
д. д.
д. д.
д. 10
10 ст.
ст. д.
д.

 ) Тенденции не очень гладкие
среди переходных металлов и внутренних переходных металлов, но
достаточно регулярны для основных элементов группы, и их можно увидеть в
диаграммы ниже.
) Тенденции не очень гладкие
среди переходных металлов и внутренних переходных металлов, но
достаточно регулярны для основных элементов группы, и их можно увидеть в
диаграммы ниже. ) Например, натрий
имеет электроотрицательность 0,93, а хлор имеет
электроотрицательность 3,16, поэтому, когда натрий и хлор образуют ионное
связь, при которой хлор отбирает электрон у натрия,
образуя катион натрия, Na + и хлорид-анион,
Кл – . Отдельные ионы натрия и хлора не
«связаны» вместе, но очень сильно притягивают друг друга из-за
противоположные заряды и образуют прочную кристаллическую решетку.
) Например, натрий
имеет электроотрицательность 0,93, а хлор имеет
электроотрицательность 3,16, поэтому, когда натрий и хлор образуют ионное
связь, при которой хлор отбирает электрон у натрия,
образуя катион натрия, Na + и хлорид-анион,
Кл – . Отдельные ионы натрия и хлора не
«связаны» вместе, но очень сильно притягивают друг друга из-за
противоположные заряды и образуют прочную кристаллическую решетку.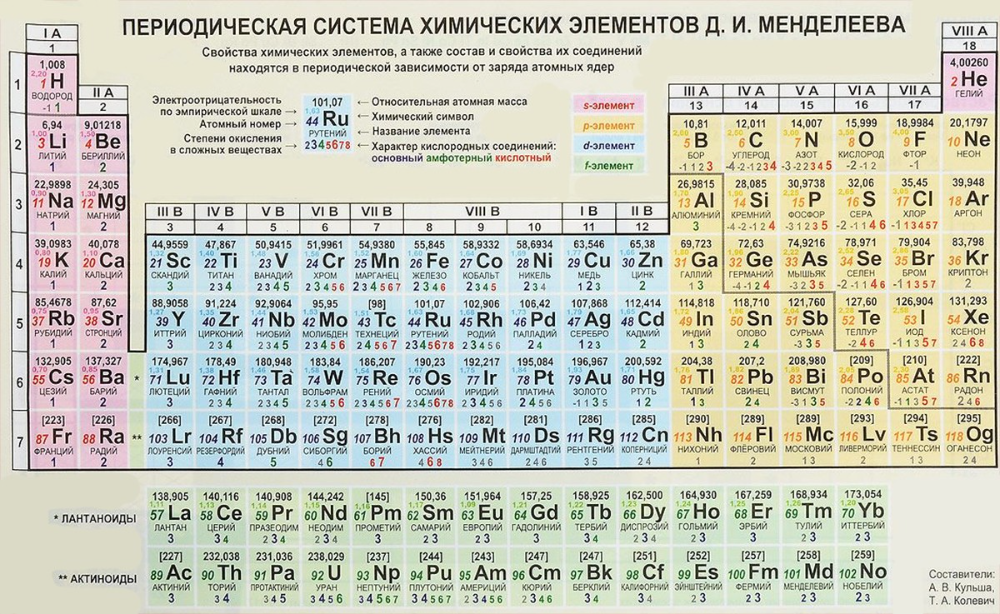 Эти связи являются неполярными
ковалентные связи . (В качестве аналогии вы можете думать об этом как
игра в перетягивание каната между двумя одинаково сильными командами, в которой
веревка не двигается.) Например, когда два хлора
атомы соединены ковалентной связью, электроны проводят так же, как
много времени близко к одним атомам хлора, как и к другим, и
полученная молекула неполярна:
Эти связи являются неполярными
ковалентные связи . (В качестве аналогии вы можете думать об этом как
игра в перетягивание каната между двумя одинаково сильными командами, в которой
веревка не двигается.) Например, когда два хлора
атомы соединены ковалентной связью, электроны проводят так же, как
много времени близко к одним атомам хлора, как и к другим, и
полученная молекула неполярна: Чем больше
электроотрицательный атом имеет частичный отрицательный заряд , д – , потому что
электроны проводят больше времени ближе к этому атому, в то время как меньше
электроотрицательный атом имеет частичный положительный заряд , d + , потому что
электроны частично (но не полностью) отрываются от этого
атом. Например, в молекуле хлороводорода
хлор электроотрицательнее водорода на 0,96
единицы электроотрицательности. Общие электроны проводят больше времени
близко к атому хлора, что делает хлорный конец молекулы
очень слабо отрицательное (обозначено на рисунке ниже синим цветом).
заштрихованная область), в то время как водородный конец молекулы очень
слегка положительный (обозначен красной заштрихованной областью), а
полученная молекула полярна:
Чем больше
электроотрицательный атом имеет частичный отрицательный заряд , д – , потому что
электроны проводят больше времени ближе к этому атому, в то время как меньше
электроотрицательный атом имеет частичный положительный заряд , d + , потому что
электроны частично (но не полностью) отрываются от этого
атом. Например, в молекуле хлороводорода
хлор электроотрицательнее водорода на 0,96
единицы электроотрицательности. Общие электроны проводят больше времени
близко к атому хлора, что делает хлорный конец молекулы
очень слабо отрицательное (обозначено на рисунке ниже синим цветом).
заштрихованная область), в то время как водородный конец молекулы очень
слегка положительный (обозначен красной заштрихованной областью), а
полученная молекула полярна: