Урок по химии на тему “Значение ПСХЭ”
Эпиграф на доске. «Периодическому закону будущее не грозит разрушением, а только надстройка и развитие обещаются» (Д.И.Менделеев).
Цели. Дать учащимся представление о законе Д.И.Менделеева и о структуре его периодической системы, выявить значение этого закона для развития химии и понимания научной картины мира в целом. Научить школьников работать с таблицей Д.И.Менделеева.
Задачи.
Образовательные.
• Сформировать знания о периодическом законе и периодической системе Д.И.Менделеева.
• Научить учащихся работать с периодической системой (уметь определять положение элемента в периодической системе, свойства элемента в зависимости от положения его в периодической системе).
• Продолжить формирование умений работать с учебником, тетрадью.
Развивающие.
• Развивать наблюдательность, память (при изучении физического смысла периодического закона и графического его отображения).
• Развивать умение сравнивать (например, сравнение свойств элементов в зависимости от их положения в периодической системе).
• Научить учащихся обобщать и делать выводы.
Воспитательные.
• Продолжить формирование мировоззрения учащихся на основе представлений о значении закона Д.И.Менделеева.
Методы ведения урока. Словесный (беседа, объяснение, рассказ), наглядный (компьютерная презентация, периодическая система, ребусы), практический (демонстрация опытов).
Тип урока. Комбинированный урок.
Ι. Организационный момент.
Дидактическая задача: создание психологического климата
Учитель: Ребята! Рада всех вас видеть! Как ваше настроение? Я предлагаю вам подчеркнуть одно из слов на шкале настроений, которое больше всего соответствует ему в начале урока. В конце урока выясним, изменилось ли ваше настроение?
II. Подготовка к усвоению нового материала.
Дидактическая задача: организовать и целенаправить познавательную деятельность учащихся.
УЧИТЕЛЬ: Тема урока: «Периодический закон и периодическая система Д.И.Менделеева» (слайд №1).
А) мотивация
Учитель: Эпиграфом нашего урока будут слова Д.И.Менделеева (слайд №2)
«Периодическому закону будущее не грозит разрушением, а только надстройка и развитие обещаются»
Цели урока: попробуйте сформулировать сами, чего мы должны достичь на уроке, чему научиться (слайд №3)
ΙΙΙ. Актуализация знаний, умений и навыков
Учитель. На какие группы можно разделить все химические элементы?
Ученик. На металлы, неметаллы и амфотерные элементы.
Учитель. У меня на столе стоит набор склянок с различными веществами: сера, железо, фосфор, йод, цинк, алюминий и т. д. Разделите все эти склянки на три группы.
К столу выходит ученик и разделяет, анализируя, все склянки на группы металлов, неметаллов и амфотерных веществ.
Учитель. Где расположены металлы и неметаллы в периодической системе? Приведите примеры.
Ученик. Слева в периодической системе расположены металлы, а справа – неметаллы (приводятся примеры).
Учитель. Какие по свойствам образуются вещества из металлов, неметаллов и амфотерных соединений?
К доске выходит ученик с набором магнитных карточек и составляет схему на доске:
K K2O КОН
Аl Аl2О3Аl(ОН)3
P P2O5H3PO4
Подтверждается схема с помощью демонстрационного опыта.
Демонстрация опыта. Определяются основности и кислотности гидроксидов с помощью индикаторов. При взаимодействии оксида калия с водой образуется основный гидроксид, что подтверждается действием фенолфталеина; при растворении кислотного оксида фосфора в воде образуется гидроксид кислотного характера, что подтверждается действием лакмуса.
Учитель. Какие естественные семейства выделяются в периодической системе?
Ученик. Например, щелочные металлы, щелочно-земельные металлы, галогены, инертные газы.
Игра «Третий лишний». Из приведенных в каждой строчке формул указать лишнюю. (Слайд 4)
Li
Cl
Na
P
S
Fe
СаО
СО2
Р2О5
SО3
Fе2О3
К2О
Н2SO4
Н3РO4
Са(ОН)2
KOH
HNO3
Fe(ОН)3
ΙV. Изучение нового материала (Слайд 5)
План
1. Периодический закон. Физический смысл закона.
Периодический закон. Физический смысл закона.
2. Периодическая система химических элементов.
3. Характеристика элементов в зависимости от положения в периодической системе.
Учитель. Начать изучение периодического закона и периодической системы химических элементов Д.И.Менделеева мне бы хотелось с прочтения стихотворения М.Глазкова
«Таблица Менделеева»:
«Пусть в зимний день
с метелями
Не навещает грусть,
Таблицу Менделеева
Я знаю наизусть.
Зачем ее я выучил?
Могу сказать зачем,
В ней стройность и величие
Любимейших поэм.
Без многословья книжного
В ней смысла торжество,
И элемента лишнего
В ней нет ни одного.
В ней пробужденье дерева
И вешних льдинок хруст,
Таблицу Менделеева
Я знаю наизусть».
На прошлом занятии мы с вами говорили о том, что периодичность – это повторяемость через определенный интервал. Почему же свой закон и свою таблицу Менделеев назвал периодической? Чтобы ответить на этот вопрос, необходимо проследить, как изменяются свойства элементов в периодической системе.
Учащиеся открывают таблицу и работают по ней. Все вместе делают вывод о том, что каждый период периодической системы начинается щелочным металлом и заканчивается инертным газом. На доске и в тетради записывают схему:
щелочные металлы щелочно-земельные металлы галогены инертные газы.
Учитель. Располагая элементы в порядке возрастания относительной атомной массы, Менделеев наблюдал периодическое изменение их свойств. В 1869 г. он сформулировал закон. Открытие периодического закона – это научный подвиг, который совершил молодой ученый, профессор Петербургского университета. Поэт Е.Ефимовский писал:
Мир сложен, он полон событий,
сомнений,
И тайн бесконечных, и смелых
загадок.
Как чудо природы, является
гений
И в хаосе этом наводит
порядок.
Весь мир большой – жара
и стужа,
планет круженье, свет зари –
Все то, что видим мы снаружи,
законом связано внутри.
Найдется ль правило такое,
что целый мир объединит?
Таблицу Менделеев строит,
природы ищет алфавит.
Случилось в Петербурге это.
Профессор университета писал
учебник для студентов.
Задумался невольно он…
Как рассказать про элементы?
Нельзя ли тут найти закон?
Искали многие решенье,
но, проходя лишь полпути,
бросали –
Мучило сомненье:
«А можно ли закон найти?»
Мир состоит из элементов
(в то время знали 60).
А сколько их всего?
На это нельзя ответить
наугад.
Но не гадал, а верил он.
Тут должен, должен быть закон!
Упрямо он искал решенье,
Был труд, надежда и терпенье,
И вера в то, что он найдет.
Он так работал целый год.
На чем попало знаки пишет
И ничего вокруг не слышит.
И наконец-то понял он,
В чем же разгадка, в чем закон!
Не упустить бы мысли той.
Он элементы ставит в строй,
Но все ж таблица не выходит.
Тогда усталостью сражен,
Лег на диван и видит сон…
То кружились, то мелькали,
то водили хоровод,
То взрывались, то пылали,
то в покое пребывали
Алюминий, натрий, калий,
фтор, бериллий, водород.
Перепутались все свойства,
недалеко до беды.
Стали строиться в ряды.
Натрий, магний, алюминий,
кремний, фосфор, сера, хлор –
По порядку, по закону
элементы встали в ряд,
И выходит, что в колонне
все похожие стоят.
(Подходит к таблице, показывает указкой.)
А рядов-то восемь кряду:
Металлы под металлами,
Едкие под едкими,
Ковкие под ковкими
Идут своими клетками.
По порядку все стоит –
Вот природы алфавит!
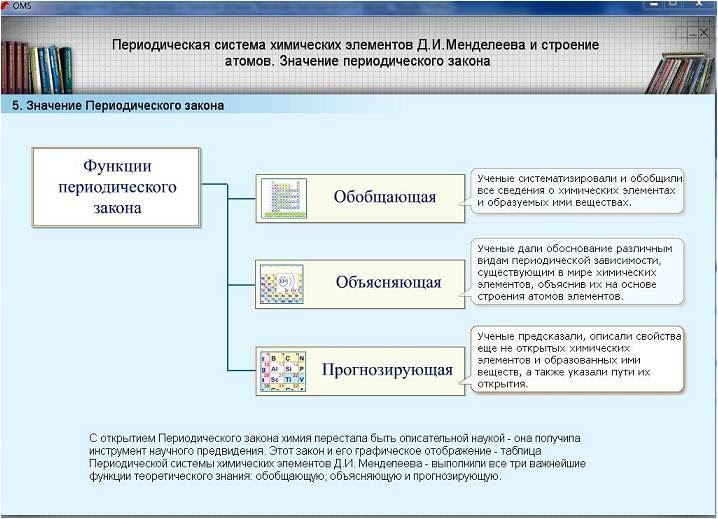
Учитель. Итак, давайте обобщим все то, что сказано, и сделаем выводы о периодичности, которая отражена в периодическом законе и прослеживается в таблице Д.И.Менделеева.
Делаются выводы, которые учащиеся записывают в тетради.
Физический смысл периодического закона (Слайд 6)
1. В ряду от лития до фтора наблюдается постепенное ослабление металлических и усиление неметаллических свойств.
2. С возрастанием относительной атомной массы от лития до углерода валентность увеличивается от одного до четырех.
3. Начиная с натрия, наблюдается повторяемость свойств элементов предыдущего ряда.
Учитель. Периодический закон – величайшее достижение химической науки, основа современной химии. Каждый из нас должен знать формулировку этого закона: свойства простых тел, а также формы и свойства простых и сложных соединений элементов находятся в периодической зависимости от относительных атомных масс элементов. (Слайд 7)
Учитель. На основе периодического закона периодической системы Д.И.Менделеев пришел к выводу о существовании новых, не открытых еще в то время элементов; свойства трех из них он подробно описал и дал им условные названия – экабор, экаалюминий и экасилиций. (Слайд 8)
Несмотря на то, что Менделееву никто не поверил, ему действительно удалось предсказать существование трех элементов, которые были открыты позднее.
В 1875 г. Поль Эмиль Лекок де Буабодран (Франция) открыл галлий, предсказанный Менделеевым (экаалюминий – подобный алюминию).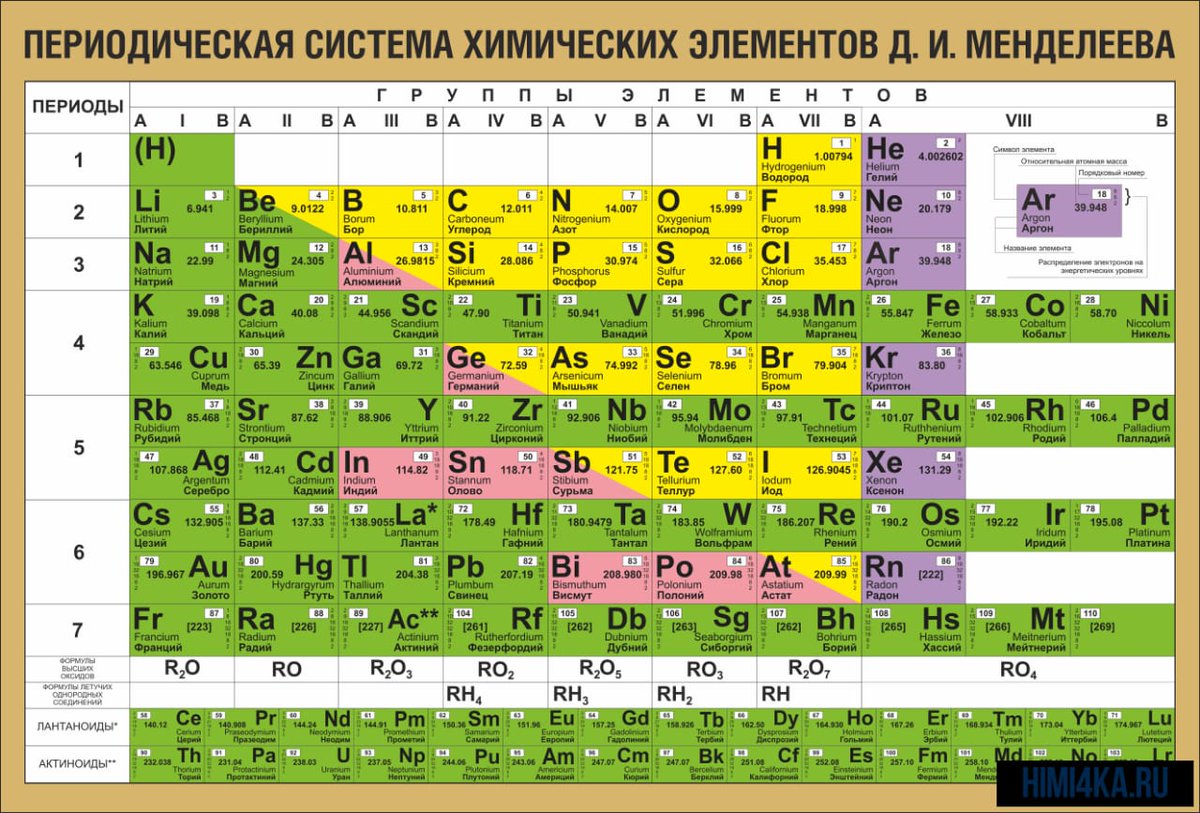
В 1879 г. Ларс Фредерик Нильсон (Швеция) открыл скандий, предсказанный Менделеевым (экабор – подобный бору).
В 1886 г. Клеменс Александр Винклер (Германия) открыл германий, предсказанный Менделеевым (экасилиций – подобный кремнию). (Слайд 9)
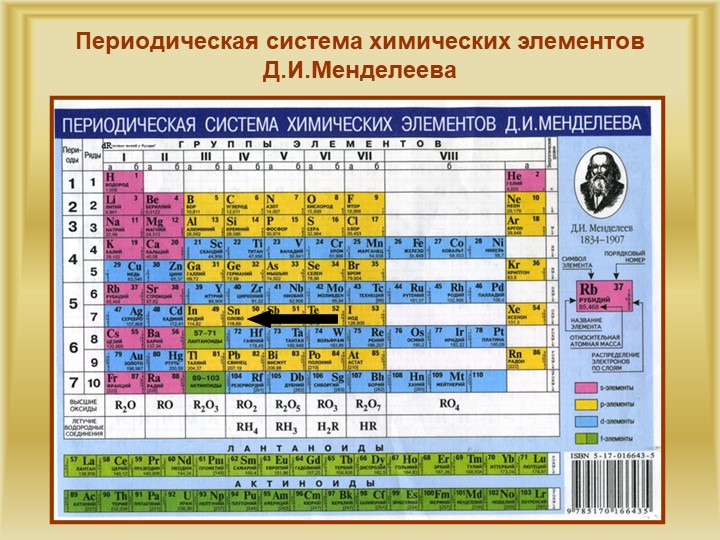
На основе периодического закона изображена его графическая структура – периодическая система химических элементов (ПСХЭ). В настоящее время известно более 800 вариантов ПСХЭ. Это различные формы передачи периодического закона. Наиболее распространена короткая форма.
(Слайд 10)
Нам необходимо разобрать строение, состав и структуру ПСХЭ.
Каждый элемент, изображенный соответствующим символом, имеет порядковый номер и занимает определенную клетку – это занумерованное место элемента в ПСХЭ, его координаты.
Горизонтальный ряд элементов, расположенных по возрастанию порядковых номеров, в котором закономерно изменяются свойства при переходе от металлов к неметаллам, называется периодом. (Слайд 11)
Учитель. Сколько всего периодов в ПСХЭ?
Сколько всего периодов в ПСХЭ?
Ученик. В ПСХЭ семь периодов, из них 1-й, 2-й, 3-й – малые, 4-й, 5-й, 6-й, 7-й – большие.
Вертикальный ряд, объединяющий элементы с одинаковой валентностью в высших оксидах, называется группой. (Слайд 12)
Всего восемь групп.
Учитель. В пределах одной группы не все элементы явно сходны по своим свойствам. Однако, например, натрий и медь находятся в одной группе, но они по-разному взаимодействуют с водой. Поэтому каждая группа делится на две подгруппы – главную и побочную. Главные подгруппы включают в себя элементы малых периодов и сходные с ними по свойствам элементы больших периодов. (Слайд 13)
Где расположены, например, элементы алюминий, медь, сера?
Ученик. Алюминий расположен в 3-м периоде, III группе, главной подгруппе; медь расположена в 4-м периоде, I группе, побочной подгруппе; сера расположена в 3-м периоде, VI группе, главной подгруппе.
Учитель. Теперь давайте немного поиграем. Я буду показывать вам ребусы, вы должны будете отгадать, что за элемент зашифрован в ребусе, и затем определить, где этот элемент расположен в ПСХЭ и какими свойствами должен обладать, исходя из его расположения в ПСХЭ.
(Слайд 14)
Учитель показывает по очередности различные ребусы, учащиеся выполняют поставленное задание.
(Ответы на ребусы:
барий, цинк, калий, кальций,
никель, мышьяк, гелий,
золото, медь, кремний, бор,
азот, сера, марганец, магний.)
V. Закрепление изученного материала
Учитель. Вы сегодня очень хорошо работали. Теперь давайте еще раз вспомним все то, о чем мы с вами говорили. А помогут нам в этом тесты.
Тесты
Учащиеся самостоятельно 5–7 мин отвечают на тестовые задания, которые заранее напечатаны и розданы каждому на стол.
1. К щелочным металлам относятся элементы:
К щелочным металлам относятся элементы:
а) Na; б) Al; в) Ca; г) Li.
2. Натрий хранят под слоем:
а) керосина; б) воды; в) песка; г) бензина.
3. Самый активный среди элементов:
а) Li; б) Na; в) Сs; г) K.
4. Среда, характерная для раствора NaOH:
а) кислая; б) щелочная; в) нейтральная.
5. Установите соответствие:
Щелочной металл
Оксид
1) Na
а) Li2O
2) Li
б) Cs2O
3) Cs
в) Na2O
г) Na2O2
д) СsO2
6. Установите соответствие:
Оксид
Гидроксид
1) Li2O
а) NaOH
2) Rb2O
б) LiOH
3) Na2O
в) RbOH
4) K2O
г) KOH
7. К галогенам относятся:
К галогенам относятся:
а) Сl; б) Mn; в) Вr; г) Re.
8. Выберите среду, характерную для водного раствора НСl:
а) щелочная; б) кислая; в) нейтральная.
9. В основу классификации элементов Д.И.Менделеев положил:
а) массу; б) плотность; в) температуру.
10. Допишите предложение:
«Д.И.Менделеев расположил элементы в порядке…»
11. В перечне химических элементов Al, P, Na, C, Cu больше:
а) металлов; б) неметаллов.
12. Малые периоды – это:
а) 1; б) 2; в) 5; г) 7.
13. В главную подгруппу I группы входят:
а) Nа; б) Сu; в) K; г) Li.
14. В главной подгруппе с уменьшением порядкового номера металлические свойства:
а) усиливаются; б) ослабевают; в) не меняются.
После того, как учащиеся ответят на тесты, они все вместе проверяют ответы. Тем ученикам, которые активно работали при проверке тестов и правильно на них ответили, выставляются высокие оценки.
УЧИТЕЛЬ. Мы познакомились с историей открытия периодического закона и еще раз убедились, что по периодической системе можно очень много узнать о каждом химическом элементе, что, бесспорно, доказывает гениальность этого открытия. Закончить урок можно следующими строками поэта Степана Щипачева:
Мы познакомились с историей открытия периодического закона и еще раз убедились, что по периодической системе можно очень много узнать о каждом химическом элементе, что, бесспорно, доказывает гениальность этого открытия. Закончить урок можно следующими строками поэта Степана Щипачева:
«Другого ничего в природе нет,
Ни здесь, ни там, в космических глубинах:
Все – от песчинок малых до планет –
Из элементов состоит единых…»
Спасибо всем, кто принял активное участие в подготовке и проведении этого урока!
VΙ Рефлексия.
Ребята, вспомните какие цели стояли перед нами? Достигли ли мы их? Отметьте свое настроение в конце урока на шкале настроения. Изменилось ли ваше настроение.
VΙΙ. Домашнее задание: § 10.6. Творческое задание:
Придумать и нарисовать ребусы.
Подчеркните одно из слов, определяющих ваше настроение в самом начале урока
Раздражен
Встревожен
Безразличен
Спокоен
Радостно
Восхищен
Раздражен
Встревожен
Безразличен
Спокоен
Радостно
Восхищен
Подчеркните одно из слов, определяющих ваше настроение в конце урокаИзменилось ли ваше настроение?
Подчеркните одно из слов, определяющих ваше настроение в самом начале урока
Раздражен
Встревожен
Безразличен
Спокоен
Радостно
Восхищен
Раздражен
Встревожен
Безразличен
Спокоен
Радостно
Восхищен
Подчеркните одно из слов, определяющих ваше настроение в конце урокаИзменилось ли ваше настроение?
*Карточка 1
Расположите предложенные вещества по известным группам.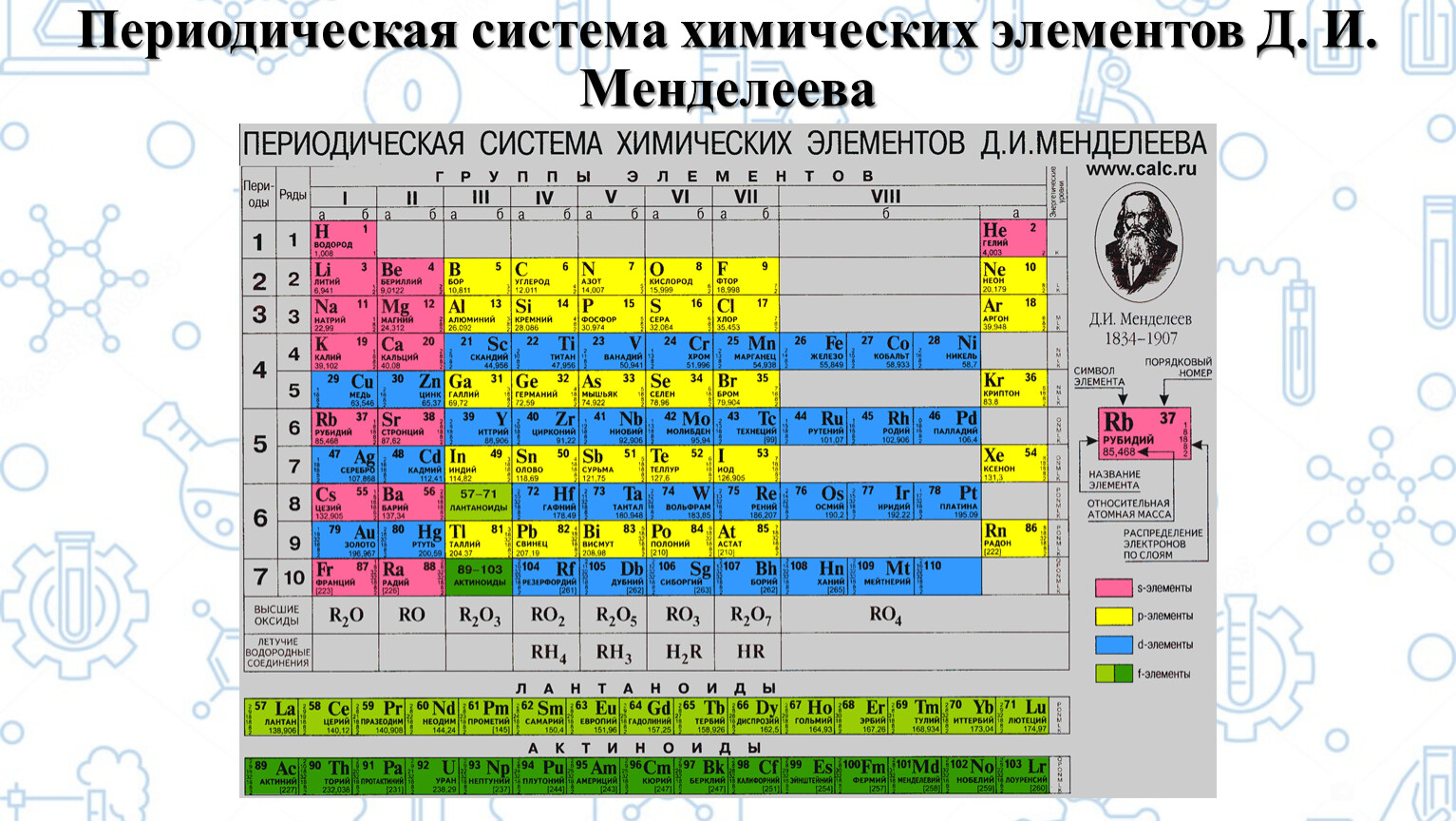
***Карточка 2
На доске составить схему генетического ряда калия, алюминия и фосфора. Что общего и чем они отличаются? Для первого и последнего ряда составить уравнения реакций.
**Карточка 3
При помощи имеющихся реактивов доказать основность и кислотность, предложенных веществ.
Сера Железо
Фосфор
Йод
Алюминий
Медь
К + О2 =
К2О 2 4
К2О + Н2О =
КОН 2 3
Р + О2 =
Р2О5 2 4 5
Р2О5 + Н2О
= Н3РО4 2 3 4 5
Инструктивная карта к уроку: «Периодическая закон и периодическая система Д. И.Менделеева»
И.Менделеева»
Прочитайте стихотворение поэта Е.Ефимовского
Мир сложен, он полон событий,
сомнений,
И тайн бесконечных, и смелых
загадок.
Как чудо природы, является
гений
И в хаосе этом наводит
порядок.
Весь мир большой – жара и стужа,
планет круженье, свет зари –
Все то, что видим мы снаружи,
законом связано внутри.
Найдется ль правило такое,
что целый мир объединит?
Таблицу Менделеев строит,
природы ищет алфавит.
Случилось в Петербурге это.
Профессор университета писал
учебник для студентов.
Задумался невольно он…
Как рассказать про элементы?
Нельзя ли тут найти закон?
Искали многие решенье,
но, проходя лишь полпути,
бросали –
Мучило сомненье:
«А можно ли закон найти?»
Мир состоит из элементов
(в то время знали 60).
А сколько их всего?
На это нельзя ответить
наугад.
Но не гадал, а верил он.
Тут должен, должен быть закон!
Упрямо он искал решенье,
Был труд, надежда и терпенье,
И вера в то, что он найдет.
Он так работал целый год.
На чем попало знаки пишет
И ничего вокруг не слышит.
И наконец-то понял он,
В чем же разгадка, в чем закон!
Не упустить бы мысли той.
Он элементы ставит в строй,
Но все ж таблица не выходит.
Тогда усталостью сражен,
Лег на диван и видит сон…
То кружились, то мелькали,
то водили хоровод,
То взрывались, то пылали,
то в покое пребывали
Алюминий, натрий, калий,
фтор, бериллий, водород.
Перепутались все свойства,
недалеко до беды.
Стали строиться в ряды.
Натрий, магний, алюминий,
кремний, фосфор, сера, хлор –
По порядку, по закону
элементы встали в ряд,
И выходит, что в колонне
все похожие стоят.
А рядов-то восемь кряду:
Металлы под металлами,
Едкие под едкими,
Ковкие под ковкими
Идут своими клетками.
По порядку все стоит –
Вот природы алфавит!
2. Ответьте на вопросы: 1.Почему возникла необходимость создания закона?
2.Какие данные об элементах использовал Д.И. Менделеев для создания таблицы?
3. Почему открытие Менделеева считают гениальным?
3. Вставьте пропущенные слова в предложения: 1. В ряду от лития до фтора наблюдается постепенное _________ металлических и ___________________неметаллических свойств.
2. С возрастанием относительной атомной массы от лития до углерода валентность увеличивается от ____________ до __________________.
3. Начиная с натрия, наблюдается _____________ свойств элементов предыдущего ряда.
ТЕСТ
1. К щелочным металлам относятся элементы:
а) Na; б) Al; в) Ca; г) Li.
2. Натрий хранят под слоем:
а) керосина; б) воды; в) песка; г) бензина.
3. Самый активный среди элементов:
Самый активный среди элементов:
а) Li; б) Na; в) Сs; г) K.
4. Среда, характерная для раствора NaOH:
а) кислая; б) щелочная; в) нейтральная.
5. Установите соответствие:
Щелочной металл
Оксид
1) Na
а) Li2O
2) Li
б) Cs2O
3) Cs
в) Na2O
г) Na2O2
д) СsO2
6. Установите соответствие:
Оксид
Гидроксид
1) Li2O
а) NaOH
2) Rb2O
б) LiOH
3) Na2O
в) RbOH
4) K2O
г) KOH
7. К галогенам относятся:
а) Сl; б) Mn; в) Вr; г) Re.
8. Выберите среду, характерную для водного раствора НСl:
а) щелочная; б) кислая; в) нейтральная.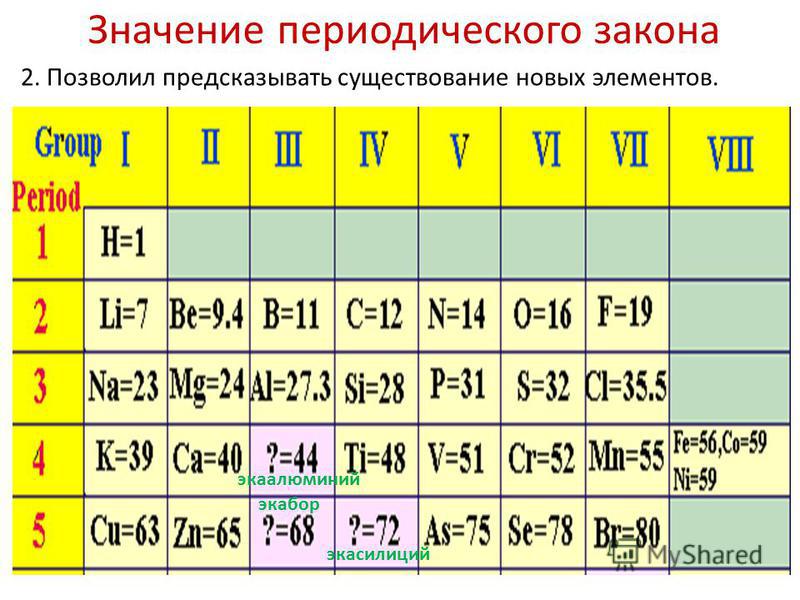
9. В основу классификации элементов Д.И.Менделеев положил:
а) массу; б) плотность; в) температуру.
10. Допишите предложение:
«Д.И.Менделеев расположил элементы в порядке…»
11. В перечне химических элементов Al, P, Na, C, Cu больше:
а) металлов; б) неметаллов.
12. Малые периоды – это:
а) 1; б) 2; в) 5; г) 7.
13. В главную подгруппу I группы входят:
а) Nа; б) Сu; в) K; г) Li.
14. В главной подгруппе с уменьшением порядкового номера металлические свойства:
а) усиливаются; б) ослабевают; в) не меняются.
Значение и развитие периодического закона — урок. Химия, 8–9 класс.
Значение периодического закона
Открытие периодического закона и создание Периодической таблицы химических элементов имеет огромное значение для развития науки.
Периодический закон:
- систематизировал и обобщил все сведения о химических элементах и их соединениях, объединил их в единое целое;
- объяснил разные виды периодичности в изменении свойств элементов и образованных ими простых и сложных веществ;
- позволил предсказывать существование неоткрытых химических элементов и прогнозировать их свойства;
- послужил базой для изучения строения ядра атома и электронных оболочек.

Сам Дмитрий Иванович Менделеев, предвидя развитие науки, писал: «Периодическому закону будущее не грозит разрушением, а только надстройка и развитие обещаются».
Развитие периодического закона
Во времена Д. И. Менделеева основным свойством атомов химических элементов считалась атомная масса. Периодический закон в формулировке Д. И Менделеева звучит так:
Свойства элементов, а также состав и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величин их атомных масс.
Позже было изучено строение атома, и стало ясно, что основной характеристикой атома химического элемента является не величина его атомной массы, а величина положительного заряда ядра. Периодический закон стали формулировать иначе. Современная формулировка выглядит следующим образом:Свойства химических элементов и образуемых ими веществ находятся в периодической зависимости от величин зарядов ядер их атомов.
Причиной периодического изменения свойств химических элементов и образуемых ими веществ является периодически повторяющееся строение наружных энергетических уровней электронных оболочек атомов.
Строение атома (продолжение) и Периодическая система химических элементов Д.И. Менделеева
Лекция № 5
Тема «Строение атома (продолжение) и Периодическая система химических элементов Д.И. Менделеева»
План лекции:
- Состояние электрона в атоме: квантовые числа.
- Структура ПСХЭ Д. И. Менделеева.
- Изменение свойств в периодах и группах.
- Выводы из знания строения атома и современной формулировки Периодического закона.
- ПСХЭ: характеристика элементов главных подгрупп.
Основные понятия и определения:
|
|
Текст лекции
Строение атома (продолжение)
Состояние электрона в атоме: квантовые числа.
В современной модели атома состояние в нем электрона определяется четырьмя параметрами – квантовыми числами.
n – главное квантовое число,
l – орбитальное квантовое число,
ml – магнитное квантовое число,
ms – спинное квантовое число.
n – соответствует энергетическому уровню (или периоду ПСХЭ).
Главное квантовое число n характеризует энергию и размеры орбитали и электронного облака, принимает значения целых чисел – от 1 до бесконечности (n = 1, 2, 3, 4, 5, 6…). Орбитали, имеющие одинаковые значения n, близки между собой по энергии и по размерам, они образуют один энергетический уровень.
l – соответствует энергетическому подуровню: l
Если n = 1, | то l = 0 | 0 – это s-подуровень |
Если n = 2, | то l = 0 l = 1 | 0 – это s-подуровень 1 – это p-подуровень |
Если n = 3, | то l = 0 l = 1 l = 2 | 0 – это s-подуровень 1 – это p-подуровень 2 – это d-подуровень |
Если n = 4, | то l = 0 l = 1 l = 2 l = 3 | 0 – это s-подуровень 1 – это p-подуровень 2 – это d-подуровень 3 – это f-подуровень |
Побочное (орбитальное) квантовое число l характеризует формы орбиталей и облаков, принимает значения целых чисел от 0 до n – 1.
ml – соответствует положению электронной орбитали в пространстве на энергетическом подуровне и принимает значения «-», «0», «+».
0 (на s-подуровне) | 0 (1 положение в пространстве) |
1 (на p-подуровне) | -1,0,+1 (3 положения в пространстве) |
2 (на d-подуровне) | -2,-1,0,+1,+2 (5 положений в пространстве) |
3 (на f-подуровне) | -3,-2,-1,0,+1,+2,+3 (7 положений в пространстве) |
ms – соответствует спину (вращение электрона вокруг своей оси по часовой или против часовой стрелки) и обозначается: +1/2 и -1/2.
Спиновое квантовое число ms, спин (от англ. spin – кружение, вращение) – характеризует вращение электрона вокруг своей оси и принимает только два значения: +1/2 и -1/2. Электрон со спином +1/2 – это первичный на орбитале электрон, условно изображают так:
; со спином -1/2 – это повторный на орбитале электрон, условно изображают так:
.
Помните: Квантовыми числами описывается только последним поставленный электрон.
l 0 1 2 3
s p d f
n 4 | 0 | -1 | 0 | +1 | -2 | -1 | 0 | +1 | +2 | -3 | -2 | -1 | 0 | +1 | +2 | +3 |
ml
↑ | или | ↑↓ | ||||||
ms | +1/2 | -1/2 | ||||||
↑ | ↑ | ↑ | или | ↑↓ | ↑ | ↑ | ||
Примеры:
По электронной формуле и энергетическим ячейкам | По квантовым числам | ||||||||||||||||||||||||||||||
12Mg 1s22s22p63 s2 3 s2 3p0 3d0
2s2 2p6
1s2 | 12Mg 3n l0 ml0 ms-1/2 3n l0 3 s2 3p0 3d0
ml0 ms-1/2 | ||||||||||||||||||||||||||||||
14Si 1s22s22p63s23 p2 3 s2 3p2 3d0
2s2 2p6
1s2 | 14Si 3n l1 ml0 ms+1/2 3n l1 3 s2 3p2 3d0
ml0 ms+1/2 |
Различные состояния электронов в атоме неравноценны, и электронные орбитали заполняются электронами строго определенным образом, подчиняясь следующим основным закономерностям:
1. Принцип минимума энергии. Правило Клечковского.
Принцип минимума энергии. Правило Клечковского.
Электрон поступает на ту орбиталь, энергия которой минимальна. Согласно правилу В. М. Клечковского, порядок заполнения энергетических состояний определяется стремлением атома к минимальному значению суммы главного и побочного (орбитального) квантовых чисел, причем в пределах фиксированного значения (п + l) в первую очередь заполняются состояния, отвечающие минимальным значениям п.
Электроны заполняют энергетические подуровни и орбитали в порядке увеличения их энергии. Этот порядок определяется значением суммы главного и побочного квантовых чисел (n+l): 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d.
Например, для атома кальция при распределении электронов по орбиталям предпочтительнее 4s-орбиталь (п + l = 4 + 0 = 4), чем 3d-орбиталь (n + l = 3 + 2 = 5). А для атома скандия предпочтение следует отдать 3d-орбитали (п + l = 3 + 2 = 5), а не 4р-орбитали (п + l = 4 + 1 = 5), так как при одинаковых суммах квантовых чисел (п + l) Зd-орбиталь имеет меньшее значение п = 3.
А для атома скандия предпочтение следует отдать 3d-орбитали (п + l = 3 + 2 = 5), а не 4р-орбитали (п + l = 4 + 1 = 5), так как при одинаковых суммах квантовых чисел (п + l) Зd-орбиталь имеет меньшее значение п = 3.
2. Принцип Паули.
В атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел.
Поэтому на каждой орбитали может находиться не более двух электронов (у которых главное, орбитальное и магнитное квантовые числа одинаковы), но обязательно с противоположными спинами. Используя этот принцип, можно подсчитать максимальное число электронных состояний N, соответствующих различным значениям главного квантового числа п: N = 2п2.
3. Правило Гунда (или Хунда).
Электроны располагаются на одинаковых орбиталях таким образом, чтобы суммарное спиновое число их было максимальным.
Таким образом, наиболее устойчивому состоянию атома соответствует максимально возможное число неспаренных электронов с одинаковыми спинами. Например, на р-подуровне 3 электрона будут занимать орбитали так
Например, на р-подуровне 3 электрона будут занимать орбитали так
↑ | ↑ | ↑ | , но не так | ↑↓ | ↑ | и не так | ↑ | ↓ | ↑ |
(+1/2)+(-1/2)+(+1/2)= (+1/2)+(-1/2)+(+1/2)= (+1/2)+(-1/2)+(+1/2)=
=(+3/2) =(+1/2) = (+1/2)
В этой записи каждая электронная орбиталь обозначена клеткой (квантовой ячейкой), а электрон — стрелкой, направление которой соответствует направлению спина.
Структура ПСХЭ Д. И. Менделеева
3Li 1s2 2s1
4Be 1s2 2s2
5B 1s2 2s2 2p1
6C 1s2 2s2 2p2
7N 1s2 2s2 2p3
Периоды ПСХЭ – это отдельные горизонтальные ряды, объединяющие элементы, у которых одинаковое число внутренних энергетических уровней, но разное число электронов на внешнем энергетическом уровне.
1H 1s1
3Li 1s2 2s1
11Na 1s2 2s2 2p6 3s1
19K 1s2 2s2 2p6 3s2 3p6 4s1
37Rb 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1
Группы ПСХЭ – это отдельные вертикальные столбцы, объединяющие элементы, у которых разное число внутренних энергетических уровней, но одинаковое число электронов на внешнем энергетическом уровне.
Внешний энергетический уровень образуется только s– или s- и p– подуровнями.
Номер периода соответствует номеру энергетического уровня (по s– и p– подуровням).
Число электронов на внешнем энергетическом уровне для элементов s– и p– подуровней соответствует номеру группы.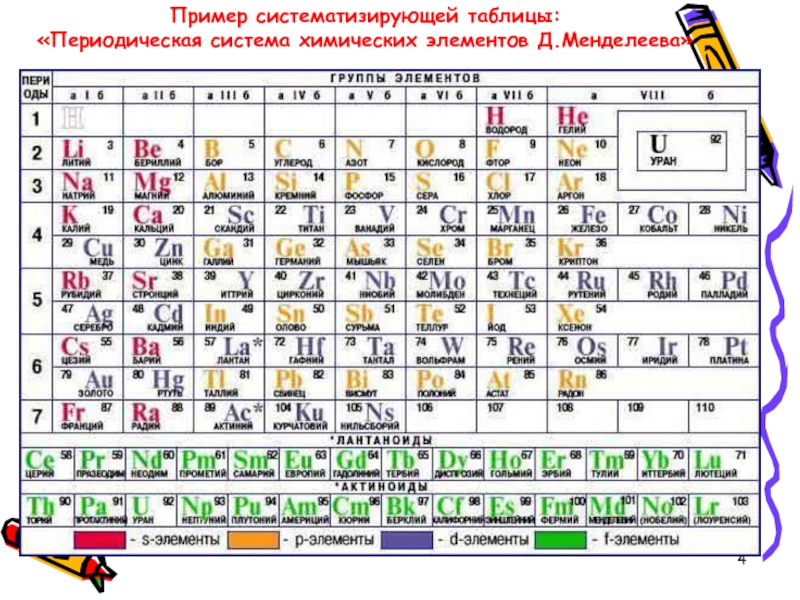
Количество электронов на внешнем уровне элементов у d– и f– подуровней равно от 0 до 2 электронов (смотри ПСХЭ).
Изменение свойств в периодах и группах.
Свойства элементов в периодах и группах изменяются периодически:
Радиус
Электроотрицательность
Металличность
Неметалличность
Энергия ионизации
Сродство к электрону
Обозначение:
– увеличение
Электроотрицательность – свойство атомов данного химического элемента в соединениях притягивать к себе электроны, участвующие в образовании химической связи (валентные электроны), или свойство атомов данного химического элемента оттягивать на себя электроны от атомов других элементов в соединениях.
Металличность – это способность атома химического элемента отдавать электроны со своего энергетического уровня.
Неметалличность – это способность атома химического элемента отбирать электроны с энергетического уровня другого химического элемента.
Энергия ионизации – это энергия, затрачиваемая для отрыва электрона от атома и превращения последнего в соответствующий ион.
Сродство к электрону – это количество энергии, выделяющееся при присоединении электрона к атому, молекуле или радикалу.
Характеристики химических элементов и их соединений закономерно изменяются в группах и периодах.
В периодах (с увеличением порядкового номера, т.е. слева и направо):
· увеличивается заряд ядра,
· увеличивается число внешних электронов,
· уменьшается радиус атомов,
· увеличивается прочность связи электронов с ядром (энергия ионизации),
· увеличивается электроотрицательность,
· усиливаются окислительные свойства простых веществ (“неметалличность”),
· ослабевают восстановительные свойства простых веществ (“металличность”),
· ослабевает основный характер гидроксидов и соответствующих оксидов,
· возрастает кислотный характер гидроксидов и соответствующих оксидов,
· валентность в соединении с кислородом возрастает от 1 до 7, высшая валентность равна номеру группы.
В группах (с увеличением порядкового номера, т.е. сверху вниз):
· увеличивается заряд ядра,
· увеличивается радиус атомов (только в главных подгруппах),
· уменьшается прочность связи электронов с ядром (энергия ионизации; только в главных подгруппах),
· уменьшается электроотрицательность (только в главных подгруппах),
· ослабевают окислительные свойства простых веществ (“неметалличность”; только в главных подгруппах),
· усиливаются восстановительные свойства простых веществ (“металличность”; только в главных подгруппах),
· возрастает основный характер гидроксидов и соответствующих оксидов (только в главных подгруппах),
· ослабевает кислотный характер гидроксидов и соответствующих оксидов (только в главных подгруппах),
· снижается устойчивость водородных соединений (повышается их восстановительная активность; только в главных подгруппах),
· валентность элементов не изменяется и равна номеру группы.
Самый активный металл Fr – легче всего отдает свои электроны с внешнего энергетического уровня. (Самый большой радиус атома в периоде и группе –у него только один электрон на внешнем энергетическом уровне, поэтому электрон притягивает к ядру очень слабо).
(Самый большой радиус атома в периоде и группе –у него только один электрон на внешнем энергетическом уровне, поэтому электрон притягивает к ядру очень слабо).
Самый активный неметалл F – легче всего притягивает электроны от атомов других элементов (очень маленький радиус атома в периоде и группе, и у него 7 электронов на внешнем энергетическом уровне, т.е. до 8 не хватает только 1 электрона, поэтому электроны притягиваются к ядру очень сильно и расстояние от ядра до внешнего энергетического уровня другого химического элемента очень небольшое).
В соединениях атомы химических элементов стремятся иметь наибольшее энергетически выгодное состояние: на внешнем энергетическом уровне должно быть или 8 электронов (полное заполнение электронами s- и p-подуровней) или 0 электронов (полное отсутствие электронов на s- и p-подуровне). Исключение составляет только первый период – там только один подуровень, а значит и максимальное число электронов – 2 электрона.
Все химические элементы в ПСХЭ можно разделить на две группы: металлы и неметаллы (по химическим и физическим свойствам), но среди металлов есть химические элементы, которые в соединениях с другими химическими элементами могут проявлять и некоторые свойства неметаллов.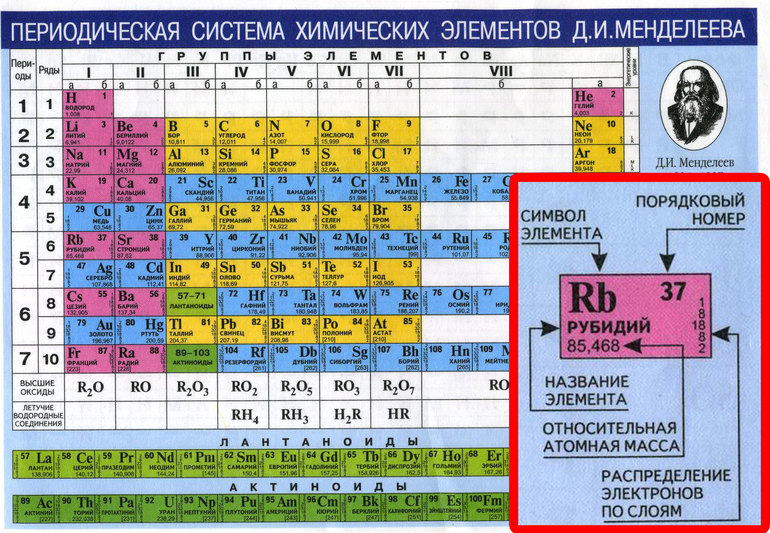
Элементы
Металлы Амфотерные элементы Неметаллы
(порядковый номер (порядковый номер (порядковый номер
– не обозначен) – обозначен полукругом) – обозначен квадратом)
Местоположение химического элемента в ПСХЭ обуславливает свойства этих элементов, и, наоборот, свойства элементов обуславливают их местоположение в ПСХЭ.
Металлы свои электроны внешнего энергетического уровня в соединениях всегда отдают. Неметаллы свои электроны внешнего уровня могут и отдавать, и принимать электроны у атомов других химических элементов (с их внешнего энергетического уровня).
d-элементы и f-элементы: все металлы;
s-элементы: кроме H и He, металлы;
p-элементы – по «правилу треугольника»: если провести в таблице Периодической системы диагональот B до At, то – «правый верхний треугольник и сама диагональная линия» это неметаллы, а «левый нижний треугольник» – это металлы.
B C N O F Ne
Cl Ar
Br Kr
I Xe
At Rn
Общее название элементов в группах
(для s- и p- подуровня или для главных подгрупп):
I группа – подгруппа щелочных металлов,
II группа – подгруппа щелочно-земельных металлом,
III группа – подгруппа бора,
IV группа – подгруппа углерода,
V группа – подгруппа азота,
VI группа – подгруппа кислорода (халькогены),
VII группа – подгруппа фтора (галогены),
VIII группа – подгруппа инертных (или благородных) газов.
Выводы из знания строения атома и современной формулировки Периодического закона.
1. Между положением элемента в периодической системе и его электронным строением существует связь: местоположение химического элемента в ПСХЭ обуславливает свойства этих элементов, и, наоборот, свойства элементов обуславливают их местоположение в ПСХЭ.
2. Порядковый номер элемента в периодической системе равен заряду ядра атома (следовательно, порядковый номер показывает число протонов в ядре и число электронов в атоме).
3. Каждый период начинается элементом, в атомах которого начинает застраиваться новый электронный слой, причём номер этого слоя равен номеру периода (следовательно, номер периода показывает число электронных слоёв в атомах элементов данного периода).
4. Элементы, атомы которых обладают сходными по строению электронными оболочками, попадают в одну подгруппу периодической системы. У всех элементов главных подгрупп электронами заполняется внешний электронный слой, причём число электронов на этом слое равно номеру группы. У элементов I и II групп электронами заполняется s–подуровень, поэтому они называются s–элементами. У элементов III – VIII групп происходит заполнение р-подуровня, поэтому эти элементы относятся к семейству р-элементов. У элементов побочных подгрупп происходит заполнение электронами d–подуровня предпоследнего слоя, а у лантаноидов и актиноидов f-подуровня предпредпоследнего слоя.
5. Свойства элементов определяются их строением. Элементы, имеющие на последнем слое 1 – 2 электрона являются металлическими, 2 – 5 электронов – переходными, 4 – 8 электронов – неметаллическими.
ПСХЭ: характеристика элементов главных подгрупп
План описания:
1. Положение в ПСХЭ
2. Состав атома
3. Строение атома
4. Свойства
5. Вывод
Описание Na.
1. 3 период (малый), I группа, главная подгруппа, подгруппа Щелочных металлов. Порядковый номер 11. Аr = 23.
2. 1123Na (11p+; 12n0) 11e–
3. 1123Na 1s2 2s2 2p6 3s1
s2
s2 p6
2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ |
s1 p0 d0
3 | ↑ |
*
* n 3 l 0 ml 0 ms +1/2
11Na0
2 8 1
это s-элемент, на внешнем энергетическом уровне 1 электрон.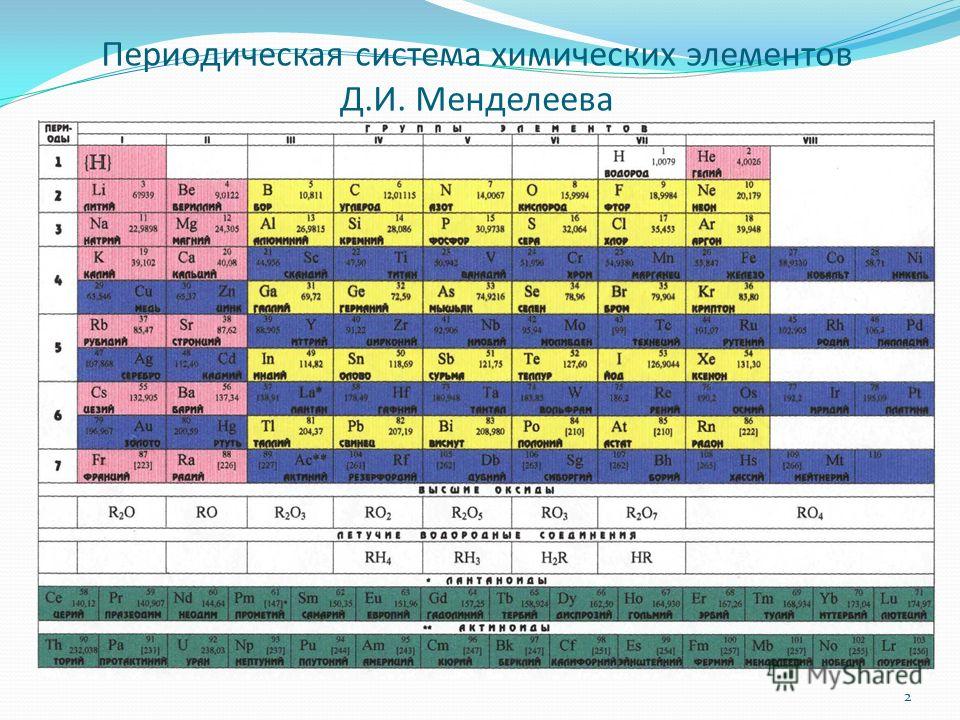
4. Na0 – 1e– Na+ катион натрия, восстановитель, окисляется
5. Na – типичный металлический элемент, щелочной металл, проявляет восстановительные свойства.
Описание As.
1. Положение в ПСХЭ 4 период (большой), V группа, главная подгруппа, подгруппа азота. Порядковый номер 33. Аr = 75.
2. Состав атома 3375As (33p+; 42n0) 33e–
3. Строение атома 3375As 1s2 2s2 2p6 3s13p64s23d104p3
s2
s2 p6
2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ |
s2 p6 d10
3 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ |
s2 p3 d0 f0
4 | ↑↓ | ↑ | ↑ | ↑ |
*
* n 4 l 1 ml +1 ms +1/2
33aAs0
2 8 18 5
это p-элемент, на внешнем энергетическом уровне 5 электронов.
4. Свойства As0 + 3e– à As-3 анион мышьяка, окислитель, восстанавливается
As0 – 3e– à As+3 катион мышьяка, восстановитель, окисляется
As0 – 5e– à As+5 катион мышьяка, восстановитель, окисляется
5. Вывод As – неметаллический элемент, проявляет и окислительные, и восстановительные свойства.
Описание Ga.
- Положение в ПСХЭ 4 период (большой), III группа, главная подгруппа, подгруппа бора. Порядковый номер 31. Аr = 70.
- Состав атома 3170Ga0 (31p+; 39n0) 31e–
- Строение атома 3170Ga0 1s2 2s2 2p6 3s13p64s23d104p1
s2
s2 p6
2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ |
s2 p6 d10
3 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ |
s2 p1 d0 f0
4 | ↑↓ | ↑ |
*
* n 4 l 1 ml -1 ms +1/2
31Ga0
2 8 18 3
это p-элемент, на внешнем энергетическом уровне 3 электрона.
- Свойства Ga0 – 3e– à Ga+3 катион галлия, восстановитель, окисляется
- Вывод Ga – амфотерный металлический элемент, проявляет восстановительные свойства.
Вопросы: (для контроля знаний)
Есть предложения по организации учебного процесса или знаете, как сделать техникум лучше?
Сообщите нам
Решаем вместе
В период с 30.11.2021 г. по 09.12.2021 г. проводится VIII Открытый региональный чемпионат «Молодые профессионалы» (WorldSkills Russia) — 2021 в Кузбассе.
В ГПОУ ЛКПТ с 01.11.2021 г. по 04.12.2021 г. впервые будет работать конкурсная площадка по компетенции «Банковское дело».
Мы будем принимать лучших представителей ПОО из городов — Кемерово, Новокузнецк, Белово.
Наш техникум будет представлять студентка 3 курса группы СБ-19 Нагорнова Светлана.
Впереди у участников ответственная, напряженная и сложная работа, которая потребует мобилизации всех знаний, умений и навыков. Желаем всем показать высочайшее мастерство в честной борьбе!
А Светлане — уверенности, успехов, и, конечно же, победы в борьбе за звание лучшего молодого профессионала Кузбасса в компетенции «Банковское дело»!
УВАЖАЕМЫЕ СТУДЕНТЫ!
Совершайте удобно платежи в адрес
Ленинск-Кузнецкого политехнического техникума
Через бесплатный интернет-банк Сбербанк Онлайн(или мобильное приложение Сбербанк онлайн):
На компьютере, подключенном к сети Интернет, наберите в адресной строке браузера https://online.sberbank.ru
Пройдите онлайн-регистрацию или введите постоянный логин и пароль, подтвердите вход SMS-паролем (потребуется карта Сбербанка с подключенной услугой «Мобильный банк»).
Для совершения платежа следуйте пунктам меню:
Платежи > в поисковой строке наберите: Л-Кузнецкий политехнический или 4212002624 >Л-Кузнецкий политехнический техникум > оплата по реквизитам> выберите карту списания > введите ФИО ребенка (студента), назначение платежа > продолжить > продолжить > оставляем паспорт, продолжить > введите серию и номер паспорта, продолжить > введите сумму, продолжить > Подтвердите оплату.
Чек об оплате доступен сразу после совершения платежа или в любое удобное время через пункт «История операций».
Горячая линия информационного сопровождения поиска и подбора работы для выпускников
+7 (38456)2-08-53, +7 (38456)2-26-60
Пушкинской картой уже воспользовались более 1 миллиона человек!
В Кузбассе по ней продано около 2000 билетов.
Сходить в театр или посетить музей за счет государства может каждый россиянин от 14 до 22 лет. А в следующем году у карты появится еще больше возможностей.
Где получить и как пользоваться — рассказываем в видео.
336,022 total views, 145 views today
Значение периодического закона и периодической системы элементов Д И. Менделеева
Открытие периодического закона и создание системы химических элементов имело огромное значение не только для химии, но и для философии, для всего нашего миропонимания. Менделеев показал, что химические элементы составляют стройную систему, в основе которой лежит фундаментальный закон природы.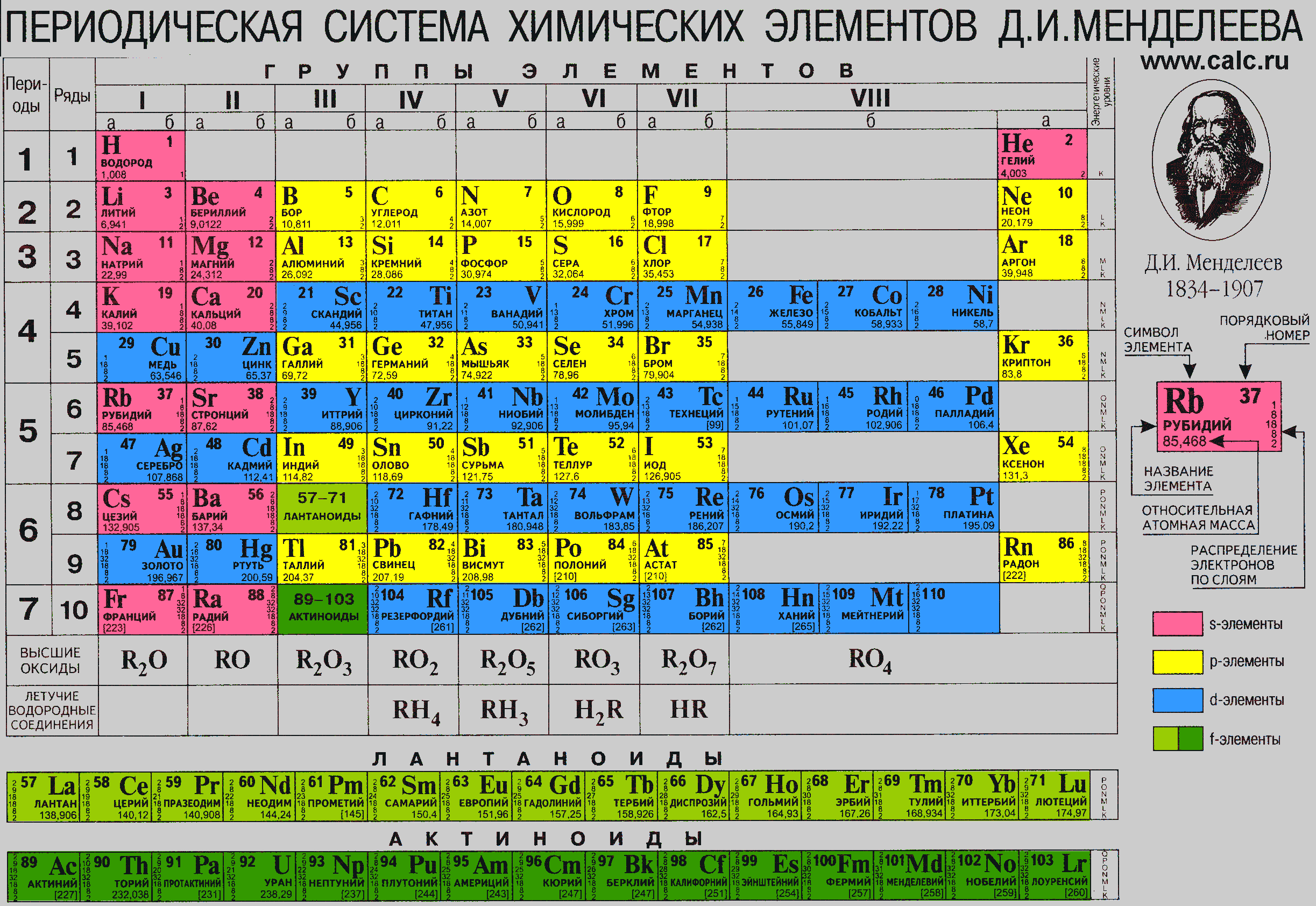 В этом нашло выражение положение материалистической диалектики о взаимосвязи и взаимообусловленности явлений природы. Вскрывая зависимость между свойствами химических элементов и массой их атомов, периодический закон явился блестящим подтверждением одного из всеобщих законов развития природы — закона перехода количества в качество. [c.54]
В этом нашло выражение положение материалистической диалектики о взаимосвязи и взаимообусловленности явлений природы. Вскрывая зависимость между свойствами химических элементов и массой их атомов, периодический закон явился блестящим подтверждением одного из всеобщих законов развития природы — закона перехода количества в качество. [c.54]
Несмотря на большое значение ранних работ различных ученых, главная заслуга в развитии периодической системы принадлежит русскому ученому Дмитрию Ивановичу Менделееву и немецкому ученому Юлиусу Лотару Мейеру. Независимо один от другого они открыли, что свойства элементов могут быть выражены как периодическая функция от. чх атомных весов, и сделали возможной периодическую классификацию, которая мало изменилась в течение последующих лет. Менделеев опубликовал свое первое сообщение о периодической системе в 1869 г., на несколько месяцев раньше появления в печати таблицы Мейера.
 Однако нет сомнения, что оба ученых достойны славы за открытие периодического закона, независимо от даты опубликования. Это было признано Королевским Обществом, присудившим в 1882 г, и Д. И. Менделееву, и Мейеру медаль Дэви. [c.84]
Однако нет сомнения, что оба ученых достойны славы за открытие периодического закона, независимо от даты опубликования. Это было признано Королевским Обществом, присудившим в 1882 г, и Д. И. Менделееву, и Мейеру медаль Дэви. [c.84] По поводу приоритета Д. И. Менделеева в открытии периодического закона А. Смит (А. Смит, Введение в неорганическую химию. Перевод под редакцией A.B. Раковского, Москва 1928) писал Лотар Мейер почти одновременно и независимо от Менделеева открыл периодическое изменение удельных объемов простых веществ с изменением атомного веса и далее хотя знание удельных объемов простых веществ имеет большое значение для изучения физико-химических особенностей элементов, однако ясно, что эти удельные объемы не пригодны для составления системы элементов и что ими во многих случаях нельзя руководствоваться для определения места элемента в системе. Вот почему Л. Мейер, открывший периодичность удельных объемов простых веществ, не мог создать периодической системы элементов, Что сделал Д. И. Менделеев, изучивший периодичность не только физических, но и химических свойств .— Прим. ред. [c.26]
И. Менделеев, изучивший периодичность не только физических, но и химических свойств .— Прим. ред. [c.26]
Открытие периодического закона и создание системы химических элементов имело огромное значение не только для химии, но и для философии, для всего нашего миропонимания. Менделеев показал, что химические элементы составляют стройную систему, в основе которой лежит фундаментальный закон природы. В этом нашло выражение положение материалистической диалектики о взаимосвязи и взаимообусловленности явлений природы. Вскрывая [c.55]
Более того, можно доказать, что все современное учение о химических элементах базируется на идеях Менделеева, в особенности полно высказанных в упомянутой статье Периодическая законность [для] химических элементов . Исключительно большое значение приобретает в связи с этим научное определение понятия химический элемент , составляющее фундамент всех современных представлений об атомах и элементах. Во втором разделе своей статьи (см.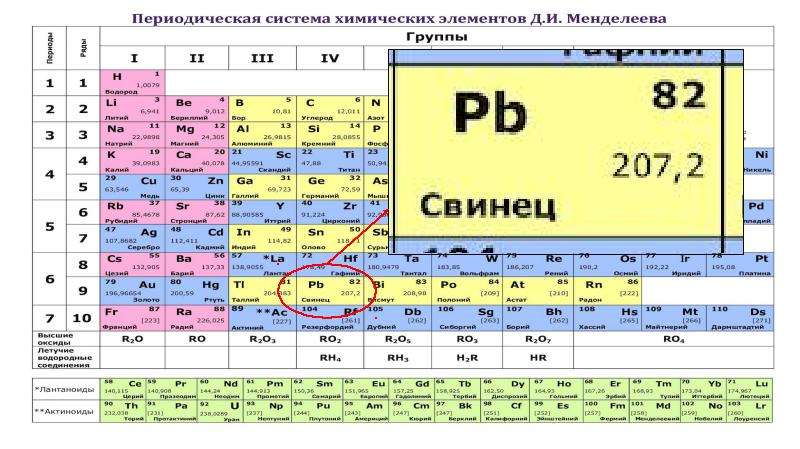 фотокопию VI) Менделеев пишет Положение элемента Я в системе определяется тем рядом и тою группою, к которым он относится, или около него стоящими элементами и У из того же ряда, элементами Н с меньшим и / ” с большим атомным весом из той же грунты. Свойства У и его соединений определяются, зная свойства X, У, Я и Я” [18, стр. 39]. [c.15]
фотокопию VI) Менделеев пишет Положение элемента Я в системе определяется тем рядом и тою группою, к которым он относится, или около него стоящими элементами и У из того же ряда, элементами Н с меньшим и / ” с большим атомным весом из той же грунты. Свойства У и его соединений определяются, зная свойства X, У, Я и Я” [18, стр. 39]. [c.15]
Сравнительно правильный ход нарастания разности атомных весов, представленный числами 16, 22 и 28, давал резкий скачок при переходе от 2г к Т1 сразу на 40. Между тем Менделеев уже в самый момент открытия периодического закона ясно видел, что переход от одного элемента к другому, качественно от него отличному, обусловлен правильным количественным изменением в атомных весах элементов, а, следовательно, и в их разностях. Это и означало фактическое признание, что количественные изменения атомного веса переходят , или превращаются, в качественные изменения химической индивидуальности элементов (т.
 е. вызывают и обусловливают их качественные изменения). В ряду элементов С, 51, Т1, 8п скачок от одного элемента к другому обусловливается количественной разностью в атомных весах в пределах около 20. Иными словами, для того, чтобы вызвать качественное изменение элемента для данного ряда, значение атомного веса должно возрасти примерно на 20 атомных единиц. А это означает, что если разность между атомными весами двух элементов, находящихся в одном и том же ряду, достигает 40 единиц, то оба эти элемента не являются соседними в общей системе. Между ними должен существовать какой-то неизвестный элемент х с промежуточным атомным весом (в данном случае около 70). Если допустить это, то закон превращения количественных изменений в качественные в данном его конкретном выражении будет полностью соблюден по всему ряду С, 51, Т1, х, 2г, 5п правильное изменение атомного веса примерно на 20 единиц будет каждый раз обусловливать качественное изменение у химических элементов. [c.8]
е. вызывают и обусловливают их качественные изменения). В ряду элементов С, 51, Т1, 8п скачок от одного элемента к другому обусловливается количественной разностью в атомных весах в пределах около 20. Иными словами, для того, чтобы вызвать качественное изменение элемента для данного ряда, значение атомного веса должно возрасти примерно на 20 атомных единиц. А это означает, что если разность между атомными весами двух элементов, находящихся в одном и том же ряду, достигает 40 единиц, то оба эти элемента не являются соседними в общей системе. Между ними должен существовать какой-то неизвестный элемент х с промежуточным атомным весом (в данном случае около 70). Если допустить это, то закон превращения количественных изменений в качественные в данном его конкретном выражении будет полностью соблюден по всему ряду С, 51, Т1, х, 2г, 5п правильное изменение атомного веса примерно на 20 единиц будет каждый раз обусловливать качественное изменение у химических элементов. [c.8] Большое прогностическое значение имеет периодический закон Д. И.Менделеева На оснопе периодической системы Д. И. Менделеев исправил атомные массы у 20 элементов, предсказал существование ряда неоткрытых элементов и дал точное описание их свойств. [c.70]
И.Менделеева На оснопе периодической системы Д. И. Менделеев исправил атомные массы у 20 элементов, предсказал существование ряда неоткрытых элементов и дал точное описание их свойств. [c.70]
О взаимосвязи закона с системой автор открытия писал Было бы правильнее мою систему назвать периодической , потому что она вытекает из периодического закона… В сопоставлении несходных элементов заключается важнейший принцип, которым моя система отличается от систем моих предшественников (Д. И, Менделеев. Периодический закон. Классики науки . М., Изд-во АН СССР, 1958. С. 388), и далее …важнейшее качество элемента познается не по низшей, а по высшим степеням окисления. По этим причинам важнейшее значение для характеристики элемента имеют высшие формы образуемых им соеднненнй,,. (Менделеев Д. И. Периодический закон. Дополнительные материалы, М,, Изд-во АН СССР, 1960, С, 343). [c.62]
В сентябре 1876 г. Лекок де Буабодран повторил опыты очистил металл и нашел плотность его равной 5,94 (по современным, 5,91), а атомную массу 69,9 (современное значение 69,72). Я полагаю,— писал он,— что нет необходимости настаивать на исключительной важности подтверждения теоретических взглядов Д. Менделеева относительно плотности нового элемента В третьем издании Основ химии (1877) впервые в периодической системе химических элементов вместо прежнего 68 , стоит Са 68 . Признаюсь,— писал Д. И. Менделеев в мае 1880 г.,— что я не думал видеть в течение моей жизни такого блистательного доказательства периодического закона, какое доставило ото открытие г. Лекок де Буабодрана Открытие галлия было первым толчком ко всеобщему признанию периодического закона. [c.273]
Я полагаю,— писал он,— что нет необходимости настаивать на исключительной важности подтверждения теоретических взглядов Д. Менделеева относительно плотности нового элемента В третьем издании Основ химии (1877) впервые в периодической системе химических элементов вместо прежнего 68 , стоит Са 68 . Признаюсь,— писал Д. И. Менделеев в мае 1880 г.,— что я не думал видеть в течение моей жизни такого блистательного доказательства периодического закона, какое доставило ото открытие г. Лекок де Буабодрана Открытие галлия было первым толчком ко всеобщему признанию периодического закона. [c.273]
Менделеев использовал открытый им периодический закон для разработки периодической системы элементов, что позволило ему предсказать существование 11 неизвестных элементов, а для некоторых известных элементов исправить значения. .. веса. [c.32]
История открытия рения лишний раз блестяще подтвердила громадное значение периодической системы элементов Д. И. Менделеева. Как известно, Д. И. Менделеев, исходя из своего периодического закона, предсказал свойства нескольких не известных [c.24]
Менделеева. Как известно, Д. И. Менделеев, исходя из своего периодического закона, предсказал свойства нескольких не известных [c.24]
Больше, чем сама периодическая таблица, имеют значение те принципы и закономерности, которые увидел Менделеев за периодической зависимостью элементов. Он открыл лежащий в основе любой классификации элементов один из фундаментальных законов природы — периодический закон. Лишь на этой основе могла быть создана не просто таблица, а единая система элементов. [c.41]
До открытия периодического закона атомный вес теллура (Те = 128), определенный с достаточно высокой точностью, не вызывал ни у одного из химиков, в том числе и у Менделеева, никаких сомнений. В день открытия периодического закона (1 марта 1869 г.) Менделеев неоднократно заносил в свои записи именно это число для теллура. Оно фигурирует в обеих неполных табличках элементов — верхней и нижней 22, с. 49], а также в списке атомных весов (22, с. 69], из которого Менделеев брал данные для занесения на карточки перед раскладыванием химического пасьянса . В черновой таблице, в которой регистрировался ход этого пасьянса , также стоит Те = 128 (см. первую книгу, фотокопия I). Однако при переписывании этой таблицы набело для отсылки в типографию 43, фотокопия II) и в отпечатанном Опыте системы элементов (см. первую книгу, фотокопия II) у значения атомного веса теллура Менделеев поставил знак вопроса Те = 128 Разъяснение этому дано в первой статье Соотношение свойств с атомным весом элементов (март [c.136]
В черновой таблице, в которой регистрировался ход этого пасьянса , также стоит Те = 128 (см. первую книгу, фотокопия I). Однако при переписывании этой таблицы набело для отсылки в типографию 43, фотокопия II) и в отпечатанном Опыте системы элементов (см. первую книгу, фотокопия II) у значения атомного веса теллура Менделеев поставил знак вопроса Те = 128 Разъяснение этому дано в первой статье Соотношение свойств с атомным весом элементов (март [c.136]
Оба ученых обнаружили, что элементы могут быть объединены в группы со сходными свойствами и что повторяемость этих свойств находится в периодической зависимости от атомного веса элемента. Из-за недостаточной чистоты и малочисленности известных в то время соединений атомные веса некоторых элементов оставались не вполне определенными, но найденные закономерности оказались настолько поразительны.ми, что са.ма возможность сопоставления свойств на основании периодического закона не подвергалась серьезным возражениям со стороны химиков.
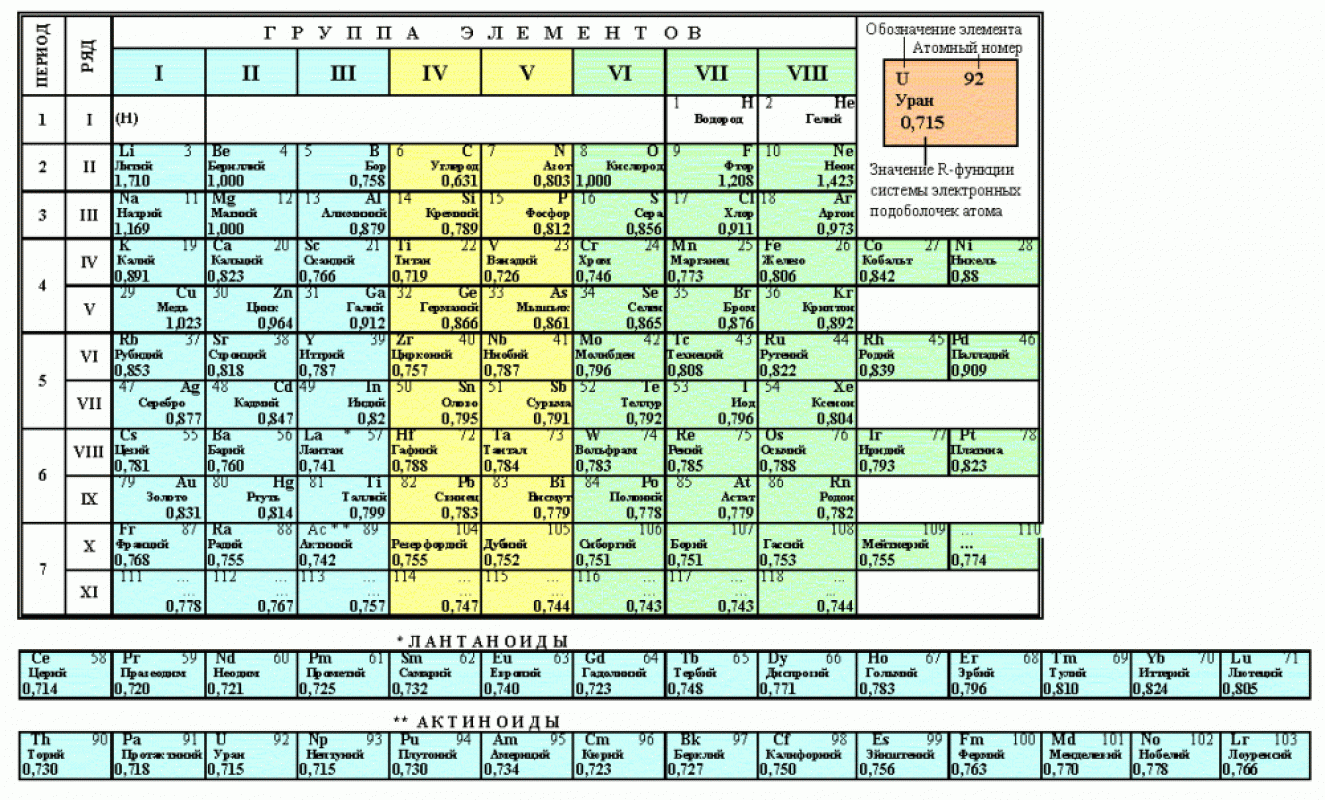 Табл. 5.4 воспроизводит периодическую систему, впервые опубликованную Менделеевым. Приоритет в установлении периодической системы следует все же признать за Менделеевым, так как, во-первых, он учитывал экспериментальную погрешность в значениях атомных весов, а во-вторых, указал на то, что периодическая система позволяет установить соответствие между самыми различными свойствами формулами окислов и многих других соединений, кислотно-основными свойствами элементов, их плотностью, температурами кипения п плавления, строением кристаллов, реакционной способностью, объемами грамм-атомов. Более того, Менделеев был настолько [c.160]
Табл. 5.4 воспроизводит периодическую систему, впервые опубликованную Менделеевым. Приоритет в установлении периодической системы следует все же признать за Менделеевым, так как, во-первых, он учитывал экспериментальную погрешность в значениях атомных весов, а во-вторых, указал на то, что периодическая система позволяет установить соответствие между самыми различными свойствами формулами окислов и многих других соединений, кислотно-основными свойствами элементов, их плотностью, температурами кипения п плавления, строением кристаллов, реакционной способностью, объемами грамм-атомов. Более того, Менделеев был настолько [c.160] Разделялось ошибочное мнение, будто в общем случае определяющим признаком места элемента в системе служил у Менделеева атомный вес этого элемента. В действительности же лишь в начальной фазе процесса открытия и только у наиболее изученных элементов, да и то не у всех, атомный вес определял место элемента в строящейся системе элементов. Но уже с самых первых шагов открытия периодического закона стало выступать — и чем дальше, тем все сильнее и явственнее—обратное соотношение между местом элемента в системе и значением его атомного веса. Это мы уже видели на примере бериллия (см. гл. I). В соответствии с тем, на какое место даже в еще не завершенной системе мог бы встать данный элемент, Менделеев стал исправлять значение его атомного веса так, чтобы оно соответствовало данному месту. Это означает, что определяющим по отношению к атомному весу в данном случае выступало место в системе, а не наоборот, как ошибочно принято считать иногда даже до сих пор. [c.38]
Это мы уже видели на примере бериллия (см. гл. I). В соответствии с тем, на какое место даже в еще не завершенной системе мог бы встать данный элемент, Менделеев стал исправлять значение его атомного веса так, чтобы оно соответствовало данному месту. Это означает, что определяющим по отношению к атомному весу в данном случае выступало место в системе, а не наоборот, как ошибочно принято считать иногда даже до сих пор. [c.38]
Уже с самого начала открытия периодического закона кроме действительно наблюденных неточностей при определении атомных весов Менделеев столкнулся с двумя случаями, которые впоследствии получили наименование аномалии периодической системы элементов . Это были две пары смежных друг с другом элементов первая — теллур (Те = 128) и иод (1=127), вторая — кобальт (Со = =58,9) и никель (№ = 58,7). Хотя Менделеев стремился сравнять у каждой пары элементов значения их атомных [c.134]
Получились несоразмерные разности между атомными весами смежных по системе элементов Ti—ЕЬ = 50—44=6, и в то же время V—Ti=51—50= 1. Это указывало на то, что атомный вес титана слишком далек от экабора и слишком близок к ванадию. Поэтому уже в конце 1870 г. Менделеев поставил впервые вопросительный знак у атомного веса титана Ti = 50 [43, с. 158]. Этим он хотел сказать, что в данном случае значение атомного веса подлежит исправлению. В связи с этим на основании периодического закона Менделеев высказал прогноз, что у титана атомный вес должен быть меньше по крайней мере на две атомные единицы по сравнению с принятым до тех пор, что давало Ti = 48. [c.146]
Это указывало на то, что атомный вес титана слишком далек от экабора и слишком близок к ванадию. Поэтому уже в конце 1870 г. Менделеев поставил впервые вопросительный знак у атомного веса титана Ti = 50 [43, с. 158]. Этим он хотел сказать, что в данном случае значение атомного веса подлежит исправлению. В связи с этим на основании периодического закона Менделеев высказал прогноз, что у титана атомный вес должен быть меньше по крайней мере на две атомные единицы по сравнению с принятым до тех пор, что давало Ti = 48. [c.146]
Менделеев спустя месяц с небольшим (2 октября 1869 г.) дал, как известно, другой ответ на вопрос о предельно атомности, показав, что она так же как и другие свойства элементов, является функцией их атомного веса и соответствует положению элемента в периодической системе. Об этом напечатано в том же выпуске ЖРХО (вып. 8 и 9, стр. 213), где Менделеев сообщает, что количество кислорода, могущее заключаться в соляных окислах, определяется порядком элементов по величине веса их атома . О переменности значений атомности у разных элементов он сообщил еще раньше (в марте 1869 г.) в своей первой статье, посвященной периодическому. закону (см. ст. 2). [c.458]
О переменности значений атомности у разных элементов он сообщил еще раньше (в марте 1869 г.) в своей первой статье, посвященной периодическому. закону (см. ст. 2). [c.458]
Будучи глубоко убежденным в правильности периодического закона, Менделеев на основании системы элементов предсказал с шествование экабора с атомным весом около 45, которому предстояло занять место в клетке, расположенной ниже бора экаалюминия с атомным весом около 70 —в клетке под алюминием, и в пустой соседней клетке справа от него, под кремнием — экасилиция с атомным весом около 72 кроме того, он выдвинул предположение о вероятной величине удельного веса, температуре плавления, атомном объеме, составе и свойствах окислов и хлоридов, соответствующих этим простым веществам. Когда недостающие элементы были открыты — ими оказались скандий 215с (1879 г.), галлий з10а (1875 г.) и германий з20е (1886 г.), то экспериментально измеренные характеристики этих элементов с поразительной точностью совпали с предсказанными значениями, и уверенность в справедливости периодического закона сильно возросла. Укрепителями периодического закона называл Менделеев открывателей этих элементов — Л. Нильсона, П. Лекок де Буабодрана и К- Винклера. [c.29]
Укрепителями периодического закона называл Менделеев открывателей этих элементов — Л. Нильсона, П. Лекок де Буабодрана и К- Винклера. [c.29]
Довольно подробно вопрос о приоритете Д. И. Менделеева в открытии периодического закона рассмотрен в книгах В. И. Семишина [222, с. 211] и H.A. Фигуровского [223]. Сам. А. Мейер даже и не помышлял отрицать выдающуюся и определяющую роль Д. И. Менделеева в открытии периодического закона. В 1869 г.,— вспоминал А. Мейер,— раньше, чем я высказал свои мысли о периодичности свойств элементов, появился реферат статьи Менделеева, в котором написано 1) при расположении элементов в порядке восходящих атомных весов наблюдается ступенчатое (у Д. И. Менделеева периодическое .— Ред.) изменение свойств элементов 2) величина атомных весов определяет свойства элементов 3) атомные веса некоторых элементов требуют исправления 4) должны существовать некоторые еще не открытые элементы… Это все было Д. И. Менделеевым опубликовано до меня и вообще впервые. Я открыто признаюсь, что у меня не хватило смелости для таких дальновидных предположений, какие с уверенностью высказал Менделеев [222, с. 40]. В наши дни известный американский физико-хи-мик Дж. Кемпбелл детально рассмотрел причины, по которым приоритет в установлении периодической системы следует признать за Менделеевым . Во-первых,— подчеркивает Кемпбелл,— он (Д. И. Менделеев.— Ред.) учитывал экспериментальную погрешность в значениях и, во-вторых, указал на то, что периодическая система позволяет установить соответствие между самыми различными свойствами фомулами окислов и многих других соединений, кислотно-основными свойствами элементов, их плотностью, температурами кипения и плавления, строением кристаллов, реакционной способностью, объемами грамм-атомов. Более того, Менделеев был настолько убежден в открытом им периодическом законе, что оставил в таблице пустые места для еще не открытых элементов и правильно предсказал их свойства, что в точности подтвердилось впоследствии 224, с.
Я открыто признаюсь, что у меня не хватило смелости для таких дальновидных предположений, какие с уверенностью высказал Менделеев [222, с. 40]. В наши дни известный американский физико-хи-мик Дж. Кемпбелл детально рассмотрел причины, по которым приоритет в установлении периодической системы следует признать за Менделеевым . Во-первых,— подчеркивает Кемпбелл,— он (Д. И. Менделеев.— Ред.) учитывал экспериментальную погрешность в значениях и, во-вторых, указал на то, что периодическая система позволяет установить соответствие между самыми различными свойствами фомулами окислов и многих других соединений, кислотно-основными свойствами элементов, их плотностью, температурами кипения и плавления, строением кристаллов, реакционной способностью, объемами грамм-атомов. Более того, Менделеев был настолько убежден в открытом им периодическом законе, что оставил в таблице пустые места для еще не открытых элементов и правильно предсказал их свойства, что в точности подтвердилось впоследствии 224, с. 160—162].— Прим. ред. [c.76]
160—162].— Прим. ред. [c.76]
Значение периодического закона Д. И. Менделеева в связи с этим еще более возросло. Научные исследования последнего времени полностью подтвердили и существование периодичности в изменениях свойств элементор, и ту последовательность в расположении элементов, которую установил Д. И. Менделеев в своей системе. Д. И. Менделеев при построении периодической системы исходил из атомных весов элементов, а не из зарядов их ядер (существование которых никто тогда не предполагал), но надо иметь в вид -, что для значительного большинства элементов возрастание их ядерных зарядов идет параллельно возрастанию их атомных весов. [c.215]
Первой загадкой был атомный вес бериллия и состав его окиси. Долгое время для окиси бериллия принималась предложенная в 1826 г. Берцелиусом глиноземная формула — ВегОз в соответствии с нею атомный вес бериллия получался Ве = 13,5. Но при таком значении атомного веса бериллий вообще не находил себе места в периодической системе элементов тем самым подрывалась бы общность периодического закона, и этот закон как бы утрачивал характер истинного закона природы Но еще в 1842 г. русский химик И. В. Авдеев показал впервые, что атомный вес бериллия равен 9,308 (при Н = 1), а окись бериллия имеет магнезиальную формулу ВеО. Однако большинство химиков продолжало придерживаться старой, глиноземной формулы. Первые годы после открытия периодического закона вопрос об атомном весе бериллия, казалось бы, не вызывал особых сомнений. Менделеев поместил Ве = 9,4 в одну группу с магнием, а в ноябре 1870 г. он отвел бериллию место II—2 в своей Естественной системе элементов (т. е. место во II группе и 2-м ряду системы). Однако, спустя несколько лет, в 1878 г. два шведских химика Нильсон и Петерсон на основании неправильно исто.ткованных ими результатов определения теплоемкости бериллия и его окиси, предложили вновь вернуться к формуле окиси ВегОз и к атомному весу Ве= 13,5. Это предложение находилось в вопиющем противоречии с периодическим законом. Тогда же в защиту ВеО и Ве = 9, а [c.81]
русский химик И. В. Авдеев показал впервые, что атомный вес бериллия равен 9,308 (при Н = 1), а окись бериллия имеет магнезиальную формулу ВеО. Однако большинство химиков продолжало придерживаться старой, глиноземной формулы. Первые годы после открытия периодического закона вопрос об атомном весе бериллия, казалось бы, не вызывал особых сомнений. Менделеев поместил Ве = 9,4 в одну группу с магнием, а в ноябре 1870 г. он отвел бериллию место II—2 в своей Естественной системе элементов (т. е. место во II группе и 2-м ряду системы). Однако, спустя несколько лет, в 1878 г. два шведских химика Нильсон и Петерсон на основании неправильно исто.ткованных ими результатов определения теплоемкости бериллия и его окиси, предложили вновь вернуться к формуле окиси ВегОз и к атомному весу Ве= 13,5. Это предложение находилось в вопиющем противоречии с периодическим законом. Тогда же в защиту ВеО и Ве = 9, а [c.81]
На Конгрессе в Карлсруэ голосование носило не императивный, а скорее информационный характер, да но главнейшим вопросам оно и не проводилось. Тем не менео можно говорить о положительных результатах Конгресса — о том, что он, как могучий катализатор, способствовал успеху реформы атомпо-молекулярной теории, начатой Жераром и завершенной Канниццаро. И этим успехом, можно повторить, Конгресс был в первую очередь обязан Канниццаро. После Конгресса, но словам Л. Мейера, когда он тюзнакомился еще с Smito пелена спала с глаз, и появи.лось чувство спокойной уверенности . Менделеев считал, что решающее значение для развития его идей, приведших к периодическому закону, име.ч 1860 г. и особенно соображения, высказанные на Конгрессе химиков Канниццаро. Я рассматриваю его (Канниццаро) как своего предшественника, потому что установленные им атомные веса послужили мне необходимой точкой опоры Хотя после Конгресса в Карлсруэ система атомных весов стала интенсивно разрабатываться (Канниццаро никогда не давал полной таблицы атомных весов), и в этом принимали участие многие химики (Вюрц, Одлинг, Л. Мейер и др.), открытие Менделеевым периодического закона и разработка им метода теоретического исправления уже известных и даже предсказания атомных весов еще неизвестных элементов стало решающим для утверждения новой системы атомных весов [c.
Тем не менео можно говорить о положительных результатах Конгресса — о том, что он, как могучий катализатор, способствовал успеху реформы атомпо-молекулярной теории, начатой Жераром и завершенной Канниццаро. И этим успехом, можно повторить, Конгресс был в первую очередь обязан Канниццаро. После Конгресса, но словам Л. Мейера, когда он тюзнакомился еще с Smito пелена спала с глаз, и появи.лось чувство спокойной уверенности . Менделеев считал, что решающее значение для развития его идей, приведших к периодическому закону, име.ч 1860 г. и особенно соображения, высказанные на Конгрессе химиков Канниццаро. Я рассматриваю его (Канниццаро) как своего предшественника, потому что установленные им атомные веса послужили мне необходимой точкой опоры Хотя после Конгресса в Карлсруэ система атомных весов стала интенсивно разрабатываться (Канниццаро никогда не давал полной таблицы атомных весов), и в этом принимали участие многие химики (Вюрц, Одлинг, Л. Мейер и др.), открытие Менделеевым периодического закона и разработка им метода теоретического исправления уже известных и даже предсказания атомных весов еще неизвестных элементов стало решающим для утверждения новой системы атомных весов [c. 132]
132]
Всем предыдущим изложением Менделеев подводит к раскрытию сущности периодического закона. При этом мы хотели бы обратить внимание на одно обстоятельство, которое имеет огромное методическое значение. Реч Ь -идет об использовании представлений об общих, особенн ЫХ и индивидуальных свойствах элементов, проявление которых и определяется положением элементов в системе, т. их взаимосвязи, особенности групп, рядов и индивидуалы е черты. Плодотворность нодобного рассмотрения содёр ЖайИЛ периодического закона бщла показана академиком Б. Кедровым на примере анализа истории открытия периодического закона [c.210]
Открытие д. и. Менделеевым периодического закона обобщило химические знания, накопленные к середине XIX в., и обусловило бурное развитие многих областей химии. Химическая наука стала развиваться в новых направлениях, которые ранее не были возможны. В частности, открытие периодического закона поставило вопрос о полноте и пределах периодической системы, в результате чего внимание многих химиков было привлечено к исследованию элементов, замыкавших в то время таблицу. Сам Д. И. Менделеев придавал исключительное значение исследованию химии урана и призывал развивать работы в этой области. Примечательно, что именно исследования урана привели к обнаружению нового явления — радиоактивности и к рождению новой области науки — радиохимии. Несомненно, что открытие радиоактивности и последовавшее за ним бурное развитие радиохимии неразрывно связаны с той революцией в области химии, которую произвел периодический закон Д. И. Метгде-леева. [c.213]
Сам Д. И. Менделеев придавал исключительное значение исследованию химии урана и призывал развивать работы в этой области. Примечательно, что именно исследования урана привели к обнаружению нового явления — радиоактивности и к рождению новой области науки — радиохимии. Несомненно, что открытие радиоактивности и последовавшее за ним бурное развитие радиохимии неразрывно связаны с той революцией в области химии, которую произвел периодический закон Д. И. Метгде-леева. [c.213]
Открытие периодического закона и создание системы химически элементов имело огромное значение не только дл.ч химии, но и для всего естествознания в целом. Открытие Д. И. Менделеева обогатило человеческое знание одной из фундаментальных закономерностей природы. Оценивая значение открытия Д. И. Менделеева, Ф. Энгельс писал Менделеев, применив… закон о переходе количества в качество, совершил научный подвиг, который смело можно поставить рядом с открытием Леверье, вычислившего орбиту еще не известной планеты — Нептуна (Маркс К. и Энгельс Ф. Соч.— Т. 20.— С. 389). [c.22]
и Энгельс Ф. Соч.— Т. 20.— С. 389). [c.22]
Природные соединения и получение германия, олова и свинца. История открытия германия является поучительным примером научного предвидения, основанного на знании фундаментальных законов природы. Через два года после опубликования периодической системы, в 1871 г., Д. И. Менделеев предсказал существование нескольких неизвестных в то время элементов, в том числе экасилиция, и описал основные свойства этих элементов и некоторых их соединений. Спустя 15 лет (в 1886 г.) немецкий химик Винклер в природном минерале аргиродите обнаружил элемент, по свойствам тождественный предсказанному под № 32 экасилицию. Это открытие подтвердило огромное значение периодического закона, и позднее Д. И. Менделеев назвал германий, скандий и галлий элементами — укрепителями периодической системы . [c.216]
Ко времени открытия Д. И. Менделеевым периодического закона были известны перекисные соединения только для 19 элементов. Д. И. Менделеев придавал особое значение неорганическим перекисям. Его интерес к этому классу соединений был обусловлен тем, что они, по господствующим тогда понятиям об их природе, не подчинялись общей закономерности, согласно которой элементы, расположенные в порядке возрастания атомного веса, дают повторяющиеся ряды высших окислов, соответствующих номеру группы периодической системы. Уместно отметить, что с открытием в сороковых годах настоящего столетия молекулярных ионов кислорода 01 , ОГ и ОГ понятие неорганическое перекисное соединение четко определилось и нет необходимости считать, что эти соединения не подчиняются общим законам валентности, периодичности и комплексообразования. Например, соединение КО2, или как писали тогда К 2О4, не представляет исключения из общего правила, согласно которому валентность калия должна соответствовать номеру группы периодической системы, где расположен этот элемент, т. е. единице, так как оно характеризуется наличием одновалентного молекулярного иона 07.
Д. И. Менделеев придавал особое значение неорганическим перекисям. Его интерес к этому классу соединений был обусловлен тем, что они, по господствующим тогда понятиям об их природе, не подчинялись общей закономерности, согласно которой элементы, расположенные в порядке возрастания атомного веса, дают повторяющиеся ряды высших окислов, соответствующих номеру группы периодической системы. Уместно отметить, что с открытием в сороковых годах настоящего столетия молекулярных ионов кислорода 01 , ОГ и ОГ понятие неорганическое перекисное соединение четко определилось и нет необходимости считать, что эти соединения не подчиняются общим законам валентности, периодичности и комплексообразования. Например, соединение КО2, или как писали тогда К 2О4, не представляет исключения из общего правила, согласно которому валентность калия должна соответствовать номеру группы периодической системы, где расположен этот элемент, т. е. единице, так как оно характеризуется наличием одновалентного молекулярного иона 07. То же самое относится, например, к соединению Каа02, характеризующемуся наличием молекулярного иона 01″, и к соединению КОд, содержащему молекулярный ион 0 .. [c.7]
То же самое относится, например, к соединению Каа02, характеризующемуся наличием молекулярного иона 01″, и к соединению КОд, содержащему молекулярный ион 0 .. [c.7]
К открытию Периодического закона Д. И. Менделеев пришел, исследуя сходство между химическими элементами. Периодический закон не только привел в систему знания по свойствам элементов, но и позволил прогнозировать новые неоткрытые элементы и их свойства. Действительным его триумфом было открытие галлия и других элементов, место для которых в Системе было предсказано Д. И. Менделеевым и свойства которых оказались близкими к предсказанным. В настоящее время Периодический закон имеет особенно большое значение для прогнозирования числа и свойств трансураиидов [Прогнозирование…, 1976]. [c.85]
Но если формула окислов редкоземельных элементов есть МегОз, то их атомные веса должны быть изменены Менделеев увеличивает их значение примерно в полтора раза по сравнению с прежними. Теперь атомный вес иттрия стал равен 88, лантана — 138, церия — 139, дидима — 140 и эрбия — 175. Теперь III группа гостеприимно распахивает свои двери для новых пришельцев. Но для всех ли Иттрий легко помещается в 6-й ряд III группы, между стронцием и цирконием поэтому иттрий перестает быть классическим редкоземельным элементом, если иметь в виду современное представление об этом семействе. Выше иттрия пустая клетка ожидает предсказанного Менделеевым экабора — будущего скандия. Ниже, в 8-й ряд вошел лантан. Пока все хорошо, ничто не вызывает сомнений. Далее следует церий, его атомный вес почти идентичен атомному весу лантана. В III группе ему уже нет места, но его может принять IV, ибо металл дает высшую окись МеО2, где он находится в четырехвалентном состоянии. Но для следующего элемента — дидима — уже нужно допустить пятивалентное состояние, тогда он попадет в V группу. Но никто не получал производных пятивалентного дидима. Неясен вопрос и с эрбием. Его, правда, можно поместить в III группу, ниже лантана, но свойства его почти не изучены и, кто знает, быть может, он представляет собой смесь элементов.
Теперь III группа гостеприимно распахивает свои двери для новых пришельцев. Но для всех ли Иттрий легко помещается в 6-й ряд III группы, между стронцием и цирконием поэтому иттрий перестает быть классическим редкоземельным элементом, если иметь в виду современное представление об этом семействе. Выше иттрия пустая клетка ожидает предсказанного Менделеевым экабора — будущего скандия. Ниже, в 8-й ряд вошел лантан. Пока все хорошо, ничто не вызывает сомнений. Далее следует церий, его атомный вес почти идентичен атомному весу лантана. В III группе ему уже нет места, но его может принять IV, ибо металл дает высшую окись МеО2, где он находится в четырехвалентном состоянии. Но для следующего элемента — дидима — уже нужно допустить пятивалентное состояние, тогда он попадет в V группу. Но никто не получал производных пятивалентного дидима. Неясен вопрос и с эрбием. Его, правда, можно поместить в III группу, ниже лантана, но свойства его почти не изучены и, кто знает, быть может, он представляет собой смесь элементов. Что это весьма вероятно, свидетельствует сама периодическая система, так как разница в атомных весах дидима и эрбия огромна и равна 35 и в этом интервале может уместиться до десятка неизвестных еще редких земель. Так, сама логика периодического закона подсказывала новые открытия в дебрях редко- [c.23]
Что это весьма вероятно, свидетельствует сама периодическая система, так как разница в атомных весах дидима и эрбия огромна и равна 35 и в этом интервале может уместиться до десятка неизвестных еще редких земель. Так, сама логика периодического закона подсказывала новые открытия в дебрях редко- [c.23]
До 1910 г. химики были уверены, что все атомы данного элемента обладают одним и тем же постоянным атомным весом. Выше мы уже отметили, что Д. И. Менделеев придавал этому положению очень большое теоретическое значение — его периодический закон был открыт и периодическая система была создана именно на основании твердой веры в это правило. Однако впоследствии (начиная с 1910 г.) было установлено, что атомы одного и того же элемента в подавляюш,ем различными атомными весами. Химикам пришлось дать атомному весу, который устанавливается для каждого элемента опытным путем, иное толкование. Было установлено, что большинство элементов обладают изотопами. [c.283]
Закон Менделеева оказался могучим орудием предвидения в области ядерных процессов. Опираясь на этот закон, удалось найти ключ к теоретическому пониманию ядерных процессов. Высказывания великого ученого о значении урана и тория и их места в периодической системе подтверждаются открытиями ядерных процессов. Между всеми известными химическими элементами уран выдается тем,— писал Менделеев,— что обладает наивысшим атомным весом… Этим обстоятельствам ныне, когда периодическая система элементов оправдывается е разнообразнейших сторон, мне кажется, должно приписать немалое значение для того интереса, который, очевидно, возрастает по отношению к урану, особенно с тех пор, как с ним оказались связанными два из важнейших — во множестве отношений — открытия физики и химии нашего времени, а именно открытие аргоновых элементов (особенно гелия) и радиоактивных веществ. Те и другие представляют своего рода неожиданность и крайность, какими-то, еще глубоко сокрытыми способами, связанные с крайностью в эволюции элементов самого урана. Наивысшая, из известных, концентрация массы весомого вещества в неделимую массу атома, существующая в уране, уже а priori должна влечь за собою выдающиеся особенности.
Опираясь на этот закон, удалось найти ключ к теоретическому пониманию ядерных процессов. Высказывания великого ученого о значении урана и тория и их места в периодической системе подтверждаются открытиями ядерных процессов. Между всеми известными химическими элементами уран выдается тем,— писал Менделеев,— что обладает наивысшим атомным весом… Этим обстоятельствам ныне, когда периодическая система элементов оправдывается е разнообразнейших сторон, мне кажется, должно приписать немалое значение для того интереса, который, очевидно, возрастает по отношению к урану, особенно с тех пор, как с ним оказались связанными два из важнейших — во множестве отношений — открытия физики и химии нашего времени, а именно открытие аргоновых элементов (особенно гелия) и радиоактивных веществ. Те и другие представляют своего рода неожиданность и крайность, какими-то, еще глубоко сокрытыми способами, связанные с крайностью в эволюции элементов самого урана. Наивысшая, из известных, концентрация массы весомого вещества в неделимую массу атома, существующая в уране, уже а priori должна влечь за собою выдающиеся особенности.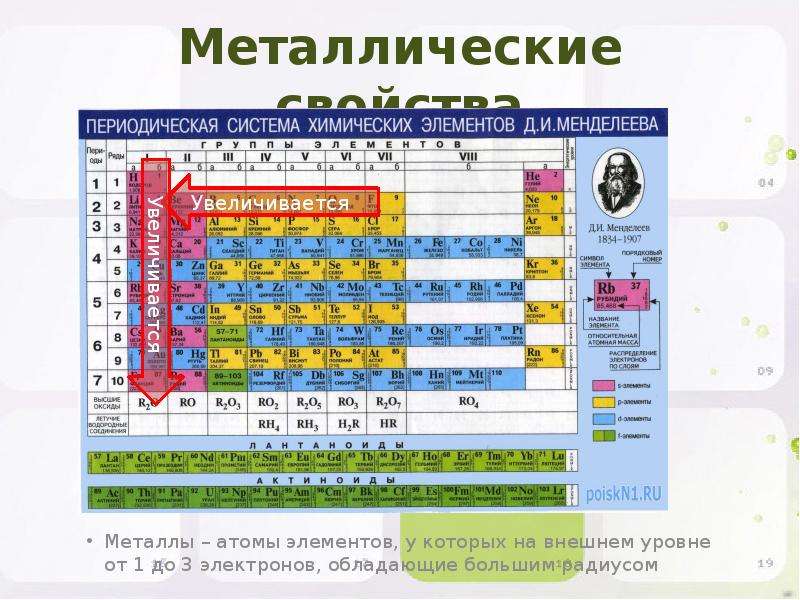 .. Убежденный в том, что исследование урана, начиная с его природных источников, поведет еще ко многим новым открытиям, я смело рекомендую тем, кто ищет пред- [c.366]
.. Убежденный в том, что исследование урана, начиная с его природных источников, поведет еще ко многим новым открытиям, я смело рекомендую тем, кто ищет пред- [c.366]
Нильсон и Петерсон в пределах от О до 100° оиредели-ли теплоемкость этого нечистого металла и сделали поправку на теплоемкость примесей. В итоге они получили для теплоемкости бериллия значение 0,4084, что требовало принятия Ве = 13,8 (так как в этом случае выдерживается закон Дюлонга и Пти 0,4084-13,8 = 5,64). В связи с этим они писали …Нагие мнение об истинном атомном весе и химической природе этого металла противоречит так называемому периодическому закону, который Менделеев предначертал для всех элементов, а именно не только потому, что при Ве=13,8 металл этот едва ли может быть помещен в менделеевскую систему, но и потому, что тогда элемент с атомным весом 9,2, как это требует периодический закон, в системе отсутствовал бы и, по-видимому, еще должен быть открыт [50, с. 581—582]. [c. 15]
15]
Выступая 8/20 октября 1881 г. с сообщением о редких металлах и периодическом законе на заседании химического отделения Русского физико-химического общества (РФХО), Менделеев отнюдь не опровергал эмпирически найденных Нильсоном и Петерсоном значений теплоемкости металлического бериллия (0,4084). Но выводы, которые сделали из своих опытов шведские химики, Менделеев отверг самым решительным образом. Методологическая основа менделеевских возражений заключалась в том, уже рассмотренном выше положении, что нельзя брать опытные данные, полученные для одного элемента, изолированно от соответствующих данных для других элементов, стоящих в закономерной связи с данным элементом. Шведские химики сочли атомную теплоемкость для бериллия при атомном весе 9,2 слишком заниженной 0,4084-9,2 3,8. Поэтому они и приняли Ве = = 13,8, чтобы получить желаемый результат 0,4084-13,8 = = 5,6. Между тем, как показал Менделеев, первое значение (3,8) вполне укладывалось в общий ряд элементов, расположенных согласно их периодической системе. В протоколе заседания сказано Затем Менделеев упомянул, что предлагаемое Нильсоном и Петерсоном возвращение к прежней формуле окиси бериллия ВегОз пе должно допустить, ибо атомная теплоемкость при переходе от к В и С через Ве должна быть именно такова, какою ее нашли эти исследователи. А уменьшение атомной теплоемкости с возрастанием нелетучести в ряде Ы (6,6), Ве (3,8), В (2,6), С (2,4) имеет тот же смысл, как и в ряде Ка (6,7), Mg (5,9), А1 (5,5), 81 (4,6). Еще менее допу- [c.19]
В протоколе заседания сказано Затем Менделеев упомянул, что предлагаемое Нильсоном и Петерсоном возвращение к прежней формуле окиси бериллия ВегОз пе должно допустить, ибо атомная теплоемкость при переходе от к В и С через Ве должна быть именно такова, какою ее нашли эти исследователи. А уменьшение атомной теплоемкости с возрастанием нелетучести в ряде Ы (6,6), Ве (3,8), В (2,6), С (2,4) имеет тот же смысл, как и в ряде Ка (6,7), Mg (5,9), А1 (5,5), 81 (4,6). Еще менее допу- [c.19]
I и II) [32, с. 191]. Окислам всех этих металлов ранее приписывался состав R0, а потому у всех у них получались заниженные значения атомных весов. Менделеев на основании периодического закона высказал предположение о том, что у них, кроме тория, атомный вес должен быть увеличен в полтора раза, а у тория — в два раза. Первоначально на карточках для химического пасьянса у всех этих металлов, как и у церия, не указывались их атомные веса. Однако при раскладывании пасьянса Менделеев начал указывать их значения для церитов Di = 95 и La=94 (ставя оба элемента рядом с Се=92) для иттрия Yt=61,6 (Попп —34 и 68, Бунзен —30,8, Делафонтен — 74) для тория Th=115,7 (ThO) и 230 (ТЮг) (Делафонтен — 230, Хидениус — 118) для эрбия Ег=56 (Бунзен) Ег 39,6/79,2. Все эти элементы вместе с индием, как не нашедшие еще своего места в системе, Менделеев вынес за ее пределы, приняв Yt = 60 , Ег=56 и Th=118 (см. первую книгу, фотокопии I и II). [c.87]
Все эти элементы вместе с индием, как не нашедшие еще своего места в системе, Менделеев вынес за ее пределы, приняв Yt = 60 , Ег=56 и Th=118 (см. первую книгу, фотокопии I и II). [c.87]
Браунер, сам чувствовавший национальное угнетение своего народа, остро реагировал на попытки некоторых шовинистически настроенных иностранцев умалить значение русского ученого — Менделеева — в истории открытия периодического закона. В декабре 1901 г., участвуя в работах XI съезда русских естествоиспытателей и врачей, Браунер говорил Вот уже более двадцати лет прошло с того времени, как я приступил к исследованию редких элементов, желая решить вопрос о положении их в периодической системе Менделеева. Поводом к этому послужило для меня прежде всего то обстоятельство, что знаменитую идею периодического закона выразил Дмитрий Иванович Менделеев, член нашей великой славянской семьи. Я видел, как эта великая идея оставалась без внимания, по всей вероятности, потому, что принадлежала русскому химику . О том, кто является действительным основателем периодической системы элементов, Браунер говорит Для меня и для каждого славянина — это Дмитрий Иванович Менделеев (ЖРФХО, 1902, т. XXXIV, отд. I, часть химич., стр. 142—143). [c.76]
О том, кто является действительным основателем периодической системы элементов, Браунер говорит Для меня и для каждого славянина — это Дмитрий Иванович Менделеев (ЖРФХО, 1902, т. XXXIV, отд. I, часть химич., стр. 142—143). [c.76]
Анализ разбивки элементов на группы по их изоморфизму, а также-группировка изоморфных тел по типу кристаллических систем имели большое-значение в деле подготовки открытия периодического закона в большинстве-случаев, как и в случае системы Грема (см. стр. 620 в основном томе), это были как раз те самые естественные группы элементов, которые в 1868— 1869 гг. Менделеев стал сопоставлять между собою сначала по значению их атомности, а начиная с 17 февраля 1869 г.—по величине атомных весов смежных членов попарно сопоставленных групп (см. ст. ф. 1 ст. 2 и др.). [Стр. 616) [c.558]
Относительная атомная масса – Энциклопедия MPLast
Относительная атомная масса – это масса атома, выраженная в атомных единицах массы (а. е. м.). Относительную атомную массу принято абозначать как Ar. Большинство природных химических элементов представляют собой смесь изотопов, поэтому за относительную атомную массу элемента принимают среднее значение относительной атомной массы природной смеси его изотопов с учетом их содержания в земных условиях. Именно эти значения и приведены в Периодической системе. Например, кислород имеет три изотопа 16О,17О и 18О, их атомные массы и содержание в природной смеси приведены в таблице 1.
е. м.). Относительную атомную массу принято абозначать как Ar. Большинство природных химических элементов представляют собой смесь изотопов, поэтому за относительную атомную массу элемента принимают среднее значение относительной атомной массы природной смеси его изотопов с учетом их содержания в земных условиях. Именно эти значения и приведены в Периодической системе. Например, кислород имеет три изотопа 16О,17О и 18О, их атомные массы и содержание в природной смеси приведены в таблице 1.
| Изотоп | Содержание в природной смеси, атомн., % ni | Атомная масса изотопа (а.е.м), Ar,i |
| 16О | 99,759 | 15,995 |
| 17О | 0,037 | 16,999 |
| 18О | 0,204 | 17,999 |
Среднее значение атомной массы с учетом вклада каждого изотопа вычисляется по следующей формуле:
Ar = Σ Ar,i × ni, где Ar,i – атомные массы соответствующих изотопов, ni – содержание их в природной смеси (в мольных долях).
Подставляя в эту формулу соответствующие значения из таблицы 1 для атомной массы кислорода, получаем:
Ar = 15,995×0,99759+ 16,999×0,00037 + 17,999×0,0024 = 15,999 а.е.м.
Обратите внимание, что атомная масса и массовое число – совершенно различные понятия: первое – масса атома в а.е.м., а второе – число нуклонов в ядре. Атомная масса – дробная величина (имеет целое значение только для изотопа 12С), в отличие от массового числа, которое всегда является целым.
Численно эти величины очень близки. Например, для водорода атомная масса равна 1,0078, а массовое число равно 1, для гелия атомная масса равна 4,0026, а массовое число – 4.
Относительные атомные массы имеют дробные значения по следующим причинам:
- Большинство элементов, существующих в природе, представляют смесь нескольких изотопов. И в Периодической системе указывается среднее значение относительной атомной массы смеси природного изотопного состава.

- Для моноизотопных элементов (например, 23Na) это значение будет также дробным, так как масса нуклонов, выраженная в а.е.м. не является целым числом (см. таблицу 1) и при образовании ядра часть массы нуклонов переходит в энергию, в соответствии с уравнением
Eсвязи = Δm×c2, где с = 3×108 м/с – скорость света в вакууме.
При образовании любой связи всегда выделяется энергия, на что расходуется часть массы связывающихся частиц. В случае образования химических связей эта величина очень мала, поэтому изменением массы здесь пренебрегают и считают, что масса образовавшейся частицы равна сумме масс частиц, участвующих в ее образовании. При образовании же ядра, выделяется очень большая энергия, и дефект массы хорошо заметен.
Автор: Ю. М. Коренев
Источник: Общая и неорганическая химия, Ю. М. Коренев, В. П. Овчаренко, 2000г
М. Коренев, В. П. Овчаренко, 2000г
Дата в источнике: 2000г
Почему атомная масса в таблице Менделеева имеет дробное значение. | Начала химии
В этой серии мы попробуем ответить на не самый очевидный вопрос, почему, если масса протона равна 1, масса нейтрона так же равна 1, то есть целому числу, то атомная масса, как сумма протонов и нейтронов, в таблице Менделеева почти всегда имеет дробное значение?
Исключительно дробные значения атомных масс.
Исключительно дробные значенияИсключительно дробные значения
Дело в том, что атомная масса в таблице Менделеева, – это среднее значение, вычисленное с учётом распространения в природе всех изотопов данного элемента.
! Изотопы – это разновидности атомов одного химического элемента, обладающие разной атомной массой.
Здесь нужно понимать, что, если изотопы – это атомы одного хим. элемента, это значит, что порядковый номер у данных атомов один, то есть, число протонов у них одинаковое, а значит, и число электронов у них так же равно. То есть, изотопы отличаются друг от друга только числом нейтронов:
То есть, изотопы отличаются друг от друга только числом нейтронов:
Различные изотопы лития
Как мы видим, существуют различные изотопы лития, содержащие в своём ядре от трёх до пяти нейтронов (способ подсчёта числа нейтронов рассматривался в предыдущей серии).
Попробуем рассчитать имеющееся в таблице Менделеева значение атомной массы на примере изотопов хлора:
Среднее значение атомной массы хлора, вычисленное с учётом содержания изотопов хлора в природеСреднее значение атомной массы хлора, вычисленное с учётом содержания изотопов хлора в природе
Известно, что примерно 75% содержащегося в природе хлора представлено изотопами хлора с атомной массой 35. Тогда как примерно 25 % хлора в природе имеет атомную массу равную 37.
То есть изотоп хлора 35 содержит в своём составе 35-17 = 18 нейтронов, а изотоп хлора 37 содержит в своём составе 37-17 = 20 нейтронов.
Рассчитаем примерное среднее значение относительной атомной массы хлора.
! Относительная томная масса химического элемента обозначается – Ar
Ar (Cl) = (35/100% * 75%) + (37/100 % * 25%) = 35,5
И действительно, атомная масса хлора в таблице Менделеева примерно равна найденному нами значению!
На этом наша третья серия подошла к концу. В следующем эпизоде мы узнаем, почему атомные массы в таблице Менделеева называются относительными.
Что означает PSHE? Бесплатный словарь
Обновленное руководство NICE усиливает передовой опыт и помогает школам проводить просвещение по вопросам алкоголя, соответствующее новой эре PSHE. Брюэр и Брэдли, учителя, которые работают над улучшением уроков для детей с ограниченными возможностями обучения в Великобритании, предлагают 101 классное занятие для обучения гражданственности, PSHE (личное, социальное и санитарное просвещение), а также религиозное образование для учащихся специального образования в возрасте от трех до 11 лет, чтобы показать, как поддерживать и мотивировать детей с особыми образовательными потребностями, развивать чувство принадлежности, развивать понимание работы как часть малого и большие группы, и развивать понимание неписаных правил поведения в более широком сообществе и понимание чувств и потребностей других. «Рассказывать детям об опасности шока от холодной воды, пока они учатся плавать или в рамках уроков PSHE, было бы простым способом повысить безопасность на воде». 50 PS Он был приговорен к девяти месяцам за решеткой, и теперь ему приказали выплатить PS35 , 650,84 в течение трех месяцев – или еще девять месяцев тюремного заключения. Меган Гайлс, учительница PSHE Габриэль Велла и Оливия Айлс Инициатива Primary Stars, поддерживаемая Премьер-лигой, предоставляет бесплатные учебные ресурсы для основных классов первого и второго уровней с привязкой к учебной программе для PE, PSHE, грамотность и школьный спорт.Джонатан Баггейли, исполнительный директор Ассоциации PSHE (Личное, социальное и медицинское просвещение), сказал: «Это исторический первый шаг и четкое заявление о намерениях правительства. На прошлой неделе я принял участие в дискуссии по личным, социальным и социальным вопросам. Медицинское образование (PSHE) .PSHE (личное, социальное, медицинское и экономическое образование) следует преподавать на регулярных уроках по расписанию в школе, чтобы все дети могли узнать о психическом здоровье.
«Рассказывать детям об опасности шока от холодной воды, пока они учатся плавать или в рамках уроков PSHE, было бы простым способом повысить безопасность на воде». 50 PS Он был приговорен к девяти месяцам за решеткой, и теперь ему приказали выплатить PS35 , 650,84 в течение трех месяцев – или еще девять месяцев тюремного заключения. Меган Гайлс, учительница PSHE Габриэль Велла и Оливия Айлс Инициатива Primary Stars, поддерживаемая Премьер-лигой, предоставляет бесплатные учебные ресурсы для основных классов первого и второго уровней с привязкой к учебной программе для PE, PSHE, грамотность и школьный спорт.Джонатан Баггейли, исполнительный директор Ассоциации PSHE (Личное, социальное и медицинское просвещение), сказал: «Это исторический первый шаг и четкое заявление о намерениях правительства. На прошлой неделе я принял участие в дискуссии по личным, социальным и социальным вопросам. Медицинское образование (PSHE) .PSHE (личное, социальное, медицинское и экономическое образование) следует преподавать на регулярных уроках по расписанию в школе, чтобы все дети могли узнать о психическом здоровье. социальное, медицинское и экономическое образование (PSHE) станет обязательным предметом.По заявлению LGA, если школы не проводят уроки плавания для своих учеников, они должны получать советы по безопасности в рамках личных, социальных, медицинских и экономических (PSHE) уроков. и обязательное экономическое (PSHE) образование в школах, R3 сказал, что есть возможность улучшить финансовое образование как часть этого.
социальное, медицинское и экономическое образование (PSHE) станет обязательным предметом.По заявлению LGA, если школы не проводят уроки плавания для своих учеников, они должны получать советы по безопасности в рамках личных, социальных, медицинских и экономических (PSHE) уроков. и обязательное экономическое (PSHE) образование в школах, R3 сказал, что есть возможность улучшить финансовое образование как часть этого.pshe – Перевод на арабский – примеры английский
Эти примеры могут содержать грубые слова, основанные на вашем поиске.
Эти примеры могут содержать разговорные слова, основанные на вашем поиске.
PSHE education способствует равенству, взаимопониманию и недискриминационному отношению в школах.
ويعزز هذا البرنامج المساواة والفهم والمواقف غير التمييزية في المدارس. Пакет освещает возможности PSHE и Гражданства и включает план урока по домашнему насилию, чтобы помочь учителям изучить проблему в классе.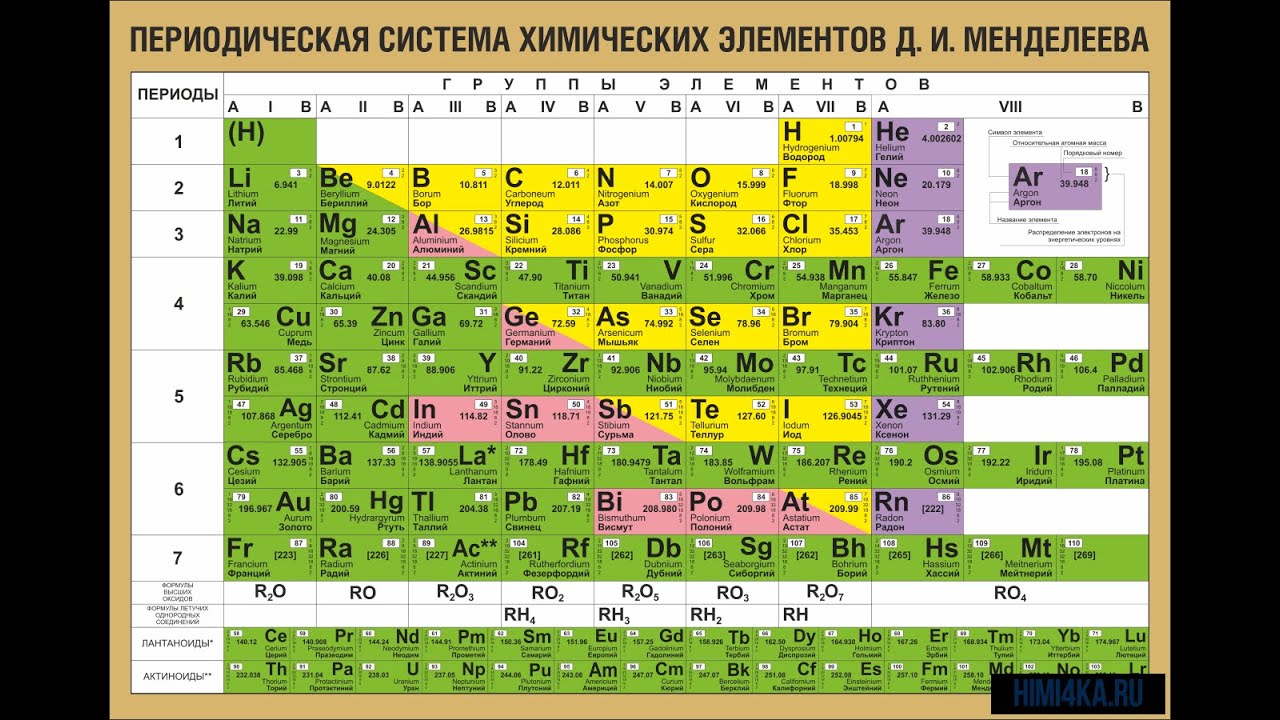
В школах Англии существует неустановленная законом программа личного, социального и медицинского просвещения ( PSHE ), которая способствует равенству, пониманию и недискриминационному отношению (см. Статью 10).
وهناك برنامج ير نظامي للتربية الشخصية والاجتماعية والصحية ي المدارس في انكلترا الارس ي انكلترا الالالالالة التربية الالالة التربية الالالة التربية Личное, социальное, медицинское и экономическое образование ( PSHE ) – это запланированная программа возможностей обучения и получения опыта, которая помогает детям и молодым людям расти и развиваться как личности, как члены семей и социальных и экономических сообществ.
PSHE – это запланированная программа возможностей обучения и получения опыта, посвященная реальным жизненным проблемам, с которыми дети и молодые люди сталкиваются по мере взросления.
وهو برنامج مصمم لإتاحة رص التعلُّم واكتساب الخبرات التي تناول قضايا الحياة الحقيقة اليا الحياة الحقيقة اليا الحياة الحقيقة اليا الحياة الحقيقة اليا الحياة الحقيقة اليا الحياة الحقيقة اليا التالالاليالالتالالات التيال اللحياة الحقيقة اليا التالالالتالال التي Управление квалификаций и учебных программ (QCA) в настоящее время проводит обзор национальной учебной программы для ключевых этапов 3 и 4 (возраст 11–16 лет). При пересмотре средней учебной программы пересматриваются все второстепенные предметы, включая личное, социальное и медицинское образование ( PSHE ).
При пересмотре средней учебной программы пересматриваются все второстепенные предметы, включая личное, социальное и медицинское образование ( PSHE ).
В Англии PSHE образование предоставляется на нестандартной основе.
PSA – Соглашение об общественных услугах PSHE – Персональное, социальное и санитарное просвещение
Правительство объявило о своем намерении сделать PSHE для образовательных учреждений обязательным в октябре 2008 года, и в настоящее время правительство проводит полные общественные консультации, которые завершатся 24 июля 2009 года, по принципам и законодательным изменениям, которые будут связаны с введением PSHE для образовательных учреждений.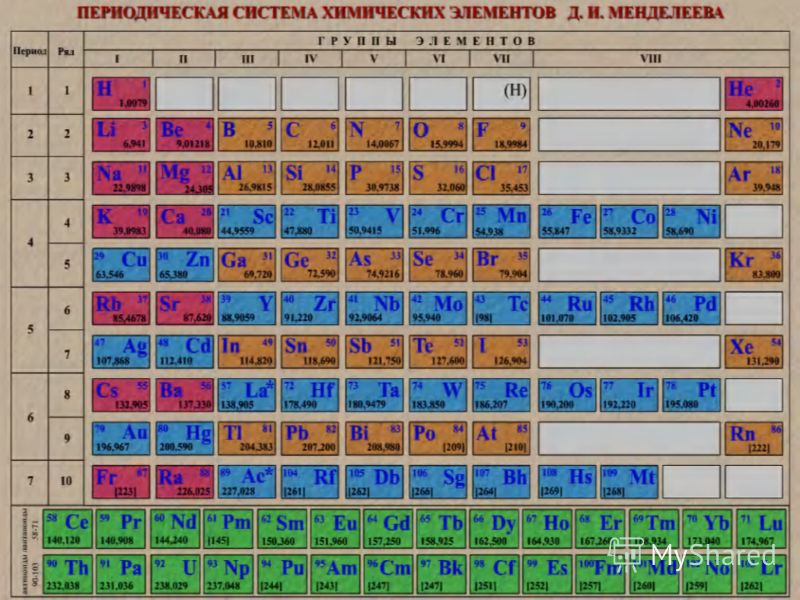 установленный законом.
установленный законом.
Гражданское образование является обязательной частью национальной учебной программы в средних школах с 2002 года; а в начальных школах гражданство является частью совместных неуставных рамок гражданства и PSHE , введенных в 2000 г.
PSHE Значение в школе – Что означает PSHE в школе? Определение PSHE
Значение для PSHE – это личное, социальное и медицинское образование, а другие значения расположены внизу, которые имеют место в школьной терминологии, а PSHE имеет 6 различных значений.Все значения, которые принадлежат аббревиатуре PSHE, используются только в терминологии Школы, другие значения не встречаются. Если вы хотите увидеть другие значения, щелкните ссылку «PSHE». Таким образом, вы будете перенаправлены на страницу, где указаны все значения PSHE.
Если внизу не указано 6 различных значений аббревиатуры PSHE, выполните поиск еще раз, введя такие структуры вопросов, как «что означает PSHE в школе, значение PSHE в школе». Кроме того, вы можете выполнить поиск, набрав PSHE в поле поиска, которое находится на нашем веб-сайте.
Значение астрологических запросов
PSHE Значение в школе
- Личное, социальное и медицинское образование
- Личное социальное и медицинское образование
- Личное, социальное и медицинское образование
- Личное социальное здоровье и экономическое
- Личное социальное здоровье Экономическое
- Личное социальное здоровье и экономика
Пожалуйста, найдите значение PSHE для школы в других источниках.
Что означает PSHE для школы?
Скомпилированы запросы аббревиатуры PSHE в School в поисковых системах.Были выбраны и размещены на сайте наиболее часто задаваемые вопросы по аббревиатуре PSHE для школы.
Мы думали, что вы задали аналогичный вопрос PSHE (для школы) поисковой системе, чтобы найти значение полной формы PSHE в школе, и мы уверены, что следующий список запросов PSHE школы привлечет ваше внимание.
Что означает PSHE для школы?
PSHE означает «Личное социальное здоровье и экономика».Что означает аббревиатура PSHE в школе?
Аббревиатура PSHE означает «Личное, социальное и медицинское образование» в школе.Что такое определение PSHE?
Определение PSHE – «Личное социальное и медицинское просвещение».Что означает PSHE в школе?
PSHE означает «Персональное социальное и медицинское просвещение» для школы.Что такое аббревиатура ПШЭ?
Аббревиатура PSHE – «Личное, социальное и медицинское образование».Что такое стенография личного, социального и медицинского просвещения?
Сокращение «Личное, социальное и медицинское образование» – PSHE.Каково определение аббревиатуры PSHE в школе?
Определения стенографического термина PSHE: «Личное, социальное и медицинское просвещение».
Какова полная форма аббревиатуры PSHE?
Полная форма аббревиатуры PSHE – «Personal Social Health and Economic».Каково полное значение PSHE в школе?
Полное значение PSHE – «Личное социальное и медицинское просвещение».Какое объяснение PSHE в школе?
Пояснение к PSHE – «Личное социальное здоровье и экономика».
Что означает аббревиатура PSHE в астрологии?
Сайт не только включает значения аббревиатуры PSHE в школе. Да, мы знаем, что ваша основная цель – объяснение аббревиатуры PSHE в школе. Однако мы подумали, что помимо значения определений PSHE в школе, вы можете рассмотреть астрологическую информацию аббревиатуры PSHE в астрологии. Поэтому также включено астрологическое объяснение каждого слова в каждой аббревиатуре PSHE.
PSHE Аббревиатура в астрологии
- PSHE (буква P)
Вы очень серьезно относитесь к социальным приличиям.Вы бы не подумали о том, чтобы сделать что-либо, что может навредить вашему имиджу или репутации.
 Внешность имеет значение, поэтому вам нужен красивый партнер. Вам также нужен умный партнер. Как ни странно, вы можете рассматривать своего партнера как своего врага; Хороший бой стимулирует эти сексуальные флюиды. Вы относительно свободны от сексуальных привязанностей. Вы готовы экспериментировать и пробовать новые способы ведения дел. Вы очень общительны и чувственны; вы любите флирт и нуждаетесь в большом физическом удовлетворении.
Внешность имеет значение, поэтому вам нужен красивый партнер. Вам также нужен умный партнер. Как ни странно, вы можете рассматривать своего партнера как своего врага; Хороший бой стимулирует эти сексуальные флюиды. Вы относительно свободны от сексуальных привязанностей. Вы готовы экспериментировать и пробовать новые способы ведения дел. Вы очень общительны и чувственны; вы любите флирт и нуждаетесь в большом физическом удовлетворении. - PSHE (буква S)
Вы скрытны, замкнуты и застенчивы.Вы очень сексуальны, чувственны и страстны, но не допускаете этого. Только в интимном уединении эта часть вашей натуры раскроется. Когда дело доходит до мелочей, вы эксперт. Вы знаете все тонкости торговли, можете сыграть любую роль или любую игру и очень серьезно относитесь к своей личной жизни. Не валяйте дурака. У вас хватит терпения дождаться подходящего человека.
- PSHE (буква H)
Вы ищете партнера, который может улучшить вашу репутацию и возможности заработка.Вы будете очень щедры по отношению к своему возлюбленному, как только возьмете на себя обязательство. На самом деле ваши подарки – это инвестиция в вашего партнера. Однако до принятия обязательства вы, как правило, экономны в своих привычках к тратам и свиданиям и столь же осторожны в своей сексуальной активности. Вы чувственный и терпеливый любовник.
- PSHE (буква E)
Ваша самая большая потребность – поговорить. Если ваш партнер не умеет слушать, у вас проблемы с общением. Человек должен быть интеллектуально стимулирующим, иначе вы не заинтересованы в сексе.Вам нужен друг для любовника и компаньон для соседа по постели. Вы ненавидите дисгармонию и разлад, но время от времени вы наслаждаетесь хорошими аргументами, которые, кажется, все встряхивают. Вы много флиртуете, потому что вызов для вас важнее полового акта, но когда вы отдаете свое сердце, вы проявляете бескомпромиссную лояльность. Когда у вас нет хорошего любовника, с которым можно заснуть, вы заснете с хорошей книгой.
PSHE, Взаимоотношения, половое и медицинское образование (RSHE) и благополучие
В этом разделе вы найдете информацию, относящуюся к учебной программе.
Эти документы представляют собой основу учебной программы для школьных руководителей и руководителей учебных программ по обеспечению PSHE и благополучия, образования, которое актуально и необходимо для сегодняшних учащихся в 21 веке.
PSHE, включая RSHE, – это запланированная программа обучения, посредством которой дети и молодые люди приобретают знания, понимание и навыки, необходимые им для управления своей жизнью. В рамках общешкольного подхода PSHE развивает качества и атрибуты, необходимые ученикам для развития как отдельных лиц, членов семьи и членов общества.
PSHE способствует их безопасности и личному развитию, помогая детям и молодым людям развивать свою индивидуальность, уверенность и чувство собственного достоинства, делать выбор карьеры и понимать, что влияет на их решения, в том числе финансовые. Развитие самопонимания, сочувствия и способности работать с другими поможет молодым людям наслаждаться здоровыми и продуктивными отношениями во всех аспектах их жизни.
Структура поддерживает школы в выполнении установленных законом обязательств по поддержке благополучия учеников и полностью соответствует концепции Ofsted, а также темам национальной учебной программы – личное развитие, здоровье и безопасность, эмоциональное благополучие и психическое здоровье, борьба с издевательствами, поведение и благополучие , Гражданство, британские ценности и социальное, моральное, духовное и культурное образование (SMSC, включая включение и равенство).Учебные планы основаны на программах обучения Ассоциации PSHE, и их реализация способствует получению вашей школой награды Healthy Schools London.
Рамки учебной программы направлены на развитие навыков и атрибутов, таких как устойчивость, самооценка, управление рисками, работа в команде и критическое мышление в контексте обучения, сгруппированных по трем основным темам: здоровье и благополучие, отношения и жизнь в более широком мире (включая экономическое благополучие и аспекты профессионального образования).
PSHE education – это школьный предмет, с помощью которого ученики развивают знания, навыки и атрибуты, необходимые им для сохранения здоровья и безопасности, а также для подготовки к жизни и работе в современной Великобритании. Факты показывают, что хорошо реализованные программы PSHE влияют как на академические, так и на неакадемические результаты учащихся, особенно наиболее уязвимых и обездоленных (Ассоциация PSHE).
Новое: структура учебной программы и ресурсы
| Взаимоотношения, половое и медицинское просвещение (RSHE) и благополучие | |
|---|---|
| Лидерство и менеджмент | DfE RSE и Руководство по санитарному просвещению, 2019 г. (pdf, 577кб) Дорожная карта для Stautory RSE (pdf, 778kb) Аудит всей школы (pdf, 216кб) Мониторинг, оценка и оценка ВИЭ (pdf, 202кб) Взаимоотношения, секс и санитарное просвещение (RSHE) как часть PSHE & Wellbeing Education для вашей информации: Часто задаваемые вопросы DfE Образование взаимоотношений, взаимоотношений и половое воспитание (RSE) и санитарное просвещение Руководства DfE для родителей (на нескольких языках) Письмо в NAHT от Дэмиана Хиндса Ofsted и RSE Форум полового воспитания Участие родителей Политика в области образования для родителей Руководство ассоциации PSHE по поддержке участия родителей в начальных и средних школах Запущено руководство по учебной программе, включающей ЛГБТ, для начальных школ Великобритании https: // www.stonewall.org.uk/about-us/news/lgbt-inclusive-curriculum-guide-launched-uk-primary-schools Обучение по заказу DfE для школ Обучение RSHE от East London & Newham RSHE Partnership (pdf, 244кб) Служба общественного здравоохранения Совета Саутварка по поддержке сексуального здоровья Молодежная служба Саутварка по сексуальному здоровью, контрацепции, наркотикам и алкоголю – HYP (pdf, 346кб) |
| Обучение согласию | Все инструкции в этом разделе подготовлены Ассоциацией PSHE. Consent_FAQs (pdf, 343кб) Consent_SoW (pdf, 1,3 МБ) Consent_supplementaryguidance (pdf, 462кб) Закон_Согласие (pdf, 307кб) |
| РСГЭ в XXI веке | DfE (2014) SRE в 21 веке (pdf, 271kb) |
| Совместный брифинг по | Ассоциация PSHE и Ассоциация естественнонаучного образования (март 2016 г.) Совместный брифинг по человеческому развитию и репродукции в начальной учебной программе (, 481кб) |
PSHE Определение: личное, социальное и медицинское образование
Что означает PSHE? PSHE означает личное, социальное и медицинское образование.Если вы посещаете нашу неанглийскую версию и хотите увидеть английскую версию личного, социального и медицинского просвещения, прокрутите вниз, и вы увидите значение персонального, социального и медицинского просвещения на английском языке. Имейте в виду, что аббревиатура PSHE широко используется в таких отраслях, как банковское дело, вычислительная техника, образование, финансы, правительство и здравоохранение. Помимо PSHE, Personal, Social and Health Education может быть сокращением от других аббревиатур.
PSHE = Личное, социальное и медицинское образование
Ищете общее определение PSHE? PSHE означает личное, социальное и медицинское образование.Мы с гордостью вносим аббревиатуру PSHE в самую большую базу сокращений и сокращений. На следующем изображении показано одно из определений PSHE на английском языке: Personal, Social and Health Education. Вы можете скачать файл изображения для печати или отправить его своим друзьям по электронной почте, Facebook, Twitter или TikTok.Значения PSHE в английском
Как упоминалось выше, PSHE используется как аббревиатура в текстовых сообщениях для обозначения личного, социального и санитарного просвещения. Эта страница посвящена аббревиатуре PSHE и его значениям как личному, социальному и санитарному просвещению.Обратите внимание, что личное, социальное и санитарное просвещение – не единственное значение PSHE. Может быть несколько определений PSHE, поэтому просмотрите их в нашем словаре, чтобы узнать все значения PSHE один за другим.Определение на английском языке: Personal, Social and Health Education
Другие значения PSHE
Помимо личного, социального и медицинского просвещения, PSHE имеет и другие значения. Они перечислены слева внизу. Прокрутите вниз и щелкните, чтобы увидеть каждый из них. Чтобы увидеть все значения PSHE, нажмите «Подробнее».Если вы посещаете нашу английскую версию и хотите увидеть определения личного, социального и медицинского просвещения на других языках, щелкните языковое меню в правом нижнем углу. Вы увидите значения личного, социального и медицинского просвещения на многих других языках, таких как арабский, датский, голландский, хинди, японский, корейский, греческий, итальянский, вьетнамский и т. Д.Начальная школа и детский сад Святой Елены
Пожалуйста, найдите время, чтобы прочитать, как и чему учат. Мы будем признательны за ваше мнение о предлагаемой учебной программе.
Что такое PSHE?
«Личное, социальное, медицинское и экономическое (PSHE) образование является важной и необходимой частью образования всех учеников».
(Национальная учебная программа DfE)
Как это соответствует целям нашей школы ?
Различные темы в PSHE исследуют концепции, в которые верит Сент-Хелен, например, когда мы узнаем о сообществе, мы помогаем ученикам принять культуру и разнообразие в нашей школе.Когда мы говорим о реальных жизненных проблемах, таких как здоровье и рост, мы можем узнать о вещах, которые имеют реальное значение для детей. PSHE призван подготовить детей ко многим сферам жизни и обеспечить нашим детям все необходимое для достижения успеха и процветания в жизни.
В PSHE есть RSE: отношения и половое воспитание. Наша политика гласит, что следующие цели:
‘… , что наш подход к ВИЭ помогает дать ученикам знания, навыки и понимание, которые им необходимы, чтобы вести уверенный, здоровый, независимый образ жизни, чтобы стать информированными, активными и ответственными гражданами. .Работа, которую мы выполняем в этой области, четко преподается и входит в нашу учебную программу PSHE. Он также проходит через все другие области учебной программы и регулярно является областью обучения, поскольку дети обсуждают свой путь в школе – в их отношениях с другими, их терпимости и понимании различий, их развивающейся осведомленности о себе и о том, как они вписываются в более широкую местную жизнь. глобальное сообщество »
ASSET Education, Политика в области ВИЭ.
Какие темы мы преподаем и как?
На изображении ниже вы можете увидеть обзор того, чему и когда можно научить.Несмотря на то, что это наш путеводитель в St Helen’s, если конкретная книга или тема из другого урока помогает продемонстрировать, что идея PSHE может эффективно преподаваться в рамках других предметов, а не в конкретное время, указанное ниже.
Многие PSHE могут быть основаны на обсуждениях / ораторах с помощью таких идей, как круговое время, но многие концепции можно изучить с помощью других средств, таких как:
Деньги: через математику
Половое созревание: через науку
Эмоциональные изменения: через искусство
Безопасность: с помощью вычислений.
Политику RSE можно прочитать здесь:
PSHE и RSE – Tangmere Academy
PSHE – это личное, социальное, медицинское и экономическое образование, а RSE – это отношения и половое воспитание.
В TPA мы преподаем многие аспекты PSHE в течение нескольких лет – некоторые дискретно, а некоторые связаны с нашими темами и ключевыми текстами. Правительство сделало PSHE обязательным предметом в сентябре 2020 года, что означает, что школы должны преподавать его и изложить рекомендации относительно того, что ученики должны знать к концу своего времени в начальной и средней школе.Правительственное руководство можно найти, щелкнув по этой ссылке. Мы воспользовались этой возможностью, чтобы ознакомиться с нашим предложением PSHE.
Наш подход к построению учебной программы PSHE
Мы являемся частью проекта с Советом графства Западный Суссекс, который называется «Образование в интересах безопасности» (E4S). По сути, PSHE представляет собой учебную программу, которая помогает детям понять мир, в котором они растут, обучая их тому, как обезопасить себя во всех сферах их мира, и дает каждому ребенку шанс на будущее.
Учебный план E4S основан на 4 ключевых краеугольных камнях:
Отношения и санитарное просвещение
Цифровая и медиаграмотность
Физическое здоровье и благополучие
Эмоциональное здоровье и благополучие
В мае и июне 2021 года мы провели тщательные консультации с персоналом, родителями, губернаторами и детьми. Результаты этой консультации опубликованы в правой части страницы.После консультации мы использовали инструменты E4S для создания индивидуальной учебной программы, основанной на потребностях наших детей. После этого мы искали связи с другими областями учебной программы и определили возможности, в которых содержание можно было бы преподавать с помощью наших основных текстов, позволяя детям дистанцироваться от обучения и обеспечивать контекст для обсуждения. PSHE / E4S также преподается отдельно по предмету, который дети будут знать как граждане TTB. Письмо и сопровождающее видео объяснение процесса консультации можно найти на панели документов в правой части страницы.
Мы будем пересматривать наши консультации ежегодно и соответственно обновлять нашу учебную программу, чтобы она продолжала соответствовать потребностям детей.
Дополнительную информацию о нашем подходе к PSHE, включая наш подход к отношениям и половому воспитанию (RSE) в TPA, можно найти в политике, которая находится на панели документов в правой части страницы.


 Мы будем принимать лучших представителей ПОО из городов — Кемерово, Новокузнецк, Белово.
Мы будем принимать лучших представителей ПОО из городов — Кемерово, Новокузнецк, Белово.
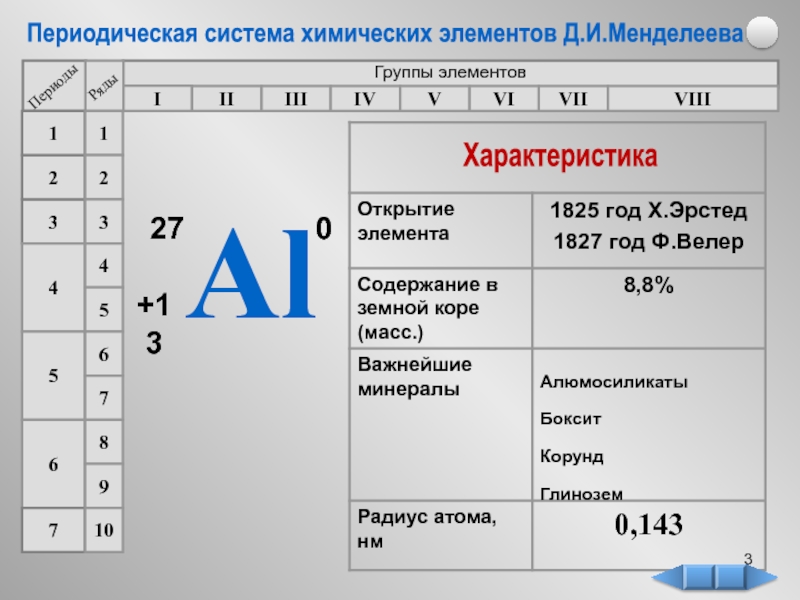

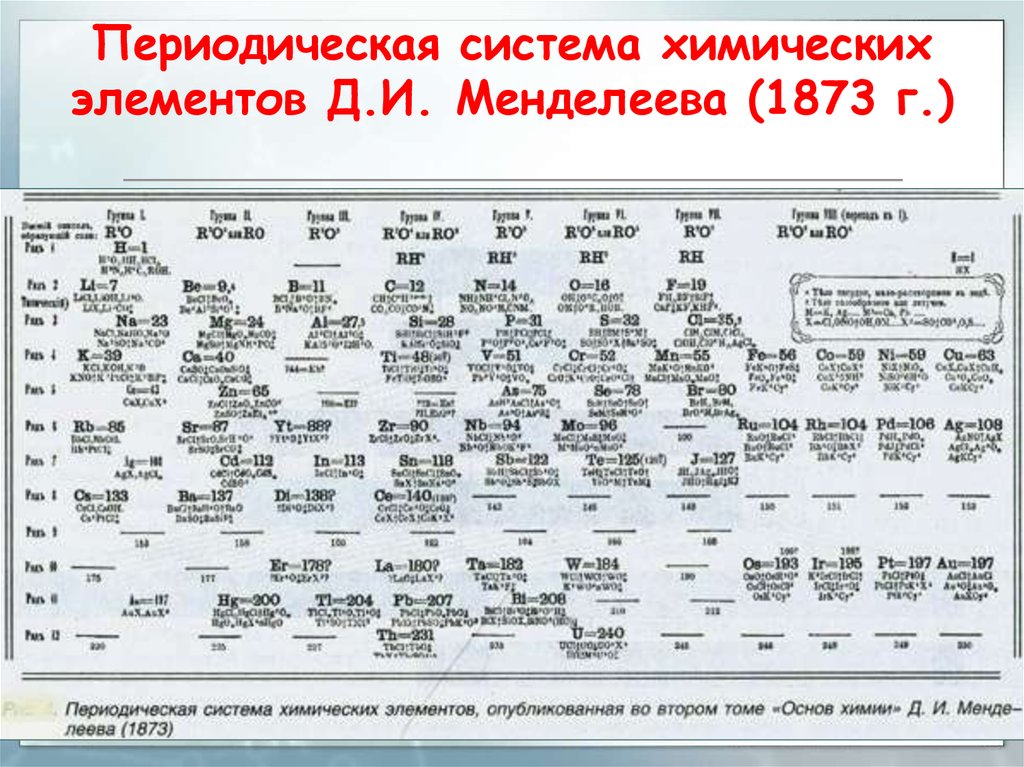
 Внешность имеет значение, поэтому вам нужен красивый партнер. Вам также нужен умный партнер. Как ни странно, вы можете рассматривать своего партнера как своего врага; Хороший бой стимулирует эти сексуальные флюиды. Вы относительно свободны от сексуальных привязанностей. Вы готовы экспериментировать и пробовать новые способы ведения дел. Вы очень общительны и чувственны; вы любите флирт и нуждаетесь в большом физическом удовлетворении.
Внешность имеет значение, поэтому вам нужен красивый партнер. Вам также нужен умный партнер. Как ни странно, вы можете рассматривать своего партнера как своего врага; Хороший бой стимулирует эти сексуальные флюиды. Вы относительно свободны от сексуальных привязанностей. Вы готовы экспериментировать и пробовать новые способы ведения дел. Вы очень общительны и чувственны; вы любите флирт и нуждаетесь в большом физическом удовлетворении.