Значение и развитие периодического закона — урок. Химия, 8–9 класс.
Значение периодического закона
Открытие периодического закона и создание Периодической таблицы химических элементов имеет огромное значение для развития науки.
Периодический закон:
- систематизировал и обобщил все сведения о химических элементах и их соединениях, объединил их в единое целое;
- объяснил разные виды периодичности в изменении свойств элементов и образованных ими простых и сложных веществ;
- позволил предсказывать существование неоткрытых химических элементов и прогнозировать их свойства;
- послужил базой для изучения строения ядра атома и электронных оболочек.
Сам Дмитрий Иванович Менделеев, предвидя развитие науки, писал: «Периодическому закону будущее не грозит разрушением, а только надстройка и развитие обещаются».
Развитие периодического закона
Во времена Д. И. Менделеева основным свойством атомов химических элементов считалась атомная масса. Периодический закон в формулировке Д. И Менделеева звучит так:
Периодический закон в формулировке Д. И Менделеева звучит так:
Свойства элементов, а также состав и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величин их атомных масс.
Позже было изучено строение атома, и стало ясно, что основной характеристикой атома химического элемента является не величина его атомной массы, а величина положительного заряда ядра. Периодический закон стали формулировать иначе. Современная формулировка выглядит следующим образом:Свойства химических элементов и образуемых ими веществ находятся в периодической зависимости от величин зарядов ядер их атомов.
Заряды ядер атомов элементов, расположенных в ряд, возрастают непрерывно. Объяснить причины периодичности учёные смогли тогда, когда изучили строение электронных оболочек атомов.Причиной периодического изменения свойств химических элементов и образуемых ими веществ является периодически повторяющееся строение наружных энергетических уровней электронных оболочек атомов.
история открытия, интересные факты и байки – Москва 24, 24.10.2012
Фото: ИТАР-ТАСС
Открытие таблицы периодических химических элементов стало одной из важных вех в истории развития химии как науки. Первооткрывателем таблицы стал российский ученый Дмитрий Менделеев. Неординарный ученый с широчайшим научным кругозором сумел объединить все представления о природе химических элементов в единую стройную концепцию.
Об истории открытия таблицы периодических элементов, интересных фактах, связанных с открытием новых элементов, и народных байках, которые окружали Менделеева и созданную им таблицу химических элементов, М24.RU расскажет в этой статье.
История открытия таблицы
К середине XIX века было открыто 63 химических элемента, и ученые всего мира не раз предпринимали попытки объединить все существовавшие элементы в единую концепцию. Элементы предлагали разместить в порядке возрастания атомной массы и разбить на группы по сходству химических свойств.
В 1863 году свою теорию предложил химик и музыкант Джон Александр Ньюленд, который предложил схему размещения химических элементов, схожую с той, что открыл Менделеев, но работа ученого не была принята всерьез научным сообществом из-за того, что автор увлекся поисками гармонии и связью музыки с химией.
В 1869 году Менделеев опубликовал свою схему периодической таблицы в журнале Русского химического общества и разослал извещение об открытии ведущим ученым мира. В дальнейшем химик не раз дорабатывал и улучшал схему, пока она не приобрела привычный вид.
Суть открытия Менделеева в том, что с ростом атомной массы химические свойства элементов меняются не монотонно, а периодически. После определенного количества разных по свойствам элементов, свойства начинают повторяться. Так, калий похож на натрий, фтор – на хлор, а золото схоже с серебром и медью.
В 1871 году Менделеев окончательно объединил идеи в периодический закон. Ученые предсказал открытие нескольких новых химических элементов и описал их химические свойства.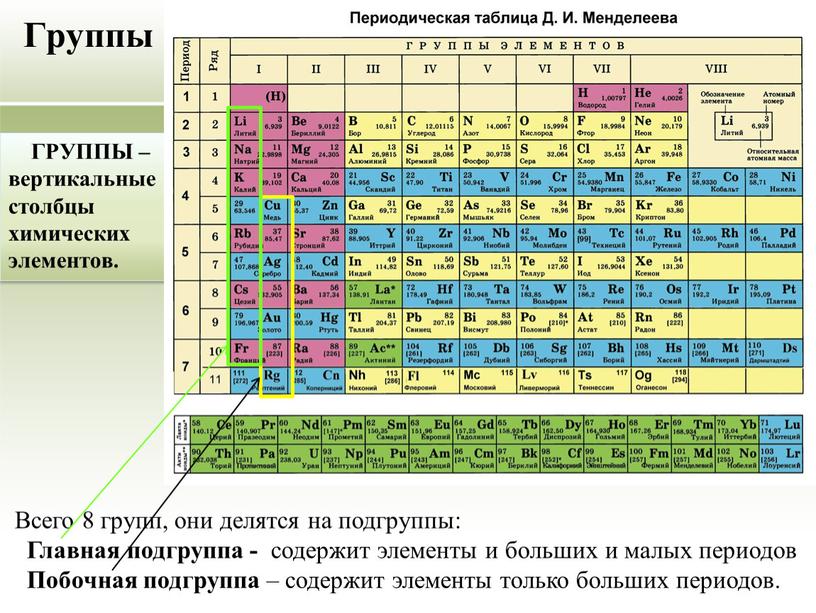 В дальнейшем расчеты химика полностью подтвердились – галлий, скандий и германий полностью соответствовали тем свойствам, которые им приписал Менделеев.
В дальнейшем расчеты химика полностью подтвердились – галлий, скандий и германий полностью соответствовали тем свойствам, которые им приписал Менделеев.
Байки о Менделееве
Гравюра, на которой изображен Менделеев. Фото: ИТАР-ТАСС
Об известном ученом и его открытиях ходило немало баек. Люди в то время слабо представляли себе химию и считали, что занятия химией – это что-то вроде поедания супа из младенцев и воровства в промышленных масштабах. Поэтому деятельность Менделеева быстро обросла массой слухов и легенд.
Одна из легенд гласит, что Менделеев открыл таблицу химических элементов во сне. Случай не единственный, точно также говорил о своем открытии Август Кекуле, которому приснилась формула бензольного кольца. Однако Менделеев только смеялся над критиками. “Я над ней, может быть, двадцать лет думал, а вы говорите: сидел и вдруг … готово!”, – как-то сказал ученый о своем открытии.
Другая байка приписывает Менделееву открытие водки. В 1865 году великий ученый защитил диссертацию на тему “Рассуждение о соединении спирта с водою”, и это сразу дало повод для новой легенды.
Посмеивались и над образом жизни ученого, а особенно над тем, что Менделеев оборудовал свою лабораторию в дупле огромного дуба.
Также современники подтрунивали над страстью Менделеева к чемоданам. Ученый в пору своего невольного бездействия в Симферополе вынужден был коротать время за плетением чемоданов. В дальнейшем он самостоятельно мастерил для нужд лаборатории картонные контейнеры. Несмотря на явно “любительский” характер этого увлечения, Менделеева часто называли “чемоданных дел мастером”.
Открытие радия
Одна из наиболее трагичных и в то же время известных страниц в истории химии и появления новых элементов в таблице Менделеева связана с открытием радия. Новый химический элемент был открыт супругами Марией и Пьером Кюри, которые обнаружили, что отходы, остающиеся после выделения урана из урановой руды, более радиоактивны, чем чистый уран.
Поскольку о том, что такое радиоактивность, тогда еще никто не знал, то новому элементу молва быстро приписала целебные свойства и способность излечивать чуть ли не от всех известных науке болезней. Радий включили в состав пищевых продуктов, зубной пасты, кремов для лица. Богачи носили часы, циферблат которых был окрашен краской, содержащей радий. Радиоактивный элемент рекомендовали как средство для улучшения потенции и снятия стресса.
Подобное “производство” продолжалось целых двадцать лет – до 30-х годов двадцатого века, когда ученые открыли истинные свойства радиоактивности и выяснили насколько губительно влияние радиации на человеческий организм.
Мария Кюри умерла в 1934 году от лучевой болезни, вызванной долговременным воздействием радия на организм.
Небулий и короний
Фото: ИТАР-ТАСС
Таблица Менделеева не только упорядочила химические элементы в единую стройную систему, но и позволила предсказать многие открытия новых элементов. В то же время некоторые химические “элементы” были признаны несуществующими на основании того, что они не укладывались в концепцию периодического закона.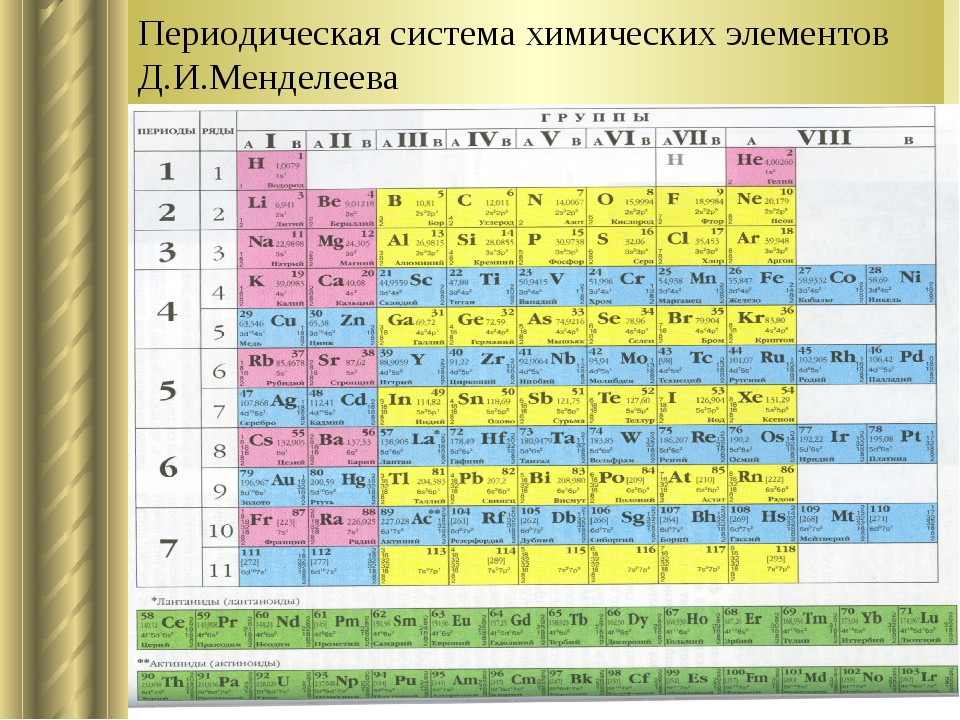 Наиболее известна история с “открытием” новых элементов небулия и корония.
Наиболее известна история с “открытием” новых элементов небулия и корония.
При исследовании солнечной атмосферы астрономы обнаружили спектральные линии, которые им не удалось отождествить ни с одним из известных на земле химических элементов. Ученые предположили, что эти линии принадлежат новому элементу, который получил название короний (потому что линии были обнаружены при исследовании “короны” Солнца – внешнего слоя атмосферы звезды).
Спустя несколько лет астрономы сделали еще одно открытие, изучая спектры газовых туманностей. Обнаруженные линии, которые снова не удалось отождествить ни с чем земным, приписали другому химическому элементу – небулию.
Открытия подверглись критике, поскольку в периодической таблице Менделеева уже не оставалось места для элементов, обладающих свойствами небулия и корония. После проверки обнаружилось, что небулий является обычным земным кислородом, а короний – сильно ионизированное железо.

Материал создан на основе информации из открытых источников. Подготовил Василий Макагонов @vmakagonov
Периодическая таблица Менделеева – главная тема Всероссийского Фестиваля NAUKA 0+ в 2019 году
Периодическая таблица химических элементов станет главной темой Всероссийского фестиваля NAUKA 0+ в 2019 году. Генеральная ассамблея ООН объявила 2019 год Международным годом Периодической таблицы химических элементов. Это событие мирового масштаба будет посвящено 150-летию открытия Периодического закона химических элементов великим русским ученым Дмитрием Ивановичем Менделеевым.
Достижение Д.И. Менделеева имеет фундаментальное значение для развития многих естественных наук: химии, физики, биологии, медицины, астрономии, геологии. Значимость Периодической таблицы химических элементов подтверждается и сегодня. Современные российские и зарубежные ученые продолжают открывать и создавать новые химические элементы, свойства которых были во многом предсказаны Д. И. Менделеевым еще 150 лет назад.
И. Менделеевым еще 150 лет назад.
В целях всемирного признания заслуг гениального русского ученого Д.И. Менделеева и в рамках поддержки Международного года Периодической таблицы химических элементов, Всероссийский фестиваль NAUKA 0+ в 2019 году будет посвящен Периодической таблице.
Такое решение было принято по итогам заседания Оргкомитета Фестиваля NAUKA 0+, прошедшего 26 декабря 2018 года в Минобрнауки РФ. В заседании приняли участие министр науки и высшего образования РФ Михаил Котюков, ректор МГУ имени М.В.Ломоносова академик Виктор Садовничий, статс-секретарь – заместитель министра просвещения РФ Павел Зенькович, министр Правительства Москвы – руководитель Департамента образования и науки города Москвы Исаак Калина, первый заместитель министра науки и высшего образования РФ академик Григорий Трубников, вице-президент РАН академик Алексей Хохлов, ведущие российские ученые, представители министерств и ведомств РФ, ректоры вузов, руководители регионов, научных организаций, институтов развития и промышленных компаний.
В своем выступлении Михаил Котюков отметил: «За последние годы Фестиваль науки стал визитной карточкой популяризации российской науки и образования. Этот проект имеет успешную 13-летнюю историю и прекрасно вписывается в решение национальных задач по развитию науки и образования. Сегодня мы заинтересованы в том, чтобы повышать открытость науки, работать над ее популяризацией, поддерживать молодых талантливых исследователей. В 2019 году главной темой Фестиваля науки станет Периодическая таблица Менделеева. Это будет созвучно празднованию в 2019 году Международного года Периодической таблицы химических элементов, объявленного резолюцией ООН».
Ректор МГУ Виктор Садовничий подчеркнул: «Всероссийский Фестиваль науки имеет богатую историю и значительные достижения. Вот уже 13 лет этот праздник науки торжествует по всей стране – Москве и региональным площадкам. Флагманом Фестиваля науки в 2019 году станет тема Периодической таблицы химических элементов – великого достижения русского ученого Д. И. Менделеева. Подготовка к Фестивалю уже идет полным ходом: формируется программа, приглашаются ученые и эксперты. И мы уверены, что в очередной раз Фестиваль науки подтвердит статус уникального научно-популярного проекта России».
И. Менделеева. Подготовка к Фестивалю уже идет полным ходом: формируется программа, приглашаются ученые и эксперты. И мы уверены, что в очередной раз Фестиваль науки подтвердит статус уникального научно-популярного проекта России».
Также в рамках заседания было принято решение о присвоении статуса центральных региональных площадок Фестиваля науки в 2019 году Тверской, Курской, Новосибирской, Ростовской, Нижегородской областям, а также Забайкальскому и Красноярскому краю.
Программа Всероссийского фестиваля науки NAUKA 0+ включает в себя более 5 тысяч уникальных мероприятий, рассчитанных на самую широкую аудиторию без возрастных ограничений. Наиболее значимые из мероприятий – лекции молодых учёных, лауреатов государственной премий РФ, Нобелевских лауреатов, увлекательные дискуссии, показ познавательных фильмов, крупнейшая интерактивная научно-популярная выставка, телемосты с МКС и ЦЕРН, Арктической полярной станцией и многое другое.
Первый в России Фестиваль наук был проведен в МГУ имени М. В.Ломоносова в 2006 году по инициативе ректора МГУ Виктора Садовничего. За три дня мероприятие посетили более 20 000 человек. Успех первого отечественного Фестиваля науки, а также популярность подобных фестивалей в других странах доказали необходимость в ежегодной организации таких мероприятий.
В.Ломоносова в 2006 году по инициативе ректора МГУ Виктора Садовничего. За три дня мероприятие посетили более 20 000 человек. Успех первого отечественного Фестиваля науки, а также популярность подобных фестивалей в других странах доказали необходимость в ежегодной организации таких мероприятий.
С 2007 года Фестиваль науки стал общегородским мероприятием и ежегодно проводится при финансовой и организационно-технической поддержке Правительства Москвы. В 2011 году Фестиваль науки получил статус Всероссийского. Всего в празднике науки ежегодно принимают участие более 80 регионов России. В 2018 году Всероссийский фестиваль науки стал рекордным по посещаемости. Мероприятия фестиваля посетили свыше 2 500 000 человек. Участниками праздника науки стали 800 научных и образовательных организаций со всего мира.
Таблица мирового значения – Поиск-НН
В Москве
Открывая 28 ноября в Фундаментальной библиотеке МГУ им. М. В. Ломоносова торжественную церемонию закрытия года Периодической таблицы химических элементов в России, завершившую отечественную серию мероприятий в рамках Международного года таблицы Менделеева, ректор Виктор Садовничий подчеркнул, что Дмитрий Иванович Менделеев был гениальным человеком, проявившим талант исследователя не только в химии, но и в физической химии и экономике. Сравнив его с гением Максвелла, Фарадея, Кюри, ректор отметил, что русского ученого Менделеева знают во всем мире: его труды показали всему миру, как фундаментальная наука позволяет на столетия вперед предопределять развитие экономики и общества в целом.
Сравнив его с гением Максвелла, Фарадея, Кюри, ректор отметил, что русского ученого Менделеева знают во всем мире: его труды показали всему миру, как фундаментальная наука позволяет на столетия вперед предопределять развитие экономики и общества в целом.
Показанный на церемонии видеоролик напомнил, что, когда 1 марта 1869 г. Д. И. Менделеев закончил свой труд «Опыт системы элементов, основанной на их атомном весе и химическом сходстве», было известно около 60 элементов. Сегодня в таблице их 118, из которых 94 встречаются в природе, а остальные являются синтетическими. Таким образом уже полтора века сбываются слова ученого: «Периодическому закону будущее не грозит разрушением, а только надстройка и развитие обещаются».
Президент РАН Александр Сергеев отметил на церемонии, что благодаря большой работе в рамках Менделеевского года общественное восприятие научной деятельности продвинулось значительно. Различные мероприятия, вошедшие в программу Года, разбудили любопытство сотен тысяч и даже миллионов человек. Предметом этого интереса стала не только сама таблица, сколько тот факт, что все на Земле и в космосе состоит из ограниченного набора элементов, который люди уже знают. Благодаря осмыслению этого обстоятельства, любопытный ум уже задается вопросами: одиноки ли мы во Вселенной, возможны ли другие взаимодействия у тех пяти элементов, из которых состоит ДНК, как на основе знаний о связях уже известных кирпичиков природы создавать принципиально новые материалы и соединения.
Предметом этого интереса стала не только сама таблица, сколько тот факт, что все на Земле и в космосе состоит из ограниченного набора элементов, который люди уже знают. Благодаря осмыслению этого обстоятельства, любопытный ум уже задается вопросами: одиноки ли мы во Вселенной, возможны ли другие взаимодействия у тех пяти элементов, из которых состоит ДНК, как на основе знаний о связях уже известных кирпичиков природы создавать принципиально новые материалы и соединения.
По словам Сергеева, это и является самым главным итогом года таблицы Менделеева в России. Благодаря ему люди самых разных занятий и возрастов по-иному посмотрели на мир. И это дает основание быть уверенным в том, что толчок, данный этим проектом, приведет в науку молодежь и безусловно отразится на новых научных успехах. «Спасибо году Менделеева!», — подытожил президент РАН.
Первый замминистра науки и высшего образования РФ Григорий Трубников отметил, что закрытие Менделеевского года и достижения в пропаганде химической науки, достигнутые в его рамках, обязательно должны получить свое развитие в десятилетии и даже столетии химии. «Чего бы мы ни касались — это химия!», — заметил он и добавил, что благодаря году таблицы Менделеева люди открыли красоту фундаментальной химии как науки будущего, без которой невозможно развитие человечества.
«Чего бы мы ни касались — это химия!», — заметил он и добавил, что благодаря году таблицы Менделеева люди открыли красоту фундаментальной химии как науки будущего, без которой невозможно развитие человечества.
Как известно, первым масштабным событием в рамках года таблицы Менделеева стала международная образовательно-просветительская акция «Открытая лабораторная», состоявшаяся 9 февраля в 120 городах России и 30 странах; среди вопросов «Лабы» была рубрика, посвященная не только Периодической системе, но и мифам вокруг химии. В целом в России в 2019 г. состоялось более 500 научно-популярных и образовательных мероприятий для школьников, студентов, молодых ученых и людей всех возрастов, приуроченных к 150-летию таблицы Менделеева и направленных на привлечение внимания общества к химии и науке в целом. Среди наиболее значимых событий — Всероссийский фестиваль NAUKA 0+, Всероссийский съезд учителей химии, Всероссийский открытый урок по химии, Всероссийский химический диктант, XXI Менделеевский съезд по общей и прикладной химии, ХХIХ Менделеевская школа-конференция молодых ученых в Иваново, химические турниры ученых и учреждение оргкомитетом V Всероссийской премии «За верность науке» спецноминации «Популяризация химии». Продолжая традиции международного научного сотрудничества, заложенные Менделеевым, по инициативе России учреждена международная премия ЮНЕСКО-России им. Д. И. Менделеева за достижения в области фундаментальных наук. Прием заявок заканчивается 15 марта 2020 г., и первое вручение премии в том же году.
Продолжая традиции международного научного сотрудничества, заложенные Менделеевым, по инициативе России учреждена международная премия ЮНЕСКО-России им. Д. И. Менделеева за достижения в области фундаментальных наук. Прием заявок заканчивается 15 марта 2020 г., и первое вручение премии в том же году.
Оператором проведения Международного года таблицы Менделеева в России стал Всероссийский фестиваль NAUKA 0+, генеральным партнером — Благотворительный Фонд «Искусство, наука и спорт».
В Токио
Церемония закрытия Международного года Периодической таблицы химических элементов состоялась в Токио 5 декабря. Подвести итоги проекта и обсудить перспективы развития химической науки собрались организаторы Менделеевского года и все причастные к его празднованию: представители мирового научного сообщества, политики, бизнесмены, общественные деятели. По словам председателя исполнительного комитета Международного года Таблицы в Японии Кохэя Тамао, церемония дала возможность оглянуться на многие мероприятия, проведенные во всем мире в честь празднования юбилея таблицы. Эти события прославили работу ученых и инженеров, внесших свой вклад в открытие и развитие Периодической таблицы, и работу тех, кто изучает новые элементы.
Эти события прославили работу ученых и инженеров, внесших свой вклад в открытие и развитие Периодической таблицы, и работу тех, кто изучает новые элементы.
В церемонии приняла участие представительная делегация из России. Первый замминистра науки и высшего образования РФ Григорий Трубников подчеркнул, что масштабное проведение Международного года таблицы Менделеева позволило расширить области сотрудничества в химии и активизировать обмен высококвалифицированными научными кадрами. Десятки миллионов людей узнали про историю открытия Периодической таблицы, про ее роль в развитии фундаментальной науки. Многочисленные открытые уроки в школах и ряд интерактивных мероприятий позволили вовлечь в атмосферу науки и познания мира огромное количество детей и молодежи. Он обратился к Международному союзу теоретической и прикладной химии (IUPAC) и ЮНЕСКО с просьбой и в дальнейшем привлекать внимание к наследию Д. И. Менделеева, распространив наглядные пособия о Периодическом законе в школах развивающихся стран.
Часть церемонии закрытия была посвящена перспективам развития Периодической таблицы. С докладами на эту тему выступили ученые с мировым именем, работающие над созданием новых элементов. Президент РАН Александр Сергеев дал молодым исследователям пять советов, ставя в пример личность Менделеева, и поделился с участниками церемонии взглядами на будущее Периодической таблицы. Также прозвучали выступления лауреатов Нобелевской премии Макото Кобаяси (физика, 2008 г.) и Акира Есино (химия, 2019 г.). С видеообращением выступил известный популяризатор химии сэр Мартин Поляков, вице-президент Лондонского королевского общества.
В рамках церемонии прошла секция под названием «Создание сверхтяжелых элементов», в ходе которой ученые из научных центров, внесших существенный вклад в синтез и открытие сверхтяжелых элементов, вышли на сцену, чтобы отпраздновать завершение 7-го периода таблицы Менделеева, и обратились с приветствиями к собравшимся. Директор Объединенного института ядерных исследований (Дубна) Виктор Матвеев рассказал об истории и перспективах синтеза новых элементов в институте. Завершил работу секции Юрий Оганесян (единственный живущий на Земле человек, в честь которого назван оганесон, 118-й элемент таблицы Менделеева), отметивший от имени первооткрывателей элементов большой вклад многих научных институтов, международных организаций и стран в синтез и признание открытия новых сверхтяжелых элементов. «Во время церемонии был трогательный момент, когда на сцену вышли руководители шести мировых лабораторий, ведущих синтез таких элементов (Россия, Германия, Япония, три лаборатории из США), с названиями тех элементов таблицы Менделеева, которые они открыли. И все говорили о важности международного научного сотрудничества, которое существенно ускоряет научный поиск. Теперь перед нами стоит следующая задача — сделать так, чтобы премия Менделеева, которая впервые будет присуждаться в следующем году, со временем вошла в число наиболее престижных мировых премий в области фундаментальной науки», — написал в Faсebook вице-президент РАН Алексей Хохлов.
Завершил работу секции Юрий Оганесян (единственный живущий на Земле человек, в честь которого назван оганесон, 118-й элемент таблицы Менделеева), отметивший от имени первооткрывателей элементов большой вклад многих научных институтов, международных организаций и стран в синтез и признание открытия новых сверхтяжелых элементов. «Во время церемонии был трогательный момент, когда на сцену вышли руководители шести мировых лабораторий, ведущих синтез таких элементов (Россия, Германия, Япония, три лаборатории из США), с названиями тех элементов таблицы Менделеева, которые они открыли. И все говорили о важности международного научного сотрудничества, которое существенно ускоряет научный поиск. Теперь перед нами стоит следующая задача — сделать так, чтобы премия Менделеева, которая впервые будет присуждаться в следующем году, со временем вошла в число наиболее престижных мировых премий в области фундаментальной науки», — написал в Faсebook вице-президент РАН Алексей Хохлов.
Самым ярким итогом празднования Международного года Периодической таблицы стала интерактивная выставка, представленная на церемонии закрытия. Основное внимание в экспозиции было приковано к таблице Менделеева — ее показали в различных формах и исполнении, в том числе самых неожиданных. Российская часть экспозиции была также посвящена таблице и современным достижениям российских ученых, в том числе инновационным разработкам в области ядерной физики и ядерной медицины. ОИЯИ продемонстрировал макет ДЦ-280, являющийся «сердцем» «фабрики сверхтяжелых элементов». Научно-исследовательский физико-химический институт им. Л. Я. Карпова представил макет генератора технеция. Ученые МГУ показали посетителям, как с помощью новых технологий оказаться в кабинете Менделеева и провести опыт в химлаборатории XIX в. Частью экспозиции стала историческая зона с собранием архивных документов и личных вещей ученого. Выставку украсил Молекулярный бар с «химическими» коктейлями.
Основное внимание в экспозиции было приковано к таблице Менделеева — ее показали в различных формах и исполнении, в том числе самых неожиданных. Российская часть экспозиции была также посвящена таблице и современным достижениям российских ученых, в том числе инновационным разработкам в области ядерной физики и ядерной медицины. ОИЯИ продемонстрировал макет ДЦ-280, являющийся «сердцем» «фабрики сверхтяжелых элементов». Научно-исследовательский физико-химический институт им. Л. Я. Карпова представил макет генератора технеция. Ученые МГУ показали посетителям, как с помощью новых технологий оказаться в кабинете Менделеева и провести опыт в химлаборатории XIX в. Частью экспозиции стала историческая зона с собранием архивных документов и личных вещей ученого. Выставку украсил Молекулярный бар с «химическими» коктейлями.
Члены РАН выступили в Токио с лекциями перед школьниками и студентами, посетили знаменитый японский научный центр RIKEN (Институт физико-химических исследований), провели встречи с коллегами из других стран. «Российская химическая наука очень уважаема во всем мире. Мы это почувствовали на себе во время посещения научного центра RIKEN, в ходе встреч с коллегами, во время открытых уроков и лекций для молодых научных сотрудников, студентов и школьников. Один из пригородов Токио был обширно украшен скульптурами и различными изображениями Периодической таблицы. Российский вклад в науку ценят в Японии», — подчеркнул президент РАН Александр Сергеев. По его мнению, Международный год Периодической таблицы приведет к большому притоку молодежи в науку во всем мире. «Я абсолютно уверен, что через короткое время мы станем свидетелями того, как в науку, прежде всего в химию, придет большой поток талантливой молодежи, увлеченной научным поиском. Этому способствовали мероприятия 2019 года, посвященные таблице Менделеева, и, что немаловажно, Россия в данном процессе сыграла одну из ключевых ролей», — резюмировал он.
«Российская химическая наука очень уважаема во всем мире. Мы это почувствовали на себе во время посещения научного центра RIKEN, в ходе встреч с коллегами, во время открытых уроков и лекций для молодых научных сотрудников, студентов и школьников. Один из пригородов Токио был обширно украшен скульптурами и различными изображениями Периодической таблицы. Российский вклад в науку ценят в Японии», — подчеркнул президент РАН Александр Сергеев. По его мнению, Международный год Периодической таблицы приведет к большому притоку молодежи в науку во всем мире. «Я абсолютно уверен, что через короткое время мы станем свидетелями того, как в науку, прежде всего в химию, придет большой поток талантливой молодежи, увлеченной научным поиском. Этому способствовали мероприятия 2019 года, посвященные таблице Менделеева, и, что немаловажно, Россия в данном процессе сыграла одну из ключевых ролей», — резюмировал он.
Международный год таблицы Менделеева укрепил сотрудничество между учеными и различными научными объединениями всего мира, учебными заведениями и промышленностью, позволил установить прочные партнерские отношения для достижений целей в будущем на благо развития химической науки.
Справка 2019 г. был объявлен Генеральной ассамблеей ООН Международным годом Периодической таблицы химических элементов в честь 150-летия открытия Периодического закона великим русским ученым Д. И. Менделеевым. Инициатива о проведении юбилейного года принадлежала Российскому химическому обществу им. Д. И. Менделеева, РАН, Министерству науки и высшего образования РФ, российским и зарубежным ученым и была поддержана десятками национальных и международных научных объединений. Цель инициативы — подчеркнуть научное и технологическое значение системы химических элементов в устойчивом развитии человечества. В результате Международный год таблицы Менделеева прошел под эгидой ЮНЕСКО во многих странах, в том числе в России, Франции, Германии, Испании, США, Японии, ЮАР, Индии, Великобритании, и на шести континентах, включая Антарктиду.
Свою первую схему таблицы в статье «Соотношение свойств с атомным весом элементов» Д. И. Менделеев опубликовал в 1869 г. в журнале Русского химического общества. С тех пор Периодическая таблица химических элементов является одним из самых значительных достижений в науке, охватывая сущность не только химии, но и всех естественных наук.
С тех пор Периодическая таблица химических элементов является одним из самых значительных достижений в науке, охватывая сущность не только химии, но и всех естественных наук.
Церемония открытия Международного года таблицы Менделеева состоялась 29 января 2019 г. в Париже, в штаб-квартире ЮНЕСКО. Участниками и гостями открытия стали более 1300 человек из 80 стран — ученые, политики, руководители международных, научных, образовательных организаций, представители бизнеса и общественных объединений.
Открытие Международного года таблицы Менделеева в России состоялось 6 февраля в Москве, в главном здании РАН. Международный год объединил множество заинтересованных сторон, включая ЮНЕСКО, научные общества в области химии и физики, научные союзы, образовательные и научно-исследовательские учреждения, технологические платформы, некоммерческие организации и частный бизнес для продвижения Периодической таблицы и укрепления ее значимости в мире. Десятки тысяч мероприятий — выставки, фестивали, конференции, презентации, творческие конкурсы, викторины и многие другие, посвященные 150-летию таблицы, — были проведены в школах и вузах.
Значение периодического закона и периодической системы элементов Д И. Менделеева
Открытие периодического закона и создание системы химических элементов имело огромное значение не только для химии, но и для философии, для всего нашего миропонимания. Менделеев показал, что химические элементы составляют стройную систему, в основе которой лежит фундаментальный закон природы. В этом нашло выражение положение материалистической диалектики о взаимосвязи и взаимообусловленности явлений природы. Вскрывая зависимость между свойствами химических элементов и массой их атомов, периодический закон явился блестящим подтверждением одного из всеобщих законов развития природы — закона перехода количества в качество. [c.54]Несмотря на большое значение ранних работ различных ученых, главная заслуга в развитии периодической системы принадлежит русскому ученому Дмитрию Ивановичу Менделееву и немецкому ученому Юлиусу Лотару Мейеру.
 Независимо один от другого они открыли, что свойства элементов могут быть выражены как периодическая функция от. чх атомных весов, и сделали возможной периодическую классификацию, которая мало изменилась в течение последующих лет. Менделеев опубликовал свое первое сообщение о периодической системе в 1869 г., на несколько месяцев раньше появления в печати таблицы Мейера. Однако нет сомнения, что оба ученых достойны славы за открытие периодического закона, независимо от даты опубликования. Это было признано Королевским Обществом, присудившим в 1882 г, и Д. И. Менделееву, и Мейеру медаль Дэви. [c.84]
Независимо один от другого они открыли, что свойства элементов могут быть выражены как периодическая функция от. чх атомных весов, и сделали возможной периодическую классификацию, которая мало изменилась в течение последующих лет. Менделеев опубликовал свое первое сообщение о периодической системе в 1869 г., на несколько месяцев раньше появления в печати таблицы Мейера. Однако нет сомнения, что оба ученых достойны славы за открытие периодического закона, независимо от даты опубликования. Это было признано Королевским Обществом, присудившим в 1882 г, и Д. И. Менделееву, и Мейеру медаль Дэви. [c.84] По поводу приоритета Д. И. Менделеева в открытии периодического закона А. Смит (А. Смит, Введение в неорганическую химию. Перевод под редакцией A.B. Раковского, Москва 1928) писал Лотар Мейер почти одновременно и независимо от Менделеева открыл периодическое изменение удельных объемов простых веществ с изменением атомного веса и далее хотя знание удельных объемов простых веществ имеет большое значение для изучения физико-химических особенностей элементов, однако ясно, что эти удельные объемы не пригодны для составления системы элементов и что ими во многих случаях нельзя руководствоваться для определения места элемента в системе. Вот почему Л. Мейер, открывший периодичность удельных объемов простых веществ, не мог создать периодической системы элементов, Что сделал Д. И. Менделеев, изучивший периодичность не только физических, но и химических свойств .— Прим. ред. [c.26]
Вот почему Л. Мейер, открывший периодичность удельных объемов простых веществ, не мог создать периодической системы элементов, Что сделал Д. И. Менделеев, изучивший периодичность не только физических, но и химических свойств .— Прим. ред. [c.26]
Открытие периодического закона и создание системы химических элементов имело огромное значение не только для химии, но и для философии, для всего нашего миропонимания. Менделеев показал, что химические элементы составляют стройную систему, в основе которой лежит фундаментальный закон природы. В этом нашло выражение положение материалистической диалектики о взаимосвязи и взаимообусловленности явлений природы. Вскрывая [c.55]
Более того, можно доказать, что все современное учение о химических элементах базируется на идеях Менделеева, в особенности полно высказанных в упомянутой статье Периодическая законность [для] химических элементов . Исключительно большое значение приобретает в связи с этим научное определение понятия химический элемент , составляющее фундамент всех современных представлений об атомах и элементах. Во втором разделе своей статьи (см. фотокопию VI) Менделеев пишет Положение элемента Я в системе определяется тем рядом и тою группою, к которым он относится, или около него стоящими элементами и У из того же ряда, элементами Н с меньшим и / ” с большим атомным весом из той же грунты. Свойства У и его соединений определяются, зная свойства X, У, Я и Я” [18, стр. 39]. [c.15]
Во втором разделе своей статьи (см. фотокопию VI) Менделеев пишет Положение элемента Я в системе определяется тем рядом и тою группою, к которым он относится, или около него стоящими элементами и У из того же ряда, элементами Н с меньшим и / ” с большим атомным весом из той же грунты. Свойства У и его соединений определяются, зная свойства X, У, Я и Я” [18, стр. 39]. [c.15]
Сравнительно правильный ход нарастания разности атомных весов, представленный числами 16, 22 и 28, давал резкий скачок при переходе от 2г к Т1 сразу на 40. Между тем Менделеев уже в самый момент открытия периодического закона ясно видел, что переход от одного элемента к другому, качественно от него отличному, обусловлен правильным количественным изменением в атомных весах элементов, а, следовательно, и в их разностях. Это и означало фактическое признание, что количественные изменения атомного веса переходят , или превращаются, в качественные изменения химической индивидуальности элементов (т. е. вызывают и обусловливают их качественные изменения). В ряду элементов С, 51, Т1, 8п скачок от одного элемента к другому обусловливается количественной разностью в атомных весах в пределах около 20. Иными словами, для того, чтобы вызвать качественное изменение элемента для данного ряда, значение атомного веса должно возрасти примерно на 20 атомных единиц. А это означает, что если разность между атомными весами двух элементов, находящихся в одном и том же ряду, достигает 40 единиц, то оба эти элемента не являются соседними в общей системе. Между ними должен существовать какой-то неизвестный элемент х с промежуточным атомным весом (в данном случае около 70). Если допустить это, то закон превращения количественных изменений в качественные в данном его конкретном выражении будет полностью соблюден по всему ряду С, 51, Т1, х, 2г, 5п правильное изменение атомного веса примерно на 20 единиц будет каждый раз обусловливать качественное изменение у химических элементов. [c.8]
е. вызывают и обусловливают их качественные изменения). В ряду элементов С, 51, Т1, 8п скачок от одного элемента к другому обусловливается количественной разностью в атомных весах в пределах около 20. Иными словами, для того, чтобы вызвать качественное изменение элемента для данного ряда, значение атомного веса должно возрасти примерно на 20 атомных единиц. А это означает, что если разность между атомными весами двух элементов, находящихся в одном и том же ряду, достигает 40 единиц, то оба эти элемента не являются соседними в общей системе. Между ними должен существовать какой-то неизвестный элемент х с промежуточным атомным весом (в данном случае около 70). Если допустить это, то закон превращения количественных изменений в качественные в данном его конкретном выражении будет полностью соблюден по всему ряду С, 51, Т1, х, 2г, 5п правильное изменение атомного веса примерно на 20 единиц будет каждый раз обусловливать качественное изменение у химических элементов. [c.8]
Большое прогностическое значение имеет периодический закон Д. И.Менделеева На оснопе периодической системы Д. И. Менделеев исправил атомные массы у 20 элементов, предсказал существование ряда неоткрытых элементов и дал точное описание их свойств. [c.70]
И.Менделеева На оснопе периодической системы Д. И. Менделеев исправил атомные массы у 20 элементов, предсказал существование ряда неоткрытых элементов и дал точное описание их свойств. [c.70]
О взаимосвязи закона с системой автор открытия писал Было бы правильнее мою систему назвать периодической , потому что она вытекает из периодического закона… В сопоставлении несходных элементов заключается важнейший принцип, которым моя система отличается от систем моих предшественников (Д. И, Менделеев. Периодический закон. Классики науки . М., Изд-во АН СССР, 1958. С. 388), и далее …важнейшее качество элемента познается не по низшей, а по высшим степеням окисления. По этим причинам важнейшее значение для характеристики элемента имеют высшие формы образуемых им соеднненнй,,. (Менделеев Д. И. Периодический закон. Дополнительные материалы, М,, Изд-во АН СССР, 1960, С, 343). [c.62]
В сентябре 1876 г.
 Лекок де Буабодран повторил опыты очистил металл и нашел плотность его равной 5,94 (по современным, 5,91), а атомную массу 69,9 (современное значение 69,72). Я полагаю,— писал он,— что нет необходимости настаивать на исключительной важности подтверждения теоретических взглядов Д. Менделеева относительно плотности нового элемента В третьем издании Основ химии (1877) впервые в периодической системе химических элементов вместо прежнего 68 , стоит Са 68 . Признаюсь,— писал Д. И. Менделеев в мае 1880 г.,— что я не думал видеть в течение моей жизни такого блистательного доказательства периодического закона, какое доставило ото открытие г. Лекок де Буабодрана Открытие галлия было первым толчком ко всеобщему признанию периодического закона. [c.273]
Лекок де Буабодран повторил опыты очистил металл и нашел плотность его равной 5,94 (по современным, 5,91), а атомную массу 69,9 (современное значение 69,72). Я полагаю,— писал он,— что нет необходимости настаивать на исключительной важности подтверждения теоретических взглядов Д. Менделеева относительно плотности нового элемента В третьем издании Основ химии (1877) впервые в периодической системе химических элементов вместо прежнего 68 , стоит Са 68 . Признаюсь,— писал Д. И. Менделеев в мае 1880 г.,— что я не думал видеть в течение моей жизни такого блистательного доказательства периодического закона, какое доставило ото открытие г. Лекок де Буабодрана Открытие галлия было первым толчком ко всеобщему признанию периодического закона. [c.273] Менделеев использовал открытый им периодический закон для разработки периодической системы элементов, что позволило ему предсказать существование 11 неизвестных элементов, а для некоторых известных элементов исправить значения.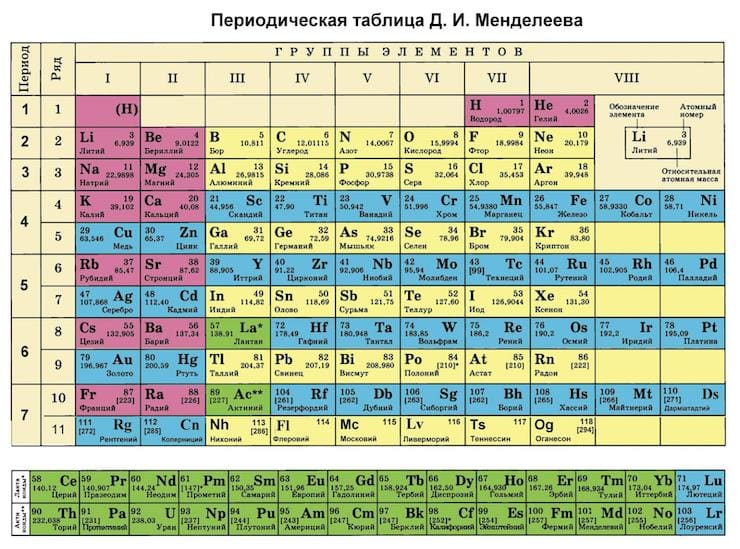 .. веса. [c.32]
.. веса. [c.32]
История открытия рения лишний раз блестяще подтвердила громадное значение периодической системы элементов Д. И. Менделеева. Как известно, Д. И. Менделеев, исходя из своего периодического закона, предсказал свойства нескольких не известных [c.24]
Больше, чем сама периодическая таблица, имеют значение те принципы и закономерности, которые увидел Менделеев за периодической зависимостью элементов. Он открыл лежащий в основе любой классификации элементов один из фундаментальных законов природы — периодический закон. Лишь на этой основе могла быть создана не просто таблица, а единая система элементов. [c.41]
До открытия периодического закона атомный вес теллура (Те = 128), определенный с достаточно высокой точностью, не вызывал ни у одного из химиков, в том числе и у Менделеева, никаких сомнений. В день открытия периодического закона (1 марта 1869 г.) Менделеев неоднократно заносил в свои записи именно это число для теллура.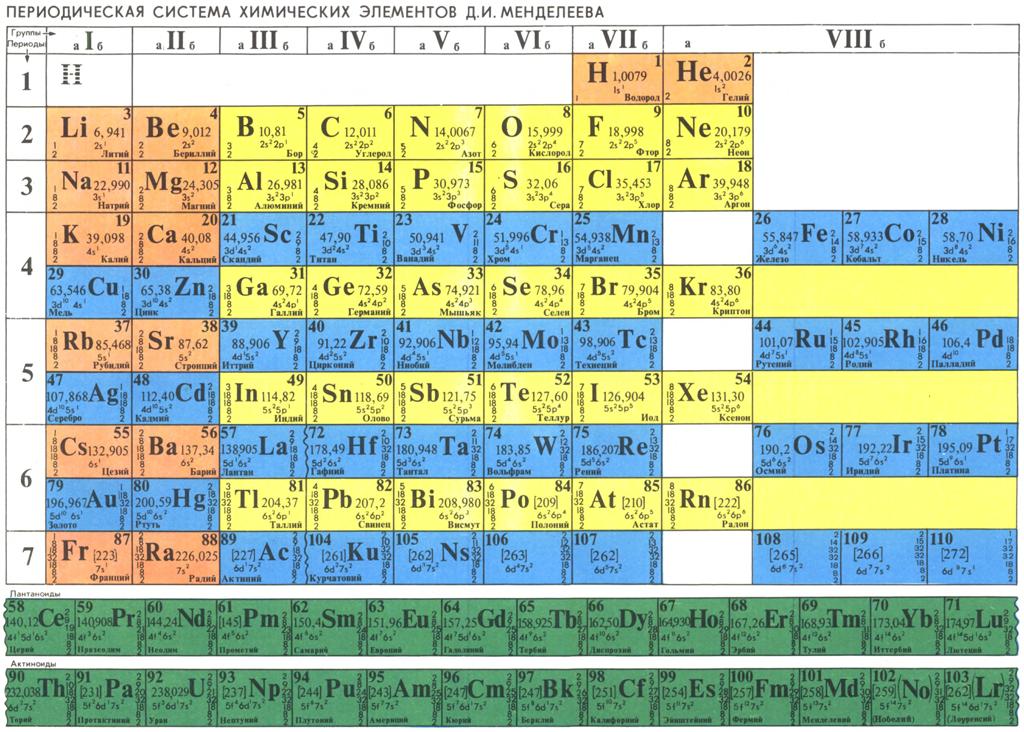 Оно фигурирует в обеих неполных табличках элементов — верхней и нижней 22, с. 49], а также в списке атомных весов (22, с. 69], из которого Менделеев брал данные для занесения на карточки перед раскладыванием химического пасьянса . В черновой таблице, в которой регистрировался ход этого пасьянса , также стоит Те = 128 (см. первую книгу, фотокопия I). Однако при переписывании этой таблицы набело для отсылки в типографию 43, фотокопия II) и в отпечатанном Опыте системы элементов (см. первую книгу, фотокопия II) у значения атомного веса теллура Менделеев поставил знак вопроса Те = 128 Разъяснение этому дано в первой статье Соотношение свойств с атомным весом элементов (март [c.136]
Оно фигурирует в обеих неполных табличках элементов — верхней и нижней 22, с. 49], а также в списке атомных весов (22, с. 69], из которого Менделеев брал данные для занесения на карточки перед раскладыванием химического пасьянса . В черновой таблице, в которой регистрировался ход этого пасьянса , также стоит Те = 128 (см. первую книгу, фотокопия I). Однако при переписывании этой таблицы набело для отсылки в типографию 43, фотокопия II) и в отпечатанном Опыте системы элементов (см. первую книгу, фотокопия II) у значения атомного веса теллура Менделеев поставил знак вопроса Те = 128 Разъяснение этому дано в первой статье Соотношение свойств с атомным весом элементов (март [c.136]
Оба ученых обнаружили, что элементы могут быть объединены в группы со сходными свойствами и что повторяемость этих свойств находится в периодической зависимости от атомного веса элемента. Из-за недостаточной чистоты и малочисленности известных в то время соединений атомные веса некоторых элементов оставались не вполне определенными, но найденные закономерности оказались настолько поразительны. ми, что са.ма возможность сопоставления свойств на основании периодического закона не подвергалась серьезным возражениям со стороны химиков. Табл. 5.4 воспроизводит периодическую систему, впервые опубликованную Менделеевым. Приоритет в установлении периодической системы следует все же признать за Менделеевым, так как, во-первых, он учитывал экспериментальную погрешность в значениях атомных весов, а во-вторых, указал на то, что периодическая система позволяет установить соответствие между самыми различными свойствами формулами окислов и многих других соединений, кислотно-основными свойствами элементов, их плотностью, температурами кипения п плавления, строением кристаллов, реакционной способностью, объемами грамм-атомов. Более того, Менделеев был настолько [c.160]
ми, что са.ма возможность сопоставления свойств на основании периодического закона не подвергалась серьезным возражениям со стороны химиков. Табл. 5.4 воспроизводит периодическую систему, впервые опубликованную Менделеевым. Приоритет в установлении периодической системы следует все же признать за Менделеевым, так как, во-первых, он учитывал экспериментальную погрешность в значениях атомных весов, а во-вторых, указал на то, что периодическая система позволяет установить соответствие между самыми различными свойствами формулами окислов и многих других соединений, кислотно-основными свойствами элементов, их плотностью, температурами кипения п плавления, строением кристаллов, реакционной способностью, объемами грамм-атомов. Более того, Менделеев был настолько [c.160]
Разделялось ошибочное мнение, будто в общем случае определяющим признаком места элемента в системе служил у Менделеева атомный вес этого элемента. В действительности же лишь в начальной фазе процесса открытия и только у наиболее изученных элементов, да и то не у всех, атомный вес определял место элемента в строящейся системе элементов. Но уже с самых первых шагов открытия периодического закона стало выступать — и чем дальше, тем все сильнее и явственнее—обратное соотношение между местом элемента в системе и значением его атомного веса. Это мы уже видели на примере бериллия (см. гл. I). В соответствии с тем, на какое место даже в еще не завершенной системе мог бы встать данный элемент, Менделеев стал исправлять значение его атомного веса так, чтобы оно соответствовало данному месту. Это означает, что определяющим по отношению к атомному весу в данном случае выступало место в системе, а не наоборот, как ошибочно принято считать иногда даже до сих пор. [c.38]
Но уже с самых первых шагов открытия периодического закона стало выступать — и чем дальше, тем все сильнее и явственнее—обратное соотношение между местом элемента в системе и значением его атомного веса. Это мы уже видели на примере бериллия (см. гл. I). В соответствии с тем, на какое место даже в еще не завершенной системе мог бы встать данный элемент, Менделеев стал исправлять значение его атомного веса так, чтобы оно соответствовало данному месту. Это означает, что определяющим по отношению к атомному весу в данном случае выступало место в системе, а не наоборот, как ошибочно принято считать иногда даже до сих пор. [c.38]
Уже с самого начала открытия периодического закона кроме действительно наблюденных неточностей при определении атомных весов Менделеев столкнулся с двумя случаями, которые впоследствии получили наименование аномалии периодической системы элементов . Это были две пары смежных друг с другом элементов первая — теллур (Те = 128) и иод (1=127), вторая — кобальт (Со = =58,9) и никель (№ = 58,7). Хотя Менделеев стремился сравнять у каждой пары элементов значения их атомных [c.134]
Хотя Менделеев стремился сравнять у каждой пары элементов значения их атомных [c.134]
Получились несоразмерные разности между атомными весами смежных по системе элементов Ti—ЕЬ = 50—44=6, и в то же время V—Ti=51—50= 1. Это указывало на то, что атомный вес титана слишком далек от экабора и слишком близок к ванадию. Поэтому уже в конце 1870 г. Менделеев поставил впервые вопросительный знак у атомного веса титана Ti = 50 [43, с. 158]. Этим он хотел сказать, что в данном случае значение атомного веса подлежит исправлению. В связи с этим на основании периодического закона Менделеев высказал прогноз, что у титана атомный вес должен быть меньше по крайней мере на две атомные единицы по сравнению с принятым до тех пор, что давало Ti = 48. [c.146]
Менделеев спустя месяц с небольшим (2 октября 1869 г.) дал, как известно, другой ответ на вопрос о предельно атомности, показав, что она так же как и другие свойства элементов, является функцией их атомного веса и соответствует положению элемента в периодической системе.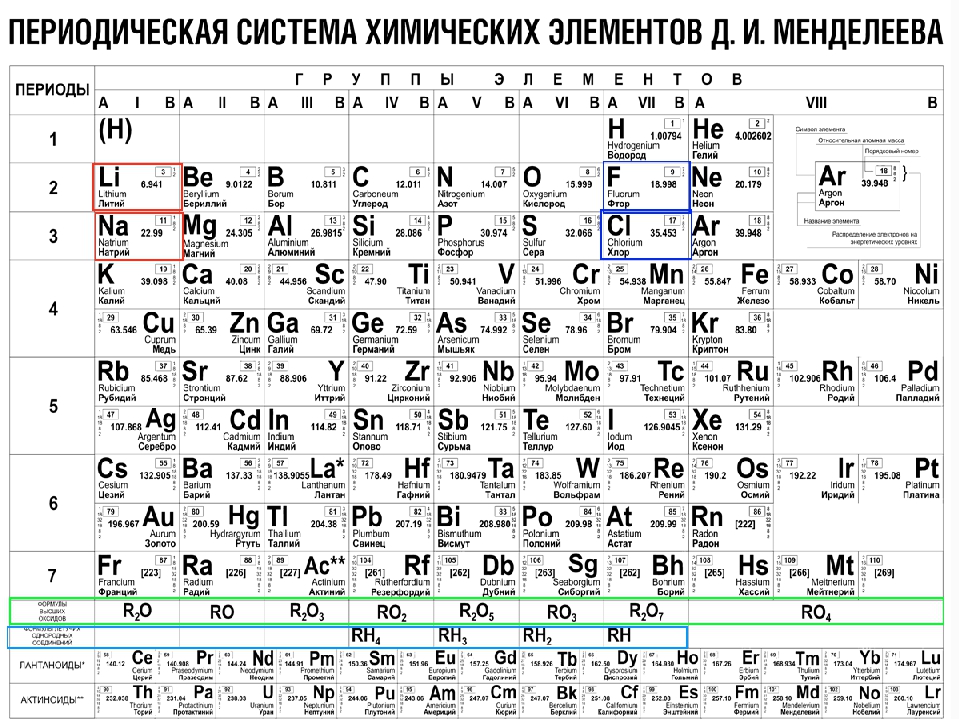 Об этом напечатано в том же выпуске ЖРХО (вып. 8 и 9, стр. 213), где Менделеев сообщает, что количество кислорода, могущее заключаться в соляных окислах, определяется порядком элементов по величине веса их атома . О переменности значений атомности у разных элементов он сообщил еще раньше (в марте 1869 г.) в своей первой статье, посвященной периодическому. закону (см. ст. 2). [c.458]
Об этом напечатано в том же выпуске ЖРХО (вып. 8 и 9, стр. 213), где Менделеев сообщает, что количество кислорода, могущее заключаться в соляных окислах, определяется порядком элементов по величине веса их атома . О переменности значений атомности у разных элементов он сообщил еще раньше (в марте 1869 г.) в своей первой статье, посвященной периодическому. закону (см. ст. 2). [c.458]
Будучи глубоко убежденным в правильности периодического закона, Менделеев на основании системы элементов предсказал с шествование экабора с атомным весом около 45, которому предстояло занять место в клетке, расположенной ниже бора экаалюминия с атомным весом около 70 —в клетке под алюминием, и в пустой соседней клетке справа от него, под кремнием — экасилиция с атомным весом около 72 кроме того, он выдвинул предположение о вероятной величине удельного веса, температуре плавления, атомном объеме, составе и свойствах окислов и хлоридов, соответствующих этим простым веществам. Когда недостающие элементы были открыты — ими оказались скандий 215с (1879 г. ), галлий з10а (1875 г.) и германий з20е (1886 г.), то экспериментально измеренные характеристики этих элементов с поразительной точностью совпали с предсказанными значениями, и уверенность в справедливости периодического закона сильно возросла. Укрепителями периодического закона называл Менделеев открывателей этих элементов — Л. Нильсона, П. Лекок де Буабодрана и К- Винклера. [c.29]
), галлий з10а (1875 г.) и германий з20е (1886 г.), то экспериментально измеренные характеристики этих элементов с поразительной точностью совпали с предсказанными значениями, и уверенность в справедливости периодического закона сильно возросла. Укрепителями периодического закона называл Менделеев открывателей этих элементов — Л. Нильсона, П. Лекок де Буабодрана и К- Винклера. [c.29]
Довольно подробно вопрос о приоритете Д. И. Менделеева в открытии периодического закона рассмотрен в книгах В. И. Семишина [222, с. 211] и H.A. Фигуровского [223]. Сам. А. Мейер даже и не помышлял отрицать выдающуюся и определяющую роль Д. И. Менделеева в открытии периодического закона. В 1869 г.,— вспоминал А. Мейер,— раньше, чем я высказал свои мысли о периодичности свойств элементов, появился реферат статьи Менделеева, в котором написано 1) при расположении элементов в порядке восходящих атомных весов наблюдается ступенчатое (у Д. И. Менделеева периодическое .— Ред.) изменение свойств элементов 2) величина атомных весов определяет свойства элементов 3) атомные веса некоторых элементов требуют исправления 4) должны существовать некоторые еще не открытые элементы. .. Это все было Д. И. Менделеевым опубликовано до меня и вообще впервые. Я открыто признаюсь, что у меня не хватило смелости для таких дальновидных предположений, какие с уверенностью высказал Менделеев [222, с. 40]. В наши дни известный американский физико-хи-мик Дж. Кемпбелл детально рассмотрел причины, по которым приоритет в установлении периодической системы следует признать за Менделеевым . Во-первых,— подчеркивает Кемпбелл,— он (Д. И. Менделеев.— Ред.) учитывал экспериментальную погрешность в значениях и, во-вторых, указал на то, что периодическая система позволяет установить соответствие между самыми различными свойствами фомулами окислов и многих других соединений, кислотно-основными свойствами элементов, их плотностью, температурами кипения и плавления, строением кристаллов, реакционной способностью, объемами грамм-атомов. Более того, Менделеев был настолько убежден в открытом им периодическом законе, что оставил в таблице пустые места для еще не открытых элементов и правильно предсказал их свойства, что в точности подтвердилось впоследствии 224, с.
.. Это все было Д. И. Менделеевым опубликовано до меня и вообще впервые. Я открыто признаюсь, что у меня не хватило смелости для таких дальновидных предположений, какие с уверенностью высказал Менделеев [222, с. 40]. В наши дни известный американский физико-хи-мик Дж. Кемпбелл детально рассмотрел причины, по которым приоритет в установлении периодической системы следует признать за Менделеевым . Во-первых,— подчеркивает Кемпбелл,— он (Д. И. Менделеев.— Ред.) учитывал экспериментальную погрешность в значениях и, во-вторых, указал на то, что периодическая система позволяет установить соответствие между самыми различными свойствами фомулами окислов и многих других соединений, кислотно-основными свойствами элементов, их плотностью, температурами кипения и плавления, строением кристаллов, реакционной способностью, объемами грамм-атомов. Более того, Менделеев был настолько убежден в открытом им периодическом законе, что оставил в таблице пустые места для еще не открытых элементов и правильно предсказал их свойства, что в точности подтвердилось впоследствии 224, с.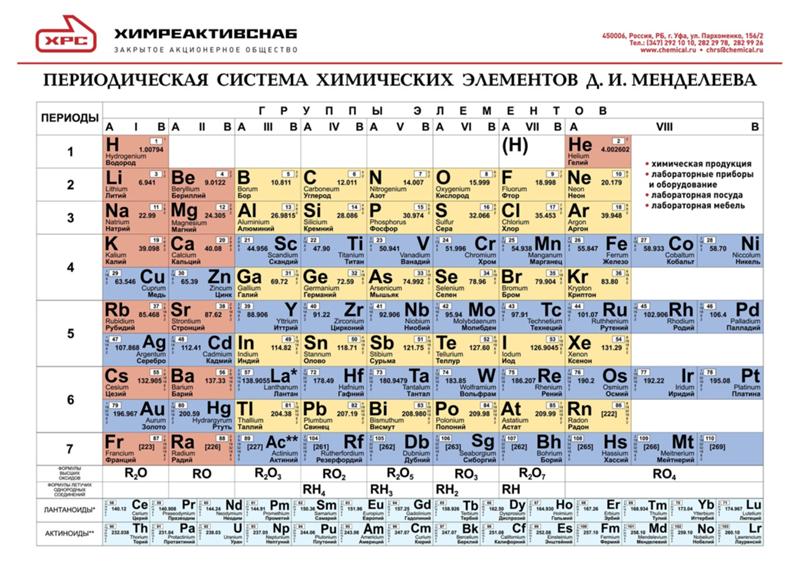 160—162].— Прим. ред. [c.76]
160—162].— Прим. ред. [c.76]
Значение периодического закона Д. И. Менделеева в связи с этим еще более возросло. Научные исследования последнего времени полностью подтвердили и существование периодичности в изменениях свойств элементор, и ту последовательность в расположении элементов, которую установил Д. И. Менделеев в своей системе. Д. И. Менделеев при построении периодической системы исходил из атомных весов элементов, а не из зарядов их ядер (существование которых никто тогда не предполагал), но надо иметь в вид -, что для значительного большинства элементов возрастание их ядерных зарядов идет параллельно возрастанию их атомных весов. [c.215]
Первой загадкой был атомный вес бериллия и состав его окиси. Долгое время для окиси бериллия принималась предложенная в 1826 г. Берцелиусом глиноземная формула — ВегОз в соответствии с нею атомный вес бериллия получался Ве = 13,5. Но при таком значении атомного веса бериллий вообще не находил себе места в периодической системе элементов тем самым подрывалась бы общность периодического закона, и этот закон как бы утрачивал характер истинного закона природы Но еще в 1842 г. русский химик И. В. Авдеев показал впервые, что атомный вес бериллия равен 9,308 (при Н = 1), а окись бериллия имеет магнезиальную формулу ВеО. Однако большинство химиков продолжало придерживаться старой, глиноземной формулы. Первые годы после открытия периодического закона вопрос об атомном весе бериллия, казалось бы, не вызывал особых сомнений. Менделеев поместил Ве = 9,4 в одну группу с магнием, а в ноябре 1870 г. он отвел бериллию место II—2 в своей Естественной системе элементов (т. е. место во II группе и 2-м ряду системы). Однако, спустя несколько лет, в 1878 г. два шведских химика Нильсон и Петерсон на основании неправильно исто.ткованных ими результатов определения теплоемкости бериллия и его окиси, предложили вновь вернуться к формуле окиси ВегОз и к атомному весу Ве= 13,5. Это предложение находилось в вопиющем противоречии с периодическим законом. Тогда же в защиту ВеО и Ве = 9, а [c.81]
русский химик И. В. Авдеев показал впервые, что атомный вес бериллия равен 9,308 (при Н = 1), а окись бериллия имеет магнезиальную формулу ВеО. Однако большинство химиков продолжало придерживаться старой, глиноземной формулы. Первые годы после открытия периодического закона вопрос об атомном весе бериллия, казалось бы, не вызывал особых сомнений. Менделеев поместил Ве = 9,4 в одну группу с магнием, а в ноябре 1870 г. он отвел бериллию место II—2 в своей Естественной системе элементов (т. е. место во II группе и 2-м ряду системы). Однако, спустя несколько лет, в 1878 г. два шведских химика Нильсон и Петерсон на основании неправильно исто.ткованных ими результатов определения теплоемкости бериллия и его окиси, предложили вновь вернуться к формуле окиси ВегОз и к атомному весу Ве= 13,5. Это предложение находилось в вопиющем противоречии с периодическим законом. Тогда же в защиту ВеО и Ве = 9, а [c.81]
На Конгрессе в Карлсруэ голосование носило не императивный, а скорее информационный характер, да но главнейшим вопросам оно и не проводилось. Тем не менео можно говорить о положительных результатах Конгресса — о том, что он, как могучий катализатор, способствовал успеху реформы атомпо-молекулярной теории, начатой Жераром и завершенной Канниццаро. И этим успехом, можно повторить, Конгресс был в первую очередь обязан Канниццаро. После Конгресса, но словам Л. Мейера, когда он тюзнакомился еще с Smito пелена спала с глаз, и появи.лось чувство спокойной уверенности . Менделеев считал, что решающее значение для развития его идей, приведших к периодическому закону, име.ч 1860 г. и особенно соображения, высказанные на Конгрессе химиков Канниццаро. Я рассматриваю его (Канниццаро) как своего предшественника, потому что установленные им атомные веса послужили мне необходимой точкой опоры Хотя после Конгресса в Карлсруэ система атомных весов стала интенсивно разрабатываться (Канниццаро никогда не давал полной таблицы атомных весов), и в этом принимали участие многие химики (Вюрц, Одлинг, Л. Мейер и др.), открытие Менделеевым периодического закона и разработка им метода теоретического исправления уже известных и даже предсказания атомных весов еще неизвестных элементов стало решающим для утверждения новой системы атомных весов [c.
Тем не менео можно говорить о положительных результатах Конгресса — о том, что он, как могучий катализатор, способствовал успеху реформы атомпо-молекулярной теории, начатой Жераром и завершенной Канниццаро. И этим успехом, можно повторить, Конгресс был в первую очередь обязан Канниццаро. После Конгресса, но словам Л. Мейера, когда он тюзнакомился еще с Smito пелена спала с глаз, и появи.лось чувство спокойной уверенности . Менделеев считал, что решающее значение для развития его идей, приведших к периодическому закону, име.ч 1860 г. и особенно соображения, высказанные на Конгрессе химиков Канниццаро. Я рассматриваю его (Канниццаро) как своего предшественника, потому что установленные им атомные веса послужили мне необходимой точкой опоры Хотя после Конгресса в Карлсруэ система атомных весов стала интенсивно разрабатываться (Канниццаро никогда не давал полной таблицы атомных весов), и в этом принимали участие многие химики (Вюрц, Одлинг, Л. Мейер и др.), открытие Менделеевым периодического закона и разработка им метода теоретического исправления уже известных и даже предсказания атомных весов еще неизвестных элементов стало решающим для утверждения новой системы атомных весов [c.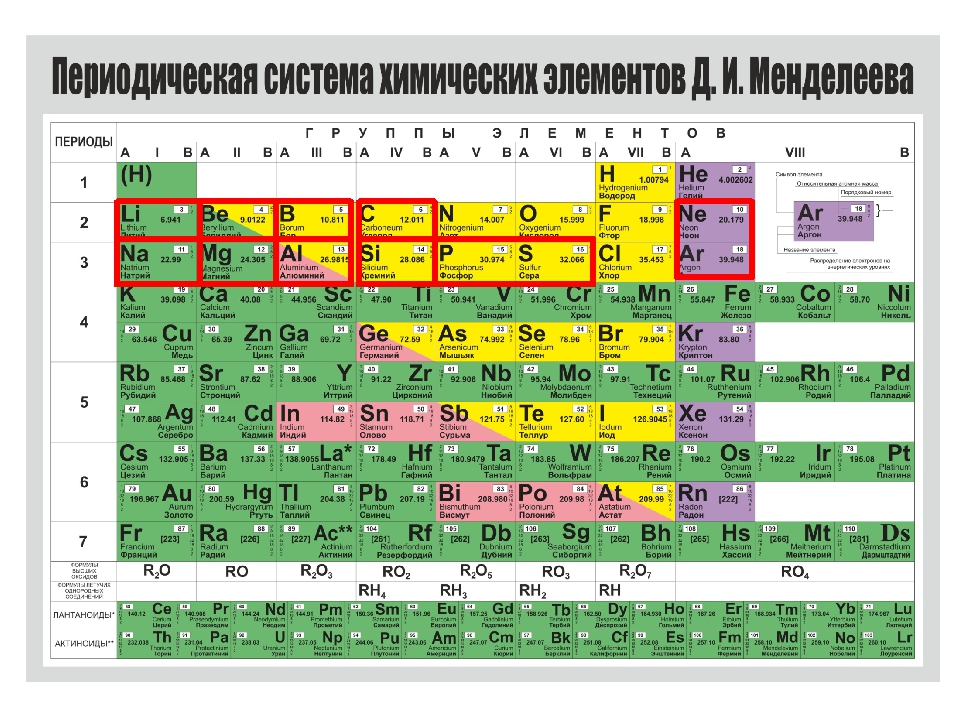 132]
132]
Всем предыдущим изложением Менделеев подводит к раскрытию сущности периодического закона. При этом мы хотели бы обратить внимание на одно обстоятельство, которое имеет огромное методическое значение. Реч Ь -идет об использовании представлений об общих, особенн ЫХ и индивидуальных свойствах элементов, проявление которых и определяется положением элементов в системе, т. их взаимосвязи, особенности групп, рядов и индивидуалы е черты. Плодотворность нодобного рассмотрения содёр ЖайИЛ периодического закона бщла показана академиком Б. Кедровым на примере анализа истории открытия периодического закона [c.210]
Открытие д. и. Менделеевым периодического закона обобщило химические знания, накопленные к середине XIX в., и обусловило бурное развитие многих областей химии. Химическая наука стала развиваться в новых направлениях, которые ранее не были возможны. В частности, открытие периодического закона поставило вопрос о полноте и пределах периодической системы, в результате чего внимание многих химиков было привлечено к исследованию элементов, замыкавших в то время таблицу. Сам Д. И. Менделеев придавал исключительное значение исследованию химии урана и призывал развивать работы в этой области. Примечательно, что именно исследования урана привели к обнаружению нового явления — радиоактивности и к рождению новой области науки — радиохимии. Несомненно, что открытие радиоактивности и последовавшее за ним бурное развитие радиохимии неразрывно связаны с той революцией в области химии, которую произвел периодический закон Д. И. Метгде-леева. [c.213]
Сам Д. И. Менделеев придавал исключительное значение исследованию химии урана и призывал развивать работы в этой области. Примечательно, что именно исследования урана привели к обнаружению нового явления — радиоактивности и к рождению новой области науки — радиохимии. Несомненно, что открытие радиоактивности и последовавшее за ним бурное развитие радиохимии неразрывно связаны с той революцией в области химии, которую произвел периодический закон Д. И. Метгде-леева. [c.213]
Открытие периодического закона и создание системы химически элементов имело огромное значение не только дл.ч химии, но и для всего естествознания в целом. Открытие Д. И. Менделеева обогатило человеческое знание одной из фундаментальных закономерностей природы. Оценивая значение открытия Д. И. Менделеева, Ф. Энгельс писал Менделеев, применив… закон о переходе количества в качество, совершил научный подвиг, который смело можно поставить рядом с открытием Леверье, вычислившего орбиту еще не известной планеты — Нептуна (Маркс К.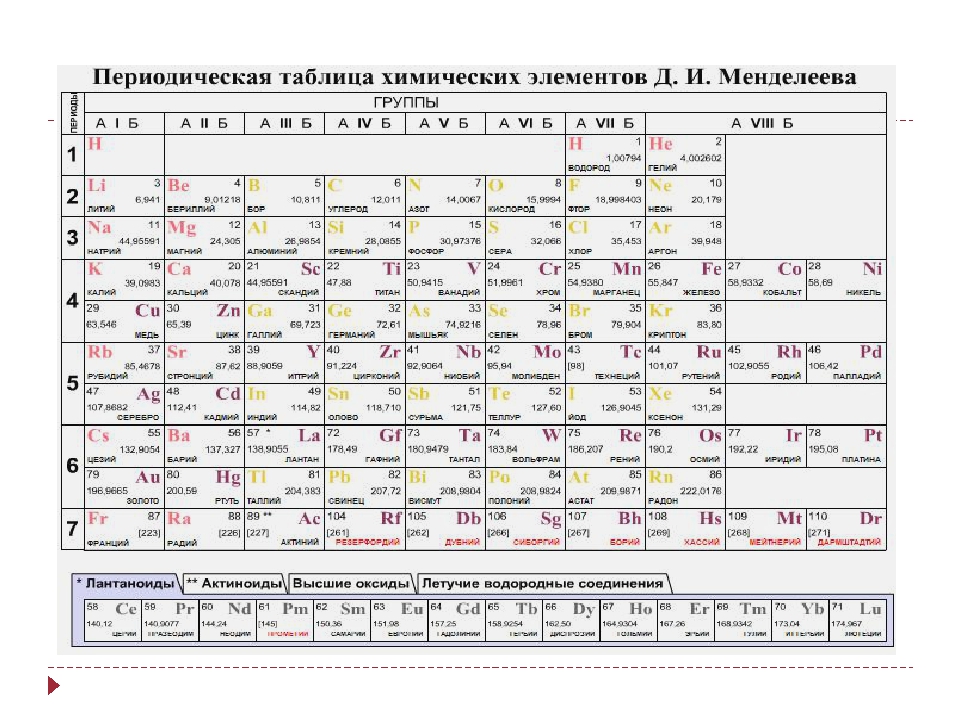 и Энгельс Ф. Соч.— Т. 20.— С. 389). [c.22]
и Энгельс Ф. Соч.— Т. 20.— С. 389). [c.22]
Природные соединения и получение германия, олова и свинца. История открытия германия является поучительным примером научного предвидения, основанного на знании фундаментальных законов природы. Через два года после опубликования периодической системы, в 1871 г., Д. И. Менделеев предсказал существование нескольких неизвестных в то время элементов, в том числе экасилиция, и описал основные свойства этих элементов и некоторых их соединений. Спустя 15 лет (в 1886 г.) немецкий химик Винклер в природном минерале аргиродите обнаружил элемент, по свойствам тождественный предсказанному под № 32 экасилицию. Это открытие подтвердило огромное значение периодического закона, и позднее Д. И. Менделеев назвал германий, скандий и галлий элементами — укрепителями периодической системы . [c.216]
Ко времени открытия Д. И. Менделеевым периодического закона были известны перекисные соединения только для 19 элементов.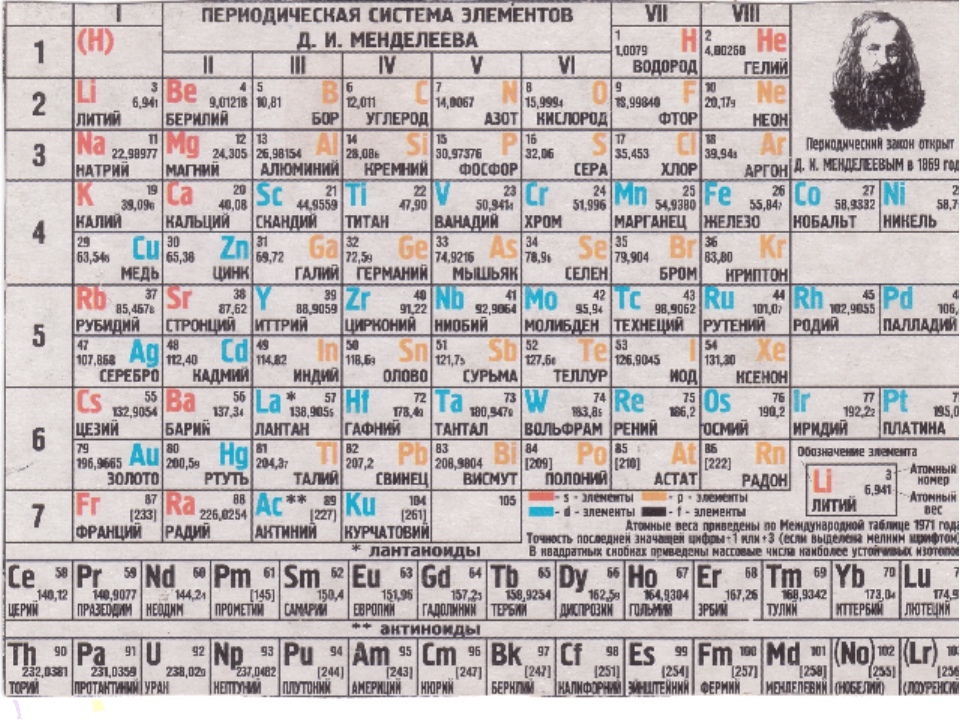 Д. И. Менделеев придавал особое значение неорганическим перекисям. Его интерес к этому классу соединений был обусловлен тем, что они, по господствующим тогда понятиям об их природе, не подчинялись общей закономерности, согласно которой элементы, расположенные в порядке возрастания атомного веса, дают повторяющиеся ряды высших окислов, соответствующих номеру группы периодической системы. Уместно отметить, что с открытием в сороковых годах настоящего столетия молекулярных ионов кислорода 01 , ОГ и ОГ понятие неорганическое перекисное соединение четко определилось и нет необходимости считать, что эти соединения не подчиняются общим законам валентности, периодичности и комплексообразования. Например, соединение КО2, или как писали тогда К 2О4, не представляет исключения из общего правила, согласно которому валентность калия должна соответствовать номеру группы периодической системы, где расположен этот элемент, т. е. единице, так как оно характеризуется наличием одновалентного молекулярного иона 07.
Д. И. Менделеев придавал особое значение неорганическим перекисям. Его интерес к этому классу соединений был обусловлен тем, что они, по господствующим тогда понятиям об их природе, не подчинялись общей закономерности, согласно которой элементы, расположенные в порядке возрастания атомного веса, дают повторяющиеся ряды высших окислов, соответствующих номеру группы периодической системы. Уместно отметить, что с открытием в сороковых годах настоящего столетия молекулярных ионов кислорода 01 , ОГ и ОГ понятие неорганическое перекисное соединение четко определилось и нет необходимости считать, что эти соединения не подчиняются общим законам валентности, периодичности и комплексообразования. Например, соединение КО2, или как писали тогда К 2О4, не представляет исключения из общего правила, согласно которому валентность калия должна соответствовать номеру группы периодической системы, где расположен этот элемент, т. е. единице, так как оно характеризуется наличием одновалентного молекулярного иона 07. То же самое относится, например, к соединению Каа02, характеризующемуся наличием молекулярного иона 01″, и к соединению КОд, содержащему молекулярный ион 0 .. [c.7]
То же самое относится, например, к соединению Каа02, характеризующемуся наличием молекулярного иона 01″, и к соединению КОд, содержащему молекулярный ион 0 .. [c.7]
К открытию Периодического закона Д. И. Менделеев пришел, исследуя сходство между химическими элементами. Периодический закон не только привел в систему знания по свойствам элементов, но и позволил прогнозировать новые неоткрытые элементы и их свойства. Действительным его триумфом было открытие галлия и других элементов, место для которых в Системе было предсказано Д. И. Менделеевым и свойства которых оказались близкими к предсказанным. В настоящее время Периодический закон имеет особенно большое значение для прогнозирования числа и свойств трансураиидов [Прогнозирование…, 1976]. [c.85]
Но если формула окислов редкоземельных элементов есть МегОз, то их атомные веса должны быть изменены Менделеев увеличивает их значение примерно в полтора раза по сравнению с прежними. Теперь атомный вес иттрия стал равен 88, лантана — 138, церия — 139, дидима — 140 и эрбия — 175. Теперь III группа гостеприимно распахивает свои двери для новых пришельцев. Но для всех ли Иттрий легко помещается в 6-й ряд III группы, между стронцием и цирконием поэтому иттрий перестает быть классическим редкоземельным элементом, если иметь в виду современное представление об этом семействе. Выше иттрия пустая клетка ожидает предсказанного Менделеевым экабора — будущего скандия. Ниже, в 8-й ряд вошел лантан. Пока все хорошо, ничто не вызывает сомнений. Далее следует церий, его атомный вес почти идентичен атомному весу лантана. В III группе ему уже нет места, но его может принять IV, ибо металл дает высшую окись МеО2, где он находится в четырехвалентном состоянии. Но для следующего элемента — дидима — уже нужно допустить пятивалентное состояние, тогда он попадет в V группу. Но никто не получал производных пятивалентного дидима. Неясен вопрос и с эрбием. Его, правда, можно поместить в III группу, ниже лантана, но свойства его почти не изучены и, кто знает, быть может, он представляет собой смесь элементов.
Теперь III группа гостеприимно распахивает свои двери для новых пришельцев. Но для всех ли Иттрий легко помещается в 6-й ряд III группы, между стронцием и цирконием поэтому иттрий перестает быть классическим редкоземельным элементом, если иметь в виду современное представление об этом семействе. Выше иттрия пустая клетка ожидает предсказанного Менделеевым экабора — будущего скандия. Ниже, в 8-й ряд вошел лантан. Пока все хорошо, ничто не вызывает сомнений. Далее следует церий, его атомный вес почти идентичен атомному весу лантана. В III группе ему уже нет места, но его может принять IV, ибо металл дает высшую окись МеО2, где он находится в четырехвалентном состоянии. Но для следующего элемента — дидима — уже нужно допустить пятивалентное состояние, тогда он попадет в V группу. Но никто не получал производных пятивалентного дидима. Неясен вопрос и с эрбием. Его, правда, можно поместить в III группу, ниже лантана, но свойства его почти не изучены и, кто знает, быть может, он представляет собой смесь элементов. Что это весьма вероятно, свидетельствует сама периодическая система, так как разница в атомных весах дидима и эрбия огромна и равна 35 и в этом интервале может уместиться до десятка неизвестных еще редких земель. Так, сама логика периодического закона подсказывала новые открытия в дебрях редко- [c.23]
Что это весьма вероятно, свидетельствует сама периодическая система, так как разница в атомных весах дидима и эрбия огромна и равна 35 и в этом интервале может уместиться до десятка неизвестных еще редких земель. Так, сама логика периодического закона подсказывала новые открытия в дебрях редко- [c.23]
До 1910 г. химики были уверены, что все атомы данного элемента обладают одним и тем же постоянным атомным весом. Выше мы уже отметили, что Д. И. Менделеев придавал этому положению очень большое теоретическое значение — его периодический закон был открыт и периодическая система была создана именно на основании твердой веры в это правило. Однако впоследствии (начиная с 1910 г.) было установлено, что атомы одного и того же элемента в подавляюш,ем различными атомными весами. Химикам пришлось дать атомному весу, который устанавливается для каждого элемента опытным путем, иное толкование. Было установлено, что большинство элементов обладают изотопами. [c.283]
Закон Менделеева оказался могучим орудием предвидения в области ядерных процессов. Опираясь на этот закон, удалось найти ключ к теоретическому пониманию ядерных процессов. Высказывания великого ученого о значении урана и тория и их места в периодической системе подтверждаются открытиями ядерных процессов. Между всеми известными химическими элементами уран выдается тем,— писал Менделеев,— что обладает наивысшим атомным весом… Этим обстоятельствам ныне, когда периодическая система элементов оправдывается е разнообразнейших сторон, мне кажется, должно приписать немалое значение для того интереса, который, очевидно, возрастает по отношению к урану, особенно с тех пор, как с ним оказались связанными два из важнейших — во множестве отношений — открытия физики и химии нашего времени, а именно открытие аргоновых элементов (особенно гелия) и радиоактивных веществ. Те и другие представляют своего рода неожиданность и крайность, какими-то, еще глубоко сокрытыми способами, связанные с крайностью в эволюции элементов самого урана. Наивысшая, из известных, концентрация массы весомого вещества в неделимую массу атома, существующая в уране, уже а priori должна влечь за собою выдающиеся особенности.
Опираясь на этот закон, удалось найти ключ к теоретическому пониманию ядерных процессов. Высказывания великого ученого о значении урана и тория и их места в периодической системе подтверждаются открытиями ядерных процессов. Между всеми известными химическими элементами уран выдается тем,— писал Менделеев,— что обладает наивысшим атомным весом… Этим обстоятельствам ныне, когда периодическая система элементов оправдывается е разнообразнейших сторон, мне кажется, должно приписать немалое значение для того интереса, который, очевидно, возрастает по отношению к урану, особенно с тех пор, как с ним оказались связанными два из важнейших — во множестве отношений — открытия физики и химии нашего времени, а именно открытие аргоновых элементов (особенно гелия) и радиоактивных веществ. Те и другие представляют своего рода неожиданность и крайность, какими-то, еще глубоко сокрытыми способами, связанные с крайностью в эволюции элементов самого урана. Наивысшая, из известных, концентрация массы весомого вещества в неделимую массу атома, существующая в уране, уже а priori должна влечь за собою выдающиеся особенности. .. Убежденный в том, что исследование урана, начиная с его природных источников, поведет еще ко многим новым открытиям, я смело рекомендую тем, кто ищет пред- [c.366]
.. Убежденный в том, что исследование урана, начиная с его природных источников, поведет еще ко многим новым открытиям, я смело рекомендую тем, кто ищет пред- [c.366]
Нильсон и Петерсон в пределах от О до 100° оиредели-ли теплоемкость этого нечистого металла и сделали поправку на теплоемкость примесей. В итоге они получили для теплоемкости бериллия значение 0,4084, что требовало принятия Ве = 13,8 (так как в этом случае выдерживается закон Дюлонга и Пти 0,4084-13,8 = 5,64). В связи с этим они писали …Нагие мнение об истинном атомном весе и химической природе этого металла противоречит так называемому периодическому закону, который Менделеев предначертал для всех элементов, а именно не только потому, что при Ве=13,8 металл этот едва ли может быть помещен в менделеевскую систему, но и потому, что тогда элемент с атомным весом 9,2, как это требует периодический закон, в системе отсутствовал бы и, по-видимому, еще должен быть открыт [50, с. 581—582]. [c.15]
Выступая 8/20 октября 1881 г. с сообщением о редких металлах и периодическом законе на заседании химического отделения Русского физико-химического общества (РФХО), Менделеев отнюдь не опровергал эмпирически найденных Нильсоном и Петерсоном значений теплоемкости металлического бериллия (0,4084). Но выводы, которые сделали из своих опытов шведские химики, Менделеев отверг самым решительным образом. Методологическая основа менделеевских возражений заключалась в том, уже рассмотренном выше положении, что нельзя брать опытные данные, полученные для одного элемента, изолированно от соответствующих данных для других элементов, стоящих в закономерной связи с данным элементом. Шведские химики сочли атомную теплоемкость для бериллия при атомном весе 9,2 слишком заниженной 0,4084-9,2 3,8. Поэтому они и приняли Ве = = 13,8, чтобы получить желаемый результат 0,4084-13,8 = = 5,6. Между тем, как показал Менделеев, первое значение (3,8) вполне укладывалось в общий ряд элементов, расположенных согласно их периодической системе. В протоколе заседания сказано Затем Менделеев упомянул, что предлагаемое Нильсоном и Петерсоном возвращение к прежней формуле окиси бериллия ВегОз пе должно допустить, ибо атомная теплоемкость при переходе от к В и С через Ве должна быть именно такова, какою ее нашли эти исследователи. А уменьшение атомной теплоемкости с возрастанием нелетучести в ряде Ы (6,6), Ве (3,8), В (2,6), С (2,4) имеет тот же смысл, как и в ряде Ка (6,7), Mg (5,9), А1 (5,5), 81 (4,6). Еще менее допу- [c.19]
I и II) [32, с. 191]. Окислам всех этих металлов ранее приписывался состав R0, а потому у всех у них получались заниженные значения атомных весов. Менделеев на основании периодического закона высказал предположение о том, что у них, кроме тория, атомный вес должен быть увеличен в полтора раза, а у тория — в два раза. Первоначально на карточках для химического пасьянса у всех этих металлов, как и у церия, не указывались их атомные веса. Однако при раскладывании пасьянса Менделеев начал указывать их значения для церитов Di = 95 и La=94 (ставя оба элемента рядом с Се=92) для иттрия Yt=61,6 (Попп —34 и 68, Бунзен —30,8, Делафонтен — 74) для тория Th=115,7 (ThO) и 230 (ТЮг) (Делафонтен — 230, Хидениус — 118) для эрбия Ег=56 (Бунзен) Ег 39,6/79,2. Все эти элементы вместе с индием, как не нашедшие еще своего места в системе, Менделеев вынес за ее пределы, приняв Yt = 60 , Ег=56 и Th=118 (см. первую книгу, фотокопии I и II). [c.87]
Браунер, сам чувствовавший национальное угнетение своего народа, остро реагировал на попытки некоторых шовинистически настроенных иностранцев умалить значение русского ученого — Менделеева — в истории открытия периодического закона. В декабре 1901 г., участвуя в работах XI съезда русских естествоиспытателей и врачей, Браунер говорил Вот уже более двадцати лет прошло с того времени, как я приступил к исследованию редких элементов, желая решить вопрос о положении их в периодической системе Менделеева. Поводом к этому послужило для меня прежде всего то обстоятельство, что знаменитую идею периодического закона выразил Дмитрий Иванович Менделеев, член нашей великой славянской семьи. Я видел, как эта великая идея оставалась без внимания, по всей вероятности, потому, что принадлежала русскому химику . О том, кто является действительным основателем периодической системы элементов, Браунер говорит Для меня и для каждого славянина — это Дмитрий Иванович Менделеев (ЖРФХО, 1902, т. XXXIV, отд. I, часть химич., стр. 142—143). [c.76]
Анализ разбивки элементов на группы по их изоморфизму, а также-группировка изоморфных тел по типу кристаллических систем имели большое-значение в деле подготовки открытия периодического закона в большинстве-случаев, как и в случае системы Грема (см. стр. 620 в основном томе), это были как раз те самые естественные группы элементов, которые в 1868— 1869 гг. Менделеев стал сопоставлять между собою сначала по значению их атомности, а начиная с 17 февраля 1869 г.—по величине атомных весов смежных членов попарно сопоставленных групп (см. ст. ф. 1 ст. 2 и др.). [Стр. 616) [c.558]
Значение периодической системы – Справочник химика 21
ФИЛОСОФСКОЕ (МИРОВОЗЗРЕНЧЕСКОЕ) ЗНАЧЕНИЕ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ЭЛЕМЕНТОВ [c.215]Значение периодической системы. Периодическая система элементов оказала большое влияние на после- [c.52]
Предсказание новых элементов. Значение, периодической системы.) Периодическая система раскрывает глубокую связь между всеми химическими элементами и их группами. Она показывает, что свойства элементов не случайны, а закономерны и определяются их положением в системе. Зная место, занимаемое элементом в таблице Менделеева, можно предсказать его важнейшие свойства. [c.109]
Здесь рассматриваются вопросы истории открытия периодического закона и развития периодической системы Д. И. Менделеева, вопросы теории строения атомов в связи с периодической системой, исторический обзор учения об атоме и элементе, об открытии, значении и законах радиоактивности также рассматривается вопрос о философском (мировоззренческом) значении периодической системы. [c.2]
Велико педагогическое значение периодической системы — она является научной основой преподавания химии в средней и высшей школе. [c.72]
История открытия рения лишний раз блестяще подтвердила громадное значение периодической системы элементов Д. И. Менделеева. Как известно, Д. И. Менделеев, исходя из своего периодического закона, предсказал свойства нескольких не известных [c.24]
Оценивая значение периодической системы, английский химик В. Рамзай называл ее компасом для исследователя , а датчанин [c.81]
ЗНАЧЕНИЕ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ [c.278]
Значение периодической системы элементов. Периодическая система, созданная Д. И. Менделеевым на основе периодического закона, раскрывает глубокую связь между всеми химическими элементами. Она показывает, что свойства каждого отдельного элемента можно понять в полной мере только в связи со всей совокупностью свойств других элементов, в связи с положением данного элемента в периодической системе. Элементы, будучи подчинены единому закону, внутренне едины по своей природе и обусловливают друг друга и… именно поэтому они располагаются в определенном порядке по периодической системе [c.36]
На последних полутора страницах статьи Браунер подчеркивает значение периодической системы. Он пишет о смысле и величине тех проблем, которые, несомненно, будут поставлены периодическим законом в химии будущего [7, с. 1221]. [c.83]
Значение периодической системы. Предсказание новых элементов Д. И. Менделеевым. Периодическая система, наглядно выражающая периодический закон, является первой естественной классификацией химических элементов. Она обнаруживает, что свойства элементов не случайны, а закономерны и определяются их местом в этой системе. На основании места, занимаемого элементом в таблице Менделеева, можно дать характеристику элементу. [c.130]
Как научное, так и педагогическое значение периодической системы состоит в том, что она отражает собой а) свойства атомов (элементов), б) свойства простых тел, отвечающих данным элементам, в) свойства сложных тел (например, водородных или кислородных соединений элементов), г) характер связи при различных сочетаниях атомов, д) строение электронной оболочки атомов, е) строение ядер атомов, ж) изменение устойчивости их при переходе от простых к сложным. [c.65]
Лишь после того, как была экспериментально доказана реальность атомов и молекул, то есть восторжествовали материалистические представления над идеалистическими в. этом основном вопросе миропонимания, значение периодической системы элементов возросло еще больше и на очередь властно встал вопрос о том, как устроен атом. [c.85]
Значение периодической системы. Периодическая система, элементов оказала большое влияние на последующее развитие химии. Она не только была первой естественной классификацией химических элементов, показавшей, что они образуют стройную систему и находятся в тесной связи друг с другом, но и явилась могучим орудием для дальнейших исследований. [c.51]
Оценивая значение периодической системы, английский химик [c.79]
Философско-мировоззренческое значение периодической системы будет рассмотрено после ознакомления с теориями строения тома (см. гл. 12). [c.65]
Здесь собраны наиболее интересные и ценные сведения по истории открытия и использования химических элементов. Очерки об отдельных элементах располагаются в порядке возрастания их атомных весов. Достаточно подробно рассказано о заслугах отечественных ученых в деле открытия и изучения элементов, о значении периодической системы Д. И. Менделеева для познания природы элементов. [c.7]
Ширмер В., Танке Э. Значение Периодической системы элементов для современной химии // 100 лет Периодическому закону химических элементов Сб.— М. Наука, 1969. [c.205]
Значение периодической системы. Периодическая система элементов Д. И. Менделеева имеет для химии исключительно большое значение. В таблице нашли отражение все важнейшие свойства элементов. Классификация элементов по Менделееву обнаруживает, что эти свойства не случайны, а закономерны атомные веса, металличность или металлоидность, валентность и т. д. изменяются закономерно. Место элемента в таблице определяется его свойствами, и, наоборот, каждому месту отвечает определенная совокупность свойств. Это позволяет дать основную характеристику элемента, исходя из того, какое место в периодической системе он занимает. Например, элемент магний в горизонтальном направлении находится между натрием и алюминием. Натрий—щелочной металл, алюминий—амфотерный. Следо-вательнр, магний должен быть химически менее активным металлом, чем натрий, но более активным, чем алюминий. И действительно, магний на холоду не разлагает воду (на что способен натрий), но, в отличие от алюминия, не амфотерен (гидроокись магния не реагирует со щелочами). В вертикальном нанравлении магний стоит выше кальция. Это говорит о меньшей металличности магния, что также подтверждается опытом х альций разлагает воду на холоду, на что магний не способен, и т. д. Если взять среднее [c.197]
Международный год периодической таблицы Менделеева — Федеральный Исследовательский Центр Фундаментальной и Трансляционной Медицины
2019 год провозглашен Генеральной ассамблеей ООН Международным годом Периодической таблицы химических элементов. Это масштабное событие посвящено 150-летию открытия Периодического закона химических элементов великим русским ученым Д.И. Менделеевым.
С инициативой о проведении Международного года Периодической таблицы химических элементов выступили Российская академия наук, Российское химическое общество имени Д.И. Менделеева, Министерство науки и высшего образования РФ, российские и зарубежные ученые.
Инициативу России поддержали зарубежные страны, международные научные организации, а также более 80 национальных академий наук и научных обществ. Среди них – Международный Союз по теоретической и прикладной химии (IUPAC), Международный союз теоретической и прикладной физики (IUPAP), Европейская Ассоциация химических и молекулярных наук (EuCheMS), Международный астрономический союз (IAU) и другие.
Международный год Периодической таблицы химических элементов пройдет под эгидой ЮНЕСКО в нескольких странах мира. В рамках этого события планируется проведение большого количества мероприятий: научных конференций, тематических выставок, конкурсов молодых ученых и т.д.
29 декабря 2018 года Председатель Правительства РФ Дмитрий Медведев подписал распоряжение «О проведении в 2019 году Международного года Периодической таблицы химических элементов» и возглавил Оргкомитет. В состав Оргкомитета вошли руководители федеральных органов исполнительной власти, ведомств и ведущих научных организаций.
Торжественная церемония открытия Международного года Периодической таблицы химических элементов состоялась 29 января 2019 года во Франции, в Париже, в штаб-квартире ЮНЕСКО.
В России церемония открытия Международного года пройдет 6 февраля 2019 года в Москве, в Президиуме РАН, и будет приурочена ко Дню российской науки и одновременно Дню рождения Дмитрия Ивановича Менделеева.
Официальным оператором церемоний открытия Международного года Периодической таблицы химических элементов в Париже и Москве выступит Всероссийский фестиваль науки NAUKA 0+. Главной темой Фестиваля науки в 2019 году станет Таблица Менделеева. Генеральный партнер Международного года Периодической таблицы химических элементов в России — Благотворительный Фонд «Искусство, наука и спорт».
В рамках Международного года во всех регионах России планируется проведение более 500 научно-популярных и образовательных мероприятий, посвященных 150-летию выдающегося открытия Д.И. Менделеева и направленных на привлечение внимания школьников, студентов и молодежи в целом к науке и ее достижениям.
Проведение в 2019 году Международного года Периодической таблицы химических элементов имеет особое значение для России. Это событие будет способствовать международному признанию заслуг великого русского ученого Д.И. Менделеева, а также укреплению престижа и популяризации отечественной науки.
www.iypt2019.org — сайт на английском языке
www.iypt2019.ru — сайт на русском языке
www.facebook.com/IYPT2019Russia — страница на Facebook
www.vk.com/iypt2019russia — страница ВКонтакте
Таблица Менделеева| Определение, элементы, группы, сборы, тенденции и факты
Изучите периодический закон химии, чтобы понять свойства элементов и их взаимосвязь.
Объяснение таблицы Менделеева.
Encyclopdia Britannica, Inc. Посмотреть все видео к этой статьеПериодическая таблица , полностью периодическая таблица элементов , в химии организованный массив всех химических элементов в порядке возрастания атомного номера – i.е., полное число протонов в атомном ядре. Когда химические элементы расположены таким образом, в их свойствах возникает повторяющийся образец, называемый «периодическим законом», в котором элементы в одном столбце (группе) имеют схожие свойства. Первоначальное открытие, сделанное Дмитрием И. Менделеевым в середине XIX века, имело неоценимое значение для развития химии.
таблица МенделееваСовременная версия периодической таблицы элементов (для печати).
Британская энциклопедия, Inc.Популярные вопросы
Что такое таблица Менделеева?
Что общего у групп периодической таблицы?
Группы периодической таблицы отображаются в виде вертикальных столбцов, пронумерованных от 1 до 18. Элементы в группе имеют очень похожие химические свойства, которые возникают из количества присутствующих валентных электронов, то есть количества электронов в крайних электронах. оболочка атома.
Откуда взялась периодическая таблица Менделеева?
Расположение элементов в периодической таблице определяется их электронной конфигурацией.Из-за принципа исключения Паули не более двух электронов могут заполнить одну и ту же орбиталь. Первый ряд периодической таблицы состоит всего из двух элементов: водорода и гелия. Поскольку у атомов больше электронов, у них появляется больше орбит, доступных для заполнения, и поэтому строки содержат больше элементов, расположенных ниже в таблице.
Почему периодическая таблица Менделеева разделяется?
У периодической таблицы есть две строки внизу, которые обычно отделяются от основной части таблицы. Эти ряды содержат элементы ряда лантаноидов и актиноидов, обычно от 57 до 71 (от лантана до лютеция) и от 89 до 103 (от актиния до лоуренсия), соответственно.Для этого нет никаких научных причин. Это сделано только для того, чтобы стол стал более компактным.
Фактически не было признано до второго десятилетия 20-го века, что порядок элементов в периодической системе соответствует порядку их атомных номеров, целые числа которых равны положительным электрическим зарядам атомных ядер, выраженным в электронных единицах. . В последующие годы был достигнут большой прогресс в объяснении периодического закона с точки зрения электронного строения атомов и молекул.Это разъяснение повысило ценность закона, который используется сегодня так же активно, как и в начале 20 века, когда он выражал единственную известную взаимосвязь между элементами.
История периодического закона
Первые годы XIX века были свидетелями быстрого развития аналитической химии – искусства различения различных химических веществ – и, как следствие, накопления обширных знаний о химических и физических свойствах как элементы, так и соединения.Столь быстрое расширение химических знаний вскоре потребовало классификации, поскольку на классификации химических знаний основана не только систематизированная химическая литература, но и лабораторные науки, посредством которых химия передается как живая наука от одного поколения химиков к другому. Связи между соединениями обнаруживались легче, чем между элементами; так получилось, что классификация элементов на много лет отстала от классификации соединений. Фактически, между химиками не было достигнуто общего согласия относительно классификации элементов в течение почти полувека после того, как системы классификации соединений стали общепринятыми.
интерактивная таблица МенделееваСовременная версия периодической таблицы элементов. Чтобы узнать название элемента, атомный номер, электронную конфигурацию, атомный вес и многое другое, выберите элемент из таблицы.
Encyclopædia Britannica, Inc.J.W. Доберейнер в 1817 году показал, что объединяющий вес, означающий атомный вес, стронция находится посередине между весом кальция и бария, а несколько лет спустя он показал, что существуют другие такие «триады» (хлор, бром и йод [галогены] и литий, натрий и калий [щелочные металлы]).Ж.-Б.-А. Дюма, Л. Гмелин, Э. Ленссен, Макс фон Петтенкофер и Дж. П. Кук расширили предложения Доберейнера между 1827 и 1858 годами, показав, что аналогичные отношения простираются дальше, чем триады элементов: фтор добавляется к галогенам, а магний – к щелочноземельным элементам. металлы, тогда как кислород, сера, селен и теллур были отнесены к одному семейству, а азот, фосфор, мышьяк, сурьма и висмут – к другому семейству элементов.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.Подпишитесь сейчасПозднее были предприняты попытки показать, что атомные веса элементов могут быть выражены арифметической функцией, и в 1862 году А.-Э.-Б. де Шанкуртуа предложил классификацию элементов, основанную на новых значениях атомных весов, данных системой Станислао Канниццаро 1858 года. Де Шанкуртуа нанес атомные веса на поверхность цилиндра с окружностью 16 единиц, что соответствует приблизительному атомному весу кислород. Получившаяся спиральная кривая привела тесно связанные элементы в соответствующие точки над или под друг друга на цилиндре, и он предположил, как следствие, что «свойства элементов являются свойствами чисел», что является замечательным предсказанием в свете современных знаний.
Классификация элементов
В 1864 г. J.A.R. Ньюлендс предложил классифицировать элементы в порядке возрастания атомного веса, при этом элементам присваиваются порядковые номера от единицы и выше и разделены на семь групп, обладающих свойствами, тесно связанными с первыми семью из известных на тот момент элементов: водород, литий, бериллий, бор, углерод. , азот и кислород. Это соотношение было названо законом октав по аналогии с семью интервалами музыкальной гаммы.
Затем в 1869 году, в результате обширной корреляции свойств и атомных весов элементов, уделяя особое внимание валентности (то есть количеству одинарных связей, которые может образовывать элемент), Менделеев предложил периодический закон: согласно которому «элементы, расположенные в соответствии с величиной атомного веса, демонстрируют периодическое изменение свойств». Лотар Мейер независимо пришел к аналогичному выводу, опубликованному после появления статьи Менделеева.
Определение периодической таблицы в химии
Таблица Менделеева представляет собой табличное расположение химических элементов путем увеличения атомного номера, в котором элементы отображаются таким образом, чтобы можно было увидеть тенденции в их свойствах.Чаще всего изобретателем таблицы Менделеева приписывают русского ученого Дмитрия Менделеева (1869 г.). Современная таблица происходит от периодической таблицы Менделеева, но с одним существенным отличием. В таблице Менделеева элементы упорядочены в соответствии с возрастающим атомным весом, а не атомным номером. Однако его таблица проиллюстрировала повторяющиеся тенденции или периодичность в свойствах элементов.
Также известен как: Периодическая таблица, Периодическая таблица элементов, Периодическая таблица химических элементов.
Ключевые выводы: определение
периодической таблицы- Периодическая таблица Менделеева представляет собой табличное расположение химических элементов, которое упорядочено по возрастанию атомного номера и группирует элементы в соответствии с повторяющимися свойствами.
- Семь строк таблицы Менделеева называются периодами. Строки расположены так, что металлы находятся в левой части таблицы, а неметаллы – в правой.
- Столбцы называются группами. Группа содержит элементы с похожими свойствами.
Организация
Структура таблицы Менделеева позволяет сразу увидеть взаимосвязи между элементами и предсказать свойства незнакомых, вновь открытых или неоткрытых элементов.
Периоды
В периодической таблице есть семь строк, которые называются периодами. Атомный номер элемента увеличивается слева направо через период. Элементы в левой части периода – это металлы, а элементы в правой части – неметаллы. При перемещении точки в таблице вниз добавляется новая электронная оболочка.
Группы
Столбцы элементов называются группами или семействами. Группы пронумерованы от 1 (щелочные металлы) до 18 (благородные газы).Элементы с группой имеют общую конфигурацию валентных электронов. Элементы в группе отображают образец в отношении атомного радиуса, электроотрицательности и энергии ионизации. Радиус атома увеличивается при движении вниз по группе, поскольку последовательные элементы получают уровень энергии электрона. Электроотрицательность уменьшается при движении вниз по группе, потому что добавление электронной оболочки отталкивает валентные электроны дальше от ядра. Двигаясь вниз по группе, элементы имеют последовательно более низкие энергии ионизации, потому что становится легче удалить электрон из внешней оболочки.
Блоки
Блоки – это разделы периодической таблицы, которые указывают внешнюю электронную подоболочку атома. S-блок включает первые две группы (щелочные металлы и щелочноземельные металлы), водород и гелий. Р-блок включает группы с 13 по 18. D-блок включает группы с 3 по 12, которые являются переходными металлами. F-блок состоит из двух периодов, расположенных ниже основной части таблицы Менделеева (лантаноиды и актиниды).
Металлы, металлоиды, неметаллы
К трем широким категориям элементов относятся металлы, металлоиды или полуметаллы и неметаллы.Металлический характер наиболее высок в нижнем левом углу таблицы Менделеева, в то время как большинство неметаллических элементов находится в верхнем правом углу.
Большинство химических элементов – это металлы. Металлы имеют тенденцию быть блестящими (металлический блеск), твердыми, проводящими и способными образовывать сплавы. Неметаллы обычно мягкие, цветные, изоляторы и способны образовывать соединения с металлами. Металлоиды обладают промежуточными свойствами между металлами и неметаллами. В правой части периодической таблицы металлы переходят в неметаллы.Металлоиды были идентифицированы по грубой схеме лестницы – от бора до кремния, германия, мышьяка, сурьмы, теллура и полония. Однако химики все чаще относят другие элементы к металлоидам, включая углерод, фосфор, галлий и другие.
История
Дмитрий Менделеев и Юлий Лотар Мейер независимо друг от друга опубликовали периодические таблицы в 1869 и 1870 годах соответственно. Однако Мейер уже опубликовал более раннюю версию в 1864 году.И Менделеев, и Мейер организовали элементы, увеличивая атомный вес, и организовали элементы в соответствии с повторяющимися характеристиками.
Было произведено несколько других более ранних таблиц. Антуан Лавуазье организовал элементы в металлы, неметаллы и газы в 1789 году. В 1862 году Александр-Эмиль Бегуйе де Шанкуртуа опубликовал периодическую таблицу, названную теллурической спиралью или винтом. Эта таблица, вероятно, была первой, в которой элементы были упорядочены по периодическим свойствам.
Источники
- Чанг, Р.(2002). Химия (7-е изд.). Нью-Йорк: Высшее образование Макгроу-Хилла. ISBN 978-0-19-284100-1.
- Эмсли, Дж. (2011). Строительные блоки природы: Путеводитель по элементам от А до Я . Нью-Йорк, Нью-Йорк: Издательство Оксфордского университета. ISBN 978-0-19-960563-7.
- Грей, Т. (2009). Элементы: Визуальное исследование каждого известного атома во Вселенной . Нью-Йорк: Black Dog & Leventhal Publishers. ISBN 978-1-57912-814-2.
- Гринвуд, Н.N .; Эрншоу, А. (1984). Химия элементов . Оксфорд: Pergamon Press. ISBN 978-0-08-022057-4.
- Мейя, Юрис; и другие. (2016). «Атомный вес элементов 2013 (Технический отчет IUPAC)». Чистая и прикладная химия . 88 (3): 265–91. DOI: 10.1515 / pac-2015-0305
Современная таблица Менделеева: периоды и группы
Задачи обучения
- Опишите устройство современной таблицы Менделеева.
Как английский словарь менялся с течением времени?
Язык меняется со временем. Новые слова входят в язык, а старые слова часто исчезают из-за отсутствия использования. Словари публикуются, чтобы люди могли успевать за изменениями в языке и знать, как правильно использовать слова.
Эти публикации могут быть печатными или электронными. Словари можно найти в Интернете, а приложения доступны для смартфонов. Словари неоценимы для хорошего и надежного общения.
Периодическая таблица Менделеева и Мозли претерпела значительные изменения. Было открыто много новых элементов, а другие синтезированы искусственно. Каждый правильно вписывается в группу элементов с похожими свойствами. Периодическая таблица представляет собой расположение элементов в порядке их атомных номеров, так что элементы с аналогичными свойствами появляются в одном вертикальном столбце или группе.
На рисунке ниже показана наиболее часто используемая форма таблицы Менделеева.Каждый квадрат показывает химический символ элемента вместе с его названием. Обратите внимание, что некоторые символы не связаны с названием элемента: Fe для железа, Pb для свинца и т. Д. Большинство из этих элементов известны с древних времен и имеют символы, основанные на их латинских названиях. Атомный номер каждого элемента написан над символом.
Период – горизонтальная строка периодической таблицы. В периодической таблице есть семь периодов, каждый из которых начинается в крайнем левом углу.Новый период начинается, когда новый основной энергетический уровень начинает заполняться электронами. В периоде 1 всего два элемента (водород и гелий), а в периодах 2 и 3 – 8 элементов. Периоды 4 и 5 содержат 18 элементов. Периоды 6 и 7 содержат 32 элемента, потому что две нижние строки, которые отделены от остальной части таблицы, принадлежат этим периодам. Их вытаскивают, чтобы сама таблица умещалась на одной странице.
Группа – это вертикальный столбец периодической таблицы, основанный на организации электронов внешней оболочки.Всего насчитывается 18 групп. Есть две разные системы нумерации, которые обычно используются для обозначения групп, и вы должны быть знакомы с обеими. Традиционная система, используемая в Соединенных Штатах, включает использование букв A и B. Первые две группы – это 1A и 2A, а последние шесть групп – от 3A до 8A. Средние группы используют B в своих названиях. К сожалению, в Европе действовала несколько иная система. Чтобы избежать путаницы, Международный союз теоретической и прикладной химии (IUPAC) решил, что официальная система нумерации групп будет простой от 1 до 18 слева направо.Многие периодические таблицы показывают обе системы одновременно.
Сводка
- Периодическая таблица Менделеева расположена в порядке атомного номера .
- Период – это горизонтальная строка периодической таблицы.
- Группа представляет собой вертикальный ряд периодической таблицы Менделеева.
Практика
Воспользуйтесь ссылкой ниже, чтобы ответить на следующие вопросы:
http://pontotriplo.org/triplepoint/2007/05/the_best_55_online_periodic_tables.html
- Выберите периодическую таблицу из столбца «лучший», который вам больше всего нравится. Почему вы выбрали этот стол?
- Какая таблица Менделеева из «конкретного» раздела вам больше всего нравится? Почему?
- Какая из «забавных» периодических таблиц вам нравится больше всего? Почему?
Обзор
- Чем сегодняшняя таблица Менделеева отличается от той, которую опубликовал Менделеев?
- Все ли элементы современной периодической таблицы встречаются в природе? Поясните свой ответ.
- Что такое «точка»? Что это собой представляет?
- Что такое «группа»? Что это собой представляет?
- Почему для групп используются две разные системы нумерации?
Глоссарий
- группа: Элементы со схожими химическими свойствами появляются через определенные промежутки времени в вертикальных столбцах.
- период: Период – это горизонтальная строка периодической таблицы.
Наизнанку Откройте для себя элементы: Периодическая таблица
Периодическая таблица Менделеева представляет собой систему классификации для элементы.Каждый элемент имеет уникальные свойства, и вы может предсказать физические и химические свойства элемента в зависимости от его положения в периодической таблице.
Когда вы смотрите на таблицу Менделеева, символы и числа выглядят как изображение слева. Символы являются сокращениями. происхождения слова для каждого элемента. Например, Символ свинца, Pb, происходит от латинского слова plumbum. что означает «жидкое серебро».
Число над символом означает атомную массу (или атомный вес). Это общее количество протонов и нейтроны в атоме.
Число под символом – это атомный номер и это отражает количество протонов в ядре атома каждого элемента. Каждый элемент имеет уникальный атомный номер. Свинец имеет 82 протона, поэтому его атомный номер равно 82. Затем элементы располагаются в порядке возрастания атомные номера – так водород (H), который имеет только один протон, расположен первым в таблице, а натрий (Na), который имеет 11 протонов и находится ниже стол.
Мы можем использовать атомный номер и атомную массу, чтобы узнать
количество протонов, нейтронов и электронов там
находятся в атоме. Вычитая атомный номер из
атомная масса, мы можем узнать количество нейтронов
Существуют.
Есть 18 основных столбцов элементов в периодической таблице. Их называют группами или семьями. Элементы в одной группе или семье имеют одинаковые – но не идентичные – свойства.Например литий, натрий и калий являются членами семьи 1. Они все очень реактивны и поэтому могут легко сочетаться с другие элементы для образования соединений. Каждый горизонтальный ряд называется периодом. В отличие от элементов в семье, элементы в период не похожи по свойствам. Есть 7 периоды стихий. 2 строки, которые были разделены из основной таблицы – редкоземельные элементы или лантаноны (лантаноиды) в первом периоде и актиноны (актиниды) в следующем периоде.
Путешествие к созданию таблица Менделеева может быть прослежена еще в Древние греки 400 г. до н.э., которые использовали слово «элемент» и “атом” для описания различий между вещи.
Периодическая таблица, известная нам сегодня, была создан четырьмя отдельными европейскими учеными во время 1860-е гг. В 1863 г. 44-летний французский геолог А. Э. Бегуйе. де Шанкуртуа составил список элементов, измеренных по их атомному весу.Между тем в Англии химик Джон А. Р. Ньюлендс заметил, что химические группы повторяются. каждые 8 элементов. Он назвал это правилом октавы, сравнивая это к музыкальным нотам.
Между 1868 и 1869 гг., Работая самостоятельно, русский химик. Дмитрий И. Менделеев и немецкий химик Лотар Мейер расположил элементы в 7 столбцов в соответствии с их химические свойства. Их таблицы были похожи, но была принята таблица Менделеева.Он собран наблюдения и открытия более ранних химиков, показывающие символы химических элементов в порядке их атомные массы, но его таблица была огромным научным прорыв, потому что он оставил пробелы и точно предсказал неоткрытые элементы. Это значительно ускорило открытие новых элементов и наше понимание их свойства, и это позволило ученым точно предсказывать элементы – многие элементы были обнаруженные или искусственно созданные, которые вписались в пробелы в таблице.Менделеев предсказал свойства скандия, галлия и германия: в течение 20 лет ученые обнаружили существование этих элементов и его предсказания оказались точными. Современный версии таблицы Менделеева содержат 109 элементов, но новый элементы обнаруживаются все время.
Неизменно полезная таблица Менделеева Химии отмечает большой день рождения
Висящие на стене квадраты выглядят как неровная стена из блоков алфавита.Буквы не образуют слов. Столбцы неровные. Эта диаграмма – символ химии – известна как Периодическая таблица элементов. Дмитрий Менделеев (MEN-duh-LAY-ev), российский ученый, работающий в Санкт-Петербурге, предложил раннюю версию. Это было 150 лет назад. Но даже сегодня эта диаграмма помогает ученым разобраться в атомах и молекулах, составляющих нашу Вселенную.
Элементы – это строительные блоки всей материи. Их атомы соединяются вместе, образуя буквально все – нас, воздух, которым мы дышим, организмы, которые разделяют наш мир, и все остальные молекулы газа или частицы массы, встречающиеся во всей нашей Вселенной.
Строки и столбцы периодической таблицы соответствуют так называемому периодическому закону . Он утверждает, что общие черты между химическими элементами повторяются в регулярных паттернах по мере того, как элементы становятся больше. Эти паттерны связывают элементы со схожим химическим поведением и помогают химикам рассказать, как атомы реагируют с образованием молекул. То, как выстраиваются строки и столбцы в этой таблице, указывает на общие черты между группами связанных элементов. Понимание этих отношений помогает химикам создавать новые соединения.Это также помогает им понять, как устроена жизнь. Это даже помогает им предсказать, как будут вести себя новые материалы.
В 1869 году русский химик Дмитрий Менделеев предложил периодический закон и свою первую таблицу Менделеева. Он опубликовал эту периодическую таблицу два года спустя в учебнике Основы химии ( Основы химии ). Ряд строк показывает, что химия носит периодический характер, а это означает, что определенные свойства повторяются. Основываясь на повторяющихся шаблонах, он оставил пробелы для четырех элементов, которые, как он ожидал, будут существовать.В течение 10 лет ученые откроют три из них.
Дмитрий Менделеев / Институт истории науки
Но хорошо известная таблица Менделеева – далеко не единственная таблица Менделеева. Ученые построили множество, некоторые из которых имеют самые разные формы. Некоторые разработали химики. Ученые и учителя в других областях разработали другие.
«Альтернативные формы полезны из-за различных аспектов науки, которые они иллюстрируют», – отмечает Кармен Джунта. Он химик в колледже Ле Мойн в Сиракузах, штат Нью-Йорк.Y. Эти менее традиционные периодические таблицы предоставляют способы не только выделить некоторые из особенностей химии, говорит он, но и лучше их сфокусировать.
Учителя и родители, подпишитесь на шпаргалку
Еженедельные обновления, которые помогут вам использовать Новости науки для студентов в учебной среде
В 2019 году мир отмечает периодическую таблицу Менделеева во всех ее формах и то, как она помогает организовать и осмыслить строительные блоки нашей Вселенной.
ЭлементарноСразу после Большого взрыва Вселенная состояла только из водорода и гелия – двух самых легких элементов. Гравитация сближала эти атомы во все больших количествах. В конце концов, это создаст плотные, раскаленные огненные печи, которые мы знаем как звезды. В центре этих звезд сильное давление сливало атомные ядра – центры атомов – создавая более крупные ядра.
Это медленно выкованные более крупные и тяжелые элементы. Они включали углерод, элемент, необходимый для всей жизни, какой мы ее знаем.Эти звездные кузницы также образовали кислород, которым мы должны дышать.
Создание элементов крупнее железа требовало еще большей космической огневой мощи. Тяжелые атомные ядра образовались в результате взрыва массивных умирающих звезд. Эти сверхновые силой столкнули более мелкие элементы вместе.
Менделеев в своей периодической таблице 1869 года расположил элементы в порядке возрастания массы. Он был одним из первых ученых, которые осознали, что в химии есть повторяющиеся закономерности. По мере того, как элементы становятся больше, некоторые из их свойств в конечном итоге повторяются.Некоторые элементы предпочитают реагировать, становясь положительно заряженными. Некоторые предпочитают заряжаться отрицательно. Такие закономерности позволили ученым предугадать, будут ли сочетаться разные типы элементов и как они это делают.
Менделеев написал в своем исследовательском журнале, что идея этого стола пришла ему во сне. Он начал с скандала. Но когда химические свойства повторились, он начал новую серию. Он выстроил элементы с похожим поведением в столбцы. Он оставил пробелы. Эти отверстия, рассуждал он, обозначают элементы, которые, вероятно, существовали, но еще не были обнаружены.
Когда он опубликовал эту таблицу, Менделеев предсказал свойства и массы четырех новых элементов. В конце концов все четыре были обнаружены – три всего за 10 лет.
Самая ранняя спираль была спроектирована французским геологом Александром-Эмилем Бегуайе де Шанкуртуа в 1862 году. У нее не было «рядов». Вместо этого все элементы намотаны вокруг цилиндра в одну длинную линию.
Александр-Эмиль Бегуайе де Шанкуртуа / Wikimedia Commons
Александр-Эмиль Бегуйе де Шанкуртуа был французским геологом.За семь лет до знаменитой таблицы Менделеева он создал спиральную «таблицу». Он расположил элементы по атомному весу. Он показал повторяющиеся периоды. Однако перерывов между рядами не было. Вместо этого он намотал свою длинную тонкую диаграмму на цилиндр. Таким образом, каждая строка перетекала в следующую. И похожие элементы выстроились друг над другом аккуратными столбиками.
Другие ученые составили аналогичные диаграммы. Вскоре усилия по систематизации всех известных элементов нарастали.По мере развития всех этих диаграмм одна из них стала доминирующей. Его сегодня можно встретить в классах и в учебниках по всему миру.
Каждый из 118 известных элементов имеет свой собственный химический символ – одну или две буквы, которые гордо представляют название элемента из его поля в периодической таблице. Некоторые из этих сокращений очевидны, например, H для водорода или C для углерода. Другие восходят к древним временам. Например, символ натрия – Na. Почему? На латыни натрий называется natrium .
Каждое поле в таблице имеет целое число, обычно в верхнем левом углу. Названный атомным номером, он показывает, сколько протонов или положительно заряженных частиц упаковано в ядро элемента. Это ядро также включает нейтроны (частицы с массой, но без заряда). Ядро окружает облако, состоящее из отрицательно заряженных электронов гораздо меньшего размера.
Нижнее число в квадрате диаграммы для каждого элемента включает цифры после десятичной точки. Это значение представляет собой атомную массу элемента.Он представляет собой среднюю массу атома этого элемента.
Периодическая таблица Менделеева проста, эффективна и продолжает давать новые эксперименты, – говорит Эрик Шерри. Он преподает химию в Калифорнийском университете в Лос-Анджелесе. Он также пишет книги о таблице Менделеева. Он описывает организационные принципы, лежащие в основе периодической таблицы, как «абсолютно важное открытие».
Двойные башни доминируютСамая распространенная сегодня таблица Менделеева иногда известна как версия «башен-близнецов».Водород (H) венчает высокую башню слева. Гелий (He) наверху правой башни.
Периодический круглый стол расставляет элементы из массива дерева. Он разработан, чтобы показать, как электроны расположены в виде узоров внутри каждого элемента. В этой конструкции в форме дерева периоды роста становятся частью более широких дисков. Подобные элементы накладываются друг на друга. Вы можете удалить каждый слой, чтобы увидеть элементы в каждой «строке».
Гэри Кац / Институт истории науки
По мере того, как атомы становятся больше, они становятся более сложными.В этих диаграммах период в периодической таблице относится к ряду элементов, демонстрирующих некоторый повторяющийся цикл. В таблице ширина строки, также называемая точкой, определяется таким образом, чтобы сохранялся шаблон поведения элементов в столбце. Сначала узор повторяется в двух элементах, так что ширина ряда составляет два элемента. Затем узор повторяется в восьми элементах. Как отмечает Скерри, по мере того, как элементы становятся больше, «периоды становятся все длиннее и длиннее» – в конечном итоге с 18 элементами, а затем с 32.
Чем длиннее, тем больше периоды могут сделать базу из тяжелых элементов этой таблицы неуклюже широкой. Чтобы обойти это, диаграмма двойной башни обычно вытаскивает часть двух нижних рядов. Эти элементы размещаются внизу страницы, почти как сноски. Эти нижние ряды содержат группы элементов, известных как лантаноиды (LAN-tha-nydes) и актиниды (AK-tih-nydes).
Актиниды включают новейшие и самые крупные элементы. Многие из них радиоактивны, и не встречаются в природе.Вместо этого физики делают их в лабораториях, бомбардируя более мелкие элементы друг в друга. Эти радиоактивные сверхтяжелые элементы также очень нестабильны. Это означает, что они распадаются на более мелкие элементы за доли секунды.
Чем они полезныТаблица Менделеева может служить своего рода книгой рецептов. На диаграмме показано, как элементы соотносятся друг с другом. То, где элемент находится на столе, говорит химику, как он может или не может взаимодействовать с другими ингредиентами.Часто эти полезные характеристики включают его массу, температуру кипения и другие важные данные.
Расположение стола помогает химикам решать проблемы. Например, химики могут захотеть создать новое соединение с характеристиками, аналогичными существующему – только лучше. Таким образом, они могут искать замену с аналогичными функциями, начиная с другого элемента из того же столбца таблицы.
Настоящий дар этих таблиц, говорит Бриджит Ван Тиггелен, – это «хранение всей информации в одном месте, обучение и обмен ею.Историк, она работает европейским директором Института истории науки в Филадельфии, штат Пенсильвания,
.Диаграмма с двумя башнями имеет много преимуществ, – говорит Марк Лич. Он работает химиком в Англии в Манчестерском столичном университете. Он утверждает, что ни одна другая таблица не может так хорошо отображать повторяющиеся шаблоны, в то же время включая другие функции.
Например, все металлы находятся слева. Справа торчат неметаллы. На этой диаграмме также показано, как изменяется размер атома и насколько легко он может отдать электрон.Такие черты важны для понимания того, как атомы будут действовать, реагировать и вступать в брак с другими, образуя молекулы.
Альтернатива Роя Александера столу Twin Tower разрезала ряды на полоски. Когда он снова собрал их вместе, получилась трехмерная версия таблицы Менделеева. Он также оказался почти идентичным тому, что был создан физиком Георгием Гамовым четверть века назад.
Рой Александр
Но диаграмма башен-близнецов не идеальна.
Химики часто спорят, например, где разместить водород и гелий.А плоская двухмерная таблица на самом деле не показывает, как строки соединяются друг с другом. Когда вы подходите к концу одного ряда, Шерри говорит: «У вас возникает ощущение, что вы как бы падаете».
Рой Александр работал строителем выставок. Ему не понравилось, как внезапно закончились ряды стола в башне-близнецах. Поэтому в 1965 году он разрезал традиционную таблицу Менделеева на полоски. Затем он собрал их вместе, создав трехмерную версию.
Спустя годы он узнал, что физик Георгий Гамов построил почти идентичную таблицу в 1940-х годах.Александр вспоминает: «Было удивительно, как он выглядел идентично моему патентному рисунку».
Учет все более крупных периодовКогда Бегуйе де Шанкуртуа впервые создал свою периодическую таблицу, многие из крупнейших элементов еще не были обнаружены. По мере увеличения элементов общие черты повторяются все реже. В конце концов, более длинные ряды с элементами лантаноидов и актинидов сделали традиционную таблицу неуклюже широкой.
Трехмерный стол может включать эти более длинные строки, просто делая спираль шире.Канадский химик Фернандо Дюфур разработал ElemenTree, чтобы проиллюстрировать это (см. Фото). Он сделал каждый период в виде шестиугольного слоя, который содержал все элементы, которые обычно появляются в одном ряду на диаграмме двух башен. Подобные элементы по-прежнему выстраиваются вертикально.
Канадский химик Фернандо Дюфур разработал ElemenTree, показанный здесь, для обработки все более крупных «рядов» в виде кольца в этой трехмерной периодической «таблице».
Ingenium / Канадские музеи науки и техники / Ingenium
Но стол в форме дерева – не единственный трехмерный ответ.В 1950-х годах учительница химии Дженни Клаусон использовала цилиндр для своего стола. Но вместо того, чтобы выпирать лишние элементы, она подтянула некоторые из них к центру.
Еще одна проблема со столом с двумя башнями заключается в том, куда поместить водород и гелий. Например, водород иногда действует больше как металл. Он сбрасывает свой электрон и притягивает отрицательно заряженные ионы. В других случаях он действует как неметалл, захватывает лишний электрон и становится отрицательно заряженным. Затем он действует больше как фтор или хлор и поглощает положительные ионы.
Чтобы учесть это, химик Теодор Бенфей создал в 1960-х годах плоский спиральный столик. Он поместил водород и гелий в центр большого синего круга. Каждая из трех внешних спиц внутри круга представляет собой группу похожих элементов. Чтобы включить более крупные элементы и возрастающие периодические циклы, он добавил террасы, выступающие из круга. К ним относятся переходные металлы, лантаноиды и актиниды.
Плоский стол, такой как башни-близнецы, удобно повесить на стену или распечатать в книге.Однако Лич добавляет: «На самом деле нет причин, по которым таблица Менделеева не является трехмерной».
Развлечения и игры?Одно из последних дополнений к растущей библиотеке периодических таблиц поступило от Европейского химического общества (ECS). Компания ECS, расположенная в Брюсселе, Бельгия, стремится привлечь внимание к относительной нехватке многих важных элементов. В нем отмечается, что в обычный сотовый телефон входит 30 элементов. И многие из этих элементов не являются широко доступными.
Одна из новейших таблиц была разработана Европейским химическим обществом. Он показывает каждый «блок» на диаграмме, размер которого соответствует его относительной численности или редкости на Земле. Показанная здесь на английском языке таблица также имеет версии на 32 других языках, включая галисийский, иврит, шотландский гэльский, русский и китайский (мандаринский).
Европейское химическое общество (CC BY-ND)
«Нам необходимо внимательно изучить нашу склонность к выбрасыванию и ненадлежащей переработке таких предметов», – утверждает ECS.«Если не будут предложены решения, мы рискуем увидеть, что многие природные элементы, из которых состоит окружающий нас мир, закончатся – будь то из-за ограниченных запасов, их расположения в зонах конфликтов или нашей неспособности полностью их переработать».
ECS признает, что этот новый стол «заставляет задуматься». И это не случайно. Он хочет, чтобы люди поняли, как важно не тратить зря «исчезающие элементы». В нем говорится, что каждый должен «задаться вопросом, действительно ли необходимы обновления наших телефонов и других электронных устройств.«И когда наша электроника умирает, – говорится в документе, -« нам нужно убедиться, что мы перерабатываем », чтобы относительно дефицитные элементы« не попадали на свалки и не загрязняли окружающую среду ».
Чтобы изучить, как люди используют элементы, ECS разработала бесплатную онлайн-видеоигру Elementary Escapades.
«Есть много места для новых периодических таблиц», – говорит Лич из Манчестера. Фактически, он стал хобби собирать новые и размещать их в Интернете. Он также всегда ищет старых.«Я, наверное, получаю новый каждую неделю», – говорит он.
Scerri также попросил студентов разработать новые. «У каждого из них, – говорит он, – есть свои собственные достоинства».
Периодическая таблица элементов обращается 150 | WUWM 89,7 FM
Может быть, вы почувствовали некую химию с 2019 годом, но не знаете почему? Может быть, это потому, что в этом году исполняется 150 лет Периодической таблице элементов. Он считается основополагающим документом современной химии, который вы, возможно, изучали в школе.
Профессор химии UW-Madison Бассам Шахашири знает как историю стола, так и его современную актуальность. Он говорит, что таблица появилась в результате сотрудничества нескольких ученых, но большую заслугу заслуживает Дмитрий Менделеев.
«Димитрий Менделеев, русский химик, он предложил – иногда люди говорят, что он обнаружил – образец аналогичного поведения [определенных элементов] и систематизировал их», – объясняет Шахашири.
Что касается современной актуальности и того, как меняется использование элементов, Шахашири цитирует литий (символ Li) в таблице: «Литиевые батареи очень полезны для нас.Литий также используется в медицине для различных целей ».
Шахашири также отмечает, что свинец (символ Pb) менее популярен, чем во времена Менделеева. В настоящее время свинец часто рассматривается как загрязнитель почвы и воды.
Полный текст разговора Чака Квирмбаха и Бассама Шахашири из WUWM можно найти здесь:
Бассам Шахашири: Менделеев, русский химик, читал курс, писал свои лекции и пытался написать книгу по неорганической химии. химическое поведение веществ.И ему пришло в голову, что, возможно, существует образец повторяющегося сходства в поведении определенных элементов. И вот что он сделал. Он предположил, что иногда люди говорят, что он обнаружил образец подобного поведения и расположил элементы в соответствии с их атомным весом. Позже оказалось, что это не совсем так, но в науке так. Мы изучаем периодическую таблицу как элементы, расположенные в соответствии с атомным номером, который является целым числом, целым числом. Это количество протонов в атоме этого элемента.Таким образом, они варьируются от одного, который представляет собой элемент водород, до элемента 118, который представляет собой общее количество элементов в периодической таблице на сегодняшний день,
Чак Квирмбах: Создал ли он это и другие, которые, безусловно, могут способствовать это, они пытались служить какой-то индустрии, как производители пушек?
Shakhashiri: Все мы люди от природы любопытны. Мы задаем вопросы, всевозможные вопросы. Знаешь, почему небо голубое? Мы проводим наблюдения и пытаемся понять смысл этих наблюдений, и в этом вся суть науки.Речь идет об исследовании поведения, естественного поведения и попытках описать словами, языком и символами, какой может быть образец поведения. Так что это действительно результат любопытства. Это не должно было служить какой-либо другой цели, но любопытство ведет к открытиям, а открытие ведет к применению.
Quirmbach: Какие приложения взлетели?
Шахашири: Сказочные приложения. Когда элементы были расположены в этой таблице в периодической таблице, сразу же было легко увидеть, что есть недостающие элементы, которые еще не были обнаружены, которые не были идентифицированы.Итак, начался поиск, чтобы найти их, идентифицировать и охарактеризовать их. Это было очень, очень важным следствием размещения элементов в таком организованном виде, который мы называем периодической таблицей. Позже, когда мы перешли к так называемым тяжелым элементам, к элементам, которые имеют 92 протона или более, например, к урану. Затем, когда люди начали теоретизировать, вносить предложения, ученые говорили, что, может быть, мы сможем синтезировать элементы, из которых мы сможем создать новые элементы, и трансурановые элементы были синтезированы несколькими людьми.Одна группа в Калифорнийском университете в Беркли, возглавляемая ученым Гленном Сиборгом, приступила к созданию новых элементов. И Гленн Сиборг предположил, что, возможно, должно быть больше элементов, о которых мы не знаем, и другие ученые не только в Соединенных Штатах, но и в России и других странах провели серьезные эксперименты, которые привели к идентификации некоторых из этих синтетических элементов. На самом деле они не были обнаружены. Они были созданы, они синтезированы, и, что интересно, некоторые из этих тяжелых элементов не имеют долгого срока службы, они распадаются, выделяют энергию и распадаются.У них очень стабильные, у некоторых время жизни порядка секунд. И это еще одно следствие этих открытий и того, как разработать технологию для обнаружения этих преобразований, так что это очень, очень интригующее и очень полезное занятие. Как вы понимаете, это тоже очень сложно, но именно здесь проявляется награда, награда.
Quirmbach: И напомните мне синтетические элементы, которые тоже есть на столе, не так ли?
Shakhashiri: Это элементы в последней строке, которые вы видите внизу таблицы.Их делают группы ученых, мужчин и женщин. И это еще один аспект, который я хочу включить в этот разговор. Как названы эти элементы. Первоначально элементы были названы, многие из них, большинство из них, в честь местоположения, региона, где они были изолированы и обнаружены, но с новыми синтетическими элементами эта заслуга принадлежит людям, которые первыми идентифицировали их. А потом идет много проверок. Есть интернациональная группа. Он называется Международный союз чистой и прикладной химии.Эта организация имеет последнее слово по поводу наименования элемента, о котором группа заявляет, что она обнаружила, опять же, я намеренно использую слово обнаружено, здесь они синтезируют. Но кто знает, может быть, во Вселенной есть какие-то из этих элементов, но время их жизни очень короткое. Но затем Международный союз чистой и прикладной химии, после очень тщательного изучения, принимает окончательное решение о названии элементов и, конечно, силе в периодической таблице в соответствии со своим атомным номером.
Quirmbach: Можете ли вы утверждать, что этот стол все еще полезен сегодня не только учителям и классам?
Шахашири: Конечно, это полезно, и иногда учителя в классе используют его не так, как нужно.Это не просто запоминание названий и символов этих элементов. Подумайте о моделях поведения и о том, как химические и физические свойства различных веществ, с которыми мы сталкиваемся, связаны друг с другом. Я знаю, что во многих классах, если люди говорят запомнить, я обычно говорил в классе: запомни названия и символы первых 36 элементов периодической таблицы, первое задание на моих первокурсниках на курсах химии в UW-Мэдисоне, и студенты говорили: хорошо , почему я должен запоминать, и я сказал, потому что, когда вы говорите об элементе калий, вы должны знать, что он представлен символом K, а не символом P, символ P относится к фосфору.Таким образом, периодическая таблица Менделеева как организованное средство химического поведения может быть поучительно использована, чтобы научить студентов осознавать ее красоту. Это то, за что я выступаю не только в своем собственном обучении, но и на семинарах, которые я провожу с учителями, с другими и с общественностью в целом. Таким образом, периодическая таблица элементов, периодическая таблица элементов могут быть использованы с пользой гораздо, гораздо важнее, чем запоминание имен и символов, но знание того, что они обозначают, является идентичностью элемента.Почему символы калия K? Почему элементы в периодической таблице расположены столбцами? Какая модель поведения? Как это соотносится со структурой электронов вне ядра? Все виды прекрасных проявлений можно распознать и правильно использовать.
Quirmbach: Давайте рассмотрим этот пример немного подробнее о K и калии, он больше связан по вертикали с натрием над ним или с кальцием справа от него? Другими словами, группировки более вертикальны или горизонтальны, или немного того и другого?
Шахашири: Корреляции есть повсюду.Это очень хороший вопрос, Чак. Шаблон, о котором я говорил, – это вертикальный узор. По химическим свойствам соединения лития, натрия, калия, рубидия и цезия очень похожи друг на друга. Есть периодическое повторение. Вот почему она называется периодической таблицей, если есть периодичность в отношениях между калием и кальцием, которая находится рядом с ней на горизонтальной линии. То, что находится на горизонтальной линии, проходит через периодическую таблицу, где количество электронов начинает увеличиваться по мере того, как вы двигаетесь слева направо за таблицей.И вы можете видеть, что из-за того, что атомный номер отличается, атомный номер увеличивается. Таким образом, количество электронов должно возрасти. Итак, прелесть периодической таблицы в том, что элементы, расположенные в столбцах вверх и вниз, обладают схожими свойствами. Но есть и общие черты внутри группы.
Quirmbach: Вы когда-нибудь задумывались о том, как изображения или популярные изображения некоторых из этих элементов изменились с годами. Я думаю, что, например, свинец и фосфор в наши дни часто рассматриваются как загрязнители в воде и других местах.Литий, о котором в детстве я мало что знал, а сейчас мы слышим о большом количестве лития, используемого в батареях. Это хороший способ взглянуть на эту таблицу, в которой элементы менялись, часто использовались и отображались?
Shakhashiri: Ну, наше собственное осознание меняется, и это снова возвращается к тому, что происходит в классе, а также к тому, что происходит при популяризации понимания науки. Итак, литиевые батареи нам очень пригодятся. Литий также используется в медицине для различных целей.Лид на моем сайте saifan.org, у меня есть одностраничное описание свойств лида. Свинец – коварное вещество. Итак, понимание свойств, пользы и опасностей – очень важная часть того, что мы делаем в науке и что мы делаем в обществе. Поэтому очень важно задать вопрос, почему левая нога вообще оказалась в бензине? Именно для улучшения детонации в двигателях была добавлена антидетонационная присадка. Но потом мы обнаружили, что это имеет очень плохие последствия для окружающей среды и здоровья.Таким образом, лозунг был такой: «Уйти вперед и найти других замену». Периодические таблицы могут найти много полезного. И всем нам интересно задавать вопросы, которые вы здесь задаете.
Quirmbach: Ну, почти мой последний вопрос: мы на 118 прямо сейчас. Знаете ли вы, что могут быть добавлены другие люди, пытающиеся синтезировать больше. Все они будут синтетическими или будут добавлены так называемые натуральные?
Shakhashiri: Что ж, это было одно из предсказаний, которые сделали Гленн Сиборг, его группа и другие, не только один человек.что может быть другой набор, другая серия элементов, атомный номер которых очень, очень велик, может быть, вы знаете, вплоть до 137, может быть, даже выше, что было бы стабильно, но не было обнаружено пока и не синтезированы. Это то, о чем мы все должны подумать и дать возможность ученым, которые являются специалистами в этих областях, и оказать им поддержку, обдумывать и разрабатывать эксперименты, методы и технологии для исследования прекрасного сложного мира, в котором мы живем.
Quirmbach: Потому что между 118 и 137 может быть что-то очень ценное, вылечивающее множество проблем, ваша надежда?
Шахашири: Кто знает, поэтому мы проводим эксперименты, чтобы удовлетворить свое любопытство, и когда мы сможем сделать открытия, я искренне надеюсь и желаю, чтобы мы использовали эти открытия с пользой. Как только вы что-то обнаруживаете, вы должны принять решение о том, как использовать это с пользой, и я надеюсь и искренне желаю, чтобы все научно-технические открытия находили хорошее применение.
Д-р Лоуренс и г-жа Ханна Гудман оказывают поддержку в области отчетности по инновациям.
У вас есть вопрос об инновациях в Висконсине, который вы бы хотели изучить из WUWM Чак Квирмбах? Отправьте его ниже.
_
Что такое таблица Менделеева?
Getty ImagesВозможно, вы не использовали периодическую таблицу Менделеева, но, скорее всего, вы ее видели.
Он известен во всем мире, и когда он был создан, он стал огромным шагом вперед, помогая ученым понять мир вокруг нас.
В 2019 году исполняется 150 лет со дня его изобретения. Что это такое и почему это так важно?
Что такое таблица Менделеева?
Чтобы наслаждаться сайтом CBBC Newsround в лучшем виде, вам необходимо включить JavaScript.
Учитель химии Кристи объясняет, что такое таблица Менделеева.Элементы – это строительные блоки всего в мире.
В зависимости от температуры они могут быть твердыми, жидкими или газообразными.
Большинство из них встречается в природе, например, кислород, золото, медь, углерод и гелий.
Таблица Менделеева – это способ упорядочить все эти химические элементы и сопоставить их вместе.
Getty ImagesКаждый квадрат на столе состоит из числа и букв.
Буквы – это химическое название элемента, например, кислород – это O, а золото – это на самом деле Au.
Число является атомным числом.
Атомы – это мельчайшие частицы химического элемента, которые могут существовать.
В настоящее время известно 118 элементов, но считается, что только 94 из них естественным образом существуют на Земле.
К сожалению, вы не видите это действие!
Чтобы наслаждаться Newsround в лучшем виде, вам необходимо включить JavaScript.
Если вы не видите интерактивное действие на этой странице, щелкните здесь.
Почему периодическая таблица называется периодической таблицей?
Она называется периодической таблицей из-за расположения элементов.
Вы заметите, что они расположены в строках и столбцах.
Горизонтальные строки (идущие слева направо) называются «точками», а вертикальные столбцы (идущие сверху вниз) называются «группами».
Супер-открытия науки
Кто создал периодическую таблицу?
В 1869 году русский ученый Дмитрий Менделеев изобрел периодическую систему, которую мы используем до сих пор.
До него другие пытались «упорядочить» элементы, но их таблицы были неполными или сгруппированы элементы вместе, которые не были похожи.
Таблица Дмитрия не включала все элементы, потому что не все они были известны в то время.
Он оставил для них пробелы и мог предсказать их свойства на основе элементов вокруг них в своей таблице.
SSPL / Print CollectorДмитрий Менделеев изобрел периодическую таблицу в 1869 году.
Почему периодическая таблица так важна?
Все – включая людей! – состоят из элементов, поэтому очень важно их понимать.
Когда таблица Дмитрия была впервые создана, она помогла ученым в этом, и это делается до сих пор.
Периодическая таблица также означает, что ученые могут предсказывать свойства материи на Земле – и в остальной части Вселенной.
Он был назван «одним из самых значительных достижений науки» Организацией Объединенных Наций, которая постановила, что 2019 год является международным годом Периодической таблицы химических элементов!
Getty Images.