Строение атома кадмия (Cd), схема и примеры
Общие сведения о строении атома кадмия
Относится к элементам d-семейства. Металл. Обозначение – Cd. Порядковый номер – 48. Относительная атомная масса – 112,41 а.е.м.
Электронное строение атома кадмия
Атом кадмия состоит из положительно заряженного ядра (+48), внутри которого есть 48 протонов и 64 нейтрона, а вокруг, по пяти орбитам движутся 48 электронов.
Рис.1. Схематическое строение атома кадмия.
Распределение электронов по орбиталям выглядит следующим образом:
+48Cd)2)8)18)18)2;
1s22s22p63s23p63d104s24p64d105s2.
Валентными электронами атома кадмия считаются электроны, расположенные на 4d— и 5s-орбиталях. Энергетическая диаграмма основного состояния принимает следующий вид:
Валентные электроны атома кадмия можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
|
Подуровень |
n |
l |
ml |
s |
|
s |
5 |
0 |
0 |
+1/2 |
|
s |
5 |
0 |
0 |
-1/2 |
|
d |
4 |
2 |
-2 |
+1/2 |
|
|
4 |
2 |
-1 |
+1/2 |
|
d |
4 |
2 |
0 |
+1/2 |
|
d |
4 |
2 |
+1 |
+1/2 |
|
d |
4 |
2 |
+2 |
+1/2 |
|
d |
4 |
2 |
-2 |
-1/2 |
|
d |
4 |
2 |
-1 |
-1/2 |
|
d |
4 |
2 |
0 |
-1/2 |
|
d |
4 |
2 |
+1 |
-1/2 |
|
d |
4 |
2 |
+2 |
-1/2 |
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Строение атома. Строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева

Атом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. В центре атома находится положительно заряженное ядро. Оно занимает ничтожную часть пространства внутри атома, в нём сосредоточены весь положительный заряд и почти вся масса атома.
Ядро состоит из элементарных частиц — протона и нейтрона; вокруг атомного ядра по замкнутым орбиталям движутся электроны.
Протон (р) — элементарная частица с относительной массой 1,00728 атомной единицы массы и зарядом +1 условную единицу. Число протонов в атомном ядре равно порядковому номеру элемента в Периодической системе Д.И. Менделеева.
Нейтрон (n) — элементарная нейтральная частица с относительной массой 1,00866 атомной единицы массы (а. е. м.).
Число нейтронов в ядре N определяют по формуле:
где А — массовое число, Z — заряд ядра, равный числу протонов (порядковому номеру).
Обычно параметры ядра атома записывают следующим образом: слева внизу от символа элемента ставят заряд ядра, а вверху — массовое число, например:
Эта запись показывает, что заряд ядра (следовательно, и число протонов) для атома фосфора равен 15, массовое число равно 31, а число нейтронов равно 31 – 15 = 16. Так как массы протона и нейтрона очень мало отличаются друг от друга, то массовое число приблизительно равно относительной атомной массе ядра.
Электрон ( е–) — элементарная частица с массой 0,00055 а. е. м. и условным зарядом –1. Число электронов в атоме равно заряду ядра атома (порядковому номеру элемента в Периодической системе Д.И. Менделеева).
Электроны движутся вокруг ядра по строго определённым орбиталям, образуя так называемое электронное облако.
Область пространства вокруг атомного ядра, где наиболее (90 и более %) вероятно нахождение электрона, определяет форму электронного облака.
Электронное облако s-электрона имеет сферическую форму; на s-энергетическом подуровне может максимально находиться два электрона.
Электронное облако p-электрона имеет гантелеобразную форму; на трёх p-орбиталях максимально может находиться шесть электронов.
Орбитали изображают в виде квадрата, сверху или снизу которого пишут значения главного и побочного квантовых чисел, описывающих данную орбиталь. Такую запись называют графической электронной формулой, например:
В этой формуле стрелками обозначают электрон, а направление стрелки соответствует направлению спина — собственного магнитного момента электрона. Электроны с противоположными спинами ↑↓ называют спаренными.
Электронные конфигурации атомов элементов можно представить в виде электронных формул, в которых указывают символы подуровня, коэффициент перед символом подуровня показывает его принадлежность к данному уровню, а степень у символа — число электронов данного подуровня.
В таблице 1 приведено строение электронных оболочек атомов первых 20 элементов Периодической системы химических элементов Д.И. Менделеева.
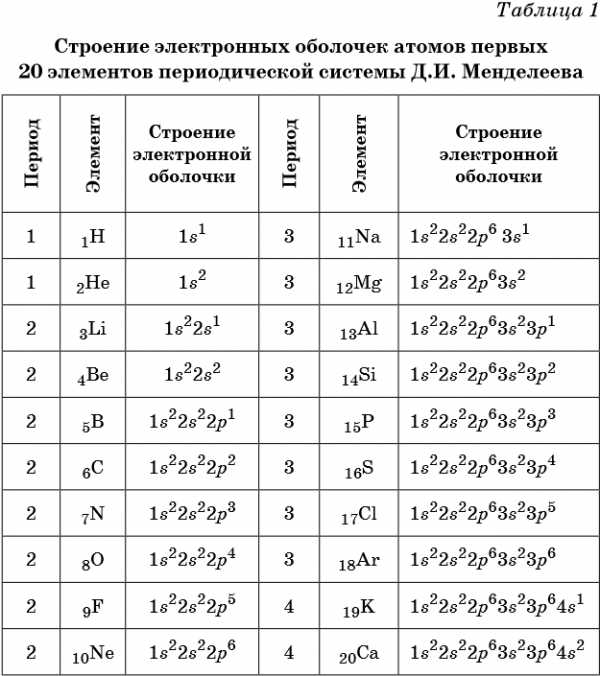
Химические элементы, в атомах которых s-подуровень внешнего уровня пополняется одним или двумя электронами, называют s-элементами. Химические элементы, в атомах которых заполняется p-подуровень (от одного до шести электронов), называют p-элементами.
Число электронных слоёв в атоме химического элемента равно номеру периода.
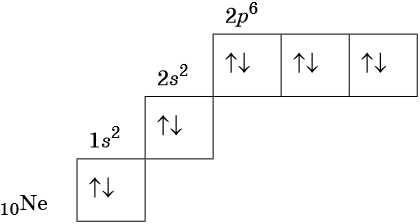
В соответствии с правилом Хунда электроны располагаются на однотипных орбиталях одного энергетического уровня таким образом, чтобы суммарный спин был максимален. Следовательно, при заполнении энергетического подуровня каждый электрон прежде всего занимает отдельную ячейку, а только после этого начинается их спаривание. Например, у атома азота все p-электроны будут находиться в отдельных ячейках, а у кислорода начнётся их спаривание, которое полностью закончится у неона.

Изотопами называют атомы одного и того же элемента, содержащие в своих ядрах одинаковое число протонов, но различное число нейтронов.
Изотопы известны для всех элементов. Поэтому атомные массы элементов в периодической системе являются средним значением из массовых чисел природных смесей изотопов и отличаются от целочисленных значений. Таким образом, атомная масса природной смеси изотопов не может служить главной характеристикой атома, а следовательно, и элемента. Такой характеристикой атома является заряд ядра, определяющий число электронов в электронной оболочке атома и её строение.
Рассмотрим несколько типовых заданий по этому разделу.
Пример 1. Атом какого элемента имеет электронную конфигурацию 1s22s22p63s23p64s1?
- Li
- Na
- K
- Cl
На внешнем энергетическом уровне у данного элемента находится один 4s-электрон. Следовательно, этот химический элемент находится в четвёртом периоде первой группе главной подгруппе. Этот элемент — калий.
К этому ответу можно прийти по-другому. Сложив общее количество всех электронов, получим 19. Общее число электронов равно порядковому номеру элемента. Под номером 19 в периодической системе находится калий.
Пример 2. Химическому элементу соответствует высший оксид RO2. Электронной конфигурации внешнего энергетического уровня атома этого элемента соответствует электронная формула:
- ns2np4
- ns2np2
- ns2np3
- ns2np6
По формуле высшего оксида (смотрите на формулы высших оксидов в Периодической системе) устанавливаем, что этот химический элемент находится в четвёртой группе главной подгруппы. У этих элементов на внешнем энергетическом уровне находятся четыре электрона — два s и два p. Следовательно, правильный ответ 2.
Тренировочные задания
1. Общее число s-электронов в атоме кальция равно
1) 20
2) 40
3) 8
4) 6
2. Число спаренных p-электронов в атоме азота равно
1) 7
2) 14
3) 3
4) 4
3. Число неспаренных s-электронов в атоме азота равно
1) 7
2) 14
3) 3
4) 4
4. Число электронов на внешнем энергетическом уровне атома аргона равно
1) 18
2) 6
3) 4
4) 8
5. Число протонов, нейтронов и электронов в атоме 94Be равно
1) 9, 4, 5
2) 4, 5, 4
3) 4, 4, 5
4) 9, 5, 9
6. Распределение электронов по электронным слоям 2; 8; 4 — соответствует атому, расположенному в(во)
1) 3-м периоде, IА группе
2) 2-м периоде, IVА группе
3) 3-м периоде, IVА группе
4) 3-м периоде, VА группе
7. Химическому элементу, расположенному в 3-м периоде VA группе соответствует схема электронного строения атома
1) 2, 8, 6
2) 2, 6, 4
3) 2, 8, 5
4) 2, 8, 2
8. Химический элемент с электронной конфигурацией 1s22s22p4 образует летучее водородное соединение, формула которого
1) ЭН
2) ЭН2
3) ЭН3
4) ЭН4
9. Число электронных слоёв в атоме химического элемента равно
1) его порядковому номеру
2) номеру группы
3) числу нейтронов в ядре
4) номеру периода
10. Число внешних электронов в атомах химических элементов главных подгрупп равно
1) порядковому номеру элемента
2) номеру группы
3) числу нейтронов в ядре
4) номеру периода
11. Два электрона находятся во внешнем электронном слое атомов каждого из химических элементов в ряду
1) He, Be, Ba
2) Mg, Si, O
3) C, Mg, Ca
4) Ba, Sr, B
12. Химический элемент, электронная формула которого 1s22s22p63s23p64s1, образует оксид состава
1) Li2O
2) MgO
3) K2O
4) Na2O
13. Число электронных слоев и число p-электронов в атоме серы равно
1) 2, 6
2) 3, 4
3) 3, 16
4) 3, 10
14. Электронная конфигурация ns2np4 соответствует атому
1) хлора
2) серы
3) магния
4) кремния
15. Валентные электроны атома натрия в основном состоянии находятся на энергетическом подуровне
1) 2s
2) 2p
3) 3s
4) 3p
16. Атомы азота и фосфора имеют
1) одинаковое число нейтронов
2) одинаковое число протонов
3) одинаковую конфигурацию внешнего электронного слоя
4) одинаковое число электронов
17. Одинаковое число валентных электронов имеют атомы кальция и
1) калия
2) алюминия
3) бериллия
4) бора
18. Атомы углерода и фтора имеют
1) одинаковое число нейтронов
2) одинаковое число протонов
3) одинаковое число электронных слоёв
4) одинаковое число электронов
19. У атома углерода в основном состоянии число неспаренных электронов равно
1) 1
3) 3
2) 2
4) 4
20. В атоме кислорода в основном состоянии число спаренных электронов равно
1) 2
3) 4
2) 8
4) 6
Ответы
himi4ka.ru
Строение атома стронция (Sr), схема и примеры
Общие сведения о строении атома стронция
Относится к элементам s-семейства. Металл. Обозначение – Sr. Порядковый номер – 38. Относительная атомная масса – 87,62 а.е.м.
Электронное строение атома стронция
Атом стронция состоит из положительно заряженного ядра (+38), внутри которого есть 38 протонов и 50 нейтронов, а вокруг, по пяти орбитам движутся 38 электронов.
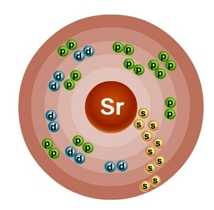
Рис.1. Схематическое строение атома стронция.
Распределение электронов по орбиталям выглядит следующим образом:
1s22s22p63s23p63d104s24p65s2.
Внешний энергетический уровень атома стронция содержит 2 электрона, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
Валентные электроны атома стронция можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s
|
Подуровень |
n |
l |
ml |
s |
|
s |
5 |
0 |
0 |
+1/2 |
|
s |
5 |
0 |
0 |
-1/2 |
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Строение атома, химическая связь, валентность и строение молекул
(Конспект лекций)
Строение атома. Введение.
Объектом изучения в химии являются химические элементы и их соединения. Химическим элементом называют совокупность атомов с одинаковым положительным зарядом. Атом – это наименьшая частица химического элемента, сохраняющая его химические свойства. Связываясь, друг с другом, атомы одного или разных элементов образуют более сложные частицы – молекулы. Совокупность атомов или молекул образуют химические вещества. Каждое индивидуальное химическое вещество характеризуется набором индивидуальных физических свойств, такими как температуры кипения и плавления, плотностью, электро- и теплопроводностью и т.п.
1. Строение атома и Периодическая система элементов
Д.И. Менделеева.
Знание и понимание закономерностей порядка заполнения Периодической системы элементов Д.И. Менделеева позволяет понять следующее:
1.физическую суть существования в природе определенных элементов,
2.природу химической валентности элемента,
3.способность и “лёгкость” элемента отдавать или принимать электроны при взаимодействии с другим элементом,
Строение атома.
Атом представляет собой сложную микросистему находящихся в движении и взаимодействующих друг с другом элементарных частиц.
В конце 19 и начале 20 веков было установлено, что атомы состоят из более мелких частиц: нейтронов, протонов и электронов, Последние две частицы являются заряженными частицами, протон несет на себе положительный заряд, электрон – отрицательный. Поскольку атомы элемента в основном состоянии электронейтральны, то это означает, что число протонов в атоме любого элемента равно числу электронов. Масса атомов определяется суммой массы протонов и нейтронов, количество которых равна разности массы атомов и его порядкового номера в периодической системе Д.И. Менделеева.
В 1926 г Шрёдингер предложил описывать движение микрочастиц в атоме элемента при помощи выведенного им волнового уравнения. При решении волнового уравнения Шрёдингера для атома водорода появляются три целочисленных квантовых числа: n, ℓ и mℓ, которые характеризуют состояние электрона в трёхмерном пространстве в центральном поле ядра. Квантовые числа n, ℓ и mℓ принимают целочисленные значения. Волновая функция, определяемая тремя квантовыми числами n, ℓ и mℓ и получаемая в результате решения уравнения Шрёдингера, называется орбиталью. Орбиталь – это область пространства, в котором наиболее вероятно нахождение электрона, принадлежащего атому химического элемента. Таким образом, решение уравнения Шредингера для атома водорода приводит к появлению трёх квантовых чисел, физический смысл которых состоит в том, что они характеризуют три разного вида орбиталей, которые может иметь атом. Рассмотрим более подробно каждое квантовое число.
Главное квантовое число n может принимать любые положительные целочисленные значения: n = 1,2,3,4,5,6,7…Оно характеризует энергию электронного уровня и размер электронного ″облака″. Характерно, что номер главного квантового числа совпадает с номером периода, в котором находится данный элемент.
Азимутальное или орбитальное квантовое число ℓ может принимать целочисленные значения от ℓ = 0….до n – 1 и определяет момент движения электронов, т.е. форму орбитали. Для различных численных значений ℓ используют следующие обозначения: ℓ = 0, 1, 2, 3, и обозначаются символами s, p, d, f, соответственно для ℓ = 0, 1, 2 и 3. В периодической системе элементов нет элементов со спиновым числом ℓ = 4.
Магнитное квантовое число mℓ характеризует пространственное расположение электронных орбиталей и, следовательно, электромагнитные свойства электрона. Оно может принимать значения от – ℓ до + ℓ, включая нуль.
Форма или, точнее, свойства симметрии атомных орбиталей зависят от квантовых чисел ℓ и mℓ. “Электронное облако”, соответствующее s – орбитали имеет, имеет форму шара (при этом ℓ= 0).
Рис.1. 1s-орбиталь
Орбитали, определяемые квантовыми числами ℓ = 1 и mℓ = -1, 0 и +1, называются р-орбиталями. Поскольку mℓ при этом имеет три разных значений, то атом при этом имеет три энергетически эквивалентные р-орбитали (главное квантовое число для них одно и тоже и может иметь значение n =2,3,4,5,6 или 7). р-Орбитали обладают осевой симметрией и имеют вид объёмных восьмёрок, во внешнем поле ориентированных по осям x, y и z (рис.1.2). Отсюда и происхождение символики px, py и pz.
Рис.2. рx, py и pz-орбитали
Кроме того, имеются d- и f- атомные орбитали, для первых ℓ = 2 и mℓ = -2, -1, 0, +1 и +2, т.е. пять АО, для вторых ℓ = 3 и mℓ = -3, -2, -1, 0, +1, +2 и +3, т.е. 7 АО.
Четвёртое квантовое ms называется спиновым квантовым числом, было введено для объяснения некоторых тонких эффектов в спектре атома водорода Гаудсмитом и Уленбеком в 1925г. Спин электрона – это угловой момент заряженной элементарной частицы электрона, ориентация которого квантована, т.е. строго ограничена определёнными углами. Эта ориентация определяется значением спинового магнитного квантового числа (s), которое для электрона равно ½, поэтому для электрона согласно правилам квантования ms = ± ½. В связи с этим к набору из трёх квантовых чисел следует добавить квантовое число ms. Подчеркнём еще раз, что четыре квантовых числа определяют порядок построения периодической таблицы элементов Менделеева и объясняют, почему в первом периоде только два элемента, во втором и в третьём – по восемь, – в четвёртом – 18 и т д. Однако, чтобы объяснить строение многоэлектронных атомов, порядок заполнения электронных уровней по мере увеличения положительного заряда атома недостаточно иметь представления о четырёх квантовых числах, “управляющих” поведением электронов при заполнении электронных орбиталей, но необходимо знать ещё некоторые простые правила, а именно, принцип Паули, правило Гунда и правила Клечковского.
Согласно принципа Паули в одном и том же квантовом состоянии, характеризуемом определенными значениями четырёх квантовых чисел, не может находиться более одного электрона. Это означает, что один электрон можно в принципе поместить на любую атомную орбиталь. Два электрона могут находиться на одной атомной орбитали только в том случае, если они отличаются спиновыми квантовыми числами.
При заполнении электронами трёх р-АО, пяти d-AO и семи f-AO следует руководствоваться кроме принципа Паули ещё и правилом Гунда: Заполнение орбиталей одной подоболочки в основном состоянии происходит электронами с одинаковыми спинами.
При заполнении подоболочек (p, d, f)абсолютное значение суммы спинов должно быть максимальной.
Правило Клечковского. Согласно правилу Клечковского при заполнении d и f орбиталией электронами должен соблюдаться принцип минимальной энергии. Согласно этому принципу электроны в основном состоянии заполняют орбитали с минимальными уровнями энергии. Энергию подуровня определяют сумма квантовых чисел n + ℓ = Е.
Первое правило Клечковского: сначала заполняются те подуровни, для которых n + ℓ = Е минимальна.
Второе правило Клечковского: в случае равенства n + ℓ для нескольких подуровней идёт заполнение того подуровня, для которого n минимальна.
В настоящее время известно 109 элементов.
2. Энергия ионизации, сродство к электрону и электроотрицательность.
Важнейшими характеристиками электронной конфигурации атома являются энергия ионизации (ЭИ) или потенциал ионизации (ПИ) и сродство атома к электрону (СЭ). Энергией ионизации называют изменение энергии в процессе отрыва электрона от свободного атома при 0 К: А =+ + ē .Зависимость энергии ионизации от порядкового номера Z элемента, размера атомного радиуса имеет ярко выраженный периодический характер.
Сродство к электрону (СЭ), представляет собой изменение энергии, которым сопровождается присоединение электрона к изолированному атому с образованием отрицательного иона при 0 К: А + ē = А– (атом и ион находятся в своих основных состояниях). При этом электрон занимает низшую свободную атомную орбиталь (НСАО), если ВЗАО занята двумя электронами. СЭ сильно зависит от их орбитальной электронной конфигурации.
Изменения ЭИ и СЭ коррелируют с изменением многих свойств элементов и их соединений, что используется для предсказания этих свойств по значениям ЭИ и СЭ. Наиболее высоким по абсолютной величине сродством к электрону обладают галогены. В каждой группе периодической таблице элементов потенциал ионизации или ЭИ уменьшается с увеличением номера элемента, что связано с увеличением атомного радиуса и с увеличением количества электронных слоев и что хорошо коррелирует с увеличением восстановительной способности элемента.
В таблице 1 Периодической системы элементов приведены значения ЭИ и СЭ в эВ/на атом. Отметим, что точные значения СЭ известны лишь для немногих атомов, их величины подчёркнуты в таблице 1.
Таблица 1
Первая энергия ионизации (ЭИ), сродство к электрону (СЭ) и электроотрицательность χ) атомов в периодической системе.
ЭИ СЭ χ r | 1 H 13.60 0.747 2.10 0,37 | 2 He 24.58 0.077 – 1,22 | ||||||||||||||||
ЭИ СЭ χ r | 3 Li 5.39 0.54 0.98 1.55 | 4 Be 9.32 -0.3 1.57 1.13 | 5 B 8.30 0.2 2.04 0.91 | 6 C 11.26 1.25 2.55 0.77 | 7 N 14.54 -0.1 3.04 0,55 | 8 O 13.62 1.47 3.44 0.59 | 9 F 17.42 3.45 3.98 0.64 | 10 Ne 21.56 – 1,60 | ||||||||||
ЭИ СЭ χ r | 11 Na 5.14 0.74 0.93 1.89 | 12 Mg 7.64 -0.3 1.31 1.60 | 13 Al 5.98 0.6 1.61 1.43 | 14 Si 8.15 1.63 1.90 1.34 | 15 P 10.55 0.7 1.90 1.13 | 16 S 10.36 2.07 2.19 1.04 | 17 Cl 13.01 3.61 3.16 0.99 | 18 Ar 15.76 – 1,92 | ||||||||||
ЭИ СЭ χ r | 19 K 4.34 0.502 0.82 2.36 | 20 Ca 6.11 –0.6 1.00 1.97 | 21 Sc 6.54 -0.4 1.36 1.64 | 22 Ti 6.82 0.08 1.54 1.46 | 23 V 6.74 0.53 1.66 1.34 | 24 Cr 6.76 0.67 1.66 1.27 | 25 Mn 7.43 -1.2 1.55 1.30 | 26 Fe 7.90 0.15 1.8 1.26(α) | 27 Co 7.86 0.66 1.88 1.25 | 28 Ni 7.63 1.16 1.91 1.24 | 29 Cu 7.72 1.23 1.90 1.28 | 30 Zn 9.39 -0.9 1.65 1.39 | 31 Ga 6./00 0.18 1.81 1,39 | 32 Ge 7.88 1.2 2.011 1,39 | 33 As 9.81 0.6 2.18 1,48 | 34 Se 9.75 2.07 2.55 1,60 | 35 Br 11.84 3.36 2.96 1.14 | 36 Kr 14.00 – 1,98 |
ЭИ СЭ χ r | 37 Rb 4.18 0.4859 0.82 2.48 | 38 Sr 5.69 -0.5 0.95 2.15 | 39 Y 6.38 0.31 1.22 1.81 | 40 Zr 6.84 0.43 1.33 1.60 | 41 Nb 6.88 0.89 1.6 1.45 | 42 Mo 7.10 0.75 2.16 1.39 | 43 Tc 7.28 0.6 1.9 1.36 | 44 Ru 7.36 1.1 2.28 1.33 | 45 Rh 7.46 1.14 2.2 1.34 | 46 Pd 8.33 0.56 2.20 1.38 | 47 Ag 7.574 1.30 1.93 1.44 | 48 Cd 8.99 -0.6 1.69 1.56 | 49 In 5.79 0.2 1.78 1.66 | 50 Sn 7.34 1.11 1.96 1.58 | 51 Sb 8.64 1.1 2.05 1.61 | 52 Te 9.01 2.2 2.1 1.70 | 53 I 10.45 3.06 2.66 1.33 | 54 Xe 12.13 – 2,18 |
ЭИ СЭ χ r | 55 Cs 3.89 0.4716 0.79 2.67 | 56 Ba 5.21 0.89 2,21 | 57 La 5.58 0.5 1.10 1,87 | 72 Hf 7.5 1.3 1,59 | 73 Ta 7.89 0.32 1.5 1.46 | 74 W 7.98 0.82 2.36 1.40 | 75 Re 7.88 0.15 1.9 1.37 | 76 Оs 8.73 1.4 2.2 1.35 | 77 Ir 9.05 1.57 2.2 1.36 | 78 Pt 8.96 2.13 2.28 1.38 | 79 Au 9.23 2.31 2.54 1.44 | 80 Hg 10.44 2.00 1,60 | 81 Tl 6.11 0.3 2.04 1,71 | 82 Pb 7.42 0.37 2.33 1.75 | 83 Bi 12.25 0.95 2.02 1,82 | 84 Po 8.42 1.9 2.0 1.67 | 85 At 9.0 2.9 2.2 | 86 Rn 1038 |
χ – электроотрицательность по Полингу
r– атомный радиус, (из «Лабораторные и семинарские занятия по общей и неорганической химии» , Н.С. Ахметов, М.К. Азизова, Л.И. Бадыгина)
studfiles.net
3.Состав и строение атома. Электронное строение атома. Орбиталь.
Атом – это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Атом состоит из ядра (оно имеет положительный заряд) и электронов (они имеют отрицательный заряд). В целом атом электронейтрален.
Положительный заряд ядра атома равен порядковому номеру химического элемента.
Ядро атома – сложная частица. В ядре сосредоточена почти вся масса атома.
Заряд ядра определяют протоны. Причем число протонов равно (по величине) заряду ядра атома, т.е. порядковому номеру.
Число нейтронов N определяют по разности между величинами: «масса ядра» А и «порядковый номер» Z.
электроны, имеющие приблизительно равный запас энергии, находятся на приблизительно равном расстоянии от ядра и образуют энергетический уровень.
Изотопами называют атомы одного и того же химического элемента (одинаковое число протонов), различающиеся массой (разное число нейтронов).
Изотопы и их химические соединения отличаются друг от друга по физическим свойствам, но химические свойства у изотопов одного химического элемента одинаковы.
Форма атома – сферическая. Радиус ядра примерно в 100000 раз меньше радиуса атома.
Химический элемент – вид атомов (совокупность атомов) с одинаковым зарядом ядра (с одинаковым числом протонов в ядре).
Изотоп – совокупность атомов одного элемента с одинаковым числом нейтронов в ядре (или вид атомов с одинаковым числом протонов и одинаковым числом нейтронов в ядре).
Разные изотопы отличаются друг от друга числом нейтронов в ядрах их атомов.
Строение электронной оболочки атома
Атомная орбиталь – состояние электрона в атоме. Условное обозначение орбитали – . Каждой орбитали соответствует электронное облако.
Орбитали реальных атомов в основном состоянии бывают четырех типов: s, p, d и f.
Электронное облако – часть пространства, в которой электрон можно обнаружить с вероятностью 90 (или более) процентов.
Примечание: иногда понятия “атомная орбиталь” и “электронное облако” не различают, называя и то, и другое “атомной орбиталью”.
Электронная оболочка атома слоистая. Электронный слой образован электронными облаками одинакового размера. Орбитали одного слоя образуют электронный (“энергетический”) уровень, их энергии одинаковы у атома водорода, но различаются у других атомов.
Однотипные орбитали одного уровня группируются в электронные (энергетические) подуровни:
s-подуровень (состоит из одной s-орбитали), условное обозначение – .
p-подуровень (состоит из трех p-орбиталей), условное обозначение – .
d-подуровень (состоит из пяти d-орбиталей), условное обозначение – .
f-подуровень (состоит из семи f-орбиталей), условное обозначение – .
Энергии орбиталей одного подуровня одинаковы.
Порядок заполнения электронами орбиталей атома определяется тремя законами природы (формулировки даны упрощенно):
1. Принцип наименьшей энергии – электроны заполняют орбитали в порядке возрастания энергии орбиталей.
2. Принцип Паули – на одной орбитали не может быть больше двух электронов.
3. Правило Хунда – в пределах подуровня электроны сначала заполняют свободные орбитали (по одному), и лишь после этого образуют электронные пары.
Общее число электронов на электронном уровне (или в электронном слое) равно 2n2.
Распределение подуровней по энергиям выражается рядом (в прядке увеличения энергии):
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p .
Валентные электроны – электроны атома, которые могут принимать участие в образовании химических связей. У любого атома это все внешние электроны плюс те предвнешние электроны, энергия которых больше, чем у внешних. Например: у атома Ca внешние электроны – 4s2, они же и валентные; у атома Fe внешние электроны – 4s2, но у него есть 3d6, следовательно у атома железа 8 валентных электронов. Валентная электронная формула атома кальция – 4s2, а атома железа – 4s23d6.
Орбиталь – пространство вокруг ядра, в котором наиболее вероятно нахождение электрона. Применительно к электрону можно сказать, что он ведет себя и как частица, и как волна, т. е. обладает, как и другие микрочастицы, корпускулярно-волновым дуализмом (двойственностью). С одной стороны, электроны как частицы производят давление, с другой стороны, движущийся поток электронов обнаруживает волновые явления, например дифракцию электронов.
studfiles.net
Строение атома
Федеральное агентство по образованию
Кубанский государственный технологический университет
Институт нефти, газа, энергетики и безопасности
Кафедра неорганической химии
Неорганическая химия
Конспект лекций
До конца 19 века считалось, что атомы являются неделимыми час-тицами, однако открытие катодных лучей, термоэлектронной эмиссии, фо-тоэффекта, явления радиоактивности, говорило о том, что атом частица сложная. В начале ХХ века появляются первые модели строения атома, которые были предложены Резерфордом, Бором, Зоммерфельдом, однако недостатком всех этих теорий было то, что их авторы пытались применить к микрообъектам законы классической механики, которым они не подчиняют-ся.
Было установлено что атом состоит из ядра и электронной оболочки. Ядро имеет положительный заряд. Величина заряда определяется числом протонов. Каждый протон имеет единичный положительный заряд. Кроме протонов в состав ядра входят электронейтральные частицы – нейтроны. Их общее название – нуклоны.
Число нуклонов называется массовым числом атомов, его обозначают символом А:
А=Z+N
где Z- число протонов, а N- число нейтронов.
Массовое число приблизительно равно массе атома, так как масса электронов незначительна, и ею можно пренебречь. Порядковый номер элемента в таблице Менделеева соответствует числу протонов в ядре (Z), т.е. он соответствует заряду ядра, следовательно разность между массовым числом (А) и его порядковым номером является числом нейтронов (N).
N=A-Z
Для одного и того же элемента атом всегда содержит определённое число протонов, а число нейтронов является различным. Значит один и тот же элемент может иметь разные массовые числа. Атомы, имеющие одинаковое число протонов (Z), но разное число нейтронов (N), называются изотопами.
Массовые числа элементов, указываемые в периодической таблице, яв-ляются средней арифметической величиной масс всех изотопов элементов и поэтому часто имеют дробные значения.
Ядро атома не участвует в химических реакциях. Химические свойства элементов определяются только числом электронов и строением их элект-ронной оболочки.
Современная теория строения атома базируется на законах квантовой механики, одним из важнейших положений которой является представле-ние о двойственной природе быстро движущихся микрообъектов , которые проявляют себя и как частицы, и как волны. Впервые дуализм свойств мик-рочастиц был установлен в 1905 году Энштейном для квантов света, в 1924 году Луи де Бройль распространил эти представления на все микрочастицы, в том числе и на электроны. Математическое выражение уравнения Луи де Бройль имеет вид :
υ = h / mv
Двойственная природа электрона приводит к тому, что его движение не может быть описано определенной траекторией, траектория размывается, возникает « полоса неопределенности» в которой находится электрон, чем точнее мы будем стараться определить его местонахождения, тем меньше узнаем о скорости его движения. Второй закон квантово-волновой теории формулируется следующим образом : Невозможно одновременно с любой заданной точностью определить координаты электрона и его скорость.
Одной из основных характеристик движущегося электрона является волновая функция (пси). Сама волновая функция физического смысла не имеет, а 2 показывает вероятность нахождения электрона в данной точке пространства. Более точным является выражение 2 dv -это веро-ятность нахождения электрона в элементарном объеме dv , она оценивается уравнением Шреденгера :
Н = Е ,
где Н – оператор Гамельтона, указывающий на последовательность операций с .
Данное уравнение имеет несколько решений, т.е. квантуется, однако волновая функция должна удовлетворять ряду условий : она должна быть однозначной, конечной, непрерывной и нормируемой.
В качестве модели состояния электрона в атоме в квантовой механике принято представление об электронном облаке. Пространство вокруг ядра, пребывание электрона в котором составляет 80 % называется атомной орби-талью. Волновая функция, являющаяся решением уравнения Шреденгера есть атомная орбиталь.
Волновая функция всегда содержит безразмерные параметры, кото-рые могут принимать ряд целочисленных значений. Эти величины называ-ются квантовыми числами.
n – главное квантовое число, характеризует запас энергии на энергетическом уровне и размеры атомной орбитали. Изменяется от 1 до 7, в электронных формулах обозначается арабскими цифрами;
l – орбитальное квантовое число, характеризует запас энергии на подуровне и форму атомной орбитали. Изменяется от 0 до (n – 1), принимает n значений, в электронных формулах обозначается латинскими буквами s- ( l = 0) , p- ( l =1 ),d- (l = 2 ) , f ( l = 3 ).
Электроны s-подуровня имеют орбиталь в виде полного шара, р-подуровня в виде объемной восьмерки, а d-подуровня имеют две формы орбиталей: веретена и розетки, у f-электронов орбитали имеют более сложную форму.
m – магнитное квантовое число, показывает число ориентаций атомных орбиталей в пространстве. Изменяется от –l до + l через 0, принимает
(2l + 1) значений. Так шарообразная s-орбиталь может иметь только одну ориентацию, а р – три ориентации , d –пять , f – семь.
Отсюда следует, что s – подуровень состоит из одной орбитали, р-подуровень – из трех орбиталей , d – из пяти орбиталей, f – подуровень из семи орбиталей.
s – спиновое квантовое число показывает направление вращения электрона вокруг своей оси, принимает два значения, равные + 1/ 2.
СТРОЕНИЕ ЭЛЕКТРОННЫХ ОБОЛОЧЕК АТОМОВ
Состояние электрона в многоэлектронных атомах всегда отвечает закону, сформулированному Паули : в атоме не может быть даже двух электронов, обладающих одинаковым набором всех четырех квантовых чисел. Это говорит о том, что на атомной орбитале может находится не более двух электронов.
Электронная оболочка имеет упорядоченное строение. Она состоит из электронных уровней (слоев), число которых равно номеру периода. В соответствии с принципом Паули максимальное число электронов на энергетическом уровне равно 2n2.
Каждый уровень, кроме первого, делится на подуровни. Число подуровней равно номеру уровня, максимальное число электронов на подуровне-2( 2l +1).
Чем выше расположен уровень, тем больше энергия его электронов.
Наименьшей энергией обладают электроны первого уровня а наибольшей -внешнего уровня. Наиболее устойчиво состояние атома, в котором электроны имеют наименьшую энергию.
Заполнение электронной оболочки происходит в соответствии с тремя правилами:
1. Заполнение электронной оболочки происходит в порядке возрастания энергии уровней (принцип наименьших энергий) .
2. Заполнение подуровней происходит в соответствии с правилом Клечковского :
– электроны заполняют тот подуровень для которого сумма значений главного и орбитального квантовых числе наименьшая;
– если сумма значений главного и орбитального квантовых чисел одинакова, то электроны заполняют тот подуровень для которого меньше значение главного квантового числа.
Отсюда следует следующий порядок заполнения уровней и подуровней : 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
3. Порядок заполнения атомных орбиталей происходит в соответствии с правилом Хунда : электроны заполняют атомные орбитали таким образом чтобы спин был максимальным.
Например:
+15 Р 1s2 2s2 2p63s2 3p3
+25 Mn 1s2 2s2 2p6 3s2 3p33d5 4s2
Приведённые формулы называются полными электронными формулами элемента. В зависимости от того электроны какого подуровня заполняются у данного элемента, они делятся на s-,p-,d– , f– элементы.
К s-элементам относятся элементы главных подгрупп первой и второй групп, р-элементы – это элементы главных подгрупп всех остальных групп. К d-элементам относятся элементы побочных подгрупп, а к f-элементам – лантаноиды и актиноиды.
Обычно используют сокращённые электронные формулы, содержащие только электроны валентного уровня, число которых равно номеру группы. ( для элементов главных подгрупп валентными являются электроны последнего энергетического уровня, для элементов побочных подгрупп последнего s и предпоследнего d).
Эти формулы используют для определения валентных возможностей атома. Их легко составить, зная период и группу атома. Например, бром-это элемент четвертого периода седьмой группы главной подгруппы, поэтому его сокращенная электронная формула: +35Вr…4s2 4p5 ; ванадий элемент четвертого периода пятой группы побочной подгрупп : +23V …3d3 4s2
2. Электронно-графические формулы
Эти схемы используют для определения валентных возможностей
атома. Уровни и подуровни должны располагаться в соответствии с их энергией: чем выше подуровень, тем выше его располагают. Орбитали изоб-ражают квадратиком или черточкой .
Например: Е 3d
17Cl…3s2 3p5
3p
3s
studfiles.net
Структура и принципы строения атома
Как известно, все материальное во Вселенной состоит из атомов. Атом – это мельчайшая единица материи, которая несет в себе ее свойства. В свою очередь, структура атома складывается из волшебного триединства микрочастиц: протонов, нейтронов и электронов.
При этом каждая из микрочастиц универсальна. То есть, не найти на свете двух разных протонов, нейтронов или электронов. Все они абсолютно друг на друга похожи. И свойства атома будут зависеть только от количественного состава этих микрочастиц в общем строении атома.
Например, структура атома водорода состоит из одного протона и одного электрона. Следующий по сложности, атом гелия состоит из двух протонов, двух нейтронов и двух электронов. Атом лития — из трех протонов, четырех нейтронов и трех электронов и т. д.
 Структура атомов (слева направо): водорода, гелия, лития
Структура атомов (слева направо): водорода, гелия, литияАтомы соединяются в молекулы, а молекулы — в вещества, минералы и организмы. Молекула ДНК, являющаяся основой всего живого – структура, собранная из тех же трех волшебных кирпичиков мироздания, что и камень, лежащий на дороге. Хотя эта структура и намного более сложная.
Еще более удивительные факты открываются тогда, когда мы пытаемся поближе рассмотреть пропорции и строение атомной системы. Известно, что атом состоит из ядра и электронов, двигающихся вокруг него по траектории, описывающей сферу. То есть это даже нельзя назвать движением в обычном понимании этого слова. Электрон скорее находится везде и сразу в пределах этой сферы, создавая вокруг ядра электронное облако и формируя электромагнитное поле.
Схематические изображения строения атомаЯдро атома состоит из протонов и нейтронов, и в нем сосредоточена почти вся масса системы. Но при этом, само ядро настолько мало, что если увеличить его радиус до масштаба в 1 см, то радиус всей структуры атома достигнет сотни метров. Таким образом, все, что мы воспринимаем как плотную материю, более чем на 99% состоит из одних только энергетических связей между физическими частицами и менее чем 1% — из самих физических форм.
Но что представляют собой эти физические формы? Из чего они состоят, и насколько они материальны? Чтобы ответить на эти вопросы, давайте подробнее рассмотрим структуры протонов, нейтронов и электронов. Итак, мы спускаемся еще на одну ступеньку в глубины микромира – на уровень субатомных частиц.
Из чего состоит электрон
Самая маленькая частица атома – электрон. Электрон обладает массой, но при этом не обладает объемом. В научном представлении электрон не из чего не состоит, а представляет собой бесструктурную точку.
Под микроскопом электрон невозможно увидеть. Он наблюдаем только в виде электронного облака, которое выглядит как размытая сфера вокруг атомного ядра. При этом с точностью, где находится электрон в момент времени, невозможно сказать. Приборы же способны запечатлеть не саму частицу, а только лишь ее энергетический след. Суть электрона не вкладывается в представления о материи. Он скорее подобен некой пустой форме, существующей только в движении и за счет движения.
 Атом водорода под микроскопом. В центре ядро, состоящее из одного протона и электронное облако вокруг.
Атом водорода под микроскопом. В центре ядро, состоящее из одного протона и электронное облако вокруг.Никакой структуры в электроне до сих пор не было обнаружено. Он является такой же точечной частицей, как и квант энергии. Фактически, электрон — и есть энергия, однако, это более устойчивая ее форма, нежели та, которая представлена фотонами света.
В настоящий момент электрон считают неделимым. Это понятно, ведь невозможно разделить то, что не имеет объема. Однако в теории уже есть наработки, согласно которым в составе электрона лежит триединство таких квазичастиц как:
- Орбитон – содержит информацию об орбитальном положении электрона;
- Спинон – ответственен за спин или вращательный момент;
- Холон – несет информацию о заряде электрона.
Впрочем, как видим, квазичастицы с материей уже не имеют абсолютно ничего общего, и несут в себе одну только информацию.
 Фотографии атомов разных веществ в электронный микроскоп
Фотографии атомов разных веществ в электронный микроскопИнтересно, что электрон может поглощать кванты энергии, например, света или тепла. В этом случае атом переходит на новый энергетический уровень, а границы электронного облака расширяются. Бывает и такое, что энергия, поглощаемая электроном настолько велика, что он может выскочить из системы атома, и далее продолжить свое движение как независимая частица. При этом он ведет себя подобно фотону света, то есть, он будто бы перестает быть частицей и начинает проявлять свойства волны. Это было доказано в эксперименте.
Эксперимент Юнга
В ходе эксперимента на экран с двумя прорезанными в нем щелями был направлен поток электронов. Проходя через эти прорези, электроны сталкивались с поверхностью еще одного – проекционного – экрана, оставляя на нем свой след. В результате такой «бомбардировки» электронами на проекционном экране появлялась интерференционная картина, подобная той, которая появилась бы, если бы через две прорези проходили бы волны, но не частицы.
Такой рисунок возникает из-за того, что волна, проходя между двух щелей, делится на две волны. В результате дальнейшего движения волны накладываются друг на друга, и на некоторых участках происходит их взаимное гашение. В результате мы получаем много полос на проекционном экране, вместо одной, как это было бы, если бы электрон вел себя как частица.
 Интерференционная картина
Интерференционная картинаСтруктура ядра атома: протоны и нейтроны
Протоны и нейтроны составляют ядро атома. И притом, что в общем объеме ядро занимает менее 1%, именно в этой структуре сосредоточена почти вся масса системы. А вот на счет структуры протонов и нейтронов физики разделились во мнениях, и на данный момент существует сразу две теории.
- Теория №1 — Стандартная
Стандартная модель говорит о том, что протоны и нейтроны состоят из трех кварков, соединенных между собой облаком глюонов. Кварки являются точечными частицами, так же, как кванты и электроны. А глюоны – это виртуальные частицы, обеспечивающие взаимодействие кварков. Однако в природе так и не было найдено ни кварков, ни глюонов, потому эта модель поддается жестокой критике.
- Теория №2 — Альтернативная
А вот по альтернативной теории единого поля, разработанной Эйнштейном, протон, как и нейтрон, как и любой другая частица физического мира, представляет собой вращающееся со скоростью света электромагнитное поле.
 Электромагнитные поля человека и планеты
Электромагнитные поля человека и планетыКаковы же принципы строения атома?
Все в мире – тонкое и плотное, жидкое, твердое и газообразное – это лишь энергетические состояния бесчисленных полей, пронизывающих пространство Вселенной. Чем выше уровень энергии в поле, тем оно тоньше и неуловимей. Чем ниже энергетический уровень, тем оно более устойчивое и ощутимое. В структуре атома, как и в структуре любой другой единицы Вселенной, лежит взаимодействие таких полей – разных по энергетической плотности. Выходит, основа всего – энергия, а материя – только иллюзия ума.
Понравилась статья? Поддержите автора!
Структура и принципы строения атома
5 (100%) 3 votestaynoe.com
