Что можно узнать из периодической системы химических элементов Д. И. Менделеева (кратко) | Химия. Шпаргалка, шпора, формула, закон, ГДЗ, опыты, тесты, сообщение, реферат, кратко, конспект, книга
Тема: Периодическая система
| Рис. 6.2. В клеточках периодической системы содержится информация о химических элементах |
Периодическая система Д. И. Менделеева — важный источник информации о химических элементах.
В клеточках периодической системы химических элементов Д.И. Менделеева кроме порядковых номеров, названий и буквенных символов для каждого химического элемента указана его относительная атомная масса.
Из периодической системы можно многое узнать о химических элементах. Например, порядковый номер химического элемента равен количеству протонов в ядре его атома. То есть, кроме относительной атомной массы, уже сейчас можно определять для каждого химического элемента величину заряда ядра его атома и, учитывая электронейтральность атома, количество электронов в пространстве вокруг его ядра. Материал с сайта http://worldofschool.ru
Найдем в периодической системе химический элемент фтор (рис. 6.2). Из надписей в клеточке узнаем, что относительная атомная масса фтора равна округленно 19. Порядковый номер фтора 9. А значит величина заряда ядра его атома составляет +9. В ядре атома фтора содержится 9 протонов, пространство вокруг ядра занимают 9 электронов.
На этой странице материал по темам:Пачему разное света системи менделева
Определи относительные атомные массы кислорода, кальция, серы.
10 фактов о периодической таблице Менделеева, которые вы не знали

Вероятно, все вы видели периодическую таблицу элементов. Возможно, что она и по сей день преследует вас в ваших снах, а может быть, она пока для вас всего лишь визуальный фон, украшающий стенку школьного класса. Однако в этой, казалось бы, случайной коллекции клеток кроется значительно больше, чем это кажется на первый взгляд.
Периодическая таблица (или ПТ, как мы будем периодически называть её в этой статье), а также те элементы, которые входят в неё, обладают чертами, о которых вы, возможно, никогда не догадывались. Вот десять фактов, начиная от создания таблицы и до внесения в неё последних элементов, которые большинству людей не известны.
10. Менделееву помогали

Периодическая таблица стала использоваться, начиная с 1869 года, когда она была составлена заросшим густой бородой Димитрием Менделеевым. Большинство людей думает, что Менделеев был единственным, кто работал над этой таблицей, и благодаря этому он стал самым гениальным химиком столетия. Однако его усилиям помогали несколько европейских учёных, которые внесли важный вклад в завершение этого колоссального набора элементов.
Менделеев широко известен как отец периодической таблицы, но, когда он её составлял, ещё не все элементы таблицы были уже открыты. Как такое стало возможно? Учёные славятся своим безумием…
9. Последние добавленные элементы
Верьте или нет, периодическая таблица не сильно менялась с 1950-х годов. Однако 2 декабря 2016 года было добавлено сразу четыре новых элемента: нихоний (элемент №113), московий (элемент №115), тенессин (элемент №117) и оганесон (элемент №118). Эти новые элементы получили свои названия только в июне 2016 года, так как потребовалась пятимесячная экспертиза, прежде чем их официально добавили в ПТ.
Три элемента получили свои названия в честь городов или государств, в которых их удалось получить, а оганесон был назван в честь российского физика-ядерщика Юрия Оганесяна за его вклад в получение этого элемента.
8. Какой буквы нет в таблице?

В латинском алфавите есть 26 букв, и каждая из них важна. Однако Менделеев решил этого не замечать. Взгляните на таблицу и скажите, какой букве не повезло? Подсказка: ищите по порядку и загибайте при этом пальцы после каждой найденной буквы. В итоге вы найдёте «пропавшую» букву (если у вас на руках присутствуют все десять пальцев). Догадались? Это буква под номером 10, буква «J».
Говорят, что «единица» – это цифра одиноких. Так, может, стоило бы назвать букву «J» буквой одиноких? Но вот забавный факт: большинство мальчиков, родившихся в США в 2000 году, получили имена, начинавшиеся с этой буквы. Таким образом, эта буква не осталась без должного внимания.
7. Синтезированные элементы

Как вы, возможно, уже знаете, на сегодняшний день в периодической таблице присутствует 118 элементов. Можете ли вы догадаться, сколько элементов из этих 118 были получены лабораторным путём? Из всего общего списка в природных условиях можно найти лишь 90 элементов.
Вам кажется, что 28 искусственно созданных элементов – это много? Ну, просто поверьте на слово. Их синтезируют, начиная с 1937 года, и учёные продолжают это делать и сейчас. Все эти элементы вы можете найти в таблице. Посмотрите на элементы с 95 по 118, все эти элементы отсутствуют на нашей планете и были синтезированы в лабораториях. То же касается и элементов под номерами 43, 61, 85 и 87.
6. 137-й элемент

В середине 20-го века известный учёный по имени Ричард Фейнман сделал довольно громкое заявление, которое повергло в изумление весь научный мир нашей планеты. По его словам, если мы когда-нибудь обнаружим 137-й элемент, то мы не сможем определить количество в нём протонов и нейтронов. Число 1/137 примечательно тем, что это значение константы тонкой структуры, которая описывает вероятность поглощения или излучения электроном фотона. Теоретически элемент №137 должен иметь 137 электронов и 100-процентную вероятность поглощения фотона. Его электроны будут вращаться со скоростью света. Ещё более невероятно, что электроны элемента 139, чтобы существовать, должны вращаться быстрее, чем скорость света.
Вы ещё не устали от физики? Возможно, вам будет интересно узнать, что число 137 объединяет три важнейших области физики: теорию о скорости света, квантовую механику и электромагнетизм. С начала 1900-х годов физики предполагают, что цифра 137 может быть основой Великой единой теории, в которую войдут все три вышеуказанных области. По общему признанию, это звучит так же невероятно, как легенды о НЛО и о Бермудском треугольнике.
5. Что можно сказать о названиях?

Почти все названия элементов имеют какой-то смысл, хотя он и не сразу понятен. Названия новым элементам даются не произвольно. Я бы назвал элемент просто первым пришедшим мне в голову словом. Например, «керфлумп». По-моему, неплохо.
Как правило, названия элементов относятся к одной из пяти основных категорий. Первая – это имена известных учёных, классический вариант – эйнштейний. Кроме того, элементы могут получить свои имена в зависимости от тех мест, где они были впервые зарегистрированы, например, германий, америций, галлий и т. д. В качестве дополнительной опции используются названия планет. Элемент уран был впервые обнаружен вскоре после того, как была открыта планета Уран. Элементы могут носить имена, связанные с мифологией, например, существует титан, названный так в честь древнегреческих титанов, и торий, названный по имени скандинавского бога-громовержца (или звёздного «мстителя», в зависимости от того, что вы предпочитаете).
И, наконец, есть названия, описывающие свойства элементов. Аргон происходит от греческого слова «аргос», что означает «ленивый» или «медленный». Из названия следует предположение, что этот газ не отличается активностью. Бром – это ещё один элемент, название которого происходит от греческого слова. «Бромос» означает «зловоние», и это довольно точно описывает запах брома.
4. Было ли создание таблицы «озарением»

Если вы любите карточные игры, то этот факт для вас. Менделееву требовалось каким-то образом упорядочить все элементы и найти систему для этого. Естественно, что для создания таблицы по категориям он обратился к пасьянсу (ну, а к чему же ещё?) Менделеев записал атомный вес каждого элемента на отдельной карточке, а затем приступил к раскладке своего передового пасьянса. Он укладывал элементы в соответствии с их специфическими свойствами, а затем упорядочивал их в каждом столбце в соответствии с их атомным весом.
Многие не могут сложить и обычный пасьянс, так что этот пасьянс впечатляет. Что будет дальше? Наверное, кто-нибудь с помощью шахмат сделает переворот в астрофизике или создаст ракету, способную долететь до окраин галактики. Представляется, что в этом не будет ничего необычного, если учесть, что Менделеев сумел получить такой гениальный результат всего лишь с помощью колоды обычных игральных карт.
3. Невезучие инертные газы

Помните, как мы классифицировали аргон как самый «ленивый» и «медленный» элемент в истории нашей вселенной? Похоже, что Менделеевым овладели такие же чувства. Когда в 1894 году впервые удалось получить чистый аргон, он не вписывался ни в один из столбцов таблицы, поэтому, вместо того чтобы заняться поисками решения, учёный решил просто отрицать его существование.
Ещё более поразительно, что аргон был не единственным элементом, который изначально постигла эта судьба. Помимо аргона, без классификации остались ещё пять других элементов. Это коснулось радона, неона, криптона, гелия и ксенона – и все отрицали их существование просто потому, что Менделеев не смог найти для них места в таблице. После нескольких лет перегруппировки и переклассификации этим элементам (названных инертными газами) всё-таки посчастливилось присоединиться к достойному клубу признанных реально существующими.
2. Атомная любовь

Совет для всех тех, кто считает себя романтиком. Возьмите бумажную копию периодической таблицы и вырежьте из неё все сложные и относительно ненужные средние столбцы так, чтобы у вас осталось 8 колонок (вы получите «короткую» форму таблицы). Сложите её посредине IV группы – и вы узнаете, какие элементы могут образовывать соединения друг с другом.
Элементы, которые «целуются» при складывании, способны образовывать стабильные соединения. Эти элементы имеют комплементарные электронные структуры, и они будут сочетаться друг с другом. И, если это не настоящая любовь, как у Ромео с Джульеттой или у Шрека с Фионой – тогда я не знаю, что такое любовь.
1. Углерод рулит

Углерод пытается быть в центре игры. Вы думаете, что всё знаете об углероде, но это не так, он занимает намного более важное место, чем вы это себе представляете. Знаете ли вы, что он присутствует более чем в половине всех известных соединений? И как насчёт того факта, что 20 процентов веса всех живых организмов приходится на углерод? Это действительно странно, но приготовьтесь: каждый атом углерода в вашем теле был когда-то частью фракции углекислого газа в атмосфере. Углерод является не только суперэлементом нашей планеты, он четвёртый по численности элемент во всей Вселенной.
Если периодическую таблицу сравнить с вечеринкой, то углерод – её главный ведущий. И кажется, что он единственный знает, как нужно всё правильно организовать. Ну и, помимо прочего, это основной элемент всех бриллиантов, так что при всей своей назойливости он ещё и блестит!
Перевод Дмитрия Оськина по статье с сайта listverse.comисточник
slavikap.livejournal.com
Как определить валентность по таблице Менделеева
Таблица Дмитрия Ивановича Менделеева – это многофункциональный справочный материал, по которому дозволено узнать самые нужные данные о химических элементах. Самое основное – знать основные тезисы ее «чтения», то есть надобно уметь положительно пользоваться этим информационным материалом, что послужит красивым подспорьем для решения всяких задач по химии. Тем больше что таблица является разрешенной на всех видах контроля познаний, включая даже ЕГЭ.

Вам понадобится
- Таблица Д.И.Менделеева, ручка, бумага
Инструкция
1. Таблица представляет собой конструкцию, в которой расположены химические элементы по своим тезисам и законам. То есть, дозволено сказать, что таблица – это многоэтажный «дом», в котором «живут» химические элементы, причем всякий их них имеет свою собственную квартиру под определенным номером. По горизонтали располагаются «этажи» — периоды, которые могут быть малые и огромные. Если период состоит из 2-х рядов (что указано сбоку нумерацией), то такой период именуется огромным. Если он имеет только один ряд, то именуется малым.
2. Также таблица поделена на «подъезды» — группы, которых каждого восемь. Как в любом подъезде квартиры находятся слева и справа, так и тут химические элементы располагаются по такому же тезису. Только в данном варианте их размещение неравномерно – с одной стороны огромнее элементов и тогда говорят о основной группе, с иной — поменьше и это свидетельствует о том, что группа побочная.
3. Валентность – это способность элементов образовывать химические связи. Существует валентность непрерывная, которая не меняется и переменная, имеющая разное значение в зависимости от того, в состав какого вещества входит элемент. При определении валентности по таблице Менделеева нужно обратить внимание на такие колляции: № группы элементы и ее тип (то есть основная либо побочная группа). Непрерывная валентность в этом случае определяется по номеру группы основной подгруппы. Дабы узнать значение переменной валентности (если таковая есть, причем, традиционно у неметаллов), то необходимо из 8 (каждого 8 групп – отсель такая цифра) вычесть № группы, в которой располагается элемент.
4. Пример № 1. Если посмотреть на элементы первой группы основной подгруппы (щелочные металлы), то дозволено сделать итог, что все они имеют валентность, равную I (Li, Na, К, Rb, Cs, Fr).
5. Пример № 2. Элементы 2-й группы основной подгруппы (щелочно-земельные металлы) соответственно имеют валентность II (Be, Mg, Ca, Sr, Ba, Ra).
6. Пример № 3. Если говорить о неметаллах, то скажем, Р (фосфор) находится в V группе основной подгруппы. Отсель его валентность будет равна V. Помимо этого фосфор имеет еще одно значение валентности, и для ее определения нужно исполнить действие 8 — № элемента. Значит, 8 – 5 (номер группы фосфора) = 3. Следственно, вторая валентность фосфора равна III.
7. Пример № 4. Галогены находятся в VII группе основной подгруппы. Значит, их валентность будет равна VII. Впрочем рассматривая, что это неметаллы, то надобно произвести арифметическое действие: 8 – 7 (№ группы элемента) = 1. Следственно, иная валентность галогенов равна I.
8. Для элементов побочных подгрупп (а к ним относятся только металлы) валентность необходимо запоминать, тем больше что в большинстве случае она равна I, II, реже III. Также придется заучить валентности химических элементов, которые имеют больше 2-х значений.
Со школы либо даже прежде весь знает, всё вокруг, включая и нас самих, состоит их атомов – наименьших и неделимых частиц. Вследствие способности атомов соединяться друг с ином, разнообразие нашего мира громадно. Способность эта атомов химического элемента образовывать связи с другими атомами называют валентностью элемента .
Инструкция
2. Для определения валентности элемента дозволено воспользоваться и формулой. Вестимо, что существует определенное соотношение между валентностью элемента , его равнозначной массой и молярной массой его атомов. Связь между этими качествами выражается формулой: Валентность = Молярная масса атомов/Эквивалентная масса. Потому что равнозначная масса – это то число, которое нужно для замещения одного моля водорода либо для реакции с одним молем водорода, то чем огромнее молярная масса в сопоставлении с массой равнозначной, тем большее число атомов водорода может заместить либо присоединить к себе атом элемента , а значит тем выше валентность.
3. Связь между химическими элемента ми имеет разную природу. Это может быть ковалентная связь, ионная, металлическая. Для образования связи атому нужно иметь: электрический заряд, неспаренный валентный электрон, свободную валентную орбиталь либо неподеленную пару валентных электронов. Совместно эти особенности определяют валентное состояние и валентные способности атома.
4. Зная число электронов атома, которое равно порядковому номеру элемента в Периодической системе элементов, руководствуясь тезисами наименьшей энергии,тезисом Паули и правилом Хунда дозволено возвести электронную конфигурацию атома. Эти построения дозволят проанализировать валентные вероятности атома. Во всех случаях, в первую очередь реализуются вероятности образовывать связи за счет наличия неспаренных валентных электронов, добавочные валентные способности, такие как свободная орбиталь либо неподеленная пара валентных электронов, могут остаться нереализованными, если на это неудовлетворительно энергии.И каждого вышесказанного дозволено сделать итог, что проще каждого определить валентность атома в каком-нибудь соединении, и значительно труднее узнать валентные способности атомов. Однако практика сделает простым и это.
Видео по теме

Вам понадобится
- таблица Менделеева
Инструкция
1. Водород и кислород принято считать одновалентным и двухвалентным элементами соответственно. Мерой валентности является число атомов водорода либо кислорода, которые элемент присоединяет для образования гидрида либо оксида.Пускай X — элемент, валентность которого необходимо определить. Тогда XHn — гидрид этого элемента, а XmOn — его оксид.Пример: формула аммиака — Nh4, тут у азота валентность 3. Натрий одновалентен в соединении Na2O.
2. Для определения валентности элемента необходимо умножить число атомов водорода либо кислорода в соединении на валентность водорода и кислорода соответственно, а после этого поделить на число атомов химического элемента, валентность которого находится.
3. Валентность элемента может быть определена и по иным атомам с вестимой валентностью. В разных соединениях атомы одного и того же элемента могут проявлять разные валентности. Скажем, сера двухвалентна в соединениях h3S и CuS, четырехвалентна в соединениях SO2 и SF4, шестивалентна в соединениях SO3 и SF6.
4. Максимальную валентность элемента считают равной числу электронов во внешней электронной оболочке атома. Максимальная валентность элементов одной и той же группы периодической системы обыкновенно соответствует ее порядковому номеру. К примеру, максимальная валентность атома углерода С должна быть равной 4.
Видео по теме
Для школьников постижение таблицы Менделеева — ужасный сон. Даже тридцать шесть элементов, которые обыкновенно задают преподаватели, оборачиваются часами утомительной зубрежки и головной болью. Многие даже не верят, что выучить таблицу Менделеева реально. Но использование мнемотехники способно гораздо облегчить жизнь школярам.

Инструкция
1. Разобраться в теории и предпочесть необходимую техникуПравила, облегчающие запоминание материала, именуются мнемоническими. Основная их хитрость — создание ассоциативных связей, когда абстрактная информация упаковывается в яркую картинку, звук либо даже запах. Существует несколько мнемонических техник. Скажем, дозволено написать рассказ из элементов запоминаемой информации, поискать созвучные слова (рубидий — рубильник, цезий — Юлий Цезарь), включить пространственное воображение либо легко зарифмовать элементы периодической таблицы Менделеева.
2. Баллада об азотеРифмовать элементы периодической таблицы Менделеева отличнее со смыслом, по определенным знакам: по валентности, скажем. Так, щелочные металлы рифмуются дюже легко и звучат, как песенка: «Литий, калий, натрий, рубидий, цезий франций». «Магний, кальций, цинк и барий — их валентность равна паре» — неувядающая классика школьного фольклора. На ту же тему: «Натрий, калий, серебро — одновалентное добродушно» и «Натрий, калий и аргентум — навечно одновалентны». Созидание в различие от зубрежки, которой хватает максимум на пару дней, стимулирует долговременную память. А значит, огромнее сказок про алюминий, стихов про азот и песен о валентности — и запоминание пойдет как по маслу.
3. Кислотный триллерДля упрощения запоминания придумывается история, в которой элементы таблицы Менделеева превращаются в героев, детали пейзажа либо сюжетные элементы. Вот, скажем, каждым знаменитый текст: «Азиат (Азот) стал лить (Литий) воду (Водород)в сосновый Бор (Бор). Но Не он (Неон) был нам надобен, а Магнолия (Магний)». Его дозволено дополнить историей о феррари (сталь — феррум), в которой ехал тайный шпион «Хлор нуль семнадцать» (17 — порядковый номер хлора), дабы поймать маньяка Арсения (мышьяк — арсеникум), у которого было 33 зуба (33 — порядковый номер мышьяка), но внезапно что-то кислое попало ему в рот (кислород), это было восемь отравленных пуль (8 — порядковый номер кислорода)… Продолжать дозволено до бесконечности. Кстати, роман, написанный по мотивам таблицы Менделеева, дозволено пристроить учительнице литературы в качестве экспериментального текста. Ей наверно понравится.
4. Возвести замок памятиЭто одно из наименований достаточно результативной техники запоминания, когда включается пространственное мышление. Секрет ее в том, что все мы можем без труда описать свою комнату либо путь от дома до магазина, школы, института. Для того, дабы запомнить последовательность элементов необходимо поместить их по дороге (либо в комнате), причем представить всякий элемент дюже ясно, зримо, ощутимо. Вот водород — худосочный блондин с вытянутым лицом. Работяга, тот, что кладет плитку — кремний. Группа дворян в драгоценный машине — инертные газы. И, безусловно, продавец воздушных шариков — гелий.
Обратите внимание!
Не необходимо принуждать себя запоминать информацию на карточках. Самое лучшее связать весь элемент с некоторым блестящим образом. Кремний — с Кремниевой долиной. Литий — с литиевыми батарейками в мобильном телефоне. Вариантов может быть уйма. Но комбинация визуального образа, механического запоминания, тактильного ощущения от шероховатой либо, напротив, гладкой глянцевой карточки, поможет без труда поднять самые мельчайшие детали из недр памяти.
Полезный совет
Дозволено нарисовать такие же карточки с информацией об элементах, как были в свое время у Менделеева, но только дополнить их нынешней информацией: числом электронов на внешнем ярусе, скажем. Все, что надобно, это раскладывать их перед сном.
Химия для всякого школьника начинается с таблицы Менделеева и фундаментальных законов. И теснее только потом, уяснив для себя, что же постигает эта трудная наука, дозволено приступать к составлению химических формул. Для грамотной записи соединения необходимо знать валентность атомов, составляющих его.

Инструкция
1. Валентность – способность одних атомов удерживать вблизи себя определенное число других и выражается она числом удерживаемых атомов. То есть, чем мощней элемент, тем огромнее у него валентность .
2. Для примера дозволено применять два вещества – HCl и h3O. Это классно знаменитые каждом соляная кислота и вода. В первом веществе содержится один атом водорода (H) и один атом хлора (Cl). Это говорит о том, в данном соединении они образуют одну связь, то есть удерживают вблизи себя один атом. Следственно, валентность и одного, и иного равна 1. Так же легко определить валентность элементов, составляющих молекулу воды. Она содержит два атома водорода и один атом кислорода. Следственно, атом кислорода образовал две связи для присоединения 2-х водородов, а они, в свою очередь, по одной связи. Значит, валентность кислорода равна 2, а водорода – 1.
3. Но изредка доводится сталкиваться с вещества ми больше трудными по строению и свойствам составляющих их атомов. Существует два типа элементов: с непрерывной (кислород, водород и др.) и непостоянной валентность ю. У атомов второго типа это число зависит от соединения, в состав которого они входят. В качестве примера дозволено привести серу (S). Она может иметь валентности 2, 4, 6 и изредка даже 8. Определить способность таких элементов, как сера, держать вокруг себя другие атомы, немножко труднее. Для этого нужно знать свойства других составляющих вещества .
4. Запомните правило: произведение числа атомов на валентность одного элемента в соединении должна совпадать с таким же произведением для иного элемента. Это дозволено проверить опять обратившись к молекуле воды (h3O):2 (число водорода) * 1 (его валентность ) = 21 (число кислорода) * 2 (его валентность ) = 22 = 2 – значит все определено правильно.
5. Сейчас проверьте данный алгорифм на больше трудном веществе, скажем, N2O5 – оксиде азота. Ранее указывалось , что кислород имеет непрерывную валентность 2, следственно дозволено составить уравнение:2 (валентность кислорода) * 5 (его число) = Х (неведомая валентность азота) * 2 (его число)Путем несложных арифметических вычислений дозволено определить, что валентность азота в составе данного соединения равна 5.
Валентность — это способность химических элементов держать определенное число атомов других элементов. В то же самое время, это число связей, образуемое данным атомом с другими атомами. Определить валентность довольно примитивно.

Инструкция
1. Возьмите на заметку, что обозначается показатель валентности римскими цифрами и ставится над знаком элемента.
2. Обратите внимание: если формула двухэлементного вещества написана верно, то,при умножении числа атомов всякого элемента на его валентность, у всех элементовдолжны получиться идентичные произведения.
3. Примите к сведению, что валентность атомов одних элементов непрерывна, а других — переменна, то есть, имеет качество меняться. Скажем, водород во всех соединениях одновалентен, от того что образует только одну связь. Кислород горазд образовывать две связи, являясь при этом двухвалентным. А вот у серы валентность может быть II, IV либо VI. Все зависит от элемента, с которым она соединяется. Таким образом, сера — элемент с переменной валентностью.
4. Подметьте, что в молекулах водородных соединений вычислить валентность дюже примитивно. Водород неизменно одновалентен, а данный показатель у связанного с ним элемента будет равняться числу атомов водорода в данной молекуле. К примеру, в Cah3 кальций будет двухвалентен.
5. Запомните основное правило определения валентности: произведение показателя валентности атома какого-нибудь элемента и числа его атомов в какой-нибудь молекуле неизменно равно произведению показателя валентности атома второго элемента и числа его атомов в данной молекуле.
6. Посмотрите на буквенную формулу, обозначающую это равенство: V1 x K1 = V2 x K2, где V — это валентность атомов элементов, а К — число атомов в молекуле. С ее подмогой легко определить показатель валентности всякого элемента, если вестимы остальные данные.
7. Разглядите пример с молекулой оксида серы SО2. Кислород во всех соединениях двухвалентен, следственно, подставляя значения в пропорцию: Vкислорода х Кислорода = Vсеры х Ксеры, получаем: 2 х 2 = Vсеры х 2. От сюда Vсеры = 4/2 = 2. Таким образом, валентность серы в данной молекуле равна 2.
Видео по теме
Открытие периодического закона и создание упорядоченной системы химических элементов Д.И. Менделеевым стали апогеем становления химии в XIX веке. Ученым был обобщен и классифицирован обширный материал умений о свойствах элементов.
Инструкция
1. В XIX веке не было никаких представлений о строении атома. Открытие Д.И. Менделеева являлось лишь обобщением опытных фактов, но их физический толк длинное время оставался непонятным. Когда возникли первые данные о строении ядра и разделении электронов в атомах, это дозволило взглянуть на периодический закон и систему элементов заново. Таблица Д.И. Менделеева дает вероятность наглядно проследить периодичность свойств элементов, встречающихся в природе.
2. Всякому элементу в таблице присвоен определенный порядковый номер (H — 1, Li — 2, Be — 3 и т.д.). Данный номер соответствует заряду ядра (числу протонов в ядре) и числу электронов, вращающихся вокруг ядра. Число протонов, таким образом, равно числу электронов, и это говорит о том, что в обыкновенных условиях атом электрически нейтрален.
3. Деление на семь периодов происходит по числу энергетических ярусов атома. Атомы первого периода имеют одноуровневую электронную оболочку, второго — двухуровневую, третьего — трехуровневую и т.д. При заполнении нового энергетического яруса начинается новейший период.
4. Первые элементы каждого периода характеризуются атомами, имеющими по одному электрону на внешнем ярусе, — это атомы щелочных металлов. Заканчиваются периоды атомами порядочных газов, имеющими всецело заполненный электронами внешний энергетический ярус: в первом периоде инертные газы имеют 2 электрона, в последующих — 8. Именно по причине схожего строения электронных оболочек группы элементов имеют сходные физико-химические свойства.
5. В таблице Д.И. Менделеева присутствует 8 основных подгрупп. Такое их число обусловлено максимально допустимым числом электронов на энергетическом ярусе.
6. Внизу периодической системы выделены лантаноиды и актиноиды в качестве независимых рядов.
7. С поддержкой таблицы Д.И. Менделеева дозволено пронаблюдать периодичность следующих свойств элементов: радиуса атома, объема атома; потенциала ионизации; силы сродства с электроном; электроотрицательности атома; степени окисления; физических свойств возможных соединений.
8. К примеру, радиусы атомов, если глядеть по периода, уменьшаются слева направо; растут сверху вниз, если глядеть по группы.
9. Отчетливо прослеживаемая периодичность расположения элементов в таблице Д.И. Менделеева осмысленно объясняется последовательным нравом заполнения электронами энергетических ярусов.
Периодический закон, являющийся основой нынешней химии и поясняющий обоснованности метаморфозы свойств химических элементов, был открыт Д.И. Менделеевым в 1869 году. Физический толк этого закона вскрывается при постижении трудного строения атома.

В XIX веке считалось, что ядерная масса является основной колляцией элемента, следственно для систематизации веществ применяли именно ее. Теперь атомы определяют и идентифицируют по величине заряда их ядра (числу протонов и порядковому номеру в таблице Менделеева). Однако, ядерная масса элементов за некоторыми исключениями (скажем, ядерная масса калия поменьше ядерной массы аргона) возрастает соизмеримо их заряду ядра.При увеличении ядерной массы отслеживается периодическое метаморфоза свойств элементов и их соединений. Это металличность и неметалличность атомов, ядерный радиус и объем, потенциал ионизации, сродство к электрону, электроотрицательность, степени окисления, физические свойства соединений (температуры кипения, плавления, плотность), их основность, амфотерность либо кислотность.
Сколько элементов в нынешней таблице Менделеева
Таблица Менделеева графически выражает открытый им периодический закон. В нынешней периодической системе содержится 112 химических элементов (последние – Мейтнерий, Дармштадтий, Рентгений и Коперниций). По последним данным, открыты и следующие 8 элементов (до 120 включительно), но не все из них получили свои наименования, и эти элементы пока еще немного в каких печатных изданиях присутствуют.Всякий элемент занимает определенную клетку в периодической системе и имеет свой порядковый номер, соответствующий заряду ядра его атома.
Как построена периодическая система
Структура периодической системы представлена семью периодами, десятью рядами и восемью группами. Весь период начинается щелочным металлом и заканчивается порядочным газом. Исключения составляют 1-й период, начинающийся водородом, и седьмой незавершенный период.Периоды делятся на малые и огромные. Малые периоды (1-й, 2-й, 3-й) состоят из одного горизонтального ряда, огромные (четвертый, пятый, шестой) – из 2-х горизонтальных рядов. Верхние ряды в огромных периодах именуются четными, нижние – нечетными.В шестом периоде таблицы позже лантана (порядковый номер 57) находятся 14 элементов, схожих по свойствам на лантан, – лантаноидов. Они вынесены в нижнюю часть таблицы отдельной строкой. То же самое относится и к актиноидам, расположенным позже актиния (с номером 89) и во многом повторяющим его свойства.Четные ряды крупных периодов (4, 6, 8, 10) заполнены только металлами.Элементы в группах проявляют идентичную высшую валентность в оксидах и других соединениях, и эта валентность соответствует номеру группы. Основные подгруппы вмещают в себя элементы мелких и крупных периодов, побочные – только крупных. Сверху вниз металлические свойства усиливаются, неметаллические – ослабевают. Все атомы побочных подгрупп – металлы.
Химический элемент селен относится к VI группе периодической системы Менделеева, он является халькогеном. Природный селен состоит из шести стабильных изотопов. Вестимо также 16 радиоактивных изотопов селена.

Инструкция
1. Селен считается дюже редким и рассеянным элементом, в биосфере он активно мигрирует, образуя больше 50 минералов. Самые знаменитые из них: берцелианит, науманнит, самородный селен и халькоменит.
2. Селен содержится в вулканической сере, галените, пирите, висмутине и других сульфидах. Его добывают из свинцовых, медных, никелевых и других руд, в которых он находится в рассеянном состоянии.
3. В тканях большинства живых существ содержится от 0,001 до 1 мг/кг селена, некоторые растения, морские организмы и грибы его концентрируют. Для ряда растений селен является нужным элементом. Надобность человека и звериных в селене составляет 50-100 мкг/кг пищи, данный элемент владеет антиоксидантными свойствами, влияет на уйма ферментативных реакций и повышает чувствительность сетчатки глаза к свету.
4. Селен может существовать в разных аллотропических модификациях: аморфной (стекловидный, порошкообразный и коллоидный селен), а также кристаллической. При поправлении селена из раствора селенистой кислоты либо стремительным охлаждением его паров получают аморфный алый порошкообразный и коллоидный селен.
5. При нагревании всякий модификации этого химического элемента выше 220°С и дальнейшем охлаждении образуется стекловидный селен, он хрупок и владеет стеклянным блеском.
6. Особенно устойчив термически гексагональный серый селен, решетка которого построена из расположенных параллельно друг другу спиральных цепочек атомов. Его получают при помощи нагревания других форм селена до плавления и неторопливым охлаждением до 180-210°С. Внутри цепей гексагонального селена атомы связаны ковалентно.
7. Селен устойчив на воздухе, на него не действуют: кислород, вода, разбавленная серная и соляная кислоты, впрочем он отменно растворяется в азотной кислоте. Взаимодействуя с металлами, селен образует селениды. Знаменито уйма комплексных соединений селена, все они ядовиты.
8. Получают селен из отходов бумажного либо сернокислого производства, способом электролитического рафинирования меди. В шламах данный элемент присутствует совместно с тяжелыми и порядочными металлами, серой и теллуром. Для его извлечения шламы фильтруют, после этого нагревают с концентрированной серной кислотой либо подвергают окислительному обжигу при температуре 700°С.
9. Селен применяется при производстве выпрямительных полупроводниковых диодов и иной преобразовательной техники. В металлургии с его поддержкой придают стали мелкозернистую конструкцию, а также улучшают ее механические свойства. В химической промышленности селен используется в качестве катализатора.
Видео по теме
Обратите внимание!
Будьте внимательны при определении металлов и неметаллов. Для этого традиционно в таблице даны обозначения.
jprosto.ru
Как узнать и определить валентность химического элемента по таблице Менделеева
 Понятие «валентность» формировалось в химии с начала XIX века. Английский ученый Э. Франкленд обратил внимание, что все элементы могут образовывать с атомами других элементов только определенное количество связей. Он назвал это «соединительной силой». Позже немецкий ученый Ф. А. Кекуле изучал метан и пришел к выводу, что один атом углерода может присоединить в нормальных условиях только четыре атома водорода.
Понятие «валентность» формировалось в химии с начала XIX века. Английский ученый Э. Франкленд обратил внимание, что все элементы могут образовывать с атомами других элементов только определенное количество связей. Он назвал это «соединительной силой». Позже немецкий ученый Ф. А. Кекуле изучал метан и пришел к выводу, что один атом углерода может присоединить в нормальных условиях только четыре атома водорода.
Он назвал это основностью. Основность углерода равна четырем. То есть углерод может образовать четыре связи с другими элементами.
Дальнейшее развитие понятие получило в работах Д. И. Менделеева . Дмитрий Иванович развивал учение о периодическом изменении свойств простых веществ. Соединительную силу он определял как способность элемента присоединять определенное количество атомов другого элемента.
Определение по таблице Менделеева
Таблица Менделеева позволяет с легкостью определять основность элементов. Для этого нужно уметь читать периодическую таблицу. Таблица по вертикали имеет восемь групп, а по горизонтали располагаются периоды. Если период состоит из двух рядов, то его называют большим, а если из одной — малым. Элементы по вертикали в столбцах, в группах распределены неравномерно. Валентность всегда обозначается римскими цифрами.
Чтобы определить валентность, нужно знать, какая она бывает. У металлов главных подгрупп она всегда постоянная, а у неметаллов и металлов побочных подгрупп может быть переменной.
Постоянная равна номеру группы. Переменная может быть высшей и низшей. Высшая переменная равна номеру группы, а низкая высчитывается по формуле: восемь минус номер группы. При определении нужно помнить:
- у водорода она равна I;
- у кислорода — II.
Если соединение имеет атом водорода или кислорода, то определить его валентность не составляет труда, особенно если перед нами гидрид или оксид.
Формула и алгоритм
Самая меньшая валентность у тех элементов, которые расположены правее и выше в таблице. И, наоборот, если элемент ниже и левее, то она будет выше. Чтобы определить ее, необходимо следовать универсальному алгоритму:
 Записываем формулу соединения.
Записываем формулу соединения.- Проставляем валентность того компонента соединения, которого знаем.
- Умножаем известную величину на количество атомов элемента в соединении.
- Находим наименьшее кратное.
- Проводим проверку: умножаем значение на индекс. Должна получаться одинаковая цифра по каждому компоненту соединения.
Пример: возьмем соединение аммиака — Nh4. Нам известно, что у атома водорода валентность постоянная и равна I. Умножаем I на 3 (количество атомов) — наименьшее кратное — 3. У азота в этой формуле индекс равен единице. Отсюда вывод: 3 делим на 1 и получаем, что у азота она равна IIII.
Величину по водороду и кислороду всегда определять легко. Сложнее, когда ее необходимо определять без них. Например, соединение SiCl4. Как определить валентность элементов в этом случае? Хлор находится в 7 группе. Значит, его валентность либо 7, либо 1 (восемь минус номер группы). Кремний находится в четвертой группе, значит, его потенциал для образования связей равен четырем. Становится логично, что хлор проявляет в этой ситуации наименьшую валентность и она равна I.
В современных учебниках химии всегда есть таблица валентности химических элементов. Это существенно облегчает задачу учащимся. Тему изучают в восьмом классе — в курсе неорганической химии.
Современные представления
 Современные представления о валентности базируются на строении атомов. Атом состоит из ядра и вращающихся на орбиталях электронах.
Современные представления о валентности базируются на строении атомов. Атом состоит из ядра и вращающихся на орбиталях электронах.
Само ядро состоит из протонов и нейтронов, которые определяют атомный вес. Для того чтобы вещество было стабильным, его энергетические уровни должны быть заполнены и иметь восемь электронов.
При взаимодействии элементы стремятся к стабильности и либо отдают свои неспаренные электроны, либо принимают их. Взаимодействие происходит по принципу «что легче» — отдать или принять электроны. От этого также зависит то, как изменяется валентность в таблице Менделеева. Количество неспаренных электронов на внешней энергетической орбитали равно номеру группы.
В качестве примера
Щелочной металл натрий находится в первой группе периодической системы Менделеева. Это значит, что у него один неспаренный электрон на внешнем энергетическом уровне. Хлор находится в седьмой группе. Это значит, что у хлора есть семь неспаренных электронов. Для завершения энергетического уровня хлору не хватает ровно одного электрона. Натрий отдает ему свой электрон и становится стабильным в соединении. Хлор же получает дополнительный электрон и тоже становится стабильным. В итоге появляется связь и прочное соединение — NaCl — знаменитая поваренная соль. Валентность хлора и натрия в этом случае будет равна 1.
obrazovanie.guru
что это такое, изучение свойств химических элементов
Атомы химических элементов могут образовывать различное число связей. Эта способность имеет специальное название – валентность. Давайте разберемся, как определить валентность по таблице Менделеева, узнаем, в чем заключается ее отличие от степени окисления, увидим закономерности, характерные для водорода, углерода, фосфора, цинка, научимся находить валентность химических элементов.
…
Вконтакте
Google+
Мой мир
Основные сведения
Валентность – это возможность атомов различных химических элементов образовывать связи между собой. Другими словами можно сказать, что это способность атома присоединить к себе определенное количество других атомов.
Важно! Это не всегда постоянное число для одного и того же элемента. В разных соединениях элемент может обладать различными значениями.
Определение по таблице Д.И. Менделеева
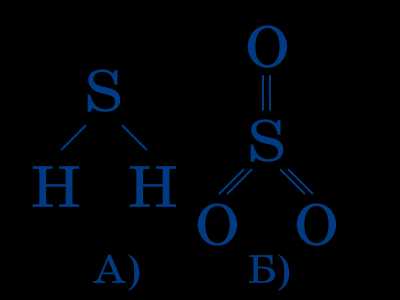 Для определения этой способности атома по таблице Менделеева необходимо знать, что такое группы и подгруппы периодической таблицы.
Для определения этой способности атома по таблице Менделеева необходимо знать, что такое группы и подгруппы периодической таблицы.
Это вертикальные столбцы, которые делят все элементы по определенному признаку. В зависимости от признака, выделяют подразделения элементов.
Этими столбцами элементы делятся на тяжелые и легкие элементы, а также подгруппы — галогены, инертные газы и тому подобное.
Итак, для определения способности элемента образовывать связи нужно руководствоваться двумя правилами:
- Высшая валентность элемента равна номеру его группы.
- Низшая валентность находится как разница между числом 8 и номером группы, в которой расположен данный элемент.
Например, фосфор проявляет высшую валентность V – P2O5 и низшую (8-5)=3– PF3.
Стоит также отметить несколько основных характеристик и особенностей при определении этого показателя:
- Валентность водорода всегда I – H2O, HNO3, H3PO4.
- Валентность кислорода всегда равна II – CO2, SO3.
- У металлов, которые расположены в главной подгруппе, этот показатель всегда равен номеру группы – Al2O3, NaOH, KH.
- Для неметаллов чаще всего проявляются только две валентности – высшая и низшая.
Также существуют элементы, у которых может быть 3 или 4 разных значений этого показателя. К ним относятся хлор, бор, йод, хром, сера и другие. Например, хлор обладает валентностью I, III, V, VII – HCl, ClF3,ClF5,HClO4 соответственно.
Определение по формуле
Для определения по формуле можно воспользоваться несколькими правилами:
- Если известна валентность (V) одного из элементов в двойном соединении: допустим, есть соединение углерода и кислорода СО2, при этом мы знаем, что валентность кислорода всегда равна II, тогда можем воспользоваться таким правилом: произведение числа атомов на его V одного элемента должно равняться произведению числа атомов другого элемента на его V. Таким образом, валентность углерода можно найти так – 2×2 (в молекуле 2 атома кислорода с V= 2), то есть валентность углерода равняется 4. Рассмотрим еще несколько примеров: P2O5 – тут валентность фосфора = (5*2)/2 = 5. HCl – валентность хлора будет равна I, так как в этой молекуле 1 атом водорода, и V= 1.
- Если известна валентность нескольких элементов, которые составляют группу: в молекуле гидроксида натрия NaOH валентность кислорода равняется II, а валентность водорода – I, таким образом группа -OH обладает одной свободной валентностью, так как кислород присоединил только один атом водорода и еще одна связь свободна. К ней и присоединится натрий. Можно сделать вывод, что натрий – одновалентный элемент.
Разница между степенью окисления и валентностью
 Очень важно понимать принципиальную разницу между этими понятиями. Степень окисления – это условный электрический заряд, которым обладает ядро атома, в то время как валентность – это количество связей, которые может установить ядро элемента.
Очень важно понимать принципиальную разницу между этими понятиями. Степень окисления – это условный электрический заряд, которым обладает ядро атома, в то время как валентность – это количество связей, которые может установить ядро элемента.
Рассмотрим подробнее, что такое степень окисления. Согласно современной теории о строении атома, ядро элемента состоит из положительно заряженных протонов и нейтронов без заряда, а вокруг него находятся электроны с отрицательным зарядом, которые уравновешивают заряд ядра и делают элемент электрически нейтральным.
В случае, если атом устанавливает связь с другим элементом, он отдает или принимает электроны, то есть выходит из состоянии баланса и начинает обладать электрическим зарядом. При этом если атом отдает электрон, он становится положительно заряженным, а если принимает – отрицательным.
Внимание! В соединении хлора и водорода HCl водород отдает один электрон и приобретает заряд +1, а хлор принимает электрон и становится отрицательным -1. В сложных соединениях, HNO3 и H2SO4, степени окисления будут такими – H+1N+5O3-2 и H2+1S +6O4-2.
Сравнивая два этих определения, можно сделать вывод, что валентность и степень окисления часто совпадают: валентность водорода +1 и валентность I, степень окисления кислорода -2 и V II, но очень важно помнить, что это правило выполняется не всегда!
В органическом соединении углерода под названием формальдегид и формулой HCOH у углерода степень окисления 0, но он обладает V, равной 4. В перекиси водорода H2O2 у кислорода степень окисления +1, но V остается равной 2. Поэтому не следует отождествлять два этих понятия, так как в ряде случаев это может привести к ошибке.
Валентности распространенных элементов
Водород
 Один из самых распространенных элементов во вселенной, встречается во многих соединениях и всегда обладает V=1. Это связано со строением его внешней электронной орбитали, на которой у водорода находится 1 электрон.
Один из самых распространенных элементов во вселенной, встречается во многих соединениях и всегда обладает V=1. Это связано со строением его внешней электронной орбитали, на которой у водорода находится 1 электрон.
На первом уровне может находиться не более двух электронов одновременно, таким образом, водород может либо отдать свой электрон и образовать связь (электронная оболочка останется пустой), либо принять 1 электрон, также образовав новую связь (электронная оболочка полностью заполнится).
Пример: H2O – 2 атома водорода с V=1 связаны с двухвалентным кислородом; HCl – одновалентные хлор и водород; HCN – синильная кислота, где водород также проявляет V, равную 1.
Углерод
Углерод может обладать либо валентностью II, либо IV. Связано это со строением внешнего электронного уровня, на котором находится 2 электрона, в случае если он их отдаст, его V будет II. То есть 2 электрона установили 2 новые связи, например, соединение CO – угарный газ, где и кислород, и водород двухвалентные. Однако бывают ситуации, когда один электрон с первого уровня переходит на второй, тогда у углерода образуется 4 свободных электрона, которые могут образовывать связи: СО2, НСООН, Н2СО3.
Фосфор
Данный элемент может обладать валентностью III и V. Как и в предыдущих случаях, связанно это со строением внешнего электронного уровня, на котором у него 3 электрона, то есть возможность образовать 3 связи, но, как и углерод, у него возможен переход 1 электрона с s-орбитали на d-орбиталь, тогда неспаренных электронов станет 5, а значит, и валентность тоже будет равна V. Например: РН3, Р2О5, Н3РО4.
Цинк
Как элемент главной подгруппы и металл, цинк может обладать только валентностью, которая равна номеру его группы, то есть 2. Во всех своих соединениях валентность цинка равна II и не зависит от типа элемента и вида связи с ним. Пример: ZnCl2, ZnO, ZnH2, ZnSO4.
Определение валентности химических элементов
Изучение валентности по периодической таблице Менделеева
Вывод
Теперь вы знаете, что такое валентность, чем она отличается от степени окисления, и легко определите валентность элементов по формулам или таблице Менделеева.
Это интересно! Основной закон Гесса и следствия из него
uchim.guru
Как определить валентность по таблице Менделеева: вспоминаем уроки химии
Таблица, созданная известным ученым Д. И. Менделеевым, включает в свой состав все химические элементы и важный сведения о них. Но, чтобы их расшифровать и определять валентность, нужно знать правила работы с этой системой.
Что такое валентность?
Это способность элемента присоединять к себе определенное количество атомов, принадлежащих другому элементу. Именно благодаря таким знаниям можно составлять формулы и совершать химические реакции.
Перед тем, как определить валентность по таблице Д. И. Менделеева, нужно знать, что она может быть постоянной или переменной. Переменную можно вычислить, а постоянную только запомнить.
Представители таблицы с постоянной активностью
- Одновалентные: галогены, водород, щелочные металлы.
- Двухвалентные: щелочные металлы и кислород.
- Трехвалентные: бор и алюминий.
Как определить валентность?
Для этого нужно знать, как устроена таблица Д. И. Менделеева. Каждый элемент этой системы имеет свой номер, по горизонтали располагаются периоды таблицы, а по вертикали — группы. Периоды делятся, в свою очередь, на большие, если состоят из двух рядов, и малые, если ряд только один. Групп всего 8, они распределены неравномерно, поэтому если в ней компонентов много, то она называется главной, а если меньше, то побочная. Чтобы определить валентность элемента, нужно знать его номер и тип, то есть к какой группе он относится. Постоянная величина соответствует номеру главной подгруппы той группы, в которой находится элемент. Видео, как определить валентность по таблице Д. И. Менделеева, поможет разобраться с переменными значениями. Обычно их считают у неметаллов. Вначале определяют номер группы и вычитают это число из 8 (общего количества групп).
Чтобы определить валентность элемента, нужно знать его номер и тип, то есть к какой группе он относится. Постоянная величина соответствует номеру главной подгруппы той группы, в которой находится элемент. Видео, как определить валентность по таблице Д. И. Менделеева, поможет разобраться с переменными значениями. Обычно их считают у неметаллов. Вначале определяют номер группы и вычитают это число из 8 (общего количества групп).
Примеры определения и подсчетов
Все щелочные металлы главной подгруппы первой группы имеют постоянную валентность, которая равна 1, щелочно-земельные металлы, располагающиеся во второй группе обладают значением 2.
Немного сложнее определить эту величину у неметаллов, например, серы. Для этого вначале посмотрим, в какой группе она находится, — это 6, постоянное значение равно 6. Для того, чтобы узнать переменное, из 8 вычитаем 6, получается 2. Таким образом, у серы две валентности: постоянная 6 и переменная 2. У галогенов также две величины постоянная 7 и переменная 1 (8−7=1).
Все элементы побочных групп имеют только постоянную цифру, которую можно посмотреть по таблице или запомнить, но обычно ее значение находится в промежутке от 1 до 3.Если таблица будет в постоянной доступности, то учить постоянную валентность не нужно, но все-таки намного проще запомнить значения распространенных в формулах и реакциях элементах.
nazvania.net
Содержание
Вам понадобится
Инструкция
|
completerepair.ru

