Европий – 63 элемент таблицы Менделеева
Последний редкоземельный элемент цериевой подгруппы – европий – так же, как и его соседи по таблице Менделеева, входит в число наиболее сильных поглотителей тепловых нейтронов. На этом базируется его применение в атомной технике и технике защиты от излучений.
В качестве материала противонейтронной защиты элемент №63 интересен тем, что его природные изотопы 151Eu и 153Eu, поглощая нейтроны, превращаются в изотопы, у которых почти так же велико сечение захвата тепловых нейтронов. Радиоактивный европий, полученный в атомных реакторах, использовали при лечении некоторых форм рака. Важное значение приобрел европий как активатор люминофоров. В частности, окись, оксисульфид и ортованадат иттрия YVO4, используемые для получения красного цвета на телевизионных экранах, активируются микропримесями европия. Имеют практическое значение и другие люминофоры, активированные европием. Основу их составляют сульфиды цинка и стронция, фториды натрия и кальция, силикаты кальция и бария.
Известно, что европием, отделенным от других лантаноидов, пытались легировать некоторые специальные сплавы, в частности сплавы на основе циркония.
Элемент №63 не во всем подобен другим редкоземельным элементам. Европий – самый легкий из лантаноидов, его плотность всего 5,245 г/см3. У европия же наибольшие из всех лантаноидов атомный радиус и атомный объем. С этими «аномалиями» свойств элемента №63 некоторые исследователи связывают и тот факт, что из всех редкоземельных элементов европий – наименее устойчивый к корродирующему действию влажного воздуха и воды.
Реагируя с водой, европий образует растворимое соединение Eu(OH)2 · 2h3O. Оно желтого цвета, но при хранении постепенно белеет. По-видимому, здесь происходит дальнейшее окисление кислородом воздуха до Eu2O3.
Как мы уже знаем, в соединениях европий бывает двух- и трехвалентным. Большинство его соединений – белого цвета обычно с кремовым, розоватым или светло-оранжевым оттенком. Соединения европия с хлором и бромом светочувствительны.
Как известно, трехвалентные ионы многих лантаноидов могут быть использованы, подобно иону Cr3+ в рубине, для возбуждения лазерного излучения. Но из всех их только ион Eu3+ дает излучение в воспринимаемой человеческим глазом части спектра. Луч европиевого лазера – оранжевый.
tablica-mendeleeva.ru
Таблица Менделеева – Интересные факты
В конце августа 1875 г. в кабинет акад. Вюрца входит его ученик, молодой французский химик Лекок-де-Буабодран. н долго не решается объяснить причину своего отменного прихода. Наконец он вынимает нз бокового кармана запечатанный зеленый конверт н вручает Вюрцу с просьбой сохранить его, не вскрывая. Получив заверения, что желание его будет нсполнено, Буа бодрен уходит.
Несмотря на свою молодость, Лекок-де-Буабодран уже в совершенстве овладел спектральным анализом веществ. Он знал наизусть спектры всех элементов. Эти цветные полоски, которые получаются при разложении света, испускаемого раскаленными веществами, давали ключ к определению состава тел. Ведь каждый элемент обладает строго определенным сочетанием спектральных линий.
Однажды, изучая спектр минерала цинковой обманки. Буабодран, к своему удивлению, обнаруживает в спектре новую, никому доселе не известную ярко-фиолетовую линию. Ученый решает, что эта линия принадлежит новому, неизвестному еще элементу. Опасаясь, что кто-либо другой оповестит мир об этом открытии, Буабодран записывает все происшедшее и в запечатанном конверте передает Вюрцу в Академию наук. Возвратившись в лабораторию, Буабодран продолжает упорно проверять свое открытие, так как боится сделать преждевременный, опрометчивый вывод.
Настает наконец день, когда все сомнения отброшены, когда он полностью убедился в правильности своих наблюдений…
В конце сентября того же года, во время очередного заседания Парижской Академии наук, Вюри при напряженном вниманиивсех присутствующих оглашает от имени своего ученика Лекока-дс-Буабодраия документ. хранящийся в запечатанном конверте В документе написано, что 27 августа 1875 г., между 3 и 4 часами пополудни. Лекок-де-Буабодран путем спектрального анализа обнаружил в цинковой обманке новый, неизвестный еще элемент. Этот элемент был назван галлием, в честь старинного названия родины Буабодрана — Франции.
Открытие галлия нашло отклик далеко за пределами Франции и помогло утверждению одного из основных законов химии.
Далеко от солнечной Франции, в далеком, хмуром Петербурге, проф. Дмитрий Иванович Менделеев сразу же оценил всю важность открытия молодого ученого. Узнав из протокола Парижской Академии об открытии галлия и о некоторых его свойствах, которые удалось установить Буабодраку. Менделеев сразу же решает, что галлий и есть тот самый элемент, существование которого он еще так недавно предсказывал на основании открытого им периодического закона.
Во времена Менделеева было известно всего 63 химических элемента. Несмотря на столь небольшое, казалось бы, число их, они не были систематизированы, распределены.
Не было единой точки зрения на природу элементов, на причины их сходства и различия. Все попытки классификации химических элементов неизменно кончались неудачей. Объяснялось это тем, что их авторы не смогли найти такого признака, общего для всех элементов, который можно было бы положить в основу классификация.
В 1867 г. Менделеев приступает к чтению лекций по курсу неорганической химии в Петербургском университете. Излагая студентам совокупность сведений о химических веществах, Менделеев все чаще и чаще задумывается над взаимными отношениями элементов и основой их классификации. Он все больше и больше склоняется к мысли о том, что наиболее важным, наиболее всеобщим свойством всех химических элементов является вес, или точнее, масса их атома. Постепенно крепнет убеждение Менделеева в том, что именно в атомных весах нужно искать причину сходства и различия элементов. Этот путь был уже отчасти испробован другими, но никто не пошел дальше предчувствия того великого закона природы, открытие и утверждение которого обессмертили имя Менделеева.
Однажды, придя поздно ночью домой, Менделеев решительно направляется в кабинет. Убеждения и мысли его созрели. Этой ночью он должен проверить, насколько правильны те взгляды, которые мучительно трудно вынашивались им в течение долгого времени. Он вынимает из шкафа лист картона и аккуратно нарезает 63 карточки, по числу химических элементов. На каждой карточке он пишет атомный вес элементе, название и важнейшие его свойства. Через некоторое время все 63 карточки заполнены. Теперь Дмитрий Иванович раскладывает их в ряд в порядке нарастания атомных весов элементов
Внимательно всматриваясь в длинный ряд карточек, Менделеев замечает, что свойства химических элементов изменяются но мере возрастания их атомного веся. Он берет первые 8 карточек, на которых нанесены элементы от водорода до фтора, и ставит их одну под другой так, чтобы атомные веса элементов возрастали сверху вниз.
Всю ночь раскладывал Менделеев карточки.
Образовавшийся вертикальный ряд карточек открывался водородом — самым легким нз всех элементов. Вес его атома принят за единицу при вычислении атомных весов. Под водородом поставлен литии, с атомным весом, равным семи. Это самый легкий нз известных металлов. Он очень энергично соединяется с кислородом н обладает ярко выраженными металлическими свойствами. У следующих за литнем элементов — бериллия и бора — по мере возрастания атомных весов металлические свойства слабеют. Дальше вниз следуют углерод, азот, кислород и фтор — уже не металлы, а металлоиды, причем фтор оказался ярко выраженным металлоидом. По своим свойствам он является полной противоположностью лития. Таким образом, свойства этих 8 элементов по мере увеличения их атомных весов изменяются от металлических к металоидным.
Следующий за фтором элемент — натрий — оказался опять резко выраженным металлом Он как бы нарушал найденную закономерность. Вместо плавного изменения свойств здесь был резкий скачок от ярко выраженного металлоида — фтора — к типичному металлу — натрию. Однако свойства следующих за натрием 7 элементов опять плавно изменялись от металлических к металлоидным. Пятнадцатый элемент — хлор — оказался опять резко выраженным металлоидом.
Теперь уже сомнений не было. Свойства элементов действительно зависят от их атомного веса, но зависимость эта не простая, а периодическая, повторяющаяся.
Когда Менделеев приставил первый вертикальный ряд элементов ко второму так. чтобы в первой строчке против лития оказался натрий, по всех остальных строчках оказались элементы, очень сходные между собой. Литий н натрий, углерод и кремний, азот и фосфор, фтор и хлор начинали собой естественные группы семейства элементов.
Дальше Дмитрий Иванович продолжил начало строк, подставив к ним сходные элементы так. что они стояли в порядке возрастания их атомных весов. Получилась таблица, названная впоследствии периодической системой элементов.
70 лет назад. 1 марта 1869 г.. Менделеев напечатал составленную таблицу и разослал ее многим ученым. Это был первый опыт составления периодической системы элементов. В дальнейшем Дмитрий Иванович видоизменил ее, сделал периоды горизонтальными, а ряды, в которых стоят сходные элементы, вертикальными. В этом виде система существует и в наши дни.
Надо было обладать гением Менделеева, для того чтобы в то время, когда атомные веса ряда элементов были вычислены неправильно, а о существовании многих элементов вообще не было известно, напасть на сдлед периодического закона. НО в XV было глубоко верить в свое открытие, чтобы, несмотря на кажущиеся непреодолимыми возражения, настаивать на безусловной правильности периодического закона.
Элементы, атомный вес которых был определен неверно, путали при помещении их в таблицу все карты. Место их в таблице не соответствовало их атомному весу. Менделеев смело преодолевает это препятствие, решив, что атомные веся этих элементов определены неправильно. Он исправляет атомные веса этих элементов в соответствии с их местом в периодической системе.
Стройности периодической таблицы очень мешало также отсутствие многих элементов, которые тогда не были известны. Вследствие этого таблица имела много пустых клеточек.
Из 63 элементов Менделееву удалось с полной уверенностью разместить в таблице только 36. Остальные элементы бы и им размещены лишь после того, как он уточнил их атомные веса И все же места 7 элементов казались самому Менделееву сомнительными.
Все это, однако, не могло поколебать глубочайшего убеждения Менделеева в том, что нм открыт один из важнейших законов природы. Его уверенность была настолько велика, что он решается на смелое предсказание 3 новых элементов, которые называет экабором, зкаялюмниием и экакремннем.
Проходит еще несколько лет после открытия Лекок-де-Буабодраном первого нз предсказанных Менделеевым элементов — экаалюмнння (галлия). Дмитрий Иванович занимается новыми исследованиями и очень активной педагогической работой в университете. Он упорно и много работает над дальнейшим уточнением открытого нм периодического закона н совсем не предполагает, что ему предстоит скоро получить новую радостную весть, на этот раз с севера — из Швеции.
В 1884 г. известный шведский хнмик Ннльсон сообщает, что им открыт второй из предсказанных Менделеевым элементов. Новый металл Ннльсон назвал скандием. Свойства вполне отвечали предсказанному Менделеевым экабору
«Таким образом, — заканчивает свое сообщение Ннльсон, — подтверждаются соображения русского химика, которые не только дали вовзможность предсказать существование названных элементов — скандия и галлия, но и предвидеть заранее их важнейшие свойства».
Наконец, п 1886 г.. немецкий ученый Винклер открывает третий предугаданный Менделеевым элемент. Винклер считает, что новый элемент — германий — как раз н есть предсказанный Менделеевым эка кремний. Чтобы еще больше убедить читателей в этом, ученый заканчивает свое сообщение таблицей сравнения свойств экакремння н германия.
В своем сообщении Вннклер говорит: «Нельзя требовать более очевидного доказательства правильности периодического закона, чем поразительное совпадение свойств экакремння и гермпння Это не простое подтверждение искусной теории — это блестящее расширение химического кругозора, великий шаг в области познаний».
Гениальное открытие Менделеева не сразу получило признание. Причиной этому служили, главным образом, слабые места менделеевской таблицы. Так например, было известно, что атомный вес никеля меньше атомного веса кобальта, между тем кобальт стоит в таблице раньше никеля; другая пара элементов — иол и теллур — также была примером такого же нарушения периодического закона.
Менделеев сознательно допустил такое нарушение своей системы Он считал, что свойства этих «спорных» элементов вполне достаточно определяют их место в таблице, в то время как атомный вес их мог быть определен неточно.
В 1894 г. весь ученый мир был поражен сенсационным открытием английского ученого Рамзая. Он нашел в воздухе новый, абсолютно недеятельный газ н назвал его аргоном (что значит «ленивый») Далее, один за другим были открыты еще четыре недеятельных газа: криптон, ксенон, гелий н неон. Вновь открытые элементы образовали новую группу, существование которой как будто нарушало стройность периодической таблицы.
Вслед за работой Рамзая последовало открытие так называемых редкоземельных элементов. Менделеев не знает, куда поместить их в своей таблице, н откровенно признает: «Тут мое личное мнение еще ин на чем не остановилось, и тут я вижу одну из труднейших задач, представляемых периодической закономерностью».
Несмотря на эти противоречия н трудности. Дмитрий Иванович уверен в своей правоте. Он считает, что наука пока еще не может объяснить этих нарушений периодической системы. При дальнейшем изучении свойств инертных газов было найдено, что эти элементы представляют собой переходную группу между металлами и галлондами. Поэтому Менделеев охотно согласился с бельгийским ученым Эррером и поместил инертные газы в новую, дополнительную группу своей таблицы — нулевую.
Осталось последнее возражение против менделеевской таблицы — несоответствие атомных весов некоторых элементов их месту в системе кобальт и никель, теллур и иод). Это возражение отпало только совсем недавно, когда наука вплотную подошла к разрешению загадки строения атома.
Во времена Менделеева атом считался неделимым. Ученые же пате-го века доказали, что атом состоит из ядра, заряженного положительно, и окружающих его электронов, заряженных отрицательно. В 1913 г. английский ученый Г. Моэли занялся изучением рентгеновских спектров элементов. Он нашел, что эти спектры очень просты и состоят из немногих линий. Для каждого элемента длина волны этих линий оказалась в очень простой математической связи с порядковым числом, т. е. номером его места в общем ряду элементов. Таким образом, оказалось возможным определить по порядковые числа всех элементов. Полученные числа определяли положение каждого элемента в менделеевской системе и объясняли все до сих пор спорные се места Порядковые номера кобальта н никеля, теллура и иоде подтвердили гениальную догадку Менделеева, который поставил кобальт раньше никеля и теллур раньше иода, хотя атомные веса этих элементов не соответствовали их месту в системе.
Открытие Мозлн сильно преобразило периодическую систему, н периодический закон формулируется теперь так – свойства элементов находятся в периодической зависимости от их порядковых номеров
Развитие науки о строении атоме позволило нейти место в системе и для редкоземельных элементов, разрешив задачу которую сам Менделеев не смог решить. Так одно за другим отпали все возражения против периодической системы, и закон Менделеева занимает почетное место среди важнейших законов естествознания.
faqo.ru
Таблица химических элементов Менделеева, металлы, неметаллы
Таблица Менделеева является одним из главных постулатов химии. С ее помощью можно найти все необходимые элементы, как щелочные, так и обычные металлы или неметаллы. В этой статье мы рассмотрим, как в такой таблице отыскать необходимые вам элементы.
Историческая справка
В середине 19 века было открыто 63 химических элемента. Первоначально предполагалось разместить элементы согласно увеличению атомной массы и поделить их на группы. Однако структурировать их не удавалось, а предложение химика Нуланда не было воспринято всерьез из-за попыток связать между собой химию и музыку.
В 1869 году Дмитрий Иванович Менделеев впервые опубликовал свою периодическую таблицу на страницах журнала Русского химического общества. Вскоре он известил о своем открытии химиков по всему миру. Менделеев впоследствии продолжал дорабатывать и улучшать свою таблицу, пока она не приобрела современный вид. Именно Менделеев сумел расставить химические элементы таким образом, чтобы они изменялись не монотонно, а периодически. Окончательно теория объединилась в периодический закон в 1871 году. Перейдем к рассмотрению неметаллов и металлов в таблице Менделеева.
Как ищутся металлы и неметаллы
Определение металлов теоретическим методом
Теоретический метод:
- Все металлы, за исключением ртути, находятся в твердом агрегатном состоянии. Они пластичны и без проблем гнутся. Также данные элементы отличаются хорошими тепло- и электропроводящими свойствами.
- Если вам нужно определить список металлов, то проведите диагональную линию от бора до астата, ниже которой будут располагаться металлические компоненты. К ним относятся также все элементы побочных химических групп.
- В первой группе первой подгруппе находятся щелочные, например, литий или цезий. При растворении образую щелочи, а именно гидроксиды. Обладают электронной конфигурацией вида ns1 с одним валентным электроном, который при отдаче приводит проявлению восстановительных свойств.
Во второй группе главной подгруппы находятся щелочно-земельные металлы по типу радия или кальция. При обычной температуре они обладают твердым агрегатным состоянием. Их электронная конфигурация имеет вид ns2. Переходные металлы располагаются в побочных подгруппах. Они обладают переменными степенями окисления. В низших степенях проявляются основные свойства, промежуточные степени выявляют кислотные свойства, а в высших степенях амфотерные.
Теоретическое определение неметаллов
В первую очередь, такие элементы обычно находятся в жидком или газообразном состоянии, иногда в твердом. При попытке согнуть их они ломаются по причине хрупкости. Неметаллы плохо проводят тепло и электрический ток. Неметаллы находятся в верхней части диагональной линии, проведенной от бора до астата. В атомах неметаллов содержится большое количество электронов, из-за чего им выгоднее принимать дополнительные электроны, нежели отдавать. К неметаллам также относят водород и гелий. Все неметаллы располагаются в группах со второй по шестую.
Химические способы определения
Есть несколько способов:
- Нередко приходится применять химические методы определения металлов. Например, нужно определить количество меди в сплаве. Для этого следует нанести каплю азотной кислоты на поверхность и через некоторое время пойдет пар. Промокните фильтрованную бумагу и подержите над колбой с аммиаком. Если пятно окрасилось в темно-голубой цвет, то это свидетельствует о наличии меди в сплаве.
- Предположим, что вам надо отыскать золото, но вы не хотите спутать его с латунью. Наносите на поверхность концентрированный раствор азотной кислоты в соотношении 1 к 1. Подтверждением большого количества золота в сплаве будет отсутствие реакции на раствор.
- Очень популярным металлом считается железо. Для его определения нужно нагреть кусочек металла в соляной кислоте. Если это действительно железо, то колба окрасится в желтый цвет. Если для вас химия довольно проблемная тема, то возьмите магнит. Если это действительно железо,то оно притянется к магниту. Никель определяется практически таким же методом, как и медь, только дополнительно капните диметилглиоксин на спирт. Никель подтвердит себя красным сигналом.
Похожими методами определяются и остальные металлические элементы. Просто используйте необходимые растворы и все получится.
Заключение
Периодическая таблица Менделеева — важный постулат химии. Она позволяет найти все необходимые элементы, в особенности металлы и неметаллы. Если вы изучите некоторые особенности химических элементов, то сможете выявить ряд особенностей, помогающих отыскать необходимый элемент. Также можно воспользоваться химическими способами определения металлов и неметаллов, так как они позволяют на практике изучить данную сложную науку. Удачи при изучении химии и периодической таблицы Менделеева, это поможет вам при дальнейших научных исследованиях!
Видео
Из видео вы узнаете, как определять металлы и неметаллы по таблице Менделеева.
liveposts.ru
| Относительная электроотрицательность (по Полингу): | 1,33 |
| Температура плавления: | 2996°C |
| Температура кипения: | 5425°C |
| Теплопроводность: | 45 |
| Плотность: | 16,6 г/см3 |
| Открыт: | Андерс Экеберг |
| Цвет в твёрдом состоянии: | Серо-синеватый |
| Тип: | Переходный металл |
| Орбитали: | 1s22s22p63s23p63d104s24p64d104f145s25p65d35f06s2 |
| Электронная формула: |
Ta – 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 4f14 5d3 6s2 Ta – [Xe] 4f14 5d3 6s2 |
| Валентность: | (+3), (+4), +5 |
| Степени окисления: | 0, +IV, V |
| Сверхпроводящее состояние при температуре: | 4,47 К |
| Потенциалы ионизации: | 7,7 В |
| Электропроводность в тв. фазе: | 6,67*106 при 300K |
| Ковалентный радиус: | 1,34 Å |
| Атомный объем: | 10,9 см3/моль |
| Атомный радиус: | 2,09 Å |
| Теплота распада: | 31,6 Кдж/моль |
| Теплота парообразования: | 743 Кдж/моль |
| Кристаллическая структура: | Объемоцентрированный куб. Высота, ширина, длина равны. Все углы прямые. По атому имеется в каждой вершине, а также атом в центре куба |
table-mendeleev.ru
Электронные конфигурации атомов химических элементов
Элементы в периодической таблице химических элементов Менделеева
Первоначально элементы в Периодической таблице химических элементов Д.И. Менделеева были расположены в соответствии с их атомными массами и химическими свойствами, но на самом деле оказалось, что решающую роль играет не масса атома, а заряд ядра и, соответственно, число электронов в нейтральном атоме.
Наиболее устойчивое состояние электрона в атоме химического элемента соответствует минимуму его энергии, а любое другое состояние называется возбужденным, в нем электрон может самопроизвольно переходить на уровень с более низкой энергией.
Рассмотрим, как распределяются электроны в атоме по орбиталям, т.е. электронную конфигурацию многоэлектронного атома в основном состоянии. Для построения электронной конфигурации пользуются следующими принципами заполнения орбиталей электронами:
— принцип (запрет) Паули – в атоме не может быть двух электронов с одинаковым набором всех 4-х квантовых чисел;
— принцип наименьшей энергии (правила Клечковского) – орбитали заполняют электронами в порядке возрастания энергии орбиталей (рис. 1).
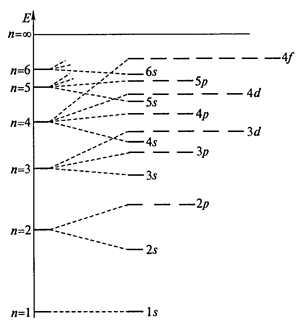
Рис. 1. Распределение орбиталей водородоподобного атома по энергиям; n – главное квантовое число.
Энергия орбитали зависит от суммы (n + l). Орбитали заполняются электронами в порядке возрастания суммы (n + l) для этих ортиталей. Так, для подуровней 3d и 4s суммы (n + l) будут равны 5 и 4, соответственно, вследствие чего, первой будет заполняться 4s орбиталь. Если сумма (n + l) одинакова для двух орбиталей, то первой заполняется орбиталь с меньшим значением n. Так, для 3d и 4p орбиталей сумма (n + l) будет равна 5 для каждой орбитали, но первой заполняется 3d орбиталь. В соответствии с этими правилами порядок заполнения орбиталей будет следующим:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<5d<4f<6p<7s<6d<5f<7p
Семейство элемента определяется по орбитали, заполняемой электронами в последнюю очередь, в соответствии с энергией. Однако, нельзя записывать электронные формулы в соответствии с энергетическим рядом.
41Nb 1s22s22p63s23p63d104s24p64d35s2 правильная запись электронной конфигурации
41Nb 1s22s22p63s23p64s23d104p65s24d3 неверная запись электронной конфигурации
Для первых пяти d – элементов валентными (т.е., электроны, отвечающие за образование химической связи) являются сумма электронов на d и s, заполненных электронами в последнюю очередь. Для p – элементов валентными являются сумма электронов, находящихся на s и p подуровнях. Для s-элементов валентыми являются электроны, находящиеся на s подуровне внешнего энергетического уровня.
— правило Хунда – при одном значении l электроны заполняют орбитали таким образом, чтобы суммарный спин был максимальным (рис. 2)
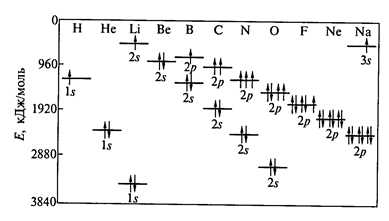
Рис. 2. Изменение энергии у 1s -, 2s – 2p – орбиталей атомов 2-го периода Периодической системы.
Примеры построения электронных конфигураций атомов
Примеры построения электронных конфигураций атомов приведены в таблице 1.
Таблица 1. Примеры построения электронных конфигураций атомов
|
Элемент |
Электронная конфигурация |
Применяемые правила |
|
2He |
1s2 |
Принцип Паули, правила Клечковского |
|
3Li |
1s2s21 |
Принцип Паули, правила Клечковского |
|
7N |
1s22s22p3 |
Правило Хунда |
|
19K |
1s22s22p64s1 |
Правила Клечковского |
|
24Cr |
1s22s22p63d54s1 |
Правило Хунда, «проскок» электрона, т.к. симметричные конигурации d5 и d10 очень устойчивы |
|
57La |
[Xe]5d16s2 |
Указываются только валентные электроны, конфигурация внутренних электронов обозначается символом инертного газа |
Задания:
Напишите электронные конфигурации элементов с порядковыми номерами: 20, 33, 49.
Ответы:
20Ca 1s22s22p63s23p64s2
33As 1s22s22p63s23p63d104s24p3
49In 1s22s22p63s23p63d104s24p64d15s2
ru.solverbook.com
сколько элементов в таблице Менделеева?
Таблица Менделеева. Периодическая система химических элементов Д. И. Менделеева. периодырядыгруппы химических элементов H 1,00795 водород2 He 4,002602 гелий II23 Li 6,9412 литий4 Be 9,01218 бериллий5 B 10,812 бор6 С 12,0108 углерод7 N 14,0067 азот8 O 15,9994 кислород9 F 18,99840 фтор10 Ne 20,179 неон III311 Na 22,98977 натрий12 Mg 24,305 магний13 Al 26,98154 алюминий14 Si 28,086 кремний15 P 30,97376 фосфор16 S 32,06 сера17 Cl 35,453 хлор18 Ar 39,948 аргон IV419 K 39,0983 калий20 Ca 40,08 кальций21 Sc 44,9559 скандий22 Ti 47,90 титан23 V 50,9415 ванадий24 Cr 51,996 хром25 Mn 54,9380 марганец26 Fe 55,847 железо27 Co 58,9332 кобальт28 Ni 58,70 никель 29 Cu 63,546 медь30 Zn 65,38 цинк31 Ga 69,72 галлий32 Ge 72,59 германий33 As 74,9216 мышьяк34 Se 78,96 селен35 Br 79,904 бром36 Kr 83,80 криптон V537 Rb 85,4678 рубидий38 Sr 87,62 стронций39 Y 88,9059 иттрий40 Zr 91,22 цирконий41 Nb 92,9064 ниобий42 Mo 95,94 молибден43 Tc 98,9062 технеций44 Ru 101,07 рутений45 Rh 102,9055 родий46 Pd 106,4 палладий 47 Ag 107,868 серебро48 Cd 112,41 кадмий49 In 114,82 индий50 Sn 118,69 олово51 Sb 121,75 сурьма52 Te 127,60 теллур53 I 126,9045 иод54 Xe 131,30 ксенон VI655 Cs 132,9054 цезий56 Ba 137,33 барий57 La 138,9 лантан ×72 Hf 178,49 гафний73 Ta 180,9479 тантал74 W 183,85 вольфрам75 Re 186,207 рений76 Os 190,2 осмий77 Ir 192,22 иридий78 Pt 195,09 платина 79 Au 196,9665 золото80 Hg 200,59 ртуть81 Tl 204,37 таллий82 Pb 207,2 свинец83 Bi 208,9 висмут84 Po 209 полоний85 At 210 астат86 Rn 222 радон VII787 Fr 223 франций88 Ra 226,0 радий89 Ac 227 актиний ××104 Rf 261 резерфордий105 Db 262 дубний106 Sg 266 сиборгий107 Bh 269 борий108 Hs 269 хассий109 Mt 268 мейтнерий110 Ds 271 дармштадтий 111 Rg 272 рентгений112 Cn 285 коперниций113 114 289 115 116 117 118 58 Ce 140,1 церий 59 Pr 140,9 празеодим 60 Nd 144,2 неодим 61 Pm 145 прометий 62 Sm 150,4 самарий 63 Eu 151,9 европий 64 Gd 157,3 гадолиний 65 Tb 158,9 тербий 66 Dy 162,5 диспрозий 67 Ho 164,9 гольмий 68 Er 167,3 эрбий 69 Tm 168,9 тулий 70 Yb 173,0 иттербий 71 Lu 174,9 лютеций 90 Th 232,0 торий 91 Pa 231,0 протактиний 92 U 238,0 уран 93 Np 237 нептуний 94 Pu 244 плутоний 95 Am 243 америций 96 Cm 247 кюрий 97 Bk 247 берклий 98 Cf 251 калифорний 99 Es 252 эйнштейний 100 Fm 257 фермий 101 Md 258 менделевий 102 No 259 нобелий 103 Lr 262 лоуренсий Классический вид таблицы Менделеева. Свойства химических элементов.
Группа российских и американских ученых под руководством Юрия Оганесяна из Объединенного института ядерных исследований, Дубна, Россия, синтезировала 117-й элемент таблицы Менделеева, пока носящий неофициальное название «унунсептий» , сообщает Science News. Это последнее достижение ученых по созданию супертяжелых элементов в лаборатории. Результаты эксперимента будут опубликованы в журнале Physical Review Letters.
touch.otvet.mail.ru
