Таблица. Основные химические формулы для решения задач
Documents войти Загрузить ×- Математика
Related documents
Масса молекулы. Количество вещества
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn

Домашнее задание №6
V m – молярный объем газа

Время, минуты 0 15 75 100 125

1)При растворении 16г CaC в воде выделяется 31, 3 кДж

Задача 10. В газовой фазе при 60°С протекает реакция по
КОЛИЧЕСТВО ВЕЩЕСТВА. МОЛЯРНЫЙ ОБЪЁМ ГАЗОВ.
химия – pedportal.net

ЗАДАЧИ НА СКОРОСТЬ температурный коэффициент реакции – 3. Какой будет
Стандартные термодинамические величины некоторых

Файл8 класс Семинар. Задачи по теме Моль
Тест по химии “Простые вещества”, учитель А.Ю. Парамонов

Решение задач по теме «Газообразные вещества».
studydoc.ru
Методический материал по общей химии “Основные расчетные формулы для решения задач на тему “Растворы”
Основные расчетные формулы для решения задач на тему «Растворы»
1. Способы выражения содержания растворенного вещества в растворе.
Массовая доля
%
Молярность
моль/л, М
Нормальность
моль/л, н
Мольная доля
доли
Моляльность
моль/кг
Титр
г/мл
2. Растворы неэлектролитов.
- Закон Генри
= kP
где – мольная доля растворенного вещества.
- Первый закон Рауля
- Второй закон Рауля
Ткип = Ecm
Tзамерз
- Закон Вант-Гоффа
V = nRT
Определение относительных молекулярных масс растворенных веществ:
3. Растворы электролитов.
- Первый закон Рауля
- Второй закон Рауля
Ткип = iEcm
Tзамерз = IKcm
- Закон Вант-Гоффа
V = inRT
- Степень диссоциации
Связь степени диссоциации и изотонического коэффициента:
- Активность
a = fc
Диссоциация КА K+ + A–
- Константа диссоциации
- Закон разбавления Оствальда
- Показатель константы диссоциации
pK = –lgK
Водородный показатель
pH = –lg[H+]
- Гетерогенное равновесие осадокраствор
KnAm nKm+ + mAn–
осадок насыщенный раствор
- Произведение растворимости (при равновесии)
ПР = [Km+]n[An-]m
Произведение концентрации (при условиях, отличных от равновесия)
ПK = cn[Km+]cm[A
- Условие образования осадка
ПК ПР
Условие растворения осадка
ПК ПР
- Растворимость вещества
infourok.ru
Конспект урока по химии для 10 класса «Решение задач на нахождение молекулярной формулы органических веществ по массовым долям и относительной плотности газов»
Конспект урока по химии для обучающихся 10 класса
Тема урока: Решение задач на нахождение молекулярной формулы органических веществ по массовым долям и относительной плотности газов.
Цели урока:
познакомить обучающихся с задачами данного типа и показать
способы решения задач на нахождение молекулярной формулы органических веществ по
массовым долям и относительной плотности газов.
Задачи урока:
– научить алгоритму решения задач данного типа;
– закрепить правила грамотного оформления условия задачи;
– развивать умения осуществлять самоконтроль и взаимоконтроль;
– создать на уроке атмосферу поиска и сотрудничества,
– развивать навыки химического мышления, логики учащихся;
– формировать у учащихся предметные компетенции, основанные на знаниях, умениях и
навыках в рамках раздела «Решение задач на вывод молекулярной формулы вещества»
при подготовке к ЕГЭ по химии.
Тип урока: комбинированный урок.
Оборудование: компьютер, мультимедийный проектор, презентация, лист контроля умений и навыков у каждого учащегося, цветовые сигналы.
Структура урока.
I. Организационный этап. Постановка цели и мотивация учебно-познавательной деятельности учащихся.
II. Актуализация знаний (фронтальная форма работы). Решение задач .
III. Решение задач по теме «Нахождение молекулярной формулы органических веществ по массовым долям и относительной плотности газов» (сочетание фронтальной и групповой форм работы, самооценка и групповая оценка).
IV. Закрепление знаний.
V. Рефлексия (самооценка).Домашнее задание.
Ход урока.
I. Организационный этап.
Умение решать химические задачи – важная составляющая знаний по предмету. Один из типов задач в курсе 10 класса – это задачи на нахождение молекулярной формулы органических веществ по массовым долям и относительной плотности газов. Подобные задания входят в ЕГЭ.
II. Актуализация знаний.
Этот вид расчетов чрезвычайно важен для химической практики, т.к. позволяет на основании экспериментальных данных определить формулу вещества (простейшую и молекулярную). На основании данных качественного и количественного анализов вы находите сначала соотношение атомов в молекуле (или другой структурной единице вещества), т.е. его простейшую формулу.
Мы с вами познакомились с первым классом органических веществ. Это алканы.
Какова общая формула класса? ( Сnh3n+2)
Вы уже имеете представление о разнообразии веществ этого класса. Наша цель сегодня познакомиться с методами определения молекулярной формулы вещества по массовым долям и относительной плотности газа.
Какую информацию несет молекулярная формула? ( качественную и количественную)
Часто используется при решении задач понятие эмпирическая формула. Как вы понимает слово эмпирический ? (основанный на опыте, опирающийся на непосредственные наблюдения, эксперимент)
Эмпирическая формула любого вещества – это формула, которая выражает простейшее целочисленное отношение элементов, содержащихся в данном веществе. Эмпирические формулы иногда называют простейшими формулами. Для вывода эмпирической формулы вещества достаточно знать его количественный состав ( массовые доли элементов).
Молекулярная (истинная) формула – формула, в которой отражается реальное число атомов каждого вида, входящих в молекулу вещества.
Например, С6Н6 — истинная формула бензола.
Что такое массовая доля? (массовая доля элемента — это его содержание в веществе в процентах по массе)
Например, в веществе состава С2Н4 содержится 2 атома углерода и 4 атома водорода. Если взять 1 молекулу такого вещества, то его молекулярная масса будет равна:
Мr(С2Н4) = 2 • 12 + 4 • 1 = 28 и там содержится 2 • 12 углерода.
Чтобы найти массовую долю углерода в этом веществе, надо его массу разделить на массу всего вещества:
ω(C) = 12 • 2 / 28 = 0,857 или 85,7%.
Если вещество имеет общую формулу СхНуОz, то массовые доли каждого их атомов так же равны отношению их массы к массе всего вещества. Масса х атомов С равна — 12х, масса у атомов Н — у, масса z атомов кислорода — 16z.
Тогда
ω(C) = 12 • х / (12х + у + 16z)
Если записать эту формулу в общем виде, то получится следующее выражение:
ω(х.э.) =
Что такое относительная плотность вещества? ( D – это величина, которая показывает, во сколько раз газ Мr1 тяжелее газа Mr2. )
D=Mr1/ Mr2
D(O₂)=Mr(газа)/Mr(O₂)
D(H₂)= Mr(газа)/Mr(H₂)
D(воздух) = Mr(газа)/Mr(воздух)
III. Решение задач по теме «Нахождение молекулярной формулы органических веществ по массовым долям и относительной плотности газов»
Алгоритм решения задач.
1. Вычисляем молекулярную массу вещества.
Мr(в) = D(x)*Мr(х) (1)
2. Вычисляем количество атомов элемента:
а) если ω дана в процентах:
n(Э) = (2)
б) если ω дана в долях:
n(Э) = (3)
3. Вычисляем молекулярную массу полученного вещества.
4. Если молекулярная масса полученного вещества равна молекулярной массе вещества (1), тогда задача решена правильно; если молекулярная масса полученного вещества отличается от молекулярной массы вещества (1), вычисляем разность и определяем количество атомов.
Пример:
Выведите формулу вещества, содержащего 82,75% углерода и 17,25 % водорода. Относительная плотность паров этого вещества по воздуху равна 2.
Дано:
ω(C) = 82,75%
ω(H) = 17,25%
D(возд) = 2
______________
Найти:
СхНу
Mr(воздуха) = 29
Решение:
1. Применяем формулу (1)
Mr(в-ва) = 29 * 2 =58
2. Находим количество атомов С по формуле (2)
n(С) = = 4
3. Находим количество атомов Н по формуле (2)
n(Н) = = 10
4. Вычисляем молярную массу С4Н10
Мr(С4Н10) =12 * 4 + 1 * 10 = 58
5. Вычисленная молекулярная масса совпадает с (1), задача решена.
Ответ: С4Н10
IV. Закрепление знаний.
Решить задачу в парах. Обсудить решение.
Найдите молекулярную формулу углеводорода, содержащего 80% углерода и 20% водорода. Относительная плотность по водороду равна 15.
Самостоятельная работа.
Вариант 1
Задача 1. Выведите формулу вещества, содержащего 81,8% углерода и 18,2 % водорода, если относительная плотность по водороду равна 22. (С₃Н₈)
Задача2. В углеводороде массовая доля углерода равна84%. Относительная плотность паров углеводорода по воздуху равна 3.45. Определите формулу углеводорода.( С₇ Н₁₆)
Дополнительное задание.
Некоторое вещество имеет относительную плотность паров углеводорода по кислороду равную 1, 375. Массовая доля водорода равна 18, 2%. Выведите молекулярную формулу углеводорода.
На основании данных условия задания:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу органического вещества ;
3) составьте возможную структурную формулу вещества , которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции получения данного вещества взаимодействием соответствующего органического вещества с гидроксидом натрия. (С₃Н₈)
Вариант 2
Задача 3.Массовая доля углерода в углеводороде составляет 83,33%. Плотность углеводорода по водороду равна 36.Определите формулу. (С₅Н₁₂)
Задача 4.Определить формулу вещества, если оно содержит 84,21% С и 15,79% Н и имеет относительную плотность по воздуху, равную 3,93. (С₈Н₁₈)
Дополнительное задание.
Некоторое вещество имеет относительную плотность паров органического вещества по водороду 57. Массовая доля водорода равна 15,79%, углерода 83,33%. Выведите молекулярную формулу углеводорода. Данное соединение имеет линейный углеродный скелет.
На основании данных условия задания:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу органического вещества;
3) составьте возможную структурную формулу вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции получения данного вещества взаимодействием соответствующего органического вещества с гидроксидом натрия. (С₈Н₁₈)
V. Рефлексия (самооценка). Домашнее задание: задача. Массовая доля углерода в углеводороде составляет 85,7%. Плотность углеводорода по воздуху равна 1,931.Определите формулу.
Конспект урока.
Ход занятия | Деятельность учителя | Деятельность учащихся |
Организационный этап 3 мин. | Работать будем в рабочих листах, по ходу урока заполняем. Сл. – 1 Умение решать химические задачи – важная составляющая знаний по предмету. Один из типов задач в курсе 10 класса – это задачи на вывод молекулярной формулы органического вещества по массовым долям и относительной плотности газа (ЕГЭ). | Подготовка к занятию. Внимательно слушают учителя. |
Актуализация знаний 10 мин. | Сл.-2 Этот вид расчетов чрезвычайно важен для химической практики, т.к. позволяет на основании экспериментальных данных определить формулу вещества (простейшую и молекулярную). На основании данных качественного и количественного анализов вы находите сначала соотношение атомов в молекуле (или другой структурной единице вещества), т.е. его простейшую формулу. Сл. -3 Мы с вами познакомились с первым классом органических веществ. Что это за класс? Какова общая формула класса? Вы уже имеете представление о разнообразии веществ этого класса. Наша цель сегодня познакомиться с методами определения молекулярной формулы вещества по массовым долям и относительной плотности газа. Сл. -4 Часто используется при решении задач понятие эмпирическая формула. Как вы понимает слово эмпирический? Эмпирическая формула любого вещества – это формула, которая выражает простейшее целочисленное отношение элементов, содержащихся в данном веществе. Эмпирические формулы иногда называют простейшими формулами. Для вывода эмпирической формулы вещества достаточно знать его количественный состав ( массовые доли элементов). Молекулярная (истинная) формула – формула, в которой отражается реальное число атомов каждого вида, входящих в молекулу вещества. Сл. -5 Что такое массовая доля? Например, в веществе состава С2Н4 содержится 2 атома углерода и 4 атома водорода. Если взять 1 молекулу такого вещества, то его молекулярная масса будет равна: Чтобы найти массовую долю углерода в этом веществе, надо его массу разделить на массу всего вещества: Сл.- 6 Если записать эту формулу в общем виде, то получится следующее выражение: ω(х.э.) = Сл.-7 Что такое относительная плотность вещества? ( D – это величина, которая показывает, во сколько раз газ Мr1 тяжелее газа Mr2. ) D=Mr1/ Mr2 D(O₂)=Mr(газа)/Mr(O₂) D(H₂)= Mr(газа)/Mr(H₂) D(воздух) = Mr(газа)/Mr(воздух) | Внимательно слушают учителя. Фронтальная работа учащихся. Устно отвечаю на вопросы. По ходу беседы делают записи в рабочем листе. 1.Алканы. 2. Сnh3n+2 3. Качественную и количественную. 4. Основанный на опыте, опирающийся на непосредственные наблюдения, эксперимент. 5. Массовая доля элемента — это его содержание в веществе в процентах по массе. 6. D – это величина, которая показывает, во сколько раз газ Мr1 тяжелее газа Mr2. |
Решение задач по теме «Нахождение молекулярной формулы органических веществ по массовым долям и относительной плотности газов» 20 мин. | Сл.-8 Алгоритм решения задач. 1. Вычисляем молекулярную массу вещества. Мr(в) = D(x)*Мr(х) (1) 2. Вычисляем количество атомов элемента: а) если ω дана в процентах: n(Э) = (2)
б) если ω дана в долях:
n(Э) = (3) 3. Вычисляем молекулярную массу полученного вещества. 4. Если молекулярная масса полученного вещества равна молекулярной массе вещества (1), тогда задача решена правильно; если молекулярная масса полученного вещества отличается от молекулярной массы вещества (1), вычисляем разность и определяем количество атомов. Сл.-9 Давайте решим задачу на вывод молекулярной формулы. Выведите формулу вещества, содержащего 82,75% углерода и 17,25 % водорода. Относительная плотность паров этого вещества по воздуху равна 2. Решите следующую задачу в парах на рабочих листах самостоятельно. | Внимательно слушают, делают записи по ходу рассказа. Обсуждают краткую запись задачи. Заполняют рабочий лист. Выведите формулу вещества, содержащего 82,75% углерода и 17,25 % водорода. Относительная плотность паров этого вещества по воздуху равна 2. Дано: ω(C) = 82,75% Найти: СхНу Решение: 1. Применяем формулу (1) Mr(в-ва) = 29 * 2 =58 2. Находим количество атомов С по формуле (2) n(С) = = 4 3. Находим количество атомов Н по формуле (2) n(Н) = = 10 4. Вычисляем молярную массу С4Н10 Мr(С4Н10) =12 * 4 + 1 * 10 = 58 5. Вычисленная молекулярная масса совпадает с (1), задача решена. Ответ: С4Н10 Решают, обсуждают. |
Закрепление знаний. 10 мин. | А теперь попробуем самостоятельно решить задачи, используя алгоритм. Вам выданы задачи. Самостоятельно решите задачи на предложенных рабочих листах. | Учащиеся решают задачи и записывают на предложенных листах. Выполненное задание сдают учителю. |
Рефлексия. 2 мин. | Запишите и решите дома задачу. Домашнее задание: задача. Массовая доля углерода в углеводороде составляет 85,7%. Плотность углеводорода по воздуху равна 1,931.Определите формулу. Как вы считаете: – удалось ли вам справиться с предложенными сегодня задачами? – какое задание было для вас наиболее интересным и почему? – какое задание было для вас наиболее сложным? | Записывают домашнее задание. |
Технологическая карта урока
Тема урока | Решение задач на нахождение молекулярной формулы органических веществ по массовым долям и относительной плотности газов. | |
Цели урока | Деятельностная | Формирование УУД при изучении алгоритма решения задач на вывод молекулярной формулы и в процессе решения задач. |
Предметно – дидактическая | Изучение алгоритма решения задач на вывод молекулярной формулы по массовым долям и относительной плотности. | |
Планируемые результаты урока | Предметные | Знают обозначение общей молекулярной формулы, массовой доли, относительной плотности газа. Знают определение молекулярной формулы, эмпирической формулы, знают формулы массовой доли, относительной плотности. Решают задачи на нахождение молекулярной формулы по массовым долям и относительной плотности газа. |
Метапредметные | Анализируют текст задачи, работают в группах, оценивают свою работу на уроке. | |
Личностные | Убеждаются в познаваемости окружающего мира, проявляют интерес к премету. | |
Тип урока | По ведущей дидактической цели | Изучение нового материала. |
По способу организации | Комбинированный | |
По ведущему методу обучения | Репродуктивный | |
Методы обучения | Основной | Объяснительно-иллюстративный |
Дополнительный | Беседа, рассказ, самостоятельная работа | |
Основные вопросы урока | 1.Понятия массовая доля, относительная плотность газа. 2.Алгоритм решения задач на вывод молекулярной формулы вещества по массовым долям и относительной плотности. | |
Средства обучения | ТСО, презентация, учебник, рабочие листы, карточки с задачами, лист контроля умений и навыков у каждого учащегося, цветовые сигналы. | |
Ход урока:
Этапы урока | Методы обучения | Учебно – познавательные задачи урока | Формируемые УУД | Методы оценки / самооценки | |
Деятельность учителя | Деятельность ученика | ||||
1. Орг. этап | Приветствует учащихся, проверяет их готовность к уроку. Предлагает обсудить тему урока. | Приветствуют учителя, готовят рабочее место. Участвуют в постановке темы урока. Записывают на рабочих листах тему урока. | Регулятивные, коммуникативные. | ||
2.Актуализация опорных знаний | Фронтальная беседа. |
1.Что это за класс? 2. Какова общая формула класса? 3. Какую информацию несет молекулярная формула? 4. Как вы понимает слово эмпирический?
5 Что такое массовая доля? 6. Что такое относительная плотность вещества? | Отвечают на вопросы учителя. Делают записи в рабочих листах по ходу беседы. 1.Алканы. 2. Сnh3n+2 3. Качественную и количественную. 4. Основанный на опыте, опирающийся на непосредственные наблюдения, эксперимент. 5. Массовая доля элемента — это его содержание в веществе в процентах по массе 6. D – это величина, которая показывает, во сколько раз газ Мr1 тяжелее газа Mr2. |
Общеучебные, коммуникативные. |
Совместное обсуждение. |
3. Формирование новых ЗУН | Беседа с элементами монологической речи. | Для решения любой задачи, что необходимо определить? Давайте определим алгоритм действий для решения задач на вывод молекулярной формулы вещества по массовым долям и относительной плотности газа. Запишем наш алгоритм действий. Теперь решим вместе одну задачу. | Отвечают на вопросы, обсуждают, приходят к общему выводу. 1.Алгоритм действий. Обсуждают, приходят к общему выводу. Полученный план действий, записывают. Обсуждают краткую запись задачи. Один ученик решает у доски , а остальные на рабочих листах |
Анализ, моделирование алгоритма, запись результатов. |
Совместное обсуждение. |
4. Развитие способов умственной деятельности | Самостоятельная работа в парах. Самостоятельная работа индивидуальная. | Предлагает выполнить задание в парах на рабочих листах самостоятельно. Решите две задачи самостоятельно. | Работают в парах. Обсуждают полученный результат, консультируются с учителем. Выполняют самостоятельную работу на рабочих листах. | Регулятивные, коммуникативные. | Взаимопроверка. |
5.Завершающий этап | Рефлексия. Домашнее задание | Даёт информацию о домашнем задании. Домашнее задание: задача. Массовая доля углерода в углеводороде составляет 85,7%. Плотность углеводорода по воздуху равна 1,931.Определите формулу. Как вы считаете: – удалось ли вам справиться с предложенными сегодня задачами? – какое задание было для вас наиболее интересным и почему? – какое задание было для вас наиболее сложным? |
Записывают домашнее задание. |
|
Самооценка |
xn--j1ahfl.xn--p1ai
Задача 40 ЕГЭ по химии 2016 » HimEge.ru
Нахождение молекулярной формулы веществ
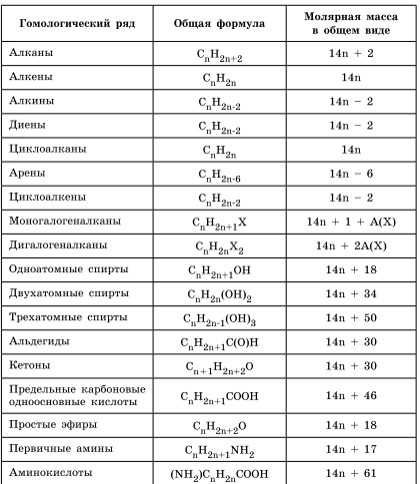
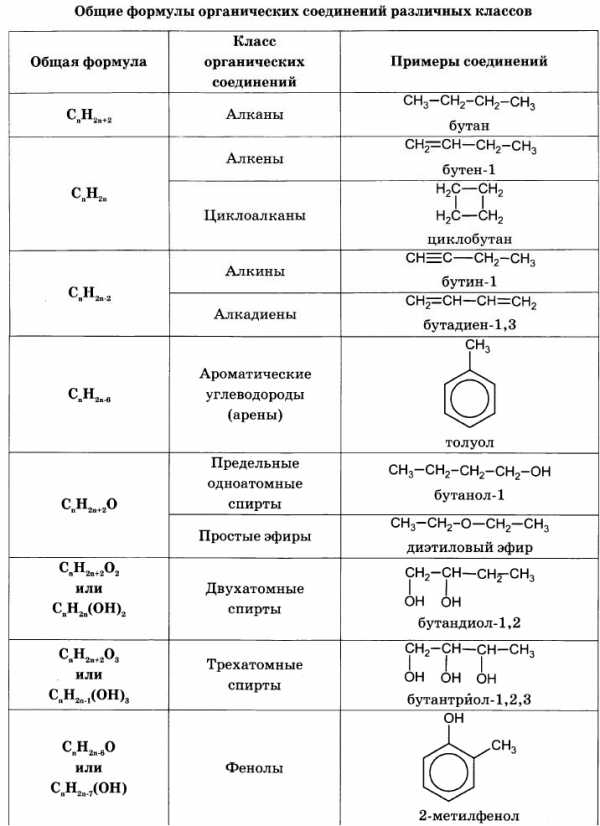
Для решения задач этого типа необходимо знать общие формулы классов органических веществ и общие формулы для вычисления молярной массы веществ этих классов:
Алгоритм решения большинства задач на нахождение молекулярной формулы включает следующие действия:
— запись уравнений реакций в общем виде;
— нахождение количество вещества n, для которого даны масса или объем, или массу или объём которого можно вычислить по условию задачи;
— нахождение молярной массы вещества М = m/n, формулу которого нужно установить;
— нахождение числа атомов углерода в молекуле и составление молекулярной формулы вещества.
Примеры решения задачи 40 ЕГЭ по химии на нахождение молекулярной формулы органического вещества по продуктам сгорания с объяснением
Задача 1.
При сгорании 11,6 г органического вещества образуется 13,44 л углекислого газа и 10,8 г воды. Плотность паров этого вещества по воздуху равна 2. Установлено, что это вещество взаимодействует с аммиачным раствором оксида серебра, каталитически восстанавливается водородом с образованием первичного спирта и способно окисляться подкисленным раствором перманганата калия до карбоновой кислоты. На основании этих данных:
1) установите простейшую формулу исходного вещества,
2) составьте его структурную формулу,
3) приведите уравнение реакции его взаимодействия с водородом.
Решение: общая формула органического вещества СxHyOz.
Переведем объем углекислого газа и массу воды в моли по формулам:
n= m/М и n= V/Vm,
Молярный объем Vm = 22,4 л/моль
n(CO2) = 13,44/22,4= 0,6 моль, =>в исходном веществе содержалось n(C) =0,6 моль,
n(H2O) = 10,8/18 = 0,6 моль, => в исходном веществе содержалось в два раза больше n(H) = 1,2 моль,
Узнаем, содержался ли кислород в органическом соединении. Для этого от массы органического вещества отнимаем массу углерода и массу водорода: m(O)= 11,6 – 0,6* 12 – 1,2= 3,2 г,
Значит, искомое соединение содержит кислород количеством:
n(O)= 3,2/16 = 0,2 моль
Посмотрим соотношение атомов С, Н и О, входящих в состав исходного органического вещества:
n(C) : n(H) : n(O) = x : y : z = 0,6 : 1,2 : 0,2 = 3 : 6 : 1
Нашли простейшую формулу: С3H6О
Чтобы узнать истинную формулу, найдем молярную массу органического соединения по формуле:
М(СxHyOz) = Dвозд(СxHyOz) *M(возд)
Mист(СxHyOz) = 29*2 = 58 г/моль
Проверим, соответствует ли истинная молярная масса молярной массе простейшей формулы:
М (С3H6О) = 12*3 + 6 + 16 = 58 г/моль — соответствует, => истинная формула совпадает с простейшей.
Молекулярная формула: С3H6О
Из данных задачи: » это вещество взаимодействует с аммиачным раствором оксида серебра, каталитически восстанавливается водородом с образованием первичного спирта и способно окисляться подкисленным раствором перманганата калия до карбоновой кислоты» делаем вывод, что это альдегид.
2) При взаимодействии 18,5 г предельной одноосновной карбоновой кислоты с избытком раствора гидрокарбоната натрия выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу кислоты.
3) Некоторая предельная карбоновая одноосновная кислота массой 6 г требует для полной этерификации такой же массы спирта. При этом получается 10,2 г сложного эфира. Установите молекулярную формулу кислоты.
4) Определите молекулярную формулу ацетиленового углеводорода, если молярная масса продукта его реакции с избытком бромоводорода в 4 раза больше,чем молярная масса исходного углеводорода
5) При сгорании органического вещества массой 3,9 г образовались оксид углерода (IV) массой 13,2 г и вода массой 2,7 г. Выведите формулу вещества, зная, что плотность паров этого вещества по водороду равна 39.
6) При сгорании органического вещества массой 15 г образовались оксид углерода (IV) объемом 16,8 л и вода массой 18 г. Выведите формулу вещества, зная, что плотность паров этого вещества по фтороводороду равна 3.
7) При сгорании 0,45 г газообразного органического вещества выделилось 0,448 л (н.у.) углекислого газа, 0,63 г воды и 0,112 л (н.у.) азота. Плотность исходного газообразного вещества по азоту 1,607. Установите молекулярную формулу этого вещества.
8) При сгорании бескислородного органического вещества образовалось 4,48 л (н.у.) углекислого газа, 3,6 г воды и 3,65 г хлороводорода. Определите молекулярную формулу сгоревшего соединения.
9) При сгорании органического вещества массой 9,2 г образовались оксид углерода (IV) объёмом 6,72 л (н.у.) и вода массой 7,2 г. Установите молекулярную формулу вещества.
10) При сгорании органического вещества массой 3 г образовались оксид углерода (IV) объёмом 2,24 л (н.у.) и вода массой 1,8 г. Известно, что это вещество реагирует с цинком.
На основании данных условия задания:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4 ) напишите уравнение реакции этого вещества с цинком.
himege.ru
Презентация по Химии “Решение задач по химической формуле”
Презентация по Химии “Решение задач по химической формуле” – скачать смотреть бесплатно53335531463039513235404944384142294843374734365045565452
XСкопируйте код и вставьте его на свой сайт.
Решение задач по химической формуле
Описание презентации по отдельным слайдам:
 1 слайд
1 слайдРешение задач по химической формуле 9 класс Кузнецова О.А. учитель химии МБОУ “СОШ №7” г Обнинск
 2 слайд
2 слайдОпределение Химическая формула – это условная запись состава вещества с помощью химических знаков и математических индексов. Химическая формула отражает качественный и количественный состав вещества.
 3 слайд
3 слайдПо химической формуле можно рассчитать Относительную молекулярную массу вещества. Молярную массу вещества. Массовые доли элементов, входящих в состав вещества.
 4 слайд
4 слайдПо химической формуле можно рассчитать Количество вещества. Массу вещества Объем газообразного вещества Число атомов элемента, содержащихся в веществе определенной массы или объема.
 5 слайд
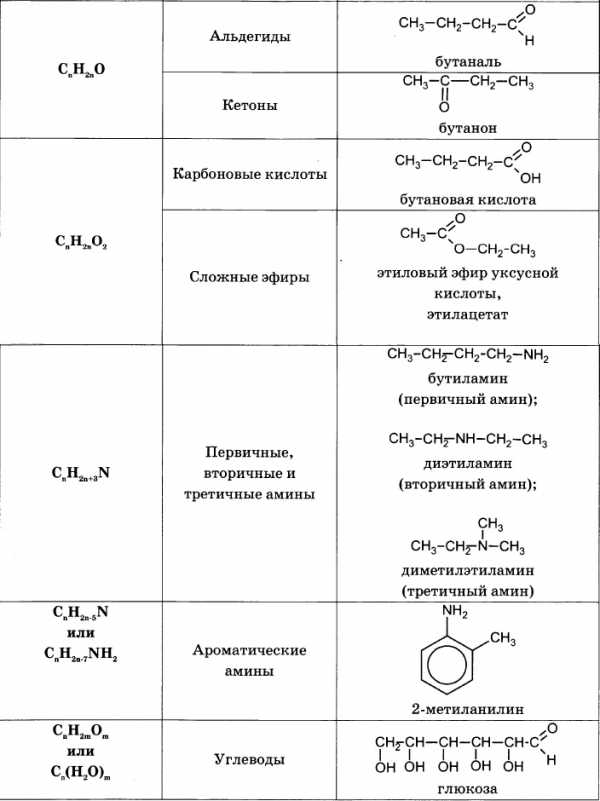
5 слайдЗадание №1 Вычислите относительные молекулярные массы следующих веществ: Серная кислота Сульфат алюминия Гидроксид бария Помощь Проверка Mr(h3SO4)=98 Mr(Al2(SO4)3)=342 Mr (Ba(OH)2)=171
 6 слайд
6 слайдПодсказка Относительная молекулярная масса равна сумме относительных атомных масс всех атомов, входящих в состав вещества, с учетом индексов.
 7 слайд
7 слайдЗадание №2 Вычислите молярные массы следующих веществ Нитрат кальция Карбонат лития Хлорид магния проверка M(Ca(NO3)2=164г/моль M(Li2CO3)=74г/моль M(MgCl2)=95г/моль
 8 слайд
8 слайдЗадание №3 Вычислите массовые доли всех элементов , входящих в состав серной кислоты Помощь Проверка
 9 слайд
9 слайдПодсказка Вычислите массовые доли всех элементов , входящих в состав серной кислоты
 10 слайд
10 слайдЗадание №4 Какая масса серы содержится в 120г серной кислоты? Дано: Решение: 1. Найти 2. Ответ: m(S)=39.18г
 11 слайд
11 слайдЗадание №5 Какая масса алюминия содержится в 300г сульфата алюминия? Дано: Решение: 1. Найти 2. Ответ: m(Al)=43.37г
 12 слайд
12 слайдЗадание №6 Какая масса хлора содержится в 240г хлорида магния? Дано: Решение: 1. Найти 2. Ответ: m(Сl)=179.38г
 13 слайд
13 слайдЗадание №7 Суточная потребность организма в железе составляет 0,01-0,02г. Обеспечит ли суточную потребность организма в железе добавление в пищу 0,1г. сульфата железа(II) при условии его полного усвоения? Запас – «депо» (0,5 г) Железосодержащие ферменты (0,4-0,7 г) Миоглобин – мышечный белок (0,3-0,6 г) Гемоглобин крови (3г)
 14 слайд
14 слайдЗадание №7 Дано: Решение: 1. Найти 2. 3. Ответ: да 0,037>0.02
 15 слайд
15 слайдПродолжите решение задач самостоятельно В эмали зубов человека содержится примерно 7500мг. натрия, а в дентине зубов – 11600мг. Подсчитайте, сколько атомов натрия находится в: а) дентине зубов; б) в эмали зубов человека. В организме взрослого человека содержится около 140г. магния, причем 2/3 от этого количества приходится на костную ткань. Подсчитайте, сколько атомов магния находится в: а) костной ткани; б) человеческом организме в целом. В организме взрослого человека содержится около 5г. железа, причем 2/3 от этого количества входит в состав гемоглобина. Подсчитайте, сколько атомов железа находится в: а) гемоглобине; б) человеческом организме в целом.
 16 слайд
16 слайдИспользованная литература 1. О.С. Габриелян Учебник «Химия – 8 класс» – М.: Дрофа, 2012г. 2. О.С. Габриелян Учебник «Химия – 9 класс» – М.: Дрофа, 2012г. 3. Картинки Гемоглобин: https://www.google.ru/url?sa=i&rct=j&q=&esrc=s&source=images&cd=&cad=rja&uact=8&docid=iIlE0Wz93-1-SM&tbnid=_WLg_gL7aXR3EM:&ved=0CAUQjRw&url=http%3A%2F%2Fwww.syl.ru%2Farticle%2F68576%2Fpovyishennyiy-gemoglobin-prichinyi-i-profilaktika&ei=WD4dU_iwBKa34wTg_IDgBA&bvm=bv.62578216,d.bGE&psig=AFQjCNHftM0ktdGsVoa9J76GHh9XwDxywg&ust=1394511792988621 Печень:https://www.google.ru/url?sa=i&rct=j&q=&esrc=s&source=images&cd=&cad=rja&uact=8&docid=gPK7UZ2fy7NsjM&tbnid=uhu8ZCSv2xz4zM:&ved=0CAUQjRw&url=http%3A%2F%2Fwww.zepper.ru%2Fpublic%2Fcategory%2Fteobiomed%2F&ei=nz4dU9qSE-aZ4wSuoYGICg&bvm=bv.62578216,d.bGE&psig=AFQjCNFwssoit7l-5Cbi2mwgjgdkcvYF9w&ust=1394511892137284
Чтобы скачать материал, введите свой email, укажите, кто Вы, и нажмите кнопку
Нажимая кнопку, Вы соглашаетесь получать от нас email-рассылку
Если скачивание материала не началось, нажмите еще раз “Скачать материал”.
72387295735876017719779579518215
336683380833837339533399334172341863420534206342353423634334
У вас есть презентация, загружайте:
Для того чтобы загрузить презентацию на сайт, необходимо зарегистрироваться.
uslide.ru
Методы решения задач по химии. Задачи на вывод химической формулы вещества
С задачами на вывод химической формулы вещества учащиеся встречаются при прохождении программы химии с 8 по 11 классы. К тому же, данный тип задач довольно часто встречается в олимпиадных заданиях, контрольно – измерительных материалах ЕГЭ (части В и С). Диапазон сложности данных задач достаточно широк. Как показывает опыт, у школьников часто возникают затруднения уже на первых этапах решения при выводе молярной массы вещества.
В данной разработке предлагаются задачи на нахождение формулы вещества, исходя из разных параметров в условиях. В представленных задачах приведены различные способы нахождения молярной массы вещества. Задачи составлены таким образом, чтобы учащиеся могли освоить оптимальные методы и различные варианты решения. Наглядно демонстрируются наиболее общие приёмы решений. Для учащихся предлагаются решённые задачи по принципу нарастания сложности и задачи для самостоятельного решения.
Таблица 1
Вывод химической формулы вещества: |
Номер задачи |
Вычисление молярной массы вещества |
Задачи для самостоятельного решения |
– на основании массовых долей (%) атомов элементов |
1 |
M, где n – число атомов |
Определить химическую формулу соединения, имеющего состав: натрий – 27,06%; азот – 16,47 %; кислород – 57,47%. Ответ: NaNO3 |
– на основании массовых долей (%) атомов элементов и плотности соединения |
2 |
М (CхНу) = D(Н2) ·М (Н2) |
Относительная плотность паров органического кислородсодержащего соединения по кислороду равна 3, 125. Массовая доля углерода равна 72%, водорода – 12 %. Выведите молекулярную формулу этого соединения. Ответ:C6H12О |
– по плотности вещества в газообразном состоянии |
3 |
М (в-ва) = ρ · М (газообр. в-ва) |
Относительная плотность паров предельного альдегида по кислороду равна 1,8125. Выведите молекулярную формулу альдегида. Ответ: C3Н6О |
– на основании массовых долей (%) атомов элементов и массе соединения |
4 |
М находится по соотношению, |
Углеводород содержит 81,82 % углерода. Масса 1 л. этого углеводорода (н.у.) составляет 1,964 г. Найдите молекулярную формулу углеводорода. |
– по массе или объёму исходного вещества и продуктам горения |
5 |
М (в-ва)=Vm·ρ |
Относительная плотность паров кислородсодержащего органического соединения по гелию равна 25,5. При сжигании 15,3 г. этого вещества образовалось 20,16 л. СО2 и 18,9 г. Н2О. Выведите молекулярную формулу этого вещества.Ответ: C6H14О |
Приводится пример решения задачи № 6 на применение уравнения Менделеева – Клайперона
Задача № 1
Массовая доля кислорода в одноосновной аминокислоте равна 42,67%. Установите молекулярную формулу кислоты.
Дано: |
Решение: M кислоты = 75 (г/моль) |
Вывести формулу соединения |
Вернуться к табл.1
Задача № 2
Относительная плотность углеводорода по водороду, имеющего состав: w(С) = 85,7 %; w (Н) = 14,3 %, равна 21. Выведите молекулярную формулу углеводорода.
Дано: |
Решение:
М (CхНу)= 21 · 2 = 42
m (Н) = 42г. /100% · 14,3 %= 6 г. Ответ: истинная формула вещества C3Н6. |
Вывести формулу соединения |
Вернуться к табл.1
Задача № 3
Определите молекулярную формулу алкана, если известно, что его пары в 2,5 раза тяжелее аргона.
Дано: |
Решение: |
Вывести формулу алкана |
Вернуться к табл.1
Задача № 4
Массовая доля углерода в соединении равна 39,97 %, водорода 6, 73 %, кислорода 53,30 %. Масса 300 мл. (н.у.) этого соединения равна 2,41 г. Выведите молекулярную формулу этого вещества.
Дано: |
Решение: |
Вывести формулу соединения |
Вернуться к табл.1
Задача № 5
Какова молекулярная формула углеводорода, имеющего плотность 1,97 г/л, если при сгорании 4,4 г. его в кислороде образовалось 6,72 л. СО2 и 7,2 г. Н2О.
Дано: |
Решение: Составляем пропорции: |
Вывести формулу |
Вернуться к табл.1
Задача № 6
Соединение содержит 62,8% S и 37,2% F. Масса 118 мл данного соединения при 70 и 98,64 КПа равна 0,51 г. Вывести формулу соединения.
Дано: |
Решение:
n(S) : n(F) = 62,80/32 : 37,2/19 = 1,96 : 1,96 = 1 : 1
M= (0, 51 · 8,31 · 280)/(98,64 ·103·118 ·10-6) = =101,95 г/моль.
Следовательно, формула соединения S2 F2 Ответ: S2F2 |
Вывести формулу соединения |
Вернуться к табл.1
poznanie21.ru
