Структура Периодической системы элементов Менделеева. Периоды большие и малые. Группы и подгруппы – главная и побочная
Структура периодической системы Периодическая система химических элементов — это классификация химических элементов, основанная на определенных особенностях строения атомов химических элементов. Она была составлена на основе Периодического закона, открытого в 1869 году Д. И. Менделеевым. В то время Периодическая система включала 63 химических элементов и по виду отличалась от современной. Сейчас в Периодической системы входят около ста двадцати химических элементов. Периодическую систему составлен в виде таблицы, в которой химические элементы расположены в определенном порядке: по мере роста их атомных масс. Сейчас существует много видов изображения Периодической системы. Наиболее распространенным является изображение в виде таблицы с расположением элементов слева направо. Все химические элементы в Периодической системе объединены в периоды и группы. Периодическая система включает семь периодов и восемь групп. Периодами называют горизонтальные ряды химических элементов, в которых свойства элементов изменяются от типичных металлических к неметаллическим. Вертикальные колонки химических элементов, которые содержат элементы, схожие по химическим свойствам, образуют группы химических элементов. Первый, второй и третий периоды называют малыми, поскольку они содержат небольшое количество элементов (первый — два элемента, второй и третий — по восемь элементов). Элементы второго и третьего периодов называют типовыми, их свойства закономерно изменяются от типичного металла до инертного газа. Все остальные периоды называют большими (четвертый и пятый содержат по 18 элементов, шестой — 32 и седьмой — 24 элемента). Особое сходство свойств проявляют элементы, находящиеся внутри больших периодов, в конце каждого четного ряда. Это так называемые триады: Ферум — Кобальт — Никол, образующих семью железа, и две другие: Рутений — Родий — Палладий и Осмий — Иридий — Платина, которые образуют семью платиновых металлов (платиноидов). В нижней части таблицы Д. И. Менделеева расположены химические элементы, образующие семью лантаноидов и семью актиноидов. Все эти элементы формально входят в состав третьей группы и идут после химических элементов лантана (номер 57) и актиния (номер 89). Периодическая система элементов содержит десять рядов. Малые периоды (первый, второй и третий) состоят из одного ряда, большие периоды (четвертый, пятый и шестой) содержат по два ряда каждый. В седьмом периоде находится один ряд. Каждый большой период состоит из четного и нечетного рядов. В парных рядах содержатся элементы металлы, в нечетных рядах свойства элементов изменяются так, как в типовых элементов, т. е. от металлических до выраженных неметаллических. Каждая группа таблицы Д. И. Менделеева состоит из двух подгрупп: главной и побочной. В состав главных подгрупп входят элементы как малых, так и больших периодов, то есть главные подгруппы начинаются либо с первого, или второго периода. В состав побочных подгрупп входят элементы только больших периодов, т. е. побочные подгруппы начинаются лишь с четвертого периода
touch.otvet.mail.ru
Группа и период в Таблице Менделеева.
2. Металлические свойства элементов в группе сверху вниз усиливаются, т. к. увеличивается количество энергетических уровней, отсюда увеличивается радиус атома, ослабевает притяжение электронов последнего энергетического уровня, уменьшается электроотрицательность, и следовательно усиливаются металлические свойства. В периоде от начала периода к концу металлические свойства ослабевают Т. К. возрастает заряд ядра атома элемента, усиливается притяжение электронов последнего энергетического уровня, возрастает электроотрицательность и ослабевают металлические свойства.
Период и группа, в таблице Менделеева имеются.
радиоактивные элементы подскажите как располагаются? период, группа, ряд
Группа периодической системы — Циклопедия
Группы периодической таблицы // KhanAcademyRussian [11:56]Группа периодической системы — последовательность атомов по возрастанию заряда ядра, включающая один или несколько столбцов в таблице Менделеева.
В периодической системе восемь групп элементов. Положение в группах s- и р-элементов определяется общим числом электронов внешнего слоя. Положение в группах d-элементов обусловливается общим числом s- электронов внешнего и d-электронов предвнешнего слоев. Как правило, номер группы соответствует высшей валентности атома.
Элементы групп подразделяются на подгруппы, s-и р-элементы составляют так называемую главную подгруппу, или подгруппу А; d-элементы — побочную, или подгруппу В. Cогласно Б. В. Некрасову, элементы группы подразделяются на три подгруппы: типические элементы и две подгруппы, составленные из элементов больших периодов.
Лантаноиды и актиноиды иногда объединяют во вторые побочные подгруппы. В каждой из них по два элемента — один лантаноид и один актиноид.
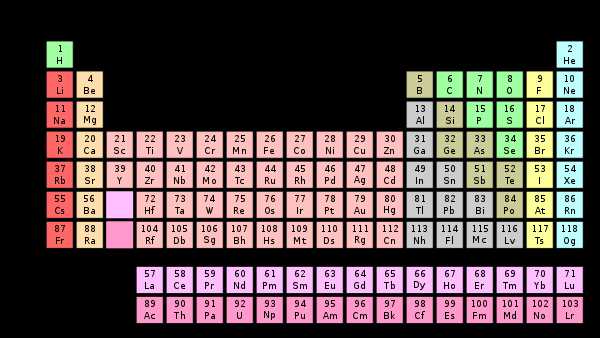
[править] Нумерация групп
Современная система нумерации содержит следующие группы (старые системы, Европейская и Американская, приведены в скобках):
- Группа 1 (IA, IA): щелочные металлы
- Группа 2 (IIA, IIA): щёлочноземельные металлы
- Группа 3 (IIIB, IIIA): подгруппа скандия
- Группа 4 (IVB, IVA): подгруппа титана
- Группа 5 (VB, VA): подгруппа ванадия
- Группа 6 (VIB, VIA): подгруппа хрома
- Группа 7 (VIIB, VIIA): подгруппа марганца
- Группа 8 (VIIIВ, VIIIA): подгруппа железа
- Группа 9 (VIIIВ, VIIIA): подгруппа кобальта
- Группа 10 (VIIIВ, VIIIA): подгруппа никеля
- Группа 11 (IB, IB): подгруппа меди
- Группа 12 (IIB, IIB): подгруппа цинка
- Группа 13 (IIIA, IIIB): подгруппа бора
- Группа 14 (IVA, IVB): подгруппа углерода
- Группа 15 (VA, VB): подгруппа азота
- Группа 16 (VIA, VIB): подгруппа кислорода (халькогены)
- Группа 17 (VIIA, VIIB): галогены
- Группа 18 (VIIIA, VIIIB): инертные газы
cyclowiki.org
