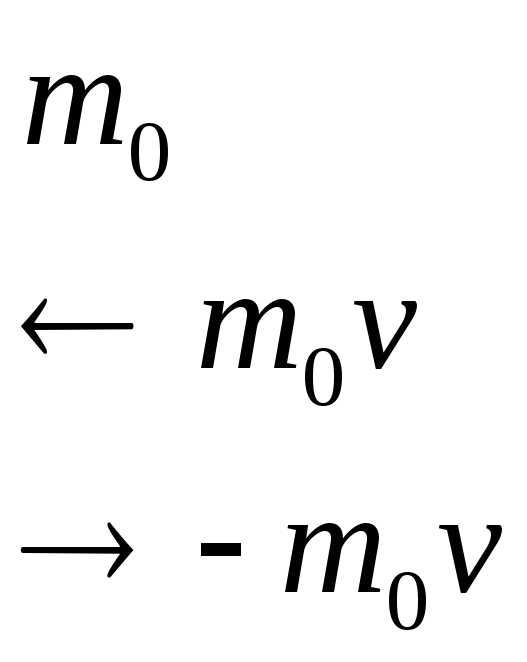Идеальный газ, все формулы и примеры
Это газ, который состоит из материальных точек, имеющих конечную массу, но не имеющих объема. Данные частицы не могут взаимодействовать на расстоянии. Столкновения частиц идеального газа описываются при помощи законов абсолютно упругого соударения шаров. Следует отметить, что имеются в виду законы столкновения именно шаров, так как точечные частицы испытывают только лобовые столкновения, которые не могут изменять направления скоростей на разные углы.
Идеальный газ существует только в теории. В реальной жизни он не может существовать в принципе, так как точечные молекулы и отсутствие их взаимодействия на расстоянии аналогично их существованию вне пространства, то есть их не существованию. Ближе всех по своим свойствам к модели идеального газа приближаются газы при малом давлении (разреженные газы) и (или) высокой температуре. Модель идеального газа подходит для изучения методов исследования систем многих частиц, знакомства с соответствующими понятиями.
В промежутках между столкновениями молекулы идеального газа движется по прямым. Законы столкновений и соударений о стенки сосудов, в которых находится газ, известны. Следовательно, если знать положения и скорости всех частиц идеального газа в какой-то момент времени, то можно найти их координаты и скорости в любой другой момент времени. Эта информация наиболее полно описывает состояние системы частиц. Однако количество частиц столь велико, что динамическое описание системы многих частиц непригодно для теории и бесполезно для практики. Это означает, что для изучения систем многих частиц информация должна быть обобщена, и ее относят не к отдельным частицам, а к их большим совокупностям.
Давление идеального газа
При помощи модели идеального газа удалось качественно и количественно объяснить давление газа на стенки сосуда, в котором он находится. Газ оказывает давление на стенки сосуда потому, что его молекулы взаимодействуют со стенками как упругие тела по законам классической механики. Количественно давление (p) идеального газа получили равным:
где — средняя кинетическая энергия поступательного движения молекул газа; — концентрация молекул газа (N – число молекул газа в сосуде; V – объем сосуда).
Законы идеальных газов
Идеальным называют газы, которые строго подчиняются законам Бойля – Мариотта и Гей – Люссака.
Закон Бойля – Мариотта. Для постоянной массы (m) идеального газа при постоянной температуре (T) произведение давления (p) газа на его объем (V) является постоянной величиной для любых состояний рассматриваемого вещества:
Закон Гей-Люссака. Для постоянной массы газа при неизменном давлении выполняется соотношение:
В поведении реальных газов наблюдают отступления от законов Бойля — Мариотта и Гей-Люссака, и эти отступления различны для разных газов.
Для идеального газа выполняется закон Шарля. Который говорит о том, что для постоянной массы газа, при постоянном объеме, отношение давления газа к температуре, не изменяется:
Для связи параметров идеального газа, часто используют уравнение состояния, которое носит имена двух ученых Клапейрона и Менделеева:
где — молярная масса газа; – универсальная газовая постоянная.
Закон Дальтона. Давление смеси идеальных газов (p) равно сумме парциальных давлений () рассматриваемых газов:
При этом уравнение состояния смеси идеальных газов имеет вид (2), как будто газ является химически однородным.
Примеры решения задач
ru.solverbook.com
2. Идеальный газ. Параметры состояния газа. Уравнение состояния идеального газа.
Простейшим объектом исследования идеальный газ. Идеальным газом называется газ, молекулы которого имеют пренебрежимо малый размер и не взаимодействуют на расстоянии. А при столкновениях взаимодействуют, как абсолютно упругие шары. Идеальный газ – абстракция. Но это понятие полезное, так как упрощает инженерные расчеты тепловых машин и процессов в них происходящих.
Основными параметрами газа, характеризующими
его состояние являются объем,  ,
давление,
,
давление, ,
и температура,
,
и температура, .
.
3. Атомная единица массы (а.Е.М.).
Массы молекул очень малы, 
1а.е.м. = 1,67 10-27кг =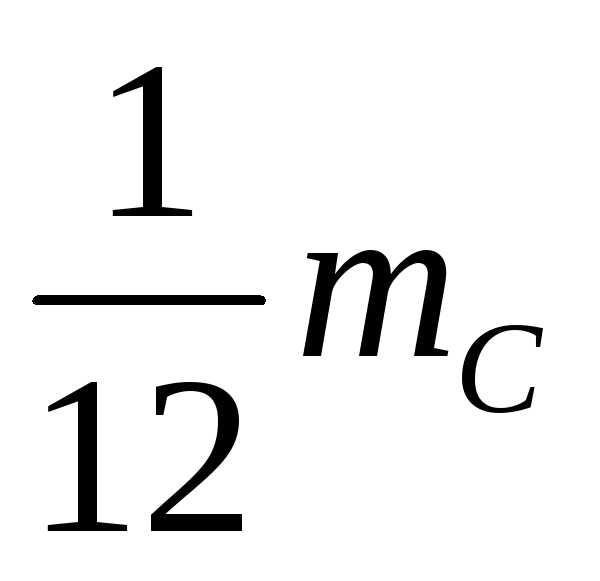 .
.
Массы всех атомов и молекул измеряют в а.е.м.:
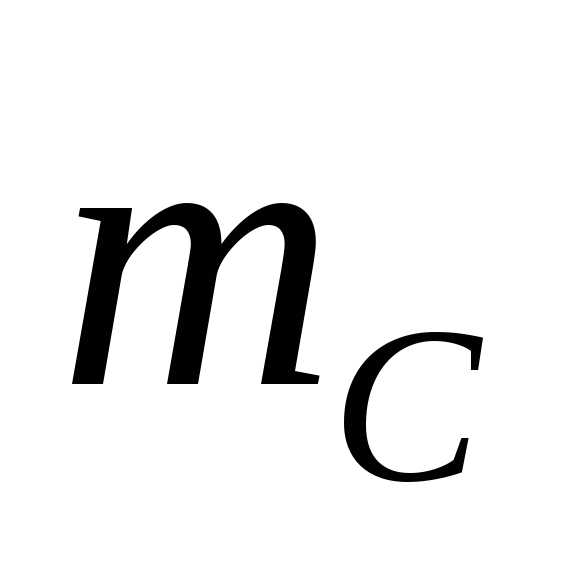 =
12 а.е.м.,
=
12 а.е.м.,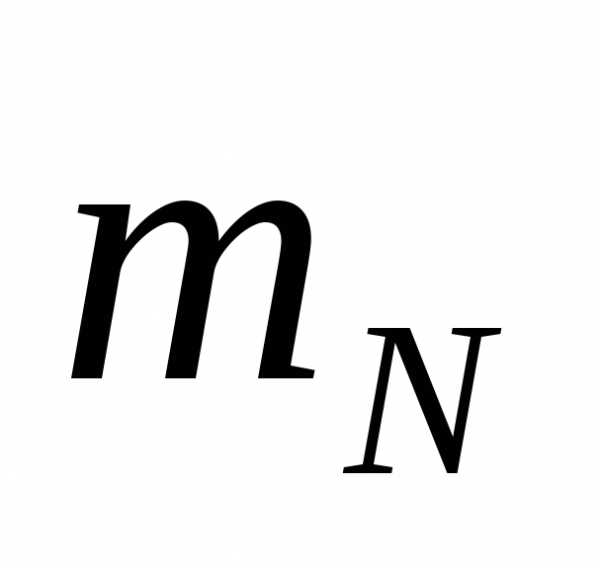 = 14 а.е.м.,
= 14 а.е.м.,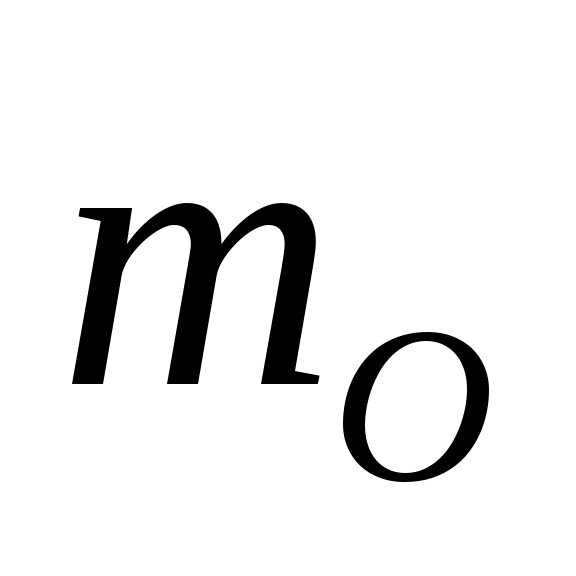 = 16 а.е.м.
= 16 а.е.м.
Относительной молекулярной (
 )
массой называется отношение массы
молекулы или атома к (1/12) массы атома
углерода
)
массой называется отношение массы
молекулы или атома к (1/12) массы атома
углерода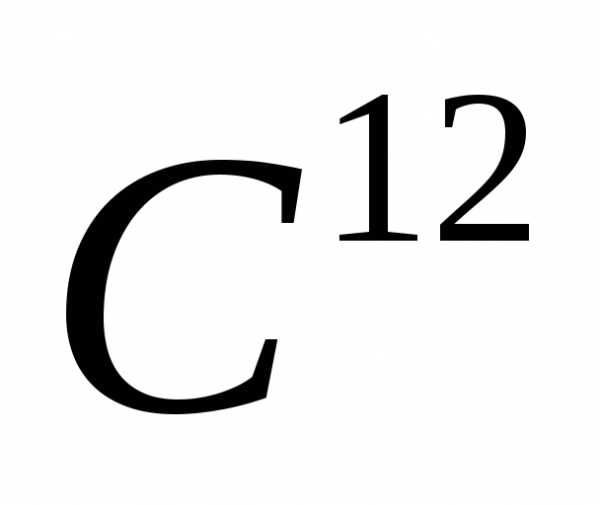 .
. Как видно из определения
– безразмерные величины. Единица массы,
равная (1/12) массы атома углерода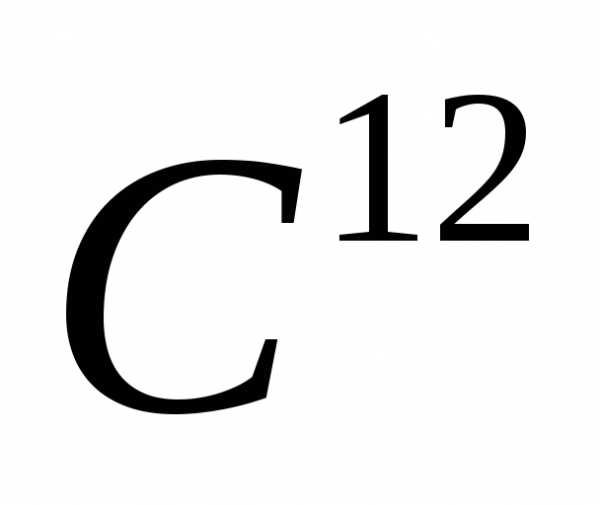 называется атомной единицей массы.
(а.е.м.). Обозначим эту единицу (то есть
а.е.м.), выраженную в килограммах через
называется атомной единицей массы.
(а.е.м.). Обозначим эту единицу (то есть
а.е.м.), выраженную в килограммах через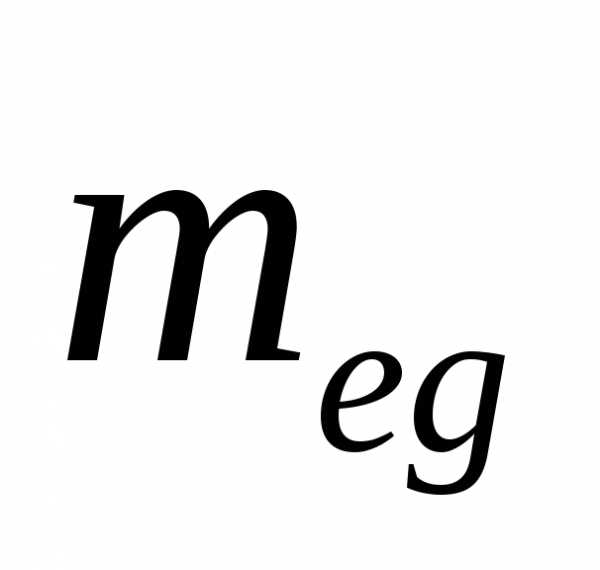 .
Тогда масса атома будет равна
.
Тогда масса атома будет равна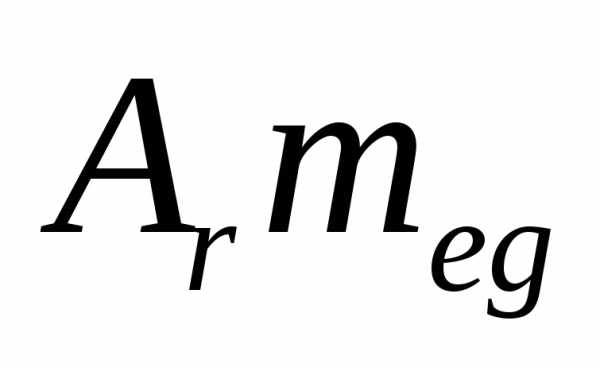
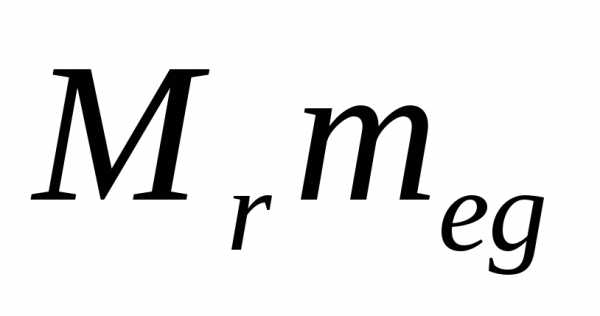 .
. Количество вещества, которое содержит
число частиц (атомов или молекул), равное
числу атомов в 0,012 кг изотопа 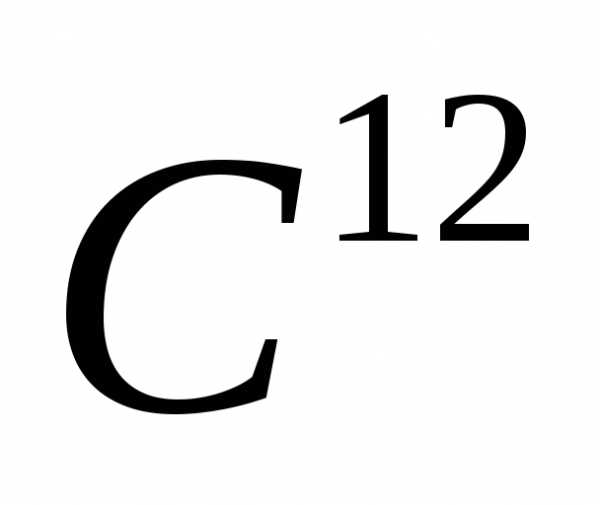 ,
называется молем.
,
называется молем.
Число частиц, содержащихся в моле
вещества называется числом Авогадро, 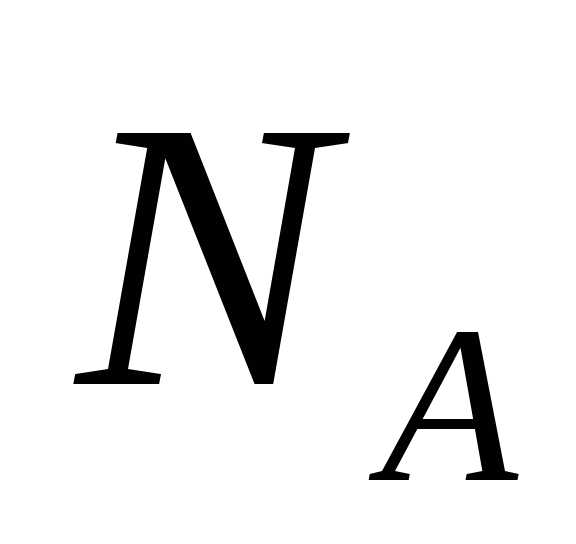 = 6,022 1023моль-1. Массу моля
называют молярной массой,
= 6,022 1023моль-1. Массу моля
называют молярной массой,
(1)
В случае углерода
(кг), (2)
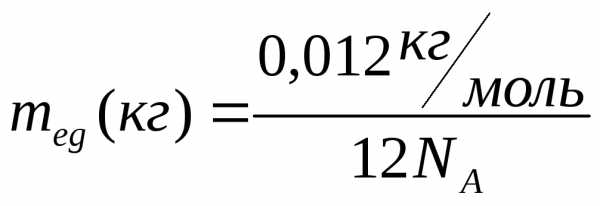 = 1,66 10-27кг.
= 1,66 10-27кг.
Из (2) следует, что
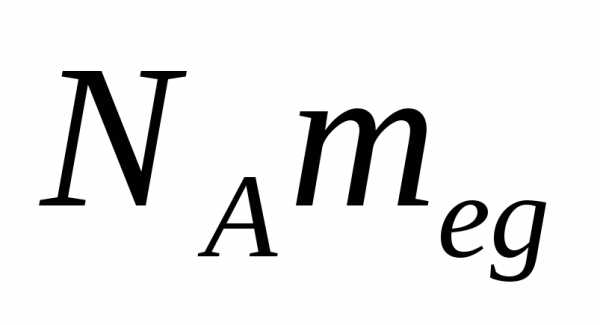 = 0,001 кг/моль.
(3)
= 0,001 кг/моль.
(3)
Подставляя (3) в (1), имеем
 = 0,001
= 0,001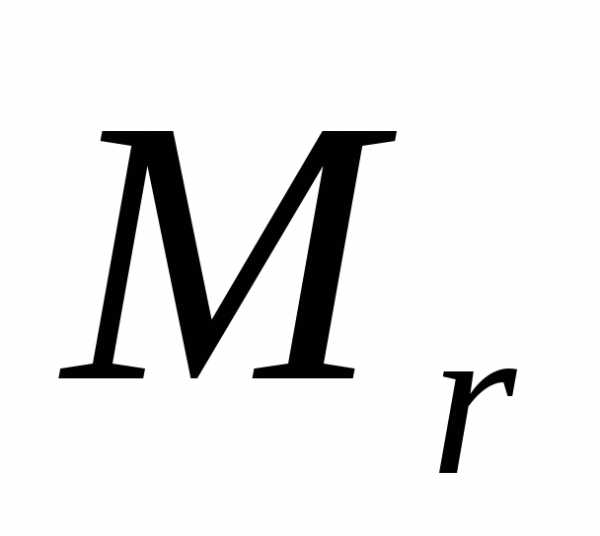 кг/моль
кг/моль
или

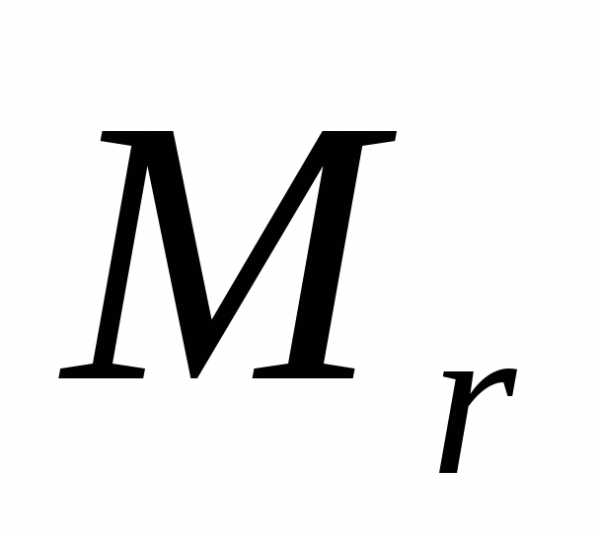 г/моль.
г/моль.Таким образом, масса моля, выраженная в граммах, численно равна относительной молекулярной массе.
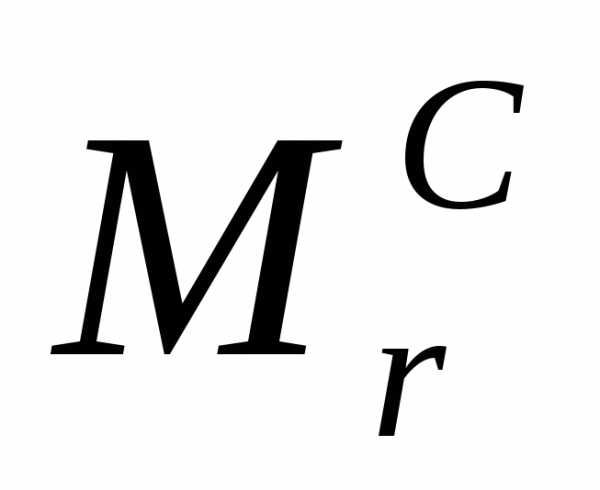 = 12а.е.м.
= 12а.е.м.
 = 12 г/моль,
= 12 г/моль,
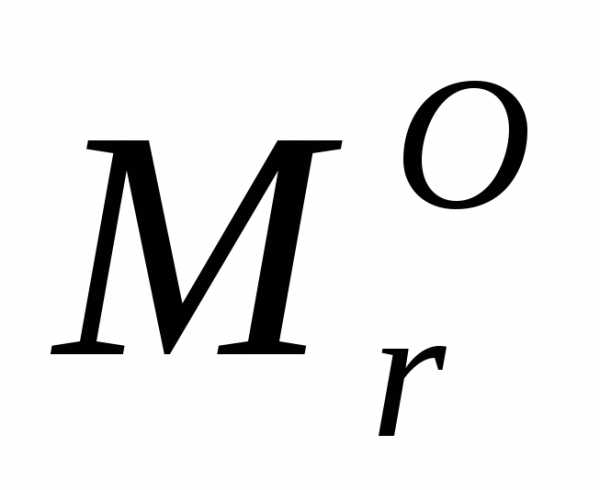 = 16а.е.м.
= 16а.е.м.
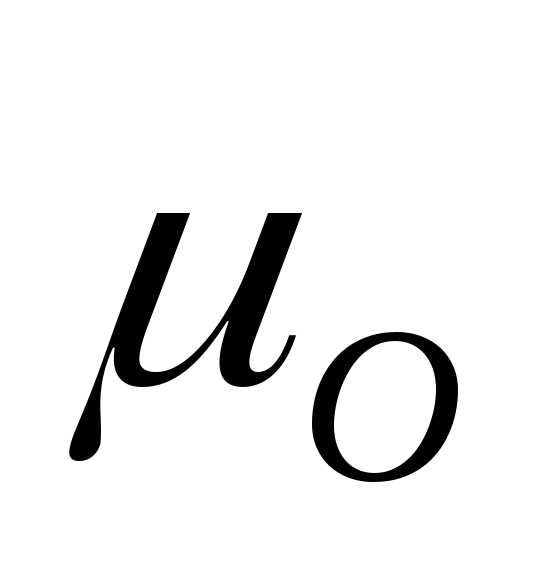
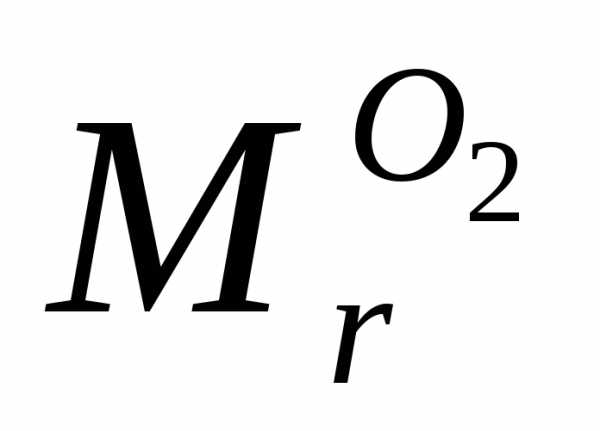 = 32а.е.м.
= 32а.е.м.
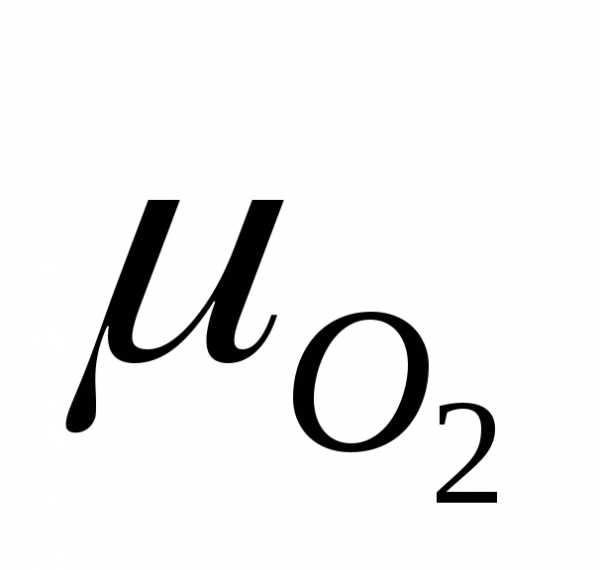 = 32 г/моль.
= 32 г/моль.
4. Свойства идеального газа.
Размеры молекул порядка 1 А =10-10м.
Давление равно силе, действующей
перпендикулярно на единичную площадку, 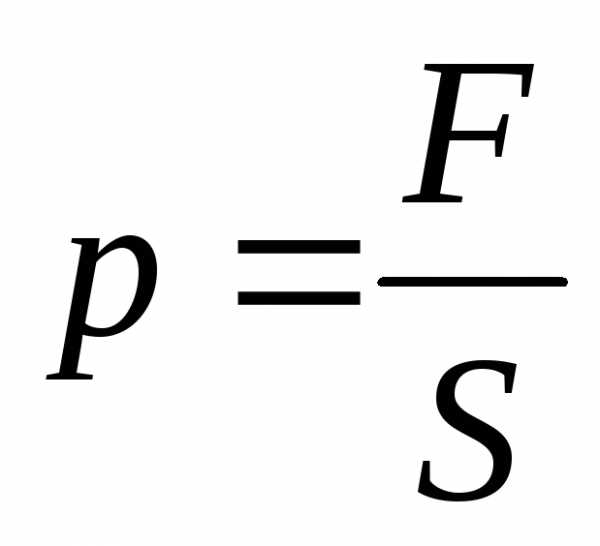 .
Давление в СИ измеряется в Па (паскалях).
Па = н/м2, 1 кг/см2= 1 атм = 9,8 104Па, 1 мм рт.ст. = 133 Па.
.
Давление в СИ измеряется в Па (паскалях).
Па = н/м2, 1 кг/см2= 1 атм = 9,8 104Па, 1 мм рт.ст. = 133 Па.
5. Уравнение Менделеева-Клапейрона.
При небольших плотностях газы подчиняются уравнению
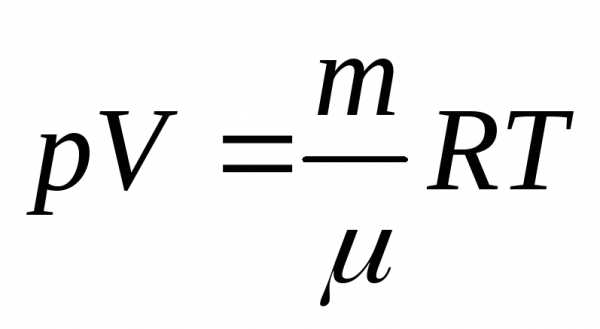
– уравнение состояния идеального газа
Менделеева-Клапейрона, 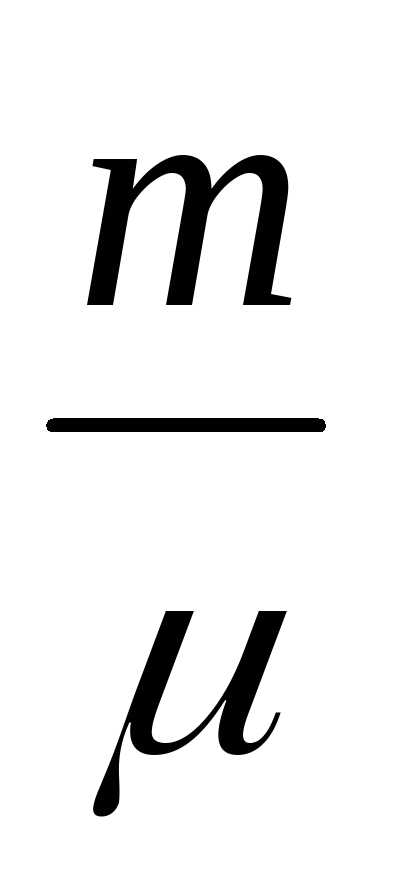 – число молей,
– число молей,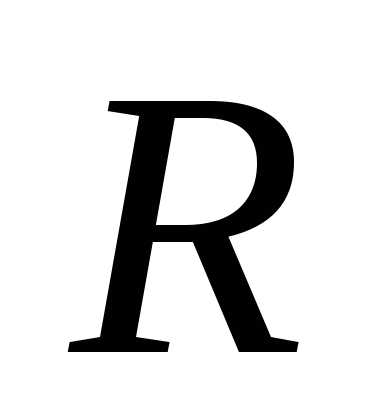 = 8,31 Дж/моль К. Можно уравнению придать
другой вид, если ввести величины
= 8,31 Дж/моль К. Можно уравнению придать
другой вид, если ввести величины
= 1,38 10-23Дж/К:
.
Если 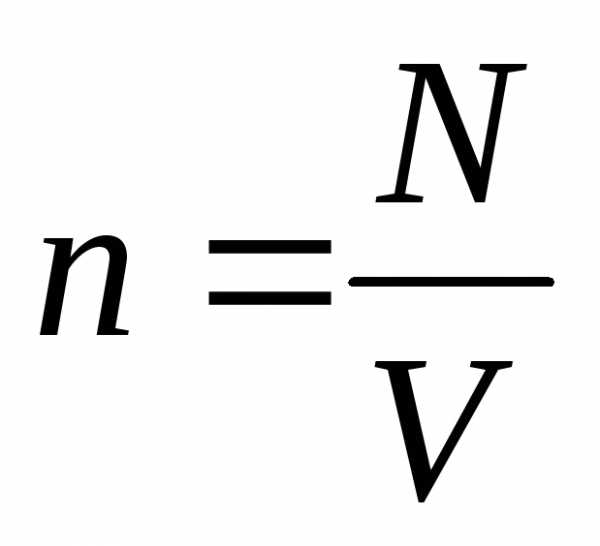 – концентрация частиц, то
– концентрация частиц, то
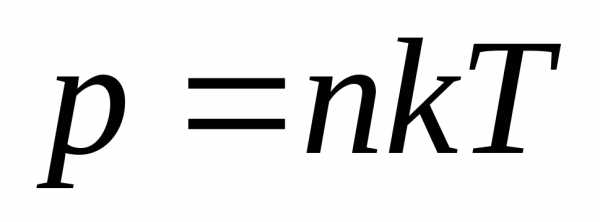 .
.
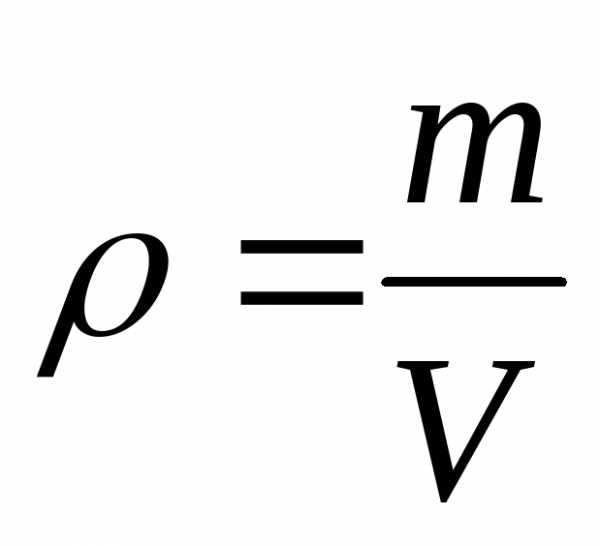 ,
то
,
то.
Это выражение используется в аэродинамике.
6. Основное уравнение кинетической теории газов (уравнение Клаузиуса).
Основное уравнение молекулярно кинетической теории связывает параметры состояния газа с характеристиками движения молекул.
Для вывода уравнения используется
статистический метод, то есть зная
характеристики отдельных молекул газа 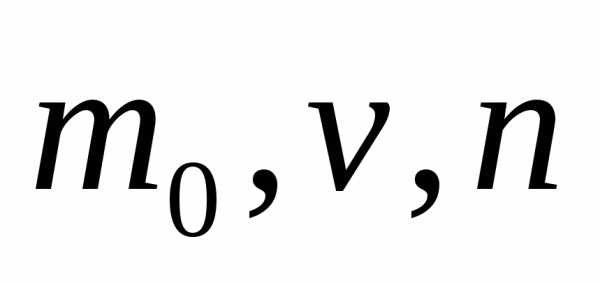 (концентрация)
можно найти
(концентрация)
можно найти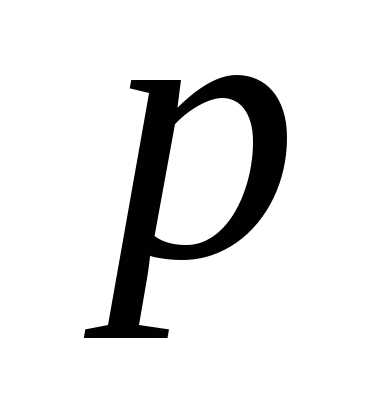 – давление газа, характеристику всего
газа.
– давление газа, характеристику всего
газа.
Для вывода уравнения рассмотрим
одноатомный идеальный газ. Молекулы
движутся хаотически. Скорости молекул
разные. Предположим, что число взаимных
столкновений между молекулами газа
пренебрежимо мало по сравнению с числом
ударов о стенки сосуда, соударения
молекул со стенками сосуда абсолютно
упруги. Найдем давление на стенки
сосуда, предположив, что газ находится
в сосуде кубической формы с ребром 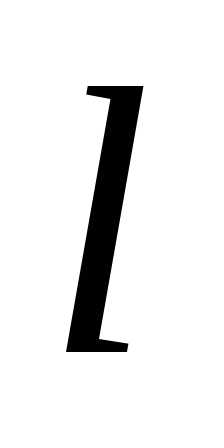 .
Давление ищем как усредненный результат
ударов молекул газа о стенки сосуда.
.
Давление ищем как усредненный результат
ударов молекул газа о стенки сосуда.
| Изменение импульса молекулы за счет столкновения со стенкой равно . |
1). По третьему закону Ньютона стенка
получает импульс от каждой молекулы 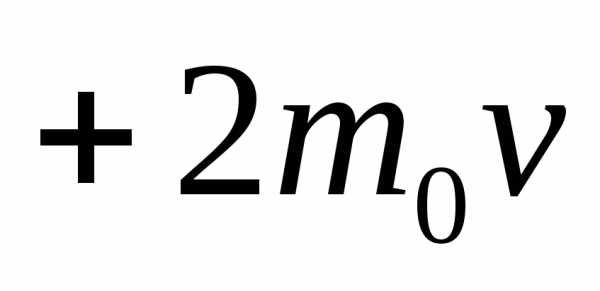
2). За время  площадки
площадки достигают
только те молекулы, которые заключены
в объеме
достигают
только те молекулы, которые заключены
в объеме
3). Число этих молекул в объеме  равно
равно
.
4). Число ударов о площадку равно 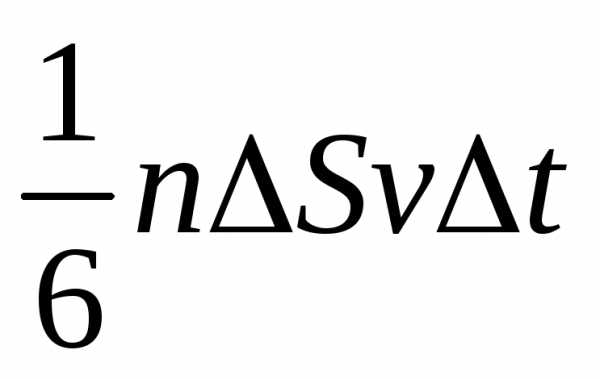 .
.
5). При столкновении молекулы передают площадке импульс
Учитывая, что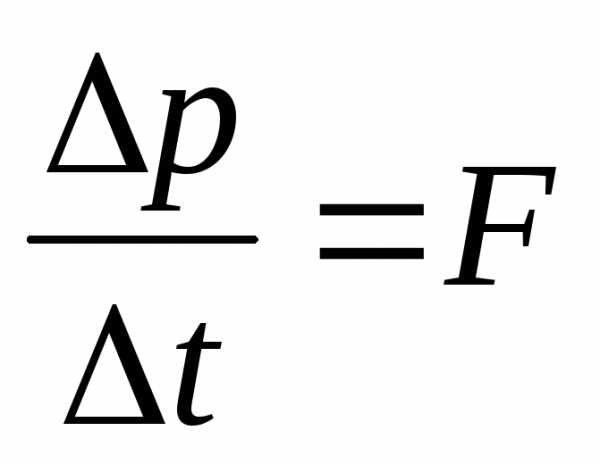 – сила, а
– сила, а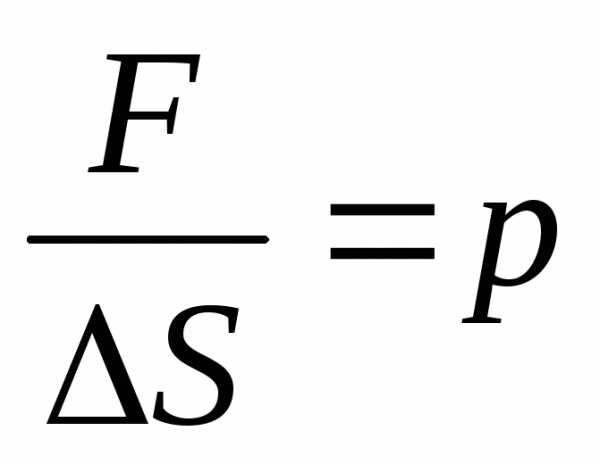 – давление,
– давление,
имеем для давления
(1)
Если в объеме газ содержит 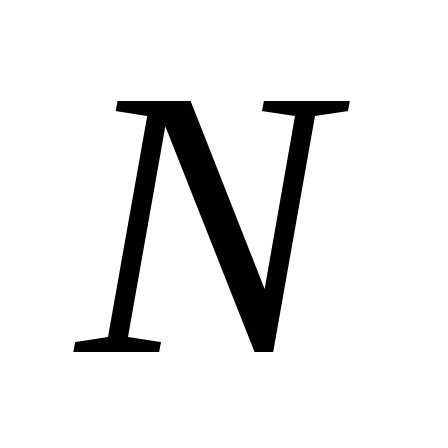 молекул, которые движутся со скоростями,
то надо ввести понятие о среднеквадратичной
скорости по формуле
молекул, которые движутся со скоростями,
то надо ввести понятие о среднеквадратичной
скорости по формуле
. (2)
Тогда выражение (1) примет вид
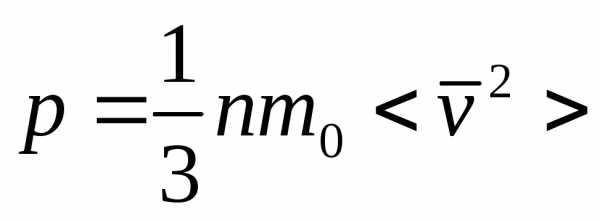 =
=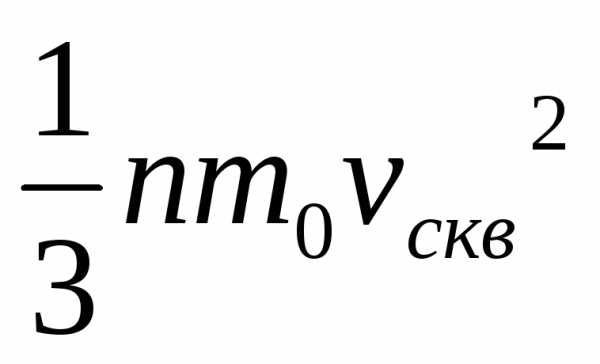
– Основное уравнение кинетической теории газов.
Это уравнение можно преобразовать, замечая, что
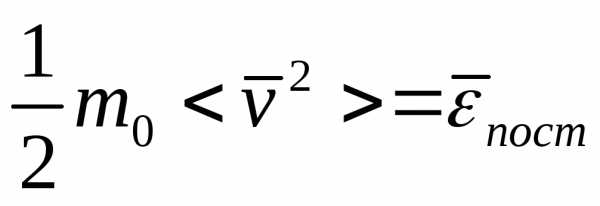 .
.
Тогда
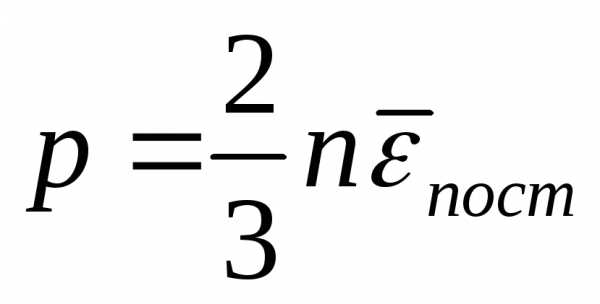 .
.
С другой стороны
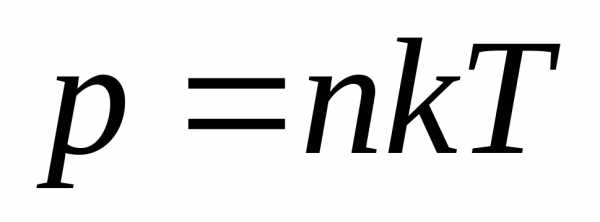 .
.
Поэтому
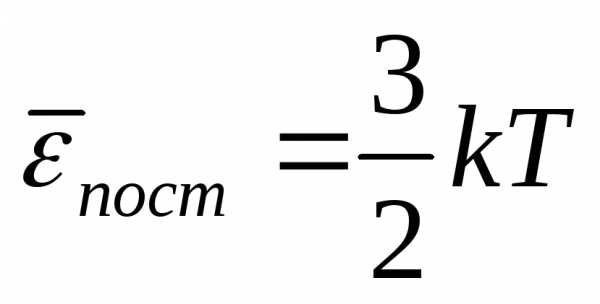 .
.
Средняя кинетическая энергия хаотического
движения молекул прямо пропорциональна
температуре и не зависит от массы. При
Т=0 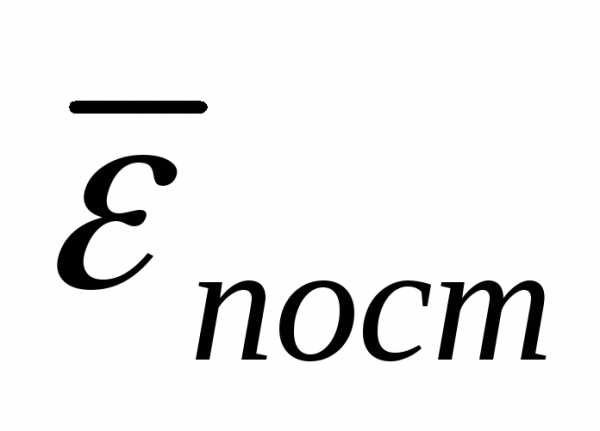 = 0, движение молекул газа прекращается
и давление равно нулю.
= 0, движение молекул газа прекращается
и давление равно нулю.
Абсолютная температура, Т – это мера средней кинетической энергии поступательного движения молекул идеального газа. Но это верно лишь при умеренных температурах, пока нет распада или ионизации молекул и атомов. Если число частиц в системе мало, то это тоже неверно, так как нельзя ввести понятие средней квадратичной скорости.
Из 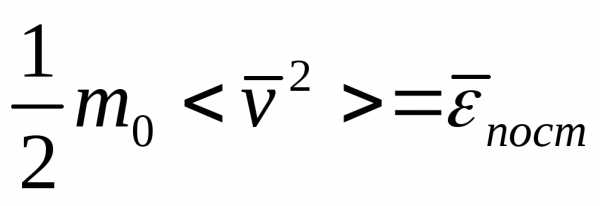 и
и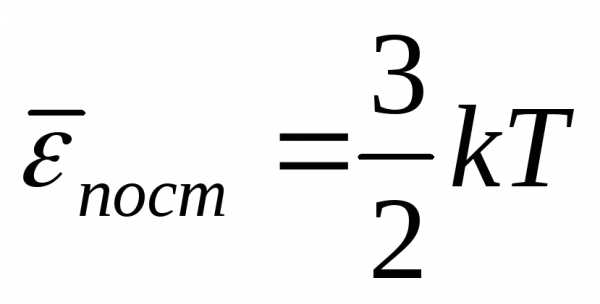 следует
следует
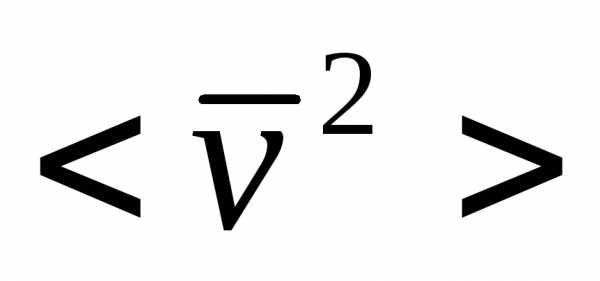 =
=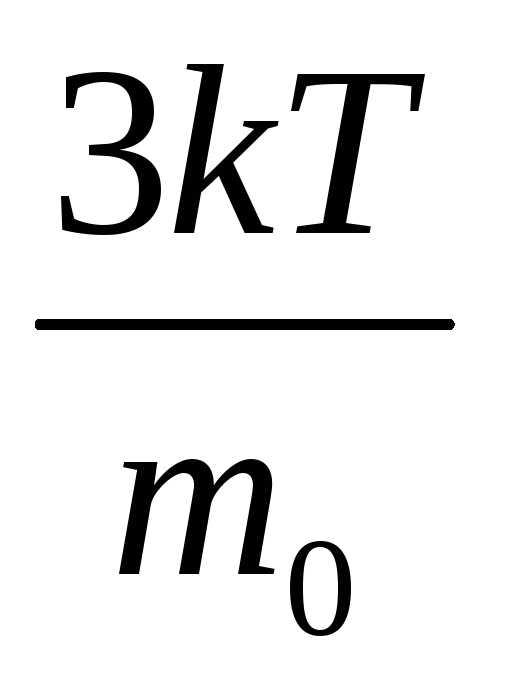 .
.
studfiles.net
4. Уравнение состояния идеального газа
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Менделеева — Клапейрона) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
где
— давление,
— молярный объём,
— универсальная газовая постоянная
— абсолютная температура,К.
Так как , где—количество вещества, а , где— масса,—молярная масса, уравнение состояния можно записать:
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
В случае постоянной массы газа уравнение можно записать в виде:
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака:
— закон Бойля — Мариотта.
— Закон Гей-Люссака.
— закон Шарля (второй закон Гей-Люссака, 1808 г.).А в форме пропорции этот закон удобен для расчёта перевода газа из одного состояния в другое. С точки зрения химика этот закон может звучать несколько иначе: Объёмы вступающих в реакцию газов при одинаковых условиях (температуре, давлении) относятся друг к другу и к объёмам образующихся газообразных соединений как простые целые числа. Например, 1 объёмводородасоединяется с 1 объёмом хлора, при этом образуются 2 объёма хлороводорода:
1 Объём азота соединяется с 3 объёмами водорода с образованием 2 объёмов аммиака:
— закон Бойля — Мариотта. Закон Бойля — Мариотта назван в честь ирландского физика, химика и философа Роберта Бойля (1627—1691), открывшего его в 1662 г., а также в честь французского физика Эдма Мариотта (1620—1684), который открыл этот закон независимо от Бойля в 1677 году. В некоторых случаях (в газовой динамике) уравнение состояния идеального газа удобно записывать в форме
где —показатель адиабаты, — внутренняя энергия единицы массы вещества.Эмиль Амага обнаружил, что при высоких давлениях поведение газов отклоняется от закона Бойля — Мариотта. И это обстоятельство может быть прояснено на основании молекулярных представлений.
С одной стороны, в сильно сжатых газах размеры самих молекул являются сравнимыми с расстояниями между молекулами. Таким образом, свободное пространство, в котором движутся молекулы, меньше, чем полный объём газа. Это обстоятельство увеличивает число ударов молекул в стенку, так как благодаря ему сокращается расстояние, которое должна пролететь молекула, чтобы достигнуть стенки. С другой стороны, в сильно сжатом и, следовательно, более плотном газе молекулы заметно притягиваются к другим молекулам гораздо большую часть времени, чем молекулы в разреженном газе. Это, наоборот, уменьшает число ударов молекул в стенку, так как при наличии притяжения к другим молекулам молекулы газа движутся по направлению к стенке с меньшей скоростью, чем при отсутствии притяжения. При не слишком больших давлениях более существенным является второе обстоятельство и произведение немного уменьшается. При очень высоких давлениях большую роль играет первое обстоятельство и произведениеувеличивается.
5. Основное уравнение молекулярно-кинетической теории идеальных газов
Для вывода основного уравнения молекулярно-кинетической теории рассмотрим одноатомный идеальный газ. Предположим, что молекулы газа движутся хаотически, число взаимных столкновений между молекулами газа пренебрежимо мало по сравнению с числом ударов о стенки сосуда, а соударения молекул со стенками сосуда абсолютно упругие. Выделим на стенке сосуда некоторую элементарную площадку DS и вычислим давление, оказываемое на эту площадку. При каждом соударении молекула, движущаяся перпендикулярно площадке, передает ей импульс m0v-(-m0v)=2m0v, где т0 — масса молекулы, v — ее скорость.
За время Dt площадки DS достигнут только те молекулы, которые заключены в объеме цилиндра с основанием DS и высотой vDt .Число этих молекул равно nDSvDt (n—концентрация молекул).
Необходимо, однако, учитывать, что реально молекулы движутся к площадке
DS под разными углами и имеют различные скорости, причем скорость молекул при каждом соударении меняется. Для упрощения расчетов хаотическое движение молекул заменяют движением вдоль трех взаимно перпендикулярных направлений, так что в любой момент времени вдоль каждого из них движется 1/3 молекул, причем половина молекул (1/6) движется вдоль данного направления в одну сторону, половина — в противоположную. Тогда число ударов молекул, движущихся в заданном направлении, о площадку DS будет 1/6nDSvDt. При столкновении с площадкой эти молекулы передадут ей импульс
DР = 2m0v•1/6nDSvDt=1/3nm0v2DSDt.
Тогда давление газа, оказываемое им на стенку сосуда,
p=DP/(DtDS)=1/3nm0v2. (3.1)
Если газ в объеме V содержит N молекул,
движущихся со скоростями v1, v2, …, vN, то
целесообразно рассматривать среднюю квадратичную скорость
характеризующую всю совокупность молекул газа.
Уравнение (3.1) с учетом (3.2) примет вид
р = 1/3пт0 <vкв>2. (3.3)
Выражение (3.3) называется основным уравнением молекулярно-кинетической теории идеальных газов. Точный расчет с учетом движения молекул по все-
возможным направлениям дает ту же формулу.
Учитывая, что n = N/V, получим
где Е — суммарная кинетическая энергия поступательного движения всех молекул газа.
Так как масса газа m =Nm0, то уравнение (3.4) можно переписать в виде
pV=1/3m<vкв>2.
Для одного моля газа т = М (М — молярная масса), поэтому
pVm=1/3M<vкв>2,
где Vm — молярный объем. С другой стороны, по уравнению Клапейрона — Менделеева, pVm=RT. Таким образом,
RT=1/3М <vкв>2, откуда
Так как М = m0NA, где m0—масса одной молекулы, а NА — постоянная Авогадро, то из уравнения (3.6) следует, что
где k = R/NA—постоянная Больцмана. Отсюда найдем, что при комнатной температуре молекулы кислорода имеют среднюю квадратичную скорость 480 м/с, водорода — 1900 м/с. При температуре жидкого гелия те же скорости будут соответственно 40 и 160 м/с.
Средняя кинетическая энергия поступательного движения одной молекулы идеального газа
<e0) =E/N = m0 <vкв>)2/2 = 3/2kT(43.8)
(использовали формулы (3.5) и (3.7)) пропорциональна термодинамической температуре и зависит только от нее. Из этого уравнения следует, что при T=0 <e0> =0,,т. е. при 0 К прекращается поступательное движение молекул газа, а следовательно, его давление равно нулю. Таким образом, термодинамическая температура является мерой средней кинетической энергии поступательного движения молекул идеального газа и формула (3.8) раскрывает молекулярно-кинетическое толкование температуры.
studfiles.net
МОЛЕКУЛЯРНАЯ ФИЗИКА
МОЛЕКУЛЯРНАЯ ФИЗИКА
Идеальный газ
Основные понятия
Основные положения молекулярной физики: 1) все вещества состоят из атомов и молекул, 2) они находятся в постоянном хаотическом движении. Поскольку размеры молекул малы, то в макроскопических объемах вещества содержится большое число молекул. Поэтому изучение движения молекул вещества основано на статистическом методе. Законы поведения большого числа молекул основаны на статистических закономерностях. Используются средние значения таких характеристик как скорость, энергия и т.д.
Термодинамикаизучает общие свойства
макроскопических систем, находящихся
в состоянии термодинамического
равновесия, а также процессы между ними.
Основу термодинамики составляют начала
– фундаментальные законы, установленные
опытным путем. Состояние термодинамических
( т/д) систем задается с помощью набора
т/д параметров, которые полностью
описывают свойства системы. К таким
параметрам относятся: давление, объем,
температура и др. Температура –
характеризует состояние т/д равновесия
макроскопической системы. Она имеет
смысл только для системы, находящейся
в состоянии равновесия.Термодинамическая
температурная шкалабазируется на
одной реперной точке – тройная точка
воды. (температура, при которой лед, вода
и насыщенный пар при давленииР=609 Па). Она равна273,16 К. В этой шкале
температура замерзания воды равна273,15 К. Температура в градусах Цельсия, ,
связана с т/д температурой соотношением
,
связана с т/д температурой соотношением
Удельный объем– это объем единицы массы вещества. Любое изменение состояния называется т/д процессом.
Идеаьный газ удовлетворяет следующим условиям:
1) Объем молекул газа пренебрежимо мал по сравнению с объемом сосуда
2) молекулы газа не взаимодействуют
3) столкновения молекул со стенками сосуда являются абсолютно упругими.
Газовые законы
Закон Бойля – Мариотта. Для заданной массы газа при постоянной температуре
дляи.
Графики в переменных 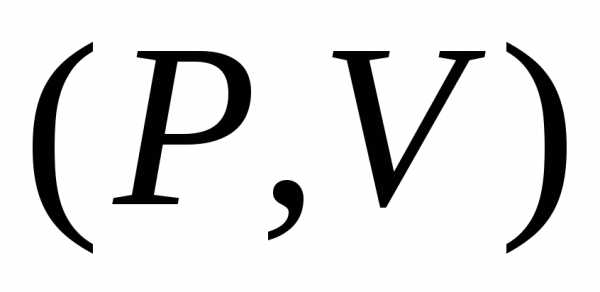 являются
гиперболами. Каждый график соответствует
одной температуре. Такие кривые называютсяизотермами. Процесс, идущий приназывается изотермическим.
являются
гиперболами. Каждый график соответствует
одной температуре. Такие кривые называютсяизотермами. Процесс, идущий приназывается изотермическим.
Рис 1
Законы Гей – Люссака.
1) прии.
График в переменных 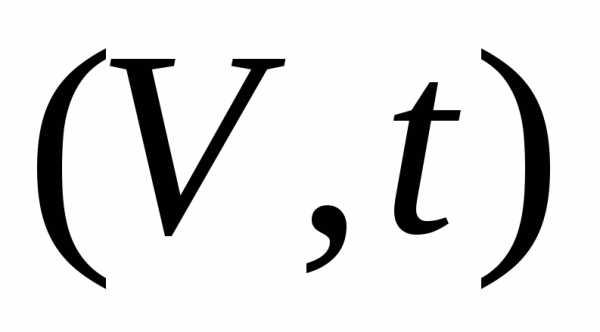 есть прямая линия. Каждая прямая
соответствует одному значению давления.
Такие линии называютсяизобарами.
Процесс, идущий приназывается изобарным.
есть прямая линия. Каждая прямая
соответствует одному значению давления.
Такие линии называютсяизобарами.
Процесс, идущий приназывается изобарным.
Рис
2) прии.
График в переменных 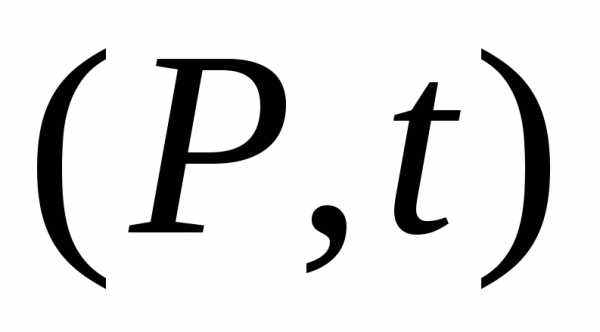 есть прямая линия. Каждая прямая
соответствует одному значению объема.
Такие линии называютсяизохорами.
Процесс, идущий приназывается изохорным.
есть прямая линия. Каждая прямая
соответствует одному значению объема.
Такие линии называютсяизохорами.
Процесс, идущий приназывается изохорным.
Рис
Значение коэффициента 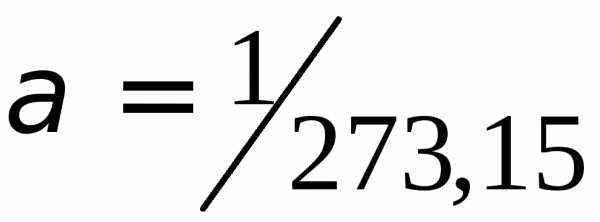
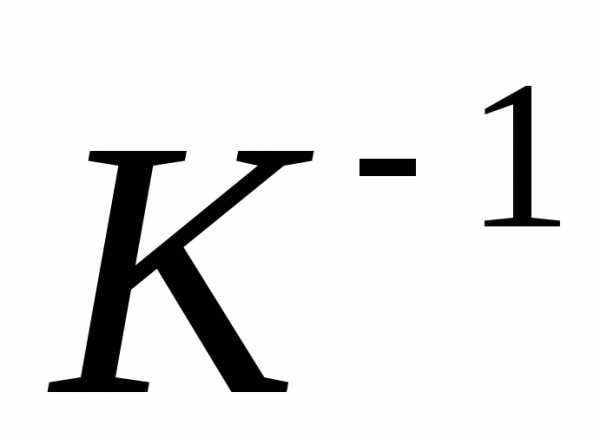 .
Если перейти к термодинамической
температуре,
получим следующие соотношения.
.
Если перейти к термодинамической
температуре,
получим следующие соотношения.
и. Несложно получить следующие соотношения:
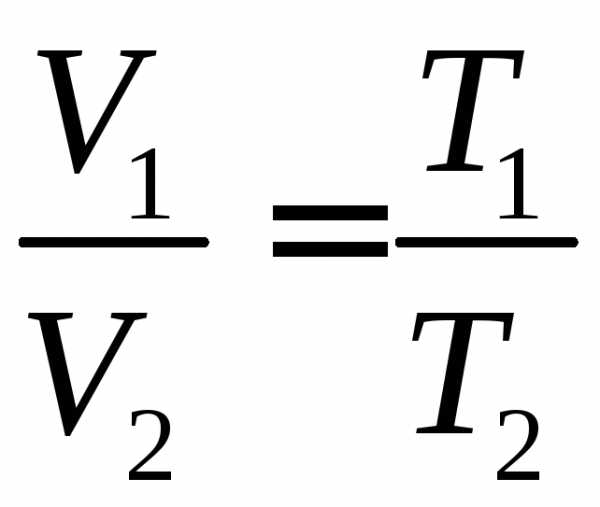 при.
при.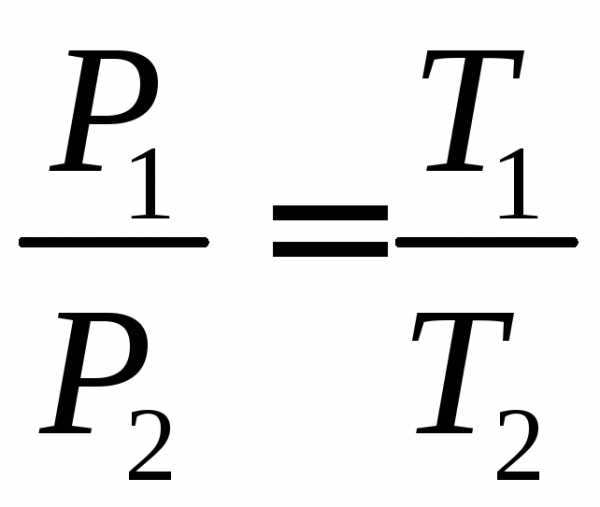 при.
при.
Закон Авогадро.Один моль любого
газа при одинаковых температуре и
давлении занимает одинаковый объем.
При нормальных условиях этот объем
равен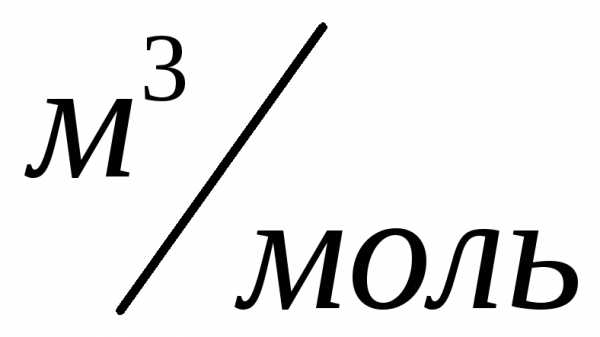 .
Один моль различных веществ содержит
одно и тоже число молекул, которое
называетсяпостоянной Авогадро:
.
Один моль различных веществ содержит
одно и тоже число молекул, которое
называетсяпостоянной Авогадро: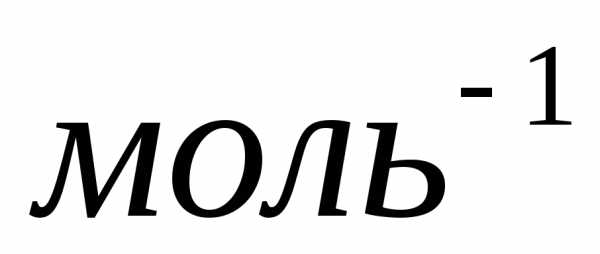 .
.
Нормальные условия: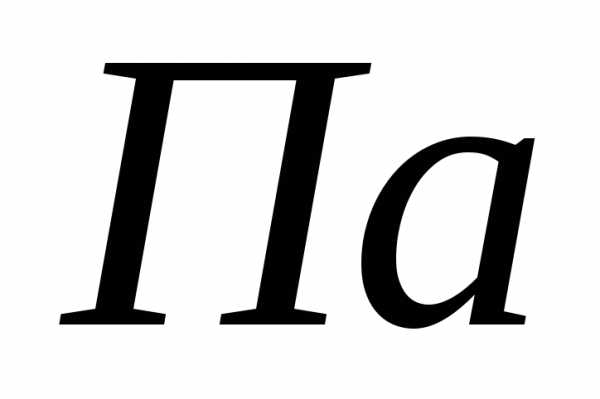 ,,
,,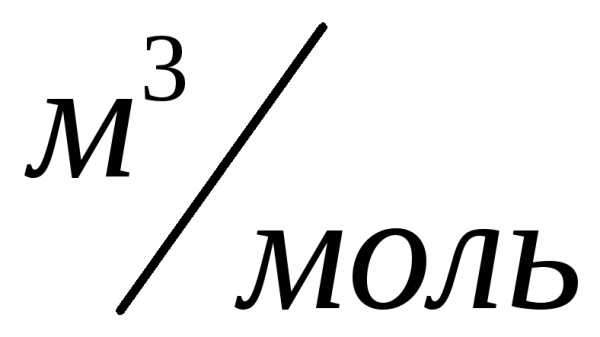 .
.
Закон Дальтона:Полное давление в
газовой смеси:где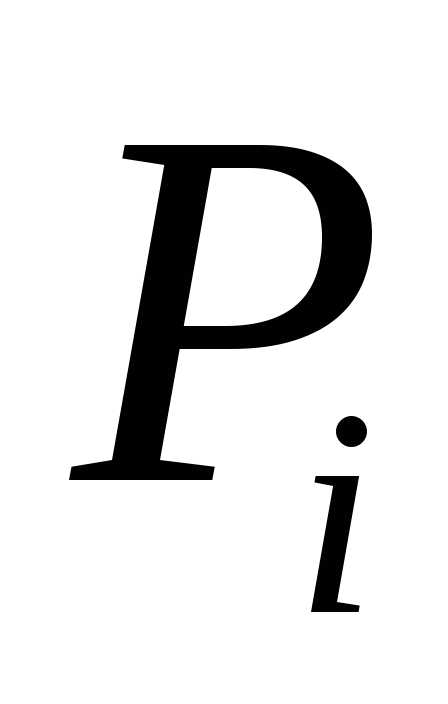 – парциальное давление
– парциальное давление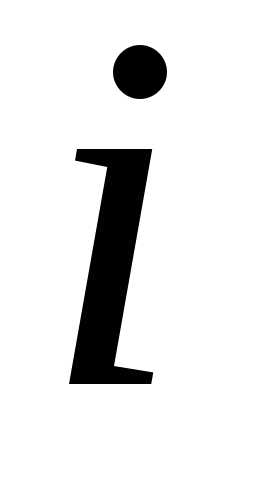 компоненты. Парциальное давление – это
давление одной компоненты газовой
смеси, когда она занимает весь объем
при той же температуре.
компоненты. Парциальное давление – это
давление одной компоненты газовой
смеси, когда она занимает весь объем
при той же температуре.
Уравнение Клапейрона – Менделеева
Уравнение, которые связывают переменные 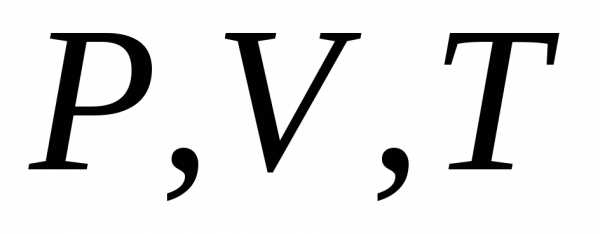 называется уравнением состояния. Оно
имеет вид.
Клапейрон вывел уравнение состояния
идеального газа, на основе законов Бойля
– Мариотта и Гей-Люссака. Рассмотрим
процесс изображенный на рисунке в
координатах
называется уравнением состояния. Оно
имеет вид.
Клапейрон вывел уравнение состояния
идеального газа, на основе законов Бойля
– Мариотта и Гей-Люссака. Рассмотрим
процесс изображенный на рисунке в
координатах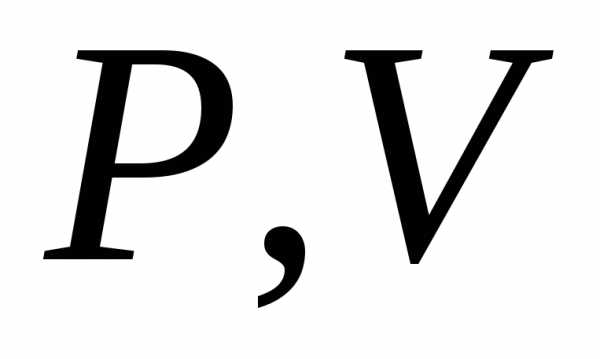 :.
Первый шаг – изотермический, второй –
изохорный процессы.
:.
Первый шаг – изотермический, второй –
изохорный процессы.
Рис
Для изотермического процесса имеем
.
Для изохорного –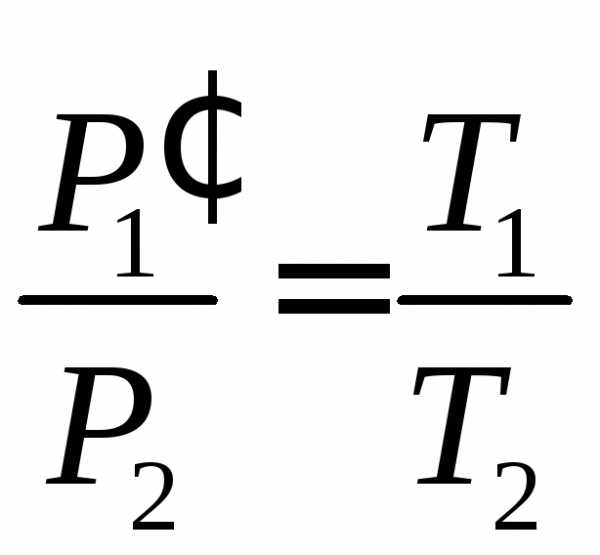 или
или
.
Исключая ,
в силу произвольности исходного и
конечного состояний находим
,
в силу произвольности исходного и
конечного состояний находим
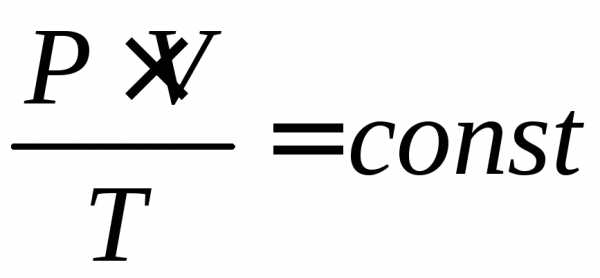 .
(1)
.
(1)
Уравнение (1) – уравнение Клапейрона.
Постоянная является различной для
разных газов. Менделеев, используя закон
Авогадро, переписал уравнение Клапейрона
для одного моля газа. Для этого он
использовал молярный объем, 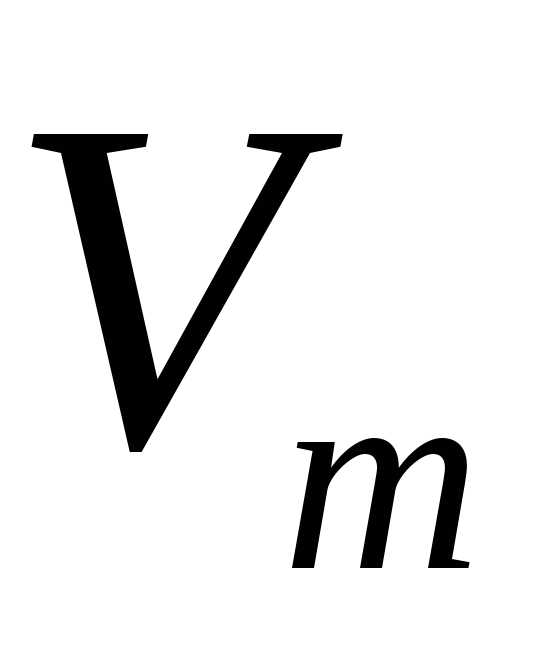 , который одинаков для любого вида газа.
Как следствие этого, постоянная в
уравнении Клапейрона будет одинаковой
для всех газов.
, который одинаков для любого вида газа.
Как следствие этого, постоянная в
уравнении Клапейрона будет одинаковой
для всех газов.
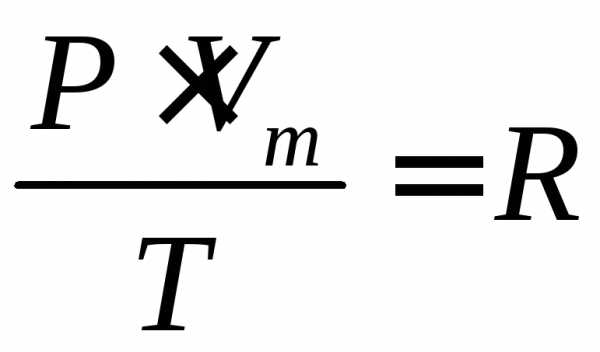 (2)
(2)
 – молярная газовая постоянная.при нормальных условиях. Для произвольной
массы газа
– молярная газовая постоянная.при нормальных условиях. Для произвольной
массы газа
(3)
где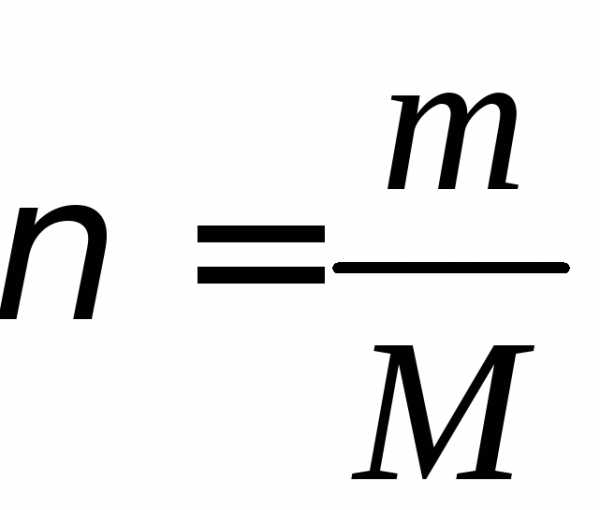 – количество вещества,
– количество вещества,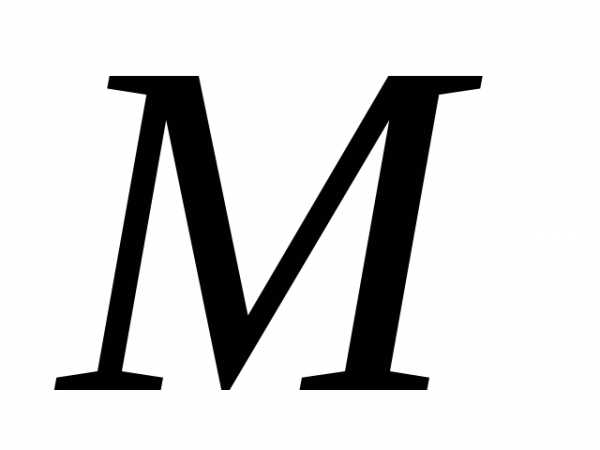 – молярная масса – это масса одного моля
вещества. Уравнения (2) и (3) это ур.
Клапейрона – Менделеева. Молярная масса
– молярная масса – это масса одного моля
вещества. Уравнения (2) и (3) это ур.
Клапейрона – Менделеева. Молярная масса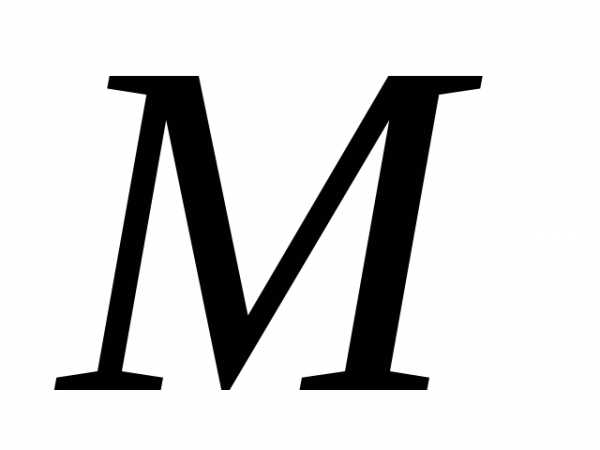 численно равна относительной массе
молекулы.
численно равна относительной массе
молекулы.
Введем постоянную Больцмана
.
Уравнение состояния идеального газа примет вид:
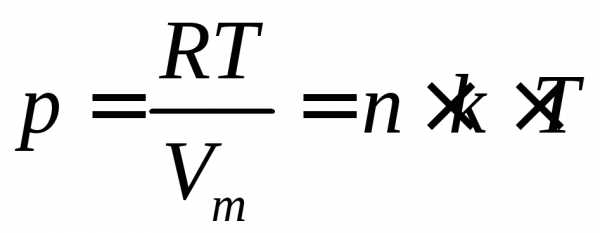
где 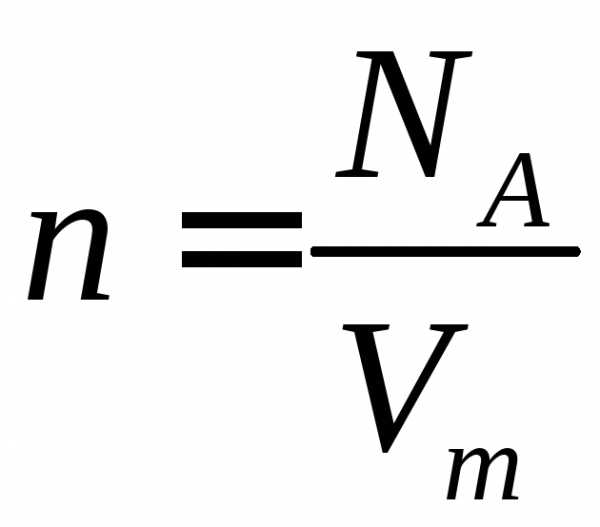 – концентрация молекул.
– концентрация молекул.
Основное уравнение молекулярно-кинетической теории идеальных газов.
Молекулы идеального газа двигаются
хаотично. Предположим, что число
соударений между молекулами газа мало
по сравнению с числом соударений о
стенки сосуда. Удары молекул о стенки
считаем абсолютно упругими. Эти удары
определяют давление в газе. Найдем
давление газа в сосуде. Выделим на стенке
сосуда площадку  и определим давление газа на эту площадку.
Давление определяется по формуле сила,
деленная на площадь:
и определим давление газа на эту площадку.
Давление определяется по формуле сила,
деленная на площадь:
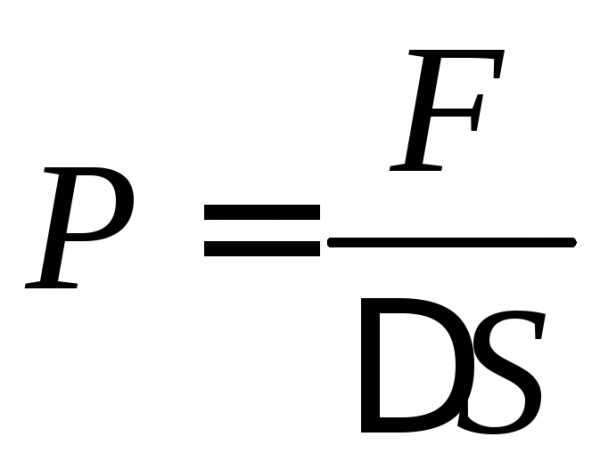 (1)
(1)
Сила определяется согласно второму закону Ньютона:
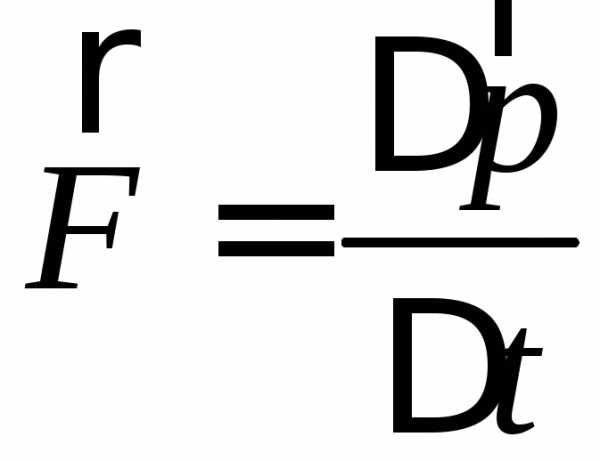 (2)
(2)
Это изменение импульса во времени.
Найдем изменение импульса молекул газа
при соударении со стенкой сосуда. Когда
молекула двигается перпендикулярно
стенке, при упругом ударе стенке
передается импульс: 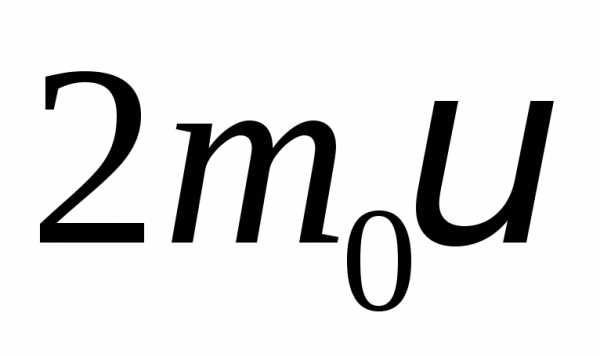 .
.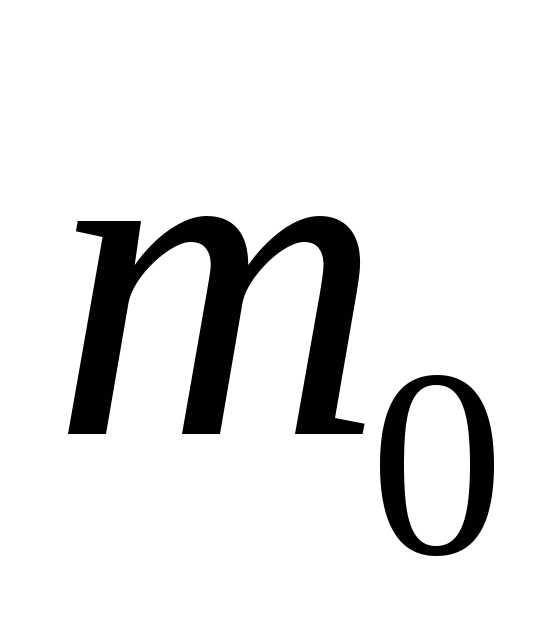 – масса молекулы,
– масса молекулы, – скорость молекулы. За время
– скорость молекулы. За время те молекулы достигнут площадки
те молекулы достигнут площадки ,
которые находятся в объеме.
Число таких молекул равно,
где
,
которые находятся в объеме.
Число таких молекул равно,
где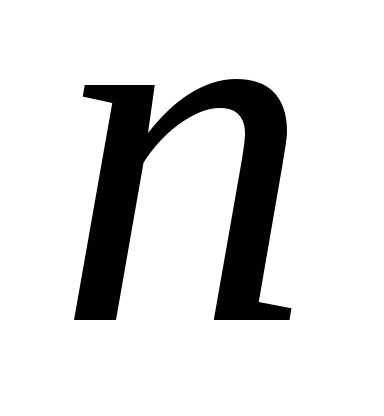 – концентрация молекул. Из-за хаотичного
движения молекулы достигают стенки под
произвольным углом, а не только под
прямым. Чтобы учесть это предположим,
что все молекулы двигаются вдоль трех
взаимно перпендикулярных направлений.
Число молекул двигающихся вдоль каждой
оси одинаково и составляет
– концентрация молекул. Из-за хаотичного
движения молекулы достигают стенки под
произвольным углом, а не только под
прямым. Чтобы учесть это предположим,
что все молекулы двигаются вдоль трех
взаимно перпендикулярных направлений.
Число молекул двигающихся вдоль каждой
оси одинаково и составляет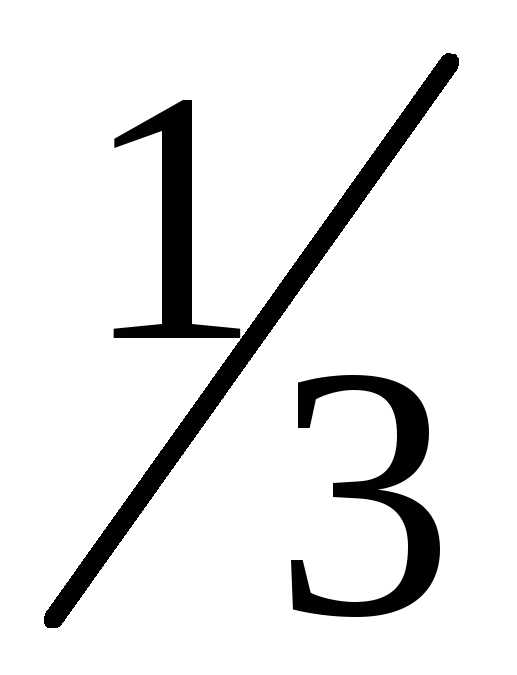 от полного числа молекул. Вдоль каждой
оси молекулы двигаются в двух
противоположных направлениях. Тогда
число ударов о площадку равно
от полного числа молекул. Вдоль каждой
оси молекулы двигаются в двух
противоположных направлениях. Тогда
число ударов о площадку равно
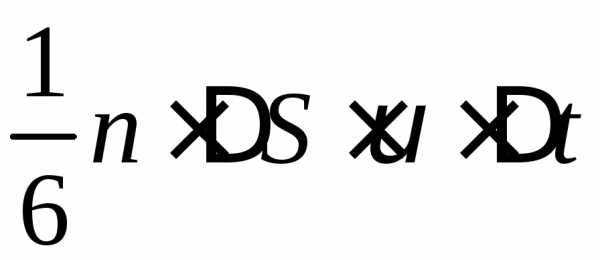 .
Они передадут стенке импульс
.
Они передадут стенке импульс
(3)
Подставим найденное изменение импульса в определение силы и далее в формулу (1). Найдем давление
(4)
Поскольку молекулы двигаются с различными скоростями, то вводят среднюю квадратичную скорость:
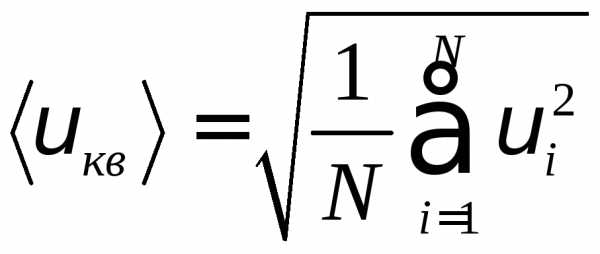 (5)
(5)
где  – число молекул в газе. Уравнение для
давления газа в сосуде примет вид:
– число молекул в газе. Уравнение для
давления газа в сосуде примет вид:
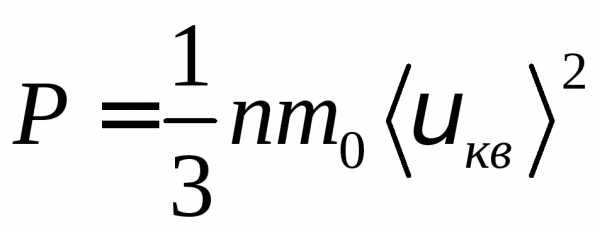 (6)
(6)
Это основное уравнение молекулярно –
кинетической теории (МКТ) газов. Точный
расчет приводит к такой формуле. Придадим
этой фортеле иной вид, используя уравнение
для идеального газа. В ур. (6) подставим
выражение для концентрации 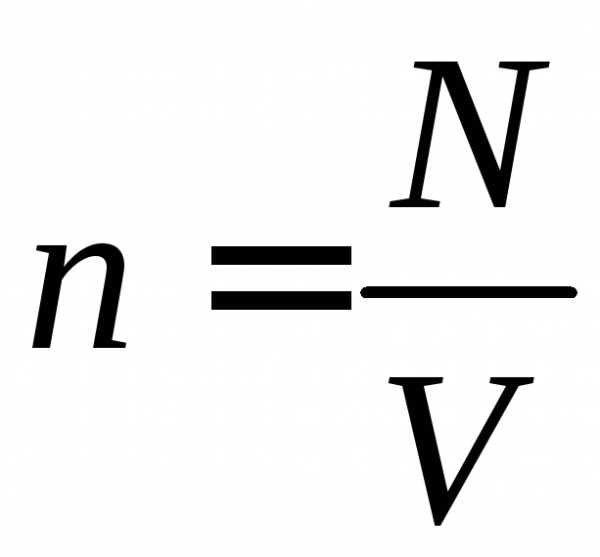 и умножим обе части равенства на объем
и умножим обе части равенства на объем .
.
(7)
где  – суммариная кинетическая энергия
поступательного движения молекул газа.
Введем массу газа
– суммариная кинетическая энергия
поступательного движения молекул газа.
Введем массу газа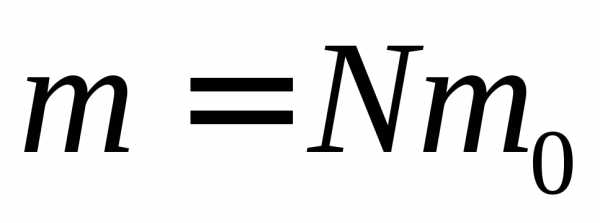 и молярную массу газа
и молярную массу газа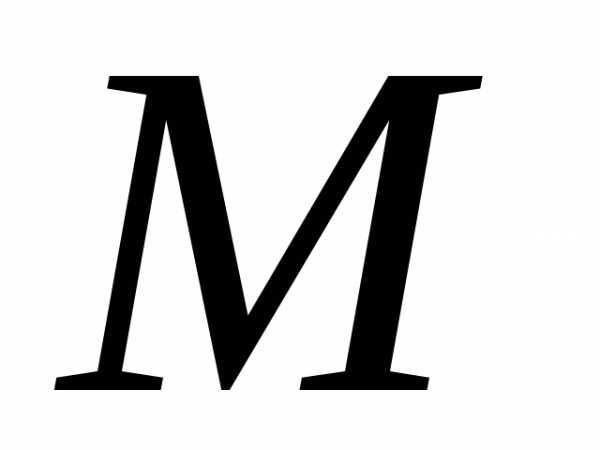 .
Это масса одного моля газа.
.
Это масса одного моля газа.
Для произвольной массы газа: 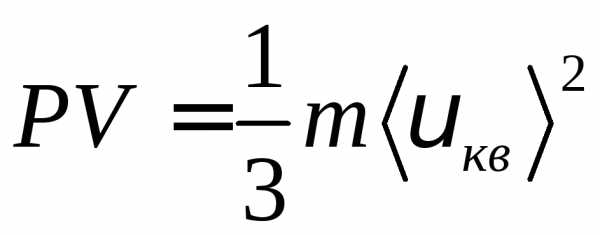 для одного моля газа:
для одного моля газа: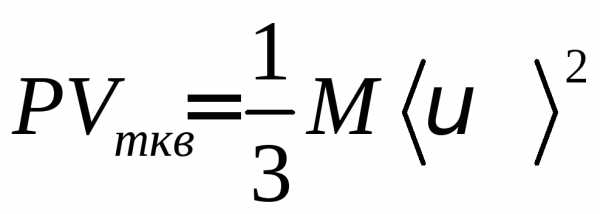 .
Используя это соотношение и уравнение
Менделеева – Клапейрона,,
получаем соотношение
.
Используя это соотношение и уравнение
Менделеева – Клапейрона,,
получаем соотношение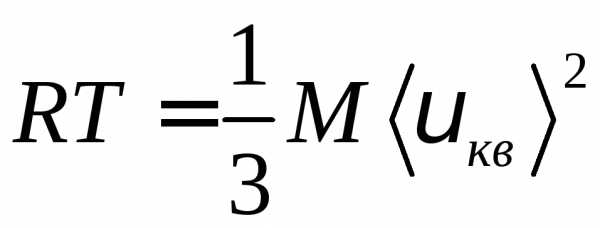 .
Отсюда находим:
.
Отсюда находим:
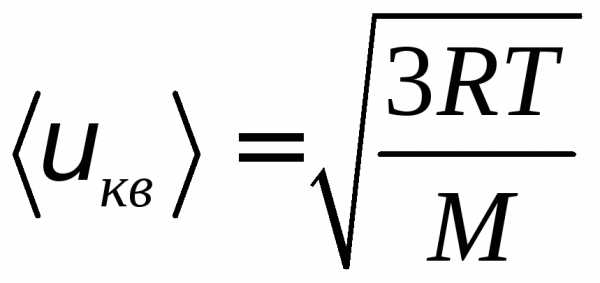 (8)
(8)
Так как молярная масса
,
где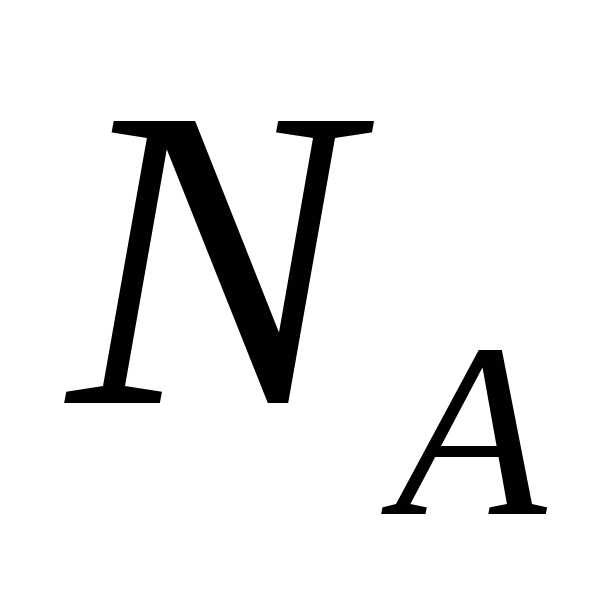 – число Авогадро, можно получить
– число Авогадро, можно получить
(9)
где 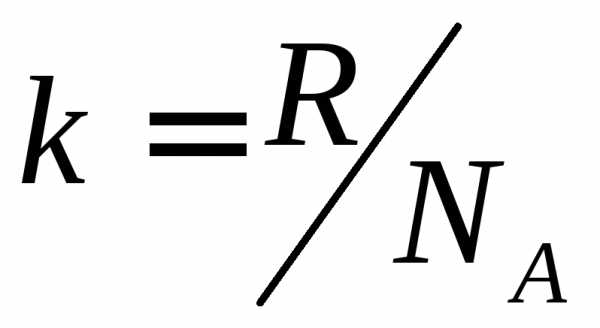 – постоянная Больцмана. Значения
среднеквадратичной скорости для
некоторых газов при комнатной температуре.
– постоянная Больцмана. Значения
среднеквадратичной скорости для
некоторых газов при комнатной температуре.
Кислород – 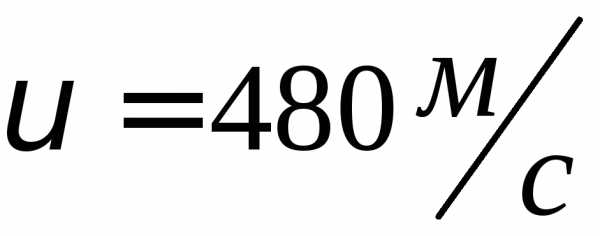 ,
водород –
,
водород –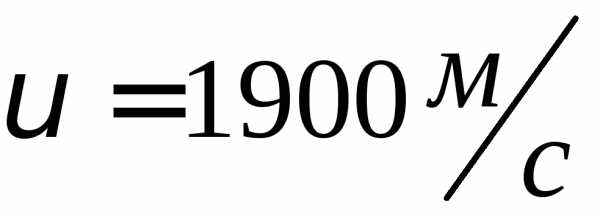 .
.
Средняя кинетическая энергия поступательного движения одной молекулы газа равна
(10)
Из Ур. (10) следует, что при  кинетическая энергия равна нулю. На
самом деле энергия нулевых колебаний
не равна нулю вследствие квантовых
эффектов.
кинетическая энергия равна нулю. На
самом деле энергия нулевых колебаний
не равна нулю вследствие квантовых
эффектов.
Закон Максвелла о распределении молекул идеального газа по скоростям
Молекулы в газе двигаются хаотично. В
процессе движения они сталкиваются, их
скорости изменяются в широких пределах.
Если система находится в состоянии
термодинамического равновесия, средняя
квадратичная скорость 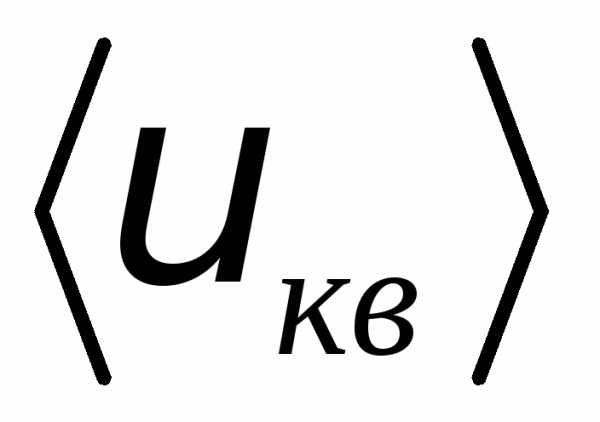 остается постоянной, хотя скорости
различных молекул могут значительно
различаться. Эта ситуация соответствует
стационарному распределению молекул
газа по скоростям. Закон распределения
молекул по скоростям вывел Максвелл в
1859 г. При выводе функции распределения
использовались следующие предположения:
остается постоянной, хотя скорости
различных молекул могут значительно
различаться. Эта ситуация соответствует
стационарному распределению молекул
газа по скоростям. Закон распределения
молекул по скоростям вывел Максвелл в
1859 г. При выводе функции распределения
использовались следующие предположения:
Число молекул в газе  велико, молекулы тождественны и находятся
в состоянии беспорядочного теплового
движения,,
внешние силовые поля на газ не действуют.
велико, молекулы тождественны и находятся
в состоянии беспорядочного теплового
движения,,
внешние силовые поля на газ не действуют.
Максвелл ввел функцию распределения
молекул по скоростям 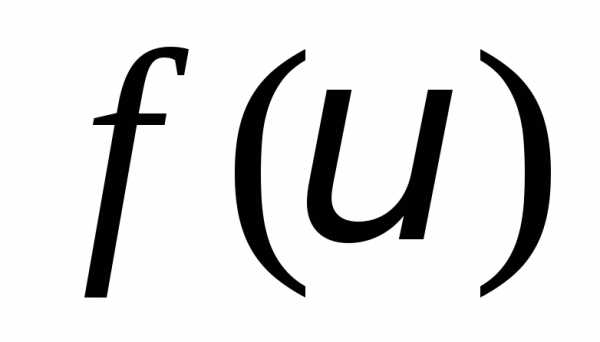 ,
где
,
где – величина скорости молекулы. График
функции
– величина скорости молекулы. График
функции
Выберем интервал скоростей
.
В него попадет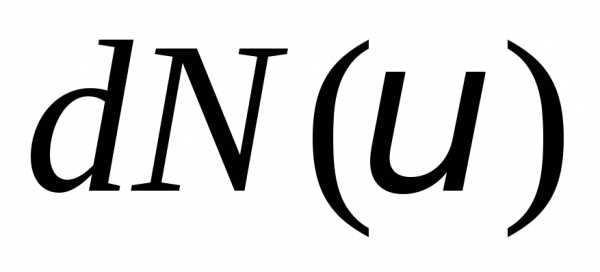 молекул. Смысл функции распрелеления
молекул. Смысл функции распрелеления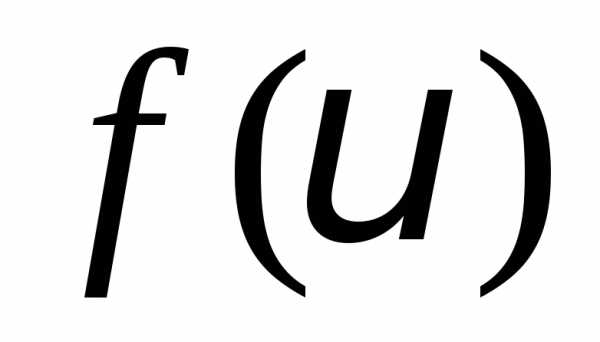 – это относительная доля молекул
– это относительная доля молекул ,
скорости которых лежат в выбранном
интервале. Функция распределения
определяется как
,
скорости которых лежат в выбранном
интервале. Функция распределения
определяется как
 или
или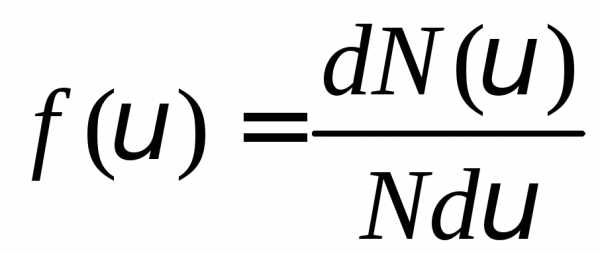 .
(1)
.
(1)
Конкретный вид функции нашел Максвелл
(2)
График функции представлен на рис. Функция (2) нормирована
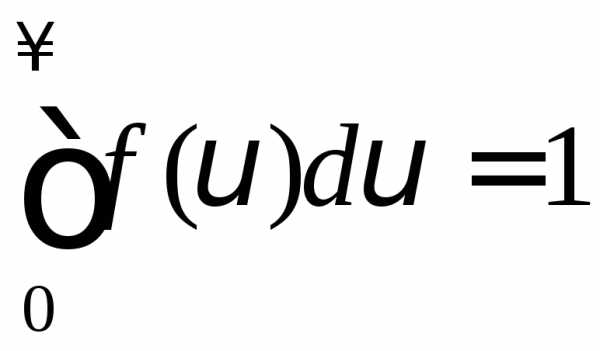 (3)
(3)
Скорость, для которой функция распределения имеет максимальное значение, называется наиболее вероятной скоростью. Для её определения найдем максимум функции распределения.
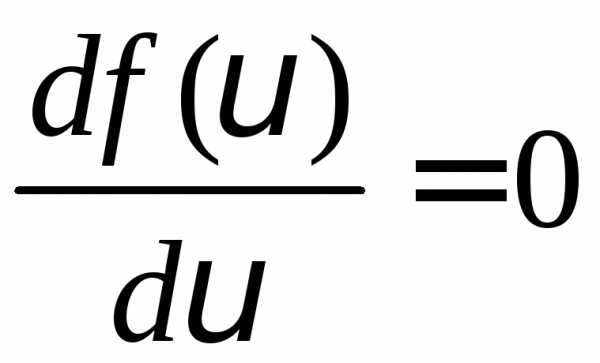 или
или
Из последнего соотношения видим, что
значения 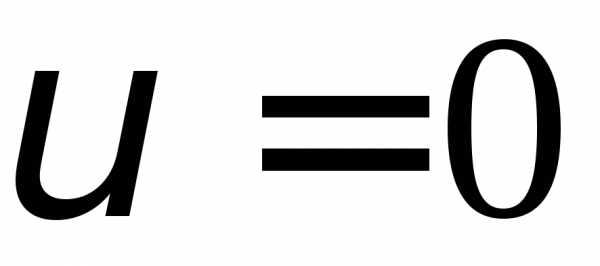 идоставляют минимум функции распределения.
Значение
идоставляют минимум функции распределения.
Значение
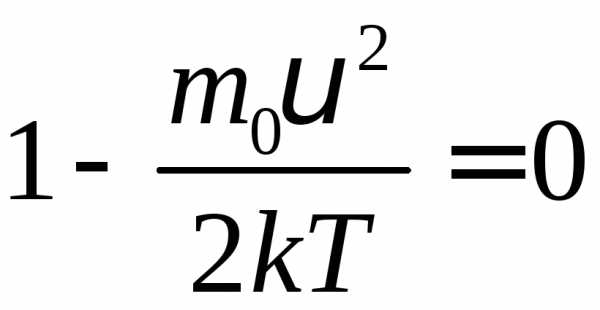

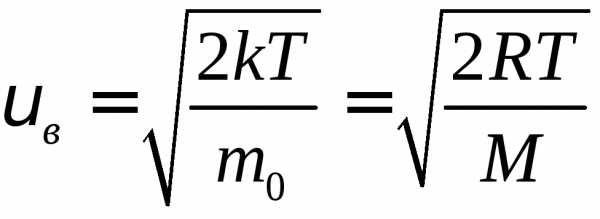 (4)
(4)
 – наиболее вероятная скорость. Средняя
скорость
– наиболее вероятная скорость. Средняя
скорость
После интегрирования
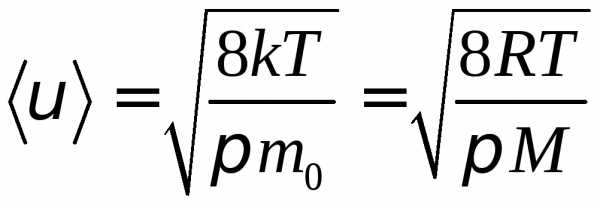 (5)
(5)
Итак, состояния газа характеризуется скоростями
1) 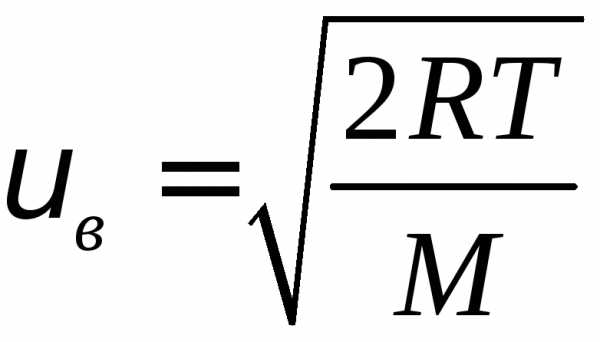 – наиболее вероятная скорость
– наиболее вероятная скорость
2) – средняя скорость
3) – средняя квадратичная скорость
Найдем распределение молекул газа по
энергиям. Полная энергия молекулы
идеального газа – это кинетическая
энергия  .
Введем новую переменную согласно
уравнению
.
Введем новую переменную согласно
уравнению
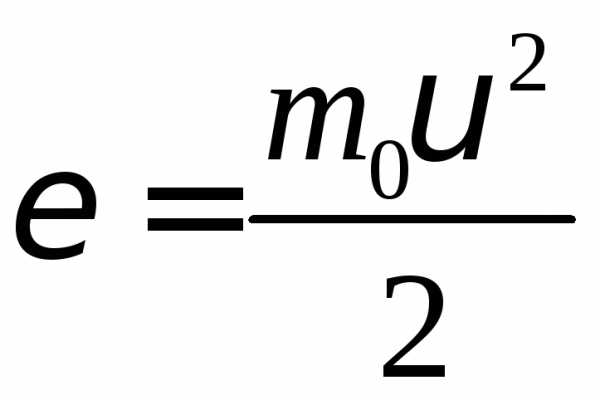 .
Дифференциал переменной.
Используя уравнение
.
Дифференциал переменной.
Используя уравнение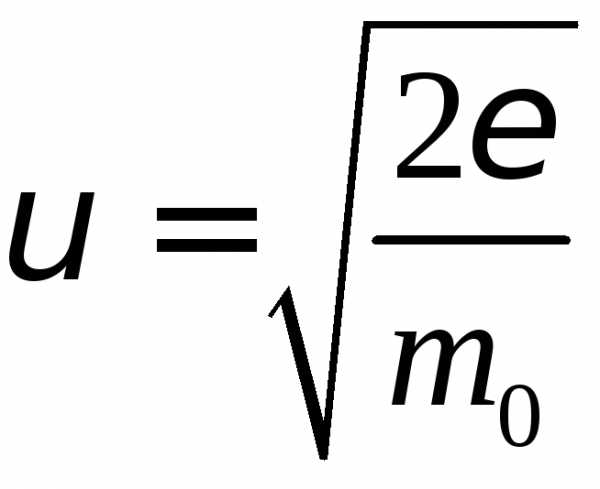 ,
находим.
Из определения функции распределения
,
находим.
Из определения функции распределения
после подстановки получаем
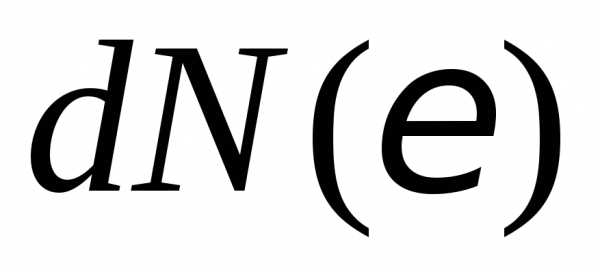 – число молекул, у которых кинетическая
энергия поступательного движения лежит
в пределах.
Тогда функция распределения по энергиям
– число молекул, у которых кинетическая
энергия поступательного движения лежит
в пределах.
Тогда функция распределения по энергиям
(6)
Средняя энергия молекулы
Это значение получили ранее.
studfiles.net
| № п/п | Наименование параметра | Формула | Обозначения |
|---|---|---|---|
| 2.1 | Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона) | Р ― давление, V ― объем, ν ― количество молей газа, R = 8,31 Дж/(К∙моль) ― молярная газовая постоянная, Т ― термодинамическая температура | |
| 2.2 | Число молекул, скорости которых находятся в интервале от v до v+dv | N ― количество всех молекул, m ― масса одной молекулы, k ― постоянная Больцмана, Т ― термодинамическая температура, v ― скорость молекулы | |
| 2.3 | Средняя арифметическая скорость молекул | R = 8,31 Дж/(К∙моль) ― молярная газовая постоянная, Т ― термодинамическая температура, М ― молярная масса газа | |
| 2.4 | Средняя квадратичная скорость молекул | R = 8,31 Дж/(К∙моль) ― молярная газовая постоянная, Т ― термодинамическая температура, М ― молярная масса газа | |
| 2.5 | Наиболее вероятная скорость молекул | R = 8,31 Дж/(К∙моль) ― молярная газовая постоянная, Т ― термодинамическая температура, М ― молярная масса газа | |
| 2.6 | Длина свободного пробега молекулы | d ─ эффективный диаметр молекулы, n = p/(kT) ― концентрация молекул газа, k = 1,38∙10–23 Дж/К ― постоянная Больцмана, Т ― термодинамическая температура | |
| 2.7 | Среднее число столкновений в единицу времени | d ― эффективный диаметр молекулы, n ― концентрация газа, <v> ― средняя арифметическая скорость молекул | |
| 2.8 | Cредняя арифметическая скорость молекул | М ― молярная масса молекулы, R ― молярная газовая постоянная, n = P/(kT) ― концентрация молекул газа | |
| 2.9 | Внутренняя энергия молекул газа | i ― число степеней свободы молекулы газа | |
| 2.10 | Показатель адиабаты | СР ― молярная теплоемкость при постоянном давлении, СV ― молярная теплоемкость при постоянном объеме | |
| 2.11 | При изотермическом процессе | ν ― количество газа, R = 8,31 Дж/(К∙моль) ― молярная газовая постоянная, Т ― термодинамическая температура, V1 и V2 ― начальный и конечный объем | |
| 2.12 | При изобарическом процессе: работа A теплота изменение внутренней энергии | или | р ― давление, V1 и V2 ― начальный и конечный объем ν ― количество молей газа, R = 8,31 Дж/(моль∙К) ― молярная газовая постоянная, ΔТ ― разность температур i ― число степеней свободы одной молекулы |
| 2.13 | При изохорном процессе | i ― число степеней свободы молекулы, ν ― количество молей газа, R = 8,31 Дж/(моль∙К) ― молярная газовая постоянная, ΔТ ― разность температур | |
| 2.14 | При адиабатическом процессе | ν ― количество газа, i ― число степеней свободы молекулы, R = 8,31 Дж/(К∙моль) ― молярная газовая постоянная, ΔТ ― разность температур | |
| 2.15 | Распределение Больцмана (частиц в силовом поле) | n ― концентрация частиц; U ― их потенциальная энергия; n0 ― концентрация частиц в точках поля, где U = 0; k ― постоянная Больцмана; Т ― термодинамическая температура газа | |
| 2.15a | Зависимость концентрации газов от высоты, если в качестве уровня, где U = 0, выбрать поверхность Земли | n0 ― концентрация частиц на высоте h = 0; m ― масса молекулы; g ― ускорение свободного падения; h ― высота над поверхностью Земли; k ― постоянная Больцмана; Т ― термодинамическая температура газа | |
| 2.16 | Барометрическая формула | где p — давление газа в слое, расположенном на высоте h, p0 — давление на нулевом уровне h0, M — молярная масса газа, R — газовая постоянная, T — абсолютная температура | |
| 2.17 | Кинетическая энергия, приходящаяся на одну степень свободы молекулы | k = 1,38∙10−23 Дж/К ― постоянная Больцмана, T — абсолютная температура газа | |
| 2.18 | Теплоемкость газа Изменение внутренней энергии газа Приращение работы | dQ ― изменение теплоты газа; dA ― приращение работы, выполненной газом; dU ― изменение внутренней энергии газа; dT ― изменение температуры газа ν ― количество молей газа, i ― число степеней свободы молекулы, R ― молярная газовая постоянная p ― давление газа, dV ― изменение объема | |
| 2.19 | Удельная теплоемкость смеси: при постоянном давлении при постоянном объеме | m1, m2 ― массы составляющих смеси; cp1, cp2 ― удельные теплоемкости составляющих смеси при постоянном давлении; cv1, cv2 ― удельные теплоемкости составляющих смеси при постоянном объеме | |
| 2.20 | Молярная теплоемкость смеси | ν1, ν2 ― количества молей составляющих смеси; Сp1, Сp2 ― молярные теплоемкости составляющих смеси при постоянном давлении; Сv1, Сv2 ― молярные теплоемкости составляющих смеси при постоянном объеме | |
| 2.21 | Изменение энтропии при изотермическом процессе | Q1 ― полученная теплота; T ― термодинамическая температура | |
| 2.22 | Изменение энтропии | Q ― полученная теплота; T ― термодинамическая температура | |
| 2.23 | Распределение молекул по энергиям | k ― постоянная Больцмана, T ― термодинамическая температура, ε ― энергия молекулы | |
| 2.24 | Распределение молекул по скоростям | k ― постоянная Больцмана, T ― термодинамическая температура, m ― масса молекулы, v ― скорость молекулы | |
| 2.25 | Теплота, затраченная на нагревание воды массы m от t1 до t2 равна | св = 4183 Дж/(кг∙К) ― удельная теплоемкость воды, m ― масса воды, t2−t1 ― разность температур | |
| 2.26 | Теплота, затраченная на испарение воды массы m, равна | λв = 2250∙103 Дж/кг ― удельная теплота парообразования для воды, m ― масса воды | |
| 2.27 | Молярная масса смеси газов | m1, m2 ― массы составляющих смеси; M1, M2 ― массы составляющих смеси |
reshenie-zadach.com.ua
Идеальный газ
МОЛЕКУЛЯРНАЯ ФИЗИКА
Идеальный газ
Основные понятия
Основные положения молекулярной физики: 1) все вещества состоят из атомов и молекул, 2) они находятся в постоянном хаотическом движении. Поскольку размеры молекул малы, то в макроскопических объемах вещества содержится большое число молекул. Поэтому изучение движения молекул вещества основано на статистическом методе. Законы поведения большого числа молекул основаны на статистических закономерностях. Используются средние значения таких характеристик как скорость, энергия и т.д.
Термодинамикаизучает общие свойства
макроскопических систем, находящихся
в состоянии термодинамического
равновесия, а также процессы между ними.
Основу термодинамики составляют начала
– фундаментальные законы, установленные
опытным путем. Состояние термодинамических
( т/д) систем задается с помощью набора
т/д параметров, которые полностью
описывают свойства системы. К таким
параметрам относятся: давление, объем,
температура и др. Температура –
характеризует состояние т/д равновесия
макроскопической системы. Она имеет
смысл только для системы, находящейся
в состоянии равновесия.Термодинамическая
температурная шкалабазируется на
одной реперной точке – тройная точка
воды. (температура, при которой лед, вода
и насыщенный пар при давленииР=609 Па). Она равна273,16 К. В этой шкале
температура замерзания воды равна273,15 К. Температура в градусах Цельсия, ,
связана с т/д температурой соотношением
,
связана с т/д температурой соотношением
Удельный объем– это объем единицы массы вещества. Любое изменение состояния называется т/д процессом.
Идеаьный газ удовлетворяет следующим условиям:
1) Объем молекул газа пренебрежимо мал по сравнению с объемом сосуда
2) молекулы газа не взаимодействуют
3) столкновения молекул со стенками сосуда являются абсолютно упругими.
Газовые законы
Закон Бойля – Мариотта. Для заданной массы газа при постоянной температуре
дляи.
Графики в переменных 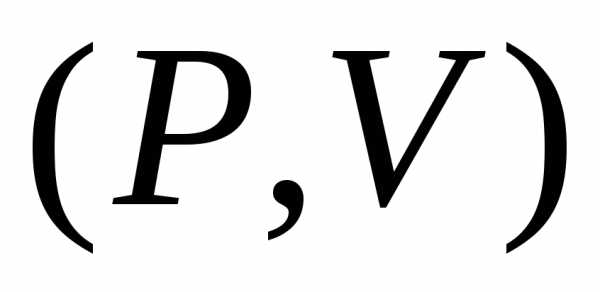 являются
гиперболами. Каждый график соответствует
одной температуре. Такие кривые называютсяизотермами. Процесс, идущий приназывается изотермическим.
являются
гиперболами. Каждый график соответствует
одной температуре. Такие кривые называютсяизотермами. Процесс, идущий приназывается изотермическим.
Рис 1
Законы Гей – Люссака.
1) прии.
График в переменных 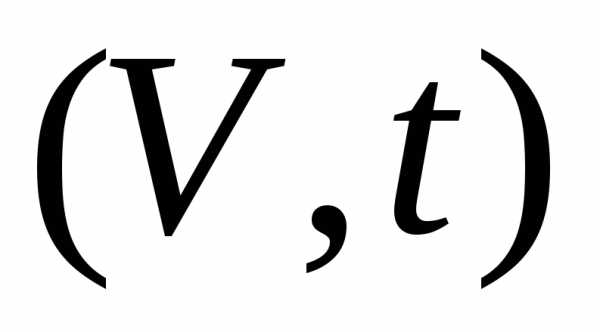 есть прямая линия. Каждая прямая
соответствует одному значению давления.
Такие линии называютсяизобарами.
Процесс, идущий приназывается изобарным.
есть прямая линия. Каждая прямая
соответствует одному значению давления.
Такие линии называютсяизобарами.
Процесс, идущий приназывается изобарным.
Рис
2) прии.
График в переменных 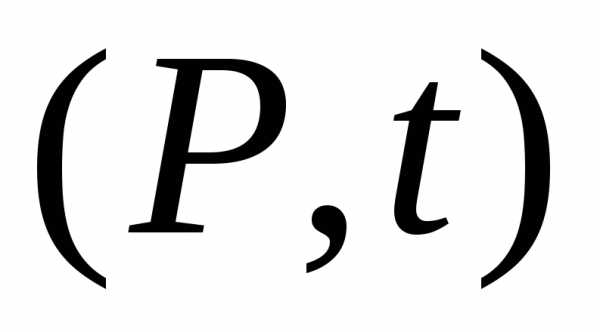 есть прямая линия. Каждая прямая
соответствует одному значению объема.
Такие линии называютсяизохорами.
Процесс, идущий приназывается изохорным.
есть прямая линия. Каждая прямая
соответствует одному значению объема.
Такие линии называютсяизохорами.
Процесс, идущий приназывается изохорным.
Рис
Значение коэффициента 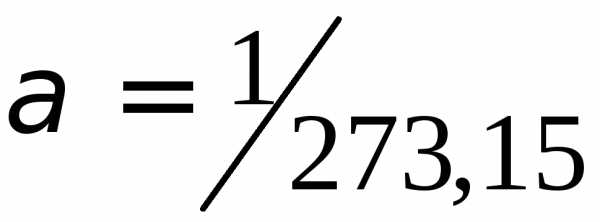
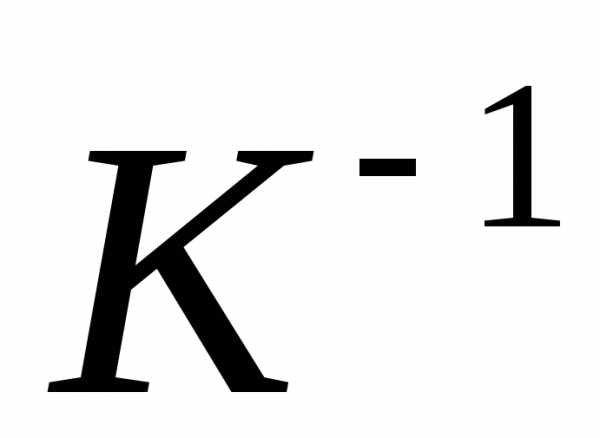 .
Если перейти к термодинамической
температуре,
получим следующие соотношения.
.
Если перейти к термодинамической
температуре,
получим следующие соотношения.
и. Несложно получить следующие соотношения:
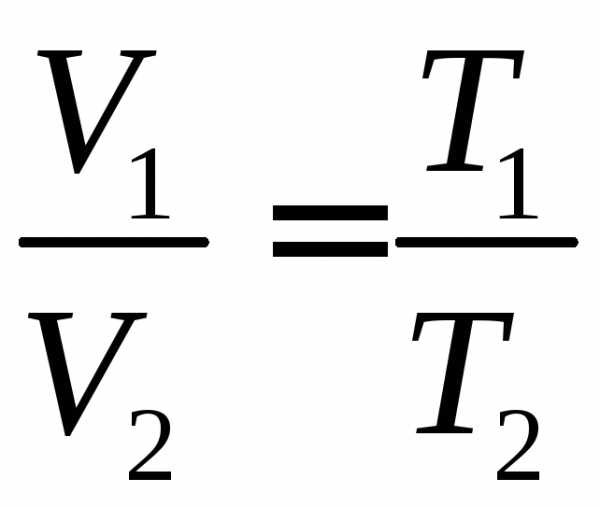 при.
при.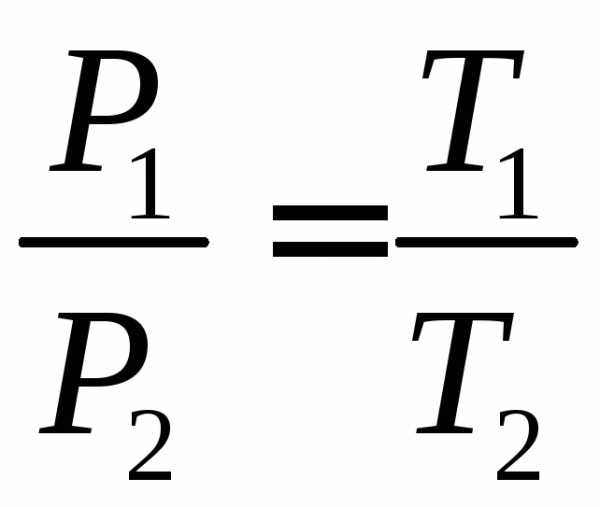 при.
при.
Закон Авогадро.Один моль любого
газа при одинаковых температуре и
давлении занимает одинаковый объем.
При нормальных условиях этот объем
равен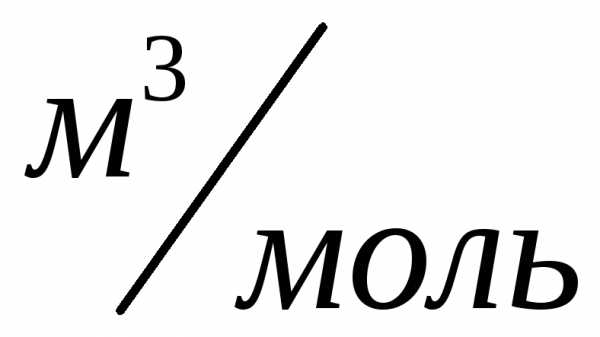 .
Один моль различных веществ содержит
одно и тоже число молекул, которое
называетсяпостоянной Авогадро:
.
Один моль различных веществ содержит
одно и тоже число молекул, которое
называетсяпостоянной Авогадро: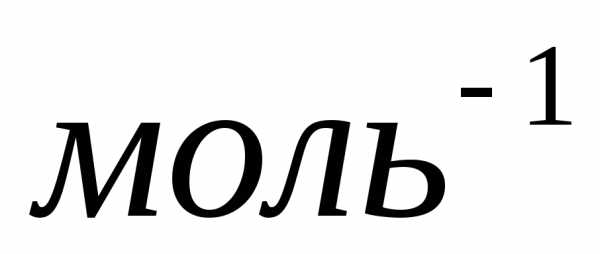 .
.
Нормальные условия: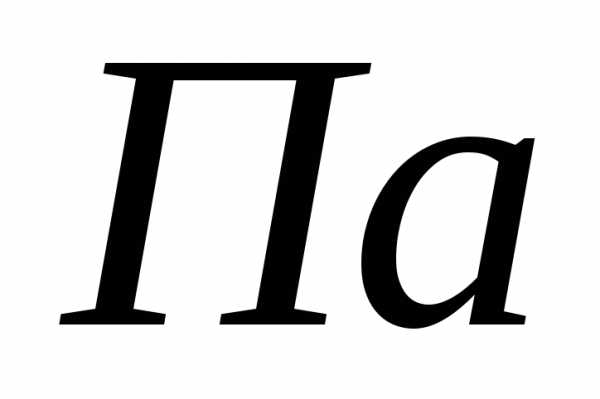 ,,
,,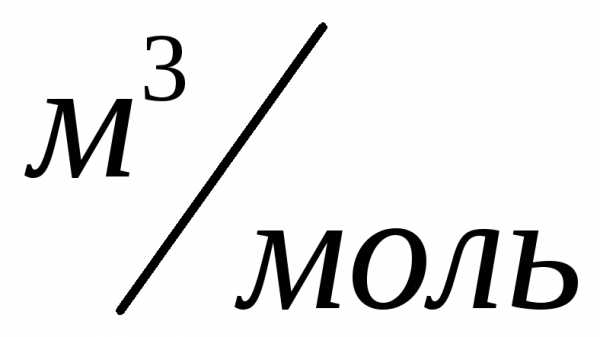 .
.
Закон Дальтона:Полное давление в
газовой смеси:где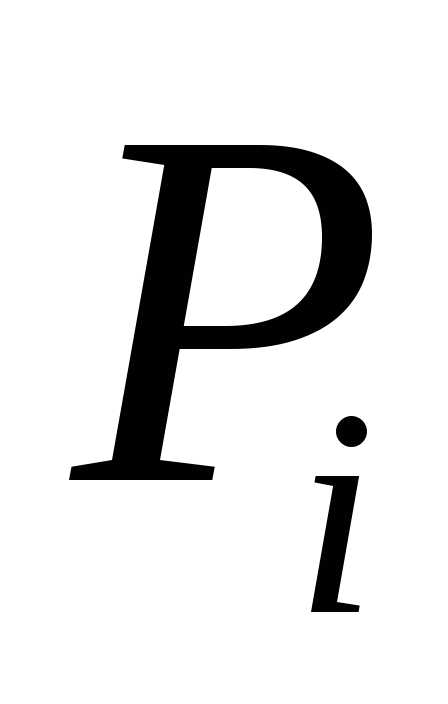 – парциальное давление
– парциальное давление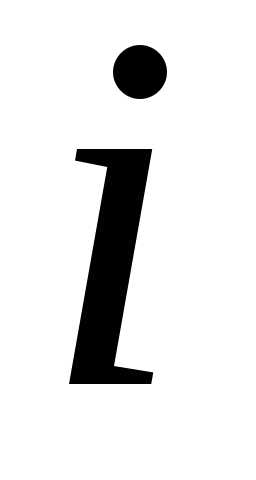 компоненты. Парциальное давление – это
давление одной компоненты газовой
смеси, когда она занимает весь объем
при той же температуре.
компоненты. Парциальное давление – это
давление одной компоненты газовой
смеси, когда она занимает весь объем
при той же температуре.
Уравнение Клапейрона – Менделеева
Уравнение, которые связывают переменные 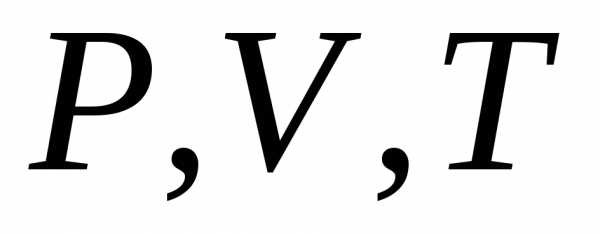 называется уравнением состояния. Оно
имеет вид.
Клапейрон вывел уравнение состояния
идеального газа, на основе законов Бойля
– Мариотта и Гей-Люссака. Рассмотрим
процесс изображенный на рисунке в
координатах
называется уравнением состояния. Оно
имеет вид.
Клапейрон вывел уравнение состояния
идеального газа, на основе законов Бойля
– Мариотта и Гей-Люссака. Рассмотрим
процесс изображенный на рисунке в
координатах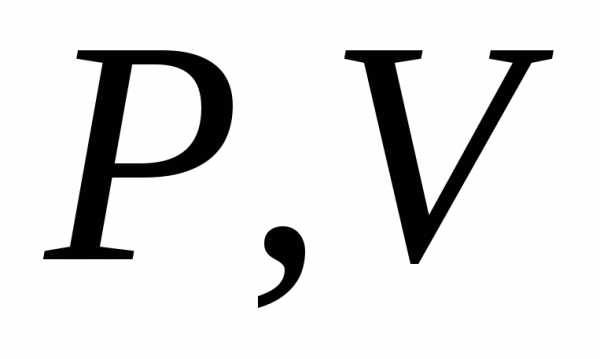 :.
Первый шаг – изотермический, второй –
изохорный процессы.
:.
Первый шаг – изотермический, второй –
изохорный процессы.
Рис
Для изотермического процесса имеем
.
Для изохорного –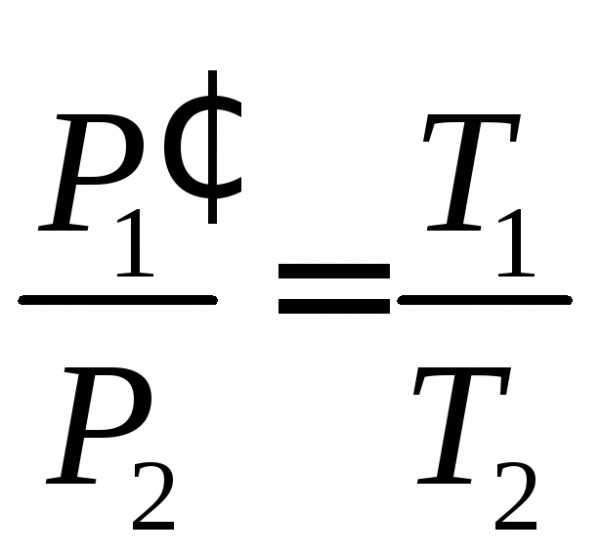 или
или
.
Исключая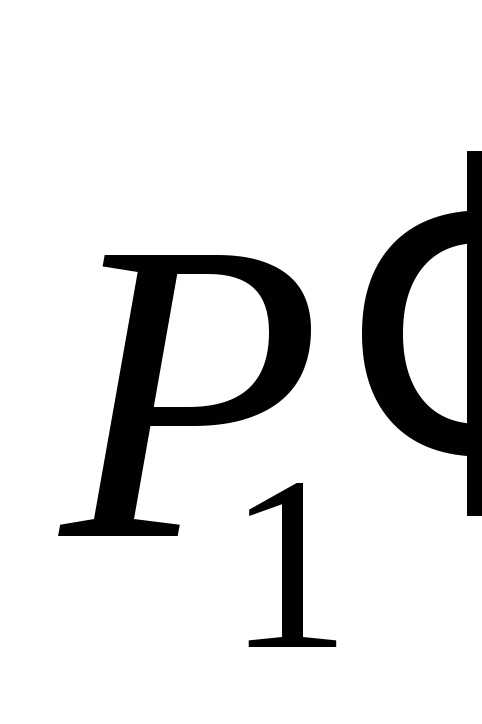 ,
в силу произвольности исходного и
конечного состояний находим
,
в силу произвольности исходного и
конечного состояний находим
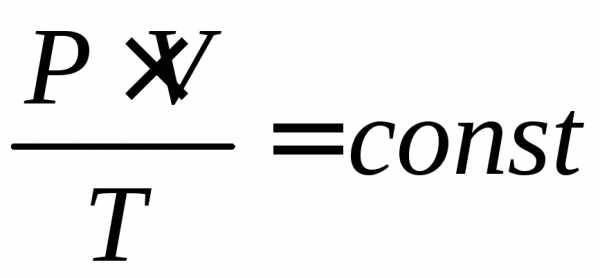 .
(1)
.
(1)
Уравнение (1) – уравнение Клапейрона.
Постоянная является различной для
разных газов. Менделеев, используя закон
Авогадро, переписал уравнение Клапейрона
для одного моля газа. Для этого он
использовал молярный объем, 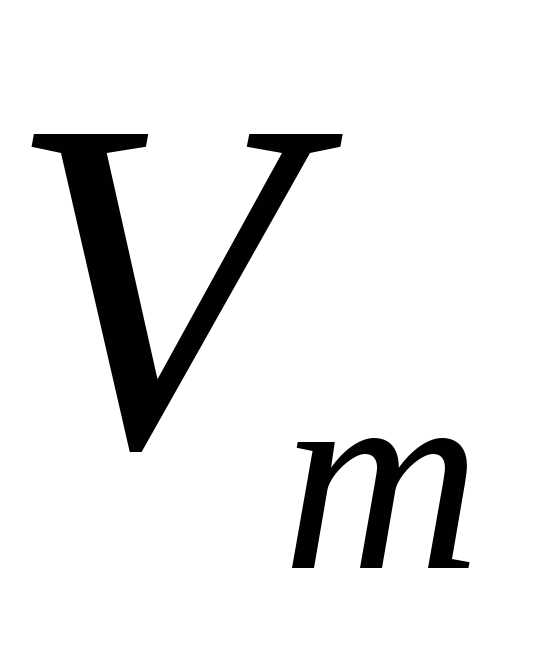 , который одинаков для любого вида газа.
Как следствие этого, постоянная в
уравнении Клапейрона будет одинаковой
для всех газов.
, который одинаков для любого вида газа.
Как следствие этого, постоянная в
уравнении Клапейрона будет одинаковой
для всех газов.
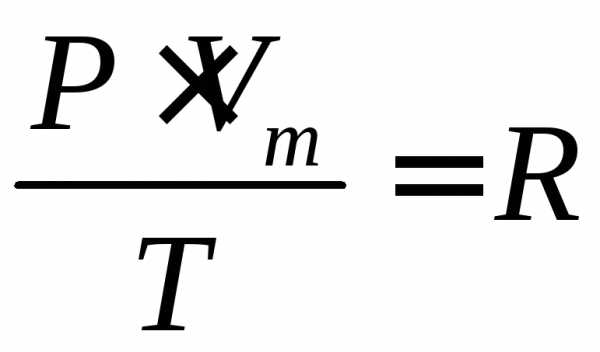 (2)
(2)
 – молярная газовая постоянная.при нормальных условиях. Для произвольной
массы газа
– молярная газовая постоянная.при нормальных условиях. Для произвольной
массы газа
(3)
где – количество вещества,
– количество вещества,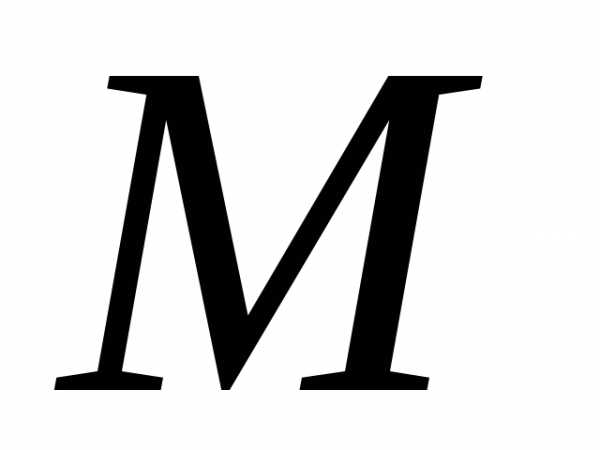 – молярная масса – это масса одного моля
вещества. Уравнения (2) и (3) это ур.
Клапейрона – Менделеева. Молярная масса
– молярная масса – это масса одного моля
вещества. Уравнения (2) и (3) это ур.
Клапейрона – Менделеева. Молярная масса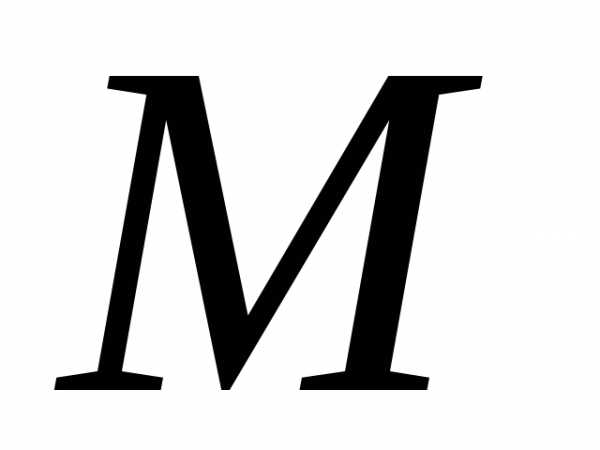 численно равна относительной массе
молекулы.
численно равна относительной массе
молекулы.
Введем постоянную Больцмана
.
Уравнение состояния идеального газа примет вид:
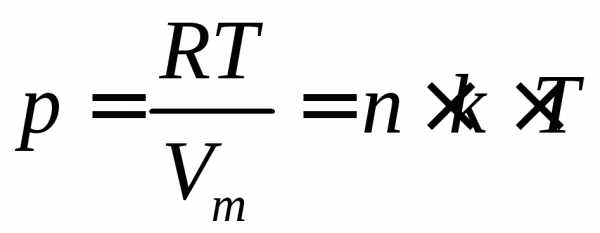
где 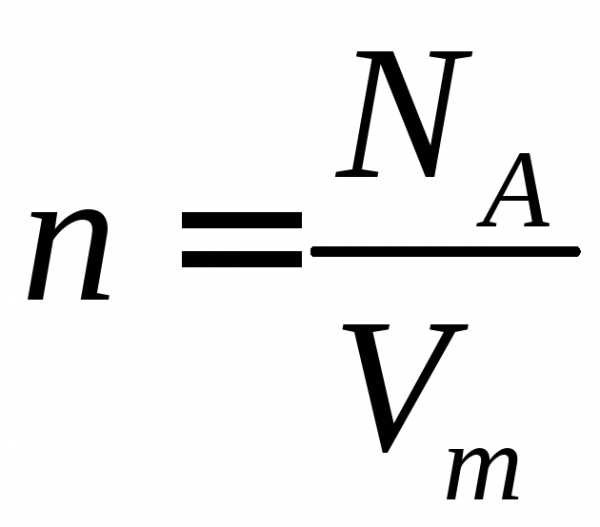 – концентрация молекул.
– концентрация молекул.
Основное уравнение молекулярно-кинетической теории идеальных газов.
Молекулы идеального газа двигаются
хаотично. Предположим, что число
соударений между молекулами газа мало
по сравнению с числом соударений о
стенки сосуда. Удары молекул о стенки
считаем абсолютно упругими. Эти удары
определяют давление в газе. Найдем
давление газа в сосуде. Выделим на стенке
сосуда площадку  и определим давление газа на эту площадку.
Давление определяется по формуле сила,
деленная на площадь:
и определим давление газа на эту площадку.
Давление определяется по формуле сила,
деленная на площадь:
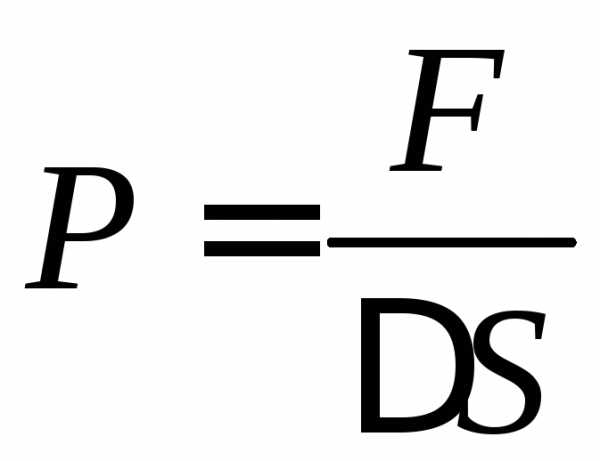 (1)
(1)
Сила определяется согласно второму закону Ньютона:
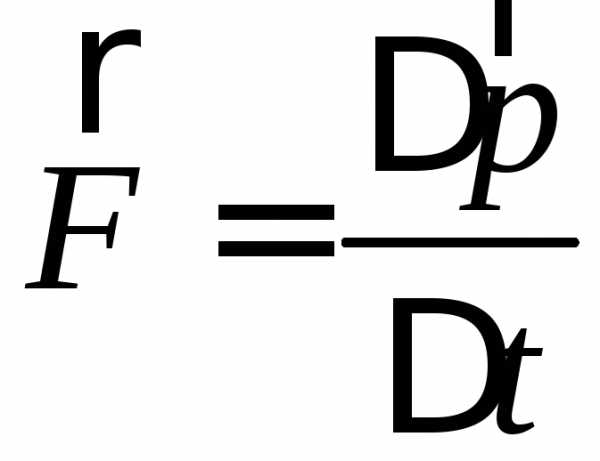 (2)
(2)
Это изменение импульса во времени.
Найдем изменение импульса молекул газа
при соударении со стенкой сосуда. Когда
молекула двигается перпендикулярно
стенке, при упругом ударе стенке
передается импульс: 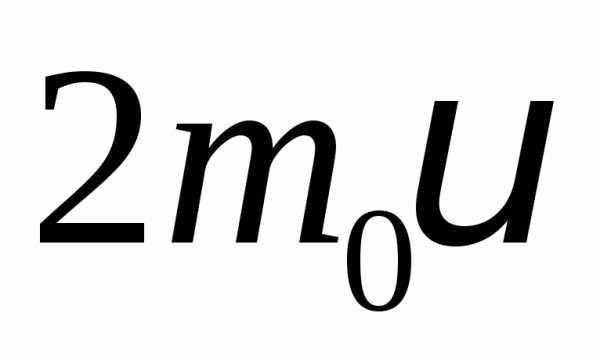 .
.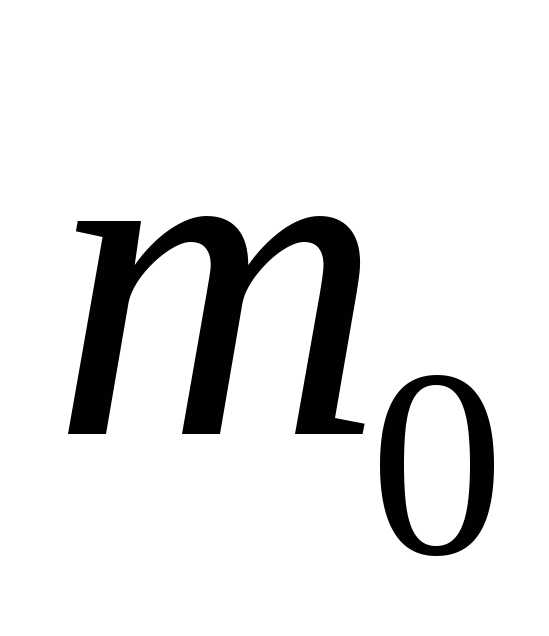 – масса молекулы,
– масса молекулы, – скорость молекулы. За время
– скорость молекулы. За время те молекулы достигнут площадки
те молекулы достигнут площадки ,
которые находятся в объеме.
Число таких молекул равно,
где
,
которые находятся в объеме.
Число таких молекул равно,
где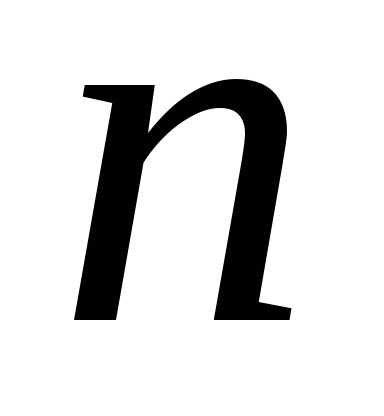 – концентрация молекул. Из-за хаотичного
движения молекулы достигают стенки под
произвольным углом, а не только под
прямым. Чтобы учесть это предположим,
что все молекулы двигаются вдоль трех
взаимно перпендикулярных направлений.
Число молекул двигающихся вдоль каждой
оси одинаково и составляет
– концентрация молекул. Из-за хаотичного
движения молекулы достигают стенки под
произвольным углом, а не только под
прямым. Чтобы учесть это предположим,
что все молекулы двигаются вдоль трех
взаимно перпендикулярных направлений.
Число молекул двигающихся вдоль каждой
оси одинаково и составляет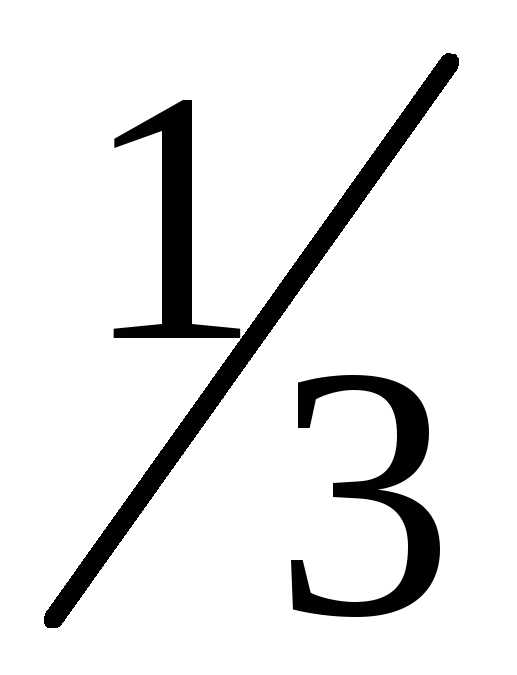 от полного числа молекул. Вдоль каждой
оси молекулы двигаются в двух
противоположных направлениях. Тогда
число ударов о площадку равно
от полного числа молекул. Вдоль каждой
оси молекулы двигаются в двух
противоположных направлениях. Тогда
число ударов о площадку равно
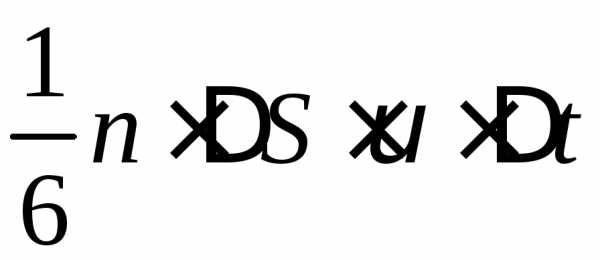 .
Они передадут стенке импульс
.
Они передадут стенке импульс
(3)
Подставим найденное изменение импульса в определение силы и далее в формулу (1). Найдем давление
(4)
Поскольку молекулы двигаются с различными скоростями, то вводят среднюю квадратичную скорость:
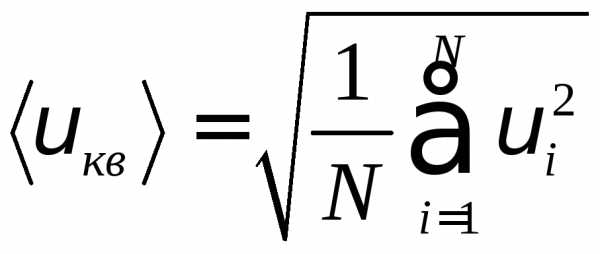 (5)
(5)
где  – число молекул в газе. Уравнение для
давления газа в сосуде примет вид:
– число молекул в газе. Уравнение для
давления газа в сосуде примет вид:
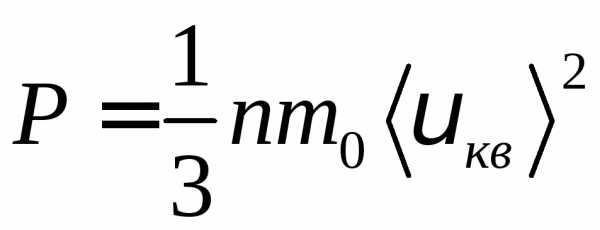 (6)
(6)
Это основное уравнение молекулярно –
кинетической теории (МКТ) газов. Точный
расчет приводит к такой формуле. Придадим
этой фортеле иной вид, используя уравнение
для идеального газа. В ур. (6) подставим
выражение для концентрации  и умножим обе части равенства на объем
и умножим обе части равенства на объем .
.
(7)
где  – суммариная кинетическая энергия
поступательного движения молекул газа.
Введем массу газа
– суммариная кинетическая энергия
поступательного движения молекул газа.
Введем массу газа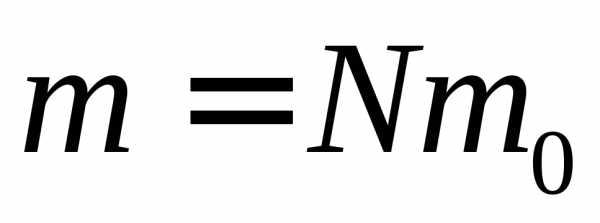 и молярную массу газа
и молярную массу газа .
Это масса одного моля газа.
.
Это масса одного моля газа.
Для произвольной массы газа: 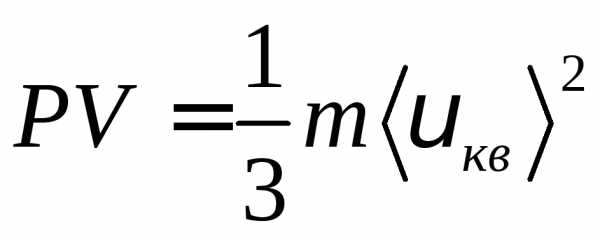 для одного моля газа:
для одного моля газа: .
Используя это соотношение и уравнение
Менделеева – Клапейрона,,
получаем соотношение
.
Используя это соотношение и уравнение
Менделеева – Клапейрона,,
получаем соотношение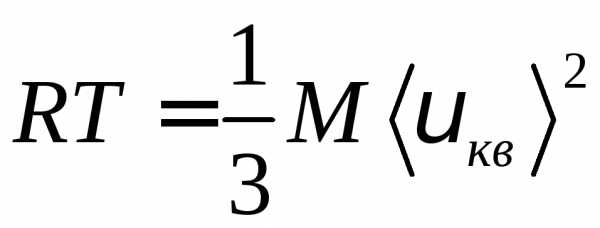 .
Отсюда находим:
.
Отсюда находим:
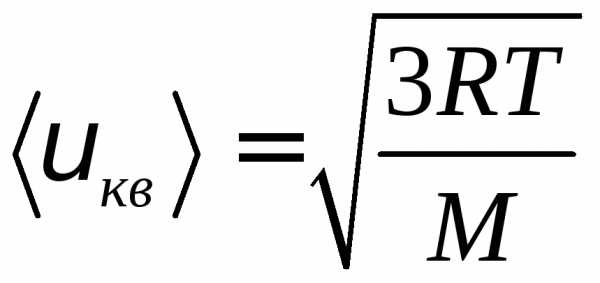 (8)
(8)
Так как молярная масса
,
где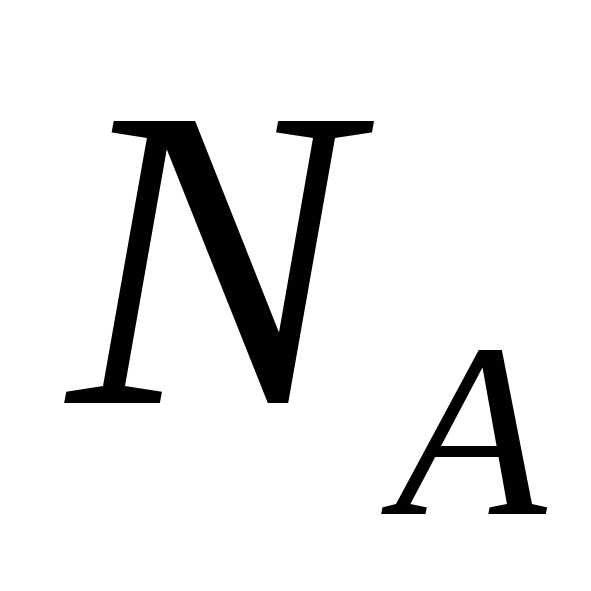 – число Авогадро, можно получить
– число Авогадро, можно получить
(9)
где 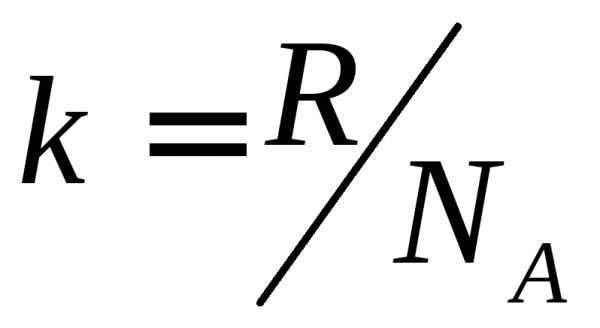 – постоянная Больцмана. Значения
среднеквадратичной скорости для
некоторых газов при комнатной температуре.
– постоянная Больцмана. Значения
среднеквадратичной скорости для
некоторых газов при комнатной температуре.
Кислород – 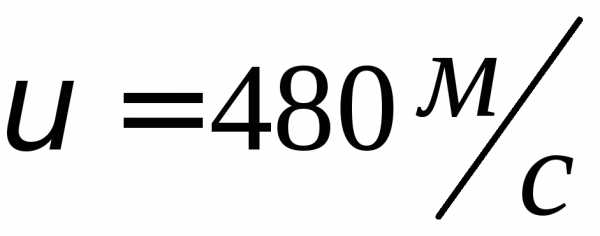 ,
водород –
,
водород –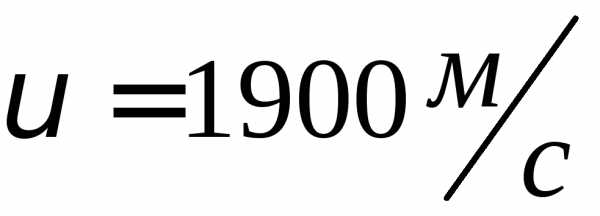 .
.
Средняя кинетическая энергия поступательного движения одной молекулы газа равна
(10)
Из Ур. (10) следует, что при  кинетическая энергия равна нулю. На
самом деле энергия нулевых колебаний
не равна нулю вследствие квантовых
эффектов.
кинетическая энергия равна нулю. На
самом деле энергия нулевых колебаний
не равна нулю вследствие квантовых
эффектов.
Закон Максвелла о распределении молекул идеального газа по скоростям
Молекулы в газе двигаются хаотично. В
процессе движения они сталкиваются, их
скорости изменяются в широких пределах.
Если система находится в состоянии
термодинамического равновесия, средняя
квадратичная скорость  остается постоянной, хотя скорости
различных молекул могут значительно
различаться. Эта ситуация соответствует
стационарному распределению молекул
газа по скоростям. Закон распределения
молекул по скоростям вывел Максвелл в
1859 г. При выводе функции распределения
использовались следующие предположения:
остается постоянной, хотя скорости
различных молекул могут значительно
различаться. Эта ситуация соответствует
стационарному распределению молекул
газа по скоростям. Закон распределения
молекул по скоростям вывел Максвелл в
1859 г. При выводе функции распределения
использовались следующие предположения:
Число молекул в газе  велико, молекулы тождественны и находятся
в состоянии беспорядочного теплового
движения,,
внешние силовые поля на газ не действуют.
велико, молекулы тождественны и находятся
в состоянии беспорядочного теплового
движения,,
внешние силовые поля на газ не действуют.
Максвелл ввел функцию распределения
молекул по скоростям 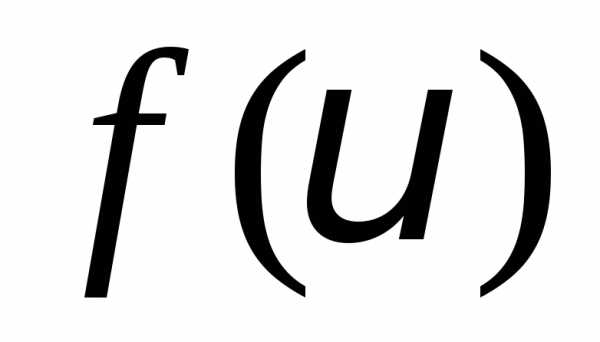 ,
где
,
где – величина скорости молекулы. График
функции
– величина скорости молекулы. График
функции
Выберем интервал скоростей
.
В него попадет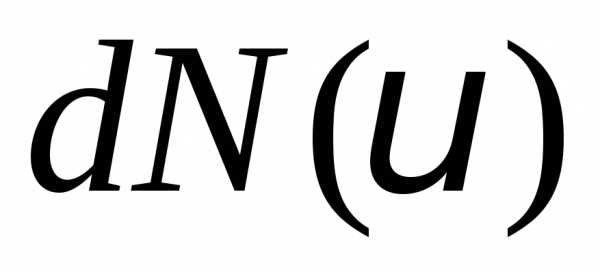 молекул. Смысл функции распрелеления
молекул. Смысл функции распрелеления – это относительная доля молекул
– это относительная доля молекул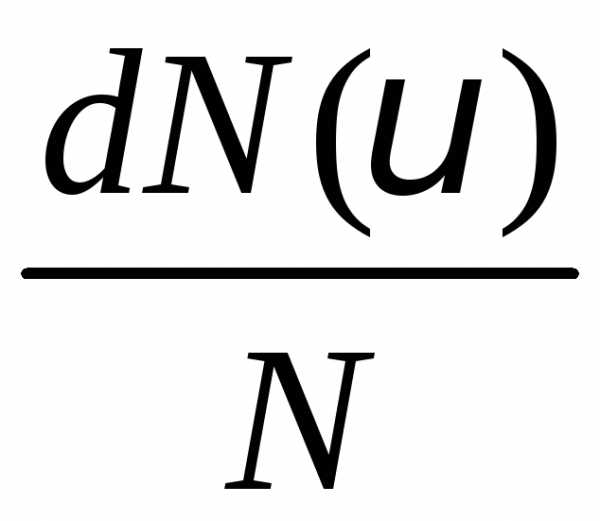 ,
скорости которых лежат в выбранном
интервале. Функция распределения
определяется как
,
скорости которых лежат в выбранном
интервале. Функция распределения
определяется как
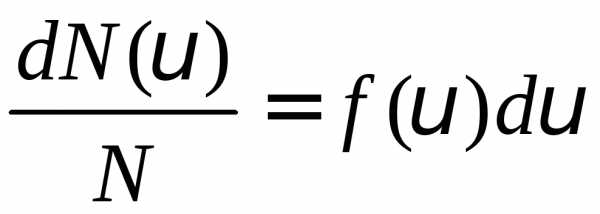 или
или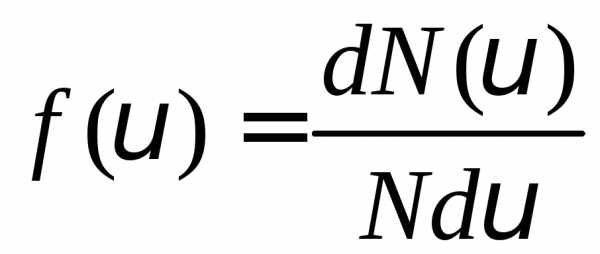 .
(1)
.
(1)
Конкретный вид функции нашел Максвелл
(2)
График функции представлен на рис. Функция (2) нормирована
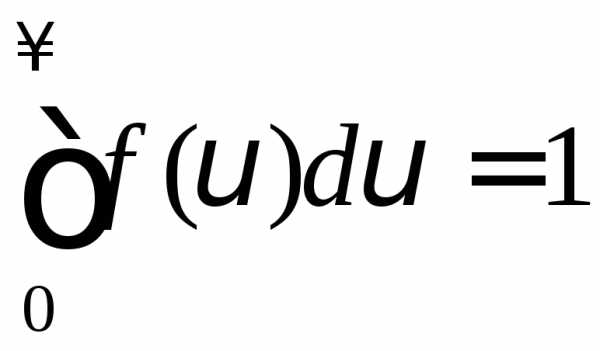 (3)
(3)
Скорость, для которой функция распределения имеет максимальное значение, называется наиболее вероятной скоростью. Для её определения найдем максимум функции распределения.
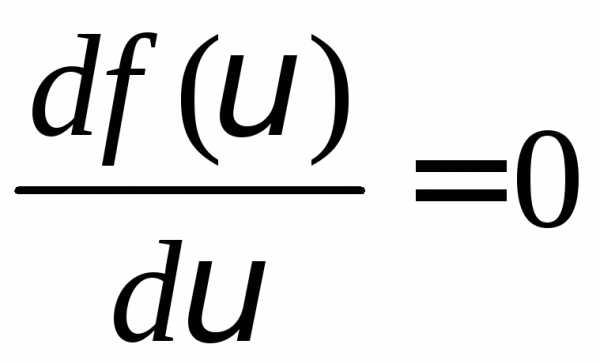 или
или
Из последнего соотношения видим, что
значения 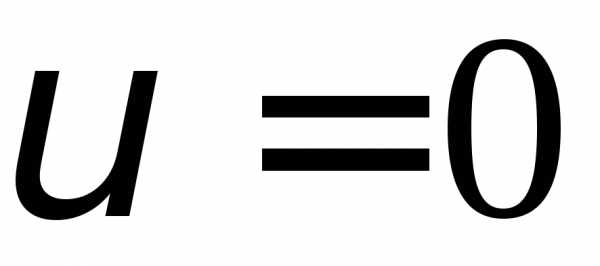 идоставляют минимум функции распределения.
Значение
идоставляют минимум функции распределения.
Значение
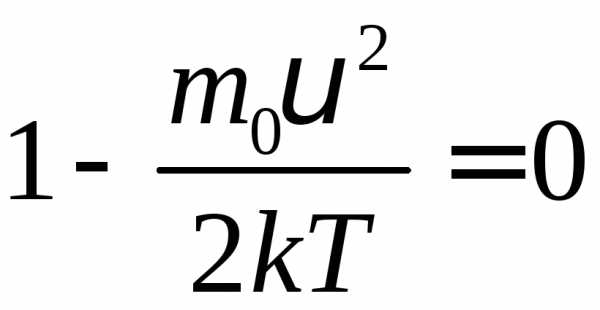

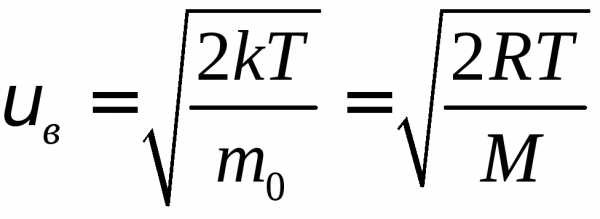 (4)
(4)
studfiles.net
Идеальные газы. Законы идеального газа. Уравнение Менделеева
1. Идеальным газом называется газ, в котором отсутствуют силы межмолекулярного взаимодействия. С достаточной степенью точности газы можно считать идеальными в тех случаях, когда рассматриваются их состояния, далекие от областей фазовых превращений.
2. Для идеальных газов справедливы следующие законы:
а) Закон Бойля – Mаpuomma: при неизменных температуре и массе произведение численных значений давления и объема газа постоянно:
pV = const
Графически этот закон в координатах РV изображается линией, называемой изотермой (рис.1).
б) Закон Гей-Люссака: при постоянном давлении объем данной массы газа прямо пропорционален его абсолютной температуре:
V = V0(1 + at)
где V – объем газа при температуре t, °С; V0 – его объем при 0°С. Величина a называется температурным коэффициентом объемного расширения. Для всех газов a = (1/273°С–1). Следовательно,
V = V0(1 +(1/273)t)
Графически зависимость объема от температуры изображается прямой линией – изобарой (рис. 2). При очень низких температурах (близких к –273°С) закон Гей-Люссака не выполняется, поэтому сплошная линия на графике заменена пунктиром.
в) Закон Шарля: при постоянном объеме давление данной массы газа прямо пропорционально его абсолютной температуре:
p = p0(1+gt)
где р0 – давление газа при температуре t = 273,15 К.
Величина g называется температурным коэффициентом давления. Ее значение не зависит от природы газа; для всех газов = 1/273 °С–1. Таким образом,
p = p0(1 +(1/273)t)
Графическая зависимость давления от температуры изображается прямой линией – изохорой (Рис. 3).
г) Закон Авогадро: при одинаковых давлениях и одинаковых температурах и равных объемах различных идеальных газов содержится одинаковое число молекул; или, что то же самое: при одинаковых давлениях и одинаковых температурах грамм-молекулы различных идеальных газов занимают одинаковые объемы.
Так, например, при нормальных условиях (t = 0°C и p = 1 атм = 760 мм рт. ст.) грамм-молекулы всех идеальных газов занимают объем Vm = 22,414 л.· Число молекул, находящихся в 1 см3 идеального газа при нормальных условиях, называется числом Лошмидта; оно равно 2,687*1019> 1/см3
3. Уравнение состояния идеального газа имеет вид:
pVm = RT
где р, Vm и Т – давление, молярный объем и абсолютная температура газа, а R – универсальная газовая постоянная, численно равная работе, совершаемой 1 молем идеального газа при изобарном нагревании на один градус:
R = 8.31*103 Дж/(кмоль*град)
Для произвольной массы M газа объем составит V = (M/m)*Vm и уравнение состояния имеет вид:
pV = (M/m) RT
Это уравнение называется уравнением Менделеева – Клапейрона.
4. Из уравнения Менделеева – Клапейрона следует, чти число n0 молекул, содержащихся в единице объема идеального газа, равно
n0 = NA/Vm = p*NA /(R*T) = p/(kT)
где k = R/NA = 1/38*1023 Дж/град – постоянная Больцмана, NA – число Авогадро.
www.examen.ru