Подгруппы — как отличить главную подргуппу от побочной в таблице менделеева? СРОООЧНО!!! — 22 ответа
Группа главная и побочная
В разделе Образование на вопрос как отличить главную подргуппу от побочной в таблице менделеева? СРОООЧНО!!! заданный автором Европейский лучший ответ это В периодической системе 8 вертикальных столбцов, названных группами. В группах объединены
сходные по свойствам элементы, принадлежащие одному семейству. Номера групп обозначены
вверху таблицы римской цифрой. Валентность элементов каждой группы соответствует, за
немногими исключениями, номеру группы.
Каждая группа элементов делится на главную и побочную подгруппы. Главные подгруппы
образуют элементы малых и больших периодов, а побочные – только элементы больших
периодов. Элементы главных и побочных подгрупп сдвинуты в разные стороны.
Те элементы, которые расположены строго под элементами II (и III) периодов, составляют главную подгруппу. Те элементы IV-VII периодов, которые сдвинуты в сторону относительно элементов II (и III) периодов, составляют побочную подгруппу. Например, для IV периода к главной подгруппе относятся K, Ca, Ga, Ge,As, Se, Br Kr. Обратите внимание, что их всегда 8 (кроме неполного VII периода). А к побочно подгруппе относятся Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn. Обратите внимание, что их всегда 10 (кроме неполного VII периода) .
1. Наибольшая (высшая) валентность элементов каждой группы по кислороду (за немногими
исключениями) соответствует номеру группы. Элементы побочных подгрупп могут проявлять и
другую валентность. Например, медь образует оксиды одновалентной и двухвалентной меди,
соответственно Сu2О (I) и СuО (II). Однако наиболее распространенными, являются соединения
2. В главных подгруппах с увеличением относительных атомных масс, усиливаются
металлические свойства элементов.
3. Неметаллические свойства у элементов главных подгрупп с увеличением порядкового номера
ослабевают. Так, в главной подгруппе VII группы (подгруппе галогенов) наиболее активным
неметаллом является фтор F, а наименее активным – иод I.
4. Элементы главных подгрупп IV – VII групп образуют так же соединения с водородом.
Валентность элементов в соединениях с водородом определяется разностью между числом 8 и
номером группы.
Сущность деления групп на две подгруппы: главную и побочную, можно объяснить и на
происходит заполнение наружного энергетического уровня S-и p-электронами.
Число валентных электронов на внешнем уровне у этих элементов совпадает с номерам группы.
У элементов побочных подгрупп d-е поступают на предпоследний энергетический уровень, он
относятся к d- элементам. Валентными у этих элементов будут d – электроны и электроны
внешнего уровня.
Таким образом, в каждой подгруппе объединены элементы, атомы которых имеют одинаковое
строение внешнего электронного уровня.
Таким образом, деление групп на подгруппы (главную и побочную) основано на различии в заполнении электронами энергетических уровней. Главную подгруппу составляют s- и p-элементы, а побочную подгруппу — d-элементы. В каждой группе объединены элементы, атомы которых имеют сходное строение внешнего энергетического уровня. При этом атомы элементов главных подгрупп содержат на внешних (последних) уровнях число электронов, равное номеру группы. Это так называемые – валентные электроны.
Главная подгруппа – содержит элементы, у которых идет заполнение s- и р- подуровней. Сверху вниз по подгруппе наблюдается усиление металлических (и ослабление неметаллических) свойств.
Привет! Вот подборка тем с ответами на Ваш вопрос: как отличить главную подргуппу от побочной в таблице менделеева? СРОООЧНО!!!
Ответ от Прославленный[гуру]
Главная подгруппа содержит элементы малых и больших периодов, а побочная – только больших.
Ответ от Ирина Карпова[гуру]
Элементы главных подгрупп находятся слева, а побочных справа
Ответ от Майя Полевая[гуру]
смотри в самых верхних строках (1 и 2 периоды) , с какой стороны элементы. Чуть правее или левее, не важно. Но это и есть главная подгруппа. Все те, которые стоят строго под ними – главная, а с другого края будет побочная. (Мы говорим об одном столбце).
Ответ от Отголосок[гуру]
По ЦВЕТУ!! с и п элементы обчно КРАСНОГО И ЖЕЛТОГО ЦВЕТА -ГЛАВНЫЕ
Ответ от Андрей Степанов[активный]
1,2,3 периодах (малые) все в главной подгруппе (т. к. их символ находиться с лева)
4,5,6 периодах (большие) 8 эл-тов из главной подгруппы и 10 эл-тов из побочной
7 периоде (незаконченный) просто смотреть как и абсолютно везде
по местоположению символа в клетке таблицы
если слева — в главной подгруппе, если справа — в побочной
Ответ от Андрей трифанов[новичек]
П
Ответ от Luka3321
главные группы это те элементы что пишутся слево, а побочные подгруппы это те элементы что пишутся с право.
Ответ от Valentin8110[новичек]
фыв
Ответ от 2 ответа[гуру]
Привет! Вот еще темы с нужными ответами:
Группа периодической системы на Википедии
Посмотрите статью на википедии про Группа периодической системы
Подгруппа на Википедии
Посмотрите статью на википедии про Подгруппа
Титан элемент на Википедии
Посмотрите статью на википедии про Титан элемент
Ответить на вопрос:
22oa.ru
Как определить в системе Менделеева группу А и В?
В периодической системе 8 вертикальных столбцов, названных группами. В группах объединены
вверху таблицы римской цифрой. Валентность элементов каждой группы соответствует, за
немногими исключениями, номеру группы.
Каждая группа элементов делится на главную и побочную подгруппы. Главные подгруппы
образуют элементы малых и больших периодов, а побочные – только элементы больших
периодов. Элементы главных и побочных подгрупп сдвинуты в разные стороны.
Те элементы, которые расположены строго под элементами II (и III) периодов, составляют главную подгруппу. Те элементы IV-VII периодов, которые сдвинуты в сторону относительно элементов II (и III) периодов, составляют побочную подгруппу. Например, для IV периода к главной подгруппе относятся K, Ca, Ga, Ge,As, Se, Br Kr. Обратите внимание, что их всегда 8 (кроме неполного VII периода). А к побочно подгруппе относятся Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn. Обратите внимание, что их всегда 10 (кроме неполного VII периода) .
Для элементов, расположенных в одной и той же группе, наблюдаются следующие закономерности:
1. Наибольшая (высшая) валентность элементов каждой группы по кислороду (за немногими
исключениями) соответствует номеру группы. Элементы побочных подгрупп могут проявлять и
другую валентность. Например, медь образует оксиды одновалентной и двухвалентной меди,
двухвалентной меди.
2. В главных подгруппах с увеличением относительных атомных масс, усиливаются
металлические свойства элементов.
3. Неметаллические свойства у элементов главных подгрупп с увеличением порядкового номера
ослабевают. Так, в главной подгруппе VII группы (подгруппе галогенов) наиболее активным
неметаллом является фтор F, а наименее активным – иод I.
4. Элементы главных подгрупп IV – VII групп образуют так же соединения с водородом.
Валентность элементов в соединениях с водородом определяется разностью между числом 8 и
Сущность деления групп на две подгруппы: главную и побочную, можно объяснить и на
основании теории строения атома. Так, к главным подгруппам относятся те элементы, у которых
происходит заполнение наружного энергетического уровня S-и p-электронами.
Число валентных электронов на внешнем уровне у этих элементов совпадает с номерам группы.
У элементов побочных подгрупп d-е поступают на предпоследний энергетический уровень, он
относятся к d- элементам. Валентными у этих элементов будут d – электроны и электроны
внешнего уровня.
Таким образом, в каждой подгруппе объединены элементы, атомы которых имеют одинаковое
строение внешнего электронного уровня.
Таким образом, деление групп на подгруппы (главную и побочную) основано на различии в заполнении электронами энергетических уровней. Главную подгруппу составляют s- и p-элементы, а побочную подгруппу — d-элементы. В каждой группе объединены элементы, атомы которых имеют сходное строение внешнего энергетического уровня. При этом атомы элементов главных подгрупп содержат на внешних (последних) уровнях число электронов, равное номеру группы. Это так называемые – валентные электроны.
У элементов побочных подгрупп валентными являются электроны не только внешних, но и предпоследних (вто-рых снаружи) уровней, в чем и состоит основное различие в свойствах элементов главных и побочных подгрупп.
Главная подгруппа – содержит элементы, у которых идет заполнение s- и р- подуровней. Сверху вниз по подгруппе наблюдается усиление металлических (и ослабление неметаллических) свойств.
obrazovalka.ru
Периодическая система химических элементов Д. И. Менделеева. Группы — Науколандия
Группами называют вертикальные колонки периодической системы химических элементов. В коротком варианте таблицы выделяют восемь групп. Номер группы совпадает с высшей валентностью химического элемента, которую он может проявлять в оксидах. Так, углерод, находясь в IV группе, проявляет в соединении с кислородом высшую валентность IV (CO2). Кальций же валентен II (CaO), так как находится во второй группе.
В коротком варианте таблицы каждую группу делят на две подгруппы — главную и побочную. В побочную подгруппу входят только элементы больших периодов — переходные металлы.
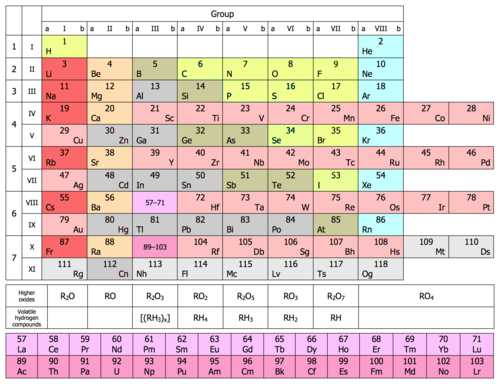
В длинном варианте периодической системы подгрупп нет, а количество групп равно 18.
В коротком варианте таблицы группы обозначают римскими цифрами, а подгруппы буквами A (главная) и B (побочная). В длинном варианте группы обозначаются арабскими цифрами.
В подгруппах (рассматриваем короткий вариант) химические элементы имеют сходные свойства. Например, элементы подгруппы IA — это щелочные металлы, а подгруппы VIIA — галогены. Как известно, у всех щелочных металлов есть похожие свойства, галогены также сходны между собой. Однако в подгруппах свойства элементов закономерно изменяются сверху вниз (с увеличением относительной атомной массы). В главных подгруппах сверху вниз увеличиваются металлические свойства простых веществ соответствующих химических элементов. Неметаллические свойства соответственно убывают. Так, в подгруппе IIIA бор (B) не металл, а расположенный под ним в третьем периоде алюминий (Al) уже является металлом. В следующей главной подгруппе — IVA — неметаллами являются углерод, кремний и германий, а вот расположенные под ними олово и свинец — металлы.
В разных подгруппах одной группы свойства элементов различаются. Однако у них одинаковая высшая валентность, равная номеру группы.
scienceland.info
На что указывает номер периода? группы в периодической системе Д. И Менделеева
группа таблицы МенделееваНомер группы определяется количеством электронов на внешней оболочке атома (валентных электронов) и, как правило, соответствует высшей валентности атома. В короткопериодном варианте периодической системы группы подразделяются на подгруппы — главные (или подгруппы A), начинающиеся с элементов первого и второго периодов, и побочные (подгруппы В) , содержащие d-элементы. Подгруппы также имеют названия по элементу с наименьшим зарядом ядра (как правило, по элементу второго периода для главных подгрупп и элементу четвёртого периода для побочных подгрупп) . Элементы одной подгруппы обладают сходными химическими свойствами. С возрастанием заряда ядра у элементов одной группы из-за увеличения числа электронных оболочек увеличиваются атомные радиусы, вследствие чего происходит снижение электроотрицательности, усиление металлических и ослабление неметаллических свойств элементов, усиление восстановительных и ослабление окислительных свойств образуемых ими веществ.
С 1989 года Международным союзом теоретической и прикладной химии (IUPAC) в качестве основного варианта периодической системы утверждена длиннопериодная форма. В связи с этим IUPAC рекомендует сплошную нумерацию групп: арабскими цифрами от 1 до 18. Несмотря на это, продолжают применяться ставшие традиционными системы нумерации с использованием римских цифр и латинских букв, отличающиеся для Америки и Европы. Современная система нумерации содержит следующие группы (старые системы, Европейская и Американская, приведены в скобках) :
Группа 1 (IA, IA): щелочные металлы
Группа 2 (IIA, IIA): щёлочноземельные металлы
Группа 3 (IIIB, IIIA): подгруппа скандия
Группа 4 (IVB, IVA): подгруппа титана
Группа 5 (VB, VA): подгруппа ванадия
Группа 6 (VIB, VIA): подгруппа хрома
Группа 7 (VIIB, VIIA): подгруппа марганца
Группа 8 (VIIIВ, VIIIA): подгруппа железа
Группа 9 (VIIIВ, VIIIA): подгруппа кобальта
Группа 10 (VIIIВ, VIIIA): подгруппа никеля
Группа 11 (IB, IB): подгруппа меди
Группа 12 (IIB, IIB): подгруппа цинка
Группа 13 (IIIA, IIIB): подгруппа бора
Группа 14 (IVA, IVB): подгруппа углерода
Группа 15 (VA, VB): подгруппа азота
Группа 16 (VIA, VIB): подгруппа кислорода (халькогены)
Группа 17 (VIIA, VIIB): галогены
Группа 18 (VIIIA, VIIIB): инертные газы
otvet.mail.ru
