Краткая история органической химии
История химии берет начало в самой глубокой древности, одновременно с началом развития человека. С древних времен человек, на зная законов о превращениях веществ, научился применять их себе во благо. Огонь, который научились добывать наши предки, позволял не только приготовить пищу, но и получить (хоть и случайно) такие металлы, как медь, свинец, олово. А позднее еще и глиняную посуду, путем обжига, стекло, краски и многое другое.
Таким образом, человек получал знания о веществах, их свойствах, но вместе с тем росло и число вопросов, на которые он не мог найти ответа. Большой вклад в развитие химии внесли ученые Древней Греции. Именно здесь возникли первые попытки объяснения самих процессов.
Так, Анаксимандр и Гераклит выдвинули принцип “противоположности”.
Эмпедокл выделил 4 элемента — это вода, воздух, огонь и земля. А Аристотель выдвинул предположение о возможных взаимодействиях этих четырех элементов.
Левкипп и Демокрит считали, что все вещества состоят из мельчайших частиц — атомов и объясняли происходящие явления с точки зрения атомистической теории.
Платон говорил, что не существует веществ в чистом виде, а только их модификации.
Следующей ступенью развития стала алхимия, основой изучения которой стали металлы, а именно стремление получить золото из всего, что только попадалось в руки. Кроме этого алхимиков волновала тема создания эликсира молодости.
Хотя такие органические вещества как сахара, крахмал, спирт, смолы, масла, Индиго и т. д. были известны с древнейших времен, однако до начала XVIII века прогресс в их химии был весьма незначителен. Поэтому началом развития именно органической химии можно считать 16 — 17 века.
В 1675 Лемери издал свой знаменитый «Cours de Chimie», в котором соединения природного происхождения он делил на три класса: минеральные, растительные и животные. Эта классификация вскоре была принята. В 1784 году, Лавуазье впервые показал, что во всех соединениях, получаемых из растительных и животных источников всегда содержится по меньшей мере углерод и водород, и часто, азот и фосфор. Аналитические работы Лавуазье стимулировали дальнейшие исследования в этом направлении, вследствие чего классификация Лемери неизбежно должна была повергнуться изменениям.
Лемери классифицировал соединения по происхождению, однако теперь было доказано (несомненно, благодаря улучшенным аналитическим методам), что в ряде случаях одно и то же соединение может быть получено из материалов как растительного так и животного происхождения. Таким образом, нет никакой разницы между этими двумя классами соединений.
Это привело к реклассификации веществ на две группы:
- все те вещества, которые могли бы быть получены из овощей или животных, т. е. которые были произведены в живом организме были классифицированы как органические;
- все те вещества, которые не были получены посредством живого организма классифицируются как неорганические.
На данном этапе исследования органических соединений оказалось, что существуют определенные различия между неорганическими и органическими соединениями, например, сложность композиции и горючесть последнего.
Берцелиус (1815) считал, что органические соединения были произведены из их элементов по законам, отличающихся от таковых для неорганических соединений. Тогда это навело его на мысль, что органические вещества производятся под воздействием жизненной силы, и что они не могут быть получены искусственно.
Однако, в 1828 году Велер преобразовал цианат аммония (неорганическое соединение) в мочевину, вещество, которое до сих пор получали только из источников животного происхождения. Этот синтез несколько ослабили различие между органическими и неорганическими соединениями. И это различие полностью укоренилось синтезом уксусной кислоты из ее элементов ученым Кольбе в 1845 году, и синтезом метана ученым Бертло в 1856 году. В 1861 г. А.М. Бутлеров получил вещество класса сахаров, воздействуя на параформальдегид известковой водой.
Теперь возникает вопрос о строении органических соединений. Этот вопрос в полной мере раскрывается в научной теории, созданной в 1861 году А.М. Бутлеровым: «Исходя из мысли, что каждый химический атом, входящий в состав тела, принимает участие в образовании этого последнего и действует здесь определённым количеством принадлежащей ему химической силы, я называю химическим строением распределение действия данной сил, вследствие которого химические атомы, посредственно влияя друг на друга, соединяются в химическую частицу»
zadachi-po-khimii.ru
Органическая химия (конспект лекций): Учебное пособие
Министерство образования и науки Российской Федерации
Федеральное агентство по образованию
ГОУ ВПО “Уральский государственный технический университет – УПИ”
КАФЕДРА ОРГАНИЧЕСКОЙ ХИМИИ
ОРГАНИЧЕСКАЯ ХИМИЯ
КОНСПЕКТ ЛЕКЦИЙ
УЧЕБНОЕ ПОСОБИЕ
рекомендовано методическим Советом ГОУ ВПО УГТУ-УПИ
для направления 240100 “Химическая технология и биотехнология”
Екатеринбург
2007
Авторы:
Понизовский М.Г., к.х.н., доцент кафедры органической химии
Русинова Л.И., к.х.н., доцент кафедры органической химии
АННОТАЦИЯ
Учебное пособие является частью учебно-методического комплекса дисциплины «Органическая химия». Оно включает в себя краткий конспект 44 лекций, охватывающих все разделы читаемого курса. Пособие предназначено для организации самостоятельной работы студентов при подготовке к лекционным, практическим, лабораторным занятиям, промежуточному, итоговому контролю и выполнению домашних заданий и контрольных работ в курсе «Органическая химия». Пособие является учебным материалом для студентов II курса ХТФ, а также может быть полезно студентам I-III курсов ФСМ, ФТФ, МТФ РТФ.
Библиография 38 назв.
Подготовлено кафедрой «Органическая химия»
Лекция №1
· Предмет органической химии. Причины ее выделения в самостоятельную науку и основные этапы развития. Теория строения и ее роль в развитии органического синтеза.
· Эмпирические, молекулярные и структурные формулы. Изомерия. Изомеры строения. Гомологические ряды. Основные функциональные группы и классы органических соединений.
· Основные принципы номенклатуры органических веществ. Заместительная номенклатура, IUPAC. Основные правила составления названий органических соединений.
Предмет органической химии
Впервые понятие органическая химия ввел шведский химик Берцелиус в 1808 г. Он считал, что различие между неорганическими и органическими веществами состоит в том, что первые могут быть получены в лаборатории обычными препаративными методами, тогда как вторые могут образовываться исключительно в результате процессов жизнедеятельности.
В 1828 г. немецкий химик Ф. Вёлер осуществил превращение неорганического вещества циановокислого аммония в хорошо известное органическое соединение – мочевину:
Открытие Ф. Вёлером органического синтеза стало мощнейшим толчком к развитию органической химии во второй половине XIX века. А. Кекуле и А. Купер независимо друг от друга открыли четырехвалентность углерода. Купер отметил способность атомов углерода образовывать цепи и предложил использовать формулы, в которых символы атомов связаны валентными черточками. В 1861 г. А.М. Бутлеров выдвинул теорию химического строения, согласно которой свойства вещества обусловлены природой, числом составляющих его атомов и способом их связывания друг с другом. Это было названо Бутлеровым
Среди элементов, входящих вместе с углеродом в состав органических веществ, исключительная роль принадлежит водороду, поскольку число органических соединений, не содержащих ни одного водородного атома, чрезвычайно мало в сравнении с общим числом известных сегодня химикам-органикам веществ.
Набор свойств, определяющих уникальную природу органических соединений, принадлежит не углероду или водороду в отдельности, а веществам, образованным этими двумя элементами – гидридам углерода, или углеводородам. Углеводороды являются основой классификации органических веществ, поскольку все органические соединения можно считать производными углеводородов, образующимися при замещении атомов водорода атомами других элементов. Поэтому органическая химия – химия углеводородов и их производных
Сам термин «органическая» сохраняет силу в связи с тем, что химия углеводородов и их производных более важна для жизни, чем химия любых других элементов.
Эмпирические, молекулярные и структурные формулы. Изомерия.
Объектом изучения химии являются индивидуальные соединения, т.е. вещества, состоящие из одинаковых молекул. В простейшем случае вещество считается чистым, если его температура плавления (для твердого) или температура кипения (для жидкости) не меняются.
Эмпирическая формула – химическая формула, отражающая качественный состав с указанием относительного количества атомов каждого элемента во всем образце (не в одной молекуле)
Молекулярная формула (брутто-формула) показывает качественный и количественный состав молекулы. Молекулярная формула может быть тождественна эмпирической или быть ее целым кратным. С6Н6 – молекулярная формула бензола.
Структурная формула показывает взаимное расположение атомов и функциональных групп в молекуле. Структурная формула бензола:
Изомеры (isos – тот же, meros – часть) – вещества, имеющие одинаковую молекулярную формулу, но различающиеся по строению. Явление изомерии обусловлено существованием молекул, имеющих одинаковый качественный и количественный состав, но обладающих различными физическими и химическими свойствами из-за различного расположения атомов или функциональных групп или их ориентации в пространстве.
Структурная изомерия – два или более соединения, имеющие одну молекулярную формулу, отличающиеся между собой:
· строением углеродного скелета, например, для С5Н12:
· различным расположением одинаковых функциональных групп (при одинаковом углеродном скелете)
Другие виды изомерии будут рассмотрены в дальнейших лекциях.
Гомологический ряд – ряд соединений, в котором каждый член отличается от предыдущего на одинаковую структурную единицу (гомологическую разность). Гомологи – члены гомологического ряда.
Классификация органических веществ.
Основа классификации органических соединений – теория строения. Все органические вещества, содержащие разные радикалы R (где R – органический остаток) и одинаковые функциональные группы, могут быть разделены на соответствующие классы. Это позволяет классифицировать вещества по их химическим и физическим свойствам, характерным для определенного строения.

Рис. 1.1. Классификация органических веществ (фрагмент)
vunivere.ru
Краткий исторический обзор органической химии
Предмет органической химии. Краткий исторический обзор органической химии.
Органическая химия изучает соединения углерода, называемые органическими веществами, кроме простейших соединений, таких, как карбонаты, СО и СО2. Определение «органическая химия как химия соединений углерода» по этой причине неточное.
К. Шорлеммер в 1889 г. дал определение органической химии как химии углеводородов и их производных. Однако и это определение не является строгим, и найти четкую границу органической и неорганической химиями трудно.
Попытки разделения по признаку происхождения (в начале XIX века к органическим относили вещества живой природы) также оказались ошибочными.
Краткий исторический обзор органической химии
Знакомство человека с органическими веществами и применение их для практических целей началось еще в глубокой древности. Такие вещества, как уксус, масла, жиры, сахар, крахмал, камедь, смолы и др.; такие процессы, как брожение виноградного сока, меда, варка пива и мыла, перегонка для получения скипидара, крашение с помощью индиго и других органических веществ, были давно известны многим народам мира.
Впервые термин «органическая химия» применил И.Я.. Берцелиус в 1808 г., определив ее как «химию растительных и животных веществ, или веществ, образующихся под влиянием жизненной силы и веществ, которые могут быть получены из них путем химических превращений».
Ф. Вёлер в 1828 г. получил мочевину из циановокислого аммония — неорганического вещества. А. Кольбе в 1845 г. синтезировал уксусную кислоту, используя древесный уголь, серу, хлор и воду. Число синтезов органических веществ из неорганических быстро росло. Так, в 1854 г. П. Бертло получил жиры, в 1861 г. А. М. Бутлеров — сахара, в 1862 г. Бертло — ацетилен. А. М. Бутлеров исходил из материалистических представлений, основанных на атомистическом учении М. В. Ломоносова и Дальтона.
Начиная с 1858 г. А. М. Бутлеров развивает и экспериментально обосновывает теорию химического строения.
Сущность этой теории заключается в трех основных положениях:
1) химические вещества определенным образом построены, т. е. имеют строгий порядок в чередовании атомов в молекуле, определенную закономерность во влиянии атомов друг на друга;
2) химическое строение веществ определяет их физические и химические свойства;
3) изучение свойств веществ позволяет определить их химическое строение.
В отличие от ранее существовавших теорий, теория химического строения позволяла классифицировать весь накопившийся и новый экспериментальный материал и, что самое важное, предсказывать возможное число органических соединений определенного состава и вероятные пути их синтеза, т. е. допускала экспериментальную проверку. Она стала общей теорией органической химии как науки.
Для написания структурной формулы любого органического соединения используют четыре основных свойства углерода: 1) четырехвалентность, а также способность его атомов 2) соединяться в цепи, 3) образовать двойные и тройные связи и 4) образовать циклы.
В семидесятых годах XIX в. теория строения дополнилась теорией пространственного расположения атомов в молекулах — стереохимической теорией (Вант-Гофф, Лебель).
Похожие статьи:
poznayka.org
Краткая история органической химии | Химия. Четвёртый год изучения.
 |
| Шведский химик Йенс-Якоб Берцелиус |
Впервые понятия об органических
веществах и об органической химии ввёл шведский учёный Берцелиус. В своём
учебнике химии Берцелиус (1827) высказывает убеждение, что “… в живой
природе элементы повинуются иным законам, чем в безжизненной” и что
органические вещества не могут образовываться под влиянием обычных физических и
химических сил , но требуют для своего образования особой “жизненной
силы”. Органическую химию он и определил, как химию растительных и
животных веществ. Последующее развитие органической химии доказало ошибочность этих взглядов.
В 1928 году Вёллер показал, что
неорганическое вещество-циановокислый аммоний-при нагревании превращается в
продукт жизнедеятельности животного организма-мочевину.
В 1845 г. Кольбе синтезировал
органическое вещество-уксусную кислоту, в качествеисходных веществ он
использовал древесный уголь, серу, хлор и воду. За сравнительно короткий период
были синтезированы и другие органические кислоты, которые раньше выделялись только из растений.
В 1854 г. Бертло удалось синтезировать
вещества, относящиеся к классу спиртов.
В 1861 г. А.М.Бутлеров действуя
известковой водой на параформальдегид впервые осуществил синтез метиленитана,
которое относится к сахарам, которые играют важную роль в процессах
жизнедеятельности организмов.
Развитиие органической химии требовали разрешения вопроса, являются ли молекулы
беспорядочным нагромождением атомов, удерживаемых силами притяжения, или же они
представляют собой частицы с определённым строением, которое можно установить,
исследуя свойства вещества. В органической химии к тому моменту накопились
факты и обобщения, которые могли служить основойсдля решения вопроса о строении
молекул.
Решающую роль сыграло открытие валентности элементов. Её открытие
непосредственно подводило к мысли, что молекулы имеют определённое строение.
Оставался открытым вопрос: как определять строение молекулы. Этот вопрос не мог
быть решён без подлинно научной теории органической химии, которая и была
создана А.М.Бутлеровым в 1861 году. Он писал: “Исходя из мысли, что каждый
химический атом, входящий в состав тела, принимает участие в образовании этого
последнего и действует здесь определённым количеством принадлежащей ему
химической силы, я называю химическим строением распределение действия данной
сил, вследствие которого химические атомы, посредственно влияя друг на друга,
соединяются в химическую частицу.”
iighjgh.blogspot.com
История развития органической химии
Органическая химия, наука, изучающая соединения углерода с другими элементами (органические соединения), а также законы их превращений. Название “органическая химия” возникло на ранней стадии развития науки, когда предмет изучения ограничивался соединениями углерода растительного и животного происхождения. Не все соединения углерода классифицируются как органические. Например, СО2, HCN, CS2 традиционно относят к неорганическим. Условно можно считать, что прототипом орг. соединений является метан СН4.
К настоящему времени число известных орг. соединений превышает 10 млн. и увеличивается каждый год на 250-300 тыс. Многообразие орг. соединений определяется уникальной способностью атомов углерода соединяться друг с другом простыми и кратными связями, образовывать соединения с практически неограниченным числом атомов, связанных в цепи, циклы, бициклы, трициклы, полициклы, каркасы и др., образовывать прочные связи почти со всеми элементами периодичной системы, а также явлением изомерии – существованием разных по свойствам веществ, обладающих одним и тем же составом и молярной массой.
Многообразие и громадное число орг. соединений определяет значение орг. химии как крупнейшего раздела современной химии. Окружающий нас мир построен главным образом из орг. соединений; пища, топливо, одежда, лекарства, краски, моющие средства, материалы, без которых невозможно создание транспорта, книгопечатания, проникновение в космос и прочее, – все это состоит из орг. соединений. Важнейшую роль орг. соединения играют в процессах жизнедеятельности. Отдельный раздел орг. химии составляет химия высокомолярных соединений: по величине молекул орг. вещества делятся на низкомолекулярные (с молярной массой от нескольких десятков до нескольких сотен, редко до тысячи) и высокомолекулярные (макромолекулярные; с молярной массой порядка 104-106 и более).
Орг. химия изучает не только соединения, получаемые из растительных и животных организмов, но в основном соединения, созданные искусственно с помощью лаборатории или промышленного органического синтеза. Более того, объектами изучения компьютерной орг. химии являются соединения, не только не существующие в живых организмах, но которые, по-видимому, нельзя получить искусственно (напр., гипотетический аналог метана, имеющий не природное тетраэдрич. строение, а форму плоского квадрата, в центре которого лежит атом С, а в вершинах – атомы Н).
Классификация органических соединений
Основу органических соединений составляет незамкнутая (открытая) или замкнутая цепь углеродных атомов; одно или несколько звеньев цепи может быть заменено на атомы, отличные от углерода, – гетероатомы, чаще всего О, N, S. По структуре органические соединения подразделяют на алифатические соединения – углеводороды и их производные, имеющие открытую углеродную цепь; карбоциклические соединения с замкнутой углеродной цепью; гетероциклические соединения. Углеводороды и их производные, не содержащие кратных связей, относятся к насыщенным соединениям, с кратными связями – к ненасыщенным.
Историческая справка
Истоки органической химии восходят к глубокой древности (уже тогда знали о спиртовом и уксуснокислом брожении, крашении индиго и ализарином). Однако в средние века (период алхимии) были известны лишь немногие индивидуальные орг. вещества. Все исследования этого периода сводились главным образом к операциям, при помощи которых, как тогда думали, одни простые вещества можно превратить в другие. Начиная с ХVI в. (период ятрохимии) исследования были направлены в основном на выделение и использование различных лекарственных веществ: был выделен из растений ряд эфирных масел, приготовлен диэтиловый эфир, сухой перегонкой древесины получены древесный (метиловый) спирт и уксусная кислота, из винного камня – винная кислота, перегонкой свинцового сахара – уксусная кислота, перегонкой янтаря – янтарная.
Слияние химических соединений растительного и животного происхождения в единую хим. науку орг. химии осуществил Й. Берцелиус, который ввел сам термин и понятие орг. вещества, образование последнего, по Берцелиусу, возможно только в живом организме при наличии “жизненной силы”.Это заблуждение опровергли Ф. Вёлер (1828), который получил мочевину (орг. вещество) из цианата аммония (неорганическое вещество), А. Кольбе, синтезировавший уксусную кислоту, М. Бертло, получивший метан из H2S и CS2, A. M. Бутлеров, синтезировавший сахаристые вещества из формалина. В первой пол. XIX в. был накоплен обширный опытный материал и сделаны первые обобщения, определившие бурное развитие орг. химии: развиты методы анализа орг. соединения (Берцелиус, Ю. Либих, Ж. Дюма, М. Шеврёль), создана теория радикалов (Вёлер, Ж. Гей-Люссак, Либих, Дюма) как групп атомов, переходящих неизменными из исходной молекулы в конечную в процессе реакции; теория типов (Ш. Жерар, 1853), в которой орг. соединения конструировались из неорганических веществ – «типов» замещением в них атомов на орг. фрагменты; введено понятие изомерии (Берцелиус).
Одновременно продолжается интенсивное развитие синтеза. Создаются первые промышленные производства органические соединения (А. Гофман, У. Перкин-старший – синтетические красители: мовеин, фуксин, цианиновые и азокрасители). Усовершенствование открытого Н. Н. Зининым (1842) способа синтеза анилина послужило основой создания анилинокрасочной промышленности.
Идея неразрывной связи хим. и физ. свойств молекулы с ее строением, идея единственности этого строения впервые была высказана Бутлеровым (1861), который создал классическую теорию хим. строения (атомы в молекулах соединяются согласно их валентностям, хим. и физ. свойства соединения определяются природой и числом входящих в их состав атомов, а также типом связей и взаимным влиянием непосредственно несвязанных атомов). Теория хим. строения определила дальнейшее бурное развитие органической химии: в 1865 Кекуле предложил формулу бензола, позднее высказал идею об осцилляции связей; В.В. Марковников и А.М. Зайцев сформулировали ряд правил, впервые связавших направление хим. реакции с хим. строением вступающего в реакцию вещества.
Работами Байера, К. Лаара, Л. Клайзена, Л. Кнорра развиты представления о таутомерии – подвижной изомерии. Все эти теоретические представления способствовали мощному развитию синтетической химии. К кон. XIX в. были получены все важнейшие представители углеводородов, спиртов, альдегидов и кетонов, карбоновых кислот, галогено- и нитропроизводных, азот- и серосодержащих структур, гетероциклов ароматической природы. Разработаны методы получения диенов, ацетиленов и алленов (А.Е. Фаворский). Открыты многочисленные реакции конденсации (Ш. Вюрц, А. П. Бородин, У. Перкин, Клайзен, А. Михаэль, Ш. Фридель, Дж. Крафтс, Э. Кнёвенагель и др.). Исключительные успехи были достигнуты Э. Г. Фишером в изучении углеводов, белков и пуринов, в использовании ферментов в орг. синтезе (1894), им же был осуществлен синтез полипептидов. Основой промышленности душистых веществ становятся работы О. Валлаха по химии терпенов. Выдающимися даже для нашего времени являются пионерские работы Р. Вильштеттера. Фундаментальный вклад в развитие орг. синтеза был внесен В. Гриньяром (1900-20) и Н.Д. Зелинским (1910) – создание исключительно плодотворного метода синтеза магнийорганических соединений и открытие каталитических превращений углеводородов; последнее сыграло выдающуюся роль в развитии химии нефти. Химия свободных радикалов началась с работ М. Гомберга (1900), открывшим трифенилметильный радикал, и была продолжена работами А. Е. Чичибабина, Г. Виланда и Ш. Гольдшмидта.
Строение органических соединений
Для органических соединений характерны неполярные ковалентные связи С—С и полярные ковалентные связи С—О, С—N, С—Hal, С—металл и т.д. Образование ковалентных связей было объяснено на основании развитых Г. Льюисом и В. Косселем (1916) предположений о важной роли электронных образований – октетов и дублетов. Молекула устойчива, если валентная оболочка таких элементов, как С, N, О, Hal, содержит 8 электронов (правило октета), а валентная оболочка водорода – 2 электрона. Хим. связь образуется обобществленной парой электронов различных атомов (простая связь). Двойные и тройные связи образуются соответсвующимися двумя и тремя такими парами. Электроотрицательные атомы (F, О, N) используют для связи с углеродом не все свои валентные электроны; “неиспользованные” электроны образуют неподеленные (свободные) электронные пары. Полярность и поляризуемость ковалентных связей в орг. соединениях в электронной теории Льюиса – Косселя объясняется смещением электронных пар от менее электроотрицательного к более электроотрицательному атому, что находит выражение в индуктивном эффекте и мезомерном эффекте.
Классическая теория хим. строения и первоначально электронные представления оказались не в состоянии удовлетворительно описать на языке структурных формул строение многих соединений, например, ароматических. Современная теория связи в орг. соединениях основана главным образом на понятии орбиталей и использует методы молекулярных орбиталей. Интенсивно развиваются квантовохимические методы, объективность которых определяется тем, что в их основе лежит аппарат квантовой механики, единственно пригодный для изучения явлений микромира.
Общая характеристика реакций органических соединений
Реакции органических соединений имеют некоторые специфические особенности. В реакциях неорганических соединений обычно участвуют ионы; эти реакции протекают очень быстро, иногда мгновенно при нормальной температуре. В реакциях орг. соединений обычно участвуют молекулы; при этом одни ковалентные связи разрываются, а другие образуются. Такие реакции протекают медленнее ионных, и для их ускорения часто требуется повысить температуру или добавить катализатор. Наиболее часто используют в качестве катализаторов и основания. Обычно протекает не одна, а несколько реакций, так что выход нужного продукта очень часто составляет менее 50%.
Возникновение органических соединений
Большинство орг. соединений в природе образуется в процессе фотосинтеза из диоксида углерода и воды под действием солнечного излучения, поглощаемого хлорофиллом в зеленых растениях. Однако орг. соединений должны были существовать на земле и до возникновения жизни, которая не могла появиться без них. Первичная земная атмосфера около 2 млрд. лет назад имела восстановительные свойства, т. к. в ней не было кислорода, а содержались прежде всего водород и вода, а также СО, азот, аммиак и метан.
В условиях сильного радиоактивного излучения земных минералов и интенсивных атмосферных разрядов в атмосфере протекал абиотический синтез аминокислот по схеме:
CH4 + H2O + NH3→Аминокислоты
Возможность такой реакции в настоящее время доказана лабораторными опытами.
biofile.ru
Предисловие
Учебное пособие включает в себя конспект 17 лекций, охватывающий все разделы читаемого курса.
В пособии в компактной и доступной форме представлен обширный теоретический и фактический материал по изучению строения, свойств, получения и применения органических соединений различных классов. В работу включены краткие как исторические, так и современные сведения о достижениях в области органической химии.
Пособие предназначено для организации самостоятельной работы студентов при подготовке к лекционным, практическим занятиям, итоговому контролю и выполнению домашних заданий и контрольных работ по дисциплине.
Учебное пособие по органической химии предназначено для студентов по направлениям подготовки 050100.62 – «Естественнонаучное образование» профиля «Химия», 020400.62 – «Биология» профиля «Биоэкология», 280700. 62 – профиль «Техносферная безопасность», а также может быть полезным студентам других специальностей и направлений.
Химия (органическая химия) [Текст] : учебно-методический комплекс по дисциплине : конспект лекций / М-во образования и науки Рос. Федерации, ФГБОУ ВПО “Хакасский государственный университет им. Н. Ф. Катанова” ; [сост. Л. А. Фисун]. – Абакан : Изд-во ФГБОУ ВПО “Хакасский государственный университет им. Н. Ф. Катанова”, 2014. – 136 с.
Лекция №1. Введение. Предмет органической химии. Основные этапы ее развития
План
1. Предмет органической химии.
2. Основные исторические этапы развития органической химии.
3. Основные источники органических соединений.
4. Теория химического строения им. А.М. Бутлерова.
Органическая химия – наука, всесторонне изучающая органические соединения. Органические соединения – это углеводороды и их функциональных производные.
Органические соединения известны человеку с глубокой древности: этиловый спирт, уксусная кислота, масла, растительные красители и другие. Однако систематическое изучение органических соединений началось во второй половине 18 века.
Термины «органическая химия», «органические вещества» введены в начале 19 века (1809г.) шведом Й.Я. Берцелиусом для обозначения веществ, выделяемых из животных и растительных организмов. В настоящее время известно более 10 миллионов органических соединений, при этом число синтетических органических соединений несравнимо больше веществ, встречающихся в природе.
Таблица 1.
Распространение углерода в природе
Источники углерода | Количество, 109т | Источники углерода | Количество, 109т |
Газы- гидраты | 104 | Наземная растительность | 830 |
Уголь,нефть, газ | 5000 | Торф | 500 |
Почва | 1400 | Атмосфера | 3,6 |
Вода | 980 | Морские растения | 3,0 |
Органические соединения образованы небольшим числом элементов – углеродом, водородом, серой, кислородом, азотом, фосфором. В состав организма человека, например, входит 24 элемента, на долю четырех из них – углерода, водорода, кислорода и азота приходится около 99% соединений. Архитектура, состав и строение органических соединений весьма разнообразны, разнообразны и уникальны их свойства.
Современная органическая химия характеризуется достаточно развитыми теоретическими представлениями, позволяющими систематизировать, объяснять и прогнозировать свойства, существование органических соединений и их роль в жизни человека.
Фундаментом теоретической органической химии является теория химического строения им. А.М. Бутлерова (1861 год), основные положения которой сформулированы следующим образом:
1. Атомы в молекулах соединяются между собой в определенной последовательности, согласно их валентности. Химическое строение – это определенная последовательность расположения связей между атомами.
2. Свойства органических веществ зависят не только от природы и числа атомов, но и от химического строения. Каждое химическое соединение имеет только одну химическую формулу, которая дает представление об его химических свойствах.
3. Явление существования нескольких соединений с одинаковым качественным и количественным составом, но с разными строением и свойствами, называется изомерией, а сами соединения – изомерами.
4. Атомы в молекулах оказывают друг на друга взаимное влияние. Химический характер каждого конкретного атома в молекуле зависит от природы связанных с ним атомов.
5. Химическое строение соединения может быть установлено по его химическим и физическим свойствам. И, наоборот, зная строение, можно определить его свойства.
Теория химического строения позволила систематизировать фактический материал органической химии, объяснять ее закономерности, предсказывать новые факты.
Достижения современной теории связаны с развитием стереохимических представлений, электронной теории, квантовой химии, глубоким проникновением физико-химических, физических и математических методов исследований, применением компьютерных технологий.
На рубеже 20 и 21 веков органическая химия достигла впечатляющих успехов в понимании тонких механизмов химических реакций, выявлении закономерностей влияния структуры на свойства органических соединений, направленного синтеза необходимых веществ и материалов.
Многие направления органической химии развивались в последние десятилетия столь интенсивно, что выросли в самостоятельные научные дисциплины – стереохимия, химия высокомолекулярных соединений и полимеров, химия природных и физиологически активных соединений, химия элементоорганических соединений, физическая органическая химия, химия гетероциклов, биоорганическая химия, молекулярная биология и т.д.
studfiles.net
ХИМИЯ ОРГАНИЧЕСКАЯ | Энциклопедия Кругосвет
Содержание статьиХИМИЯ ОРГАНИЧЕСКАЯ – раздел химической науки, изучающий углеводороды – вещества, содержащие углерод и водород, а также различные производные этих соединений, включающие атомы кислорода, азота и галогенов. Все такие соединения называют органическими.
Органическая химия возникла в процессе изучения тех веществ, которые добывались из растительных и животных организмов, состоящих в основной своей массе из органических соединений. Именно это определило чисто историческое название таких соединений (организм – органический). Некоторые технологии органической химии возникли еще в глубокой древности, например, спиртовое и уксуснокислое брожение, использование органических красителей индиго и ализарина, процессы дубления кожи и др. В течение долгого времени химики умели лишь выделять и анализировать органические соединения, но не могли получать их искусственно, в результате чего возникло убеждение, что органические соединения могут быть получены только с помощью живых организмов.
Начиная со второй половины 19 в. методы органического синтеза стали интенсивно развиваться, что позволило постепенно преодолеть устоявшееся заблуждение. Впервые синтез органических соединений в лаборатории удалось осуществить Фридриху Велеру (в период 1824–1828), при гидролизе дициана он получил щавелевую кислоту, выделяемую до этого из растений, а при нагревании циановокислого аммония за счет перестройки молекулы (см. ИЗОМЕРИЯ) получил мочевину – продукт жизнедеятельности живых организмов (рис. 1. Первые синтезы органических соединений).
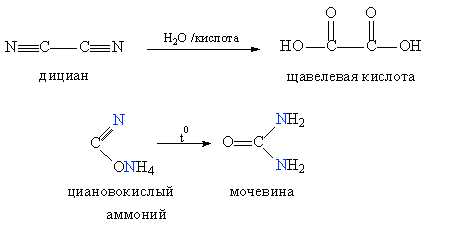
Сейчас многие из соединений, присутствующих в живых организмах, можно получить в лаборатории, кроме того, химики постоянно получают органические соединения, не встречающиеся в живой природе.
Становление органической химии как самостоятельной науки произошло в середине 19 в., когда благодаря усилиям ученых-химиков, стали формироваться представления о строении органических соединений. Наиболее заметную роль сыграли работы Э.Франкланда (определил понятие валентности), Ф.Кекуле (установил четырехвалентность углерода и строение бензола), А. Купера (предложил используемый и поныне символ валентной черты, соединяющей атомы при изображении структурных формул), А.М.Бутлерова (создал теорию химического строения, в основе которой лежит положение, согласно которому свойства соединения определяются не только его составом, но и тем, в каком порядке соединены атомы).
Следующий важный этап в развитии органической химии связан с работами Я.Вант-Гоффа, который изменил сам способ мышления химиков, предложив перейти от плоского изображения структурных формул к пространственному расположению атомов в молекуле, в итоге химики стали рассматривать молекулы как объемные тела.
Представления о природе химической связи в органических соединениях впервые сформулировал Г.Льюис, предположивший, что атомы в молекуле связаны с помощью электронов: пара обобщенных электронов создает простую связь, а две или три пары образуют, соответственно, двойную и тройную связь. Рассматривая распределение электронной плотности в молекулах (например, ее смещение под влиянием электроотрицательных атомов O, Cl и др.) химики смогли объяснить реакционную способность многих соединений, т.е. возможность их участия в тех или иных реакциях.
Учет свойств электрона, определяемых квантовой механикой, привел к развитию квантовой химии, использующей представления о молекулярных орбиталях. Сейчас квантовая химия, показавшая на многих примерах свою предсказательную силу, успешно сотрудничает с экспериментальной органической химией.
Небольшую группу соединений углерода не относят к органическим: угольная кислота и ее соли (карбонаты), цианистоводородная кислота HCN и ее соли (цианиды), карбиды металлов и некоторые другие соединения углерода, которые изучает неорганическая химия.
Главная особенность органической химии – исключительное разнообразие соединений, которое возникло из-за способности атомов углерода соединяться друг с другом в практически неограниченном количестве, образуя молекулы в виде цепочек и циклов. Еще большее разнообразие достигается за счет включения между атомами углерода атомов кислорода, азота и др. Явление изомерии, благодаря которому молекулы, обладающие одинаковым составом, могут иметь различное строение, дополнительно увеличивает многообразие органических соединений. Сейчас известно свыше 10 млн. органических соединений, причем их количество ежегодно увеличивается на 200–300 тысяч.
Классификация органических соединений.
В качестве основы при классификации приняты углеводороды, их считают базовыми соединениями в органической химии. Все остальные органические соединения рассматривают как их производные.
При систематизации углеводородов принимают во внимание строение углеродного скелета и тип связей, соединяющих атомы углерода.
I. АЛИФАТИЧЕСКИЕ (aleiphatos. греч. масло) углеводороды представляют собой линейные или разветвленные цепочки и не содержат циклических фрагментов, они образуют две крупные группы.
1. Предельные или насыщенные углеводороды (названы так потому, что не способны что-либо присоединять) представляют собой цепочки атомов углерода, соединенных простыми связями и окруженных атомами водорода (рис. 1). В том случае, когда цепочка имеет разветвления, к названию добавляют приставку изо. Простейший насыщенный углеводород – метан, с него начинается ряд этих соединений.

Рис. 2. НАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ
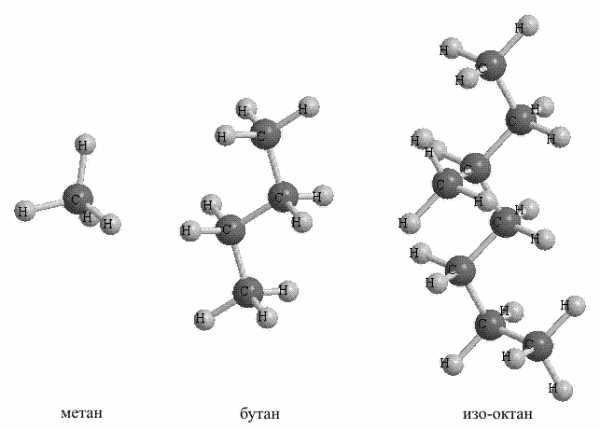
Основные источники насыщенных углеводородов – нефть и природный газ. Реакционная способность насыщенных углеводородов очень низкая, они могут реагировать только с наиболее агрессивными веществами, например, с галогенами или с азотной кислотой. При нагревании насыщенных углеводородов выше 450 С° без доступа воздуха разрываются связи С-С и образуются соединения с укороченной углеродной цепью. Высокотемпературное воздействие в присутствии кислорода приводит к их полному сгоранию до СО2 и воды, что позволяет эффективно использовать их в качестве газообразного (метан – пропан) или жидкого моторного топлива (октан).
При замещении одного или нескольких атомов водорода какой-либо функциональной (т.е. способной к последующим превращениям) группой образуются соответствующие производные углеводородов. Соединения, содержащие группировку С-ОН, называют спиртами, НС=О – альдегидами, СООН – карбоновыми кислотами (слово «карбоновая» добавляют для того, чтобы отличить их от обычных минеральных кислот, например, соляной или серной). Соединение может содержать одновременно различные функциональные группы, например, СООН и NH2, такие соединения называют аминокислотами. Введение в состав углеводорода галогенов или нитрогрупп приводит соответственно к галоген- или нитропроизводным (рис. 3).
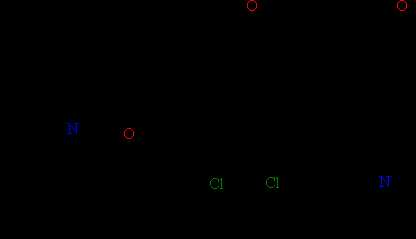
Рис. 4. ПРИМЕРЫ НАСЫЩЕННЫХ УГЛЕВОДОРОДОВ с функциональными группами
Все показанные производные углеводородов образуют крупные группы органических соединений: спирты, альдегиды, кислоты, галогенпроизводные и т.д. Поскольку углеводородная часть молекулы имеет очень низкую реакционную способность, химическое поведение таких соединений определяется химическими свойствами функциональных групп –ОН, -СООН, -Cl, -NO2 и др..
2. Ненасыщенные углеводороды имеют те же варианты строения основной цепи, что и насыщенные, но содержат двойные или тройные связи между атомами углерода (рис. 6). Простейший ненасыщенный углеводород – этилен.

Рис. 6. НЕНАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ
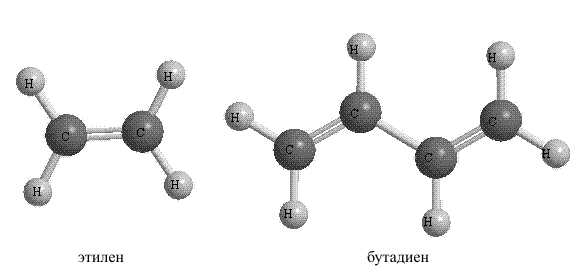
Наиболее характерно для ненасыщенных углеводородов присоединение по кратной связи (рис. 8), что позволяет синтезировать на их основе разнообразные органические соединения.
Рис. 8. ПРИСОЕДИНЕНИЕ РЕАГЕНТОВ к ненасыщенным соединениям по кратной связи
Другое важное свойство соединений с двойными связями – их способность полимеризоваться (рис. 9.), двойные связи при этом раскрываются, в результате образуются длинные углеводородные цепи.
Рис. 9. ПОЛИМЕРИЗАЦИЯ ЭТИЛЕНА
Введение в состав ненасыщенных углеводородов упомянутых ранее функциональных групп так же, как и в случае насыщенных углеводородов, приводит к соответствующим производным, которые также образуют крупные группы соответствующих органических соединений – ненасыщенные спирты, альдегиды и т.д. (рис. 10).
Рис. 10. НЕНАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ с функциональными группами
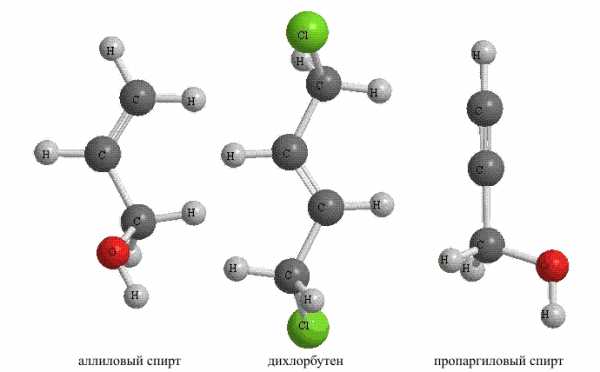
Для показанных соединений приведены упрощенные названия, точное положение в молекуле кратных связей и функциональных групп указывают в названии соединения, которое составляют по специально разработанным правилам.
Химическое поведение таких соединений определяется как свойствами кратных связей, так и свойствами функциональных групп.
II. КАРБОЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ содержат циклические фрагменты, образованные только атомами углерода. Они образуют две крупные группы.
1. Алициклические (т.е. и алифатические и циклические одновременно) углеводороды. В этих соединениях циклические фрагменты могут содержать как простые, так и кратные связи, кроме того, соединения могут содержать несколько циклических фрагментов, к названию этих соединений добавляют приставку «цикло», простейшее алициклическое соединение – циклопропан (рис. 12).

Рис. 12. АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ
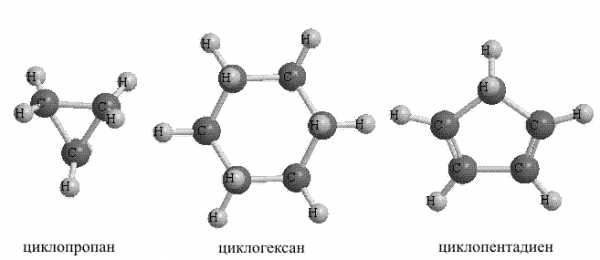
Помимо показанных выше существуют иные варианты соединения циклических фрагментов, например, они могут иметь один общий атом, (так называемые, спироциклические соединения), либо соединяться таким образом, чтобы два или более атомов были общими для обоих циклов (бициклические соединения), при объединении трех и более циклов возможно также образование углеводородных каркасов (рис. 14).

Рис. 14. ВАРИАНТЫ СОЕДИНЕНИЯ ЦИКЛОВ в алициклических соединениях: спироциклы, бициклы и каркасы. В названии спиро- и бициклических соединений указывают тот алифатический углеводород, который содержит такое же общее число атомов углерода, например, в показанном на рисунке спироцикле содержится восемь атомов углерода, поэтому его название построено на основе слова «октан». В адамантане атомы расположены так же, как в кристаллической решетке алмаза, что определило его название (греч. adamantos – алмаз)
Многие моно- и бициклические алициклические углеводороды, а также производные адамантана входят в состав нефти, их обобщенное название – нафтены.
По химическим свойствам алициклические углеводороды близки соответствующим алифатическим соединениям, однако, у них появляется дополнительное свойство, связанное с их циклическим строением: небольшие циклы (3–6-членные) способны раскрываться, присоединяя некоторые реагенты (рис. 15).
Рис. 15. РЕАКЦИИ АЛИЦИКЛИЧЕСКИХ УГЛЕВОДОРОДОВ, протекающие с раскрытием цикла
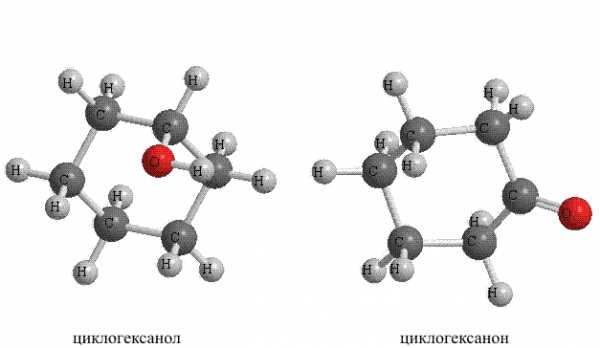
Введение в состав алициклических углеводородов различных функциональных групп приводит к соответствующим производным – спиртам, кетонам и т.п. (рис. 16).

Рис. 16. АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ с функциональными группами
2. Вторую крупную группу карбоциклических соединений образуют ароматические углеводороды бензольного типа, т.е содержащие в своем составе один или несколько бензольных циклов (существуют также ароматические соединения небензольного типа (см. АРОМАТИЧНОСТЬ). При этом они могут также содержать фрагменты насыщенных или ненасыщенных углеводородных цепей (рис. 18).

Рис. 18. АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ.
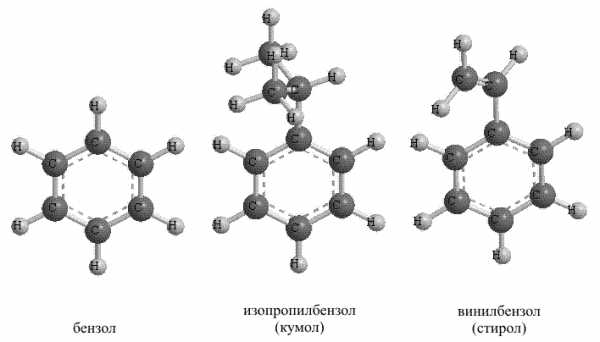
Существуют группа соединений, в которых бензольные кольца как бы спаяны между собой, это так называемые конденсированные ароматические соединения (Рис. 20).

Рис. 20. КОНДЕНСИРОВАННЫЕ АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ
Многие ароматические соединения, в том числе и конденсированные (нафталин и его производные) входят в состав нефти, второй источник этих соединений – каменноугольная смола.
Для бензольных циклов не характерны реакции присоединения, которые проходят с большим трудом и в жестких условиях, наиболее типичны для них реакции замещения атомов водорода (рис.21).
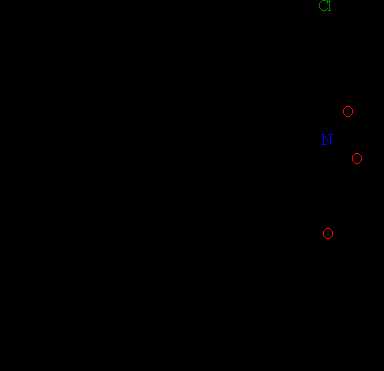
Рис. 21. РЕАКЦИИ ЗАМЕЩЕНИЯ атомов водорода в ароматическом ядре.
Помимо функциональных групп (галогена, нитро- и ацетильной группы), присоединенных к бензольному ядру (рис. 21), можно также ввести иные группы, в результате получаются соответствующе производные ароматических соединений (рис. 22), образующие крупные классы органических соединений – фенолы, ароматические амины и др.
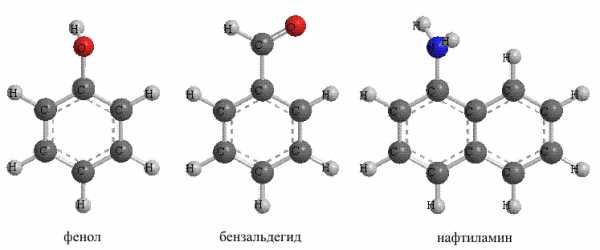
Рис. 22. АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ с функциональными группами. Соединения, в которых neгруппа -ОН соединена с атомом углерода в ароматическом ядре, называют фенолами, в отличие от алифатических соединений, где такие соединения называют спиртами.
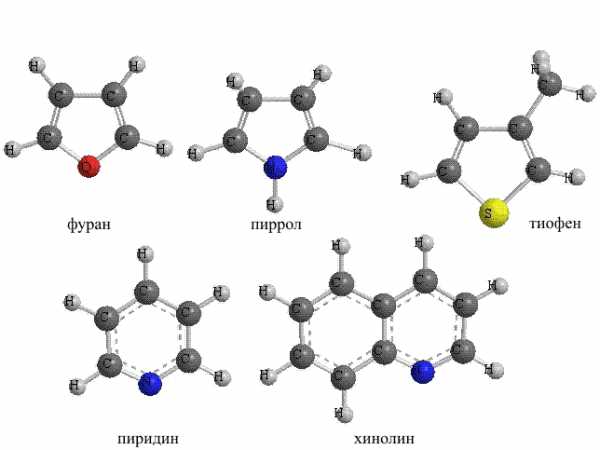
III. ГЕТЕРОЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ содержат в составе цикла (помимо атомов углерода) различные гетероатомы: O, N, S. Циклы могут быть различного размера, содержать как простые, так и кратные связи, а также присоединенные к гетероциклу углеводородные заместители. Существуют варианты, когда гетероцикл «спаян» с бензольным ядром (рис. 24).
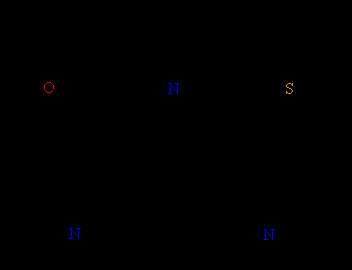
Рис. 24. ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ. Их названия сложились исторически, например, фуран получил название от фуранового альдегида – фурфурола, получаемого из отрубей (лат. furfur – отруби). Для всех показанных соединений реакции присоединения затруднены, а реакции замещения проходят достаточно легко. Таким образом, это ароматические соединения небензольного типа.
Разнообразие соединений этого класса увеличивается дополнительно за счет того, что гетероцикл может содержать два и более гетероатомов в цикле (рис. 26).
Рис. 26. ГЕТЕРОЦИКЛЫ с двумя и более гетероатомами.
Точно так же, как и рассмотренные ранее алифатические, алициклические и ароматические углеводороды, гетероциклы могут содержать в своем составе различные функциональные группы (-ОН, -СООН, -NH2 и др.), причем гетероатом в цикле в некоторых случаях также можно рассматривать как функциональную группу, поскольку он способен принимать участие в соответствующих превращениях (рис. 27).
Рис. 27. ГЕТЕРОАТОМ N в роли функциональной группы. В названии последнего соединения буква «N» указывает, к какому атому присоединена метильная группа.
Реакции органической химии.
В отличие от реакций неорганической химии, где с высокой скоростью (иногда мгновенно) взаимодействуют ионы, в реакциях органических соединений обычно участвуют молекулы, содержащие ковалентные связи. В результате все взаимодействия протекают гораздо медленнее, чем в случае ионных соединений (иногда десятки часов), часто при повышенной температуре и в присутствии ускоряющих процесс веществ – катализаторов. Многие реакции протекают через промежуточные стадии или в нескольких параллельных направлениях, что приводит к заметному снижению выхода нужного соединения. Поэтому при описании реакций вместо уравнений с числовыми коэффициентами (что традиционно принято в неорганической химии) часто используют схемы реакций без указания стехиометрических соотношений.
Название крупных классов органических реакций часто связывают с химической природой действующего реагента или с типом вводимой в соединение органической группы:
а) галогенирование – введение атома галогена (рис. 8, первая схема реакции),
б) гидрохлорирование, т.е. воздействие HCl (рис. 8, вторая схема реакции)
в) нитрование – введение нитрогруппы NO2 (рис. 21, второе направление реакции)
г) металлирование – введение атома металла (рис. 27, первая стадия)
а) алкилирование – введение алкильной группы (рис. 27, вторая стадия)
б) ацилирование – введение ацильной группы RC(O)- (рис. 27, вторая стадия)
Иногда название реакции указывает на особенности перестройки молекулы, например, циклизация – образование цикла, дециклизация – раскрытие цикла (рис.15).
Крупный класс образуют реакции конденсации (лат. condensatio – уплотнение, сгущение), при которых происходит формирование новых связей С-С с одновременным образованием легко удаляемых неорганических или органических соединений. Конденсацию, сопровождаемую выделением воды, называют дегидратацией. Конденсационные процессы могут также проходить внутримолекулярно, то есть, в пределах одной молекулы (рис. 28).

Рис. 28. РЕАКЦИИ КОНДЕНСАЦИИ
В конденсации бензола (рис. 28) роль функциональных групп выполняют фрагменты С-Н.
Классификация органических реакций не имеет строгого характера, например, показанную на рис. 28 внутримолекулярную конденсацию малеиновой кислоты можно также отнести к реакциям циклизации, а конденсацию бензола – к дегидрированию.
Существуют внутримолекулярные реакции, несколько отличающиеся от конденсационных процессов, когда фрагмент (молекула) отщепляется в виде легко удаляемого соединения без очевидного участия функциональных групп. Такие реакции называют элиминированием (лат. eliminare – изгонять), при этом образуются новые связи (рис. 29).

Рис. 29. РЕАКЦИИ ЭЛИМИНИРОВАНИЯ
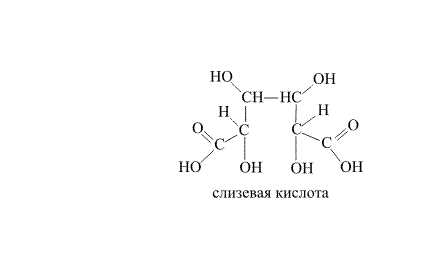
Возможны варианты, когда совместно реализуются несколько типов превращений, что показано далее на примере соединения, в котором при нагревании протекают разнотипные процессы. При термической конденсации слизевой кислоты (рис. 30) проходит внутримолекулярная дегидратация и последующее элиминирование СО2.

Рис. 30. ПРЕВРАЩЕНИЕ СЛИЗЕВОЙ КИСЛОТЫ (получаемой из желудевого сиропа) в пирослизевую кислоту, названную так потому, что получают ее нагреванием слизевой. Пирослизевая кислота представляет собой гетероциклическое соединение – фуран с присоединенной функциональной (карбоксильной) группой. В процессе реакции разрываются связи С-О, С-Н и образуются новые связи С-Н и С-С.
Существуют реакции, при которых происходит перестраивание молекулы без изменения состава (см. ИЗОМЕРИЗАЦИЯ).
Методы исследования в органической химии.
Современная органическая химия помимо элементного анализа использует многие физические методы исследования. Сложнейшие смеси веществ разделяют на составляющие компоненты с помощью хроматографии, основанной на перемещении растворов или паров веществ через слой сорбента. Инфракрасная спектроскопия – пропускание инфракрасных (тепловых) лучей через раствор или сквозь тонкий слой вещества – позволяет установить наличие в веществе определенных фрагментов молекулы, например, групп С6Н5, С=О, NH2 и др.
Ультрафиолетовая спектроскопия, называемая также электронной, несет информацию об электронном состоянии молекулы, она чувствительна к присутствию в веществе кратных связей и ароматических фрагментов. Анализ кристаллических веществ с помощью лучей рентгеновского диапазона (рентгеноструктурный анализ) дает объемную картину расположения атомов в молекуле, подобную тем, что показаны на приведенных выше анимированных рисунках, иными словами, позволяет как бы увидеть строение молекулы своими глазами.
Спектральный метод – ядерный магнитный резонанс, основанный на резонансном взаимодействии магнитных моментов ядер с внешним магнитным полем, дает возможность различить атомы одного элемента, например, водорода, расположенные в различных фрагментах молекулы (в углеводородном скелете, в гидроксильной, карбоксильной или аминогруппе), а также определить их количественное соотношение. Подобный анализ возможен также для ядер С, N, F и др. Все эти современные физические методы привели к интенсивным исследованиям в органической химии – стало возможным быстро решать те задачи, на которые ранее уходили долгие годы.
Некоторые разделы органической химии выделились в крупные самостоятельные области, например, химия природных веществ, лекарственных препаратов, красителей, химия полимеров. В середине 20 в. химия элементоорганических соединений стала развиваться как самостоятельная дисциплина, которая изучает вещества, содержащие связь С-Э, где символ Э обозначает любой элемент(кроме углерода, водорода, кислорода, азота и галогенов). Велики успехи биохимии, изучающей синтез и превращения органических веществ, происходящие в живых организмах. Развитие всех этих областей основано на общих законах органической химии.
Современный промышленный органический синтез включат в себя широкий набор различных процессов – это, прежде всего, крупнотоннажные производства – переработка нефти, газа и получение моторных топлив, растворителей, теплоносителей, смазочных масел, кроме того, синтез полимеров, синтетических волокон, разнообразных смол для покрытий, клеев и эмалей. К малотоннажным производствам относят получение лекарственных препаратов, витаминов, красителей, пищевых добавок и душистых веществ.
Михаил Левицкий
www.krugosvet.ru
