Что скрывается под символом : Mu?
 Мужчина в таблице Менделеева
Мужчина в таблице Менделеева Элемент: 116.
Название: Мужчина.
Символ: Mu
Первооткрыватель: Утроба элемента Fm.
Атомная масса: У удачных образцов несколько варьируется с элементом Fm, но при неправильном хранении, использовании или прокате может достигнуть 370 кг
Распространенность: В силу некоторой схожести элемента Mu с элементом Fm, встречаются изотопы, которые легко спутать с элементом Fm, посему истинная распространенность элемента M наукой до сих пор неизвестна.
ФИЗИЧЕСКИЕ СВОЙСТВА.
Вся физическая активность элемента Mu приближена к состоянию покоя. Моменты пика активности легко спутать с бездействием.
Когда в непосредственной близости с элементом М появляется элемент Fm, первый выходит из состояния покоя.
Внимание! Легко возбудим!
ХИМИЧЕСКИЕ СВОЙСТВА.
Наибольшей тайной элемента Мu является ограниченная вместимость h3O, но при этом вместимость C2H5OH приближается к отметке over 9000 (бесконечность) .
Часто поглощает C2H5OH. Есть недоказанная наукой теория, что элемент М питается исключительно от C2H5OH.
Периодически взаимодействует с изотопом Fm. Но подобное взаимодействие элементом Fm воспринимается отрицательно.
При правильном расположении элемента — выработка благородных металлов, купюр и акций достаточно высокая, при отсутствии или недостатке настоятельно рекомендуется поменять на более продуктивный.
ПРИМЕНЕНИЕ.
Широко применяется для переноски тяжестей, добычи пищи, приобретения недвижимости, ремонта механических и электронных приборов и конструкций. Можно использовать как механизм для удовлетворения сексуальных потребностей, предварительно детально проинструктировав. Незаменим для выноса мусора в холодное время года.
КАЧЕСТВЕННАЯ РЕАКЦИЯ.
При наличии поблизости высококачественного образца Fm, у элемента М начинается качественная реакция, заключенная в [вырезано цензурой] . При отсутствии поблизости качественных образцов Fm образует устойчивые и химически инертное соединение Mu-Mu-Mu, поглощающее большое количество этилового спирта.
МЕРЫ ПРЕДОСТОРОЖНОСТИ.
При попадании в неопытные руки представляет серьезную опасность. Запрещается иметь более одного образца. В случае взаимодействия в формуле Mu-Fm-Mu происходит превращение в роговитый изотоп, который возвращается в исходное состояние только при распаде соединения, сопровождаемой бурной взрывной реакцией, которая возникает при засвечивании соединения) 
С Праздником, дорогие наши, желаю что бы каждый нашёл себе достойное применение!!! 
otvet.mail.ru
Что такое химические элементы? Система и характеристика химических элементов
Очень много различных вещей и предметов, живых и неживых тел природы нас окружает. И все они имеют свой состав, строение, свойства. В живых существах протекают сложнейшие биохимические реакции, сопровождающие процессы жизнедеятельности. Неживые тела выполняют различные функции в природе и жизни биомассы и имеют сложный молекулярный и атомарный состав.
Но все вместе объекты планеты имеют общую особенность: они состоят из множества мельчайших структурных частиц, называемых атомами химических элементов. Настолько мелких, что невооруженным взглядом их не рассмотреть. Что такое химические элементы? Какими характеристиками они обладают и откуда стало известно об их существовании? Попробуем разобраться.

Понятие о химических элементах
В общепринятом понимании химические элементы – это лишь графическое отображение атомов. Частиц, из которых складывается все существующее во Вселенной. То есть на вопрос “что такое химические элементы” можно дать такой ответ. Это сложные маленькие структуры, совокупности всех изотопов атомов, объединенные общим названием, имеющие свое графическое обозначение (символ).
На сегодняшний день известно о 118 элементах, которые открыты как в естественных условиях, так и синтетически, путем осуществления ядерных реакций и радиоактивных распадов ядер других атомов. Каждый из них имеет набор характеристик, свое местоположение в общей системе, историю открытия и название, а также выполняет определенную роль в природе и жизни живых существ. Изучением этих особенностей занимается наука химия. Химические элементы – это основа для построения молекул, простых и сложных соединений, а следовательно, химических взаимодействий.
История открытия
Само понимание того, что такое химические элементы, пришло только в XVII веке благодаря работам Бойля. Именно он впервые заговорил об этом понятии и дал ему следующее определение. Это неделимые маленькие простые вещества, из которых складывается все вокруг, в том числе и все сложные.
До этой работы господствовали взгляды алхимиков, признававшим теорию четырех стихий – Эмпидокла и Аристотеля, а также открывших “горючие начала” (сера) и “металлические начала” (ртуть).
Практически весь XVIII век была распространена совершенно ошибочная теория флогистона. Однако уже в конце этого периода Антуан Лоран Лавуазье доказывает, что она несостоятельна. Он повторяет формулировку Бойля, но при этом дополняет ее первой попыткой систематизации всех известных на тот момент элементов, распределив их на четыре группы: металлы, радикалы, земли, неметаллы.
Следующий большой шаг в понимании того, что такое химические элементы, делает Дальтон. Ему принадлежит заслуга открытия атомной массы. На основе этого он распределяет часть известных химических элементов в порядке возрастания их атомной массы.
Стабильно интенсивное развитие науки и техники позволяет делать ряд открытий новых элементов в составе природных тел. Поэтому к 1869 году – времени великого творения Д. И. Менделеева – науке стало известно о существовании 63 элементов. Работа русского ученого стала первой полной и навсегда закрепившейся классификацией этих частиц.
Строение химических элементов на тот момент установлено не было. Считалось, что атом неделим, что это мельчайшая единица. С открытием явления радиоактивности было доказано, что он делится на структурные части. Практически каждый при этом существует в форме нескольких природных изотопов (аналогичных частиц, но с иным количеством структур нейтронов, от чего меняется атомная масса). Таким образом, к середине прошлого столетия удалось добиться порядка в определении понятия химического элемента.
Система химических элементов Менделеева
В основу ученый положил различие в атомной массе и сумел гениальным образом расположить все известные химические элементы в порядке ее возрастания. Однако вся глубина и гениальность его научного мышления и предвидения заключалась в том, что Менделеев оставил пустые места в своей системе, открытые ячейки для еще неизвестных элементов, которые, по мнению ученого, в будущем будут открыты.
И все получилось именно так, как он сказал. Химические элементы Менделеева с течением времени заполнили все пустые ячейки. Была открыта каждая предсказанная ученым структура. И теперь мы можем смело говорить о том, что система химических элементов представлена 118 единицами. Правда, три последних открытия пока еще официально не подтверждены.
Сама по себе система химических элементов отображается графически таблицей, в которой элементы располагаются согласно иерархичности их свойств, зарядам ядер и особенностям строения электронных оболочек их атомов. Так, имеются периоды (7 штук) – горизонтальные ряды, группы (8 штук) – вертикальные, подгруппы (главная и побочная в пределах каждой группы). Чаще всего отдельно в нижние слои таблицы выносятся два ряда семейств – лантаноиды и актиноиды.

Периодическая система Менделеева содержит всю необходимую информацию о химических элементах (порядковый номер, массовое число, название, иногда последние слои электронного строения).
Названия элементов
Право дать название предоставляется тому человеку, который совершил открытие данного химического элемента. Многие названы в честь планет (уран, плутоний, нептуний). Другим дали наименование в честь великих ученых (менделевий, резерфордий, коперниций и другие).
Часто элементы называют в честь городов и стран (рутений, германий, дубний, франций, европий и прочие). Посылом даже служат мифические герои (прометий). Также распространено явление, когда то или иное наименование дается по свойствам, проявляемым простыми и сложными веществами данного элемента (водород, кислород, углерод).

Названия записываются на латыни, но в нашей стране существует и русский их перевод с закрепившимися произношениями. Символом каждого элемента считается первая буква латинского слова либо первая и какая-либо из последующих. Пример: кальций (Са) – Calcium, бор (В) – Boron.
Характеристика атомов химических элементов
Каждый представитель периодической системы имеет свои особенности как в строении, так и в проявляемых свойствах. Характеристика химического элемента складывается из разбора состава его ядра и электронных слоев, а также из определения простого вещества, им образуемого, и сложных соединений.
Состав ядра атомов химических элементов включает несколько частиц – нуклонов:
- протоны, определяющие его положительный заряд (р+1), а также часть атомной массы;
- нейтроны, влияющие на массовое число элемента и не имеющие заряда (n0).
Еще один вид частиц – электроны. Они движутся вокруг ядра и имеют отрицательный заряд (е-1). Ориентация их не хаотичная, а строго упорядоченная. Они располагаются на орбиталях (s, p, d и f), которые формируют подуровни и уровни (электронные слои).
Атомная масса элемента складывается из протонов и нейтронов, совокупность которым имеет название “массовое число”. Количество протонов определяется очень просто – оно равно порядковому номеру элемента в системе. А так как атом в целом – система электронейтральная, то есть не имеющая вообще никакого заряда, то количество отрицательных электронов всегда равно количеству положительных частиц протонов.
Таким образом, характеристика химического элемента может быть дана по его положению в периодической системе. Ведь в ячейке описано практически все: порядковый номер, а значит, электроны и протоны, атомная масса (усредненное значение всех существующих изотопов данного элемента). Видно, в каком периоде находится структура (значит, на стольких слоях будут располагаться электроны). Также можно предсказать количество отрицательных частиц на последнем энергетическом уровне для элементов главных подгрупп – оно равно номеру группы, в которой располагается элемент.

Количество нейтронов можно рассчитать, если вычесть из массового числа протоны, то есть порядковый номер. Таким образом, можно получить и составить целую электронно-графическую формулу для каждого химического элемента, которая будет в точности отражать его строение и показывать возможные степени окисления и проявляемые свойства.
Распространение элементов в природе
Изучением этого вопроса занимается целая наука – космохимия. Данные показывают, что распределение элементов по нашей планете повторяет такие же закономерности во Вселенной. Главным источником ядер легких, тяжелых и средних атомов являются ядерные реакции, происходящие в недрах звезд – нуклеосинтез. Благодаря этим процессам Вселенная и космическое пространство снабдили нашу планету всеми имеющимися химическими элементами.
Всего из известных 118 представителей в естественных природных источниках людьми были обнаружены 89. Это основополагающие, самые распространенные атомы. Химические элементы также были синтезированы искусственно, путем бомбардировки ядер нейтронами (нуклеосинтез в лабораторных условиях).

Самыми многочисленными считаются простые вещества таких элементов, как азот, кислород, водород. Углерод входит в состав всех органических веществ, а значит, также занимает лидирующие позиции.
Классификация по электронному строению атомов
Одна из самых распространенных классификаций всех химических элементов системы – это распределение их на основе электронного строения. По тому, сколько энергетических уровней входит в состав оболочки атома и который из них содержит последние валентные электроны, можно выделить четыре группы элементов.
S-элементы
Это такие, у которых последней заполняется s-орбиталь. К этому семейству относятся элементы первой группы главной подгруппы (или щелочные металлы). Всего один электрон на внешнем уровне определяет схожие свойства этих представителей как сильных восстановителей.
Р-элементы
Всего 30 штук. Валентные электроны располагаются на р-подуровне. Это элементы, формирующие главные подгруппы с третьей по восьмую группу, относящиеся к 3,4,5,6 периодам. Среди них по свойствам встречаются как металлы, так и типичные неметаллические элементы.
d-элементы и f-элементы
Это переходные металлы с 4 по 7 большой период. Всего 32 элемента. Простые вещества могут проявлять как кислотные, так и основные свойства (окислительные и восстановительные). Также амфотерные, то есть двойственные.
К f-семейству относятся лантаноиды и актиноиды, у которых последние электроны располагаются на f-орбиталях.
Вещества, образуемые элементами: простые
Также все классы химических элементов способны существовать в виде простых или сложных соединений. Так, простыми принято считать такие, которые образованы из одной и той же структуры в разном количестве. Например, О2 – кислород или дикислород, а О3 – озон. Такое явление носит название аллотропии.

Простые химические элементы, формирующие одноименные соединения, характерны для каждого представителя периодической системы. Но не все они одинаковы по проявляемым свойствам. Так, существуют простые вещества металлы и неметаллы. Первые образуют главные подгруппы с 1-3 группу и все побочные подгруппы в таблице. Неметаллы же формируют главные подгруппы 4-7 групп. В восьмую основную входят особые элементы – благородные или инертные газы.
Среди всех открытых на сегодня простых элементов известны при обычных условиях 11 газов, 2 жидких вещества (бром и ртуть), все остальные – твердые.
Сложные соединения
К таковым принято относить все, которые состоят из двух и более химических элементов. Примеров масса, ведь химических соединений известно более 2 миллионов! Это соли, оксиды, основания и кислоты, сложные комплексные соединения, все органические вещества.
fb.ru
элемент — Малый академический словарь
элеме́нт
-а, м.
1.
У древнегреческих философов-материалистов — одно из первоначал, одна из составных частей природы
(огонь, вода, воздух, земля), лежащих в основе всех вещей, явлений; стихия.
2. мн. ч. (элементы, -ов).
Основы, начала чего-л.
— Я обучался элементам наук и древних языков в архангельской школе. Лажечников, Ледяной дом.
3. хим.
Простое вещество, не разложимое химическими методами на составные части, являющееся составной частью других сложных веществ.
Периодическая система элементов.
□
В земле распространены больше всего легкие элементы; пять из них — кислород, кремний, алюминий, железо и кальций — составляют 90,03% земной коры. Ферсман, Занимательная геохимия.
4.
Составная часть какого-л. целого.
[Воропаев] стал развивать свою мысль о том, что такое культура и из каких элементов она состоит. Павленко, Чья-то жизнь.
Всякая песня состоит из двух элементов — из слов и музыки, слитых между собою воедино. Исаковский, О поэтическом мастерстве.
|| спец.
Деталь какого-л. сооружения, устройства, механизма.
||
Доля чего-л. в чем-л., отдельная сторона, придающая чему-л. характерные особенности.
Сновидение было не фантастическое, без малейших каких-либо черт сказочного, неправдоподобного или таинственного элемента. Гл. Успенский, Без определенных занятий.
Устраните из жизни простеца элемент бессознательности, и вы увидите перед собою человека, отданного в жертву непрерывному ужасу.
5. собир. или мн. ч. (элементы, -ов) с определением.
Представители какой-л. общественной среды.
Прогрессивные элементы общества.
□
В центре Парижа, в стороне от многолюдных больших бульваров, есть узенькая улица XV века «Улица Венеции». — Эта отвратительная щель населена теми, кого на языке науки называют деклассированным элементом. А. Н. Толстой, Убийство Антуана Риво.
Семиреченская крестьянская армия вообще не имела в среде своей пролетарских элементов, в ней был преимущественно крестьянин-середняк.
6. с определением. разг.
Человек, личность.
План [строительных работ] сильно сократили и утвердили после долгих споров, во время которых Василий — Матвеича назвал «отсталым элементом». Николаева, Жатва.
||
О скверном или вредном человеке.
— Не распинайся! И так известно, что ты за элемент. Федин, Необыкновенное лето.
7.
Прибор, являющийся маломощным источником электрического тока, создаваемого за счет химической энергии.
Гальванический элемент. Сухой элемент.
◊
@ женский элемент
женщины.
В особенности замечательно в нем [городе С.] преобладание женского элемента над мужским. Салтыков-Щедрин, Губернские очерки.
@ мужской элемент
мужчины.
@
[От лат. elementum — стихия, первоначальное вещество]
Источник: Малый академический словарь на Gufo.megufo.me
Урок 1. Атомы и химические элементы – HIMI4KA
В уроке 1 «Атомы и химические элементы» из курса «Химия для чайников» рассмотрим, кто и когда высказал идею о том, что все вокруг состоит из атомов; также выясним, что из себя представляет химический элемент и каким образом обозначается.

Все, что нас окружает, мы сами, Земля, на которой мы живем, состоит из самых разнообразных веществ. А из чего состоят сами вещества? Ведь их можно дробить на более мелкие части, а те, в свою очередь, на еще более мелкие. Где предел такого деления? Что представляют собой частицы, которые дальше уже нельзя раздробить обычными способами? Над этими вопросами задумывались ученые еще в глубокой древности.
Атомное строение веществ
Первые представления об атомах как мельчайших, далее неделимых частицах веществ появились у философов Древней Греции еще за 400 лет до н. э. Они считали, что каждое вещество составлено из присущих только ему атомов, т. е. существуют атомы, например, мяса, песка, дерева, воды и т. д. Другими словами, сколько есть веществ, столько и видов атомов.
Доказательств существования атомов в то время, конечно, не было, и это учение было забыто почти на две тысячи лет. И только в самом начале XIX в. идея атомного строения веществ была возрождена английским ученым Дж. Дальтоном.
Согласно его теории все вещества состоят из очень маленьких частиц — атомов. В процессе химических превращений атомы не разрушаются и не возникают вновь, а только переходят из одних веществ в другие. Они являются как бы деталями конструктора, из которых можно собирать всевозможные изделия.
Атомы — мельчайшие, химически неделимые частицы.
Химические элементы
Общее число атомов во Вселенной невообразимо велико. Однако видов атомов сравнительно немного. Каждый такой определенный вид атомов называется химическим элементом.
Химический элемент — определенный вид атомов.
Позже, после изучения строения атома, вы узнаете более точное определение этого понятия.
Всего в настоящее время известно 118 химических элементов. Атомы одного и того же элемента имеют одинаковые размеры, практически одинаковое строение и массу. Атомы разных элементов различаются между собой, прежде всего, строением, размерами, массой и целым рядом других характеристик.
На заметку: Из 118 химических элементов в природе встречается только 92, а остальные 26 получены искусственно с помощью специальных физических методов.
Из атомов такого небольшого числа химических элементов построены все вещества, существующие в природе и полученные химиками в лабораториях. А это более 60 млн веществ. Все они представляют собой самые различные сочетания атомов тех или иных элементов. Так же, как из 33 букв алфавита составлены все слова русского языка, из атомов относительно небольшого числа элементов состоят все известные вещества.
Символы химических элементов
Каждый элемент имеет свое название и условное обозначение — химический символ (знак).
Химический символ (знак) — условное обозначение химического элемента с помощью букв его латинского названия.
Символы химических элементов состоят из одной или двух букв их латинских названий. Понятно, что вторая буква нужна, чтобы различать элементы, в названиях которых первая буква одинакова. Например, элемент углерод обозначается первой буквой С его латинского названия — Carboneum (карбонеум), а элемент медь — двумя первыми буквами Cu его латинского названия — Cuprum (купрум).
Современные символы и названия наиболее распространенных элементов, необходимые вам на начальном этапе изучения химии, приведены в таблице под спойлером.
Спойлер
| Название химического элемента | Химический знак элемента | Относительная атомная масса (округленная) |
| Азот | N | 14 |
| Алюминий | Al | 27 |
| Водород | H | 1 |
| Железо | Fe | 56 |
| Золото | Au | 197 |
| Калий | K | 39 |
| Кальций | Ca | 40 |
| Кислород | O | 16 |
| Кремний | Si | 28 |
| Магний | Mg | 24 |
| Медь | Cu | 64 |
| Натрий | Na | 23 |
| Ртуть | Hg | 201 |
| Свинец | Pb | 207 |
| Сера | S | 32 |
| Серебро | Ag | 108 |
| Углерод | C | 12 |
| Фосфор | P | 31 |
| Хлор | Cl | 35,5 |
| Цинк | Zn | 65 |
[свернуть]
Если вы хотите познакомиться с названиями и символами всех химических элементов, загляните сюда. Там представлена периодическая система элементов, о которой вы узнаете позже.
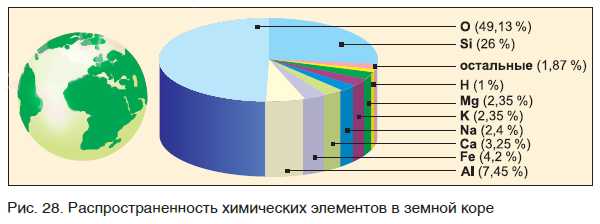
Распространенность химических элементов в природе крайне неравномерна. Самый распространенный элемент в земной коре (слое толщиной 16 км) — кислород О. Его содержание составляет 49,13 % от общего числа атомов всех элементов. Доли остальных элементов показаны на рис. 28.
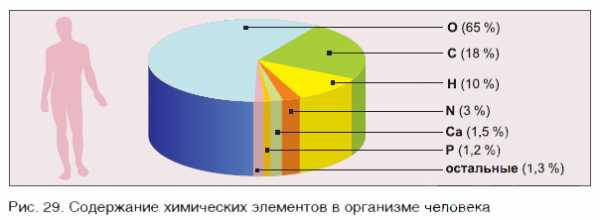
В организме человека на долю атомов кислорода приходится 65 % от массы тела, в то время как доля атомов углерода — 18 %, водорода — 10 %, азота — 3 % (см. рис. 29).
Во всей нашей Галактике почти 92 % от общего числа всех атомов приходится на долю водорода Н, 7,9 % — на долю гелия He и только 0,10 % — на атомы всех остальных элементов. Именно эти два самых легких элемента составляют основу звездной материи.
Краткие выводы урока:
- Атомы — мельчайшие, химически неделимые частицы.
- При химических реакциях атомы не исчезают и не возникают из ничего, а только переходят из одних веществ в другие.
- Каждый отдельный вид атомов называется химическим элементом. Он имеет свое название и обозначение — химический символ (знак).
- Атомы разных химических элементов различаются массой, размерами и строением.
Надеюсь урок 1 «Атомы и химические элементы» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
Химический элемент – это… Что такое Химический элемент?
Химический элемент — совокупность атомов с одинаковым зарядом ядра и числом протонов, совпадающим с порядковым (атомным) номером в таблице Менделеева
Формой существования химических элементов в свободном виде являются простые вещества (одноэлементные)[3]
История становления понятия
Слово «элемент» (лат. elementum) использовалось еще в античности (Цицероном, Овидием, Горацием) как часть чего-то (элемент речи, элемент образования и т. п.). В древности было распространено изречение «Как слова состоят из букв, так и тела — из элементов». Отсюда — вероятное происхождение этого слова: по названию ряда согласных букв в латинском алфавите: l, m, n, t («el» — «em» — «en» — «tum»).
Близкое к современному пониманию понятие химического элемента отражала новая система химической философии, изложенная Робертом Бойлем в книге «Химик-скептик» (1661). Бойль указал, что ни четыре стихии Аристотеля, ни три принципа алхимиков не могут быть признаны в качестве элементов. Элементы, согласно Бойлю — практически неразложимые тела (вещества), состоящие из сходных однородных (состоящих из первоматерии) корпускул, из которых составлены все сложные тела и на которые они могут быть разложены. Корпускулы могут различаться формой, размером, массой. Корпускулы, из которых образованы тела, остаются неизменными при превращениях последних[5].
В 1789 г. Антуан Лоран Лавуазье в «Элементарном курсе химии», приводит первый в истории новой химии список химических элементов (таблицу простых тел), разделённых на несколько типов. Он впервые отождествляет с химическими элементами ряд простых веществ (в их числе, кислород, азот, водород, сера, фосфор, уголь и все известые к тому времени металлы). В число элементов были включены свет, теплород и «
Благодаря Джону Дальтону в начале XIX в. в химии возобладала атомно-молекулярная гипотеза, рассматривающая химический элемент как отдельный вид атомов и указывающая на природу простых и сложных веществ, как состоящих, соответственно, из атомов одного или различного видов. Дальтон же впервые указывает на атомный вес как важнейшее свойство элементов, определяющее его химическую природу. Благодаря усилиям Йенса Берцелиуса и его последователей были весьма точно определены атомные веса (атомные массы) известных элементов. Середина XIX в. ознаменовалась целым рядом открытий новых элементов. На международном съезде химиков в г. Карлсруэ в 1860 г. были приняты определения понятий молекулы и атома.
Ko времени открытия Периодического закона Д. И. Менделеевым (1869) было известно 63 элемента. Именно атомный вес был выделен им как свойство атомов, определяющее периодический характер изменения свойств химических элементов, а также образуемых ими простых и сложных веществ. Менделеев определял химические элементы как «материальные части простых или сложных тел, к-рые придают им известную совокупность физических и химических свойств». Oткрытие Mенделеева позволило предвидеть существование, a также свойства ряда неизвестных в то время элементов и послужило научной основой для их классификации.
Однако с открытием изотопов стало ясно, что различные совокупности атомов одного и того же элемента могут иметь различающиеся атомные массы; так, радиогенный гелий, выделенный из урановых минералов, в связи с преобладанием изотопа
Современное понимание химического элемента как совокупности атомов, характеризующихся одинаковым положительным зарядом ядра, равным номеру элемента в Периодической таблице, появилось благодаря фундаментальным работам Генри Мозли (1915) и Джеймса Чедвика (1920)[7].
Известные химические элементы
На середину 2012 года известно 118 химических элементов (с порядковыми номерами с 1 по 118), из них 94 обнаружены в природе (некоторые — лишь в следовых количествах), остальные 24 получены искусственно в результате ядерных реакций. Предпринимались попытки синтеза следующих сверхтяжёлых трансурановых элементов, в т.ч. были заявления о синтезе элемента унбиквадий (124) и косвенных свидетельствах о элементах унбинилий (120) и унбигексий (126), которые пока не подтверждены. Также было объявлено об обнаружении элемента экатория-унбибия (122) в образцах природного тория
Право предложить название новому химическому элементу предоставляется первооткрывателям. Сообщение о новом открытии проверяется в течение нескольких лет независимыми лабораториями, и, в случае подтверждения, Международный союз теоретической и прикладной химии (ИЮПАК, IUPAC, en:International Union for Pure and Applied Chemistry) официально утверждает название нового элемента.
Не все из известных на сегодня 118 элементов имеют утвержденные ИЮПАК постоянные названия. Самым тяжёлым из официально признанных элементов, имеющих официальные постоянные названия, является 116-й, получивший в мае 2012 года имя ливерморий вместе со 114-м элементом флеровием.
Названия сверхтяжёлых элементов с номерами 113, 115, 117, 118, полученные в 2002—2010 годах в России и США, официально пока не утверждены. Они имеют временные систематические названия.
Символы химических элементов
Символы химических элементов используются как сокращения для названия элементов. В качестве символа обычно берут начальную букву названия элемента и в случае необходимости добавляют следующую или одну из следующих. Обычно это начальные буквы латинских названий элементов: Cu — медь (cuprum), Ag — серебро (argentum), Fe — железо (ferrum), Au — золото (aurum), Hg — ртуть (hydrargirum). Такая система химических символов была предложена в 1811 г. шведским химиком Я. Берцелиусом.
Цифрами меньшего размера возле символа элемента обозначаются: слева вверху — атомная масса, слева внизу — порядковый номер, справа вверху — заряд иона, справа внизу — число атомов в молекуле[7]:
| атомная масса | заряд иона | |
| Символ элемента | ||
|---|---|---|
| порядковый номер | число атомов в молекуле |
Примеры:
Временные символы элементов состоят из трёх букв, представляющих аббревиатуру их атомного номера на латыни.
В Периодической таблице карточка химического элемента обычно включает следующие характеристики:
Распространённость химических элементов в природе
 Распространённость химических элементов в земной коре (% масс.) – кларковые числа
Распространённость химических элементов в земной коре (% масс.) – кларковые числаИз всех химических элементов в природе найдено 88; такие элементы, как технеций Tc (порядковый номер 43), прометий Pm (61), астат At (85) и франций Fr (87), а также все элементы, следующие за ураном U (порядковый номер 92), впервые получены искусственно. Некоторые из них в исчезающе малых количествах обнаружены в природе.
Из химических элементов наиболее распространены в земной коре кислород и кремний. Эти элементы вместе с элементами алюминий, железо, кальций, натрий, калий, магний, водород и титан составляют более 99 % массы земной оболочки, так что на остальные элементы приходится менее 1 %. В морской воде, помимо кислорода и водорода — составных частей самой воды, высокое содержание имеют такие элементы, как хлор, натрий, магний, сера, калий, бром и углерод. Массовое содержание элемента в земной коре называется кларковым числом или кларком элемента.
Содержание элементов в коре Земли отличается от содержания элементов в Земле, взятой как целое, поскольку химсоставы коры, мантии и ядра Земли различны. Так, ядро состоит в основном из железа и никеля. В свою очередь, содержания элементов в Солнечной системе и в целом во Вселенной также отличаются от земных. Наиболее распространённым элементом во Вселенной является водород, за ним идёт гелий. Исследование относительных распространённостей химических элементов и их изотопов в космосе является важным источником информации о процессах нуклеосинтеза и об эволюции Солнечной системы и небесных тел.
Классификация химических элементов
Химические элементы как составная часть химических веществ
Химические вещества могут состоять как из одного химического элемента (простое вещество), так и из разных (сложное вещество или химическое соединение).
Химические элементы образуют около 500 простых веществ[10]. Способность одного элемента существовать в виде различных простых веществ, отличающихся по свойствам, называется аллотропией.[10]
В обычных условиях 11 элементов существуют в виде газообразных простых веществ (H, He, N, O, F, Ne, Cl, Ar, Kr, Xe, Rn), 2 — жидкости (Br и Hg), остальные элементы образуют твёрдые тела.
См. также
Ссылки
Примечания
dic.academic.ru
Химический элемент — Циклопедия
Химические элементы // Мрия Урок Химия — просто. Урок 1 «ПСЭ»Химический элемент — совокупность атомов с одинаковым зарядом ядра. Носителем положительного заряда ядра являются протоны. Их число определяет величину заряда ядра, и следовательно, атомный (порядковый) номер химического элемента.
Близкое к современному определение химического элемента было дано Д. И. Менделеевым: «Под именем элементов должно подразумевать те материальные составные части простых и сложных тел, которые придают им известную совокупность физических и химических свойств. Если простому телу соответствует понятие о частице, то элементу отвечает понятие об атоме».
[править] Физические основы
Важной характеристикой ядра является массовое число А, которое равно общему числу нуклонов — протонов Z и нейтронов N входящих в ядро:
А = Z + N.
Масса ядра всегда меньше арифметической суммы масс протонов и нейтронов, входящих в его состав. Разность между этими величинами называют дефектом массы.
Согласно соотношению Эйнштейна дефект массы и энергия связи нуклонов в ядре эквивалентны:
- [math]\! \Delta E = \Delta m c^2 = {c^2}{\Delta}m[/math]
где [math]\Delta m[/math] — дефект массы и с — скорость света в вакууме.
Энергия связи нуклонов в ядре в миллионы раз превышает энергию химической связи. Поэтому при химических превращениях веществ атомные ядра не изменяются, и элементы остаются неизменными.
Для понимания физических основ устройства атомов элементов важно также знать законы квантовой механики.
Химическая природа элемента обусловливается способностью его атома терять и приобретать электроны. Эта способность может быть количественно оценена энергией ионизации атома и его сродством к электрону.
[править] Распространенность химических элементов
Распространенность элементов в космосе в целом уменьшается по убыванию атомного номера. Исторически все элементы возникли из водорода в результате ядерных реакций, и до сих пор Вселенная практически полностью состоит из водорода. Космическое вещество Солнечной системы состоит примерно на три четверти из водорода и гелия. Элементы с завершенными ядерными слоями («магические числа» 2, 8, 20, 28, 50, 82, 126: гелий-кислород-кальций-железо-сурьма-свинец) как правило играют большую роль в природе и чаще встречаются, чем окружающие их элементы. Распространенность элементов зависит от многих факторов, но в конечном счете определяется вероятностью ядерных реакций их образования и относительной устойчивостью отдельных изотопов.
Об образовании и превращении элементов см. также Ядерная реакция.
[править] Периодическая система элементов
[править] Элементы малых периодов
Об устройстве электронного облака см. также атомная орбиталь.
Первый период периодической системы состоит из двух элементов — водород и гелий. Электронная формула невозбужденного атома водорода 1s1. В соответствии с принципом Паули в одной орбитали могут находиться два электрона с противоположными спинами. Следовательно, электронная формула следующего после водорода элемента — гелия 1s2.
Второй и третий периоды содержат по 8 элементов. Во втором периоде заполняется второй квантовый слой, в третьем периоде — третий. У двух первых элементов (натрий и магний), заполняются s-орбитали, у шести последних (алюминий — аргон) заполняются p-орбитали. У последних элементов этих периодов — аргона и неона, завершается заполнение орбиталей.
[править] Элементы больших периодов
Четвертый и пятый периоды содержат по 18 элементов. У атомов элементов 4-го периода начинает заполняться 4s-орбиталь слоя N (n = 4). Появление электрона в 4s-состоянии при наличии свободных 3d-орбиталей обусловливается экранированием ядра плотным и симметричным электронным слоем 3s23p6. В связи с отталкиванием от этого слоя для 19-го электрона атома калия и 20-го электрона атома кальция оказывается энергетически выгодным 4s-состояние.
При дальнейшем возрастании заряда ядра у следующего после кальция элемента — скандия состояние 3d становится энергетически более выгодным, чем 4р.
Элементы, в атомах которых заполняются d-орбитали, называются d-элементами. У d-элементов 4-го периода, следовательно, достраивается слой М до 18 электронов.
После заполнения 3d-орбиталей у последующих шести элементов (Ga — Kr) заполняются р-орбитали внешнего слоя.
В пятом периоде заполнение электронных слоев и подслоев происходит, как и в четвертом периоде.
Шестой период содержит 32 элемента и тоже начинается двумя s-элементами (Cs и Ва). Далее, у лантана начинает заполняться d-орбиталь предвнешнего слоя (5d-подслой).
У следующих за лантаном 14 элементов (Се — Lu) энергетически более выгодно 4f-состояние по сравнению с 5d-состоянием. Поэтому у этих элементов происходит заполнение 4f-орбиталей, чем и объясняется существование лантаноидов.
Аналогичная ситуация в седьмом периоде: имеются два s-элемента (Fr, Ra), за ними следуют d-элемент Ас и четырнадцать f-элементов (Th — Lr)(актиноиды), далее снова d-элементы.
cyclowiki.org
