Взаимное влияние атомов в молекулах органических соединений
Лекции по органической химии для студентов педиатрического факультета
Цель: изучение электронного строения органических соединений и способов передачи взаимного влияния атомов в их молекулах.
План:
Индуктивный эффект
Виды сопряжения.
Ароматичность органических соединений
Мезомерный эффект (эффект сопряжения)
Индуктивный эффект
Молекула органического соединения представляет собой совокупность атомов, связанных в определённом порядке ковалентными связями. При этом связанные атомы могут различаться по величине электроотрицательности (Э.О.).
Чем больше величина Э.О. данного элемента, тем сильнее он притягивает электроны связи. Величины Э.О. были установлены американским химиком Л. Полингом и этот ряд называется шкалой Полинга.
Э. О. атома углерода зависит от состояния его гибридизации, т.к. атомы углерода, находящиеся в различных видах гибридизации отличаются друг от друга по Э. О. и это зависит от доли s-облака в данном виде гибридизации. Например, атом С в состоянии sp3-гибридизации обладает наименьшей Э.О. так как на долю р-облака приходится меньше всего s-облака. Большей Э.О. обладает атом С в sp- гибридизации.
Все атомы, составляющие молекулу находятся во взаимной связи друг с другом и испытывают взаимное влияние. Это влияние передаётся по ковалентным связям с помощью электронных эффектов.
Одним из свойств ковалентной связи является некоторая подвижность электронной плотности. Она способна смещаться в сторону атома с большей Э,О.
Наличие полярной связи в молекуле сказывается на состоянии соседних связей. Они испытывают влияние полярной связи, и их электронная плотность также смещается в сторону более Э.О. атома, т. е. происходит передача электронного эффекта.
Индуктивный эффект передаётся по цепи с затуханием, т. к. при образовании ϭ-связи выделяется большое количество энергии и она плохо поляризуется и поэтому индуктивный эффект проявляется в большей степени на одну две связи. Направление смещения электронной плотности всех ϭ-связей обозначают прямыми стрелками.→
Например: СH3δ+ < → CH2δ+< → CH2δ+< →Clδ– Э.О. Сl > Э.О. С
СH3δ+< → CH2δ+< → CH2δ+< →OHδ– Э.О. ОН > Э.О. С
Атом или группа атомов, смещающие электронную плотность ϭ-связи от атома углерода на себя называются электроноакцепторными заместителями и проявляют отрицательный индуктивный эффект
Ими являются галогены (Cl, Br, I), OH–, NH2–, COOH, COH, NO2, SO3H и др.
Атом или группа атомов, отдающие электронную плотность называются электронодонорными заместителями и проявляют положительный индуктивный эффект (+I-эффект).
+I-эффект проявляют алифатические углеводородные радикалы, СН3, С2Н5 и др.
Индуктивный
эффект проявляется и в случае, когда
связанные атомы углерода различны по
состоянию гибридизации. Например, в
молекуле пропена группа СН
пропен-1
studfiles.net
В помощь учителю и учащимся. Электронные эффекты.
Электронные эффекты – смещение электронной плотности в молекуле, ионе или радикале под влиянием заместителей. Заместителем считается любой атом (кроме водорода) или группа атомов, связанные с атомом углерода. Различают индуктивный (I) и мезомерный (Индуктивный эффект (I-эффект)
Известно, что полярная ковалентная связь образуется между атомами с различной электроотрицательностью. Наличие в молекуле полярной σ-связи вызывает поляризацию ближайших двух–трех σ-связей и ведет к возникновению частичных зарядов δ+ (дельта плюс) или δ– (дельта минус) на соседних атомах. Направление смещения электронной плотности всех σ-связей обозначается прямыми стрелками (по линии связи) и символами частичных зарядов, индуцируемых заместителем:
Таким образом, заместители (X или Y) вызывают поляризацию не только “своей”, но и соседних связей. Такой вид передачи влияния атомов, приводящий к поляризации ковалентных связей и индуцированию зарядов на атомах, называется индуктивным (индукционным) электронным эффектом.
Из-за слабой поляризуемости σ-связей I-эффект быстро затухает с удалением от заместителя и через 3-4 связи становится практически равным 0.
Индуктивный эффект называют отрицательным (–I), если заместитель уменьшает электронную плотность на атоме углерода, с которым связан этот заместитель. При этом заместитель приобретает частичный отрицательный заряд (δ-), а атом углерода – частичный положительный заряд (δ+).Индуктивный эффект называется положительным (+I), если заместитель увеличивает электронную плотность на атоме углерода, индуцируя на нем частичный отрицательный заряд δ-, сам при этом приобретая заряд δ+.
Направление (знак) I-эффекта заместителя качественно оценивается путем сравнения со стандартом — атомом водорода, индуктивный эффект которого принят за 0.
–I-эффект проявляют заместители, которые содержат более электроотрицательные атомы, чем атом углерода: +I-эффект проявляют заместители, содержащие атомы с низкой электроотрицательностью:
- -F, -Cl, -Br, -OH, -NH
- -Mg-, -Li; алифатические углеводородные радикалы (-CH3, -C2H5) и т.п.
- Мезомерный эффект – смещение электронной плотности по цепи делокализованных (сопряженных) π-связей.
Мезомерный эффект (М-эффект)
Этот эффект проявляют заместители, связанные с sp2– или sp-гибридизованным атомом. Благодаря подвижности π-электронов, М-эффект передается по цепи сопряжения без затухания.
+М-эффектом обладают заместители, повышающие электронную
плотность в сопряженной системе. К ним относятся группы, которые
содержат атомы с неподеленной парой электронов, способные к передаче
этой пары электронов в общую систему сопряжения. +
–М-эффект проявляют заместители с электроотрицательными атомами и смещающие электронную плотность на себя. –М-эффект характерен для групп -CH=O, -COOH, -NO2. Хотя эти группы имеют неподеленные электронные пары, пространственное расположение орбиталей с этими электронами не позволяет им вступать в систему сопряжения. Таким образом, в данном случае заместитель может лишь оттягивать электроны из общей системы сопряжения за счет своей более высокой электроотрицательности.
Для определения знака М-эффекта полезно строить атомно-орбитальные модели, отражающие пространственную ориентацию орбиталей и возможности их перекрывания. Например:
В этом примере π-орбиталь кратной связи C=O и sp2-орбитали с неподеленными парами электронов атома кислорода расположены перпендикулярно друг другу, т.е. их перекрывание невозможно и ни одна электронная пара кислорода не может передаваться в π-систему. Следовательно, группа C=O проявляет не +М-, а –М-эффект.
Направление смещения электронной плотности под влиянием
| Химия: индуктивный и мезомерный эффекты | ||||
| Заместитель | Индуктивный эффект | Мезомерный эффект | Совместное действие | |
| Алкильные группы (R) | +I | – | Элекронодонорный | |
| -O– | +I | +M | Элекронодонорный | |
| -NH2, -NHR, -NR2 | -I | +M | Элекронодонорный | |
| -OH, -OR | -I | +M | Элекронодонорный | |
| -NH3+ -NR3+ | -I | – | Элекронодонорный | |
| Галогены (F, Cl, Br, I) | -I | +M | Элекроноакцепторный | |
| >C=O | -I | -M | Элекроноакцепторный | |
| -COOH, -COOR | -I | -M | Элекроноакцепторный | |
| -NO2 | -I | -M | Элекроноакцепторный | |
| -C≡N | -I | -M | Элекроноакцепторный | |
| -SO3H | -I | -M | Элекроноакцепторный | |
himoza1977.blogspot.com
Взаимное влияние атомов в молекулах органических соединений » HimEge.ru
Реакционная способность органических соединений определяется
– смещением электронной плотности в простых связях;
– смещением электронной плотности в кратных связях.
Электронные эффекты — смещение электронной плотности в молекуле, ионе или радикале под влиянием заместителей. Заместителем считается любой атом (кроме водорода) или группа атомов, связанные с атомом углерода.
Различают индуктивный (I) и мезомерный (M) эффекты заместителей.
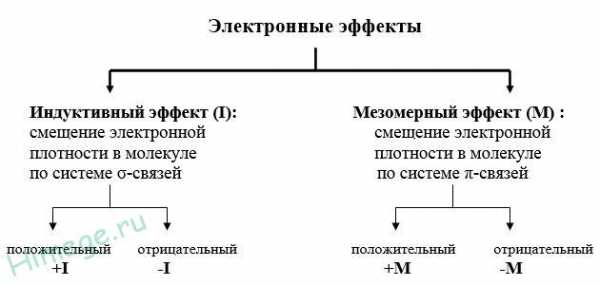
Заместители А, вызывающие отрицательный индуктивный эффект, являются электроноакцепторами: -NO2, -CN, -COOH, -F, — Cl, -Br, -I, -COOR, -COR, -OR, -OH, -NH2, -Ar
Заместители B, вызывающие положительный индуктивный эффект, являются электронодонорами: — CR3, -CHR2, -CH2R, -CH3
- Индуктивный эффект проявляется всегда при наличии в молекуле атомов с различной электроотрицательностью.
- Индуктивный эффект распространяется только через σ-связи и всегда в одном направлении.
- Индуктивный эффект затухает в цепи через 3 – 4 σ-связи.
Пример влияния индуктивного эффекта на направление химической реакции — присоединение галогенводородов к алкенам по правилу Марковникова и против правила Марковникова.
Мезомерный эффект действует в сопряженных системах.
Сопряженная система состоит из чередующихся простых и кратных связей. В сопряжение также может вступать атом с неподеленной парой р-электронов или атом с вакантной р-орбиталью.
Мезомерный эффект проявляется лишь в том случае, когда заместитель включен в сопряженную систему молекулы.
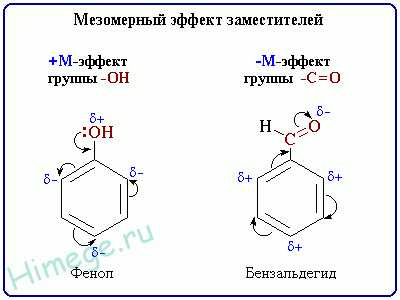
Заместители А, вызывающие отрицательный мезомерный эффект:
-NO2, -CN, -COOH, -COOR, — CONH2.
Заместители В, вызывающие положительный мезомерный эффект:
-NH2, -OH, -F, -Cl, -Br.
himege.ru
Индуктивный (индукционный) и мезомерный эффекты
⇐ ПредыдущаяСтр 13 из 199Следующая ⇒
Одним из положений теории А.М. Бутлерова является взаимное влияние атомов друг на друга, как непосредственно связанных между собой, так и связанных опосредованно.
Индуктивный (индукционный) эффект – это эффект, вызванный влиянием атомов в молекуле за счёт смещения электронной плотности по σ – связи. Обозначается Iэф..
С понятием индуктивного эффекта тесно связано понятие электроотрицательности атомов и дипольного момента.
В молекулах, подобных СН4, СCl4 и др., все связи равноценны и, следовательно, распределение электронной плотности симметрично. В молекуле СН3Cl в ковалентной связи С – Cl электронная плотность смещена к более электроотрицательному атому хлора, в результате чего создаётся электрический диполь с частичным отрицательным зарядом на атоме хлора (δ-) и с частичным положительным зарядом на атоме углерода (δ+): δ+δ-
СН3 → Сl
В сложной молекуле, например, хлористом пропиле поляризация связи С – Сl оказывает влияние на состояние соседних связей. Дипольный момент, возникший здесь, индуцирует другие дипольные моменты на соседних связях, но значительно меньшие по величине, то есть с удлинением углеродной цепочки индуктивный эффект затухает и, как правило, через три – четыре связи исчезает:
δ+++ δ++ δ+ δ-
СН3 → СН2 → СН2 → Сl
Атомы и группы атомов могут вызывать различное смещение электрических центров валентных электронов.
Различают группы, вызывающие положительный индуктивный эффект (+I) и отрицательный индуктивный эффект (-I). Принято, что индуктивный эффект атома водорода равен нулю.
Атомные группировки и атомы, отталкивающие от себя электронную плотность и обогащающие ею соседние атомы, проявляют (+I). Это:
1) алкильные группы, причём (+I) уменьшается в ряду:
(СН3)3С > (СН3)2СН > СН3СН2 > СН3 > Н;
2) элементы, менее электроотрицательные, чем углерод, например, щелочные металлы:
К > Na > Li;
3) группы с полным отрицательным зарядом:
С— > N— > O—
Например, этилат – анион: СН3 ← СН2 ← O—(+I).
Положительный индуктивный эффект больше у элементов, которые расположены в периодической системе левее и ниже.
Атомы и группы атомов, которые притягивают к себе электронную плотность от соседних атомов, обладают отрицательным индуктивным эффектом. Чем выше и правее в таблице Д.И. Менделеева расположены элементы, тем ярче проявляется отрицательный индуктивный эффект (-I):
1) F > O > N;
2) F > Cl > Br;
3) NO2 > C = O > F > Cl > Br > OH > H;
O – R
4) (–I) проявляют группы с полным положительным зарядом на элементе, связанном с атомом углерода:
С → О+, С → N+, C → S+, C → P+;
5) (–I) обнаруживают группы с семиполярной связью и группы с кратными связями:
С → N+ – О—, → С = О, →С = NR и др.;
О
6) в случае сложных нейтральных заместителей (–I) зависит от природы атомов, составляющих заместитель. Например, (–I) атома кислорода возрастает, если он связан с группой, обладающей своим (–I):
– ОСОСН3 > – OH > – OСН3;
7) (–I) – эффект зависит от характера гибридизации атома углерода. Например, электроотрицательность атома углерода повышается при увеличении s – характера его орбиталей:
sp > sp2 > sp3
(½ s) ( 1/3 s) (¼ s)
Группы, обладающие различным Iэф., влияют на химические свойства веществ, например, сила кислот уменьшается в ряду:
СН2 ← СOOH > СН2 ← СН2 ← СOOH > СН2←СН2←СН2←COOH,
Сl Cl Cl
что объясняется уменьшением силы индуктивного эффекта атома хлора на подвижность атома водорода карбоксильной группы.
Или другой пример, Iэф., влияет на реакционную способность карбонильных соединений, а именно:
О O O
Н – С > CH3 → C > CH3 → C ←СН3
δ+ Н δ+ H δ+
Частично положительный заряд (δ+) самый большой у муравьиного альдегида, так как индуктивный эффект водорода равен нулю. У уксусного альдегида (δ+) меньше вследствие (+I) метильной группы, который гасит (δ+) карбонильного углерода с одной стороны. Наименьшей активностью обладает ацетон, у которого (δ+) карбонильного углерода гасится метильными группами с обеих сторон; а чем больше (δ+) карбонильного углерода, тем активнее соединение.
Помимо индуктивного эффекта σ – связи существует индуктивный эффект π – связи. Этот эффект проявляется тогда, когда полярный заместитель «X» находится при кратной связи и поляризует соседний углеродный атом, создавая на нём частичный заряд. Он отличается от (I σ) тем, что (I π) – эффект затухает медленнее и вызывает альтернирующее (чередующееся) по знаку и величине изменение заряда на атомах. Направление (I σ) – и (I π) – эффектов часто противоположно. (I π) – Эффект рассматривается как часть мезомерного эффекта:
X X
δ—δ+
δ+δ—
δ+δδ—δ—δ δ+
mykonspekts.ru
Взаимное влияние атомов в молекулах органических соединений
Лекции по органической химии для студентов педиатрического факультета
Цель: изучение электронного строения органических соединений и способов передачи взаимного влияния атомов в их молекулах.
План:
Индуктивный эффект
Виды сопряжения.
Ароматичность органических соединений
Мезомерный эффект (эффект сопряжения)
Индуктивный эффект
Молекула органического соединения представляет собой совокупность атомов, связанных в определённом порядке ковалентными связями. При этом связанные атомы могут различаться по величине электроотрицательности (Э.О.).
Чем больше величина Э.О. данного элемента, тем сильнее он притягивает электроны связи. Величины Э.О. были установлены американским химиком Л. Полингом и этот ряд называется шкалой Полинга.
Э. О. атома углерода зависит от состояния его гибридизации, т.к. атомы углерода, находящиеся в различных видах гибридизации отличаются друг от друга по Э. О. и это зависит от доли s-облака в данном виде гибридизации. Например, атом С в состоянии sp3-гибридизации обладает наименьшей Э.О. так как на долю р-облака приходится меньше всего s-облака. Большей Э.О. обладает атом С в sp- гибридизации.
Все атомы, составляющие молекулу находятся во взаимной связи друг с другом и испытывают взаимное влияние. Это влияние передаётся по ковалентным связям с помощью электронных эффектов.
Одним из свойств ковалентной связи является некоторая подвижность электронной плотности. Она способна смещаться в сторону атома с большей Э,О.
Наличие полярной связи в молекуле сказывается на состоянии соседних связей. Они испытывают влияние полярной связи, и их электронная плотность также смещается в сторону более Э.О. атома, т. е. происходит передача электронного эффекта.
Индуктивный эффект передаётся по цепи с затуханием, т. к. при образовании ϭ-связи выделяется большое количество энергии и она плохо поляризуется и поэтому индуктивный эффект проявляется в большей степени на одну две связи. Направление смещения электронной плотности всех σ-связей обозначают прямыми стрелками.→
Например: СH3δ+ < → CH2δ+< → CH2δ+< →Clδ– Э.О. Сl > Э.О. С
СH3δ+< → CH2δ+< → CH2δ+< →OHδ– Э.О. ОН > Э.О. С
Атом или группа атомов, смещающие электронную плотность ϭ-связи от атома углерода на себя называются электроноакцепторными заместителями и проявляют отрицательный индуктивный эффект (-I-эффект).
Ими являются галогены (Cl, Br, I), OH–, NH2–, COOH, COH, NO2, SO3H и др.
Атом или группа атомов, отдающие электронную плотность называются электронодонорными заместителями и проявляют положительный индуктивный эффект (+I-эффект).
+I-эффект проявляют алифатические углеводородные радикалы, СН3, С2Н5 и др.
Индуктивный эффект проявляется и в случае, когда связанные атомы углерода различны по состоянию гибридизации. Например, в молекуле пропена группа СН3 проявляет +I-эффект, так как атом углерода в ней находится в sp3-гибридном состоянии, а атомы углерода при двойной связи в sp2-гибридном состоянии и проявляют большую электроотрицательность, поэтому проявляют -I-эффект и являются электроноакцепторами.
пропен-1
studfiles.net
Ароматичность
Это понятие, включающее различные свойства ароматических соединений ввёл немецкий физик Э. Хюккель (1931).
Условия ароматичности:
плоский замкнутый цикл
все атомы С находятся в sp2 – гибридизации
образуется единая сопряженная система всех атомов цикла
выполняется правило Хюккеля: “В сопряжении участвуют 4n+2 -электронов, где n = 1, 2, 3…”
Простейший представитель ароматических углеводородов – бензол. Он удовлетворяет всем четырем условиям ароматичности.
Правило Хюккеля: 4n+2 = 6, n = 1.
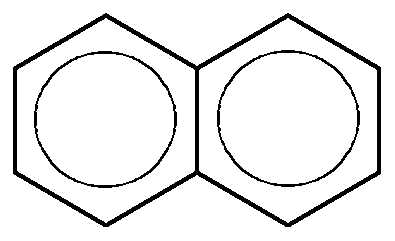
Нафталин | Нафталин – ароматическое соединение Правило Хюккеля: 4n+2 = 10, n = 2. |
Пиридин | Пиридин – ароматическое гетероциклическое соединение. |
Мезомерный эффект
В отличие от несопряженных в которых электронное влияние заместителей передается по ϭ-связям (индуктивный эффект), в сопряженных системах в передаче электронного влияния основную роль играют π-электроны делокализованных ковалентных связей. Эффект, проявляющийся в смещении электронной плотности делокализованной (сопряженной) π-системы, называют эффектом сопряжения или мезомерным эффектом.
При этом заместитель становится частью сопряженной системы. Он может вносить в систему сопряжения π-связь (карбонильная, карбоксильная, нитро группа, сульфогруппа и др.), неподелённую пару электронов гетероатома (галогены, амино-, гидроксильную группы), вакантную или заполненную одним или двумя электронами р-орбиталей. Обозначается буквой М и изогнутой стрелкой Мезомерный эффект может быть «+» или «–».
Заместители, повышающие электронную плотность в сопряженной системе, проявляют положительный мезомерный эффект. Они содержат атомы с неподеленной электронной парой или отрицательным зарядом и способны к передаче своих электронов в общую сопряженную систему, т. е. являютсяэлектронодонорами.(ЭД). Они направляют реакции SEв положения 2,4,6 и называются ориентантами I рода
Примеры ЭД:
Фенол | р, -сопряжение Гидроксильная группа –ОН проявляет +М. |
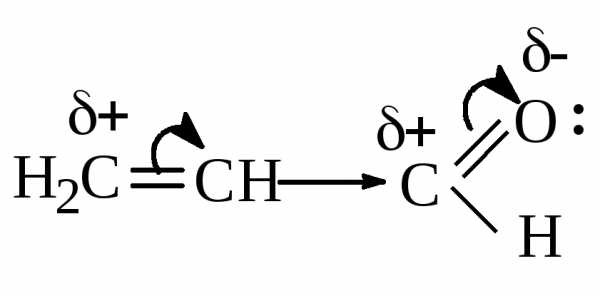
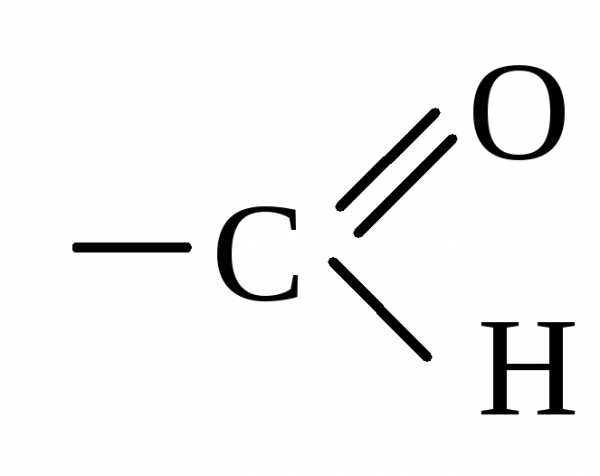
Заместитель, притягивающий электроны из сопряженной системы, проявляет –М и наз-сяэлектроноакцептором (ЭА). Это заместители, имеющие двойную связь
Акролеин | Альдегидная группа проявляет – М. |
бензальдегид
Таблица 1 Электронные эффекты заместителей
Заместители | Ориентанты в С6Н5–R | I | М |
Аlk (R-): СН3-, С2Н5-… | Ориентанты I рода: направляют ЭД заместители в орто- и пара- положения | + | |
– | – | + | |
– | – | + | |
–Н | – | + | |
ЭА | Ориентанты II рода: направляют заместители в мета- положения | – | – |
Рекомендуемая литература
Основная
1. Лузин А. П., Зурабян С. Э., Н. А. Тюкавкина, Органическая химия (учебник для учащихся средних фармацевтическх и медицинских заведений), 2002 г. С.42-46, 124-128.
Дополнительная
Егоров А. С., Шацкая К. П. Химия. Пособие – репититор для поступающих в вузы
Кузьменко Н. Е., Еремин В. В., Попков В. А. Начала химии М., 1998. С. 57-61.
Райл С. А., Смит К., Уорд Р. Основы органической химии для студентов биологических и медицинских специальностей М.: Мир, 1983.
4. Лекции преподавателей.
6
studfiles.net
5. Электронные эффекты в органических молекулах
Все атомы, составляющие органическую молекулу, находятся во взаимосвязи и испытывают взаимное влияние. Это влияние передается в основном через систему ковалентных связей с помощью электронных эффектов.
Электронный эффект – смещение электронной плотности в молекуле под влиянием отдельных атомов или групп атомов.
Смещение электронов, приводящее к поляризации связи, определяется разностью электроотрицательностей атомов, образующих химическую связь. Атомы, связанные полярной связью, несут частичные заряды:
| δ+ δ−
—C → Cl (χC = 2,5; χCl = 3,0)
|
Смещение электронной плотности по цепи σ-связей называется индуктивным эффектом и обозначается I. Индуктивный эффект передается по цепи с затуханием, что объясняется малой подвижностью электронов σ-связи:
δ//+ δ/+ δ+ δ−
CH3 → CH2 → CH2 → Cl δ+ >> δ/+ >> δ//+
В зависимости от того, удаляется ли электронная плотность от рассматриваемого атома углерода или приближается к нему, индуктивный эффект называют отрицательным (−I) или положительным (+I).
Электроноакцепторные заместители, смещающие электронную плотность σ-связи от атома углерода к себе, проявляют отрицательный индуктивный эффект (−I): галогены, NH2, OH, >C=O, COOH и др.
Электронодонорные заместители, смещающие электронную плотность к атому углерода от себя, проявляют положительный индуктивный эффект (+I): атомы металлов, углеводородные радикалы.
Индуктивный эффект проявляется и в случае, когда связанные между собой атомы углерода различаются по типу гибридизации:
δ+ δ−
H3C → CH = CH2
Мезомерным эффектом, или эффектом сопряжения, называется перераспределение электронной плотности, происходящее с участием негибридных p-орбиталей. Мезомерный эффект (M) осуществляется как через систему π-связей (например, в бутадиене-1,3), так и через участие гетероатомов с неподеленными электронными парами (O, N, S):
..
CH2=CH−CH=CH2 CH2=CH−O−CH=CH2
π−π – сопряжение p−π − сопряжение
Мезомерный эффект, как и индуктивный, может быть как отрицательным, так и положительным. Благодаря большей подвижности электронов π-связи M-эффект практически не ослабевает при передаче по сопряженной цепи. По этой причине |M| > | I |.
Особенности органических реакций
Реакции органических соединений в принципе подчиняются тем же законам, что и реакции неорганических веществ, хотя и имеют некоторые специфические особенности.
В неорганических реакциях обычно участвуют ионы; реакции протекают быстро (10−10 – 10−7 с) при достаточно низких температурах. В реакциях органических соединений участвуют молекулы, при этом разрываются одни малополярные ковалентные связи и образуются другие. Органические реакции протекают медленнее ионных, часто для их осуществления необходимы повышенные температуры, давление, катализаторы.
Органические реакции редко приводят к высокому выходу продукта. Наличие в молекуле нескольких идентичных или близких по энергии связей приводит к тому, что реакции происходят одновременно по нескольким направлениям. Это обстоятельство определяет способ записи органических реакций: как правило, используют не химические уравнения, а схемы реакций, в которых обычно не приводятся стехиометрические отношения:
CH3 CH3 CH3

 NO2
NO2
H2SO4
+ HNO3 +
NO2
Любая химическая реакция сопровождается разрывом одних связей между атомами и образованием других. Разрыв ковалентных связей может осуществляться следующими способами:
а) гомолитический разрыв – при этом пара электронов делится таким образом, что каждая из образующихся частиц получает по одному электрону:
R : X → R· + ·X
Нейтральный атом или частица с неспаренным электроном называется свободным радикалом, а реакции с их участием – радикальными.
б) гетеролитический разрыв – при этом оба электрона связи остаются с одной из ранее связанных частиц:
B−
R3C : X R3C : + BX
частица R3C: заряжена отрицательно и называется карбанионом.
А+
R3C : X R3C+ + AX
в этом случае образуется карбкатион.
Реакции, идущие с гетеролитическим разрывом ковалентных связей, относят к ионным реакциям.
Разрыв химической связи происходит при нагревании, облучении, а чаще при действии на молекулу вещества активной частицы – реагента. Активная частица может быть ионом, нейтральной молекулой или радикалом.
Если реагент – отрицательный ион (OH−, Cl−) или нейтральная молекула с неподеленной электронной парой (:NH3, H2O:), то его называют нуклеофильным, т.е. обладающим сродством к ядру. Реакции с участием таких реагентов называют нуклеофильными.
Если реагент – положительный ион (H+, Cl+, NO2+, H3C+), готовый принять неподеленную пару электронов для образования новой связи, то его называют электрофильным, а реакции с участием таких реагентов – электрофильными.
Классификация органических веществ
Основными структурными признаками, положенными в основу классификации органических соединений, являются углеродный скелет и функциональная группа.
Классификация по типу углеродного скелета
В зависимости от строения углеродного скелета органические соединения разделяют на ациклические – соединения с открытой (незамкнутой) углеродной цепью и циклические.
Ациклические соединения могут быть как насыщенными (алканы), так и ненасыщенными (алкены, алкины).
Циклические соединения – соединения с замкнутой цепью – в зависимости от природы атомов, составляющих цикл, делят на карбоциклические и гетероциклические. Карбоциклические соединения содержат в цикле только атомы углерода и делятся на две существенно различающиеся по химическим свойствам группы: алифатические циклические (сокращенно алициклические) и ароматические. Гетероциклические соединения содержат в цикле, кроме атомов углерода, один или несколько атомов других элементов – гетероатомов.
Классификация по типу функциональной группы
В большинстве органических соединений, кроме атомов углерода и водорода, содержатся атомы других элементов (не входящие в скелет). Эти атомы или их группировки, во многом определяющие физические и химические свойства органических соединений, называют функциональными группами.
Функциональная группа оказывается окончательным признаком, по которому соединения относятся к тому или иному классу. Важнейшие группы приведены в табл. 1.1.
Соединения, которые содержат несколько функциональных групп, называют полифункциональными.
Соединения, имеющие одинаковые функциональные группы, но различающиеся числом атомов углерода, обладают похожими физическими и химическими свойствами. Такие соединения называются гомологами. Совокупность всех гомологов образует гомологический ряд.
Таблица 1.1. Важнейшие функциональные группы
Функциональная группа | Класс соединения | |
Обозначение | Название | |
−F, −Cl, −Br, −I | галоген | галогенопроизводные |
−OH | гидроксил | спирты, фенолы |
>C=O | карбонил | альдегиды, кетоны |
−COOH | карбоксил | карбоновые кислоты |
−NH2, >NH, >N− | аминогруппа | амины |
−NO2 | нитрогруппа | нитросоединения |
−SO3H | сульфогруппа | сульфокислоты |
studfiles.net


 ,
– сопряжение
,
– сопряжение Н2,
–NНR,
–NR2
Н2,
–NНR,
–NR2 Н,
–
Н,
– Н,
–
Н,
– R
R L
L