Ответы@Mail.Ru: что такое молекулярно-кинетическая теория?
МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ – раздел молекулярной физики, изучающий свойства вещества на основе представлений об их молекулярном строении и определенных законах взаимодействия между атомами (молекулами) , из которых состоит вещество. Считается, что частицы вещества находятся в непрерывном, беспорядочном движении и это их движение воспринимается как тепло.До 19 в. весьма популярной основой учения о тепле была теория теплорода или некоторой жидкой субстанции, перетекающей от одного тела к другому. Нагревание тел объяснялось увеличением, а охлаждение – уменьшением содержащегося внутри них теплорода. Понятие об атомах долго казалось ненужным для теории тепла, однако многие ученые уже тогда интуитивно связывали тепло с движением молекул. Так, в частности, думал русский ученый М. В. Ломоносов. Прошло немало времени, прежде чем молекулярно-кинетическая теория окончательно победила в сознании ученых и стала неотъемлемым достоянием физики. Многие явления в газах, жидкостях и твердых телах находят в рамках молекулярно-кинетической теории простое и убедительное объяснение. Так давление, оказываемое газом на стенки сосуда, в котором он заключен, рассматривается как суммарный результат многочисленных соударений быстро движущихся молекул со стенкой, в результате которых они передают стенке свой импульс. (Напомним, что именно изменение импульса в единицу времени приводит по законам механики к появлению силы, а сила, отнесенная к единице поверхности стенки, и есть давление) . Кинетическая энергия движения частиц, усредненная по их огромному числу, определяет то, что принято называть температурой вещества.
Истоки атомистической идеи, т. е. представления о том, что все тела в природе состоят из мельчайших неделимых частиц-атомов, восходят еще к древнегреческим философам – Левкиппу и Демокриту. Более двух тысяч лет назад Демокрит писал: «…атомы бесчисленны по величине и по множеству, носятся же они во вселенной, кружась в вихре, и таким образом рождается все сложное: огонь, вода, воздух, земля» . Решающий вклад в развитие молекулярно-кинетической теории был внесен во второй половине 19 в. трудами замечательных ученых Дж. К. Максвелла и Л. Больцмана, которые заложили основы статистического (вероятностного) описания свойств веществ (главным образом, газов) , состоящих из огромного числа хаотически движущихся молекул. Статистический подход был обобщен (по отношению к любым состояниям вещества) в начале 20 в. в трудах американского ученого Дж. Гиббса, который считается одним из основоположников статистической механики или статистической физики. Наконец, в первые десятилетия 20 в. физики поняли, что поведение атомов и молекул подчиняется законам не классической, а квантовой механики. Это дало мощный импульс развитию статистической физики и позволило описать целый ряд физических явлений, которые ранее не поддавались объяснению в рамках обычных представлений классической механики.
otvet.mail.ru
Молекулярно–кинетическая теория
В качестве одного из примеров применения молекулярно-кинетической теории можно рассмотреть вывод выражения для давления газа.
Рассмотрим давление идеального газа в состоянии равновесия.
Давление определяется силой $\triangle F$, с которой газ давит на единицу площади $\triangle S$ стенки сосуда:
\[p=\frac{\triangle F}{\triangle S}(1.1)\]Сила есть импульс, передаваемый от тела к телу в секунду:
\[\triangle \overrightarrow{F}=\frac{\triangle \overrightarrow{p}}{\triangle t}(1.2)\]Значит, чтобы найти давление газа, нужно найти, какой импульс передаёт газ единице площади стенки сосуда в секунду. Займемся этим расчётом. Будем считать, что соударение отдельной молекулы со стенкой сосуда подчиняется законам упругого столкновения: молекула отскакивает от стенки с первоначальным по модулю импульсом и угол ее падения равен углу отражения (рис. 1).
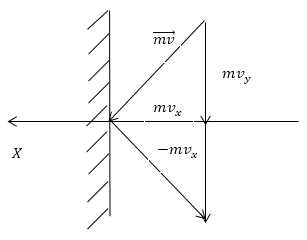
В этом случае от молекулы стенке передаётся только х – составляющая импульса:
\[\triangle p_x=mv_x-\left(-mv_x\right)=2mv_x\ (1.3)\]Движение молекул в направлении других осей координат при передаче импульса выбранной стенке не существенно, и можно считать, что молекулы движутся только по оси х. (Движение по другим осям будет учтено в конце расчёта.) Найдем число столкновений молекул о площадку с единичной площадью стенки в секунду, если скорость молекулы равна $v_x$. Легко понять, что это число pавно числу молекул с данной скоростью, находящихся в цилиндре с основанием в единицу площади и высотой, численно равной $v_x$.(рис. 2) В самом деле, молекулы вне данного цилиндpа пpосто не попадут в течение секунды на заданную единицу площади стенки (или не долетят до стенки, или ударятся о стенку не в том месте).
Рис. 2
Наоборот, все молекулы, попадающие в цилиндр, проходя за секунду путь, равный $v_x$, попадут на данную площадь стенки сосуда. Обозначим число молекул, обладающих заданной скоростью $v_x$ и находящихся в единице объема газа, через $n_{vx}$ Тогда число молекул, попадающих в цилиндp, или число молекул, удаpяющихся о стенку со скоpостью $v_x$ равно: $v_xn_{vx}$.
Эти молекулы передают стенке импульс, равный:
\[{2mv_xv_xn}_{vx}=2mv^2_xn_{vx}\left(1.4\right)\]Полный же импульс, который получает стенка на единице площади, т.е. давление газа, определяется суммированием таких выражений по всем возможным положительным значениям скорости молекулы:
\[p=\sum\limits_{v_x>0}{2mv^2_xn_{vx}(1.5)}\]Обозначим через n полное число молекул в единице объема газа. Половина из них летит к стенке (имеет скорость $v_x>0$). Перепишем формулу (1.5) в виде:
\[p=2m\frac{\sum\limits_{v_x>0}{v^2_xn_{vx}}}{\frac{n}{2}}\frac{n}{2}\ (1.6)\]и учтем, что выражение $\frac{\sum\limits_{v_x>0}{v^2_xn_{vx}}}{\frac{n}{2}}$представляет собой средний квадрат скорости молекулы. Средние величины будем обозначать скобками $$. Следовательно, формулу (1.6) можно переписать так:
\[p=2\frac{m }{2}n\ \left(1.7\right)\]Наконец, учтем, что скоpости молекул газа pаспpеделены по напpавлениям pавномеpно (газ изотpопен), и, следовательно,
\[ =++=3 (1.8)\]Поэтому окончательно формулу для давления газа представим в виде:
\[p=\frac{2}{3}\frac{m }{2}n= \frac{2}{3} n(1.9)\]Итак, давление идеального газа в состоянии равновесия равно двум третям произведения средней кинетической энергии поступательного движения молекулы газа на число молекул в единице объема газа.
spravochnick.ru
Основные положения МКТ. Масса и размер молекул. Количество вещества. Молекулярная физика
Основные положения МКТ. Масса и размер молекул. Количество вещества. Молекулярная физика
МКТ – это просто!
«Ничто не существует, кроме атомов и пустого пространства …» – Демокрит
«Любое тело может делиться до бесконечности» – Аристотель
Основные положения молекулярно-кинетической теории (МКТ)
Цель МКТ – это объяснение строения и свойств различных макроскопических тел и тепловых явлений, в них протекающих, движением и взаимодействием частиц, из которых состоят тела.
Макроскопические тела – это большие тела, состоящие из огромного числа молекул.
Тепловые явления – явления, связанные с нагреванием и охлаждением тел.
Основные утверждения МКТ
1. Вещество состоит из частиц (молекул и атомов).
2. Между частицами есть промежутки.
3. Частицы беспорядочно и непрерывно движутся.
4. Частицы взаимодействуют друг с другом (притягиваются и отталкиваются).
Подтверждение МКТ:
1. экспериментальное
– механическое дробление вещества; растворение вещества в воде; сжатие и расширение газов; испарение; деформация тел; диффузия; опыт Бригмана: в сосуд заливается масло, сверху на масло давит поршень, при давлении 10 000 атм масло начинает просачиваться сквозь стенки стального сосуда;
– диффузия; броуновское движение частиц в жидкости под ударами молекул;
– плохая сжимаемость твердых и жидких тел; значительные усилия для разрыва твердых тел; слияние капель жидкости;
2. прямое
– фотографирование, определение размеров частиц.
Броуновское движение
Броуновское движение – это тепловое движение взвешенных частиц в жидкости (или газе).
Броуновское движение стало доказательством непрерывного и хаотичного (теплового) движения молекул вещества.
– открыто английским ботаником Р. Броуном в 1827 г.
– дано теоретическое объяснение на основе МКТ А. Эйнштейном в 1905 г.
– экспериментально подтверждено французским физиком Ж. Перреном.
Масса и размеры молекул
Размеры частиц
Диаметр любого атома составляет около см.
Число молекул в веществе
где V – объем вещества, Vo – объем одной молекулы
Масса одной молекулы
где m – масса вещества,
N – число молекул в веществе
Единица измерения массы в СИ: [m]= 1 кг
В атомной физике массу обычно измеряют в атомных единицах массы (а.е.м.).
Условно принято считать за 1 а.е.м. :
Относительная молекулярная масса вещества
Для удобства расчетов вводится величина – относительная молекулярная масса вещества.
где числитель – это масса молекулы, а знаменатель – 1/12 массы атома углерода
– это величина безразмерная, т.е. не имеет единиц измерения
Относительная атомная масса химического элемента
где числитель – это масса атома, а знаменатель – 1/12 массы атома углерода
– величина безразмерная, т.е. не имеет единиц измерения
Относительная атомная масса каждого химического элемента дана в таблице Менделеева.
Другой способ определения относительной молекулярной массы вещества
Относительная молекулярная масса вещества равна сумме относительных атомных масс химических элементов, входящих в состав молекулы вещества.
Количество вещества
Количество вещества (ν) определяет относительное число молекул в теле.
где N – число молекул в теле, а Na – постоянная Авогадро
Единица измерения количества вещества в системе СИ: [ν]= 1 моль
1 моль – это количество вещества, в котором содержится столько молекул (или атомов), сколько атомов содержится в углероде массой 0,012 кг.
Запомни!
В 1 моле любого вещества содержится одинаковое число атомов или молекул!
Но!
Одинаковые количества вещества для разных веществ имеют разную массу!
Постоянная Авогадро
Число атомов в 1 моле любого вещества называют числом Авогадро или постоянной Авогадро:
Молярная масса
Молярная масса (M) – это масса вещества, взятого в одном моле, или иначе – это масса одного моля вещества.
где
– масса молекулы
– постоянная Авогадро
Единица измерения молярной массы: [M]=1 кг/моль.
Формулы для решения задач
Эти формулы получаются в результате подстановки вышерассмотренных формул.
Масса любого количества вещества
и формула для 7 класса
(плотность х объем)
Число молекул в веществе
Молярная масса
Масса одной молекулы
Связь между относительной молекулярной массой и молярной массой
Молекулярная физика. Термодинамика – Класс!ная физика
Основные положения МКТ. Масса и размер молекул. Количество вещества. – Взаимодействие молекул. Строение твердых тел, жидкостей и газов. – Идеальный газ. Основное уравнение МКТ. — Температура. Тепловое равновесие. Абсолютная шкала температур. — Уравнение состояния идеального газа. — Изопроцессы. Газовые законы. — Взаимные превращения жидкостей и газов. Влажность воздуха. — Твердые тела. Кристаллические тела. Аморфные тела.
class-fizika.ru
Основные положения МКТ — Мегаобучалка
Молекулярная физика и термодинамика
Молекулярная физика и термодинамика – это по существу две разные по своим подходам, но тесно связанные науки, занимающиеся одним и тем же – изучением макроскопических свойств физических систем, но совершенно разными методами.
В основе молекулярной физики или молекулярно-кинетической теории лежат определенные представления о строении вещества. Для установления законов поведения макроскопических систем, состоящих из огромного числа частиц, в молекулярной физике используются различные модели вещества, например, модели идеального газа.
Молекулярная физика является статистической теорией, т. е. теорией, которая рассматривает поведение систем, состоящих из огромного числа частиц (атомов, молекул), на основе вероятностных моделей. Она стремится на основе статистического подхода установить связь между экспериментально измеренными макроскопическими величинами (давление, объем, температура и т.д.) и микроскопическими характеристиками частиц, входящих в состав системы (масса, импульс, энергия и т.д.).
В отличие от молекулярно-кинетической теории, термодинамика при изучении свойств макроскопических систем не опирается ни на какие представления о молекулярной структуре вещества. Термодинамика является наукой
Оба подхода – термодинамический и статистический – не противоречат, а дополняют друг друга. Только совместное использование термодинамики и молекулярно-кинетической теории может дать наиболее полное представление о свойствах систем, состоящих из большого числа частиц.
Молекулярно-кинетическая теория
Основные положения МКТ
Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц химических веществ.
В основе молекулярно-кинетической теории лежат три основных положения:
1. Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов («элементарных молекул»). Молекулы химического вещества могут быть простыми и сложными, т.е. состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
2. Атомы и молекулы находятся в непрерывном хаотическом движении.
3. Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
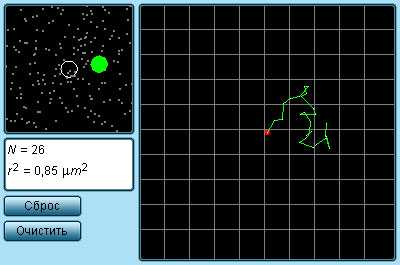
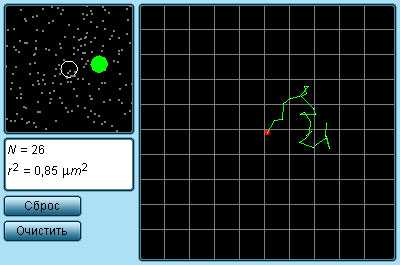
| Рисунок 3.1.1. Траектория броуновской частицы |
Наиболее ярким экспериментальным подтверждением представлений молекулярно-кинетической теории о беспорядочном движении атомов и молекул является броуновское движение
Главный вывод теории А. Эйнштейна состоит в том, что квадрат смещения <r2> броуновской частицы от начального положения, усредненный по многим броуновским частицам, пропорционален времени наблюдения t.
Это соотношение выражает так называемый диффузионный закон. Как следует из теории коэффициент пропорциональности D монотонно возрастает с увеличением температуры.
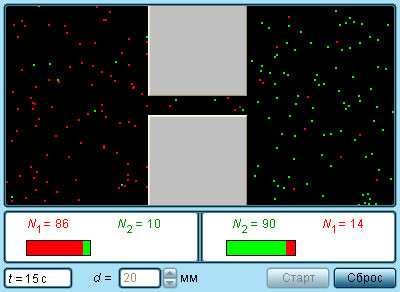
Постоянное хаотичное движение молекул вещества проявляется также в другом легко наблюдаемом явлении – диффузии. Диффузией называется явление проникновения двух или нескольких соприкасающихся веществ друг в друга. Наиболее быстро процесс протекает в газе, если он неоднороден по составу. Диффузия приводит к образованию однородной смеси независимо от плотности компонентов. Так, если в двух частях сосуда, разделенных перегородкой, находятся кислород O2 и водород H2, то после удаления перегородки начинается процесс взаимопроникновения газов друг в друга, приводящий к образованию взрывоопасной смеси – гремучего газа. Этот процесс идет и в том случае, когда легкий газ (водород) находится в верхней половине сосуда, а более тяжелый (вислород) – в нижней.
Значительно медленнее протекают подобные процессы в жидкостях. Взаимопроникновение двух разнородных жидкостей друг в друга, растворение твердых веществ в жидкостях (например, сахара в воде) и образование однородных растворов – примеры диффузионных процессов в жидкостях.
В реальных условиях диффузия в жидкостях и газах маскируется более быстрыми процессами перемешивания, например, из-за возникновения конвекционных потоков.
Наиболее медленно процесс диффузии протекает в твердых телах. Однако, опыты показывают, что при контакте хорошо очищенных поверхностей двух металлов через длительное время в каждом из них обнаруживается атомы другого металла.
Диффузия и броуновское движение – родственные явления. Взаимопроникновение соприкасающихся веществ друг в друга и беспорядочное движение мельчайших частиц, взвешенных в жидкости или газе, происходят вследствие хаотичного теплового движения молекул.
 |
| Модель. Броуновское движение |
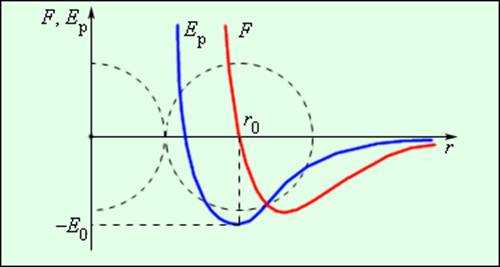
Силы, действующие между двумя молекулами, зависят от расстояния между ними. Молекулы представляют собой сложные пространственные структуры, содержащие как положительные, так и отрицательные заряды. Если расстояние между молекулами достаточно велико, то преобладают силы межмолекулярного притяжения. На малых расстояниях преобладают силы отталкивания. Зависимости результирующей силы F и потенциальной энергии Eр взаимодействия между молекулами от расстояния между их центрами качественно изображены на рис. 3.1.2. При некотором расстоянии r = r0 сила взаимодействия обращается в нуль. Это расстояние условно можно принять за диаметр молекулы. Потенциальная энергия взаимодействия при r = r0 минимальна. Чтобы удалить друг от друга две молекулы, находящиеся на расстоянии r0, нужно сообщить им дополнительную энергию E0. Величина E0 называется глубиной потенциальной ямы или энергией связи.
| Рисунок 3.1.2. Сила взаимодействия F и потенциальная энергия взаимодействия Eр двух молекул. F > 0 – сила отталкивания, F < 0 – сила притяжения |
Молекулы имеют чрезвычайно малые размеры. Простые одноатомные молекулы имеют размер порядка 10–10 м. Сложные многоатомные молекулы могут иметь размеры в сотни и тысячи раз больше.
Беспорядочное хаотическое движение молекул называется тепловым движением. Кинетическая энергия теплового движения растет с возрастанием температуры. При низких температурах средняя кинетическая энергия молекулы может оказаться меньше глубины потенциальной ямы E0. В этом случае молекулы конденсируются в жидкое или твердое вещество; при этом среднее расстояние между молекулами будет приблизительно равно r0. При повышении температуры средняя кинетическая энергия молекулы становится больше E0, молекулы разлетаются, и образуется газообразное вещество.
В твердых телах молекулы совершают беспорядочные колебания около фиксированных центров (положений равновесия). Эти центры могут быть расположены в пространстве нерегулярным образом (аморфные тела) или образовывать упорядоченные объемные структуры (кристаллические тела) (см. §3.6).
 |
| Модель. Агрегатные состояния |
В жидкостях молекулы имеют значительно большую свободу для теплового движения. Они не привязаны к определенным центрам и могут перемещаться по всему объему. Этим объясняется текучесть жидкостей. Близко расположенные молекулы жидкости также могут образовывать упорядоченные структуры, содержащие несколько молекул. Это явление называется ближним порядком в отличие от дальнего порядка, характерного для кристаллических тел.
В газах расстояния между молекулами обычно значительно больше их размеров. Силы взаимодействия между молекулами на таких больших расстояниях малы, и каждая молекула движется вдоль прямой линии до очередного столкновения с другой молекулой или со стенкой сосуда. Среднее расстояние между молекулами воздуха при нормальных условиях порядка 10–8 м, т. е. в десятки раз превышает размер молекул. Слабое взаимодействие между молекулами объясняет способность газов расширяться и заполнять весь объем сосуда. В пределе, когда взаимодействие стремится к нулю, мы приходим к представлению об идеальном газе.
 |
| Модель. Кинетическая модель идеального газа |
В молекулярно-кинетической теории количество вещества принято считать пропорциональным числу частиц. Единица количества вещества называется молем (моль).
Моль – это количество вещества, содержащее столько же частиц (молекул), сколько содержится атомов в 0,012 кг углерода 12C. Молекула углерода состоит из одного атома.
Таким образом, в одном моле любого вещества содержится одно и то же число частиц (молекул). Это число называется постоянной Авогадро NА:
| NА = 6,02·1023 моль–1. |
Постоянная Авогадро – одна из важнейших постоянных в молекулярно-кинетической теории.
Количество вещества ν определяется как отношение числа N частиц (молекул) вещества к постоянной Авогадро NА:
Массу одного моля вещества принято называть молярной массой M. Молярная масса равна произведению массы m0 одной молекулы данного вещества на постоянную Авогадро:
Молярная масса выражается в килограммах на моль (кг/моль). Для веществ, молекулы которых состоят из одного атома, часто используется термин атомная масса.
За единицу массы атомов и молекул принимается 1/12 массы атома изотопа углерода 12C (с массовым числом 12). Она называется атомной единицей массы (а. е. м.):
| 1 а. е. м. = 1,66·10–27 кг. |
Эта величина почти совпадает с массой протона или нейтрона. Отношение массы атома или молекулы данного вещества к 1/12 массы атома углерода 12C называется относительной массой.
 |
| Модель. Диффузия газов |
megaobuchalka.ru
МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ | Энциклопедия Кругосвет
Содержание статьиМОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ – раздел молекулярной физики, изучающий свойства вещества на основе представлений об их молекулярном строении и определенных законах взаимодействия между атомами (молекулами), из которых состоит вещество. Считается, что частицы вещества находятся в непрерывном, беспорядочном движении и это их движение воспринимается как тепло.
До 19 в. весьма популярной основой учения о тепле была теория теплорода или некоторой жидкой субстанции, перетекающей от одного тела к другому. Нагревание тел объяснялось увеличением, а охлаждение – уменьшением содержащегося внутри них теплорода. Понятие об атомах долго казалось ненужным для теории тепла, однако многие ученые уже тогда интуитивно связывали тепло с движением молекул. Так, в частности, думал русский ученый М.В.Ломоносов. Прошло немало времени, прежде чем молекулярно-кинетическая теория окончательно победила в сознании ученых и стала неотъемлемым достоянием физики.
Многие явления в газах, жидкостях и твердых телах находят в рамках молекулярно-кинетической теории простое и убедительное объяснение. Так давление, оказываемое газом на стенки сосуда, в котором он заключен, рассматривается как суммарный результат многочисленных соударений быстро движущихся молекул со стенкой, в результате которых они передают стенке свой импульс. (Напомним, что именно изменение импульса в единицу времени приводит по законам механики к появлению силы, а сила, отнесенная к единице поверхности стенки, и есть давление). Кинетическая энергия движения частиц, усредненная по их огромному числу, определяет то, что принято называть температурой вещества.
Истоки атомистической идеи, т.е. представления о том, что все тела в природе состоят из мельчайших неделимых частиц-атомов, восходят еще к древнегреческим философам – Левкиппу и Демокриту. Более двух тысяч лет назад Демокрит писал: «…атомы бесчисленны по величине и по множеству, носятся же они во вселенной, кружась в вихре, и таким образом рождается все сложное: огонь, вода, воздух, земля». Решающий вклад в развитие молекулярно-кинетической теории был внесен во второй половине 19 в. трудами замечательных ученых Дж.К.Максвелла и Л.Больцмана, которые заложили основы статистического (вероятностного) описания свойств веществ (главным образом, газов), состоящих из огромного числа хаотически движущихся молекул. Статистический подход был обобщен (по отношению к любым состояниям вещества) в начале 20 в. в трудах американского ученого Дж.Гиббса, который считается одним из основоположников статистической механики или статистической физики. Наконец, в первые десятилетия 20 в. физики поняли, что поведение атомов и молекул подчиняется законам не классической, а квантовой механики. Это дало мощный импульс развитию статистической физики и позволило описать целый ряд физических явлений, которые ранее не поддавались объяснению в рамках обычных представлений классической механики.
Молекулярно-кинетическая теория газов.
Газовое состояние (см. ГАЗ) – одно из тех состояний вещества, описание которого на основе методов молекулярно-кинетической теории уже с самого начала ее развития дало наиболее полные и ощутимые результаты. В первую очередь это относится к так называемому идеальному газу, молекулы которого большую часть времени проводят в состоянии свободного хаотического движения, резко меняя свою скорость лишь в моменты кратковременных столкновений. Молекулярно-кинетическая теория успешно объясняет все известные экспериментальные законы идеального газа (закон Бойля – Мариотта, закон Гей-Люссака, закон Авогадро и формулируемое на их основе уравнение состояния Менделеева – Клапейрона). На базе этой теории получили свое полное объяснение процессы переноса в газах: диффузия, вязкость и теплопроводность.
Давление газа.
В качестве одного из примеров применения молекулярно-кинетической теории можно рассмотреть вывод выражения для давления газа. Сначала определяется среднее число столкновений молекул, происходящих за единицу времени с поверхностью стенки сосуда. В газе выделяются три взаимно перпендикулярных оси, соответствующие декартовой системе координат. Если в сосуде содержится N молекул, то из-за огромного их числа логично предположить, что в любой момент времени вдоль каждого из направлений будут двигаться примерно N/3 молекул. Очевидно, что в направлении самой стенки сосуда перпендикулярно к ней будет в среднем двигаться 1/6 часть всех молекул.
Пусть есть плоский элемент поверхности на стенке сосуда DS. Предполагается, для простоты, что все молекулы движутся с одинаковой скоростью v. Тогда за время Dt до элемента стенки DS долетят все движущиеся по направлению к нему молекулы, которые заключены в объеме цилиндра с основанием DS и высотой v Dt (рис. 1).

Если n = N/V – число молекул в единице объема, то число молекул, долетевших до стенки и ударившихся об нее, равно Dv = (n/6)vDSDt. Соответственно, число ударов молекул об единичную площадку в единицу времени оказывается равным
(1)
Каждая молекула, летящая к стенке, при столкновении с ней передает стенке свой импульс. Поскольку скорость молекулы при упругом столкновении со стенкой меняется от величины v до –v, величина передаваемого импульса равна 2mv. Сила, действующая на поверхность стенки DS за время Dt, определяется величиной полного импульса, передаваемого всеми молекулами достигнувшим стенки за этот промежуток времени, т.е. F = 2mv nc DS/Dt, где nc определено выражением (1). Для величины давления p = F/DS в этом случае находим: p = (1/3)nmv2.
Для получения окончательного результата можно отказаться от предположения об одинаковой скорости молекул, выделив независимые группы молекул, каждая из которых имеет свою приблизительно одинаковую скорость. Тогда средняя величина давления находится усреднением квадрата скорости по всем группам молекул или
(2)
Это выражение можно представить также в виде
(3)
где – средняя кинетическая энергия молекул газа (в расчете на одну молекулу).
Тепловое равновесие, понятие температуры. Известно, что тепло всегда перетекает от горячего тела к холодному, т.е. температура соприкасающихся тел стремится выравняться. Это явление характеризуют как переход системы в состояние теплового равновесия. Понятие температуры является не столь очевидным, как многие привычные понятия механики: масса, сила, энергия и т.д. Температура связана с весьма неопределенным понятием теплоты и холода, которые располагаются в сознании человека где-то рядом с запахом и вкусом. Одно из главных достижений молекулярно-кинетической теории состоит в том, что теплота рассматривается просто как одна из форм энергии, а именно – кинетическая энергия атомов и молекул. Эта величина, усредненная по огромному числу беспорядочно движущихся частиц, и оказывается мерилом того, что называется температурой тела. Такое представление распространяется на все вещества – твердые, жидкие и газообразные. Частицы нагретого тела движутся быстрее, чем холодного. Если два тела, имеющие первоначально разные температуры, входят в соприкосновение друг с другом, движение частиц в одном из них замедляется, в другом наоборот ускоряется: средняя кинетическая энергия частиц становится везде одинаковой. Это и означает, что система в целом приходит в состояние полного теплового равновесия.
Поскольку понятие температуры тесно связано с усредненной кинетической энергией молекул, было бы естественным и в качестве единиц ее измерения использовать энергетические единицы (например, эрг или джоуль). Однако, энергия теплового движения частиц фактически очень мала по сравнению с эргом (не говоря уже о джоуле), поэтому использование этой величины оказывается неудобным. В молекулярной физике пользуются практически удобной условной единицей измерения температуры – градусом, который определяется таким образом, что интервал температур между точками кипения и замерзания воды при атмосферном давлении полагается равным 100 градусам.
Если температура T измеряется в градусах Кельвина (К), то связь ее со средней кинетической энергией молекул имеет вид
(4) Ek = (3/2)kT,
где k = 1,38·10–16 эрг/K – переводный коэффициент, определяющий, какая часть эрга содержится в градусе. Величина k называется постоянной Больцмана (она была введена Планком в 1899).
Уравнение состояния. Газовые законы.
Подстановка соотношений (4) в (3), приводит к известному уравнению состояния идеального газа
(5) p = nkT
Из соотношений (2) и (5) следует также выражение для средне-квадратичной скорости молекул
,
Этой формуле удобно придать другой вид, умножив числитель и знаменатель под знаком квадратного корня на число Авогадро
Na = 6,023·1023.
Тогда
(7)
Здесь M = mNA – атомная или молекулярная масса, величина R = kNA = 8,318·107 эрг называется газовой постоянной.
Средняя скорость молекул в газе даже при умеренных температурах оказывается очень большой. Так, для молекул водорода (H2) при комнатной температуре (T = 293K) эта скорость равна около 1900 м/c , для молекул азота в воздухе – порядка 500 м/с. Скорость звука в воздухе при тех же условиях равна 340 м/с.
Учитывая, что n = N/V, где V – объем, занимаемый газом, N – полное число молекул в этом объеме, легко получить следствия из (5) в виде известных газовых законов. Для этого полное число молекул представляется в виде N = vNA, где v – число молей газа, и уравнение (5) принимает вид
(8) pV = vRT,
которое носит название уравнения Клапейрона – Менделеева.
При условии T = const давление газа меняется обратно пропорционально занимаемому им объему (закон Бойля – Мариотта).
В замкнутом сосуде фиксированного объема V = const давление меняется прямо пропорционально изменению абсолютной температуры газа Т. Если газ находится в условиях, когда постоянным сохраняется его давление p = const, но изменяется температура (такие условия можно осуществить, например, если поместить газ в цилиндр, закрытый подвижным поршнем), то объем, занимаемый газом, будет меняться пропорционально изменению его температуры (закон Гей-Люссака).
Пусть в сосуде есть смесь газов, т.е. имеются несколько разных сортов молекул. В этом случае величина импульса, передаваемого стенке молекулами каждого сорта, не зависит от наличия молекул других сортов. Отсюда следует, что давление смеси идеальных газов равно сумме парциальных давлений, которые создавал бы каждый газ в отдельности, если бы занимал весь объем. В этом состоит еще один из газовых законов – известный закон Дальтона.
Длина свободного пробега молекул. Одним из первых, кто еще в 1850-х дал разумные оценки величины средней тепловой скорости молекул различных газов, был австрийский физик Клаузиус. Полученные им непривычно большие значения этих скоростей сразу же вызвали возражения. Если скорости молекул действительно так велики, то запах любого пахучего вещества должен был бы практически мгновенно распространяться из одного конца замкнутого помещения в другой. На самом деле распространение запаха происходит очень медленно и осуществляется, как теперь известно, посредством процесса так называемой диффузии в газе. Клаузиус, а затем и другие исследователи, сумели дать убедительное объяснение этому и другим процессам переноса в газе (таким как теплопроводность и вязкость) с помощью понятия средней длины свободного пробега молекул, т.е. среднего расстояния, которое пролетает молекула от одного столкновения до другого.
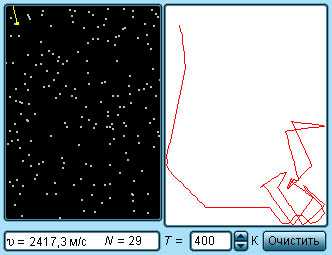
Каждая молекула в газе испытывает очень большое число столкновений с другими молекулами. В промежутке между столкновениями молекулы движутся практически прямолинейно, испытывая резкие изменения скорости лишь в момент самого столкновения. Естественно, что длины прямолинейных участков на пути молекулы могут быть различными, поэтому имеет смысл говорить лишь о некоторой средней длине свободного пробега молекул.
За время Dt молекула проходит сложный зигзагообразный путь, равный vDt. Изломов траектории на этом пути столько, сколько произошло столкновений. Пусть Z означает число столкновений, которое испытывает молекула в единицу времени Средняя длина свободного пробега равна тогда отношению длины пути к полному числу столкновений ZDt, испытанных молекулой на этом пути,
(9)
Для оценки величины Z принимается, что молекулы представляют собой твердые упругие шарики радиуса a, которые равномерно распределены в объеме газа с плотностью n. Сначала предполагается, что молекула движется в среде, где все остальные молекулы неподвижны. Можно видеть, что молекула пролетает мимо другой молекулы, не испытав столкновения с ней, если расстояние между центрами молекул превышает 2a. Следовательно, за время t, равное 1c, молекула взаимодействует только с теми партнерами по столкновению, центры которых расположены в объеме цилиндра длиной и с площадью основания s = 4pa2 (рис.2). На самом деле, после каждого столкновения направление движения молекулы меняется, и нужно рассматривать ее движение в цилиндре, составленном как бы из отдельных колен, однако смысл рассуждений не меняется, если считать этот коленчатый цилиндр выпрямленным.
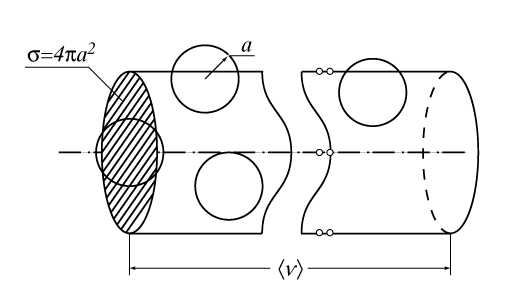
Величину s называют эффективным поперечным сечением столкновений молекул. Число молекул в объеме цилиндра равно ns. Таким же будет число столкновений, т.е. Z = ns. Используя (9), находим
l = 1/ns
На самом деле, конечно, в газе одновременно находятся в движении все молекулы, поэтому в выражение для Z должна входить средняя скорость относительного движения молекул, так что Z = nотн.s. Более точный расчет, проведенный впервые Максвеллом, показывает, что . В результате получается известная в элементарной кинетической теории формула
(10)
Характерный радиус молекул для различных газов можно оценить из экспериментальных данных по вязкости (внутреннему трению) в газе. Для молекул N2, например, a » 2,0·10–10 м. В таблице 1 приведены рассчитанные по формуле (10) значения l0 в мкм (1мкм = 10–6м) для некоторых газов при нормальных условиях (p = 1атм, T=273K). Эти значения оказываются примерно в 100–300 раз больше собственного диаметра молекул.
www.krugosvet.ru
Основные положения МКТ
Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц химических веществ.
В основе молекулярно-кинетической теории лежат три основных положения:
1. Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов («элементарных молекул»). Молекулы химического вещества могут быть простыми и сложными, т.е. состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
2. Атомы и молекулы находятся в непрерывном хаотическом движении.
3. Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
|
Рисунок 3.1.1. Траектория броуновской частицы |
Наиболее ярким экспериментальным подтверждением представлений молекулярно-кинетической теории о беспорядочном движении атомов и молекул является броуновское движение. Это тепловое движение мельчайших микроскопических частиц, взвешенных в жидкости или газе. Оно было открыто английским ботаником Робертом Броуном в 1827 г. Броуновские частицы движутся под влиянием беспорядочных ударов молекул. Из-за хаотического теплового движения молекул эти удары никогда не уравновешивают друг друга. В результате скорость броуновской частицы беспорядочно меняется по модулю и направлению, а ее траектория представляет собой сложную зигзагообразную кривую (рис. 3.1.1). Теория броуновского движения была создана А.Эйнштейном в 1905 г. Экспериментально теория Эйнштейна была подтверждена в опытах французского физика Жана Перрена, проведенных в 1908–1911 гг.
 |
Модель. Броуновское движение. |
Главный вывод теории А. Эйнштейна состоит в том, что квадрат смещения <r2> броуновской частицы от начального положения, усредненный по многим броуновским частицам, пропорционален времени наблюдения t.
Это соотношение выражает так называемый диффузионный закон. Как следует из теории коэффициент пропорциональности D монотонно возрастает с увеличением температуры.
Постоянное хаотичное движение молекул вещества проявляется также в другом легко наблюдаемом явлении – диффузии. Диффузией называется явление проникновения двух или нескольких соприкасающихся веществ друг в друга. Наиболее быстро процесс протекает в газе, если он неоднороден по составу. Диффузия приводит к образованию однородной смеси независимо от плотности компонентов. Так, если в двух частях сосуда, разделенных перегородкой, находятся кислород O2 и водород H2, то после удаления перегородки начинается процесс взаимопроникновения газов друг в друга, приводящий к образованию взрывоопасной смеси – гремучего газа. Этот процесс идет и в том случае, когда легкий газ (водород) находится в верхней половине сосуда, а более тяжелый (вислород) – в нижней.
Значительно медленнее протекают подобные процессы в жидкостях. Взаимопроникновение двух разнородных жидкостей друг в друга, растворение твердых веществ в жидкостях (например, сахара в воде) и образование однородных растворов – примеры диффузионных процессов в жидкостях.
В реальных условиях диффузия в жидкостях и газах маскируется более быстрыми процессами перемешивания, например, из-за возникновения конвекционных потоков.
Наиболее медленно процесс диффузии протекает в твердых телах. Однако, опыты показывают, что при контакте хорошо очищенных поверхностей двух металлов через длительное время в каждом из них обнаруживается атомы другого металла.
Диффузия и броуновское движение – родственные явления. Взаимопроникновение соприкасающихся веществ друг в друга и беспорядочное движение мельчайших частиц, взвешенных в жидкости или газе, происходят вследствие хаотичного теплового движения молекул.
Силы, действующие между двумя молекулами, зависят от расстояния между ними. Молекулы представляют собой сложные пространственные структуры, содержащие как положительные, так и отрицательные заряды. Если расстояние между молекулами достаточно велико, то преобладают силы межмолекулярного притяжения. На малых расстояниях преобладают силы отталкивания. Зависимости результирующей силы F и потенциальной энергии Eр взаимодействия между молекулами от расстояния между их центрами качественно изображены на рис. 3.1.2. При некотором расстоянии r = r0 сила взаимодействия обращается в нуль. Это расстояние условно можно принять за диаметр молекулы. Потенциальная энергия взаимодействия при r = r0 минимальна. Чтобы удалить друг от друга две молекулы, находящиеся на расстоянии r0, нужно сообщить им дополнительную энергию E0. Величина E0 называется глубиной потенциальной ямы или энергией связи.
|
Рисунок 3.1.2. Сила взаимодействия F и потенциальная энергия взаимодействия Eр двух молекул. F > 0 – сила отталкивания, F < 0 – сила притяжения |
Молекулы имеют чрезвычайно малые размеры. Простые одноатомные молекулы имеют размер порядка 10–10 м. Сложные многоатомные молекулы могут иметь размеры в сотни и тысячи раз больше.
Беспорядочное хаотическое движение молекул называется тепловым движением. Кинетическая энергия теплового движения растет с возрастанием температуры. При низких температурах средняя кинетическая энергия молекулы может оказаться меньше глубины потенциальной ямы E0. В этом случае молекулы конденсируются в жидкое или твердое вещество; при этом среднее расстояние между молекулами будет приблизительно равно r0. При повышении температуры средняя кинетическая энергия молекулы становится больше E0, молекулы разлетаются, и образуется газообразное вещество.
В твердых телах молекулы совершают беспорядочные колебания около фиксированных центров (положений равновесия). Эти центры могут быть расположены в пространстве нерегулярным образом (аморфные тела) или образовывать упорядоченные объемные структуры (кристаллические тела).
 |
Модель. Агрегатные состояния |
В жидкостях молекулы имеют значительно большую свободу для теплового движения. Они не привязаны к определенным центрам и могут перемещаться по всему объему. Этим объясняется текучесть жидкостей. Близко расположенные молекулы жидкости также могут образовывать упорядоченные структуры, содержащие несколько молекул. Это явление называется ближним порядком в отличие от дальнего порядка, характерного для кристаллических тел.
В газах расстояния между молекулами обычно значительно больше их размеров. Силы взаимодействия между молекулами на таких больших расстояниях малы, и каждая молекула движется вдоль прямой линии до очередного столкновения с другой молекулой или со стенкой сосуда. Среднее расстояние между молекулами воздуха при нормальных условиях порядка 10–8 м, т. е. в десятки раз превышает размер молекул. Слабое взаимодействие между молекулами объясняет способность газов расширяться и заполнять весь объем сосуда. В пределе, когда взаимодействие стремится к нулю, мы приходим к представлению об идеальном газе.
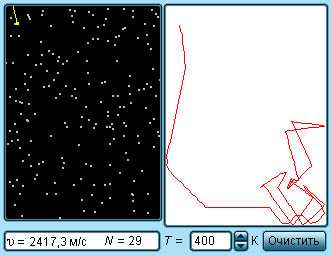 |
Модель. Кинетическая модель идеального газа |
В молекулярно-кинетической теории количество вещества принято считать пропорциональным числу частиц. Единица количества вещества называется молем (моль).
Моль – это количество вещества, содержащее столько же частиц (молекул), сколько содержится атомов в 0,012 кг углерода 12C. Молекула углерода состоит из одного атома.
Таким образом, в одном моле любого вещества содержится одно и то же число частиц (молекул). Это число называется постоянной Авогадро NА:
NА = 6,02·1023 моль–1. |
Постоянная Авогадро – одна из важнейших постоянных в молекулярно-кинетической теории.
Количество вещества ν определяется как отношение числа N частиц (молекул) вещества к постоянной Авогадро NА:
Массу одного моля вещества принято называть молярной массой M. Молярная масса равна произведению массы m0 одной молекулы данного вещества на постоянную Авогадро:
Молярная масса выражается в килограммах на моль (кг/моль). Для веществ, молекулы которых состоят из одного атома, часто используется термин атомная масса.
За единицу массы атомов и молекул принимается 1/12 массы атома изотопа углерода 12C (с массовым числом 12). Она называется атомной единицей массы (а. е. м.):
1 а. е. м. = 1,66·10–27 кг. |
Эта величина почти совпадает с массой протона или нейтрона. Отношение массы атома или молекулы данного вещества к 1/12 массы атома углерода 12C называется относительной массой.
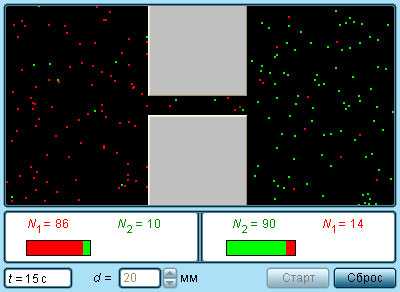 |
Модель. Диффузия газов |
questions-physics.ru
Основные положения молекулярно-кинетической теории и их опытное обоснование
Молекулярно-кинетическая теория (МКТ) – это учение, которое объясняет тепловые явления в макроскопических телах и внутренние свойства этих тел движением и взаимодействием атомов, молекул и ионов, из которых состоят тела. В основе МКТ строения вещества лежат три положения:
- Вещество состоит из частиц – молекул, атомов и ионов. В состав этих частиц входят более мелкие элементарные частицы. Молекула – наименьшая устойчивая частица данного вещества. Молекула обладает основными химическими свойствами вещества. Молекула является пределом деления вещества, то есть самой маленькой частью вещества, которая способна сохранять свойства этого вещества. Атом – это наименьшая частица данного химического элемента.
- Частицы, из которых состоит вещество, находятся в непрерывном хаотическом (беспорядочном) движении.
- Частицы вещества взаимодействуют друг с другом – притягиваются и отталкиваются.
Эти основные положения подтверждаются экспериментально и теоретически.
Состав вещества
Современные приборы позволяют наблюдать изображения отдельных атомов и молекул. С помощью электронного микроскопа или ионного проектора (микроскопа) можно получить изображения отдельных атомов и оценить их размеры. Диаметр любого атома имеет порядок d = 10-8 см (10-10 м). Размеры молекул больше размеров атомов. Поскольку молекулы состоят из нескольких атомов, то чем больше количество атомов в молекуле, тем больше её размер. Размеры молекул лежат в пределах от 10-8 см (10-10 м) до 10-5 см (10-7 м).
Хаотическое движение частиц
Непрерывное хаотическое движение частиц подтверждается броуновским движением и диффузией. Хаотичность движения означает, что у молекул не существует каких-либо предпочтительных путей и их движения имеют случайные направления. Это означает, что все направления равновероятны.
Диффузия (от латинского diffusion – растекание, распространение) – явление, когда в результате теплового движения вещества происходит самопроизвольное проникновение одного вещества в другое (если эти вещества соприкасаются).
Взаимное перемешивание веществ происходит по причине непрерывного и беспорядочного движения атомов или молекул (или других частиц) вещества. С течением времени глубина проникновения молекул одного вещества в другое увеличивается. Глубина проникновения зависит от температуры: чем выше температура, тем больше скорость движения частиц вещества и тем быстрее протекает диффузия.
Диффузия наблюдается во всех состояниях вещества – в газах, жидкостях и твёрдых телах. Примером диффузии в газах служит распространение запахов в воздухе при отсутствии прямого перемешивания. Диффузия в твёрдых телах обеспечивает соединение металлов при сварке, пайке, хромировании и т.п. В газах и жидкостях диффузия происходит намного быстрее, чем в твёрдых телах.
Взаимодействие частиц
Существование устойчивых жидких и твёрдых тел объясняется наличием сил межмолекулярного взаимодействия (сил взаимного притяжения и отталкивания). Этими же причинами объясняется малая сжимаемость жидкостей и способность твёрдых тел сопротивляться деформациям сжатия и растяжения.
Силы межмолекулярного взаимодействия имеют электромагнитную природу – это силы электрического происхождения. Причиной этого является то, что молекулы и атомы состоят из заряженных частиц с противоположными знаками зарядов – электронов и положительно заряженных атомных ядер. В целом молекулы электрически нейтральны. По электрическим свойствам молекулу можно приближённо рассматривать как электрический диполь.
Силы притяжения принято считать отрицательными, а силы отталкивания – положительными, хотя это деления является условным.
Сила взаимодействия между молекулами имеет определённую зависимость от расстояния между молекулами. Эта зависимость изображена на рис. 1.1. Здесь показаны проекции сил взаимодействия на прямую, которая проходит через центры молекул.
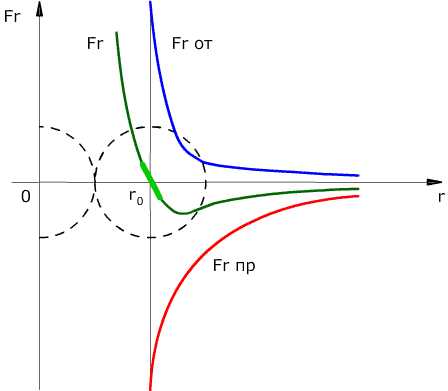
Рис. 1.1. Зависимость межмолекулярных сил от расстояния между взаимодействующими атомами.
Как видим, по мере уменьшения расстояния между молекулами r сила притяжения Fr пр увеличивается (красная линия на рисунке). Как уже было сказано, силы притяжения принято считать отрицательными, поэтому по мере уменьшения расстояния кривая уходит вниз, то есть в отрицательную зону графика.
Силы притяжения действуют по мере сближения двух атомов или молекул, пока расстояние r между центрами молекул находится в районе 10-9 м (2-3 диаметра молекул). По мере увеличения этого расстояния силы притяжения ослабевают. Силы притяжения являются короткодействующими силами.
| (1.1) |
где a – коэффициент, зависящий от вида сил притяжения и строения взаимодействующих молекул.
При дальнейшем сближении атомов или молекул на расстояниях между центрами молекул порядка 10-10 м (это расстояние сравнимо с линейными размерами неорганических молекул) появляются силы отталкивания Fr от (синяя линия на рис. 1.1). Эти силы появляются за счёт взаимного отталкивания положительно заряженных атомов в молекуле и убывают с увеличением расстояния r ещё быстрее, чем силы притяжения (что видно на графике – синяя линия более «круто» стремится к нулю, чем красная).
| (1.2) |
где b – коэффициент, зависящий от вида сил отталкивания и строения взаимодействующих молекул.
На расстоянии r = r0 (это расстояние примерно равно сумме радиусов молекул) силы притяжения уравновешивают силы отталкивания, а проекция результирующей силы Fr = 0. Этому состоянию соответствует наиболее устойчивое расположение взаимодействующих молекул.
В общем случае результирующая сила равна:
| (1.3) |
При r > r0 притяжение молекул превосходит отталкивание, при r < r0– отталкивание молекул превосходит их притяжение.
Зависимость сил взаимодействия молекул от расстояния между ними качественно объясняет молекулярный механизм появления сил упругости в твёрдых телах.
При растяжении твёрдого тела частицы удаляются друг от друга на расстояния, превышающие r0. При этом появляются силы притяжения молекул, которые возвращают частицы в первоначальное положение.
При сжатии твёрдого тела частицы сближаются на расстояния, меньшие расстояния r0. Это приводит к увеличению сил отталкивания, которые возвращают частицы в первоначальное положение и препятствуют дальнейшему сжатию.
Если смещение молекул из положений равновесия мало, то силы взаимодействия растут линейно с увеличением смещения. На графике этот отрезок показан утолщённой линией светло-зелёного цвета.
Поэтому при малых деформациях (в миллионы раз превышающих размер молекул) выполняется закон Гука, согласно которому сила упругости пропорциональна деформации. При больших смещениях закон Гука не действует.
av-mag.ru