МКТ – это… Что такое МКТ?
МКТмолекулярно-кинетическая теория
физ.
МКТМосковский клуб туристов
Москва
МКТтабельный маскировочный комплект
МКТМинистерство курортов и туризма
гос.
МКТмонтажный кран тракторный
центр «Модернизация котельной техники»
техн.
МКТМосковское кабельное телевидение
Москва
МКТМеждународная конференция труда
- МКТ
многофункциональный кассовый терминал
ж.-д.
- МКТ
Источник: http://www.rzd-partner.ru/news/2008/04/01/321674.html
- МКТ
- мультитерминал
мультимодальный контейнерный терминал
- МКТ
Источник: http://www.logistics.ru/9/23/i20_22043p0.htm
МКТМеждународная коалиция по защите тигров
англ.: ITC, International tiger coalition
с 2008
КНР, организация, РФ, США
Источник: http://www.globaltigerinitiative.org/2009/07/09/zapret-support/
МКТмалый коммерческий транспорт
в маркировке, транспорт
МКТмедицинские компьютерные технологии
комп., мед., организация, техн.
Источник: http://www.rinti.ru/news/show.asp?id=202
Примеры использования
ООО «МКТ» в Краснодаре
НП «МКТ» в Алтайском крае
МКТмногоканальное телевидение
Источник: http://mktsystems.h21.ru/public1.htm
МКТэлектр.
техн.
Словарь сокращений и аббревиатур. Академик. 2015.
sokrasheniya.academic.ru
Расшифровка характеристик полимерных труб. Труба мкт расшифровка
Расшифровка аббревиатур на трубах для водоснабжения и отопления
Современный рынок стройматериалов предлагает широкий выбор самой разнообразной продукции, сориентироваться в качестве которой бывает довольно сложно. Чтобы купить правильные трубы для отопления и водоснабжения, необходимо внимательно изучить маркировку выбранного товара. Так, если вы меняете отопительную систему или приобретаете трубы для горячей воды, то товар должен иметь на этикетке следующие сокращения: PEX-AL-PEX, а также PE-RT-PE-RT. Только в этом случае качество труб будет соответствовать всем международным стандартам, принятым для такого рода продукции.
Все маркировки, которые встречаются на трубах, несут в себе определенную смысловую нагрузку. Аббревиатурой PE-X обозначается обладающий высокой прочностью сшитый полиэтилен, а буквы PE-RT присваиваются термостойкому пластику. Трубы из полиэтилена маркируются с помощью символов PE-R, а на изделиях из полипропилена указывается надпись PP-R.
Если вы приобрели материал из сшитого полиэтилена, то на его этикетке будет присутствовать одна из букв английского алфавита, обозначающая тип сшивки. Первые четыре буквы соответствуют пероксидному типу, сшивке с помощью газа, потока электронов, специфического соединения молекул.
Изучая нанесенные на этикетку труб обозначения, обязательно необходимо обращать внимание на характеристику типа жидкости, для которой предназначен товар. Кроме того, на изделиях указываются температурные показатели, при которых допускается их использование, а также максимально возможное давление.
На трубы наносится дата их производства, а также смена и машина, которая осуществляла выпуск изделия. Помимо этого в маркировке отображается документ, по которому определялось качество трубы. Как правило, товар данной группы должен соответствовать нормативному документу ISO 9001.
Знание того, как расшифровывается информация на этикетке труб, не только поможет вам выбрать качественный товар, но и облегчит ремонт всей системы.
Раковина для кухни: выбор размера, материала, покрытияРекомендации, которым нужно следовать при замене канализационных труб
www.684015.ru
Расшифровка характеристик полимерных т
pellete.ru
Основные положения МКТ | ЭТО ФИЗИКА
Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц химических веществ.
В основе молекулярно-кинетической теории лежат три основных положения:
1. Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов («элементарных молекул»). Молекулы химического вещества могут быть простыми и сложными, т.е. состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
2. Атомы и молекулы находятся в непрерывном хаотическом движении.
3. Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
|
Рисунок 3.1.1. Траектория броуновской частицы |
Наиболее ярким экспериментальным подтверждением представлений молекулярно-кинетической теории о беспорядочном движении атомов и молекул является броуновское движение. Это тепловое движение мельчайших микроскопических частиц, взвешенных в жидкости или газе. Оно было открыто английским ботаником Робертом Броуном
Главный вывод теории А. Эйнштейна состоит в том, что квадрат смещения <r2> броуновской частицы от начального положения, усредненный по многим броуновским частицам, пропорционален времени наблюдения
Это соотношение выражает так называемый диффузионный закон. Как следует из теории коэффициент пропорциональности D монотонно возрастает с увеличением температуры.
Постоянное хаотичное движение молекул вещества проявляется также в другом легко наблюдаемом явлении – диффузии. Диффузией называется явление проникновения двух или нескольких соприкасающихся веществ друг в друга. Наиболее быстро процесс протекает в газе, если он неоднороден по составу. Диффузия приводит к образованию однородной смеси независимо от плотности компонентов. Так, если в двух частях сосуда, разделенных перегородкой, находятся кислород O
Значительно медленнее протекают подобные процессы в жидкостях. Взаимопроникновение двух разнородных жидкостей друг в друга, растворение твердых веществ в жидкостях (например, сахара в воде) и образование однородных растворов – примеры диффузионных процессов в жидкостях.
В реальных условиях диффузия в жидкостях и газах маскируется более быстрыми процессами перемешивания, например, из-за возникновения конвекционных потоков.
Наиболее медленно процесс диффузии протекает в твердых телах. Однако, опыты показывают, что при контакте хорошо очищенных поверхностей двух металлов через длительное время в каждом из них обнаруживается атомы другого металла.
Диффузия и броуновское движение – родственные явления. Взаимопроникновение соприкасающихся веществ друг в друга и беспорядочное движение мельчайших частиц, взвешенных в жидкости или газе, происходят вследствие хаотичного теплового движения молекул.
Силы, действующие между двумя молекулами, зависят от расстояния между ними. Молекулы представляют собой сложные пространственные структуры, содержащие как положительные, так и отрицательные заряды. Если расстояние между молекулами достаточно велико, то преобладают силы межмолекулярного притяжения. На малых расстояниях преобладают силы отталкивания. Зависимости результирующей силы F и потенциальной энергии Eр взаимодействия между молекулами от расстояния между их центрами качественно изображены на рис. 3.1.2. При некотором расстоянии r = r0 сила взаимодействия обращается в нуль. Это расстояние условно можно принять за диаметр молекулы. Потенциальная энергия взаимодействия при r = r0 минимальна. Чтобы удалить друг от друга две молекулы, находящиеся на расстоянии r0, нужно сообщить им дополнительную энергию E0. Величина E0 называется глубиной потенциальной ямы или энергией связи.
|
Рисунок 3.1.2. Сила взаимодействия F и потенциальная энергия взаимодействия Eр двух молекул. F > 0 – сила отталкивания, F < 0 – сила притяжения |
Молекулы имеют чрезвычайно малые размеры. Простые одноатомные молекулы имеют размер порядка 10–10 м. Сложные многоатомные молекулы могут иметь размеры в сотни и тысячи раз больше.
Беспорядочное хаотическое движение молекул называется тепловым движением. Кинетическая энергия теплового движения растет с возрастанием температуры. При низких температурах средняя кинетическая энергия молекулы может оказаться меньше глубины потенциальной ямы E0. В этом случае молекулы конденсируются в жидкое или твердое вещество; при этом среднее расстояние между молекулами будет приблизительно равно r0. При повышении температуры средняя кинетическая энергия молекулы становится больше E0, молекулы разлетаются, и образуется газообразное вещество.
В твердых телах молекулы совершают беспорядочные колебания около фиксированных центров (положений равновесия). Эти центры могут быть расположены в пространстве нерегулярным образом (аморфные тела) или образовывать упорядоченные объемные структуры (кристаллические тела).
В жидкостях молекулы имеют значительно большую свободу для теплового движения. Они не привязаны к определенным центрам и могут перемещаться по всему объему. Этим объясняется текучесть жидкостей. Близко расположенные молекулы жидкости также могут образовывать упорядоченные структуры, содержащие несколько молекул. Это явление называется ближним порядком в отличие от дальнего порядка, характерного для кристаллических тел.
В газах расстояния между молекулами обычно значительно больше их размеров. Силы взаимодействия между молекулами на таких больших расстояниях малы, и каждая молекула движется вдоль прямой линии до очередного столкновения с другой молекулой или со стенкой сосуда. Среднее расстояние между молекулами воздуха при нормальных условиях порядка 10–8 м, т. е. в десятки раз превышает размер молекул. Слабое взаимодействие между молекулами объясняет способность газов расширяться и заполнять весь объем сосуда. В пределе, когда взаимодействие стремится к нулю, мы приходим к представлению об идеальном газе.
В молекулярно-кинетической теории количество вещества принято считать пропорциональным числу частиц. Единица количества вещества называется молем (моль).
Моль – это количество вещества, содержащее столько же частиц (молекул), сколько содержится атомов в 0,012 кг углерода 12C. Молекула углерода состоит из одного атома.
Таким образом, в одном моле любого вещества содержится одно и то же число частиц (молекул). Это число называется постоянной Авогадро NА:
NА = 6,02·1023 моль–1. |
Постоянная Авогадро – одна из важнейших постоянных в молекулярно-кинетической теории.
Количество вещества ν определяется как отношение числа N частиц (молекул) вещества к постоянной Авогадро NА:
Массу одного моля вещества принято называть молярной массой M. Молярная масса равна произведению массы m0 одной молекулы данного вещества на постоянную Авогадро:
Молярная масса выражается в килограммах на моль (кг/моль). Для веществ, молекулы которых состоят из одного атома, часто используется термин атомная масса.
За единицу массы атомов и молекул принимается 1/12 массы атома изотопа углерода 12C (с массовым числом 12). Она называется атомной единицей массы (а. е. м.):
1 а. е. м. = 1,66·10–27 кг. |
Эта величина почти совпадает с массой протона или нейтрона. Отношение массы атома или молекулы данного вещества к 1/12 массы атома углерода 12C называется относительной массой.
www.its-physics.org
Мкт – это… Что такое Мкт?
Молекулярно-кинетическая теория (сокращённо МКТ) — теория, рассматривающая строение вещества с точки зрения трёх основных приближенно верных положений:
Основное уравнение МКТ
где k является отношением газовой постоянной R к числу Авогадро, а i – число степеней свободы молекул.
Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) газовой системы с микроскопическими (масса молекул, средняя скорость их движения).
Вывод основного уравнения МКТ
Пусть имеется кубический сосуд с ребром длиной l и одна частица массой m в нём.
Обозначим скорость движения vx, тогда перед столкновением со стенкой сосуда импульс частицы равен mvx, а после – − mvx, поэтому стенке передается импульс p = 2mvx. Время, через которое частица сталкивается с одной и той же стенкой, равно .
Отсюда следует:
поэтому давление .
Соответственно, и .
Таким образом, для большого числа частиц верно следующее: , аналогично для осей y и z.
Поскольку , то .
Отсюда
или .
Пусть — средняя кинетическая энергия молекул, а Ek — полная кинетическая энергия всех молекул, тогда:
, откуда .
Уравнение среднеквадратичной скорости молекулы
Уравнение среднеквадратичной скорости молекулы легко выводится из основного уравнения МКТ для одного моля газа.
, для 1 моля N = Na, где Na — постоянная Авогадро
Nam = Mr, где Mr — молярная масса газа
Отсюда окончательно
Изопроцессы – это процессы, протекающие при значении одного из макроскопических параметров.
Существуют три изопроцесса: изотермический, изохорный, изобарный.
Wikimedia Foundation. 2010.
dic.academic.ru
Молекулярно-кинетическая теория: первое, второе, третье положения. Молекула, атом. Характеристики вещества: плотность, молярная масса, количество вещества, концентрация
Тестирование онлайн
Основное положение мкт. Основные понятия
Первое положение молекулярно-кинетической теории
Вещество состоит из частиц.
Молекула – это самая маленькая частица вещества, которая обладает его основными химическими свойствами.
Молекула состоит из атомов. Атом – наименьшая частица вещества, которая не делится при химических реакциях.
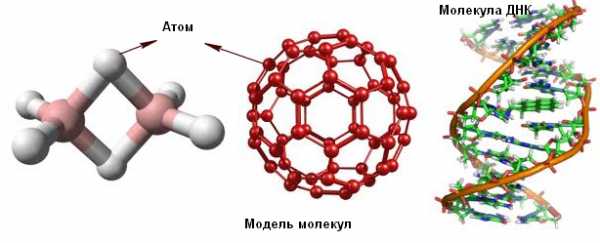
Многие молекулы состоят из двух или больше атомов, удерживаемых вместе химическими связями. Некоторые молекулы состоят из сотен тысяч атомов.
Второе положение молекулярно-кинетической теории
Молекулы находятся в непрерывном хаотическом движении. Это движение не зависит от внешних воздействий. Движение происходит в непредсказуемом направлении из-за столкновения молекул. Доказательством является броуновское движение частиц (открыто Р.Броуном 1827г). Частицы помещают в жидкость или газ и наблюдают их непредсказуемое движение из-за соударений с молекулами вещества.
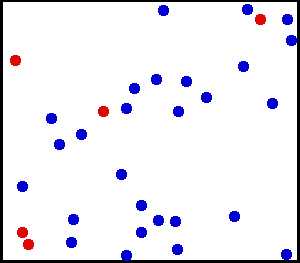
Броуновское движение
Доказательством хаотического движения является диффузия – проникновение молекул одного вещества в промежутки между молекулами другого вещества. Например, запах освежителя воздуха мы ощущаем не только в том месте, где его распылили, но он постепенно перемешивается с молекулами воздуха во всей комнате.
Агрегатное состояние вещества
В газах среднее расстояние между молекулами в сотни раз превышает их размеры. В основном молекулы движутся поступательно и равномерно. После столкновений начинают вращаться.
В жидкостях расстояние между молекулами значительно меньше. Молекулы совершают колебательное и поступательное движения. Молекулы через малые промежутки времени скачкообразно переходят в новые положения равновесия (мы наблюдаем текучесть жидкости).
В твердых телах молекулы колеблются и очень редко перемещаются (только при увеличении температуры).
Третье положение молекулярно-кинетической теории
Между молекулами существуют силы взаимодействия, которые имеют электромагнитную природу. Эти силы позволяют объяснить возникновение сил упругости. Когда вещество сжимают, молекулы сближаются, между ними возникает сила отталкивания, когда внешние силы отдаляют молекулы друг от друга (растягивают вещество), между ними возникает сила притяжения.
Плотность вещества
Это скалярная величина, которая определяется по формуле
Плотность веществ – известные табличные значения
Химические характеристики вещества
Постоянная Авогадро NA – число атомов, содержащихся в 12г изотопа углерода
Количество вещества – это отношение числа элементов этого вещества к постоянной Авогадро
1 моль любого вещества содержит одинаковое число частиц, это число равно постоянной Авогадро.
Молярная масса M – это масса одного моля вещества
Если тело состоит из N молекул массой m0, то масса тела
Концентрация частиц – это количество частиц в объеме
Можно вывести формулы
fizmat.by
ОК “Основное уравнение МКТ”
ОСНОВНОЕ УРАВНЕНИЕ МКТ.
Основное уравнение МКТ устанавливает связь между давлением газа и характеристиками его молекул (массой, скоростью и средней энергией).
При выводе уравнения будем исходить из основных положений МКТ, понятий идеального газа и механики Ньютона.
Идеи вывода:
1. Сначала определим среднюю силу удара одной молекулы о стенки сосуда.
2. Затем вычислим, сколько молекул ударяет о данную стенку за некоторое время t.
3. Перемножим силу на число ударов, разделим на площадь стенки и вычислим давление.
Из законов Ньютона нам известно, что при упругом ударе частица отскакивает с той же скоростью, при этом ее импульс изменяется на противоположный. Используя второй закон Ньютона в формулировке Ньютона Ft = mV – mVо мы легко вычисляем импульс силы. Он равен Ft = 2mV.
А: Вычисляем силу удара одной молекулы о стенку сосуда.
Двигаясь под некоторым углом к стенке, молекула сталкивается с ней и отскакивает по тем же углом. При этом вертикальная проекция скорости Vу не изменяется, а горизонтальная меняется на противоположную: Vx =-Vox.
Применяя второй закон Ньютона, вычисляем силу удара одной молекулы. Если при этом рассматривается некоторая средняя проекция скорости, то находится и средняя сила.
Б: Подсчитаем, сколько молекул ударяет о стенку за некоторое время.
Молекулы, двигаясь в некотором объёме, за время t пролетают расстояние АВ = Vx t. Если сечение сосуда S, то его оббьем V = АВ S. Пусть концентрация молекул в сосуде n = z/v, где общее число молекул z.
Так, как половина летит в обратную сторону, то в стенку ударяет z = nv/2. Итак, произведя вычисления, устанавливаем, что за время t в стенку ударяет z = молекул.
С: Вычислим давление газа.
Для этого определим силу удара всех молекул Fz, разделим на площадь и найдем давление p = Fz/S. Подставим в формулу вычисленные значения и произведем преобразования. Получим p = mnVx .
Но, знакомясь с идеальным газом, мы определили среднеквадратичное значение проекции скорости как .
Подставим в уравнение и получим p = mnV . Это и есть основное уравнение МКТ. Оно устанавливает связь параметров молекулы (массы, концентрации и среднеквадратичной скорости молекул с макроскопическим параметром газа – давлением).
Формулу можно представить и в другом виде. Так средняя кинетическая энергия молекулы E = mV /2 то можно представить основное уравнение и в следующем виде p = При этом давление газа определяется концентрацией молекул и средней кинетической энергией.
Несколько позже, используя это уравнение, мы установим связь между параметрами газа и выведем ряд газовых законов.
У Вас недостаточно прав для комментирования
- Просмотров: 618
www.shelita.info
1 Основные положения молекулярно-кинетической теории газа. Понятие о идеальном и реальном газе.
Основные положения МКТ:
1. Все вещества состоят из мельчайших частиц: молекул, атомов или ионов.
2. Эти частицы находятся в непрерывном хаотическом движении, скорость которого определяет температуру вещества.
3. Между частицами существуют силы притяжения и отталкивания, характер которых зависит от расстояния между ними.
Идеальный газ – это газ, взаимодействие между молекулами которого пренебрежимо мало.
Основные отличия идеального газа от реального: частицы идеального газа – шарики очень малых размеров, практически материальные точки; между частицами отсутствуют силы межмолекулярного взаимодействия; соударения частиц абсолютно упругие. Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева. Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определенный объем. Состояние реального газа часто на практике описывается обобщенным уравнением Менделеева — Клапейрона.
2 Параметры и функции состояния. Уравнение состояния идеального газа.
Параметры:
Давление обусловлено взаимодействием молекул рабочего тела с поверхностью и численно равно силе, действующей на единицу площади поверхности тела по нормали к последней.
Температурой называется физическая величина, характеризующая степень нагретости тела. С точки зрения молекулярно-кинетических представлений температура есть мера интенсивности теплового движения молекул.
Удельный объем v — это объем единицы массы вещества. Если однородное тело массой М занимает объем v, то по определению v= V/М. В системе СИ единица удельного объема 1 м3/кг. Между удельным объемом вещества и его плотность существует очевидное соотношение:
Если все термодинамические параметры постоянны во времени и одинаковы во всех точках системы, то такое состояние системы называется равновесным.
Для равновесной термодинамической системы существует функциональная связь между параметрами состояния, которая называется уравнением состояния
уравнение Клапейрона — Менделеева
3 Смеси газов. Кажущаяся молекулярная масса. Газовая постоянная смеси газов.
Смесь газов – механическое соединение не вступающих друг с другом химическую реакцию газов. Основным законом, определяющим поведение газовой смеси, является закон Дальтона: полное давление смеси идеальных газов равно сумме парциальных давлений всех входящих в нее компонентов:Парциальное давление pi — давление, которое имел бы газ, если бы он один при той же температуре занимал весь объем смеси. Газовую постоянную смеси определяют как:,- кажущаяся (средняя) молекулярная масса смеси. При объемном составе, при массовом составе:.-универсальная газовая постоянная.
4 Первый закон термодинамики.
Первый закон термодинамики – это закон сохранения энергии, записанный с помощью термодинамических понятий (аналитическая формулировка: вечный двигатель 1 рода невозможен):
Энергия. Под внутренней энергией в термодинамике понимают кинетическую энергию движения молекул, потенциальную энергию их взаимодействия и нулевая (энергея движения частиц внутри молекулы при T=0K). Кинетическая энергия молекул является функцией температуры, значение потенциальной энергии зависит от среднего расстояния между молекулами и, следовательно, от занимаемого газом объема V, т. е. является функцией V. Поэтому внутренняя энергия U есть функция состояния тела.
Теплота. Энергия, предаваемая от одного тела к другому за счет разности температур, называется теплотой. Теплота может передаваться либо при непосредственном контакте между телами (теплопроводностью, конвекцией), либо на расстоянии (излучением), причем во всех случаях этот процесс возможен только при наличии разности температур между телами.
Работа. Энергия, передаваемая от одного тела к другому при изменении объема этих тел или перемещение в пространстве, называется работой. При конечном изменении объема работа против сил внешнего давления, называемая работой расширения, равна Работа изменения объема эквивалентна площади под кривой процесса в диаграмме р, v.
Внутренняя энергия — это свойство самой системы, она характеризует состояние системы. Теплота и работа — это энергетические характеристики процессов механического и теплового взаимодействий системы с окружающей средой. Они характеризуют те количества энергии, которые переданы системе или отданы ею через ее границы в определенном процессе.
Выражение первого закона термодинамики
studfiles.net


