Нанотехнологии в медицине и фармации
М.А.ПАЛЬЦЕВ, академик РАН и РАМН
«Ремедиум» № 9-2008.
Впервые термин «нанотехнология» применил Норио Танигучи, инженер из Токийского университета, в 1974 г. в статье, которая посвящалась обработке материалов. Прошло еще 20 лет, прежде чем термин был введен в широкий научный оборот. Сегодня нанотехнологии являются одной из наиболее интенсивно развивающихся областей науки в самых разных отраслях, в т.ч. в медицине и фармации.
Развивать нанотехнологии сегодня стремятся не только ведущие индустриальные державы, но и развивающиеся страны, в частности в Азиатско-тихоокеанском регионе. Самые масштабные государственные научно-исследовательские программы в области нанотехнологий реализуют США и Япония, инвестиции в эти программы составляют у них более 1 млрд. долл. США в год. С 1997 г. объем инвестиций в эти технологии в мире вырос на порядок и в 2004 г. составил 4,6 млрд. долл.
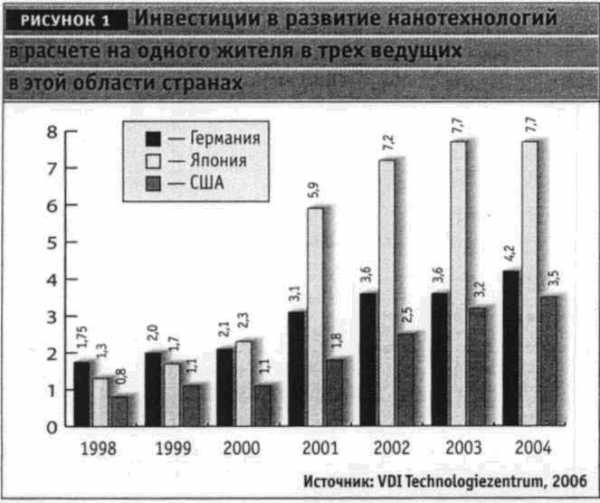
В США, например, развитие биотехнологий рассматривается в качестве основного мотора инноваций, который должен способствовать конкурентоспособности североамериканских продуктов на мировом рынке. Частные инвестиции в биотехнологии в США превышают государственные, и это свидетельствует как о достаточном уровне зрелости наноразработок, так и об их высоком экономическом потенциале.
В последние годы быстрыми темпами развивается также наномедицина, которая привлекает всеобщее внимание не только чисто научными достижениями, но и социальной значимостью. Под этим термином сегодня понимают применение нанотехнологий в диагностике, мониторинге и лечении заболеваний.
Развитие наномедицины тесно связано с революционными достижениями геномики и протеомики, которые позволили ученым приблизиться к пониманию молекулярных основ болезней. Наномедицина развивается там, где данные геномики и протеомики сочетаются с возможностями, позволяющими создать материалы с новыми свойствами на нанометрическом уровне. Выделяют 5 основных областей применения нанотехнологий в медицине: доставка активных лекарственных веществ, новые методы и средства лечения на нанометровом уровне, диагностика in vivo, диагностика in vitro, медицинские имплантаты (Wagner V., Wechsler D., 2004).
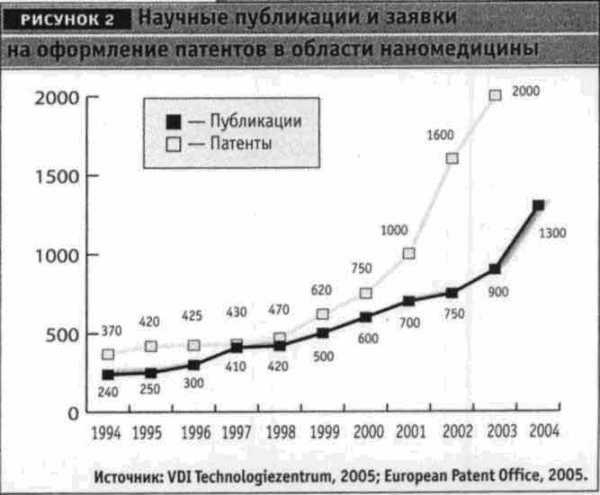
О значении наномедицины свидетельствует поступательный рост публикаций на эту тему в международных научных журналах (рис. 2). В течение 10 лет количество научных публикаций по наномедицине в мире увеличилось в 4 раза. Растет также число патентных заявок на изобретения, а это указывает на увеличивающуюся коммерциализацию данной сферы. Бесспорным лидером и по научным публикациям, и по числу патентных заявок являются США – оттуда приходят ежегодно 32% публикаций и 53% заявок, следом идут Германия (8% публикаций и 10% заявок) и Япония (9 и 6%, соответственно).
Движущей силой многих наномедицинских инноваций являются start-up-компании, строящие свою стратегию на внедрении и коммерциализации инноваций.
Интерес фармацевтической и медицинской промышленности к нанотехнологиям в последние годы значительно повысился, поэтому следует ждать значительных вложений в эту область. В недалеком будущем нанотехнологии будут играть одну из ведущих ролей в качестве движущей силы инноваций в медицине.
Уже в 2004 г. мировой оборот наномедицинских препаратов оценивался экспертами в 6 млрд. долл. Правда, в этих подсчетах эксперты относят к наномедицинским любые медицинские технологии, в которых используются наноматериалы или нанотехнологии. Так, применение наночастиц золота в экспресс-диагностике является лишь одной из составных частей диагностического теста, но их присутствие дает основание экспертам причислить данный способ диагностики к нанотехнологиям.
Более 50% фармацевтических компаний-производителей, которые активно работают в области наномедицины, используют нанотехнологии для разработки систем доставки активных лекарственных веществ к органам и тканям-мишеням. Эти препараты дают сегодня 80% оборота в мировой наномедицине. Одной из ведущих областей применения таких систем является онкология. Применение систем доставки направлено на уменьшение неблагоприятных побочных эффектов ЛС. Среди этих нанопрепаратов уже имеются два блокбастера, не считая других успешных препаратов, вместе их оборот составляет 5 млрд. долл.
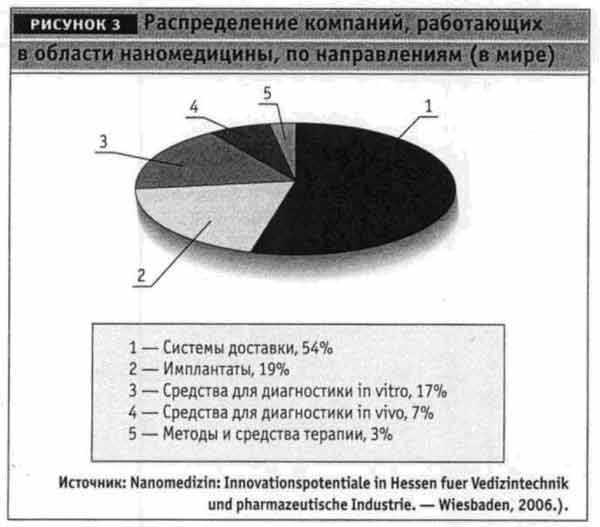
Значительно ниже доля предприятий, производящих на нанотехнологической основе имплантаты (19%) и средства для диагностики in vitro (17%). Наиболее сложными проблемами – разработкой методов и средств лечения на основе принципиально новых терапевтических концепций – занимаются лишь 3% компаний (рис. 3).
Системы доставки активных веществ
В 60-е годы прошлого века были получены липосомы, способные доставлять в орган-мишень лекарственное вещество. Различают два вида липосом: мультиламелларные липосомы, диаметр которых может составлять до 10 µm, и состоящие из одной ламеллы (пластинки) с диаметром примерно от 20 до 50 nm. Последние используются в качестве средства доставки активного лекарственного вещества.
Полимерные наночастицы было предложено использовать в качестве систем доставки в 70-х гг. ХХ в. (Ravi Kumar, 2000, 2003). Исходным материалом для них могут служить различные естественные или биоинертные синтетические полимеры, например, полисахариды, полимолочная кислота, полилактиды, полиакрилаты, акрилполимеры и др. Под термином «полимерные наночастицы» понимают два морфологически различных вида частиц: наносферы и нанокапсулы. Наносферы представляют собой сплошные полимерные матрицы, на которых распределяется активное вещество. Нанокапсулы состоят из полимерной оболочки, охватывающей наполненную жидкостью полость. Эти виды наночастиц различаются по высвобождению активного лекарственного вещества: из наносфер высвобождение протекает по экспоненте, а из нанокапсул – в течение длительного времени константно.
Еще один тип систем доставки лекарственных активных веществ обязан достижениям в области разработки дефинированных поливалентных и дендритических полимеров. Здесь примерами могут послужить полианионные полимеры – ингибиторы клеточных связей с вирусами, поликатионные комплексы с ДНК или РНК (т.н. полиплексы) и дендритические частицы (Haag R., Kratz F., 2006).
К сожалению, несмотря на высокий потенциал эффективности, системы доставки активных веществ в органы и ткани-мишени связаны и с нежелательными побочными эффектами. Так, фармацевтический гигант Novartis, концерн Ciba после анализа данных по безопасности различных систем доставки, приняли решение сосредоточиться на разработке ЛС с расщепляемым наноносителями, поскольку безопасность стабильных наночастиц вызывает сомнения и нужны дополнительные исследования для ее подтверждения (Feiertaf A., 2007).
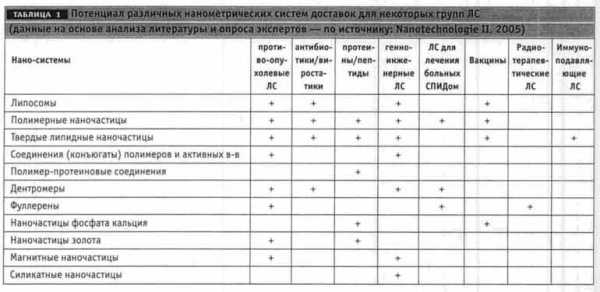
Поиск альтернативных систем продолжается. Наряду с совершенствованием известных систем доставки разрабатываются новые – соединения полимеров с активными веществами, полимерные мицеллы, неорганические наночастицы, твердые липидные наночастицы, фуллерены (табл. 1). Последние, по мнению экспертов, могут стать основой не только для систем доставки, но и для нового класса ЛС (Gorman, 2002, Csixty, 2003). На основе фуллеренов разрабатываются препараты – средства доставки ЛС для лечения ВИЧ-инфицированных пациентов и онкологических больных.
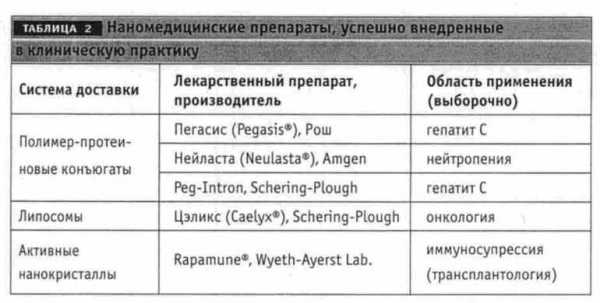
Системы доставки имеют большое значение для ЛС на основе протеинов, действие которых зачастую снижается из-за ограниченного времени нахождения в крови, химической лабильности и способности провоцировать иммунную реакцию. С помощью систем доставки ученые пытаются улучшить аппликационные свойства протеиновых препаратов. Благодаря присоединению к протеину полимерной цепочки удается не только увеличить период их полураспада в крови, но и повысить их эффективность. Сегодня известны два бестселлера среди нанофармацевтических препаратов – полимер-протеиновый конъюгат, Пегасис (Pegasys – пэгилированный альфа2а-интерферон) для лечения гепатита С и Нейласта (Neulasta – пегилированный hG-CSF) для терапии нейтропении (табл. 2).
Активные вещества и новые способы лечения
Нанометровые молекулы могут применяться непосредственно в качестве активных веществ. В частности, интересным классом молекул с этой точки зрения являются дендримеры. Эти разветвленные, как крона дерева, молекулы (отсюда их название) могут достигать размера мелких протеинов. По сравнению с классическими полимерными молекулами они обладают тем преимуществом, что можно контролировать их синтез с заданными свойствами, т.е. запрограммировать для определенного медицинского применения. Кроме того, на поверхности можно расположить специфическим образом определенные функциональные группы, так что они будут особенно эффективно взаимодействовать с вирусами и клетками. Примером создания активного вещества на основе дендримера является препарат Vivigel – гель, способный защитить от ВИЧ-инфекции. Вивигель разработан австралийской биотехнологической компанией Starpharma, сейчас проходят его клинические исследования.
Одним из новых принципов является размельчение активных лекарственных веществ до нанометровых размеров. Так пытаются решить проблему недостаточной растворимости ЛС: 40% новых активных веществ, которые сейчас находятся в разработке, растворяются плохо и, соответственно, обладают недостаточной биодоступностью.
В 90-е годы удалось получить наночастицы активного лекарственного вещества, т.н. активные нанокристаллы, с помощью процессов размельчения или гипербарической гомогенизации (Mueller et al., 2001). Эти наночастицы на 100% состоят из активного вещества и производятся в виде суспензии (наносуспензии), которую можно вводить внутривенно, а для перорального приема можно производить гранулы или таблетки из суспензии. При этом не нужна полимерная матрица, разрушение которой, как считают некоторые ученые, может оказывать токсическое действие на клетки. Обычный размер нанокристаллов составляет 200-600 nm. Для улучшения аппликационных свойств нанокристаллических лекарственных средств проводят модификацию поверхности кристаллов. В этом направлении работают компании Wyeth-Ayers Laboratories (США), PharmaSol (ФРГ), SkyePharma (Великобритания), Merck&Co. (США) и многие др. Одним из нанокристаллических препаратов, внедренных в клиническую практику в 2000 г., является Rapamune (Wyeth-Ayers Laboratories) – иммуносупрессивное ЛС, которое применяют после трансплантации органов. При производстве этого препарата была применена технология Nano-Crystal® (разработчик – Elan). А в 2003 г. фармконцерны Merck&Co. и Johnson&Johnson заключили контракт с компанией Elan на применение этой технологии при производстве других инновационных ЛС.
Иная концепция заложена в основу термотерапии наночастицами. Это новый способ лечения раковых опухолей. Суть метода в том, что наночастицы вводят в опухоль, а затем либо за счет воздействия магнитного поля, либо лазерного облучения их нагревают, при этом опухолевые клетки разрушаются. Впервые эта медицинская технология была предложена более 15 лет назад учеными из университетской клиники Шарите (Берлин) под руководством д-ра Йордана (Jordan). За эту разработку в 2005 г. ученые были отмечены премией Frost&Sullivan Award for Technology Innovation. В 2003 г. разработка была передана коммерческой нанотехнологической компании для доведения и внедрения. Тогда же начались клинические исследования термотерапии опухолей мозга и рака предстательной железы. Сегодня в этом направлении работает целый ряд компаний в Европе (например, Magnamedics, Ахен) и США (Nanospectra Bioscience, Хьюстон).
Диагностика in vivo
Революционные достижения геномики и молекулярной биологии привели к лучшему пониманию молекулярных процессов, которые лежат в основе болезней. Диагностику, основанную на передаче визуальной информации о молекулярных структурах, можно назвать молекулярной визиографией. Здесь используется тот же принцип, что и при традиционных методах получения изображений – радиографии, эхографии, УЗИ и т.д., только требуется иное контрастное вещество, а также специальные медицинские приборы и системы обработки данных.
Контрастное вещество для молекулярной диагностики состоит из наночастиц, с которыми соединены визуализирующие компоненты и определенные антитела либо какие-нибудь другие молекулы, способные отыскать цель. Когда контрастное вещество вводится в кровеносное русло, его поисковые компоненты взаимодействуют с целевыми структурами на поверхности больной клетки по принципу «ключ-замок», и визуализирующие компоненты попадают в больные ткани. После этого остается «считать» визуализированную информацию. Над этой концепцией работает компания Kereos (Ст.Луис), которая разрабатывает контрастные вещества на основе наноэмульсии перфторкарбона, каждая капелька которой несет по нескольку тысяч атомов гадолиниума. Таким образом, резко повышается контрастность. Эти препараты компания разрабатывает в сотрудничестве с мировыми концернами Philips и Bristol-Myers Squibb.
Сложные молекулярные контрастные вещества, создаваемые на основе нанотехнолоий, пока еще не доступны для клинической практики. Но уже внедрены простые контрастные вещества, которые состоят из наночастиц окиси железа. Они обеспечивают высокую контрастность в диагностике заболеваний печени. Такое контрастное вещество разработала и внедрила под торговой марктй Resovist® компания Schering.
Диагностика in vitro
Эксперты указывают, что нанотехнологии способствовали ренессансу биосенсорики, т.к. они позволили осуществить совершенно новые сенсорные концепции. Нанотехнологии в диагностике in vitro развиваются в двух направлениях: 1) использование наночастиц как маркеров биологических молекул; 2) применение инновационных нанотехнологических способов измерения.
Фирма Nanosphere из Иллинойса разработала новые диагностические тесты для выявления онкологических заболеваний, болезни Альцгеймера и муковисцидоза. Причем заявлено, что новый диагностический тест для муковисцидоза будет стоить в 10 раз дешевле имеющихся сегодня.
К новым наномедицинским диагностическим тестам относятся также сенсорные системы Cantilever и SPR (поверхностный плазменный резонанс). Сенсор Cantilever состоит из искусственных балок длиной от нескольких 10 до 200 µm и толщиной от нанометров до микрометров. Балки покрываются слоем молекул ДНК или протеинов, которые специфически взаимодействуют с целевыми биомолекулами в пробе. Это взаимодействие приводит к отклонению балки, движение которой улавливает лазерный детектор. По сравнению со многими оптическими методами сенсор Cantilever обладает тем преимуществом, что молекулы в пробе не требуют маркировки, и за счет этого процедура диагностики существенно упрощается. Сенсор SPR позволяет измерять взаимодействие между протеинами или протеинами и ДНК в режиме реального времени за счет определенного расположения нанослоев и разной интенсивности отраженного света в зависимости от массы биомолекул в слое. Эти приборы уже нашли широкое применение в медицинском материаловедении.
Стоит упомянуть еще диагностическую систему Quicklab, предназначенную для экспресс-диагностики. Это малогабаритный электронный прибор с биочипом с нанометровыми электродами. Молекулы ДНК и протеины определяются биохимическим методом. Принцип разработан Институтом кремниевых технологий (ФРГ) и воплощен концерном Siemens Corp. Technology. Прибор предназначен для диагностики инфекционных заболеваний, заражения крови, воспаления легких, болезней мочеполовых путей.
Имплантаты и биоматериалы
Имплантология получила в последние десятилетия импульс для развития в связи с потребностью в способах и средствах восстановления или замещения органов и тканей. Ряд фирм уже давно работают с нанокристаллическими материалами и покрытием поверхности имплантатов гидроксиапатитом.
Другим методом является нанокристаллическое алмазное покрытие, которое также обещает увеличить продолжительность функционирования и стабильность имплантатов. В экспериментах уже показано, что остеобласты распознают алмазные субмикроструктуры и могут закрепляться на них. Эти результаты указывают на прекрасную биосовместимость алмазных покрытий.
Материалы из нанокристаллического гидроксилапатита применяются для лечения костных дефектов, причем благодаря нанокристаллической структуре в таком имплантате могут закрепляться костеобразующие клетки и процесс остеогенеза практически включает искусственный материал в естественную кость.
Недавно начало развиваться еще одно направление нанотехнологических биоматериалов – нановолокна, которые ученые предполагают использовать при тканевом инжиниринге – создании искусственных тканей (в перспективе – возможно также и органов) на основе клеточных технологий.
Заключение
Таким образом, сегодня закладывается фундамент применения нанотехнологий практически во всех областях медицины (табл. 3). При этом в системах доставки и в диагностике in vivo в настоящее время преимущественно используются наночастицы как носители активных лекарственных или контрастных веществ в пораженные органы и ткани-мишени.
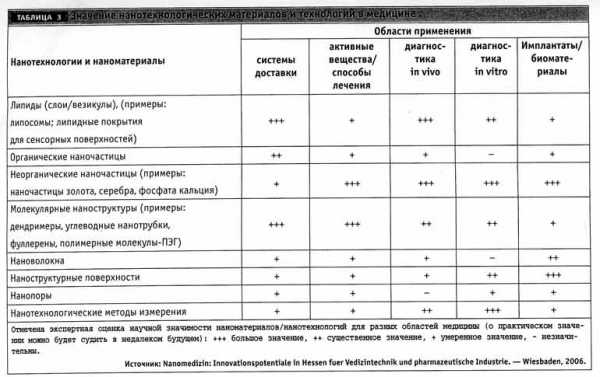
В разработках новых активных веществ и способов лечения, во-первых, используется фармацевтический потенциал определенных молекулярных наносистем (дендримеры, фуллерены), во-вторых, могут использоваться наночистицы в комбинации с термическим или механическим действием магнитных полей, лазерного излучения, ультразвука и пр. Быстрыми темпами развивается нанотехнологическая диагностика in-vitro: здесь используется широкий арсенал возможностей нанотехнологий – от наночастиц с маркерами до биочипов. В области разработки биоматериалов внимание исследователей приковано опять-таки к наночастицам, в том числе нанокристаллам, которые должны поднять на новый уровень современную имплантологию, ортопедию, стоматологию.
Портал «Вечная молодость» www.vechnayamolodost.ru
07.04.2009
www.vechnayamolodost.ru
Нанотехнологии в медицине и фармации — реферат
Нанотехнологии
в медицине и фармации
Впервые термин «нанотехнология» применил Норио Танигучи, инженер из Токийского университета, в 1974 г. в статье, которая посвящалась обработке материалов. Прошло еще 20 лет, прежде чем термин был введен в широкий научный оборот. Сегодня нанотехнологии являются одной из наиболее интенсивно развивающихся областей науки в самых разных отраслях, в т.ч. в медицине и фармации.
Развивать нанотехнологии сегодня стремятся не только ведущие индустриальные державы, но и развивающиеся страны, в частности в Азиатско-Тихоокеанском регионе. Самые масштабные государственные научно-исследовательские программы в области нанотехнологии реализуют США и Япония, инвестиции в эти программы составляют у них более 1 млрд. долл. в год. С 1997 г. объем инвестиций в эти технологии в мире вырос на порядок и в 2004 г. составил 4,6 млрд. долл (Nanotech Report 2004. – Lux Research, New York, 2004) (рис. 1).
В США, например, развитие биотехнологий рассматривается в качестве основного мотора инноваций, который должен способствовать конкурентоспособности североамериканских продуктов на мировом рынке. Частные инвестиции в биотехнологии в США превышают государственные, и это свидетельствует как о достаточном уровне зрелости наноразработок, так и об их высоком экономическом потенциале. В последние годы быстрыми темпами развивается также наномедицина, которая привлекает всеобщее внимание не только чисто научными достижениями, но и социальной значимостью. Под этим термином сегодня понимают применение нанотехнологии в диагностике, мониторинге и лечении заболеваний. Развитие наномедицины тесно связано с революционными достижениями геномики и протеомики, которые позволили ученым приблизиться к пониманию молекулярных основ болезней. Наномедицина развивается там, где данные геномики и протеомики сочетаются с возможностями, позволяющими создать материалы с новыми свойствами на нанометрическом уровне. Выделяют 5 основных областей применения нанотехнологий в медицине: доставка активных лекарственных веществ, новые методы и средства лечения на нанометровом уровне, диагностика in vivo, диагностика in vitro, медицинские имплантаты (Wagner V., Wechsler D, 2004).
О значении наномедицины свидетельствует поступательный рост публикаций на эту тему в международных научных журналах (рис. 2). В течение 10 лет количество научных публикаций по наномедицине в мире увеличилось в 4 раза. Растет также число патентных заявок на изобретения, а это указывает на увеличивающуюся коммерциализацию данной сферы. Бесспорным лидером и по научным публикациям, и по числу патентных заявок являются США — оттуда приходят ежегодно 32% публикаций и 53% заявок, следом идут Германия (8% публикаций и 10% заявок) и Япония (9 и 6%, соответственно). Движущей силой многих наномедицинских инноваций являются start-up-компании, строящие свою стратегию на внедрении и коммерциализации инноваций.
Интерес фармацевтической
и медицинской промышленности к
нанотехнологиям в последние годы значительно
повысился, поэтому следует ждать значительных
вложений в эту область. В недалеком будущем
нанотехнологии будут играть одну из ведущих
ролей в качестве движущей силы инноваций
в медицине.
Уже в 2004 г. мировой оборот наномедицинских
препаратов оценивался экспертами в 6
млрд. долл (VDI Technologiezentrum GmbH, 2006). Правда,
в этих подсчетах эксперты относят к наномедицинским
любые медицинские технологии, в которых
используются наноматериалы или нанотехнологии.
Так, применение наночастиц золота в экспресс-диагностике
является лишь одной из составных частей
диагностического теста, но их присутствие
дает основание экспертам причислить
данный способ диагностики к нанотехнологиям.
Более 50% фармацевтических компаний-производителей, которые активно работают в области наномедицины, используют нанотехнологии для разработки систем доставки активных лекарственных веществ к органам и тканям-мишеням. Эти препараты дают сегодня 80% оборота в мировой наномедицине. Одной из ведущих областей применения таких систем является онкология. Использование систем доставки направлено на уменьшение неблагоприятных побочных эффектов ЛС. Среди этих нанопрепаратов уже имеются два блокбастера, не считая других успешных препаратов, вместе их оборот составляет 5 млрд. долл. Значительно ниже доля предприятий, производящих на нанотехнологической основе имплантаты (19%) и средства для диагностики in vitro (17%). Наиболее сложными проблемами — разработкой методов и средств лечения на основе принципиально новых терапевтических концепций — занимаются лишь 3% компаний (рис. 3).
СИСТЕМЫ ДОСТАВКИ
АКТИВНЫХ ВЕЩЕСТВ
В 60-е годы прошлого века были получены
липосомы, способные доставлять в орган-мишень
лекарственное вещество. Различают два
вида липосом: мультиламелларные липосомы,
диаметр которых может составлять до 10
µm, и состоящие из одной ламеллы (пластинки)
с диаметром примерно от 20 до 50 nm. Последние
используются в качестве средства доставки
активного лекарственного вещества. Полимерные
наночастицы было предложено использовать
в качестве систем доставки в 70-х годах
XX в. (Ravi Kumar, 2000, 2003). Исходным материалом
для них могут служить различные естественные
или биоинертные синтетические полимеры,
например, полисахариды, полимолочная
кислота, полилактиды, полиакрилаты, акрилполимеры
и др. Под термином «полимерные наночастицы»
понимают два морфологически различных
вида частиц: наносферы и нанокапсулы.
Наносферы представляют собой сплошные
полимерные матрицы, на которых распределяется
активное вещество. Нанокапсулы состоят
из полимерной оболочки, охватывающей
наполненную жидкостью полость. Эти виды
наночастиц различаются по высвобождению
активного лекарственного вещества: из
наносфер высвобождение протекает по
экспоненте, а из нанокапсул — в течение
длительного времени константно.
Еще один тип систем доставки лекарственных
активных веществ обязан достижениям
в области разработки дефинированных
поливалентных и дендритических полимеров.
Здесь примерами могут послужить полианионные
полимеры — ингибиторы клеточных связей
с вирусами, поликатионные комплексы с
ДНК или РНК (т.н. полиплексы) и дендритные
клетки (Haag R., Kratz F., 2006).
К сожалению,
несмотря на высокий потенциал
Поиск альтернативных систем продолжается.
Наряду с совершенствованием известных
систем доставки разрабатываются новые
— соединения полимеров с активными веществами,
полимерные мицеллы, неорганические наночастицы,
твердые липидные наночастицы, фуллерены
(табл. 1).
Последние,
по мнению экспертов, могут стать
основой не только для систем доставки,
но и для нового класса ЛС (Gorman, 2002,
Csixty, 2003). На основе фуллеренов разрабатываются
препараты — средства доставки ЛС для
лечения ВИЧ-инфицированных пациентов
и онкологических больных.
Системы доставки имеют большое значение
для ЛС на основе протеинов, действие которых
зачастую снижается из-за ограниченного
времени нахождения в крови, химической
лабильности и способности провоцировать
иммунную реакцию. С помощью систем доставки
ученые пытаются улучшить аппликационные
свойства протеиновых препаратов. Благодаря
присоединению к протеину полимерной
цепочки удается не только увеличить период
их полураспада в крови, но и повысить
их эффективность. Сегодня известны два
бестселлера среди нанофармацевтических
препаратов — полимер-протеиновый конъюгат
Пегасис (Pegasys — пэги лированный альфа2а-интерферон)
для лечения гепатита С и Нейласта (Neulasta
— пегилированный hG-CSF) для терапии нейтропении
(табл. 2).
АКТИВНЫЕ ВЕЩЕСТВА
И НОВЫЕ СПОСОБЫ
ЛЕЧЕНИЯ
Нанометровые молекулы могут применяться
непосредственно в качестве активных
веществ. В частности, интересным классом
молекул с этой точки зрения являются
дендримеры. Эти разветвленные, как крона
дерева, молекулы (отсюда их название)
могут достигать размера мелких протеинов.
По сравнению с классическими полимерными
молекулами они обладают тем преимуществом,
что можно контролировать их синтез с
заданными свойствами, т.е. запрограммировать
для определенного медицинского применения.
Кроме того, на поверхности можно расположить
специфическим образом определенные функциональные
группы, так чтобы они особенно эффективно
взаимодействовали с вирусами и клетками.
Примером создания активного вещества
на основе дендримера является препарат
Vivigel -гель, способный защитить от ВИЧ-инфекции.
Вивигель разработан австралийской биотехнологической
компанией Starpharma, сейчас проходят его
клинические исследования.
Одним из новых принципов является размельчение
активных лекарственных веществ до нанометровых
размеров. Так пытаются решить проблему
недостаточной растворимости ЛС: 40% новых
активных веществ, которые сейчас находятся
в разработке, растворяются плохо и, соответственно,
обладают недостаточной биодоступностью.
В 90-е годы удалось получить наночастицы
активного лекарственного вещества, т.н.
активные нанокристаллы, с помощью процессов
размельчения или гипербарической гомогенизации
(Mueller et al., 2001). Эти наночастицы на 100% состоят
из активного вещества и производятся
в виде суспензии (наносуспензии), которую
можно вводить внутривенно, а для перорального
приема можно производить гранулы или
таблетки из суспензии. При этом не нужна
полимерная матрица, разрушение которой,
как считают некоторые ученые, может оказывать
токсическое действие на клетки. Обычный
размер нанокристаллов составляет 200—600
nm. Для улучшения аппликационных свойств
нанокристаллических ЛС проводят модификацию
поверхности кристаллов. В этом направлении
работают компании Wyeth-Ayers Laboratories (США),
PharmaSol (ФРГ), SkyePharma (Великобритания), Merck&Co.
(США) и многие другие. Одним из нанокристаллических
препаратов, внедренных в клиническую
практику в 2000 г., является Rapamune (Wyeth-Ayers
Laboratories) — иммуносупрессивное ЛС, которое
применяют после трансплантации органов.
При производстве этого препарата была
применена технология Nano-Crystal® (разработчик
— Elan). А в 2003 г. фармконцерны Merck&Co. и
Johnson&Johnson заключили контракт с компанией
Elan на применение этой технологии при
производстве других инновационных ЛС.
Иная концепция заложена в основу термотерапии
наночастицами. Например, новый способ
лечения раковых опухолей заключается
в том, что наночастицы вводят в опухоль,
а затем либо за счет воздействия магнитного
поля, либо лазерного облучения их нагревают,
при этом опухолевые клетки разрушаются.
Впервые эта медицинская технология была
предложена более 15 лет назад учеными
из университетской клиники Шарите (Берлин)
под руководством д-ра Йордана (Jordan). За
эту разработку в 2005 г. ученые были отмечены
премией Frost&Sullivan Award for Technology Innovation. В
2003 г. разработка была передана коммерческой
нанотехнологической компании для доведения
и внедрения. Тогда же начались клинические
исследования термотерапии опухолей мозга
и рака предстательной железы. Сегодня
в этом направлении работает целый ряд
компаний в Европе (например, Magnamedics, Ахен)
и США (Nanospectra Bioscience, Хьюстон).
ДИАГНОСТИКА IN VIVO
Революционные достижения геномики и
молекулярной биологии привели к лучшему
пониманию молекулярных процессов, которые
лежат в основе болезней. Диагностику,
основанную на передаче визуальной информации
о молекулярных структурах, можно назвать
молекулярной визиографией. Здесь используется
тот же принцип, что и при традиционных
методах получения изображений — радиографии,
эхографии, УЗИ и т.д., только требуется
иное контрастное вещество, а также специальные
медицинские приборы и системы обработки
данных.
Контрастное
вещество для молекулярной диагностики
состоит из наночастиц, с которыми соединены
визуализирующие компоненты и определенные
антитела либо какие-нибудь другие молекулы,
способные отыскать цель. Когда контрастное
вещество вводится в кровеносное русло,
его поисковые компоненты взаимодействуют
с целевыми структурами на поверхности
больной клетки по принципу «ключ-замок»,
и визуализирующие компоненты попадают
в больные ткани. После этого остается
«считать» визуализированную информацию.
Над этой концепцией работает компания
Kereos (СтЛуис), которая разрабатывает контрастные
вещества на основе наноэмульсии перфторкарбона,
каждая капелька которой несет по нескольку
тысяч атомов гадолиниума. Таким образом,
резко повышается контрастность. Эти препараты
компания разрабатывает в сотрудничестве
с мировыми концернами Philips и Bristol-Myers Squibb.
Сложные молекулярные контрастные вещества,
создаваемые на основе нанотехнолоий,
пока еще не доступны для клинической
практики. Но уже внедрены простые контрастные
вещества, которые состоят из наночастиц
окиси железа. Они обеспечивают высокую
контрастность в диагностике заболеваний
печени. Такое контрастное вещество разработала
и внедрила под торговой маркой Resovist®
компания Schering.
ДИАГНОСТИКА IN VITRO
Эксперты указывают, что нанотехнологии
способствовали ренессансу биосенсорики,
т.к. они позволили осуществить совершенно
новые сенсорные концепции. Нанотехнологии
в диагностике in vitro развиваются в двух
направлениях: 1) использование наночастиц
как маркеров биологических молекул; 2)
применение инновационных нанотехнологических
способов измерения. Фирма Nanosphere из Иллинойса
разработала новые диагностические тесты
для выявления онкологических заболеваний,
болезни Альцгеймера и муковисцидоза.
Причем заявлено, что новый диагностический
тест для муковисцидоза будет стоить в
10 раз дешевле имеющихся сегодня. К новым
наномедицинским диагностическим тестам
относятся также сенсорные системы Cantilever
и SPR (поверхностный плазменный резонанс).
Сенсор Cantilever состоит из искусственных
балок длиной от нескольких десятков до
200 µm и толщиной от нанометров до микрометров.
Балки покрываются слоем молекул ДНК или
протеинов, которые специфически взаимодействуют
с целевыми биомолекулами в пробе. Это
взаимодействие приводит к отклонению
балки, движение которой улавливает лазерный
детектор. По сравнению со многими оптическими
методами сенсор Cantilever обладает тем преимуществом,
что молекулы в пробе не требуют маркировки,
и за счет этого процедура диагностики
существенно упрощается. Сенсор SPR позволяет
измерять взаимодействие между протеинами
или протеинами и ДНК в режиме реального
времени за счет определенного расположения
нанослоев и разной интенсивности отраженного
света в зависимости от массы биомолекул
в слое. Эти приборы уже нашли широкое
применение в медицинском материаловедении.
Стоит упомянуть еще диагностическую
систему Quicklab, предназначенную для экспресс-диагностики.
Это малогабаритный электронный прибор
с биочипом с нанометровыми электродами.
Молекулы ДНК и протеины определяются
биохимическим методом. Принцип разработан
Институтом кремниевых технологий (ФРГ)
и воплощен концерном Siemens Corp. Technology. Прибор
предназначен для диагностики инфекционных
заболеваний, заражения крови, воспаления
легких, болезней мочеполовых путей.
ИМПЛАНТАТЫ И БИОМАТЕРИАЛЫ
Имплантология получила в последние десятилетия
импульс для развития в связи с потребностью
в способах и средствах восстановления
или замещения органов и тканей. Ряд фирм
уже давно работают с нанокристаллическими
материалами и покрытием поверхности
имплантатов гидроксилапатитом.
Другим методом является нанокристаллическое
алмазное покрытие, которое также обещает
увеличить продолжительность функционирования
и стабильность имплантатов. В экспериментах
уже показано, что остеобласты распознают
алмазные субмикроструктуры и могут закрепляться
на них. Эти результаты указывают на прекрасную
биосовместимость алмазных покрытий.
Материалы из нанокристаллического гидроксилапатита
применяются для лечения костных дефектов,
причем благодаря нанокристаллической
структуре в таком имплантате процесс
остеогенеза практически включает искусственный
материал в естественную кость. Недавно
начало развиваться еще одно направление
нанотехнологических биоматериалов —
нановолокна, которые ученые предполагают
использовать при тканевом инжиниринге
— создании искусственных тканей (в перспективе
— возможно также и органов) на основе
клеточных технологий.
ЗАКЛЮЧЕНИЕ
Таким образом сегодня закладывается
фундамент применения нанотехнологий
практически во всех областях медицины
(табл.3).
При этом в системах доставки и в диагностике in vivo в настоящее время преимущественно используются наночастицы как носители активных лекарственных или контрастных веществ в пораженные органы и ткани-мишени. В разработках новых активных веществ и способов лечения, во-первых, используется фармацевтический потенциал определенных молекулярных наносистем (дендримеры, фуллерены), во-вторых, могут использоваться наночастицы в комбинации с термическим или механическим действием магнитных полей, лазерного излучения, ультразвука и пр. Быстрыми темпами развивается нанотехнологическая диагностика in-vitro: здесь используется широкий арсенал возможностей нанотехнологий – от наночастиц с маркерами до биочипов. В области разработки биоматериалов внимание исследователей приковано опять-таки к наночастицам, в т.ч. нанокристалам, которые должны поднять на новый уровень современную имплантологию, ортопедию, стоматологию.
turboreferat.ru
Нанотехнологии в медицине и фармации
с. 1Нанотехнологии в медицине и фармации
Впервые термин «нанотехнология» применил Норио Танигучи, инженер из Токийского университета, в 1974 г. в статье, которая посвящалась обработке материалов. Прошло еще 20 лет, прежде чем термин был введен в широкий научный оборот. Сегодня нанотехнологии являются одной из наиболее интенсивно развивающихся областей науки в самых разных отраслях, в т.ч. в медицине и фармации.
Развивать нанотехнологии сегодня стремятся не только ведущие индустриальные державы, но и развивающиеся страны, в частности в Азиатско-Тихоокеанском регионе. Самые масштабные государственные научно-исследовательские программы в области нанотехнологии реализуют США и Япония, инвестиции в эти программы составляют у них более 1 млрд. долл. в год. С 1997 г. объем инвестиций в эти технологии в мире вырос на порядок и в 2004 г. составил 4,6 млрд. долл (Nanotech Report 2004. – Lux Research, New York, 2004) (рис. 1).
В США, например, развитие биотехнологий рассматривается в качестве основного мотора инноваций, который должен способствовать конкурентоспособности североамериканских продуктов на мировом рынке. Частные инвестиции в биотехнологии в США превышают государственные, и это свидетельствует как о достаточном уровне зрелости наноразработок, так и об их высоком экономическом потенциале. В последние годы быстрыми темпами развивается также наномедицина, которая привлекает всеобщее внимание не только чисто научными достижениями, но и социальной значимостью. Под этим термином сегодня понимают применение нанотехнологии в диагностике, мониторинге и лечении заболеваний. Развитие наномедицины тесно связано с революционными достижениями геномики и протеомики, которые позволили ученым приблизиться к пониманию молекулярных основ болезней. Наномедицина развивается там, где данные геномики и протеомики сочетаются с возможностями, позволяющими создать материалы с новыми свойствами на нанометрическом уровне. Выделяют 5 основных областей применения нанотехнологий в медицине: доставка активных лекарственных веществ, новые методы и средства лечения на нанометровом уровне, диагностика in vivo, диагностика in vitro, медицинские имплантаты (Wagner V., Wechsler D, 2004).
О значении наномедицины свидетельствует поступательный рост публикаций на эту тему в международных научных журналах (рис. 2). В течение 10 лет количество научных публикаций по наномедицине в мире увеличилось в 4 раза. Растет также число патентных заявок на изобретения, а это указывает на увеличивающуюся коммерциализацию данной сферы. Бесспорным лидером и по научным публикациям, и по числу патентных заявок являются США — оттуда приходят ежегодно 32% публикаций и 53% заявок, следом идут Германия (8% публикаций и 10% заявок) и Япония (9 и 6%, соответственно). Движущей силой многих наномедицинских инноваций являются start-up-компании, строящие свою стратегию на внедрении и коммерциализации инноваций.
Интерес фармацевтической и медицинской промышленности к нанотехнологиям в последние годы значительно повысился, поэтому следует ждать значительных вложений в эту область. В недалеком будущем нанотехнологии будут играть одну из ведущих ролей в качестве движущей силы инноваций в медицине.
Уже в 2004 г. мировой оборот наномедицинских препаратов оценивался экспертами в 6 млрд. долл (VDI Technologiezentrum GmbH, 2006). Правда, в этих подсчетах эксперты относят к наномедицинским любые медицинские технологии, в которых используются наноматериалы или нанотехнологии. Так, применение наночастиц золота в экспресс-диагностике является лишь одной из составных частей диагностического теста, но их присутствие дает основание экспертам причислить данный способ диагностики к нанотехнологиям.
Более 50% фармацевтических компаний-производителей, которые активно работают в области наномедицины, используют нанотехнологии для разработки систем доставки активных лекарственных веществ к органам и тканям-мишеням. Эти препараты дают сегодня 80% оборота в мировой наномедицине. Одной из ведущих областей применения таких систем является онкология. Использование систем доставки направлено на уменьшение неблагоприятных побочных эффектов ЛС. Среди этих нанопрепаратов уже имеются два блокбастера, не считая других успешных препаратов, вместе их оборот составляет 5 млрд. долл. Значительно ниже доля предприятий, производящих на нанотехнологической основе имплантаты (19%) и средства для диагностики in vitro (17%). Наиболее сложными проблемами — разработкой методов и средств лечения на основе принципиально новых терапевтических концепций — занимаются лишь 3% компаний (рис. 3).
СИСТЕМЫ ДОСТАВКИ АКТИВНЫХ ВЕЩЕСТВ
В 60-е годы прошлого века были получены липосомы, способные доставлять в орган-мишень лекарственное вещество. Различают два вида липосом: мультиламелларные липосомы, диаметр которых может составлять до 10 µm, и состоящие из одной ламеллы (пластинки) с диаметром примерно от 20 до 50 nm. Последние используются в качестве средства доставки активного лекарственного вещества. Полимерные наночастицы было предложено использовать в качестве систем доставки в 70-х годах XX в. (Ravi Kumar, 2000, 2003). Исходным материалом для них могут служить различные естественные или биоинертные синтетические полимеры, например, полисахариды, полимолочная кислота, полилактиды, полиакрилаты, акрилполимеры и др. Под термином «полимерные наночастицы» понимают два морфологически различных вида частиц: наносферы и нанокапсулы. Наносферы представляют собой сплошные полимерные матрицы, на которых распределяется активное вещество. Нанокапсулы состоят из полимерной оболочки, охватывающей наполненную жидкостью полость. Эти виды наночастиц различаются по высвобождению активного лекарственного вещества: из наносфер высвобождение протекает по экспоненте, а из нанокапсул — в течение длительного времени константно.
Еще один тип систем доставки лекарственных активных веществ обязан достижениям в области разработки дефинированных поливалентных и дендритических полимеров. Здесь примерами могут послужить полианионные полимеры — ингибиторы клеточных связей с вирусами, поликатионные комплексы с ДНК или РНК (т.н. полиплексы) и дендритные клетки (Haag R., Kratz F., 2006).
АКТИВНЫЕ ВЕЩЕСТВА И НОВЫЕ СПОСОБЫ ЛЕЧЕНИЯ
Нанометровые молекулы могут применяться непосредственно в качестве активных веществ. В частности, интересным классом молекул с этой точки зрения являются дендримеры. Эти разветвленные, как крона дерева, молекулы (отсюда их название) могут достигать размера мелких протеинов. По сравнению с классическими полимерными молекулами они обладают тем преимуществом, что можно контролировать их синтез с заданными свойствами, т.е. запрограммировать для определенного медицинского применения. Кроме того, на поверхности можно расположить специфическим образом определенные функциональные группы, так чтобы они особенно эффективно взаимодействовали с вирусами и клетками. Примером создания активного вещества на основе дендримера является препарат Vivigel -гель, способный защитить от ВИЧ-инфекции. Вивигель разработан австралийской биотехнологической компанией Starpharma, сейчас проходят его клинические исследования.
Одним из новых принципов является размельчение активных лекарственных веществ до нанометровых размеров. Так пытаются решить проблему недостаточной растворимости ЛС: 40% новых активных веществ, которые сейчас находятся в разработке, растворяются плохо и, соответственно, обладают недостаточной биодоступностью. В 90-е годы удалось получить наночастицы активного лекарственного вещества, т.н. активные нанокристаллы, с помощью процессов размельчения или гипербарической гомогенизации (Mueller et al., 2001). Эти наночастицы на 100% состоят из активного вещества и производятся в виде суспензии (наносуспензии), которую можно вводить внутривенно, а для перорального приема можно производить гранулы или таблетки из суспензии. При этом не нужна полимерная матрица, разрушение которой, как считают некоторые ученые, может оказывать токсическое действие на клетки. Обычный размер нанокристаллов составляет 200—600 nm. Для улучшения аппликационных свойств нанокристаллических ЛС проводят модификацию поверхности кристаллов. В этом направлении работают компании Wyeth-Ayers Laboratories (США), PharmaSol (ФРГ), SkyePharma (Великобритания), Merck&Co. (США) и многие другие. Одним из нанокристаллических препаратов, внедренных в клиническую практику в 2000 г., является Rapamune (Wyeth-Ayers Laboratories) — иммуносупрессивное ЛС, которое применяют после трансплантации органов. При производстве этого препарата была применена технология Nano-Crystal® (разработчик — Elan). А в 2003 г. фармконцерны Merck&Co. и Johnson&Johnson заключили контракт с компанией Elan на применение этой технологии при производстве других инновационных ЛС. Иная концепция заложена в основу термотерапии наночастицами. Например, новый способ лечения раковых опухолей заключается в том, что наночастицы вводят в опухоль, а затем либо за счет воздействия магнитного поля, либо лазерного облучения их нагревают, при этом опухолевые клетки разрушаются. Впервые эта медицинская технология была предложена более 15 лет назад учеными из университетской клиники Шарите (Берлин) под руководством д-ра Йордана (Jordan). За эту разработку в 2005 г. ученые были отмечены премией Frost&Sullivan Award for Technology Innovation. В 2003 г. разработка была передана коммерческой нанотехнологической компании для доведения и внедрения. Тогда же начались клинические исследования термотерапии опухолей мозга и рака предстательной железы. Сегодня в этом направлении работает целый ряд компаний в Европе (например, Magnamedics, Ахен) и США (Nanospectra Bioscience, Хьюстон).
ДИАГНОСТИКА IN VIVO
Революционные достижения геномики и молекулярной биологии привели к лучшему пониманию молекулярных процессов, которые лежат в основе болезней. Диагностику, основанную на передаче визуальной информации о молекулярных структурах, можно назвать молекулярной визиографией. Здесь используется тот же принцип, что и при традиционных методах получения изображений — радиографии, эхографии, УЗИ и т.д., только требуется иное контрастное вещество, а также специальные медицинские приборы и системы обработки данных.
Контрастное вещество для молекулярной диагностики состоит из наночастиц, с которыми соединены визуализирующие компоненты и определенные антитела либо какие-нибудь другие молекулы, способные отыскать цель. Когда контрастное вещество вводится в кровеносное русло, его поисковые компоненты взаимодействуют с целевыми структурами на поверхности больной клетки по принципу «ключ-замок», и визуализирующие компоненты попадают в больные ткани. После этого остается «считать» визуализированную информацию. Над этой концепцией работает компания Kereos (СтЛуис), которая разрабатывает контрастные вещества на основе наноэмульсии перфторкарбона, каждая капелька которой несет по нескольку тысяч атомов гадолиниума. Таким образом, резко повышается контрастность. Эти препараты компания разрабатывает в сотрудничестве с мировыми концернами Philips и Bristol-Myers Squibb.
Сложные молекулярные контрастные вещества, создаваемые на основе нанотехнолоий, пока еще не доступны для клинической практики. Но уже внедрены простые контрастные вещества, которые состоят из наночастиц окиси железа. Они обеспечивают высокую контрастность в диагностике заболеваний печени. Такое контрастное вещество разработала и внедрила под торговой маркой Resovist® компания Schering.
ДИАГНОСТИКА IN VITRO
Эксперты указывают, что нанотехнологии способствовали ренессансу биосенсорики, т.к. они позволили осуществить совершенно новые сенсорные концепции. Нанотехнологии в диагностике in vitro развиваются в двух направлениях: 1) использование наночастиц как маркеров биологических молекул; 2) применение инновационных нанотехнологических способов измерения. Фирма Nanosphere из Иллинойса разработала новые диагностические тесты для выявления онкологических заболеваний, болезни Альцгеймера и муковисцидоза. Причем заявлено, что новый диагностический тест для муковисцидоза будет стоить в 10 раз дешевле имеющихся сегодня. К новым наномедицинским диагностическим тестам относятся также сенсорные системы Cantilever и SPR (поверхностный плазменный резонанс). Сенсор Cantilever состоит из искусственных балок длиной от нескольких десятков до 200 µm и толщиной от нанометров до микрометров. Балки покрываются слоем молекул ДНК или протеинов, которые специфически взаимодействуют с целевыми биомолекулами в пробе. Это взаимодействие приводит к отклонению балки, движение которой улавливает лазерный детектор. По сравнению со многими оптическими методами сенсор Cantilever обладает тем преимуществом, что молекулы в пробе не требуют маркировки, и за счет этого процедура диагностики существенно упрощается. Сенсор SPR позволяет измерять взаимодействие между протеинами или протеинами и ДНК в режиме реального времени за счет определенного расположения нанослоев и разной интенсивности отраженного света в зависимости от массы биомолекул в слое. Эти приборы уже нашли широкое применение в медицинском материаловедении. Стоит упомянуть еще диагностическую систему Quicklab, предназначенную для экспресс-диагностики. Это малогабаритный электронный прибор с биочипом с нанометровыми электродами. Молекулы ДНК и протеины определяются биохимическим методом. Принцип разработан Институтом кремниевых технологий (ФРГ) и воплощен концерном Siemens Corp. Technology. Прибор предназначен для диагностики инфекционных заболеваний, заражения крови, воспаления легких, болезней мочеполовых путей.
ИМПЛАНТАТЫ И БИОМАТЕРИАЛЫ
Имплантология получила в последние десятилетия импульс для развития в связи с потребностью в способах и средствах восстановления или замещения органов и тканей. Ряд фирм уже давно работают с нанокристаллическими материалами и покрытием поверхности имплантатов гидроксилапатитом.
Другим методом является нанокристаллическое алмазное покрытие, которое также обещает увеличить продолжительность функционирования и стабильность имплантатов. В экспериментах уже показано, что остеобласты распознают алмазные субмикроструктуры и могут закрепляться на них. Эти результаты указывают на прекрасную биосовместимость алмазных покрытий. Материалы из нанокристаллического гидроксилапатита применяются для лечения костных дефектов, причем благодаря нанокристаллической структуре в таком имплантате процесс остеогенеза практически включает искусственный материал в естественную кость. Недавно начало развиваться еще одно направление нанотехнологических биоматериалов — нановолокна, которые ученые предполагают использовать при тканевом инжиниринге — создании искусственных тканей (в перспективе — возможно также и органов) на основе клеточных технологий.
ЗАКЛЮЧЕНИЕ
Таким образом сегодня закладывается фундамент применения нанотехнологий практически во всех областях медицины (табл.3). При этом в системах доставки и в диагностике in vivo в настоящее время преимущественно используются наночастицы как носители активных лекарственных или контрастных веществ в пораженные органы и ткани-мишени. В разработках новых активных веществ и способов лечения, во-первых, используется фармацевтический потенциал определенных молекулярных наносистем (дендримеры, фуллерены), во-вторых, могут использоваться наночастицы в комбинации с термическим или механическим действием магнитных полей, лазерного излучения, ультразвука и пр. Быстрыми темпами развивается нанотехнологическая диагностика in-vitro: здесь используется широкий арсенал возможностей нанотехнологий – от наночастиц с маркерами до биочипов. В области разработки биоматериалов внимание исследователей приковано опять-таки к наночастицам, в т.ч. нанокристалам, которые должны поднять на новый уровень современную имплантологию, ортопедию, стоматологию.
Источник: журнал “Ремедиум” сентябрь 2008
Автор: Пальцев Михаил Александрович
Дата: 20.10.2008
с. 1
kilouma.ru
Нанотехнологии в медицине и фармации
Впервые термин «нанотехнология» применил Норио Танигучи, инженер из Токийского университета, в 1974 г. в статье, которая посвящалась обработке материалов. Прошло еще 20 лет, прежде чем термин был введен в широкий научный оборот. Сегодня нанотехнологии являются одной из наиболее интенсивно развивающихся областей науки в самых разных отраслях, в т.ч. в медицине и фармации.
Развивать нанотехнологии сегодня стремятся не только ведущие индустриальные державы, но и развивающиеся страны, в частности в Азиатско-тихоокеанском регионе. Самые масштабные государственные научно-исследовательские программы в области нанотехнологий реализуют США и Япония, инвестиции в эти программы составляют у них более 1 млрд. долл. США в год. С 1997 г. объем инвестиций в эти технологии в мире вырос на порядок и в 2004 г. составил 4,6 млрд. долл.
В США, например, развитие биотехнологий рассматривается в качестве основного мотора инноваций, который должен способствовать конкурентоспособности североамериканских продуктов на мировом рынке. Частные инвестиции в биотехнологии в США превышают государственные, и это свидетельствует как о достаточном уровне зрелости наноразработок, так и об их высоком экономическом потенциале.
В последние годы быстрыми темпами развивается также наномедицина, которая привлекает всеобщее внимание не только чисто научными достижениями, но и социальной значимостью. Под этим термином сегодня понимают применение нанотехнологий в диагностике, мониторинге и лечении заболеваний.
Развитие наномедицины тесно связано с революционными достижениями геномики и протеомики, которые позволили ученым приблизиться к пониманию молекулярных основ болезней. Наномедицина развивается там, где данные геномики и протеомики сочетаются с возможностями, позволяющими создать материалы с новыми свойствами на нанометрическом уровне. Выделяют 5 основных областей применения нанотехнологий в медицине: доставка активных лекарственных веществ, новые методы и средства лечения на нанометровом уровне, диагностика in vivo,
диагностика in vitro, медицинские имплантаты (Wagner V., Wechsler D., 2004).О значении наномедицины свидетельствует поступательный рост публикаций на эту тему в международных научных журналах (рис. 2). В течение 10 лет количество научных публикаций по наномедицине в мире увеличилось в 4 раза. Растет также число патентных заявок на изобретения, а это указывает на увеличивающуюся коммерциализацию данной сферы. Бесспорным лидером и по научным публикациям, и по числу патентных заявок являются США – оттуда приходят ежегодно 32% публикаций и 53% заявок, следом идут Германия (8% публикаций и 10% заявок) и Япония (9 и 6%, соответственно).
Движущей силой многих наномедицинских инноваций являются start-up-компании, строящие свою стратегию на внедрении и коммерциализации инноваций.
Интерес фармацевтической и медицинской промышленности к нанотехнологиям в последние годы значительно повысился, поэтому следует ждать значительных вложений в эту область. В недалеком будущем нанотехнологии будут играть одну из ведущих ролей в качестве движущей силы инноваций в медицине.
Уже в 2004 г. мировой оборот наномедицинских препаратов оценивался экспертами в 6 млрд. долл. Правда, в этих подсчетах эксперты относят к наномедицинским любые медицинские технологии, в которых используются наноматериалы или нанотехнологии. Так, применение наночастиц золота в экспресс-диагностике является лишь одной из составных частей диагностического теста, но их присутствие дает основание экспертам причислить данный способ диагностики к нанотехнологиям.
Более 50% фармацевтических компаний-производителей, которые активно работают в области наномедицины, используют нанотехнологии для разработки систем доставки активных лекарственных веществ к органам и тканям-мишеням. Эти препараты дают сегодня 80% оборота в мировой наномедицине. Одной из ведущих областей применения таких систем является онкология. Применение систем доставки направлено на уменьшение неблагоприятных побочных эффектов ЛС.
Среди этих нанопрепаратов уже имеются два блокбастера, не считая других успешных препаратов, вместе их оборот составляет 5 млрд. долл.Значительно ниже доля предприятий, производящих на нанотехнологической основе имплантаты (19%) и средства для диагностики in vitro (17%). Наиболее сложными проблемами – разработкой методов и средств лечения на основе принципиально новых терапевтических концепций – занимаются лишь 3% компаний (рис. 3).
База мировой наномедицины сегодня:
(VDI Technologiezentrum GmbH, 2006)
М.А.ПАЛЬЦЕВ, академик РАН и РАМН
www.remedium.ru
www.nedug.ru
Конференция по теме “Нанотехнологии в биологии, химии, медицине, фармации”
Разделы: Химия, Биология, Внеклассная работа, Конкурс «Презентация к уроку»
Презентация к уроку
Загрузить презентацию (20,7 МБ)
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Цели:
- Образовательная: расширить знания учащихся о современной науке, нанотехнологиях и их вкладе в развитие биологии, химии, медицины и фармации.
- Воспитательная:воспитывать у учащихся уважение к людям науки и их достижениям.
- Развивающие:
- развивать у учащихся умения сравнивать и обобщать материал, анализировать, делать выводы;
- развивать у учащихся коммуникативные навыки, творческие способности.
ХОД МЕРОПРИЯТИЯ
Вступительное слово ведущего:Сегодня мы все чаще слышим слова нанонаука, нанотехнологии, наноструктурированные материалы и объекты. Отчасти они уже вошли в повседневную жизнь, ими обозначают приоритетные направления научно-технической политики в развитых странах. А что же понимают под нанотехнологиями?
Учащийся 1: Сама приставка “нано-” происходит от греческого слова “nanos”, что переводится как “карлик” и означает одну миллиардную часть чего-либо. Один нанометр (1 нм) – одна миллиардная доля метра (10–9 м) (Презентация). Как представить себе такую короткую дистанцию? Проще всего это сделать с помощью денег: нанометр и метр соотносятся по масштабу как копеечная монета и земной шар. Нанометрами измеряются лишь самые примитивные существа, такие как вирусы, их длина в среднем 100 нм. Живая природа заканчивается на рубеже примерно в десять нанометров – такие размеры имеют сложные молекулы белков, строительные блоки живого. Простые молекулы в десятки раз меньше. Величина атомов – несколько ангстрем (один ангстрем равен 0,1 нм). Например, диаметр атома кислорода – 0,14 нм. Здесь и проходит нижняя граница наномира, мира наномасштабов. Именно в наномире идут процессы фундаментальной важности – совершаются химические реакции, выстраивается строгая геометрия кристаллов, структуры белков. С этими процессами и работают нанотехнологи. Благодаря малому размеру наночастицы отличаются по свойствам как от отдельных атомов, так и от объемного материала, состоящего из многих миллиардов атомов. Например, нанозолото по химической активности во много раз превосходит обычное. Серебро не растворимо в большинстве кислот, за исключением концентрированной серной и азотной. Однако, наночастицы серебра растворяются даже в слабых кислотах. Таких как, например, уксусная.
Учащийся 2: Нанотехнологии – это способы создания наноразмерных структур, которые придают материалам и устройствам полезные, а иногда просто необыкновенные свойства. Нанотехнология позволяет поместить частицу лекарства в нанокапсулу и точно нацелить на пораженную болезнью клетку, не повредив соседние. Фильтр, пронизанный бесчисленными нанометровыми каналами, которые пропускают воду, но слишком тесны для примесей и микробов, тоже продукт нанотехнологий. В лабораториях нанотехнологов уже испытываются суперматериалы – углеродные волокна, в тысячи раз прочнее стали, покрытия, делающие предмет невидимым. А некоторые виды нанопродукции уже продаются в магазинах. Например, слово «нанокосметика» все чаще звучит в рекламных роликах: наночастицы, входящие в состав косметических кремов, удаляют мельчайшие загрязнения с кожи. Известно, что микробы не любят серебро, но оказывается, что в виде наночастиц оно их просто приводит в ужас и обращает в бегство. Ткани с добавками такого серебра набирают популярность у истинных ценителей гигиены – из них уже делают даже «наноноски». Впрочем, многие из давно привычных вещей тоже невозможны без «нано»: процессор вашего компьютера содержит миллионы наноразмерных транзисторов, над дисплеем тоже, скорее всего, поработали нанотехнологи. «Нано» уже повсюду – военные используют нанотехнологии, медики используют нанотехнологии, даже производители продуктов питания, и те используют нанотехнологии.
Учащийся 3: Многие источники, в первую очередь англоязычные, первое упоминание методов, которые впоследствии будут названы нанотехнологией, связывают с известным выступлением Ричарда Фейнмана «Там внизу много места» (англ. «There’s Plenty of Room at the Bottom»), сделанным им в 1959 году в Калифорнийском технологическом институте на ежегодной встрече Американского физического общества. Ричард Фейнман предположил, что возможно механически перемещать одиночные атомы при помощи манипулятора соответствующего размера. Изложенные Фейнманом в лекции идеи о способах создания и применения таких манипуляторов совпадают с фантастическим рассказом советского писателя Бориса Житкова «Микроруки», опубликованным в 1931. Но не только. В широко известном произведении русского писателя Н. Лескова «Левша» есть любопытный фрагмент: «Если бы, – говорит, – был лучше мелкоскоп, который в пять миллионов увеличивает, так вы изволили бы, – говорит, – увидать, что на каждой подковинке мастерово имя выставлено: какой русский мастер ту подковку делал». Увеличение в 5 млн. раз обеспечивают современные электронные и атомно-силовые микроскопы, считающиеся основными инструментами нанотехнологий, таким образом, литературного героя Левшу можно считать первым в истории нанотехнологом. А сам термин «нанотехнология» впервые употребил Норио Танигути в 1974 году. Он назвал этим термином производство изделий размером несколько нанометров. В 1980-х годах этот термин использовал Эрик К. Дрекслер в своей книге: «Машины создания: грядёт эра нанотехнологии» («Engines of Creation: The Coming Era of Nanotechnology»). Центральное место в его исследованиях играли математические расчёты, с помощью которых можно было проанализировать работу устройства размерами в несколько нанометров.
Учащийся 4: Сегодня мы являемся свидетелями стремительного развития биологии и химии, идущего сразу в нескольких направлениях. Во-первых, значительно усовершенствованы технологии определения структуры биополимеров. Оказывается, возможно «читать» и анализировать биологические тексты, в частности определять нуклеотидные последовательности ДНК, устанавливать аминокислотные последовательности белков. Это позволило к настоящему времени практически полностью расшифровать генетическую информацию, заключённую в геноме человека, а также в геномах основных патогенных и многих промышленно значимых микроорганизмов и вирусов. Следовательно, создаются уникальные предпосылки для разработки новых технологий лечения и профилактики заболеваний, такие, что в обозримом будущем можно будет говорить о создании персонализированной медицины. Во-вторых, человечество сегодня переходит от перебора в ходе экспериментов множества лекарственных соединений к целенаправленному созданию химическим путем соединений с заранее заданными свойствами, что, по сути, позволяет не искать в природе, а придумывать и производить новые типы терапевтических средств.
Учащийся 5: Нанотехнологии, в свою очередь, открывают дополнительные новые возможности для использования сложных биохимических молекул и биологических систем, в том числе живых организмов. Например, они позволяют путём направленной модификации придавать живым системам (прежде всего микроорганизмам) свойства, необходимые для обеспечения определённой функции, допустим, для продукции наноматериалов. Например, клетки бактерий Magnetospirillum magneticum можно заставить синтезировать частицы магнетита – Fe3O4. Важно, что такая «продукция» бактериальных клеток окружена мембраной, поэтому частицы магнетита легко выделять из раствора. Такие частицы могут применяться в самых разных методах: например, в диагностике, контроле за адресной доставкой лекарств, выделении нуклеиновых кислот. Всем известный вирус табачной мозаики, представляющий собой симметричный палочковидный белковый цилиндр – капсид, состоящий из более чем двух тысяч одинаковых белковых молекул, уложенных по спирали с полостью внутри, в которой находится молекула РНК, в качестве средства «в руках» нанотехнологий, может применяться в качестве контейнера для доставки наночастиц.
Учащийся 4: Сегодня нанотехнологии – это самая финансируемая область науки в мире. Прогресс в этой области связан в первую очередь с разработкой наноматериалов для аэрокосмической, автомобильной, электронной промышленности, однако не остаются в стороне от нанотехнологий и медицина и фармация. Уже не первый год в медицине существует такое направление, как наномедицина, занимающаяся слежением, контролем, конструированием и исправлением нарушений в организме человека на молекулярном уровне, используя наноустройства и наноструктуры. За последние 20 лет нанотехнологии оказали существенное влияние на системы доставки лекарств, позволили решить вопросы растворимости и биодоступности лекарственных препаратов, помогли уменьшить системные и нецелевые побочные эффекты.
Учащийся 5: Более половины фармацевтических компаний-производителей, которые активно работают в области наномедицины, используют нанотехнологии для разработки систем доставки активных лекарственных веществ к органам и тканям-мишеням. А ведущая область применения этих систем – онкология. Специфические формы и малые размеры позволили осуществлять доставку различных терапевтических агентов к труднодоступным целям, например, позволили преодолеть гематоэнцефалический барьер или доставлять лекарства внутрь клеточного ядра. Также нанотехнологии позволяют решить проблему недостаточной растворимости лекарственных средств: 40% новых активных веществ, которые сейчас находятся в разработке, растворяются плохо и, соответственно, обладают недостаточной биодоступностью.
Учащийся 6: Адресная доставка лекарств к больным клеткам является важной задачей фармацевтики, она позволяет медикаментам попадать только в больные органы, избегая здоровые, которым эти лекарства могут нанести вред. В качестве средств доставки в настоящее время используют:
– Липосомы
– Наносферы и нанокапсулы
– Углеродные нанотрубки
– Фуллерены
– Нанопокрытия
Липосомы были получены еще в 60-е годы прошлого века. Они представляют собой замкнутые пузырьки из фосфолипидов. Липосомы выходят из кровяного русла в ткани там, где проницаемость сосудов повышена, то есть в растущих злокачественных опухолях. Следовательно, на поверхности липосом можно закрепить антитела, способные распознавать специфические для опухоли антигены и, таким образом, обеспечить доставку лекарства именно в опухолевые клетки.
Учащийся 7: Наносферы представляют собой сплошные полимерные матрицы, на которых распределяется активное вещество. Нанокапсулы состоят из полимерной оболочки, охватывающей наполненную жидкостью полость, в которой и находится лекарственный препарат. В настоящее время разрабатываются наносферы с регулируемыми наноклапанами. Они выполнены из пористого кварца. Поры таких наносфер заполнены переносимым веществом. При нейтральных и кислых значениях pH поры закрыты. При повышении значений pH до щелочных показателей поры открываются и заключенное в порах вещество покидает сферу. Сейчас разработка таких наносфер продолжается – для фармацевтических целей необходимо, чтобы даже незначительной разницы в pH между здоровой и больной тканью было достаточно для «переключения» клапанов и высвобождения лекарства только в больных тканях.
Учащийся 6: Углеродные нанотрубки – это цилиндрические структуры, состоящие из одной или нескольких свёрнутых в трубку графитовых плоскостей (графенов). Их диаметр составляет всего несколько нанометров, в результате чего они могут легко проходить через клеточные мембраны, и даже через ядерную мембрану клетки. Использование углеродных нанотрубок является многообещающей технологией доставки лекарств и диагностических носителей, так как к их стенкам можно прикрепить не только лекарственные препараты, но и другие молекулы, а также целые диагностические системы. Разрабатываются программируемые нанотрубки, открывающиеся и закрывающиеся в ответ на раздражитель.
Учащийся 7: Фуллерены – аллотропная модификация углерода (другие – алмаз, карбин и графит), представляющая собой выпуклые замкнутые многогранники, напоминающие по форме футбольный мяч, в который можно поместить лекарственное вещество. На основе фуллеренов разрабатываются препараты – средства доставки лекарственных средств для лечения ВИЧ-инфицированных пациентов и онкологических больных. Например, фуллерен может содержать внутри атом радиоактивного элемента, а на поверхности – группы, позволяющие ей прикрепиться к раковой клетке. Фуллерены являются одним из самых изучаемых объектов в химии за последние 20 лет. Производные фуллерена легко проникают через биологические мембраны, поэтому они также используются в качестве меток и индикаторов в медико-биологических исследованиях. Кроме того, фуллерен легко присоединяет свободные радикалы, поэтому может выполнять в организме роль антиоксиданта.
Учащийся 6: Также как и фуллерены, нанопокрытия представляют собой сферические углеродные структуры, покрытые снаружи металлом, обычно золотом. В нанопокрытия могут быть вставлены полимеры, содержащие лекарственные препараты. Высвобождение лекарственного препарата может осуществляться под воздействием инфракрасного лазера, волнами СВЧ диапазона или механическими воздействиями. Например, разрабатывается технология лечения рака, в которой нанопокрытия систематически доставляются к раковой ткани и затем активируются инфракрасным лазером, приводящим к термическому разрушению опухоли и кровеносных сосудов, снабжающих опухоль. К сожалению, несмотря на высокий потенциал эффективности, системы доставки активных веществ в органы и ткани-мишени связаны и с нежелательными побочными эффектами – безопасность стабильных наночастиц вызывает сомнения и нужны дополнительные исследования для ее подтверждения. Однако, поиск альтернативных систем непрерывно продолжается.
Учащийся 7: Оказалось, что при нанодоставке лекарств размер не имеет значения, а вот форма имеет. Хотя логически очевидно, что чем меньше частица, тем с большей вероятностью она проникнет в клеточную мембрану, исследователи обнаружили, что частицы вытянутой формы способны проникать в клетку быстрее, чем частицы любой другой, в том числе сферической формы. В частности, вытянутые частицы (150 нанометров в ширину и 450 нанометров в длину) проникают в человеческие клетки примерно в 4 раза быстрее и глубже, чем более мелкие по совокупности измерений частицы (например, 200 нанометров на 200 нанометров). А объясняется это, как оказалось, очень просто – иммунной системе человека сложнее реагировать на вытянутые наночастицы. Макрофаги – клетки, поглощающие инородные частицы, удаляющие их из кровеносной системы, предпочтительно связывают объекты, не требующие от них значительного удлинения.
Учащийся 8: Нанотехнологии также используются для разработки различных систем диагностики. Диагностику можно проводить как внутри организма, так и вне его. Например, наносферы могут использоваться в диагностике, например, как рентгеноконтрастное вещество, прикрепляющееся к поверхности каких-либо определенных клеток и показывающее их расположение в организме. Примером же использования нанотехнологий в диагностических целях вне организма человека является лаборатория-на-чипе. Такая лаборатория представляет собой небольшую стеклянную пластинку, по размеру и форме напоминающую sim-карту. На ее поверхность лазером наносятся рецепторы к нужным исследователю веществам, например, антитела к исследуемым антигенам. Они наносятся близко друг к другу, на одной пластинке могут быть размещены датчики для нескольких тысяч веществ, так что можно определить сразу множество антигенов. Прикрепление антигена к антителу выявляется электрическим путем или по флуоресценции (свечению). Таким образом, например, анализ крови, проведенный с использованием специально разработанных микрочипов, позволяет определить заболевание тогда, когда никаких, казалось бы, симптомов другими методами не выявляется. Значит, лечение можно начать проводить гораздо раньше, чем делается теперь. А выявлять таким способом можно и возбудителей инфекционных заболеваний, и генетические, и онкологические заболевания, а также токсические вещества, попадающие в организм. В будущем такой чип размером всего в несколько миллиметров можно будет помещать на кожу для анализа веществ, выделяемых с потом, или внутрь организма (в полость рта, желудочно-кишечный тракт, под кожу или в мышцу) и он сможет сообщать о состоянии внутренней среды организма, сигнализировать о любых подозрительных изменениях.
Учащийся 9: Наноматериалы могут
использоваться в медицине в качестве
имплантантов для замены тех или иных тканей. Для
создания хорошего имплантанта необходимо, чтобы
клетки организма опознавали его как «свой» и
прикреплялись к его поверхности. В настоящее
время достигнуты успехи в изготовлении
имплантантов, покрытых наноматериалом,
имитирующим естественную костную ткань. В основе
этого покрытия лежит гидроксилапатит, который,
как известно, составляет основу костной ткани
человека. К полученному материалу хорошо
прикрепляются собственные костные клетки
организма, таким образом, материал имплантанта
как бы включается включается в естественную
кость, что позволяет использовать такие
материалы как «клей» или «шпатлевку» для костной
ткани, позволяющие ликвидировать трещины,
переломы и иные повреждения костей. Для
увеличения продолжительности жизни и
стабильности имплантантов при их изготовлении
можно использовать нанокристаллическое
алмазное покрытие. В экспериментах уже показано,
что остеобласты – клетки костной ткани
распознают алмазные субмикроструктуры и могут
закрепляться на них, что указывает на прекрасную
биосовместимость алмазных покрытий. Недавно
начало развиваться еще одно направление
нанотехнологических биоматериалов –
нановолокна, которые ученые предполагают
использовать при создании искусственных тканей
(в перспективе – возможно также и органов).
Также представляет интерес и разработка
материалов, обладающих противоположным
свойством: не позволяющих клеткам прикрепляться
к поверхности. Одним из возможных применений
таких материалов могло бы стать изготовление
биореакторов для выращивания стволовых клеток.
Дело в том, что прикрепившись к поверхности,
стволовая клетка стремиться дифференцироваться,
то есть образовать те или иные
специализированные клетки. Если использовать
материалы, к которым стволовые клетки
прикрепляться не смогут, можно будет управлять
процессами деления стволовых клеток и
превращением их в специализированные клетки.
Учащийся 10: Нанотехнологии можно использовать не только для создания новых способов доставки уже известных лекарственных средств, но и для разработки кардинально новых методов и средств терапии различных заболеваний, да и не только для этого. Так, например, новые бактерицидные средства создаются на основе использования полезных свойств ряда наночастиц. Издревле было известно, что вода, находящаяся в контакте с серебром, способна убивать болезнетворные бактерии. Целебная сила такой воды, по современным представлениям, объясняется содержанием в ней наночастиц серебра. Таким образом, возможно применение серебряных наночастиц для очистки воды и воздуха, или при дезинфекции одежды и спецпокрытий. Нанесение на упаковочные пленки наночастиц серебра позволит продлить срок хранения продуктов. Иная концепция заложена в основу термотерапии наночастицами. Например, новый способ лечения раковых опухолей заключается в том, что наночастицы вводят в опухоль, а затем либо засчет воздействия магнитного поля, либо лазерного облучения их нагревают, при этом опухолевые клетки разрушаются. Впервые эта медицинская технология была предложена более 15 лет назад, сегодня в этом направлении работает целый ряд компаний в Европе и США.
Учащийся 11: Если наноматериалы работают в организме человека так же, как в организме мышей, то люди будут готовиться к атаке респираторных вирусных инфекций, вдыхая аэрозоль, содержащий крошечные полые белковые клетки, производные теплолюбивых бактерий. Эти клетки настолько малы, что различить их возможно на электронном микроскопе. Диаметр человеческого волоса в 7000 – 10000 раз больше, чем эти клетки. Такие клетки активизируют иммунную реакцию в легких. Эта активированная иммунная реакция будет защищать против любых вирусов респираторных инфекций более чем на месяц. Людям не придется ждать, пока ученые проанализируют новые формы вирусов, разработают вакцины против них, а затем распространят вакцины. Если этот подход работает в человеческом организме, то люди, подготовившие свои легкие с помощью наноматериалов, буду иметь всего лишь насморк пару дней, тогда как без такой подготовки были бы госпитализированы, а вместо того, чтобы пропускать работу в течение нескольких дней в связи с гриппозной инфекцией, человеку необходимо будет всего несколько дополнительных часов сна.
Учащийся 12: Нанотехнологии зашли уже так далеко, что позволяют создавать не только отдельные материалы, но и целые сложные машины, такие как например, нанороботов. Так например, с 2006 года в рамках соревнований по футболу среди роботов, а существуют и такие, появилась номинация, в которой игровое поле представляет из себя квадрат со стороной 2.5 мм, а максимальный размер игрока ограничен 300 мкм, то есть это соревнования среди нанороботов. В недалеком будущем ожидается создание молекулярных роботов-врачей, которые смогут «жить» внутри человеческого организма, устраняя все возникающие повреждения, или предотвращая возникновение таковых. Они смогут манипулировать отдельными атомами и молекулами и за счет этого осуществлять ремонт клеток. В настоящее время целый ряд групп ученых во всем мире работает над созданием микроустройств, которые могли бы работать внутри человеческого организма. Такие устройства смогут быть стационарно закреплены в тканях, перемещаться пассивно, например, вдоль желудочно-кишечного тракта, или активно, например, “ползти” по поверхностям внутренних полостей человеческого организма, плавать во внутренних жидкостях или, даже, “пробуравливать” себе ходы в тканях.
Учащийся 13: Уже сейчас имеются современные устройства для исследования желудочно-кишечного тракта, имеющие размеры всего несколько миллиметров, и при этом несущие на своем борту миниатюрную видеокамеру и систему освещения. Полученные ими кадры передаются наружу. Ученые надеются, что в будущем подобного рода устройства смогут проникать в любую точку организма, собирать там диагностическую информацию, доставлять лекарственные вещества и, в еще более отдаленной перспективе, осуществлять «нанохирургические операции» – разрушать атеросклеротические бляшки, уничтожать бактерии, вирусы, клетки с признаками злокачественного перерождения, восстанавливать поврежденные нервные волокна, «ремонтировать» другие поврежденные клетки, ткани, производить анализ ДНК с последующей ее корректировкой. Возможно, когда-нибудь такие нанороботы позволят оживлять замороженных на десятки лет людей. Максимальный размер таких устройств не будет превышать 3-4 микрон. Источником энергии, питающим таких нанороботов, предполагается, будут являться запасы глюкозы и аминокислот в теле человека. А в качестве строительного материала для них скорее всего будут использованы алмазоподобные наноматериалы, так как они имеют очень гладкую поверхность, вследствие чего вызывают меньшую активность лейкоцитов, и при этом очень низкую биологическую и химическую активность, что позволит сделать таких роботов химически инертными.
Учащийся 12: Стоит отметить, что на сегодняшний день нанотехнология, как новое направление медицинской науки, только зарождается. Большинство нанобиотехнологичеких разработок находятся сейчас на стадии инициации или получения первых результатов, а основная масса методов пока представляет собой только проекты. Несмотря на это, большинство экспертов уверено, что именно эти методы будут основополагающими в XXI веке. И хотя, скорее всего успехи наномедицины и нанофармации станут широко применяться по грубым оценкам только спустя 40-50 лет. уже сегодня можно с уверенностью сказать, что на нанотехнологии в этих областях науки возлагаются большие надежды, что подтверждается ежегодным ростом продаж и инвестиций в этой отрасли.
Учащийся 13: Ключевые технологии и материалы всегда играли большую роль в истории цивилизации, выполняя не только узко производственные функции, но и социальные. Достаточно вспомнить, как сильно отличались каменный и бронзовый века, век пара и век электричества, атомной энергии и компьютеров. По мнению многих экспертов, XXI в. будет веком нанонауки и нанотехнологий, которые и определят его лицо. Воздействие нанотехнологий на жизнь обещает иметь всеобщий характер, изменить экономику и затронуть все стороны быта, работы, социальных отношений. С помощью нанотехнологий мы сможем экономить время, получать больше благ за меньшую цену, постоянно повышать уровень и качество жизни.
xn--i1abbnckbmcl9fb.xn--p1ai
Реферат на тему: “Нанотехнологии в фармации” 77283-2
500
Уважаемый студент!
Представленная работа ранее уже была оценена преподавателем нашего клиента на “отлично”. Использование данного материала в качестве основы ускорит процесс подготовки Вашего собственного проекта. Можете быть уверены, что работа уникальна, предлагаем ее только мы, и в открытом доступе в интернете она не находится! Еще один плюс: готовая работа в несколько раз дешевле, чем новая.Содержание
Введение.
Значение нанотехнологий в фармации.
Системы доставки активных веществ.
Активные вещества и новые способы лечения.
Диагностика in vivo.
Имплантаты и биоматериалы.
Сравнительный анализ методов синтеза наночастиц для лекарственных препаратов.
Липосомы — универсальные средства доставки лекарственных средств.
Заключение.
Список литературы.
Введение
Развиваться нанотехнологии на сегодня стремятся не только ведущие индустриальные державы, но и развивающиеся страны, в частности в Азиатско-Тихоокеанском регионе. Самые масштабные государственные научно-исследовательские программы в области нанотехнологий реализуют США и Япония, инвестиции в эти программы составляют у них более 1 млрд. долл. в год. С 1997 г. объем инвестиций в эти технологии в мире вырос на порядок и в 2004 г. составил 4,6 млрд. долл.
В США, например, развитие биотехнологий рассматривается в качестве основного мотора инноваций, который должен способствовать конкурентоспособности североамериканских продуктов на мировом рынке. Частные инвестиции в биотехнологии в США превышают государственные, и это свидетельствует как о достаточном уровне зрелости наноразработок, так и об их высоком экономическом потенциале.
В последние годы быстрыми темпами развивается также наномедицина, которая привлекает всеобщее внимание не только чисто научными достижениями, но и социальной значимостью. Под этим термином сегодня понимают применение нанотехнологий в диагностике, мониторинге и лечении заболеваний. Развитие наномедицины тесно связано с революционными достижениями геномики и протеомики, которые позволили ученым приблизиться к пониманию молекулярных основ болезней. Наномедицина развивается там, где данные геномики и протеомики сочетаются с возможностями, позволяющими создать материалы с новыми свойствами на нанометрическом уровне. Выделяют 5 основных областей применения нанотехнологий в медицине: доставка активных лекарственных веществ, новые методы и средства лечения на нанометровом уровне, диагностика in vivo, диагностика in vitro, медицинские имплантаты (Wagner V., Wechsler D., 2004).
20 стр.
Если данный вариант Вам не подходит, мы поможем Вам в написании новой работы. Вы можете обратиться к нам с любыми проблемами в учебе! Кроме того, если Вам интересно разобраться в предмете, мы научим Вас самостоятельно решать задачи, подготавливать рефераты, курсовые, дипломы и т.д.
stydend.ru
Перспективы использования нанотехнологий в медицине и фармации – 15 января 2008
Перспективы использования нанотехнологий в медицине и фармации Нанотехнологии являются одним из самых многообещающих направлений в современной науке. Начало им положило случайное открытие американских ученых, которые обнаружили, что атомы углерода в лазерном разряде могут соединяться между собой, образуя нанотрубки и шарики (фуллерены, или капсулы), обладающие уникальными свойствами. Они устойчивы к воздействию температуры, света, иных агрессивных факторов. Это открытие имеет большое значение для медицины и фармации: наноструктуры можно использовать как емкости для транспортировки (в том числе адресной) лекарственных веществ в организме, обеспечения их сохранности, регулируемого высвобождения. С открытием нанотрубок и фуллеренов стали стремительно развиваться нанотехнологии, основанные на применении материалов, имеющих размер частиц от 1 до 100 нанометров (нано – 10-9 м). Наноструктуры «конструируют» путем обработки различных веществ химическими или физическими методами под контролем зондового сканирующего микроскопа, а также способом, который называют «самосборка молекул». Чем меньше размер наночастицы, тем более ей свойственны так называемые квантовые эффекты, которые можно использовать в тех или иных целях. Нанотехнологические исследования в медицине и фармации ведутся на стыке разных направлений науки: создание новых молекул, микроэлектромеханических и микрооптикоэлектромеханических систем (MEMS и MOEMS), нанотехнологии твердых веществ, микроэлектроника. Эти исследования сосредоточены на получении препаратов нового поколения, разработке способов доставки лекарственных средств, получении искусственных тканей организма, совершенствовании методов диагностики заболеваний и лабораторного тестирования препаратов. Мировой рынок фармацевтической нанопродукции формируется быстрыми темпами. В ближайшие годы он станет емким и высокотехнологичным – подобно рынку информационных технологий. На исследования в области нанотехнологий в мире тратится больше 4 млрд $ в год. По прогнозам американской ассоциации «National Science Foundation», объем рынка товаров и услуг с использованием нанотехнологий к 2015 г. достигнет 1 трлн $. В фармацевтической отрасли к этому времени примерно половина всей продукции будет производиться с применением нанотехнологий. В 30 странах приняты национальные программы по нанотехнологиям. Разработки в этой области осуществляют все ведущие университеты мира. За последние годы создано свыше 1600 нанотехнологических компаний и научных центров, и количество их удваивается каждые 1,5-2 года. Лидером в области нанотехнологий являются США (27% мирового рынка нанотехнологий). В этой стране в 2000 г., после длительного сбора и анализа данных о нанотехнологиях в разных странах, была принята Национальная нанотехнологическая инициатива. Ее цель – поддержка долгосрочных исследований и разработок, ведущих к значительным открытиям. Федеральное правительство отнесло нанотехнологии к сфере национальной безопасности. Большинство штатов США учредили программы и административные структуры для развития наноисследований и поддержки коммерческих предприятий, занятых в этой области. Общий объем финансирования на эти цели в 2005-2008 гг. составит 3,8 млрд $. Второе место на рынке нанотехнологий принадлежит Японии (более 24%), третье – Западной Европе (25%) с преобладающим вкладом Германии, Великобритании и Франции, оставшиеся 24% делят Китай, Россия, Южная Корея, Канада и Австралия. В Казахстане тоже уделяется внимание нанотехнологиям. Согласно Государственной программе развития науки в РК на 2007-2012 гг., они являются одним из приоритетных направлений. Координатор этих исследований – Национальная академия наук РК. В стране имеются научные коллективы, которые проводят изыскания в области нанотехнологий и имеют определенные достижения. Так, в лаборатории структуры и регуляции ферментов Института молекулярной биологии и биохимии им. М.А. Айтхожина разработаны универсальные нанокапсулы из фосфатидилинозитола и созданы трансдермальные формы с их применением. В фармацевтической отрасли следует ожидать расширения использования нанотехнологий в целевой инженерии (создание молекул с заданными свойствами), нанолекарств, которые будут доставляться кровотоком непосредственно к больному органу человека, что увеличит эффективность лечения и снизит его побочные эффекты. Ожидается, что с помощью нанотехнологий будут созданы лекарства совершенно нового типа – высокоспецифичные препараты, в том числе индивидуальные (для конкретных пациентов). Уже сегодня с помощью нанотехнологий получены субстанции с заданными свойствами. Так, российскими учеными был создан иммуномодулятор и антиоксидант Имунофан. Этот регуляторный пептид четвертого поколения – представитель нового класса лекарственных средств, так называемых «умных лекарств», применяемых в сверхнизких дозах и оказывающих воздействие только на поврежденные или патологически измененные клетки организма, практически не затрагивая здоровых. Ученые исследуют противовирусную активность фуллеренов, их способность поглощать свободные радикалы. Установлено, что фуллерены обладают хорошей адсорбционной способностью, поэтому на их основе можно создавать сорбенты, например, для лечения атеросклероза. Самособирающиеся пептидные нанотрубки могут стать эффективным средством борьбы с бактериями, устойчивыми к антибиотикам. Разрабатываемые методы позволят в перспективе получить пептидные препараты, действие которых будет основано на внедрении в наружную мембрану бактерии пептидных колец, которые, собираясь в трубки, приведут к гибели патогенов. Использование нанотехнологий для фототермического разрушения клеток – перспективное направление в лечении рака и инфекционных заболеваний. Суть метода такова. Наночастицы золота имеют максимум поглощения в ближней инфракрасной области, поэтому при облучении данной частью спектра сильно разогреваются. Если при этом они находятся внутри клеток или рядом с ними, то эти клетки погибают. Поместить золотые наночастцы в клетки, которые необходимо уничтожить, можно путем соединения частиц с антителами или другими молекулами, тропными к этим клеткам. Все более актуальной становится проблема устойчивости патогенных организмов к антибиотикам. Например, некоторые штаммы синегнойной палочки (Pseudomonas aeruginosa) не чувствительны ни к одному из существующих антибиотиков. Проблему могут решить наночастицы золота и фотодинамическая терапия. Исследователи из Южной Каролины (США) синтезировали золотые нанопалочки длиной 68 нм и диаметром 18 нм, максимум поглощения для которых наблюдается при длине волны около 785 нм. К этим нанопалочкам «пришили» антитела к Pseudomonas aeruginosa. Полученные частицы были добавлены к культуре синегнойной палочки, которую затем облучали лазером (785 нм, 50 мВатт) в течение 10 минут. Результат соответствовал ожиданиям: выжило в 4 раза меньше бактерий, по сравнению с необлученным образцом. Таким образом, фотодинамическая терапия в сочетании с нанотехнологиями, по-видимому, может быть успешно применена там, где антибиотики бессильны. С помощью нанотехнологий можно модифицировать вспомогательные вещества для повышения качества лекарственных средств. Например, повысить влагоемкость микрокристаллической целлюлозы, с тем чтобы защитить от воздействия влаги фармакологически активные компоненты. Нанокапсулы из различных материалов (кобальта, железа, кадмия и т.д.) могут быть средством транспортировки лекарственных веществ. В них можно «упаковать» и клетки, например, инсулинсекретирующие. Для этого используются капсулы, которые, благодаря малым размерам пор (примерно 6 нм), защищают клетки от воздействия иммунной системы организма. Таким образом, появилась возможность вводить не инсулин, а вырабатывающие его клетки, и, значит, добиться физиологически регулируемого поступления этого гормона в кровь. Перспективными являются управляемые липидно-белковые бионанотрубки. Возможно, в дальнейшем их будут использовать для помещения в нанокапсулы лекарственных веществ (или генов) для доставки в определенные участки организма, а также для извлечения их из капсул. Липидно-белковые нанотрубки состоят из микротрубчатого белка (тубулина), окруженного двойным липидным слоем, который, в свою очередь, покрыт кольцами или спиралями из тубулина. Концы этих нанотрубок могут быть открыты либо закрыты жировыми «шапочками», что зависит от соотношения количества липидов и белков, электрического заряда липидного бислоя. Меняя эти показатели, можно управлять процессом инкапсуляции (введения в капсулу) лекарственного вещества и его высвобождения. Сами такие трубки могут быть средствами доставки лекарств, например, для химиотерапии. В 1999 г. специалисты Корнельского университета (США) разработали биомотор вращательного действия на основе фермента АТФазы. Присоединив к одному концу нанотрубки биомотор, а к другой – набор протеиновых маркеров, связанных с лекарством, находящимся внутри нанотрубки, ученые получили так называемый «наноробот». Для транспортирования молекул и атомов к месту сборки наноробота использовался наноконвейер на основе нанотрубок. Наноробот сможет быстро перемещаться по кровеносным сосудам, доставляя лекарства к больным клеткам. Источником энергии для него служат молекулы АТФ, которых достаточно в крови. Ведется разработка различных нанороботов: микрофагоцитов – искусственных иммунных клеток (предполагается, что они будут находить в организме человека чужеродные соединения и перерабатывать их в нейтральные), респироцитов – аналогов эритроцитов (их внедрение позволит снизить потребность человека в кислороде и подолгу обходиться без него, облегчить самочувствие людей, страдающих астмой), клоттоцитов – искусственных тромбоцитов (они помогут быстро прекращать кровотечения), васкулоидов (комплексы нанороботов, способные выполнять различные функции крови, но делать это гораздо эффективнее). Васкулоиды, циркулирующие в крови, по мнению ученых, могут обезопасить организм от микробов и вирусов, предотвратить возникновение атеросклероза, варикозного расширения вен, восстанавливать поврежденные клетки. Перспективным направлением в современной биохимии и биоэлектронике является создание биосенсорных электрохимических систем на основе наноструктурированных электродов для определения концентрации лекарственных веществ и (или) их метаболитов в биологических средах. Однако результаты этих разработок пока не наши выхода в производство и клиническую практику. Электрохимические системы на основе ферментов (различных изоформ цитохрома Р450) могут быть использованы для диагностики заболеваний, мониторинга метаболизма лекарственных препаратов, а также в качестве модельных детоксикационных систем (для подбора детоксикантов). Внедрение вышеописанных систем позволит существенно повысить чувствительность диагностики. Немаловажное значение в диагностике заболеваний могут получить нанокристаллы. Их уникальным свойством является способность изменять окраску в зависимости от размера. Похожие свойства проявляют и наночастицы из металлов. Вероятно, это позволит создать быстрые сверхчувствительные сенсоры для оптических тестов, с помощью которых можно будет, например, обнаруживать раковые клетки, проводить анализ крови в реанимации, при отравлениях, инфекционных заболеваниях. Не исключено, что будут созданы высокоселективные и чувствительные биосенсоры на основе нановолокон. В частности, исследуется способность протеиновых волокон (которые образуют скелет клетки) проводить электричество в водной среде и возможность создания сенсоров, основанных на регистрации изменения этой проводимости. Сотрудники одной из биотехнологических компаний США разработали устройство для выявления вирусов (ViriChip). Это силиконовый чип, покрытый нанослоем антител к какому-либо вирусу. На поверхность чипа помещают пробу (1 мкл) исследуемого материала. Если в ней содержится искомый вирус, он присоединяется к специфичному антителу. Эту структуру регистрирует атомно-силовой микроскоп. Развитие нанотехнологий, несомненно, приведет к фундаментальной перестройке существующих способов производства материалов. В медицине и фармации это означает создание высокоэффективных препаратов, средств доставки лекарственных веществ к клеткам-мишеням, а также чувствительных дешевых систем для диагностики. Но, как известно, у любой медали – две стороны. Существуют опасения, что широкое применение наноматериалов в медицине создаст новые риски. Наночастицы могут оказаться вредными для человеческого организма, поскольку они свободно проникают через клеточные мембраны. Не исключено их поглощение чувствительными нервными окончаниями и поступление в центральную нервную систему и нервные узлы (путем перемещения вдоль отростков нейронов). Некоторые данные подтверждают предположение, что наночастицы, попадая в организм из атмосферы через дыхательные пути, вызывают нейродегенеративные заболевания. Кроме того, уместен вопрос о судьбе отработавших наночастиц после доставки ими лекарств к больному органу. Марк СИНОВАЦ
15 января 2008
kfv
pharmnews.kz
