Основы молекулярной физики и термодинамики
2.1. Основные положения молекулярно – кинетической теории.
Основные положения МКТ. Параметры состояния. Идеальный газ. Газовые законы. Уравнение Менделеева – Клайперона. Физический смысл температуры. Методы ее измерения. Реальный газ. Атмосфера. Барометрическая формула. Методы измерение атмосферного давления. Легочное дыхание.
Литература: [2, с. 117–129]; [2, с. 121–136]
Молекулярная физика изучает физические свойства макроскопических тел (представляющих собой совокупность большого числа частиц), а также совершающиеся в них физические процессы, обусловленные тепловым движением и взаимодействием микрочастиц (атомов, молекул), составляющих эти тела. При этом используется два метода исследования: термодинамический и молекулярно-кинетический. В первом случае все процессы в макротелах рассматриваются с энергетической точки зрения. При помощи молекулярно-кинетического метода устанавливаются законы протекания различных физических процессов в макротелах на основе их молекулярной структуры и механизма взаимодействия отдельных молекул между собой. Каждый из этих методов нельзя рассматривать изолированно друг от друга.
Представление о том, что все тела построены из мельчайших частиц – атомов, было высказано еще в V в. до н. э. греческим философом Демокритом. Однако атомистические воззрения не получили признания и были возрождены лишь во второй половине XVII в. Бойлем. Затем в XVIII–XIX вв. на основе разработок Ломоносова, Дальтона, Больцмана, Максвелла и других была создана классическая молекулярно-кинетическая теория.
1. Все вещества состоят из очень маленьких отдельных частиц – молекул.
Молекулы
в свою очередь состоят из еще более
мелких частиц –
атомов. Различные
комбинации из атомов и создают все
множество видов молекул. Атомы
также не являются пределом делимости
вещества, а представляют
собой весьма сложные образования,
состоящие из электрически
положительно заряженного ядра, окруженного
отрицательно заряженной электронной
оболочкой. Однако классическая
молекулярно-кинетическая
теория не касается вопроса о строении
атомов и молекул, рассматривая
их упрощенно как твердые частички
сферической формы диаметром
в среднем порядка 10
2. Между молекулами тела одновременно действуют силы взаимного притяжения и силы взаимного отталкивания.
Силы межмолекулярного взаимодействия имеют электрическую природу, обусловленную тем, что молекулы состоят из электрически заряженных частиц (положительных – атомных ядер и отрицательных – электронов), которым, как известно, свойственно притяжение – для разноименно заряженных и отталкивание – для одноименно заряженных частиц. Наличие сил притяжения и отталкивания между молекулами отчетливо обнаруживается в свойстве твердых сохранять свою форму при деформации.
3. Молекулы, образующие тело, находятся в состоянии непрерывного беспорядочного движения.
При этом они сталкиваются друг с другом и изменяют свою скорость, как по направлению, так и по величине. Правда, столкновения в обычном смысле этого слова не происходит, так как соприкосновению молекул препятствуют резко возрастающие при их сближении силы отталкивания.
Скорость движения молекул в теле связана с его температурой: чем больше эта скорость, тем выше температура тела
T = t + 273, 15 (2.1.1)
Температура, равная 0 К, называется абсолютным нулем температуры.
Газ называется идеальным, если взаимодействием между его молекулами можно пренебречь (размеры молекул не учитываются; между молекулами не действуют силы взаимного притяжения; столкновения молекул происходят как столкновения упругих шаров). Очень близки по своим свойствам к идеальному газу гелий и водород, а также разреженные газы при не очень низких температурах. Для таких газов справедливы законы открытые опытным путем еще до появления молекулярно – кинетической теории. При переходе газа из одного состояния в другое его параметры (P, V, T) изменяются. В том случае, когда в ходе такого процесса один из параметров состояния (при неизменной массе) остается постоянным, такой процесс называют изопроцессом.
Изотермический процесс протекает при постоянной температуре (Т=const) и описывается законом Бойля – Мариотта: для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная
PV = const (2.1.2)
Рисунок 2.1
Эта кривая носит название изотермы.
Изобарический процесс протекает при постоянном давлении (p = const) и подчиняется закону Гей-Люссака: объем данной массы при постоянном давлении возрастает линейно с ростом температуры
V = V0 (1 + αt) (2.1.3)
где V0 – объем при 0°С, V – объем при температуре t, α – термический коэффициент объемного расширения

Рисунок 2.2
Пунктирная линия на графике означает, что экспериментальные газовые законы неприменимы в области низких температур.
При низких температурах вещество переходит в жидкое или твердое состояние. Введя абсолютную температуру Т можно представить формулу (2.1.3) в другом виде
 (2.1.4)
(2.1.4)
Изохорический процесс протекает при постоянном объеме (V = const) и описывается законом Шарля: давление данной массы газа при постоянном объеме возрастает линейно с ростом температуры
p= p0 (1 + γt) (2.1.5)
где p0 – давление при 0°С, p – давление при температуре t, γ – термический коэффициент давления. Для идеального газа γ = α. График изохорического процесса, только в координатах V и t, аналогичен графику изобарического процесса. Введя абсолютную температуру Т можно представить формулу (2.1.5) в виде
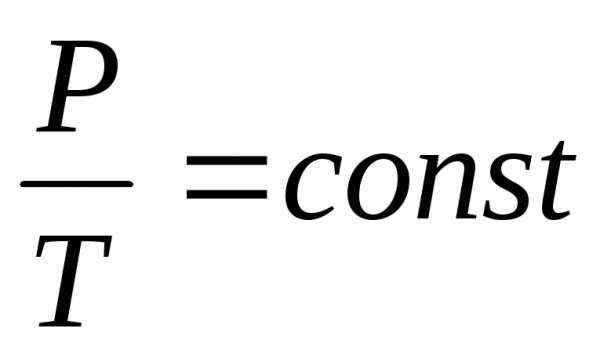 (2.1.6)
(2.1.6)
Рассмотрим самый общий случай газового процесса, когда одновременно изменяются и объем, и давление, и температура. Закон, описывающий такого рода процесс, был установлен в 1834 г. французским физиком Клайпероном путем объединения экспериментальных газовых законов и имеет следующий вид
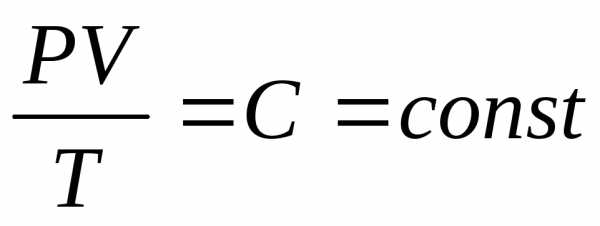 (2.1.7)
(2.1.7)
где С – постоянная величина, называемая газовой постоянной. Это значит, что для данной массы газа величина PV/T остается неизменной. Недостатком уравнения Клайперона является тот факт, что постоянная С различна для разных газов. Менделеев усовершенствовал закон Клайперона, используя закон Авогадро (установлен в 1811 г. итальянским ученым Авогадро), который гласит, что при одинаковых температуре и давлении моли любых газов занимают одинаковые объемы. Полученное Менделеевым выражение получило название уравнение Клайперона – Менделеева или уравнение состояния идеального газа и имеет вид
 (2.1.8)
(2.1.8)
где M – молярная масса газа, R = 8, 32 Дж/(К·моль) – универсальная газовая постоянная. R одинакова для всех газов. Универсальная газовая постоянная численно равна работе при изобарическом расширении 1 моля газа вследствие нагревания его на один градус (физический смысл).
С точки зрения молекулярно-кинетической теории газ представляет множество хаотически движущихся молекул. В процессе движения молекулы газа ударяются об стенки сосуда (действуют на стенки с некоторой силой). Рассчитанная на единицу площади стенки эта сила представляет собой давление газа. Сила удара зависит от скорости молекул, а, следовательно, давление газа является функцией кинетической энергии его молекул. Данная зависимость была выведена в 50-х годах XIX века немецким физиком Клаузиусом и получила название основного уравнения молекулярно-кинетической теории идеального газа
 (2.1.9)
(2.1.9)
где
p
– давление газа, n
– концентрация молекул газа, 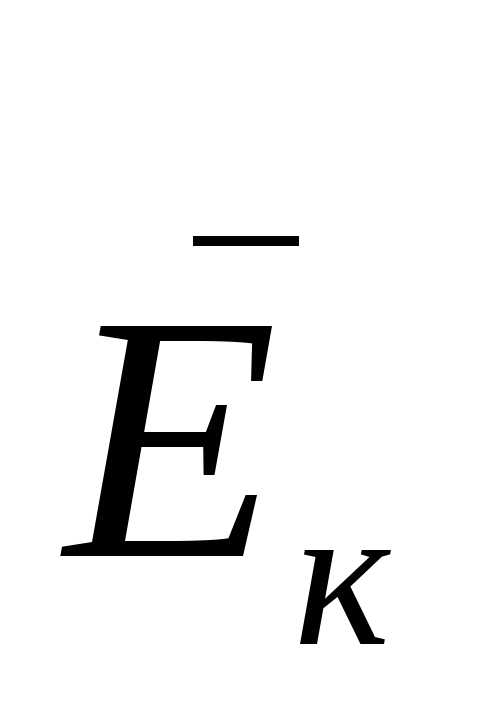 –
средняя кинетическая энергия
поступательного движения молекул газа.
Воспользовавшись уравнением
Клайперона-Менделеева можно получить
следующее выражение
–
средняя кинетическая энергия
поступательного движения молекул газа.
Воспользовавшись уравнением
Клайперона-Менделеева можно получить
следующее выражение
 (2.1.10)
(2.1.10)
где k = R/NA = 1,38·10-23 Дж/К – постоянная Больцмана. Из формулы (2.1.10) следует, что термодинамическая температура есть величина, пропорциональная средней кинетической энергии поступательного движения молекул идеального газа. Таким образом, абсолютная температура является мерой средней кинетической энергии поступательного движения молекул газа (физический смысл температуры). Подставив (2.1.10) в (2.1.9) получим, что
 (2.1.11)
(2.1.11)
Из этого выражения находим, что
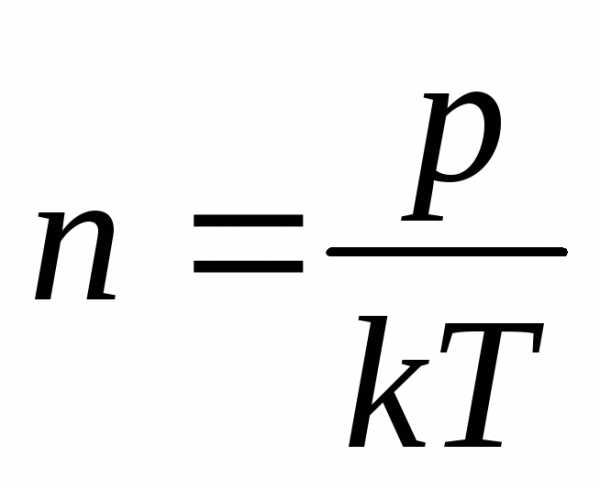 (2.1.12)
(2.1.12)
Из формулы (2.1.12) видно, что при одинаковых температуре и давлении все газы содержат в единице объема одинаковое число молекул. Так например при нормальных условиях в 1м3 газа содержится число молекул n = 2,69·1025м-3 (число Лошмидта).
Ввиду хаотичности теплового движения траектория движения молекул представляет собой ломаную линию. Длинной свободного пробега называется путь проходимый ею между двумя последовательными столкновениями. Длина свободного пробега все время меняется. Поэтому следует говорить о средней длине свободного пробега как о среднем пути, проходимом молекулой между двумя последовательными столкновениями.
Уравнение Клайперона-Менделеева описывает поведение идеального газа, молекулы которого можно рассматривать как материальные точки, между которыми не действуют силы взаимного притяжения. Чтобы получить уравнение состояния реального газа, голландский физик Ван-дер-Ваальс в 1837 г. ввел в уравнение Клайперона-Менделеева соответствующие поправки. Запишем уравнение Клайперона-Менделеева для одного моля газа
(2.1.13)
где VMобъем одного моля идеального газа, или, то же самое, что и объем сосуда, в котором могут двигаться его молекулы. У реального газа часть b этого объема занимают сами молекулы. Поэтому свободный объем, в котором могут двигаться молекулы реального газа меньше VM на величину VM – b. Величина b зависит от вида газа.
Давление p в формуле (2.1.13) это фактически давление, производимое на идеальный газ стенками сосуда. Действие сил притяжения между молекулами реального газа вызывает добавочное сжатие газа, создавая тем самым добавочное внутреннее давление p‘. Поэтому фактическое давление реального газа будет равно p + p‘. Ван-дер-Ваальс установил, что внутреннее давление обратно пропорционально квадрату объема
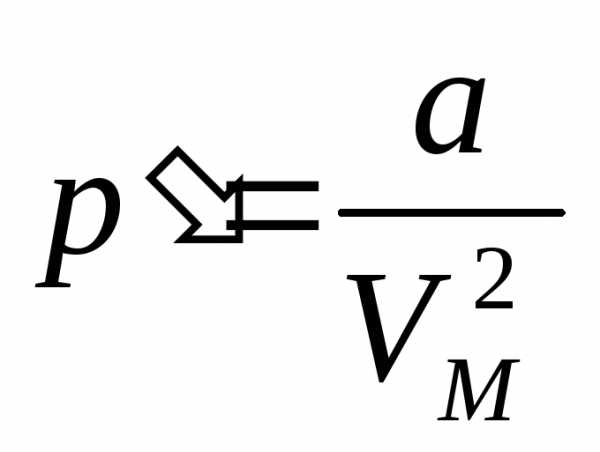 (2.1.14)
(2.1.14)
где a – коэффициент пропорциональности, зависящий от вида газа. С учетом данных поправок формула (2.1.13) примет следующий вид
 (2.1.15)
(2.1.15)
– уравнение Ван-дер-Ваальса или уравнение состояния реального газа для одного моля. Учитывая, что V = νVM(где V – объем ν молей газа), а ν = m/M, легко перейти к уравнению Ван-дер-Ваальса для любой массы газа m
(2.1.16)
где М – молярная масса газа.
Самый важный для человека газ – это воздух. Земля окружена атмосферой – слоем воздуха состоящего из смеси различных газов. Атмосфера удерживается около Земли силами тяготения и оказывает давление на все тела, которые она окружает. Масса атмосферы составляет около 5·1015 тонн. Давление воздуха на уровне моря во всех пунктах земной поверхности равно приблизительно 105 Па и меняется в зависимости от различных процессов, происходящих в атмосфере. Давление атмосферы убывает с высотой по нелинейному (экспоненциальному) закону. Это объясняется тем, что с ростом высоты уменьшается не только вес столба воздуха, но и его плотность. Данная зависимость описывается барометрической формулой
 (2.1.17)
(2.1.17)
где p0 – давление атмосферы на уровне моря ( h = 0), p – давление на высоте h, М – молярная масса воздуха, g – ускорение свободного падения, Т – температура, R – универсальная газовая постоянная. Атмосферное давление измеряют при помощи барометров.
Во всех органах и клетках постоянно происходит разрушение углеводов, белков и жиров, причем распад этих веществ почти всегда связан с окислением. При окислении поглощается кислород и образуется углекислый газ. Обмен этими газами между организмом и окружающей средой происходит в легких при дыхании.
При вдохе, когда грудная клетка расширяется, воздух «засасывается» в легкие. Сначала вдыхаемый воздух поступает в носовую полость, где согревается, увлажняется и очищается от пыли; поэтому очень важно дышать носом, а не ртом. Затем воздух переходит в носоглотку и гортань. Продолжением гортани служит дыхательное горло-трахея, которая представляет собой трубку длиной примерно 12 см. От трахеи отходят еще две трубки-главные бронхи, идущие к обоим легким. В этих дыхательных путях выделяется слизь, которая задерживает поступающую с воздухом пыль. Кроме того, в гортани, трахее и бронхах имеются мерцательные реснички, своими постоянными движениями способствующие удалению пыли и других посторонних частиц.
Бронхи разветвляются в легких на более мелкие трубочки, заканчивающиеся тонкостенными легочными пузырьками, или альвеолами. Количество их достигает нескольких миллионов. В них-то и попадает, в конце концов, воздух. Во время каждого вдоха при спокойном дыхании до легочных альвеол доходит 300-400 мл воздуха. При усиленном дыхании в легкие поступает воздуха в несколько раз больше.
Легочные пузырьки оплетены многочисленными капиллярами – мельчайшими кровеносными сосудами, которые можно видеть только с помощью микроскопа. Толщина стенки легочных пузырьков и легочных капилляров измеряется ничтожными долями миллиметра. Молекулы кислорода легко проникают из воздуха, содержащегося в легочных пузырьках, в кровь. Вот почему выдыхаемый воздух содержит около 17% кислорода, т. е. на 4% меньше, чем вдыхаемый воздух.
Следовательно, в легких кровь обогащается кислородом. Одновременно из крови в воздух легочных альвеол поступает углекислый газ. Если во вдыхаемом воздухе имеются лишь следы углекислого газа (0,03%), то в выдыхаемом воздухе его содержится около 3,5%. Кроме того, за сутки через легкие выделяется из организма около 0,3-0,4 л воды. В выдыхаемом воздухе всегда много водяных паров. Поэтому в холодный день во время выдоха видны клубы водяных паров около ноздрей и рта. Эти водяные пары, попав из теплых легких в холодную атмосферу, превращаются в мелкие капельки воды. То же происходит, если дышать на холодное стекло: на нем появляется налет влаги, оно «запотевает».
studfiles.net
Основы молекулярной физики и термодинамики
Федун В. И. Конспект лекций по физике Молекулярная физика и термодинамика
Молекулярная физика и термодинамика – разделы физики, в которых изучаются макроскопические процессы в телах, связанные с огромным числом содержащихся в этих телах атомов и молекул.
Лекция 13.
12. 1. Статистический и термодинамический методы исследования.
В основе исследования лежат два метода: термодинамический и статистический.
Термодинамикой называют науку о наиболее общих свойствах макроскопических физических систем, находящихся в состоянии термодинамического равновесия, и о процессах перехода между этими состояниями. Она позволяет найти общие закономерности при установлении равновесия в физических системах.
Термодинамика строится на основе фундаментальных принципов (начал), которые являются обобщением многочисленных наблюдений и выполняются независимо от конкретной природы образующих систему тел. Поэтому закономерности и соотношения между физическими величинами, к которым приводит термодинамика, имеют универсальный характер.
Термодинамический метод. (Основа термодинамики) – метод исследования систем, состоящих из большого числа частиц и оперирующий величинами, характеризующими всю систему в целом (например, объём, давление, температура), не рассматривая микроструктуры системы и проходящих в системе микропроцессов.
Термодинамический метод применим для большинства областей физики, химии и других наук. Термодинамический метод устанавливает связи между макроскопическими характеристиками системы и ничего не говорит о микроструктуре системы, механизмах явлений и т.д.
Недостаток термодинамического метода (независимость от конкретной природы вещества) восполняется статистическим методом, лежащим в основе молекулярной физики.
Молекулярная физика – раздел физики, в котором изучаются строение и свойства вещества исходя из молекулярно-кинетических представлений, основывающихся на том, что все тела состоят из молекул, находящихся в непрерывном хаотическом движении.
Статистический метод (основа молекулярной физики) – метод исследования систем из большого числа частиц, оперирующий статистическими закономерностями и средними значениями физических величин, характеризующих всю совокупность частиц, например, средние значения скоростей теплового движения молекул и их энергий.
Процессы, изучаемые молекулярной физикой, являются результатом совокупного действия огромного числа молекул. Поэтому в молекулярной физике оперируют не характеристиками каждой частицы, а некоторыми средними значениями величин, взятыми по всем частицам. Например, температура тела определяется (обусловлена) скоростью беспорядочного движения молекул, но так как в любой момент времени различные молекулы имеют различные скорости, то она может быть выражена через среднее значение скорости движения молекул.
Нельзя говорить о температуре одной молекулы.
12. 2. Основные понятия термодинамики и молекулярной физики.
12. 2. 1. Основные понятия термодинамики.
Термодинамическая система – совокупность макроскопических тел, которые обмениваются энергией как между собой, так и с внешней средой.
Внешняя среда – тела, не входящие в исследуемую термодинамическую систему.
Замкнутая термодинамическая система – система, не обменивающаяся с внешней средой ни энергией, ни веществом.
Термодинамические параметры (параметры состояния) – совокупность физических величин, характеризующих свойства термодинамической системы. Обычно в качестве параметров состояния выбирают объём, давление и температуру.
Термодинамический процесс – любое изменение в термодинамической системе, связанное с изменением хотя бы одного из её термодинамическ их параметров.
Термодинамическое равновесие – неизменность состояния системы с течением времени, при этом предполагается, что внешние условия системы так же не изменяются.
В термодинамике постулируется, что каково бы ни было начальное состояние тел изолированной системы, в ней, в конце концов, установится термодинамическое равновесие.
Это утверждение называют общим началом термодинамики.
Переход системы в состояние термодинамического равновесия называется релаксацией.
Под термодинамически равновесным состоянием подразумевается такое состояние физической системы, в которое она самопроизвольно переходит через достаточно большой промежуток времени в условиях изоляции от внешней среды. В состоянии термодинамического равновесия в системе прекращаются все необратимые процессы, связанные с диссипацией энергии: теплопроводность, диффузия, химические реакции и другие. Параметры системы, находящейся в состоянии термодинамического равновесия, не меняются со временем. Строго говоря, те параметры системы, которые не фиксируют заданные условия существования системы, могут испытывать малые колебания относительно своих средних значений – флуктуации.
Существование температуры как параметра, единого для всех частей находящейся в равновесии системы, называют нулевым началом термодинамики.
studfiles.net
Основы молекулярной физики и термодинамики
Федун В. И. Конспект лекций по физике Молекулярная физика и термодинамика
Молекулярная физика и термодинамика – разделы физики, в которых изучаются макроскопические процессы в телах, связанные с огромным числом содержащихся в этих телах атомов и молекул.
Лекция 13.
12. 1. Статистический и термодинамический методы исследования.
В основе исследования лежат два метода: термодинамический и статистический.
Термодинамикой называют науку о наиболее общих свойствах макроскопических физических систем, находящихся в состоянии термодинамического равновесия, и о процессах перехода между этими состояниями. Она позволяет найти общие закономерности при установлении равновесия в физических системах.
Термодинамика строится на основе фундаментальных принципов (начал), которые являются обобщением многочисленных наблюдений и выполняются независимо от конкретной природы образующих систему тел. Поэтому закономерности и соотношения между физическими величинами, к которым приводит термодинамика, имеют универсальный характер.
Термодинамический метод. (Основа термодинамики) – метод исследования систем, состоящих из большого числа частиц и оперирующий величинами, характеризующими всю систему в целом (например, объём, давление, температура), не рассматривая микроструктуры системы и проходящих в системе микропроцессов.
Термодинамический метод применим для большинства областей физики, химии и других наук. Термодинамический метод устанавливает связи между макроскопическими характеристиками системы и ничего не говорит о микроструктуре системы, механизмах явлений и т.д.
Недостаток термодинамического метода (независимость от конкретной природы вещества) восполняется статистическим методом, лежащим в основе молекулярной физики.
Молекулярная физика – раздел физики, в котором изучаются строение и свойства вещества исходя из молекулярно-кинетических представлений, основывающихся на том, что все тела состоят из молекул, находящихся в непрерывном хаотическом движении.
Статистический метод (основа молекулярной физики) – метод исследования систем из большого числа частиц, оперирующий статистическими закономерностями и средними значениями физических величин, характеризующих всю совокупность частиц, например, средние значения скоростей теплового движения молекул и их энергий.
Процессы, изучаемые молекулярной физикой, являются результатом совокупного действия огромного числа молекул. Поэтому в молекулярной физике оперируют не характеристиками каждой частицы, а некоторыми средними значениями величин, взятыми по всем частицам. Например, температура тела определяется (обусловлена) скоростью беспорядочного движения молекул, но так как в любой момент времени различные молекулы имеют различные скорости, то она может быть выражена через среднее значение скорости движения молекул.
Нельзя говорить о температуре одной молекулы.
12. 2. Основные понятия термодинамики и молекулярной физики.
12. 2. 1. Основные понятия термодинамики.
Термодинамическая система – совокупность макроскопических тел, которые обмениваются энергией как между собой, так и с внешней средой.
Внешняя среда – тела, не входящие в исследуемую термодинамическую систему.
Замкнутая термодинамическая система – система, не обменивающаяся с внешней средой ни энергией, ни веществом.
Термодинамические параметры (параметры состояния) – совокупность физических величин, характеризующих свойства термодинамической системы. Обычно в качестве параметров состояния выбирают объём, давление и температуру.
Термодинамический процесс – любое изменение в термодинамической системе, связанное с изменением хотя бы одного из её термодинамическ их параметров.
Термодинамическое равновесие – неизменность состояния системы с течением времени, при этом предполагается, что внешние условия системы так же не изменяются.
В термодинамике постулируется, что каково бы ни было начальное состояние тел изолированной системы, в ней, в конце концов, установится термодинамическое равновесие.
Это утверждение называют общим началом термодинамики.
Переход системы в состояние термодинамического равновесия называется релаксацией.
Под термодинамически равновесным состоянием подразумевается такое состояние физической системы, в которое она самопроизвольно переходит через достаточно большой промежуток времени в условиях изоляции от внешней среды. В состоянии термодинамического равновесия в системе прекращаются все необратимые процессы, связанные с диссипацией энергии: теплопроводность, диффузия, химические реакции и другие. Параметры системы, находящейся в состоянии термодинамического равновесия, не меняются со временем. Строго говоря, те параметры системы, которые не фиксируют заданные условия существования системы, могут испытывать малые колебания относительно своих средних значений – флуктуации.
Существование температуры как параметра, единого для всех частей находящейся в равновесии системы, называют нулевым началом термодинамики.
studfiles.net
Основы молекулярной физики и термодинамики
2.1. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ИДЕАЛЬНЫХ ГАЗОВ
● Закон Бойля-Мариотта
рV = const при Т = const, m = const,
где р – давление; V – объем; Т – термодинамическая температура; m – масса газа.
● Закон Гей-Люссака
V =V0 (1+ αt) , или V1 /V2 = T1 /T2
при p = const, m = const;
p = p0 (1+ αt) , или p1 / p2 =T1 /T2
при V = const, m = const,
где t – температура по шкале Цельсия; V0 и p0 – соответственно объем и давление при 0 °С; коэффициент α =1/ 273 К−1 ; индексы 1 и 2 относятся к произвольным состояниям.
● Закон Дальтона для давления смеси n идеальных газов
где pi – парциальное давление i-го компонента смеси.
● Уравнение состояния идеального газа (уравнение Клапейрона-Менделеева)
pVm = RT (для одного моля газа),
pV = (m/M)RT (для произвольной массы газа),
где Vm – молярный объем; R – молярная газовая постоянная; M – молярная масса газа; m – масса газа; m/M = ν – количество вещества.
● Зависимость давления газа от концентрации n молекул и температуры
p = nkT ,
где k – постоянная Больцмана ( k = R/ NA , NA – постоянная Авогадро).
● Основное уравнение молекулярно-кинетической теории идеальных газов
или
или
где 〈 υкв 〉 – средняя квадратичная скорость молекул; Е – суммарная кинетическая энергия поступательного движения всех молекул газа; n – концентрация
молекул, m0 – масса одной молекулы; m = Nm0 – масса газа; N – число молекул в объеме газа V.
● Скорость молекул:
– наиболее вероятная
– средняя квадратичная
– средняя арифметическая
где m0 – масса одной молекулы.
● Средняя кинетическая энергия поступательного движения молекулы идеального газа
● Закон Максвелла для распределения молекул идеального газа по скоростям
где функция f (υ) распределения молекул по скоростям определяет относительное число молекул dN(υ)/ N из общего числа N молекул, скорости которых лежат в интервале от υ до υ + dυ .
● Закон Максвелла для распределения молекул идеального газа по энергиям теплового движения
где функция f (ε) распределения молекул по энергиям теплового движения определяет относительное число молекул dN(ε)/ N из общего числа N молекул, которые имеют кинетические энергии ε = m0υ2 / 2 , заключенные в интервале от ε до ε + dε.
● Барометрическая формула
где ph и p0 – давление газа на высоте h и h0 .
● Распределение Больцмана во внешнем потенциальном поле
где n и n0 – концентрация молекул на высоте h и h = 0 ; П = m0gh – потенциальная энергия молекулы в поле тяготения.
● Среднее число соударений, испытываемых молекулой газа за 1 с,
где d – эффективный диаметр молекулы; п – концентрация молекул; 〈υ〉 – средняя арифметическая скорость молекул.
● Средняя длина свободного пробега молекул газа
● Закон теплопроводности Фурье
где Q – теплота, прошедшая посредством теплопроводности через площадь S за время t; dT / dx – градиент температуры; λ – теплопроводность:
где cV – удельная теплоемкость газа при постоянном объеме; ρ – плотность газа; 〈υ〉 – средняя арифметическая скорость теплового движения его молекул; 〈l〉 – средняя длина свободного пробега молекул.
● Закон диффузии Фика
где М – масса вещества, переносимая посредством диффузии через площадь S за время t; dρ/ dx – градиент плотности, D – диффузия:
● Закон Ньютона для внутреннего трения (вязкости)
где F – сила внутреннего трения между движущимися слоями площадью S; dυ/ dx – градиент скорости; η – динамическая вязкость:
2.2. ОСНОВЫ ТЕРМОДИНАМИКИ
● Средняя кинетическая энергия поступательного движения, приходящаяся на одну степень свободы молекулы,
● Средняя энергия молекулы
где i – сумма поступательных, вращательных и удвоенного числа колебательных степеней свободы (i = nпост + nвращ + 2nколеб ).
● Внутренняя энергия идеального газа
где ν – количество вещества; m – масса газа; М – молярная масса газа; R – молярная газовая постоянная.
● Первое начало термодинамики
Q = ΔU + A ,
где Q – количество теплоты, сообщенное системе или отданное ею; ΔU – изменение ее внутренней энергии; А – работа системы против внешних сил.
● Первое начало термодинамики для малого изменения системы
dQ = dU + δA.
● Связь между молярной Cm и удельной с теплоемкостями газа
Cm = cM ,
где М – молярная масса газа.
● Молярные теплоемкости газа при постоянном объеме и постоянном давлении
● Уравнение Майера
Cp = CV + R .
● Изменение внутренней энергии идеального газа
● Работа, совершаемая газом при изменении его объема,
δA = pdV .
● Полная работа при изменении объема газа
где V1 и V2 – соответственно начальный и конечный объемы газа.
● Работа газа:
– при изобарном процессе
– при изотермическом процессе
● Уравнение адиабатического процесса (уравнение Пуассона)
pV γ = const , TVγ−1 = const , Tγ p1−γ = const ,
где γ = Cp /CV = (i + 2)/ i – показатель адиабаты.
● Работа в случае адиабатического процесса
или
где T1 , T2 и V1 , V2 – соответственно начальные и конечные температура и объем газа.
● Термический коэффициент полезного действия для кругового процесса (цикла)
где Q1 – количество теплоты, полученное системой; Q2 – количество теплоты, отданное системой; А – работа, совершаемая за цикл.
● Термический коэффициент полезного действия цикла Карно
где T1 – температура нагревателя; T2 – температура холодильника.
● Изменение энтропии при равновесном переходе из состояния 1 в состояние 2
2.3. РЕАЛЬНЫЕ ГАЗЫ, ЖИДКОСТИ И ТВЕРДЫЕ ТЕЛА
● Уравнение состояния реальных газов (уравнение Ван-дер-Ваальса) для моля газа
где Vm – молярный объем; а и b – постоянные Ван-дер-Ваальса, различные для разных газов.
● Уравнение Ван-дер-Ваальса для произвольной массы газа
или
где ν = m / М – количество вещества.
● Внутреннее давление, обусловленное силами взаимодействия молекул,
p′ = a /Vm2 .
● Связь критических параметров (объема, давления и температуры) с постоянными а и b Ван-дер-Ваальса
Vk = 3b, pk = a /(27b2), Tk = 8a /(27Rb).
● Внутренняя энергия реального газа
U = ν (CVT − a /Vm) ,
где CV – молярная теплоемкость газа при постоянном объеме.
● Энтальпия системы
U1 + p1V1 =U2 + p2V2 ,
где индексы 1 и 2 соответствуют начальному и конечному состояниям системы.
● Поверхностное натяжение
σ = F / l , или σ = ΔE / ΔS ,
где F – сила поверхностного натяжения, действующая на контур l, ограничивающий поверхность жидкости; ΔЕ – поверхностная энергия, связанная с площадью ΔS поверхности пленки.
Δp = σ (1/ R1 + 1/ R2) ,
где R1 и R2 – радиусы кривизны двух взаимно перпендикулярных нормальных сечений поверхности жидкости; радиус кривизны положителен, если центр кривизны находится внутри жидкости (выпуклый мениск), и отрицателен, если центр кривизны находится вне жидкости (вогнутый мениск). В случае сферической поверхности
Δp = 2σ / R .
● Высота подъема жидкости в капиллярной трубке
где θ – краевой угол; r – радиус капилляра; р – плотность жидкости; g – ускорение свободного падения.
● Закон Дюлонга и Пти
CV = 3R ,
где CV – молярная (атомная) теплоемкость химически простых твердых тел.
● Уравнение Клапейрона-Клаузиуса, позволяющее определить изменение температуры фазового перехода в зависимости от изменения давления при равновесно протекающем процессе,
где L – теплота фазового перехода; (V2 −V1) – изменение объема вещества при переходе его из первой фазы во вторую; Т – температура перехода (процесс изотермический).
studyport.ru
Молекулярная физика и основы термодинамики электронный учебник по физике – Список учебников
КГТУ-КХТИ. Кафедра физики. Поливанов М.А., Старостина И.А., Кондратьева О.И.
Для перемещения по тексту электронного учебника можно использовать:
1- нажатие клавиш PgDn, PgUp,, для перемещения по страницам и строкам;
2- нажатие левой клавиши «мыши» по выделенному тексту для перехода в требуемый раздел;
3- нажатие левой клавиши «мыши» по выделенному значку @ для перехода в оглавление.
ВВЕДЕНИЕ. @
Молекулярная физика – раздел физики, в котором изучаются свойства тел в различных агрегатных состояниях на основе рассмотрения их молекулярного строения. Физические свойства макроскопических систем (т.е. систем, состоящих из очень большого числа частиц) изучаются двумя разными, но взаимно дополняющими друг друга методами – статистическим и термодинамическим.
Статистический метод основан на использовании теории вероятностей. В этом методе свойства макроскопической системы определяются усредненными значениями скорости частиц, их энергии и других динамических характеристик. Например, температура тела определяется скоростью хаотического движения его молекул, но так как в любой момент времени различные молекулы имеют разные скорости, то температура может быть выражена только через среднее значение скорости движения. Нельзя говорить о температуре одной молекулы.
Термодинамический метод основан на анализе законов и условий, характеризующих, происходящие в системе изменения макропараметров типа давления, энергии, энтропии и др. В этом методе не рассматривается внутреннее микроскопическое строение изучаемых тел и их изменения. Раздел теоретической физики, в котором изучаются свойства макроскопических систем и энергетика различных физических и химических процессов, называется термодинамикой. В основе термодинамики лежит несколько фундаментальных законов (начал), которые являются обобщением многочисленных наблюдений.
1. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ИДЕАЛЬНЫХ ГАЗОВ
1.1. Термодинамические параметры. @
Мысленно выделенная макроскопическая система, рассматриваемая методами термодинамики, называется термодинамической системой. Все тела, не включенные в состав исследуемой системы, называются внешней средой. Состояние системы задается термодинамическими параметрами (или, по-другому, параметрами состояния) – совокупностью физических величин, характеризующих свойства системы. Обычно в качестве основных параметров выбирают давление р, температуру Т и удельный объем v. Различают два типа термодинамических параметров: экстенсивные и интенсивные. Экстенсивные параметры пропорциональны количеству вещества в системе, а интенсивные не зависят от количества вещества и массы системы. Интенсивными параметрами являются давление, температура, удельный объем и др., а экстенсивными – объем, энергия, энтропия.
Объем пропорционален количеству вещества в системе. При расчетах удобнее оперировать с удельным объемом v – это величина, равная отношению объема к массе системы, то есть объем единицы массы v = V/m = 1/ρ, где ρ – плотность вещества.
Давлением называется физическая величина 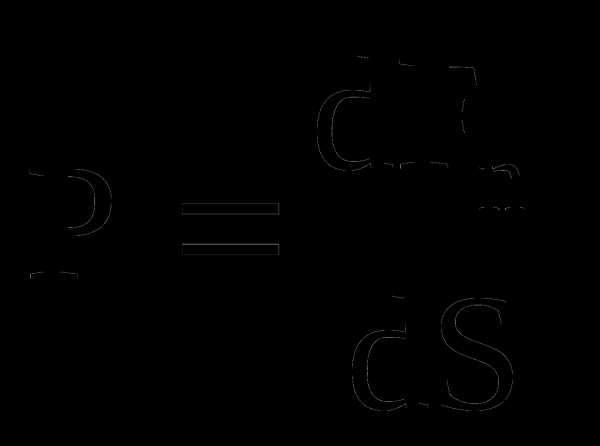 где dFn– проекция силы на нормаль к поверхности площадьюdS.
где dFn– проекция силы на нормаль к поверхности площадьюdS.
Температура – это физическая величина, характеризующая энергию макроскопической системы, находящейся в состоянии термодинамического равновесия. Температура системы является мерой интенсивности теплового движения и взаимодействия частиц, образующих систему. В этом состоит молекулярно-кинетический смысл температуры. В настоящее время существует две температурных шкалы – термодинамическая (градуированная в Кельвинах (К)) и Международная практическая (градуированная в градусах Цельсия (˚С)). 1˚С = 1К. Связь между термодинамической температурой Т и температурой по Международной практической шкале имеет вид: Т = t + 273,15˚С.
Всякое изменение состояния термодинамической системы, характеризующееся изменением ее параметров, называется термодинамическим процессом. Термодинамический процесс называется равновесным, если при этом система проходит ряд бесконечно близких равновесных состояний. Равновесное состояние – это такое состояние, в которое система приходит в конце концов при неизменных внешних условиях и дальше остается в этом состоянии сколь угодно долго. Реальный процесс изменения состояния системы будет тем ближе к равновесному, чем медленнее он совершается.
1. 2. Уравнение состояния идеального газа. @
В молекулярно-кинетической теории широко используется физическая модель идеального газа. Это вещество, находящееся в газообразном состоянии, для которого выполняются следующие условия:
Собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда.
Между молекулами газа отсутствуют взаимодействия, кроме случайных столкновений.
Столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
Модель идеального газа можно использовать при изучении реальных газов, т.к. они при условиях, близких к нормальным (давление р0 = 1,013∙105Па, температура Т0=273,15К) ведут себя аналогично идеальному газу. Например, воздух при Т=230К и р= р0/50 по всем трем критериям подобен модели идеального газа.
Поведение идеальных газов описывается рядом законов.
Закон Авогадро: моли любых газов при одинаковых температуре и давлении занимают одинаковые объемы. При нормальных условиях этот объем равен VM=22,4∙10-3м3/моль. В одном моле различных веществ содержится одно и то же число молекул, называемое числом Авогадро NA= 6,022∙1023моль-1 .
Закон Бойля – Мариотта: для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная pV = const при Т = const и m = const.
Закон Шарля: давление данной массы газа при постоянном объеме изменяется линейно с температурой р=р0(1+αt) при V = const и m = const.
Закон Гей-Люссака: объем данной массы газа при постоянном давлении изменяется линейно с температурой V = V0(1+αt) при р = const и m = const. В этих уравнениях t – температура по шкале Цельсия, р0 иV0 -давление и объем при 0°С, коэффициент α =1/273,15 К-1.
Французский физик и инженер Б.Клапейрон и русский ученый Д.И.Менделеев, объединив закон Авогадро и законы идеальных газов Бойля – Мариотта, Шарля и Гей – Люссака, вывели уравнение состояния идеального газа – уравнение, связывающее вместе все три термодинамических параметра системы: для одного моля газа рVМ= RT и для произвольной массы газа
г
де VМ – молярный объем, т.е. объем одного моля газа, R – молярная газовая постоянная, равная 8,31Дж/(моль·К), М – молярная масса, V= VМ· m/M – объем всей массы газа, = m/M – количество вещества в молях. Это уравнение называется уравнением Менделеева– Клапейрона.
Существует еще одна форма записи данного уравнения:
Е
е можно получить, если учесть, что k =R/NA= 1,38∙10-23 Дж/К – это постоянная Больцмана, а n =NA/VМ – это концентрация молекул газа.
Для расчета давления в смеси разных газов применяется закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений входящих в нее газов: р =р1 + р2 + … + pn . Парциальное давление – это такое давление, которое производил бы газ, входящий в состав газовой смеси, если бы он один занимал объем, равный объему смеси при той же температуре. Для расчета парциального давления идеального газа используют уравнение Менделеева– Клапейрона.
1. 3. Основное уравнение молекулярно – кинетической теории идеальных газов и его следствия. @
Рассмотрим одноатомный идеальный газ, занимающий некоторый объем V (рис.1.1.) Пусть число столкновений между молекулами пренебрежимо мало по сравнению с числом столкновений со стенками сосуда. В
Рис.1.1. К выводу основного уравнения молекулярно-кинетической теории.
ыделим на стенке сосуда некоторую элементарную площадку ΔS и вычислим давление, оказываемое на эту площадку. При каждом соударении молекула, массой m0, движущаяся перпендикулярно площадке со скоростью υ, передает ей импульс, который представляет собой разницу импульсов молекулы до и после соударения:m0υ -(-m0υ) = 2m0υ.
За время Δt площадки ΔS достигнут только те молекулы, которые заключены в объеме цилиндра с основанием ΔS и длиной υΔt. Это число молекул будет nυΔSΔt, где n – концентрация молекул. Необходимо, однако, учитывать, что реально молекулы движутся к площадке под разными углами и имеют различные скорости, причем скорость молекул при каждом соударении меняется. Для упрощения расчетов хаотическое движение молекул заменяют движением вдоль трех взаимно перпендикулярных координатных осей, так что в любой момент времени вдоль каждого из них движется 1/3 молекул, причем половина – 1/6 – движется в одну сторону, половина – в противоположную. Тогда число ударов молекул, движущихся в заданном направлении, о площадку ΔS будет nυΔSΔt /6. При столкновении с площадкой эти молекулы передадут ей импульс
.
В данном случае, когда сила, действующая на единицу площади, постоянна, для давления газа на стенку сосуда мы можем записать р = F/ΔS = ΔP/ΔSΔt = = nm0υ2/3. Молекулы в сосуде движутся с самыми различными скоростями υ1,υ2….υn, общее число их – N. Поэтому необходимо рассматривать среднюю квадратичную скорость, которая характеризует всю совокупность молекул:
Т
аким образом, давление газа, оказываемое им на стенку сосуда, будет равно
П
риведенное выше уравнение и есть основное уравнение молекулярно-кинетической теории идеальных газов. Поскольку m0‹υкв›2/2 – это средняя энергия поступательного движения молекулы ‹ εпост›, уравнение можно переписать в виде:
С
ледствия:
1. Учитывая, что концентрация n = N/V, получаем
г
де E – суммарная кинетическая энергия поступательного движения всех молекул газа. Таким образом, давление равно двум третям энергии поступательного движения молекул, содержащихся в единице объема газа.

2. Для вывода второго следствия воспользуемся первым следствием и уравнением Менделеева-Клапейрона:
Энергия молекул Е в веществе пропорциональна количеству вещества в системе и температуре.
Н
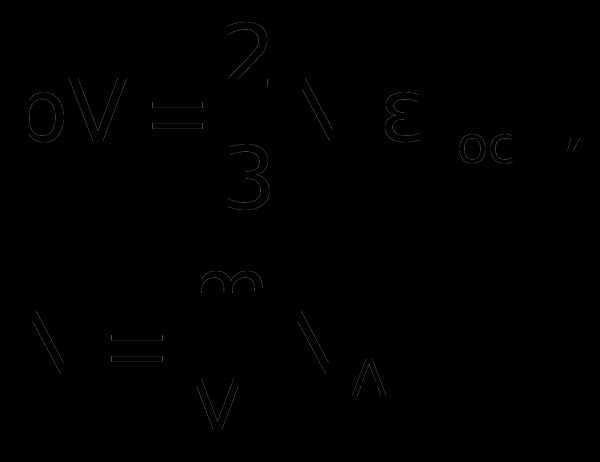
айдем еще кинетическую энергию поступательного движения одной молекулы ‹ εпост›, учитывая
k =R/NA получим:
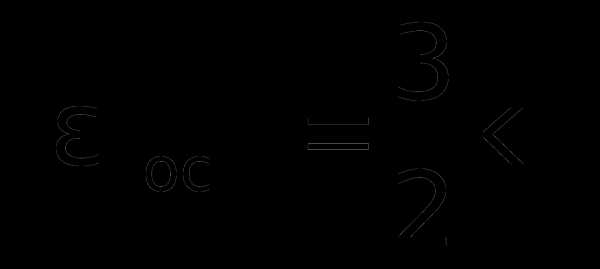
Отсюда следует, что средняя кинетическая энергия хаотического поступательного движения молекул идеального газа пропорциональна его абсолютной температуре и зависит только от нее, т.е. температура есть количественная мера энергии теплового движения молекул. При одинаковой температуре средние кинетические энергии молекул любого газа одинаковы. При Т=0К ‹εпост› = 0 и поступательное движение молекул газа прекращается, однако анализ различных процессов показывает, что Т = 0К – недостижимая температура.
4. Учитывая, что ‹εпост› = 3kT/2, р = 2n‹ εпост›/3, получим отсюда: р = nkT.
Мы получили уже знакомый нам вариант уравнения Менделеева-Клапейрона, выведенный в данном случае из понятий молекулярно-кинетической теории статистическим методом. Последнее уравнение означает, что при одинаковых температуре и давлении все газы содержат в единице объема одинаковое число молекул.
1. 4. Барометрическая формула. @
При выводе основного уравнения молекулярно-кинетической теории предполагалось, что если на молекулы газа не действуют внешние силы, то молекулы равномерно распределены по объему. Однако молекулы любого газа находятся в потенциальном поле тяготения Земли. Тяготение, с одной стороны, и тепловое движение молекул, с другой, приводят к некоторому стационарному состоянию газа, при котором концентрация молекул газа и его давление с высотой убывают. Выведем закон изменения давления газа с высотой, предполагая при этом, что поле тяготения однородно, температура постоянна и масса всех молекул одинакова. Если атмосферное давление на высоте h равно р, то на высоте h+dh оно равно р + dp (рис.1.2). При dh > 0, dр < 0, т.к. давление с высотой убывает. Разность давлений р и (р + dр) равна гидростатическому давлению столба газа авсd, заключенного в объеме цилиндра высотой dh и площадью с основанием равным единице. Это запишется в следующем виде: p- (p+dp) = gρdh, – dp = gρdh или dp = gρdh, где ρ – плотность газа на высоте h. Воспользуемся уравнением состояния идеального газа рV = mRT/M и выразим плотность ρ=m/V=pM/RT. Подставим это выражение в формулу для dр:
dp = – pMgdh/RT или dp/p = – Mgdh/RT
Интегрирование данного уравнения дает следующий результат: Здесь С – константа и в данном случае удобно обозначить постоянную интегрирования через lnC. Потенцируя полученное выражение, находим, что
При условии h=0 получим, что С=р0, где р0-давление на высоте h=0.
Д
анное выражение называется барометрической формулой. Она позволяет найти атмосферное давление в зависимости от высоты, или высоту, если известно давление.
Зависимость давления от высоты демонстрирует рисунок 1.3. Прибор для определения высоты над уровнем моря называется высотомером или альтиметром. Он представляет собой барометр, проградуированный в значениях высоты.
1. 5. Закон Больцмана о распределении частиц во внешнем потенциальном поле. @
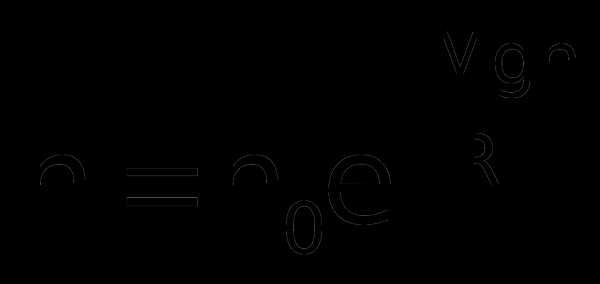
Если воспользоваться выражением р = nkT, то можно привести барометрическую формулу к виду:
з
десь n – концентрация молекул на высоте h, n0 – то же у поверхности Земли. Так как М = m0NA, где m0 – масса одной молекулы, а R = k NA, то мы получим П = m0gh – это потенциальная энергия одной молекулы в поле тяготения. Поскольку kT~‹εпост›, то концентрация молекул на определенной высоте зависит от соотношения П и ‹εпост›
Полученное выражение называется распределением Больцмана для внешнего потенциального поля. Из него следует, что при постоянной температуре плотность газа (с которой связана концентрация) больше там, где меньше потенциальная энергия его молекул.
1. 6. Распределение Максвелла молекул идеального газа по скоростям. @
При выводе основного уравнения молекулярно-кинетической теории отмечалось, что молекулы имеют различные скорости. В результате многократных соударений скорость каждой молекулы меняется со временем по модулю и по направлению. Из-за хаотичности теплового движения молекул все направления являются равновероятными, а средняя квадратичная скорость остается постоянной. Мы можем записать
П
остоянство ‹υкв› объясняется тем, что в газе устанавливается стационарное, не меняющееся со временем распределение молекул по скоростям, которое подчиняется определенному статистическому закону. Этот закон теоретически был выведен Д.К.Максвеллом. Он рассчитал функцию f(), называемую функцией распределения молекул по скоростям. Если разбить диапазон всех возможных скоростей молекул на малые интервалы, равные d, то на каждый интервал скорости будет приходиться некоторое число молекул dN(), имеющих скорость, заключенную в этом интервале (Рис.1.4.).
Функция f(v) определяет относительное число молекул, скорости которых лежат в интервале от до + d. Это число – dN()/N= f()d. Применяя методы теории вероятностей, Максвелл нашел вид для функции f()
Д анное выражение – это закон о распределении молекул идеального газа по скоростям. Конкретный вид функции зависит от рода газа, массы его молекул и температуры (рис.1.5). Функция f()=0 при =0 и достигает максимума при некотором значении в, а затем асимптотически стремится к нулю. Кривая несимметрична относительно максимума. Относительное число молекул dN()/N, скорости которых лежат в интервале d и равное f()d, находится как площадь заштрихованной полоски основанием dv и высотой f(), показанной на рис.1.4. Вся площадь, ограниченная кривой f() и осью абсцисс равна единице, потому что, если просуммировать все доли молекул, имеющих всевозможные значения скорости, то получается единица. Как показано на рис.1.5, с ростом температуры кривая распределения смещается вправо, т.е. растет число быстрых молекул, но площадь под кривой остается постоянной, т.к. N = const.
анное выражение – это закон о распределении молекул идеального газа по скоростям. Конкретный вид функции зависит от рода газа, массы его молекул и температуры (рис.1.5). Функция f()=0 при =0 и достигает максимума при некотором значении в, а затем асимптотически стремится к нулю. Кривая несимметрична относительно максимума. Относительное число молекул dN()/N, скорости которых лежат в интервале d и равное f()d, находится как площадь заштрихованной полоски основанием dv и высотой f(), показанной на рис.1.4. Вся площадь, ограниченная кривой f() и осью абсцисс равна единице, потому что, если просуммировать все доли молекул, имеющих всевозможные значения скорости, то получается единица. Как показано на рис.1.5, с ростом температуры кривая распределения смещается вправо, т.е. растет число быстрых молекул, но площадь под кривой остается постоянной, т.к. N = const.
Скорость в, при которой функция f() достигает максимума, называется наиболее вероятной скоростью. Из условия равенства нулю первой производной функции f(v) ′ = 0 следует, что
Н
а рисунке 1.4. отмечена еще одна характеристика – средняя арифметическая скорость молекулы. Она определяется по формуле:
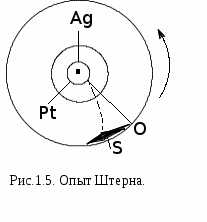 Опыт, проведенный немецким физиком О.Штерном, экспериментально подтвердил справедливость распределения Максвелла (рисунок 1.5.). Прибор Штерна состоит из двух коаксиальных цилиндров. Вдоль оси внутреннего цилиндра со щелью проходит платиновая проволока, покрытая слоем серебра. Если пропустить по проволоке ток,она нагревается и серебро испаряется. Атомы серебра, вылетая через щель, попадают на внутреннюю поверхность второго цилиндра. Если прибор будет вращаться, то атомы серебра осядут не против щели, а сместятся от точки О на некоторое расстояние. Исследование количество осадка позволяет оценить распределение молекул по скоростям. Оказалось, что распределение соответствует максвелловскому.
Опыт, проведенный немецким физиком О.Штерном, экспериментально подтвердил справедливость распределения Максвелла (рисунок 1.5.). Прибор Штерна состоит из двух коаксиальных цилиндров. Вдоль оси внутреннего цилиндра со щелью проходит платиновая проволока, покрытая слоем серебра. Если пропустить по проволоке ток,она нагревается и серебро испаряется. Атомы серебра, вылетая через щель, попадают на внутреннюю поверхность второго цилиндра. Если прибор будет вращаться, то атомы серебра осядут не против щели, а сместятся от точки О на некоторое расстояние. Исследование количество осадка позволяет оценить распределение молекул по скоростям. Оказалось, что распределение соответствует максвелловскому.
2. ОСНОВЫ ТЕРМОДИНАМИКИ
2.1. Внутренняя энергия. @
Важной характеристикой любой термодинамической системы является ее внутренняя энергия – энергия хаотического теплового движения частиц системы – молекул, атомов и энергия их взаимодействия. К внутренней энергии не относится кинетическая энергия движения системы как целого и потенциальная энергия системы во внешних полях. Внутренняя энергия системы в определенном состоянии не зависит от того, как система пришла в это состояние (т.е. от пути перехода), а определяется только значениями термодинамических параметров в этих состояниях. В термодинамике имеются и другие функции, удовлетворяющие этим условиям, их называют функциями состояния системы. Таким образом, внутренняя энергия – это функция состояния.
Для дальнейших рассуждений нам понадобится понятие числа степеней свободы – это число независимых переменных (координат), полностью определяющих положение системы в пространстве. Например, молекулу одноатомного газа можно рассматривать как материальную точку, обладающую тремя степенями свободы поступательного движения (координаты x,y,z) (рис.2.1. а). Молекула двухатомного газа, рассматриваемая в классической механике как совокупность двух материальных точек, жестко связанных между собой, имеет уже 5 степеней свободы. У нее имеется 3 степени свободы поступательного движения центра масс и 2 степени вращательного, связанного с поворотами на углы и (рис. 2.1. б). Эти углы полярный угол θ и азимутальный угол φ, определяют ориентацию оси молекулы. В данном случае, на первый взгляд кажется, что необходимо также задавать угол поворота ψ молекулы относительно собственной оси. Но вращение двухатомной молекулы вокруг своей собственной оси ничего не меняет в положении молекулы, так как структуры у материальных точек атомов нет и, поэтому, этот угол не нужен для задания положения такой молекулы в пространстве. Трехатомные молекулы (рис. 2.1.в), в которых атомы связаны жестко между собой, имеют 6 степеней свободы, так как здесь уже необходим дополнительный угол ψ.
Если расстояния между атомами меняются, т.е. атомы в молекуле колеблются, то для задания этих расстояний необходимы дополнительные координаты – колебательные степени свободы и общее число степеней свободы будет больше 6. Для много-атомных молекул число степеней может быть намного больше 6.
Р
Рис.2.1. Степени свободы: а) одноатомной молекулы;б) двухатомной молекулы;в) трех- и многоатомной молекулы.
анее мы получили формулу для средней кинетической энергии поступательного движения одно-атомной молекулы идеального газа следующее выражение: ‹ε0› = 3kT/2. Но у одно-атомной молекулы имеется 3 степени свободы поступательного движения и ни одна не имеет преимущества перед другими. Поэтому на каждую степень в среднем должна приходиться одинаковая энергия, равная 1/3 общей: ‹ε1› = kT/2. Так как, очевидно, что все степени свободы равноценны, то в классической статистической физике существует закон Больцмана о равномерном распределении энергии по степеням свободы. Он формулируется так: для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная кТ/2, а на каждую колебательную степень свободы – кТ. Колебательная степень свободы обладает вдвое большей энергией, так как на нее приходится не только кинетическая, но и потенциальная энергия взаимодействия. Таким образом, средняя энергия любой молекулы ‹ε› = ikT/2, где i – это сумма поступательных, вращательных и удвоенного числа колебательных степеней свободы.
Из этого закона получаем, что внутренняя энергия UМ одного моля идеального газа равна UМ=ikTNA/2 = iRT/2, а внутренняя энергия U газа массы m равна U = ikTN/2 = iRTm/2M (здесь мы учитываем, что потенциальная энергия взаимодействия молекул равна 0, общее число молекул в одном моле равно NA, N= mNA/M и kNA=R).
2.2. Первое начало термодинамики. @
Обмен энергией между термодинамической системой и внешней средой может осуществляться двумя качественно различными способами: путем совершения работы и путем теплообмена.
Изменение энергии системы, происходящее под действием сил измеряется работой. Если термодинамическая система совершает работу против внешних сил, то работа считается положительной (А>0). Если работу над системой совершают внешние силы, то она считается отрицательной (А< 0).
Изменение энергии системы, происходящее в результате теплообмена, определяется количеством переданной или отнятой теплоты Q. При теплообмене тела систем должны находится в тепловом контакте, т.е. молекулы этих систем должны иметь возможность сталкиваться при своем движении и обмениваться своей кинетической энергией. Если энергия (теплота) передается системе, то Q>0, если она от системы отнимается, то Q<0. Итак, работа и теплота – это две формы передачи энергии от одних тел другим. Поскольку внутренняя энергия – это механическая энергия всех молекул, то при всех ее изменениях должен соблюдаться закон сохранения энергии. Применительно к термодинамическим процессам этим законом является первое начало термодинамики, установленное в результате обобщения опытных данных. Опыт показал, что при любом способе перехода системы из состояния 1 в состояние 2 изменение внутренней энергии системы ΔU = U1 – U2 определяется количеством теплоты Q, полученной системой, и работой А, совершенной системой против внешних сил (получаемое тепло увеличивает энергию системы, а работа системы над внешней средой уменьшает ее) :
textarchive.ru
Основы молекулярной физики и термодинамики
Федун В. И. Конспект лекций по физике Молекулярная физика и термодинамика
Молекулярная физика и термодинамика – разделы физики, в которых изучаются макроскопические процессы в телах, связанные с огромным числом содержащихся в этих телах атомов и молекул.
Лекция 13.
12. 1. Статистический и термодинамический методы исследования.
В основе исследования лежат два метода: термодинамический и статистический.
Термодинамикой называют науку о наиболее общих свойствах макроскопических физических систем, находящихся в состоянии термодинамического равновесия, и о процессах перехода между этими состояниями. Она позволяет найти общие закономерности при установлении равновесия в физических системах.
Термодинамика строится на основе фундаментальных принципов (начал), которые являются обобщением многочисленных наблюдений и выполняются независимо от конкретной природы образующих систему тел. Поэтому закономерности и соотношения между физическими величинами, к которым приводит термодинамика, имеют универсальный характер.
Термодинамический метод. (Основа термодинамики) – метод исследования систем, состоящих из большого числа частиц и оперирующий величинами, характеризующими всю систему в целом (например, объём, давление, температура), не рассматривая микроструктуры системы и проходящих в системе микропроцессов.
Термодинамический метод применим для большинства областей физики, химии и других наук. Термодинамический метод устанавливает связи между макроскопическими характеристиками системы и ничего не говорит о микроструктуре системы, механизмах явлений и т.д.
Недостаток термодинамического метода (независимость от конкретной природы вещества) восполняется статистическим методом, лежащим в основе молекулярной физики.
Молекулярная физика – раздел физики, в котором изучаются строение и свойства вещества исходя из молекулярно-кинетических представлений, основывающихся на том, что все тела состоят из молекул, находящихся в непрерывном хаотическом движении.
Статистический метод (основа молекулярной физики) – метод исследования систем из большого числа частиц, оперирующий статистическими закономерностями и средними значениями физических величин, характеризующих всю совокупность частиц, например, средние значения скоростей теплового движения молекул и их энергий.
Процессы, изучаемые молекулярной физикой, являются результатом совокупного действия огромного числа молекул. Поэтому в молекулярной физике оперируют не характеристиками каждой частицы, а некоторыми средними значениями величин, взятыми по всем частицам. Например, температура тела определяется (обусловлена) скоростью беспорядочного движения молекул, но так как в любой момент времени различные молекулы имеют различные скорости, то она может быть выражена через среднее значение скорости движения молекул.
Нельзя говорить о температуре одной молекулы.
12. 2. Основные понятия термодинамики и молекулярной физики.
12. 2. 1. Основные понятия термодинамики.
Термодинамическая система – совокупность макроскопических тел, которые обмениваются энергией как между собой, так и с внешней средой.
Внешняя среда – тела, не входящие в исследуемую термодинамическую систему.
Замкнутая термодинамическая система – система, не обменивающаяся с внешней средой ни энергией, ни веществом.
Термодинамические параметры (параметры состояния) – совокупность физических величин, характеризующих свойства термодинамической системы. Обычно в качестве параметров состояния выбирают объём, давление и температуру.
Термодинамический процесс – любое изменение в термодинамической системе, связанное с изменением хотя бы одного из её термодинамическ их параметров.
Термодинамическое равновесие – неизменность состояния системы с течением времени, при этом предполагается, что внешние условия системы так же не изменяются.
В термодинамике постулируется, что каково бы ни было начальное состояние тел изолированной системы, в ней, в конце концов, установится термодинамическое равновесие.
Это утверждение называют общим началом термодинамики.
Переход системы в состояние термодинамического равновесия называется релаксацией.
Под термодинамически равновесным состоянием подразумевается такое состояние физической системы, в которое она самопроизвольно переходит через достаточно большой промежуток времени в условиях изоляции от внешней среды. В состоянии термодинамического равновесия в системе прекращаются все необратимые процессы, связанные с диссипацией энергии: теплопроводность, диффузия, химические реакции и другие. Параметры системы, находящейся в состоянии термодинамического равновесия, не меняются со временем. Строго говоря, те параметры системы, которые не фиксируют заданные условия существования системы, могут испытывать малые колебания относительно своих средних значений – флуктуации.
Существование температуры как параметра, единого для всех частей находящейся в равновесии системы, называют нулевым началом термодинамики.
studfiles.net
Основы молекулярной физики и термодинамики
ОСНОВЫ МОЛЕКУЛЯРНОЙ ФИЗИКИ И ТЕРМОДИНАМИКИ
Литература
(рекомендуемая для изучения теоретического курса и решения задач)
1. Савельев И. В. Курс общей физики, т.1. – М.: Наука, 1989
2. Трофимова Т. И. Курс физики. – М.: Высшая школа, 1990
3. Черных А. В. Основы молекулярной физики и термодинамики. Учебное пособие.
4. Яворский Б. М., Детлаф А. А. Курс физики. — М.: Наука, 1989
5. Яворский Б. М., Детлаф А. А. Справочник по физике. М.: Наука, 1985
6. Кабардин О. Ф. Физика. Справочные материалы. – М.: Просвещение, 1985
7. Кухлинг Х. Справочник по физике. – М.: Мир, 1982
8. Кошкин Н. И., Ширкевич М. Г. Справочник по элементарной физике. — М.: Наука, 1975
ТЕМА 1. Основы молекулярно-кинетической теории идеальных газов
· уровень №1 – «удовлетворительно» (1 балл)
· уровень №2- «хорошо» (2 балла)
· уровень №3 –«отлично» (3 балла)
Уровень №3.
А. Вопросы по теории.
1. Каковы основные положения термодинамического и молекулярно – кинетического (статистического) методов изучения макроскопических систем? Назовите основные параметры термодинамической системы.
2. Дайте определение единицы вещества 1 моль. Сколько молекул содержится в моле любого вещества? Как можно рассчитать линейные размеры одной молекулы?
3. Запишите уравнение состояния идеального газа (уравнение Менделеева – Клапейрона). Каковы физический смысл, размерность и численное значение универсальной газовой постоянной R? Сформулируйте газовые законы.
4. На чем основан вывод уравнения молекулярно – кинетической теории идеальных газов для давления? Сравните это уравнение с уравнением Менделеева – Клапейрона.
5. Получите соотношения и . Каковы физический смысл, численное значение и единицы измерения постоянной Больцмана k?
6. Каково содержание одного из основных положений статистической физики о равнораспределении энергии по степеням свободы? Считая, что средняя энергия молекулы идеального газа , получите выражение для внутренней энергии произвольной массы идеального газа: .
7. При каких условиях выполняется закон Максвелла для распределения молекул газа по скоростям? Напишите аналитическое выражение этого закона и изобразите его графически.
8. Получите соотношения для следующих скоростей молекул: а) наиболее вероятной; б) средней арифметической; в) средней квадратичной.
9. Проанализируйте выражение зависимости атмосферного давления от высоты (барометрическая формула), считая температуру постоянной.
10.Исходя из барометрической формулы, получите выражение зависимости концентрации молекул от высоты. Сформулируйте закон распределения Больцмана.
11.Что называют длиной свободного пробега молекул? Что такое эффективный диаметр молекул газа? Какова связь между длиной свободного пробега и числом соударений молекул в единицу времени?
12.В чем сущность явлений переноса? Каковы они и при каких условиях возникают? Объяснить физическую сущность законов Фурье? Фика? Ньютона?
В. Лабораторные работы.
№№ 156, 157, 161, 162, 163, 166, 167, 181к, 185к.
Уровень №2.
А. Вопросы по теории.
1. Почему термодинамический и статистический методы исследования макроскопических систем качественно различны и взаимно дополняют друг друга?
2. Что такое термодинамические параметры? Какие термодинамические параметры Вам известны?
3. Какова идеализированная модель идеального газа. Какие законы, описывающие поведение идеальных газов, были установлены опытным путем (сформулируйте, запишите и там где это необходимо, представьте их графически).
4. Запишите уравнение состояния идеального газа (Менделеева – Клапейрона).
5. Сформулируйте основные положения молекулярно – кинетической теории газов.
6. Запишите основное уравнение молекулярно – кинетической теории газов и поясните его.
7. Что такое энергия теплового движения молекул идеального газа? Чему она равна?
8. Дайте определение числа степеней свободы молекул газа? Какие значения может принимать число степеней свободы молекул идеального газа? В чем состоит закон распределения энергии по степеням свободы?
9. Что такое средняя квадратичная, наиболее вероятная и средняя арифметическая скорости молекул? Как они выражаются?
10.Запишите закон Максвелла для распределения молекул идеального газа по скоростям и поясните физический смысл.
11.Дайте определение длины свободного пробега и эффективного диаметра молекулы газа.
12.Запишите барометрическую формулу и поясните ее физический смысл. Запишите и объясните закон Больцмана для распределения частиц во внешнем потенциальном поле.
13.Явления переноса в термодинамически неравновесных системах. Что Вы о них знаете?
В. Лабораторные работы.
№№ 156, 157, 161, 162, 163, 166, 167, 181к, 185к.
Уровень №1.
А. Вопросы по теории.
1. Основные положения молекулярно – кинетической теории. Явления, подтверждающие молекулярно – кинетическую теорию.
2. Идеальный газ. Уравнение состояния идеального газа (Менделеева – Клапейрона).
3. Газовые законы (Бойля – Мариотта, Гей – Люссака, Шарля) (математическая форма записи и графическое представление).
4. Абсолютная температура. Закон Авогадро.
5. Чему равно давление смеси газов? Сформулируйте закон Дальтона, поясните его. Что называется парциальным давлением газа?
6. Запишите основное уравнение молекулярно – кинетической теории газов. Что такое концентрация молекул?
7. Запишите закон распределения молекул идеального газа по скоростям.
8. Запишите барометрическую формулу, поясните ее физический смысл.
9. Запишите и объясните закон Больцмана для распределения частиц во внешнем потенциальном поле.
10.Какие явления переноса Вам известны?
В. Лабораторные работы.
№№ 156, 157, 161, 162, 163, 166, 167, 181к, 185к.
ТЕМА 2. Основы термодинамики
· уровень №1 – «удовлетворительно» (0,5 балла)
· уровень №2- «хорошо» (1 балл)
· уровень №3 –«отлично» (2 балла)
Уровень №3.
А. Вопросы по теории.
1. Какие состояния термодинамической системы и какие термодинамические процессы называются: а)равновесными; б)неравновесными? Дайте определение внутренней энергии термодинамической системы как функции ее состояния.
2. В чем сходство и различие между понятиями работы и количества теплоты?
3. Чем определяется внутренняя энергия идеального газа и от чего зависит ее изменение?
4. Что называют теплоемкостью вещества? Какие виды теплоемкости Вам известны, и какая существует между ними связь? Запишите уравнение Майера, что оно показывает?
5. Сформулируйте первое начало термодинамики и примените его к различным изопроцессам в идеальном газе.
6. Какой процесс называется адиабатическим? Запишите уравнение адиабатического процесса. Чему равен показатель адиабаты. Примените первое начало термодинамики к данному процессу.
7. Изобразите графически изотермический и адиабатический процессы на диаграмме p – V и сравните эти зависимости. Как по графику можно определить работу газа?
8. Какие процессы называются круговыми (циклами)? Каков принцип действия: теплового двигателя; холодильной машины?
9. Из каких процессов состоит цикл Карно? Изобразите на диаграмме p–V прямой равновесный цикл Карно и получите выражение для его коэффициента полезного действия. Зависит ли КПД идеального обратимого теплового двигателя от свойств рабочего тела?
10.Сформулируйте второе начало термодинамики.
11.Что такое термодинамическая вероятность состояния? В чем состоит статистический смысл второго начала термодинамики? Запишите связь изменения энтропии с термодинамическими вероятностями начального и конечного состояний газа?
В. Лабораторные работы.
№№ 150, 151, 155, 171, 182к, 183к, 184к, 401.
Уровень №2.
А. Вопросы по теории.
1. Что такое внутренняя энергия идеального газа? В результате, каких процессов она может изменяться?
2. Что называют теплоемкостью вещества? Что такое удельная теплоемкость? Что называется молярной теплоемкостью? Какая существует между ними связь?
3. Какая из теплоемкостей при постоянном объеме или при постоянном давлении больше и почему?
4. Сформулируйте первое начало термодинамики, поясните его физический смысл. Какой вид принимает первое начало термодинамики применительно к изохорному процессу?
5. Запишите первое начало термодинамики для изобарного процесса, поясните его. Чему равна работа при изобарическом расширении и изобарическом сжатии газа?
6. Запишите первое начало термодинамики применительно к изотермическому процессу и поясните его смысл. Как определить работу при изотермическом расширении и изотермическом сжатии?
7. Какой процесс называется адиабатическим? Что представляет собой показатель степени адиабаты. Запишите уравнения адиабаты, описывающие связь между параметрами р и V, р и Т, V и Т.
8. Запишите первое начало термодинамики применительно к адиабатическому процессу и поясните его физический смысл. Как подсчитать работу, совершаемую газом при адиабатическом процессе?
9. Какие процессы называют обратимыми, а какие – необратимыми? Что такое круговой процесс (цикл)? Как определить КПД тепловой машины?
10.Что представляет собой цикл Карно? Как определить КПД цикла Карно?
11.Сформулируйте второе начало термодинамики. Объясните, что называется энтропией. Чему равно изменение энтропии при переходе вещества из одного состояния в другое?
12.Каково статистическое толкование второго начала термодинамики?
В. Лабораторные работы.
№№ 150, 151, 155, 171, 182к, 183к, 184к, 401.
Уровень №1.
А. Вопросы по теории.
1. Что понимают под внутренней энергией тела? В результате, каких процессов может изменяться внутренняя энергия тела?
2. Что называют теплоемкостью вещества? Какие виды теплоемкости Вам известны?
3. Закон сохранения энергии в механических и тепловых процессах.
4. Первый закон термодинамики. Применение его к различным изопроцессам.
5. Адиабатный процесс. Применение первого закона термодинамики к адиабатному процессу.
6. Принцип действия тепловых двигателей. КПД теплового двигателя.
7. Что представляет собой цикл Карно? Как определить КПД цикла Карно?
8. Сформулируйте второй закон термодинамики.
9. Что такое приведенное количество теплоты? Что такое энтропия? Чему равно изменение энтропии обратимого и необратимого цикла?
10.Как связана термодинамическая вероятность состояния с энтропией (уравнение Больцмана)?
В. Лабораторные работы.
№№ 150, 151, 155, 171, 182к, 183к, 184к, 401.
fiziku5.ru
