История возникновения таблицы Менделеева. Часть 1


Рис. 1. Периодическая таблица Д.И. Менделеева в первозданном виде
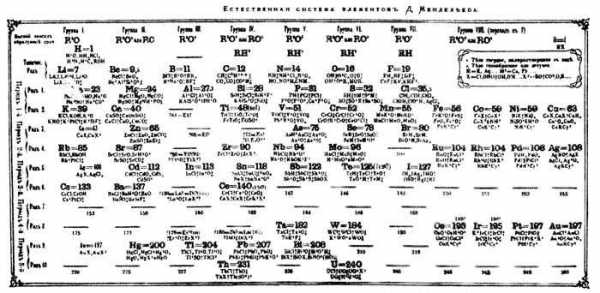
Рис. 2. Периодическая таблица Д.И. Менделеева 1871 года. В этой таблице еще нет некоторых элементов, которые были позже внесены Менделеевым в более совершенных вариантах (галлий, скандий, германий, латан). Нет еще нулевой группы
И казалось бы, какие страсти могут быть вокруг Периодической таблицы химических элементов Дмитрия Ивановича Менделеева? Да самые что ни на есть настоящие! И научные, и субъективные! Вот уж где переплелись тщеславие ученых с базисными научными знаниями соответствующей эпохи, равнодушие завистников с благородством и меркантильностью. И с политической целесообразностью.
И хотя споры ученых вокруг таблицы химических элементов возникли задолго до появления самой таблицы, нам начать нужно все-таки с самого начала.
ДЕБРИ ИСТОРИИ
Еще древние задумывались о сущности природы, определяя химические элементы как различные состояния тел. Да и для химиков средневековья химический элемент оставался как неразлагаемое вещество простого тела.
Химический элемент XVIII века коренным образом отличался от элемента древности и средних веков. Одним из первых, кто более глубоко подошел к проблеме элементов, был М.В. Ломоносов, который ввел понятие о «начале», отличающемся от простого тела. Это «начало» он пояснял так: «Через химию известно, что в киновари есть ртуть…, однако в киновари ртути ни сквозь самые лучшие микроскопы видеть нельзя; но всегда в них тот же вид кажется». И далее: «В киновари имеется «начало» ртуть, но нет простого тела, металла ртути как такового». Это «начало» теперь называется элементом. Химический элемент не есть простое тело. В 1741 г. ученый формулирует первый постулат — элемент есть часть тела, не состоящая из каких-либо других меньших тел и различных между собой. Однако найти разницу между элементом и атомом он так и не смог. Сложной задачей это оказалось и для последующих поколений химиков, в чем мы далее убедимся.
Впервые что-то подобное таблице составил в 1829 г. И.В. Деберейнер, опубликовав табличку «триад»:
Деберейнер указывал, что помимо химического сходства наблюдается и закономерность в отношении атомного веса: величина его для промежуточного элемента (например, Na) приблизительно равна среднему арифметическому из величин для двух крайних (Li и K).
В 1849 г. классификацией элементов заинтересовался видный русский ученый Г.И. Гесс. В учебнике «Основания чистой химии» он описывал четырнадцать элементов-неметаллов с похожими химическими свойствами, разделив их по четырем группам.
В 1863 г. А.Э.Б. Шанкуртуа разместил химические элементы в порядке возрастания атомных весов по винтовой линии, описанной вокруг цилиндра. Сходные по свойствам элементы в большинстве случаев располагались при этом друг под другом, но имели место и значительные расхождения.
В 1864 г. немец Л.Ю. Мейер объединил «шесть связанных между собой хорошо охарактеризованных групп элементов» и получил такую таблицу:
А англичанин В. Одлинг, переработав свою раннюю таблицу 1857 г., основанную на эквивалентных весах под названием «Атомные веса и знаки элементов», опубликовал в том же 1864 г. году приводимую ниже таблицу, не сопровождая ее какими-либо пояснениями:

В 1865 г. Дж. А.К. Ньюлендс заметил, что если написать химические элементы в порядке возрастания их атомных масс, то приблизительное повторение свойств наблюдается на восьмом элементе, считая от исходного. Он назвал эту закономерность «законом октав». Последовательно перенумеровав все известные на тот момент элементы, Ньюлендс свел их в следующую таблицу:
Эта усовершенствованная таблица, как ясно стало позже, имела ряд недостатков. Во-первых, много элементов (Mn, Fe и др.) попали совершенно на несоответствующие им места. Во-вторых, отсутствие пропусков в таблице не позволяло систематизировать новые элементы в случае их открытия.
www.science-techno.ru
ТАБЛИЦА МЕНДЕЛЕЕВА История открытия таблицы К середине
 ТАБЛИЦА МЕНДЕЛЕЕВА
ТАБЛИЦА МЕНДЕЛЕЕВА


 Открытие радия Одна из наиболее трагичных и в то же время известных страниц в истории химии и появления новых элементов в таблице Менделеева связана с открытием радия. Новый химический элемент был открыт супругами Марией и Пьером Кюри, которые обнаружили, что отходы, остающиеся после выделения урана из урановой руды, более радиоактивны, чем чистый уран.
Открытие радия Одна из наиболее трагичных и в то же время известных страниц в истории химии и появления новых элементов в таблице Менделеева связана с открытием радия. Новый химический элемент был открыт супругами Марией и Пьером Кюри, которые обнаружили, что отходы, остающиеся после выделения урана из урановой руды, более радиоактивны, чем чистый уран.
 Поскольку о том, что такое радиоактивность, тогда еще никто не знал, то новому элементу молва быстро приписала целебные свойства и способность излечивать чуть ли не от всех известных науке болезней. Радий включили в состав пищевых продуктов, зубной пасты, кремов для лица. Богачи носили часы, циферблат которых был окрашен краской, содержащей радий. Радиоактивный элемент рекомендовали как средство для снятия стресса. Подобное “производство” продолжалось целых двадцать лет – до 30 -х годов двадцатого века, когда ученые открыли истинные свойства радиоактивности и выяснили насколько губительно влияние радиации на человеческий организм. Мария Кюри умерла в 1934 году от лучевой болезни, вызванной долговременным воздействием радия на организм.
Поскольку о том, что такое радиоактивность, тогда еще никто не знал, то новому элементу молва быстро приписала целебные свойства и способность излечивать чуть ли не от всех известных науке болезней. Радий включили в состав пищевых продуктов, зубной пасты, кремов для лица. Богачи носили часы, циферблат которых был окрашен краской, содержащей радий. Радиоактивный элемент рекомендовали как средство для снятия стресса. Подобное “производство” продолжалось целых двадцать лет – до 30 -х годов двадцатого века, когда ученые открыли истинные свойства радиоактивности и выяснили насколько губительно влияние радиации на человеческий организм. Мария Кюри умерла в 1934 году от лучевой болезни, вызванной долговременным воздействием радия на организм. Небулий и короний Таблица Менделеева не только упорядочила химические элементы в единую стройную систему, но и позволила предсказать многие открытия новых элементов. В то же время некоторые химические “элементы” были признаны несуществующими на основании того, что они не укладывались в концепцию периодического закона. Наиболее известна история с “открытием” новых элементов небулия и корония.
Небулий и короний Таблица Менделеева не только упорядочила химические элементы в единую стройную систему, но и позволила предсказать многие открытия новых элементов. В то же время некоторые химические “элементы” были признаны несуществующими на основании того, что они не укладывались в концепцию периодического закона. Наиболее известна история с “открытием” новых элементов небулия и корония.

present5.com
Периодическая система химических элементов – История открытия
Химия – Периодическая система химических элементов – История открытия
01 марта 2011Оглавление:
1. Периодическая система химических элементов
2. История открытия
3. Структура периодической системы
4. Значение периодической системы
К середине XIX века были открыты 63 химических элемента, и попытки найти закономерности в этом наборе предпринимались неоднократно. В 1829 году Дёберейнер опубликовал найденный им «закон триад»: атомный вес многих элементов близок к среднему арифметическому двух других элементов, близких к исходному по химическим свойствам. Первую попытку расположить элементы в порядке возрастания атомных весов предпринял Александр Эмиль Шанкуртуа, который разместил элементы вдоль винтовой линии и отметил частое циклическое повторение химических свойств по вертикали. Обе указанные модели не привлекли внимания научной общественности.
В 1866 году свой вариант периодической системы предложил химик и музыкант Джон Александр Ньюлендс, модель которого внешне немного напоминала менделеевскую, но была скомпрометирована настойчивыми попытками автора найти в таблице мистическую музыкальную гармонию. В этом же десятилетии появились ещё несколько попыток систематизации химических элементов; ближе всего к окончательному варианту подошёл Юлиус Лотар Мейер. Д. И. Менделеев опубликовал свою первую схему периодической таблицы в 1869 году в статье «Соотношение свойств с атомным весом элементов»; ещё ранее научное извещение об открытии было им разослано ведущим химикам мира.
Д. И. Менделеев
По легенде, мысль о системе химических элементов пришла к Менделееву во сне, однако известно, что однажды на вопрос, как он открыл периодическую систему, учёный ответил: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово».
Написав на карточках основные свойства каждого элемента, Менделеев начинает многократно переставлять эти карточки, составлять из них ряды сходных по свойствам элементов, сопоставлять ряды один с другим. Итогом работы стал отправленный в 1869 году в научные учреждения России и других стран первый вариант системы, в котором элементы были расставлены по девятнадцати горизонтальным рядам и по шести вертикальным столбцам. В 1870 году Менделеев в «Основах химии» публикует второй вариант системы, имеющий более привычный нам вид: горизонтальные столбцы элементов-аналогов превратились в восемь вертикально расположенных групп; шесть вертикальных столбцов первого варианта превратились в периоды, начинавшиеся щелочным металлом и заканчивающиеся галогеном. Каждый период был разбит на два ряда; элементы разных вошедших в группу рядов образовали подгруппы.
Сущность открытия Менделеева заключалась в том, что с ростом атомной массы химических элементов их свойства меняются не монотонно, а периодически. После определённого количества разных по свойствам элементов, расположенных по возрастанию атомного веса, свойства начинают повторяться. Например, натрий похож на калий, фтор похож на хлор, а золото похоже на серебро и медь. Разумеется, свойства не повторяются в точности, к ним добавляются и изменения. Отличием работы Менделеева от работ его предшественников было то, что основ для классификации элементов у Менделеева была не одна, а две атомная масса и химическое сходство. Для того, чтобы периодичность полностью соблюдалась, Менделеевым были предприняты очень смелые шаги: он исправил атомные массы некоторых элементов, несколько элементов разместил в своей системе вопреки принятым в то время представлениям об их сходстве с другими, оставил в таблице пустые клетки, где должны были разместиться пока не открытые элементы. В 1871 году на основе этих работ Менделеев сформулировал Периодический закон, форма которого со временем была несколько усовершенствована.
Научная достоверность Периодического закона получила подтверждение очень скоро: в 1875—1886 годах были открыты галлий, скандий и германий, для которых Менделеев, пользуясь периодической системой, предсказал не только возможность их существования, но и, с поразительной точностью, целый ряд физических и химических свойств.
В начале XX века с открытием строения атома было установлено, что периодичность изменения свойств элементов определяется не атомным весом, а зарядом ядра, равным атомному номеру и числу электронов, распределение которых по электронным оболочкам атома элемента определяет его химические свойства.
Дальнейшее развитие периодической системы связано с заполнением пустых клеток таблицы, в которые помещались всё новые и новые элементы: благородные газы, природные и искусственно полученные радиоактивные элементы. В 2010 году, с синтезом 117 элемента, седьмой период периодической системы был завершён, проблема нижней границы таблицы Менделеева остаётся одной из важнейших в современной теоретической химии.
Просмотров: 4223
4108.ru
Менделеев Дмитрий Иванович краткая биография и его открытия
В XIX веке как никогда много было сделано научных открытий и создано технических изобретений. Казалось, что нет ничего необъяснимого или неподвластного науке. Одним из ярчайших представителей того времени стал ученый и изобретатель Менделеев Дмитрий Иванович. Краткая биография и его открытия описаны в данной статье.

Как провел детство Менделеев Д.И.
Будущий ученый родился последним, семнадцатым в семье ребенком 27 января по юлианскому календарю 1834 года в Тобольске.
Мать Дмитрия, Мария Дмитриевна Корнильева, владела мелкой стекольной фабрикой.
А отцом его был директор училищ Тобольского округа Иван Менделеев.
Дмитрий Иванович детство провел в окружении русской интеллигенции.
Его семья часто гостила у брата Марии Дмитриевны, который был управляющим у князей Трубецких.
Нередко у него в гостях бывали литераторы, художники, ученые.
Немало первых жизненных впечатлений будущим химиком было получено также на заводе матери.

Менделеев Дмитрий Иванович краткая биография
В 1850 в возрасте 16 лет Дмитрий начал учебу в Главном Педагогическом институте в Санкт-Петербурге. Через полтора месяца умерла его мать, и юноша остался без родственников и друзей, а также без имущества. Учился он с огромным интересом. Химия и минералогия были его любимыми предметами. Особенно увлекало Дмитрия огромное разнообразие химических превращений и соединений, в основе которых лежат лишь несколько десятков элементов. На последнем курсе, за выпускную диссертацию «Изоморфизм» о химических процессах, сопровождающих образование кристаллов, наградили золотой медалью Менделеева Дмитрия Ивановича. Фото представлено ниже:

Осенью 1856 будущий открыватель Периодического закона стал профессором технологического института и приват-доцентом университета в Петербурге. С 1859 по 1861 работал в Гейдельберге (Германия). Имея собственную лабораторию, он вел научные поиски в пока не определенном направлении. Однако после Международного съезда химиков 1860 года в Карлсруэ ученый пришел к выводу, что работать следует в направлении атомных масс (в то время применялся термин «атомный вес»).
В 1862 изобретатель по уговорам сестры женился на Феозвой Никитичной Лещевой. Так и не ужился со своей первой женой Менделеев. Дети, однако, пользовались особой нежностью отца. Вскоре он купил имение Боблово, напоминающее ему родной Тобольск. Скудные земли тех мест хорошо подходили для его сельскохозяйственных экспериментов. Он занялся анализом удобрений и условий, влияющих на урожай, обучал крестьян эффективному земледелию. В результате количество урожая, учитывая скудность земель, было удивительно большим.

Результаты Менделеевской докторской диссертации о смешивании воды и этилового спирта, которую ученый защитил в 1865, положены в основу алкоголеметрии в Голландии, Австрии, Германии и России.
Дальнейшие научные поиски привели к созданию в начале 1869 года Периодической системы. Большинство академий мира избрали создателя таблицы элементов своим членом, а самые знаменитые университеты – почетным доктором.
Брак великого изобретателя не был счастливым, и весной 1877 он завел роман с 17-летней художницей. Через 3 года ученый, наконец, расстался с семьей, и в апреле 1882 они обвенчались. С тех пор в доме часто стали бывать художники – Репин, Ярошенко, Куинджи.
С 1892 великий химик стал главным хранителем депо мер и весов. И за считанные годы превратил это учреждение в крупный научный центр. Недаром с юных лет он любил точные измерения и чувствительные инструменты.
20 января 1907 года в Санкт-Петербурге от пневмонии умер Менделеев. Краткая биография великого ученого свидетельствует о его подлинной преданности родине и науке. Похоронен Дмитрий Иванович на Волковском кладбище.
Менделеев Дмитрий Иванович интересные факты из жизни
7 августа 1897 уже немолодой химик решил оторваться от Земли на воздушном шаре с опытным аэронавтом для наблюдения солнечного затмения. Перед самым подъемом начался дождь, и очевидно было, что намокший шар не сможет поднять двух человек. Аэронавт выпрыгнул из корзины, а шар неожиданно начал подниматься. Ученому, впервые в жизни взлетевшему на воздушном шаре, ничего не оставалось, как провести задуманное в одиночку. Оказавшись над плотными облаками, он пронаблюдал полное затмение, а затем посадил шар.

Накануне погребения мозг великого химика был изъят для исследования в надежде узнать причину его гениальности, а также гениальности вообще. Через год профессор Бехтерев сообщил, что мозг покойного ученого отличается особой развитостью и избытком извилин. Не считал себя гениальным, пожалуй, только сам Менделеев. Интересные факты из жизни великого химика, впрочем, не ограничиваются этими двумя.
Что изобрел Дмитрий Иванович Менделеев для нужд армии
В 1890—1892 годах Дмитрий Иванович вместе с И. М. Чельцовым работал над созданием бездымного пороха. В декабре 1890 им была получена растворимая нитроклетчатка – продукт взаимодействия целлюлозы с азотной кислотой. А в январе 1891 — особый ее вид, названный создателем «пироколлодий». Ученый разработал на основе пироколлодия собственный рецепт бездымного пороха, который оказался лучше заграничного.
Частый вопрос, задаваемый в кроссвордах и викторинах, звучит примерно так: «Всем известен Менделеев Дмитрий Иванович. Что изобрел для нужд армии (5 букв) этот ученый?». Разумеется, ответ прост, но не слишком внимательные люди отвечают: «бездымный пироколлоидный порох», когда в действительности порох является пироколлодийным.

Менделеев Дмитрий Иванович достижения в химии и науке
За свою сознательную жизнь ощутимый вклад в самые разные научные сферы внес Д. И. Менделеев. Открытия ученого принесли огромную пользу миру и особенно России. Далее перечислены и кратко пояснены его основные научные достижения:
- Открытие Периодического закона – одного из фундаментальных законов мироздания, неотъемлемого для всего естествознания.
- Вывод уравнения идеального газа. Это уравнение выражает взаимозависимость между объемом, давлением и температурой любого газа, если пренебречь размерами и потенциальной энергией его молекул, а также временем, которое занимают их столкновения.
- Предложение ввести термодинамическую шкалу температур.
- Создание Учения о растворах, где показана связь свойств и химического состава растворов.
- Создание пироколлодийного бездымного пороха.
- Внедрение новых методов перегонки нефти, идеи постройки нефрепроводов. В итоге, Россия была превращена из импортера в экспортера нефтепродуктов.
- Создание точной теории весов.
Менделеев Дмитрий Иванович: таблица Менделеева
Между свойствами тех или иных химических элементов обнаруживалось как сильное сходство, так и резкий контраст. Предпринимавшиеся попытки классификации элементов были далеки от совершенства.
Гениальный химик обнаружил, что если элементы с похожими свойствами расположить в порядке возрастания массы атома, то они оказываются расположенными и в порядке изменения выраженности общих свойств. Если же расположить по возрастанию веса атома все известные элементы, то в этом случае ряд окажется разделенным на отрезки, внутри которых соблюдается закономерное изменение характеристик элементов. Отсюда следует закон: характеристики химических элементов состоят в периодической зависимости от массы их атома.
Для наглядности систематизации элементов целесообразно представлять их в виде таблицы. Где строки образуют периоды – отрезки, о которых было сказано только что. А столбцы составляют группы сходных элементов, расположенных по убыванию или возрастанию выраженности их общих свойств.
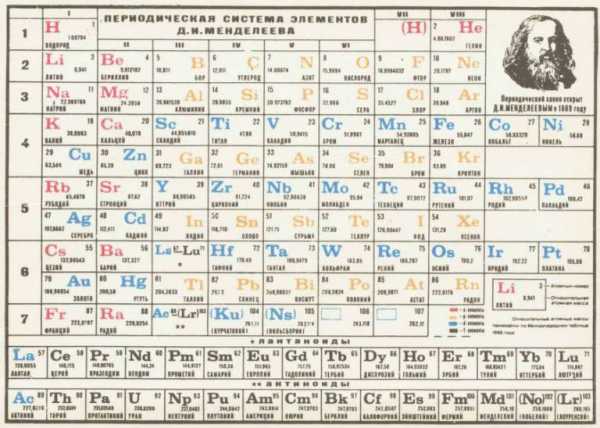
С помощью Периодической системы удалось предсказать существование еще не известных элементов и даже детально определить свойства некоторых из них. Что и сделал Менделеев Дмитрий Иванович. Таблица его до настоящего времени остается наиболее удачной классификацией элементов химии.
Самое важное в жизни рассмотрено у такого ученого, как Менделеев Дмитрий Иванович (краткая биография). И его открытия оставили заметный след в науке России. А вы как считаете – эти достижения важны? Оставьте свое мнение или отзыв для всех на форуме.
womaninc.ru
Помогите пожалуйста !!!Мне нужна краткая история открытия ПЕРИОДИЧЕСКОЙ СИСТЕМЫ МЕНДЕЛЕЕВА
Периоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от их атомного веса (по-современному, от атомной массы) . Всего предложено несколько сотен [1] вариантов изображения периодической системы (аналитических кривых, таблиц, геометрических фигур и т. п.) . В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.К середине XIX века были открыты 63 химических элемента, и попытки найти закономерности в этом наборе предпринимались неоднократно. В 1829 году Дёберейнер опубликовал найденный им «закон триад» : атомный вес многих элементов близок к среднему арифметическому двух других элементов, близких к исходному по химическим свойствам (стронций, кальций и барий; хлор, бром и иод и др.) . Первую попытку расположить элементы в порядке возрастания атомных весов предпринял Александр Эмиль Шанкуртуа (1862), который разместил элементы вдоль винтовой линии и отметил частое циклическое повторение химических свойств по вертикали. Обе указанные модели не привлекли внимания научной общественности.
В 1866 году свой вариант периодической системы предложил химик и музыкант Джон Александр Ньюлендс, модель которого («закон октав» ) внешне немного напоминала менделеевскую, но была скомпрометирована настойчивыми попытками автора найти в таблице мистическую музыкальную гармонию. В этом же десятилетии появились ещё несколько попыток систематизации химических элементов; ближе всего к окончательному варианту подошёл Юлиус Лотар Мейер (1864). Д. И. Менделеев опубликовал свою первую схему периодической таблицы в 1869 году в статье «Соотношение свойств с атомным весом элементов» (в журнале Русского химического общества) ; ещё ранее (февраль 1869 г. ) научное извещение об открытии было им разослано ведущим химикам мира.
Д. И. Менделеев
По легенде, мысль о системе химических элементов пришла к Менделееву во сне, однако известно, что однажды на вопрос, как он открыл периодическую систему, учёный ответил: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово» .
Написав на карточках основные свойства каждого элемента (их в то время было известно 63, из которых один — дидим Di — оказался в дальнейшем смесью двух вновь открытых элементов празеодима и неодима) , Менделеев начинает многократно переставлять эти карточки, составлять из них ряды сходных по свойствам элементов, сопоставлять ряды один с другим [2]. Итогом работы стал отправленный в 1869 году в научные учреждения России и других стран первый вариант системы («Опыт системы элементов, основанной на их атомном весе и химическом сходстве») , в котором элементы были расставлены по девятнадцати горизонтальным рядам (рядам сходных элементов, ставших прообразами групп современной системы) и по шести вертикальным столбцам (прообразам будущих периодов) . В 1870 году Менделеев в «Основах химии» публикует второй вариант системы («Естественную систему элементов») , имеющий более привычный нам вид: горизонтальные столбцы элементов-аналогов превратились в восемь вертикально расположенных групп; шесть вертикальных столбцов первого варианта превратились в периоды, начинавшиеся щелочным металлом и заканчивающиеся галогеном. Каждый период был разбит на два ряда; элементы разных вошедших в группу рядов образовали подгруппы.
otvet.mail.ru
История возникновения таблицы Менделеева. Часть 2
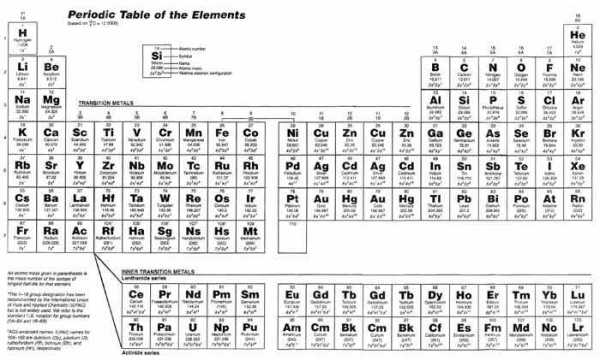
Рис. 1. Периодическая система элементов для юных скаутов в варианте американской науки. В ней в два раза больше золота и серебра — это должно понравиться будущим бизнесменам. Великолепная идея!
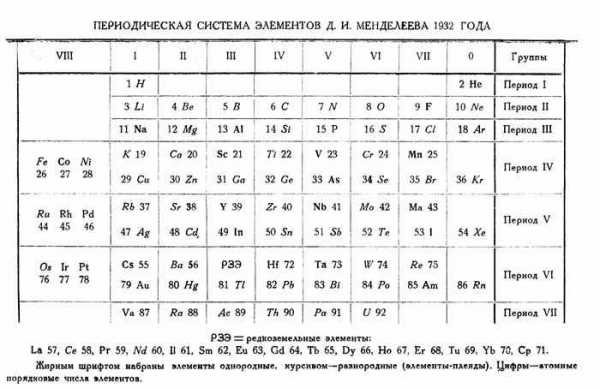
Рис. 2. Таблица варианта 1932 года
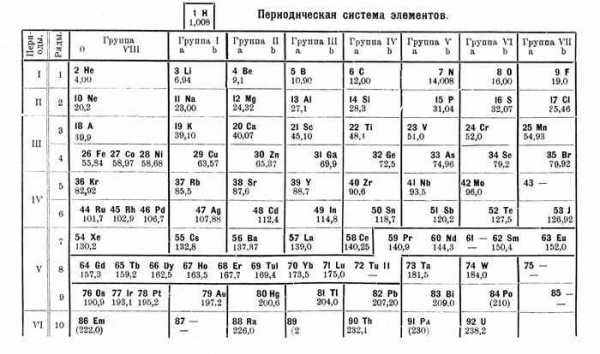
Рис. 3. Таблица варианта 1934 года
СТРАСТИ ПО ИМЕНАМ
Если проблема нижней и верхней границ Периодической системы элементов на сегодняшний день решена достаточно уверенно, то проблема ее расширения вперед водорода оставалась главной, но упорно умалчиваемой загадкой учения о периодичности вплоть до начала ХХ века!
«Никогда мне в голову не приходило, что именно водородом должен начинаться ряд элементов, хотя легче его не было и поныне нет ни одного другого элементарного или сложного газа». И еще. «Хотя у меня и мелькали мысли о том, что раньше водорода можно ждать элементов, обладающих атомным весом меньше 1, но я не решался высказаться в этом смысле по причине гадательности предположения». Эти мысли высказаны, да-да, Д.И. Менделеевым в 1902 г. в статье «Попытка понимания мирового эфира». И хотя подобная идея не сыскала чистых сторонников, однако…
Мысль о том, что «здесь что-то есть», приходила на ум ученым тех лет, если взглянуть на таблицу элементов в ином ракурсе. Факт, что водороду долгое время приписывалась атомная масса, равная 1, по нему и измерялись атомные массы всех остальных элементов. И если бы все атомные массы были целочисленными, то, тем самым, исключалась бы возможность существования элементов легче водорода. Но другим фактом оказалась именно нецелочисленность атомных весов, в том числе, и для самого водорода.
Шведский ученый И. Ридберг, современник Д.И. Менделеева, рассматривал в качестве предшественника водорода электрон с порядковым числом 0, а также два гипотетических элемента с номерами 2 и 3. В работе астрофизика А. Нильсона также фигурировали элементы легче водорода, которые могли существовать в различных космических объектах. Предлагался на эту роль и нейтрон, но это были догадки. После работ Г. Мозли водород как элемент с минимальным целочисленным положительным зарядом, равным единице, окончательно определился в качестве начальной границы периодической системы Д.И. Менделеева.
Теперь мы подошли к самой любопытной части истории Периодической таблицы элементов Д.И. Менделеева — это наименования элементов. Больной вопрос во все времена, в наше время он стал еще более актуальным.
Следует особо подчеркнуть, что Д.И. Менделеев последовательно отстаивал свой приоритет в открытии периодичности, но никогда не претендовал на соавторство в открытии предсказанных им элементов.
Вот один пример. Немец К. Винклер в 1886 г. выделил из минерала серебра новый элемент, приняв его за аналог сурьмы. Д.И. Менделеев отреагировал мгновенно — в период пяти дней с момента сообщения К. Винклером о своих работах вместе с В. Рихтером и Л. Мейером поставил его в известность, что тот открыл новый элемент — экасилиций. Учитывая давние дружеские отношения с великим русским ученым, К. Винклер попросил Д.И. Менделеева дать согласие назвать новый элемент германием в честь его родины, на что наш соотечественник дал положительный ответ. К сожалению, такое преклонение иностранцев перед заслуженными достижениями наших ученых длилось недолго.
Массовое открытие новых элементов, независимо от того, ложными они оказались или истинными, поставило перед учеными вопрос систематизации их обозначений. Например, предлагалось производить названия новых элементов от греческих или латинских обозначений порядковых номеров их размещений в таблице. В 1925 г. американцем Р. Хамером была высказана идея «предварительного наименования» еще не открытых или только что открытых элементов. Однако единства не было.
В конце концов, химики остановились на, казалось бы, оптимальном варианте обозначения элементов. В ходе синтеза трансурановых элементов большое значение приобрела тенденция называть элементы в честь выдающихся ученых, чьи работы имели особое значение в изучении строения и свойств материи. Но и тут жизнь показала, что единого согласия среди ученого мира не наблюдается до сих пор. Яркий пример этому — печальная судьба элемента с номером 104.
К началу 60-х годов прошлого века еще не было никаких сведений об элементах №№ 102 и 103, но уже велись научные споры об элементе № 104.
Существовало несколько теорий о свойствах элементов в конце периодической системы. Много вопросов касалось элемента № 104, т.к. было непонятно, где будет находиться этот элемент — в VI группе и напоминать свойства урана, либо должен входить в группу актиноидов.
Было высказано предложение, что этот элемент должен открывать новое семейство сверхтяжелых элементов, следующих за актиноидами. А это уже должен быть качественный скачок в химических свойствах. Но много было сторонников и того, что элемент № 104 должен все-таки быть элементом IV группы. Таким образом, этот загадочный элемент являлся своеобразным флажком, который мог бы вывести Периодическую таблицу Д.И. Менделеева на новый уровень развития науки. И соревнование между ведущими странами мира в авторстве его открытия оказалось нешуточным.
Работы коллектива академика АН СССР Г.Н. Флерова по синтезу 104-го элемента начались в то время, когда элемент № 103 еще не был открыт. И уже 28 августа 1964 г. Советский Союз отрапортовал об открытии нового химического элемента под № 104. А через два года на Международном ученом совете Объединенного института ядерных исследований было решено назвать этот элемент в честь великого соотечественника авторов открытия нового элемента. 104-му элементу был присвоен символ Ku, а название — курчатовий. Были определены и его свойства, благодаря которым элемент № 103 оказался последним в группе актиноидов.
О синтезе элемента № 102 сообщила в 1957 г. интернациональная группа физиков в Нобелевском институте в г. Стокгольме. Но в следующем году работы были повторены учеными Советского Союза и США, и выяснилось, что результаты этих работ не соответствовали данным ученых предыдущего года. И никому не удавалось повторить эксперименты, проведенные в Швеции. Ученые шутили: «От нобелия (а так назвали этот элемент в Стокгольме) остался один No». Достоверно элемент № 102 был синтезирован лишь в 1967 г. в Советском Союзе, подтверждение – в США. Но символ «No» так и остался за этим элементом, хотя первоначально к нему и не мог относиться
Кстати, все тот же Г.Н. Флеров выяснил ошибочность открытия в 1961 г. элемента № 103 американским коллективом ученых под руководством А. Гиорсо. Достоверный синтез этого элемента был осуществлен лишь в 1965 году, в результате которого Г.Н. Флеров уточнил единственно верный период его полураспада — 35 с, а не 8, как то утверждалось американцами. Тогда наши соотечественники заняли лидирующее положение в мире в деле синтеза новых трансурановых элементов, успев «дойти» к 1991 г. до 107 элемента. Вообще в период с 1766 г. по 1991 г. учеными было открыто следующее количество элементов:

Не секрет, что соперничество между СССР и США распространялось на все сферы жизни человечества, в том числе и на науку. Разыгрался спор и относительно элементов с атомными номерами 102-105. Открыты они были в СССР группой Г.Н. Флерова и Ю.Ц. Оганесяна, и первооткрыватели предложили для них следующие названия:
Однако у IUPAC (Международный союз теоретической и прикладной химии) оказались другие представления о приоритете и названиях элементов. И как вы можете догадаться, эта организация находится в США.
С распадом СССР западная наука долго не ждала. Уже в 1991 г. начался закономерный процесс переувековечивания имен «великих». Курчатовий, если он где-то и присутствовал в иностранных Периодических таблицах, сразу исчез из химии. К 1996 г. исчез он из Периодической таблицы и в самой России.
По сути дела, произошел отход от отечественной системы обозначения элементов и приведение ее к международной, хотя не все ведущие в химической науке страны считают это необходимым.
Рекомендации Комиссии по номенклатуре неорганической химии (CNIC), касающиеся номенклатуры трансфермиевых элементов (101-109 включительно) были рассмотрены бюро IUPAC в Гуилфорде (Великобритания) в сентябре 1995 года. В результате критических замечаний бюро решило принять рекомендации как предварительные и разослать их в национальные (региональные) номенклатурные центры обычным путем, с комментариями, для публикации в национальных химических журналах, прося подтвердить согласие со CNIC.
Комиссия обсудила названия на встрече в Честертауне (штат Мэриленд, США) в августе 1996 года. Хотя она и подтвердила, что открыватели новых элементов имеют право (!) предложить их названия и что такие предложения должны быть серьезно обсуждены, она также указала, что окончательное решение таких вопросов должно быть отдано CNIC и обязательно утверждаться межведомственным комитетом по номенклатуре и символам, Бюро и советом Союза. В Честертауне CNIC повторил заключение, принятое трансфермиевой рабочей группой (TWG), основанное на принятых решениях. Однако, он также дополнил свое решение правилом, что имена ныне живущих ученых не могут быть использованы для названий элементов. Отклики из национальных организаций и химического сообщества показали полную ясность в вопросе о неуместности этого. Комиссия согласилась, в соответствии с традицией, в качестве источников для названий использовать:
а) мифические образы;
б) местности, территории и страны;
в) свойства элементов;
г) имена ученых.
После некоторых дискуссий комиссия согласилась с тем, что элементы 101, 102 и 103 должны быть названы менделевием, нобелием и лоуренсием. Это произошло несмотря на то, что первоначальные утверждения шведов о получении элемента 102 были признаны ошибочными Дубненской лабораторией, которая в конце концов произвела бесспорный синтез.
Открытие элемента 106 в Беркли тоже было признано бесспорным, и название, предложенное шведскими учеными — сиборгий, — утверждено. Для справки: шведы лишь повторили результаты советских ученых шесть лет спустя.
Наконец, комиссия предложила назвать резерфордием элемент 104 в честь Э. Резерфорда. Для справки: годы жизни И.В. Курчатова 1903-1960 гг.
Окончательный список рекомендаций выглядел так:
Наверное, для успокоения возмущений постсоветских ученых как первооткрывателей шести из восьми указанных элементов только одному новому элементу было позволено носить малопонятное иностранцу название дубний — и кто его знает, этот город за границей? Умный ход.
Однако не все оказались согласными даже и с дубнием. И, как пример, обратимся к американскому варианту периодической таблицы Д.И. Менделеева (рис. 1). Помимо отсутствия авторства нашего великого соотечественника, эта таблица интересна следующим.
Во-первых, невзирая на международный принцип обозначать полное название элементов по первой букве символа, на что недавно перешли и Украина и Россия, эта таблица содержит все равно свои, американские названия некоторых химических элементов, таких, например, как Sodium для натрия. Названия элементов с порядковыми номерами от 104 до 109 тоже в американском варианте.
Во-вторых, расположение редкоземельных элементов представлено в зрительно-логической связи с вертикальными столбцами подгрупп других, никак не связанных с ними элементов. Впрочем, эта же проблема почему-то присутствует и в некоторых украинских вариантах Периодической таблицы элементов. Далее. Сама таблица разбита на две части, а водород представлен в раздельной от всей таблицы ячейке.
В-третьих, и это самое главное, в таблицу введены непонятно зачем две новые подгруппы, а точнее, продублированы столбцы 11 (1В) и 12 (2В). Кроме того, этот повтор также распространен на группу лантаноидов и актиноидов! При этом рядом с таблицей размещена информация следующего содержания (в переводе на русский): «Обозначения 1-18 групп рекомендованы международным IUPAC, но широко не используются. Обращаем ваше внимание на стандартное американское обозначение номеров групп (1A-8A и 1B-8B)».
И в-четвертых. Пикантность этой таблицы состоит в том, что она сопровождает набор веществ для химических опытов юного скаута-американца, что-то наподобие отечественного набора юного химика. Смелые парни, эти американцы, коль учат такому своих детей. Видать, знают, что делают.
После 1991 г. иностранными учеными продолжался синтез новых элементов. Так, например, открытый в 1994 г. 110-й элемент был назван Дармштадтий (Ds), а открытый в 1995 г. элемент № 111 получил название Рентгений (Rg). Кстати, получив недавно новый, 118-й элемент, авторы открытия претендуют на свое название этому элементу — московий. Читатель теперь сам сможет определить, чьи первооткрыватели этих элементов.
www.science-techno.ru
Пять главных достижений Дмитрия Менделеева (5 фото + Видео)
Автор: nlo-mir Человек 383

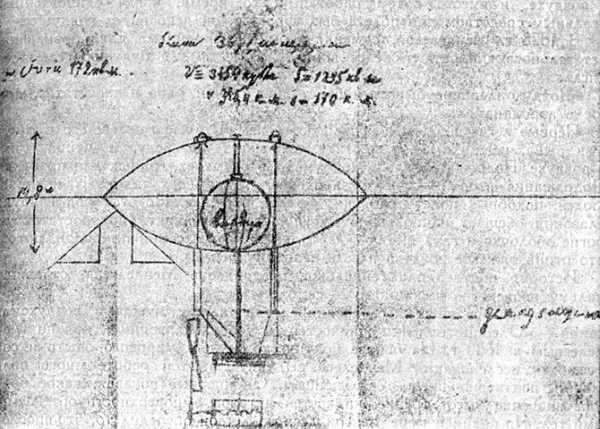
19 октября 1875 года в докладе на заседании физического общества при Петербургском университете Дмитрий Менделеев выдвинул идею аэростата с герметичной гондолой для исследования высотных слоёв атмосферы. Дмитрий Менделеев был фантастически эрудированным человеком и учёным, исследователем во многих науках. За свою жизнь Менделеев сделал немало великих открытий. Сегодня мы решили сделать подборку из пяти главных достижений Дмитрия Менделеева.
Создание управляемого аэростата
Дмитрий Менделеев занимался изучением газов в химии. Также Менделеева интересовали проекты стратостатов и аэростатов. Так в 1875 году он разработал проект стратостата объёмом около 3600 м3 с герметичной гондолой, подразумевающий возможность подъёма в верхние слои атмосферы, уже позже он спроектировал управляемый аэростат с двигателями.
Создание периодической таблицы химических элементов
Одним из главных достижений Дмитрия Ивановича Менделеева было создание периодической таблицы химических элементов. Эта таблица – классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Таблица – это графическое выражение периодического закона, который установил сам Менделеев. Также известно, что периодическая таблица, разработанная Менделеевым больше в рамках химии, явилась готовой систематизацией типов атомов для новых разделов физики.

Открытие критической температуры
Ещё одно немалое достижение Менделеева – это открытие «температуры абсолютного кипения жидкостей», то есть критической температуры. Критическую температуру Менделеев открыл в 1860 году, устроив в своем доме лаборатории, с помощью которой он исследовал поверхностное натяжение жидкостей при различных температурах. Сама под собой в термодинамике «критическая температура» подразумевает значение температуры в критической точке, то есть при температуре выше критической точки газ невозможно сконденсировать ни при каком давлении.

Открытие общего уравнения состояния идеального газа
Уравнение состояния идеального газа – это формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Это уравнении называется уравнением Клайперона-Менделеева, именно потому что вклад в открытие уравнения внесли оба этих ученых. Если уравнение Клапейрона содержало неуниверсальную газовую постоянную, значение которой необходимо было измерять для каждого газа, то Менделеев нашел коэффициент пропорциональности того, чего он назвал универсальной газовой постоянной.

Открытие Главной палаты мер и весов
Главная палата мер и весов была учреждена в 1893 году в Санкт-Петербурге по инициативе Дмитрия Менделеева. Главная палата мер и весов являлась центральным учреждением Министерства финансов и заведовала поверочной частью в Российской империи и подчиненным отделу торговли. Задачей этой Палаты, которую открыл Менделеев, было «сохранение единообразия, верности и взаимного соответствия мер и весов», как говорилось в Положении о мерах на 1899 год. Ныне Главная палата мер и весов – это Всероссийский научно-исследовательский институт метрологии имени Д.И. Менделеева.
Видео
Другие статьи:
nlo-mir.ru
