Периодическая таблица Менделеева / Блог :: Бингоскул
- Блог
- →
- Периодическая таблица Менделеева
Таблица Менделеева является фундаментом нашего современного знания о химии.
Содержание:
- Сколько элементов в таблице Менделеева?
- Классический вид периодической таблицы Менделеева
- Таблица Менделеева для ЕГЭ по химии
- Периодический закон Менделеева
Сколько элементов в таблице Менделеева?
Ответ: 118 или 126 элементов в зависимости от вида таблицы.
Почему такая разница?
В природе люди обнаружили 94 элемента. Другие 24 элемента были созданы в лабораториях. Всего получается 118 штук. Еще 8 элементов являются лишь гипотетическими вариантами.
Классический вид периодической таблицы Менделеева

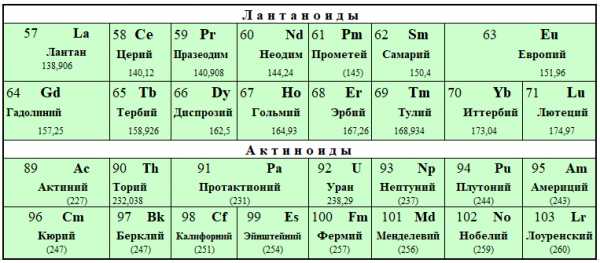
Таблица Менделеева для ЕГЭ по химии
Ниже приведена таблица, которую можно использовать на ЕГЭ по химии, входит в пакет разрешенных документов.

Периодический закон Менделеева
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева:
«Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов».
Современная:
«Свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера)».
Ряд активности металлов
Таблица растворимости солей, кислот, оснований в воде
Решай с ответами задания ЕГЭ по химии:
bingoschool.ru
Справочный материал для ЕГЭ и ОГЭ
Для сдающих ЕГЭ и ОГЭ, отдельной темой выкладываем справочный материал приближенный к тому, что выдают на экзамене:
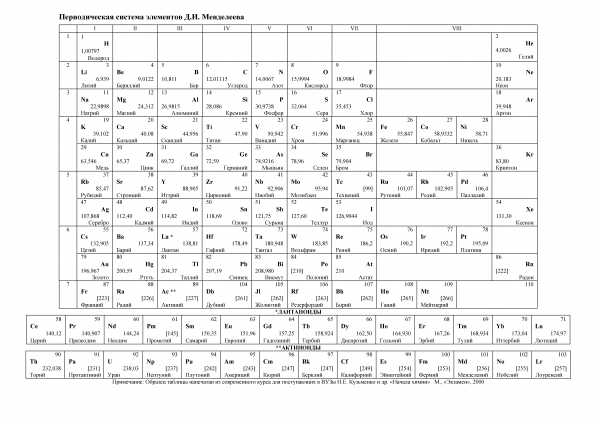 Таблица Менделеева для ЕГЭ и ОГЭ
Таблица Менделеева для ЕГЭ и ОГЭ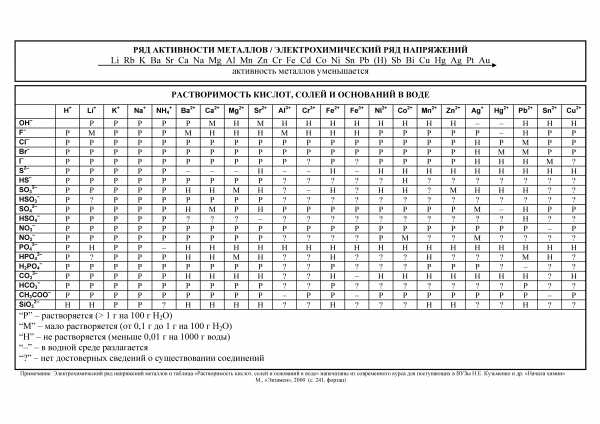 Таблица растворимости для ЕГЭ и ОГЭ
Таблица растворимости для ЕГЭ и ОГЭwww.chem-mind.com
Чем можно пользоваться на ЕГЭ?
Выдают ли на ЕГЭ калькулятор, или нужно приносить его с собой? Выдают ли на ЕГЭ по химии таблицу Менделеева и таблицу растворимости? Ниже вы найдете ответы на эти и другие вопросы. Внимательно прочитайте статью, поделитесь со своими друзьями. Помните — незнание правил ЕГЭ не освобождает от ответственности за их нарушение!
Ответы на эти и другие вопросы найти легко — на официальных порталах ЕГЭ: ege.edu.ru, fipi.ru, mathege.ru.
Перечень дополнительных устройств, которыми разрешается пользоваться во время экзаменов по каждому предмету ЕГЭ, ежегодно утверждается приказом Минобрнауки России.
Кроме того, в комплекты КИМ по некоторым предметам включены справочные материалы.
Ниже дан полный перечень разрешенных дополнительных устройств и материалов, составленный на основе спецификаций по предметам.
ЕГЭ по математике
Разрешается пользоваться линейкой.
Справочные материалы, которые можно использовать во время экзамена, выдаются каждому участнику ЕГЭ вместе с текстом его экзаменационной работы.
ЕГЭ по географии
Разрешено использование непрограммируемого калькулятора (на каждого ученика), линейки и транспортира.
Непрограммируемый калькулятор должен обеспечивать арифметические вычисления (сложение, вычитание, умножение, деление, извлечение корня) и вычисление тригонометрических функций (sin, cos, tg, ctg, arcsin, arcos, arctg).
Калькулятор не должен предоставлять возможность сохранения в своей памяти баз данных экзаменационных заданий и их решений, а также любой другой информации, знание которой прямо или косвенно проверяется на экзамене.
Калькулятор не должен предоставлять экзаменующемуся возможности получения извне информации во время сдачи экзамена. Коммуникационные возможности калькулятора не должны допускать беспроводного обмена информацией с любыми внешними источниками.
ЕГЭ по химии
Разрешено использование непрограммируемого калькулятора с возможностью вычисления тригонометрических функций (cos, sin, tg) и линейки.
Также к каждому варианту экзаменационной работы прилагаются следующие материалы:
- периодическая система химических элементов Д.И. Менделеева;
- таблица растворимости солей, кислот и оснований в воде;
- электрохимический ряд напряжений металлов.
ЕГЭ по физике
Разрешено использование непрограммируемого калькулятора (на каждого ученика)
Кроме того, каждый КИМ содержит справочные данные, которые могут понадобиться при выполнении работы.
ЕГЭ по иностранным языкам
Дополнительные материалы и оборудование на экзамене по иностранному языку включают звуковоспроизводящую аппаратуру, аудиокассеты или компакт-диски (CD) с материалами для выполнения заданий раздела 1 «Аудирование».
По остальным предметам использование дополнительного оборудования и материалов на экзамене не предусмотрено.
Всё, что не входит в
- мобильные телефоны или иные средства связи;
- любые электронно-вычислительные устройства и справочные материалы и устройства.
При нарушении этих правил и отказе в их соблюдении организаторы совместно с уполномоченным представителем ГЭК вправе удалить участника ЕГЭ с экзамена с внесением записи в протокол проведения экзамена в аудитории с указанием причины удаления. На бланках и в пропуске проставляется метка о факте удаления с экзамена.
Обратите внимание!
- Калькулятор и ручку (с запасом) необходимо приносить на экзамен самому.
- Если вы просто пронесли телефон на экзамен, то организаторы имеют право удалить вас с экзамена, даже если вы этим телефоном не пользовались.
- На некоторые экзамены можно приносить непрограммируемый калькулятор, но с возможностью расчета тригонометрических функций. Заранее (в начале года) купите себе такой калькулятор, и весь год постарайтесь работать с ним, выполняя тренировочные и диагностические работы, чтобы привыкнуть к этому калькулятору.
- Ноутбуки, планшеты, КПК, смартфоны, компьютеры в часах использовать на экзамене ЕГЭ запрещено! За пользование ими вас могут удалить с экзамена.
Если у вас остались какие-то вопросы по поводу экзамена, вы можете задать их через форму обратной связи ниже. Рекомендую также прочитать остальные мои методические статьи)
chemege.ru
ЕГЭ. Периодический закон и Периодическая система химических элементов Д.И. Менделеева. Строение атома
Урок посвящен решению задач из ЕГЭ по теме: Периодический закон и Периодическая система химических элементов Д. И. Менделеева. Строение атома. Цель урока – научиться характеризовать общие свойства химических элементов и их соединений на основе положения в химической системе Д.И. Менделеева.
|
Вопрос |
Комментарий |
|
А1. Из каких частиц состоит атомное ядро? 1. из протонов и электронов 2. из нейтронов и протонов 3. только из протонов 4. только из нейтронов |
Атом – это электронейтральная частица, состоящая из протонов, нейтронов и электронов. Протоны и нейтроны входят в состав ядра атома, а электроны вращаются вокруг. Правильный ответ 2. |
|
А2. Что такое изотопы? 1. атомы с разным зарядом ядра 2. вещества, имеющие одинаковый состав, но разную массу 3. атомы, имеющие одинаковое число протонов, но разное число нейтронов 4. атомы, имеющие разное число электронов |
Изотопы – это атомы одного химического элемента. У них одинаковое число электронов и протонов в атоме, но разное число нейтронов и поэтому разная масса. Правильный ответ 3. |
|
А3. Что называется химическим элементом? 1. совокупность атомов с одинаковым зарядом ядра 2. совокупность атомов с одинаковой массой 3. совокупность атомов с одинаковым числом нейтронов 4. совокупность атомов с равным числом протонов и нейтронов |
Химический элемент – это совокупность атомов с одинаковым зарядом ядра.
Правильный ответ 1. |
|
А4. Какая частица состоит из 8 протонов, 10 нейтронов и 8 электронов? 1. изотоп кислорода -8 2. изотоп кислорода -18 3. изотоп аргона -18 4. ион кислорода с зарядом -2 |
Находим в периодической системе элемент №8. Это кислород. Прибавив к 8 протонам 10 нейтронов, получим массу атома 18. Это 18О. Правильный ответ 2. |
|
А5. Электронная формула атома химического элемента – 1s22s22p63s23p4. Укажите знак элемента и формулу его высшего оксида. 1. S, SO2 2. Se, SeO2 3. S, SO3 4. Se, SeO3 |
Нужно просуммировать количество электронов, которое равно количеству протонов. Это число 16. Это сера S, формула её высшего оксида – SO
Правильный ответ 3. |
|
А6. Наиболее сильно выражены металлические свойства у: 1. P 2. S 3. Se 4. Te |
Чем левее и ниже элемент расположен в Периодической системе, тем ярче выражены его металлические свойства. Все приведенные элементы, кроме фосфора, находятся в 6 группе. Фосфор – это типичный неметалл. Теллур (Те) находится ниже всех в группе. Правильный ответ 4. |
|
А7. Число электронов в атоме равно: 2. числу протонов 3. номеру периода 4. номеру группы |
Атом – это электронейтральная частица, поэтому число электронов равно числу протонов. Правильный ответ 2. |
|
А8. К р-элементам относится: 1. K 2. Mg 3. Na 4. Al |
Al находится в III-A группе. Электронное строение внешнего энергетического уровня …3s23p1. Правильный ответ 4. |
|
А9. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса? 1. Li, Be, B, C 2. Be, Mg, Ca, Sr 3. N,O, F, Ne 4. Na, Mg, Al, Si |
По группе сверху вниз атомные радиусы увеличиваются, а по периоду слева направо – уменьшаются.
Правильный ответ 2. |
|
А10. Химический элемент расположен в IV периоде I–A группе. Распределению электронов в атоме этого элемента соответствует ряд чисел: 1. 2, 8, 8, 2 2. 2, 8, 18, 1 3. 2, 8, 8, 1 4. 2, 8, 18, 2 |
Это 19К. Сумма электронов в ряду должна быть равна 19.
Правильный ответ 3. |
|
А11. Бром – это элемент 1. главной подгруппы IV группы 2. побочной подгруппы IV группы 3. главной подгруппы VII группы 4. побочной подгруппы VII группы |
Бром – это галоген, элемент главной подгруппы VII группы.
Правильный ответ 3. |
|
А 12. Элементу с зарядом ядра +12 соответствует высший оксид: 1. ЭО 2. Э2О 3. Э2О3 4. Э2О5 |
По заряду ядра находим этот элемент в Периодической системе. Это Mg. Ему соответствует оксид ЭО.
Правильный ответ 1. |
|
А13. Электроное строение внешнего энергeтического уровня атома кремния: 1. …2s22p2 2. …3s23p2 3. …2s22p4 4. …3s23p4 |
Кремний находится в 3-ем периоде, поэтому у него три энергетических уровня. Не учитываем варианты с цифрой 2. Так как Si – в IV группе, то валентных электронов 4. Только во втором варианте сумма электрона равна 4.
Правильный ответ 2. |
В3. Химический элемент железо представлен в природе несколькими изотопами: 54Fe, 56Fe, 57Fe, 58Fe. Определить, сколько протонов содержат атомы всех этих изотопов.
При обозначении изотопов вверху пишется массовое число, т. е. сумма масс протонов и нейтронов. Для определения числа протонов нужно посмотреть положение железа в Периодической системе. Порядковый номер железа – 26, значит, ядро атома железа содержит 26 протонов.
Правильный ответ 26.
В4. Определить сколько нейтронов содержит ядро атома изотопа неона-22.
Для определения числа нейтронов нужно посмотреть положение неона в Периодической системе. Порядковый номер неона – 10. Это количество протонов. Вычитаем из массового числа количество протонов, получаем число нейтронов. Это 12.
Правильный ответ 12.
В5. Какой заряд ядра имеют изотопы химического элемента фтора?
Порядковый номер фтора – 9. Значит, заряд его ядра будет равен +9.
Правильный ответ +9
В6. Ядро атома одного из изотопов калия содержит 21 нейтрон. Определить массовое число данного изотопа.
Массовое число равно сумме количества нейтронов и протонов. Нужно сложить число протонов (19) и число нейтронов (21).
Правильный ответ 40.
В7. Определить число нейтронов в ядре атома фосфора -31.
Вычитаем из массового числа (31) его порядковый номер (15) получаем число нейтронов. Это 16.
Правильный ответ 16.
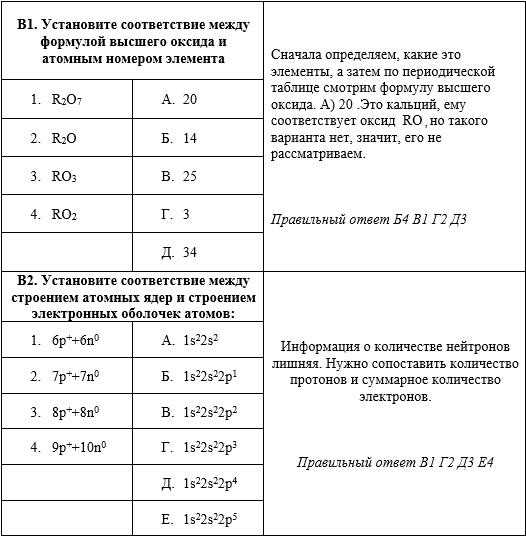
В8. Под номерами 1-3 в колонке слева приведены ряды химических элементов. Укажите, какими буквами в колонке справа обозначены закономерности, на основе которых составлен каждый из этих рядов.
|
1. Na, Mg, Al, Si, P, S, Cl |
А) Электроотрицательность уменьшается |
|
2. F, O, N, Cl |
Б) Изменяется характер химических свойств высших оксидов: основные свойства ослабевают, кислотные усиливаются |
|
3. Be, Mg, Ca, Sr, Ba |
В) Неметалличность свойств простых веществ, образованных химическими элементами, усиливается |
|
|
Г) Степени окисления атомов химических элементов в соединении с кислородом увеличиваются |
|
|
Д) Степени окисления атомов химических элементов в соединении с водородом увеличиваются |
|
|
Е) Радиусы атомов увеличиваются |
|
|
Ж) Степень окисления атомов в высших оксидах одинакова |
Комментарий к В8. При решении этого задания нужно вспомнить таблицу, которая приводилась в предыдущем уроке.
Закономерности изменения периодических свойств приведены в Табл. 1.
|
Параметр |
По группе вниз |
По периоду вправо |
|
Заряд ядра |
Увеличивается |
Увеличивается |
|
Число валентных электронов |
Не меняется |
Увеличивается |
|
Число энергетических уровней |
Увеличивается |
Не меняется |
|
Радиус атома |
Увеличивается |
Уменьшается |
|
Электроотрицательность |
Уменьшается |
Увеличивается |
|
Металлические свойства |
Увеличиваются |
Уменьшаются |
|
Степень окисления в высшем оксиде |
Не меняется |
Увеличивается |
|
Степень окисления в водородных соединениях (для элементов IV-VII групп) |
Не меняется |
Увеличивается |
Табл. 1.
Представленные в вопросе элементы находятся либо в одном периоде, либо в одной группе.
1. Na, Mg, Al, Si, P, S, Cl соответствуют варианты Б, В, Г
2. F, O, N, Cl не соответствуют ни один из вариантов
3. Be, Mg, Ca, Sr, Ba соответствуют варианты А, Е, Ж
Правильный ответ 1-Б В Г; 2-; 3-А Е Ж.
|
Вопрос |
Комментарий |
|
С1. Опишите химические свойства элемента с порядковым номером 23 по его положению в Периодической системе. |
Элемент №23 – это ванадий V. Это металл, т. к. он находится в побочной подгруппе V группы, в 4-ом периоде. Его электронная конфигурация: 1s22s22p63s23p64s23d3. Летучих водородных соединений не образует. Высший оксид V2O5 – кислотный оксид. Как металл отдает свои валентные электроны. |
|
С2. Элемент образует высший оксид состава ЭО3. В летучем водородном соединении массовая доля водорода составляет 5,88%. Рассчитайте относительную атомную массу элемента и назовите его. |
По формуле высшего оксида понятно, что элемент находится в VI группе. Формула водородного соединения – Н2Э. Массовая доля равна отношению массы элемента к суммарной массе соединения. Пусть атомная масса элемента будет Х. Тогда , отсюда Х=200:5,88-2=32. Значит этот элемент – сера S. |
Подведение итога урока
На уроке были рассмотрены задачи ЕГЭ по теме «Периодический закон и Периодическая система химических элементов Д. И. Менделеева. Строение атома». Мы научились характеризовать общие свойства химических элементов и их соединений на основе положения в химической системе Д.И. Менделеева.
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
2. Попель П.П. Химия: 8 кл.: учебник для общеобразовательных учебных заведений / П.П. Попель, Л.С.Кривля. – К.: ИЦ «Академия», 2008. – 240 с.: ил.
3. Учебно-тренировочные материалы для подготовки к единому государственному экзамену. Химия / Каверина А.А., Добротин Д.Ю., Медведев Ю.Н., Корощенко А.С. – М.: Интеллект- Центр, 2011.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Официальный информационный портал Единого Государственного Экзамена (Источник).
2. Chemport.ru (Источник).
3. Химик (Источник).
Домашнее задание
interneturok.ru
