Химия 11кл_Рудзитис_Фельдман_ГДЗ_2000 – Стр 7
Решение:
Вычислим молярные массы воды и оксида серы (IV):
М(Н2О) = 1 2 + 16 = 18 г/моль
M(SО2) = 32 + 16 2 = 64 г/моль
Вычислим количество вещества воды и оксида серы (IV), образовавшихся при сжигании вещества:
ν(h3O) = | m(h3 O) | = |
| 0,36 г | = 0,02 моль | ||||
M(h3O) | 18г/ моль | ||||||||
|
|
|
| ||||||
ν(SO2 ) = |
| m(SO | 2 ) |
| = |
| 1,28г | = 0,02 моль | |
| M(SO2 ) | 64 г/ моль | |||||||
|
|
|
| ||||||
Т.к. в реакции получаются SO2 и Н2О, то в исходном веществе содержатся могут только S, Н и О. Тогда исходное вещество можно схематично изобразить формулой SхНуОz. Тогда уравнение реакции запишется
S Н О | x + y | O | 2 |
| хSО + | y | Н | О | |
| |||||||||
|
| ||||||||
х у z | 4 |
| 2 | z | 2 |
| |||
|
|
|
|
|
|
| |||
В 0,02 моль воды содержится 0,02 2 = 0,04 моль атомов водорода. В 0,02 моль оксида серы содержится 0,02 моль атомов водорода. Вычислим массу водорода и серы в веществе:
m(Н) = n(Н) М(Н) = 0,04 моль 1 г/моль = 0,04 г.
m(S) = n(S) M(S) = 0,02 моль 32 г/моль = 0,64 г.
Масса серы и водорода равна 0,64 + 0,04 = 0,68 г, то есть равна массе вещества, значит в веществе не содержится других элементов, кроме серы и водорода. На 0,04 моль водорода приходится 0,02 моль серы, то есть на 2 атома водорода приходится 1 атом серы, простейшая формула вещества h3S, это сероводород.
Ответ: сероводород h3S.
3адача № 2
Через раствор, содержащий 10 г гидроксида натрия, пропустили 20 г сероводорода. Какая соль образовалась при этом? Определите ее массу и количество.
studfiles.net
Система химических элементов Д. И. Менделеева
Урок посвящен знакомству с историей открытия Периодического закона и изучению структуры Периодической системы химических элементов. Периодическая таблица содержит в себе огромное количество информации о химических элементах. На этом уроке вы научитесь определять по положению элемента в таблице Д.И. Менделеева его принадлежность к металлам или неметаллам, его высшую и низшую валентность.
I. Д. И. Менделеев
Еще алхимики пытались найти закон природы, на основе которого можно было бы систематизировать химические элементы. Но им недоставало надежных и подробных сведений об элементах. К середине XIX в. знаний о химических элементах стало достаточно, а число элементов возросло настолько, что в науке возникла естественная потребность в их классификации. Первые попытки классификации элементов на металлы и неметаллы оказались несостоятельными. Предшественники Д.И.Менделеева (И. В. Деберейнер, Дж. А. Ньюлендс, Л. Ю. Мейер) многое сделали для подготовки открытия периодического закона, но не смогли постичь истину. Дмитрий Иванович установил связь между массой элементов и их свойствами.
Дмитрий Иванович родился в г. Тобольске. Он был семнадцатым ребенком в семье. Закончив в родном городе гимназию, Дмитрий Иванович поступил в Санкт-Петербурге в Главный педагогический институт, после окончания которого с золотой медалью уехал на два года в научную командировку за границу. После возвращения его пригласили в Петербургский университет. Приступая к чтению лекций по химии, Менделеев не нашел ничего, что можно было бы рекомендовать студентам в качестве учебного пособия. И он решил написать новую книгу – «Основы химии».
Открытию периодического закона предшествовало 15 лет напряженной работы. 1 марта 1869 г. Дмитрий Иванович предполагал выехать из Петербурга в губернии по делам.
Видео-фильм о Д.И. Менделееве
II. Открытие Периодического закона
Периодический закон был открыт на основе характеристики атома – относительной атомной массы.
Менделеев расположил химические элементы в порядке возрастания их атомных масс и заметил, что свойства элементов повторяются через определенный промежуток – период, Дмитрий Иванович расположил периоды друг под другом., так, чтобы сходные элементы располагались друг под другом – на одной вертикали, так была построена периодическая система элементов.
1 марта 1869г. Формулировка периодического закона Д.И. Менделеева.
Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
К сожалению, сторонников периодического закона сначала было очень мало, даже среди русских ученых. Противников – много, особенно в Германии и Англии.
Открытие периодического закона – это блестящий образец научного предвидения: в 1870 г. Дмитрий Иванович предсказал существование трех еще неизвестных тогда элементов, которые назвал экасилицием, экаалюминием и экабором. Он сумел правильно предсказать и важнейшие свойства новых элементов. И вот через 5 лет, в 1875 г., французский ученый П.Э. Лекок де Буабодран, ничего не знавший о работах Дмитрия Ивановича, открыл новый металл, назвав его галлием. По ряду свойств и способу открытия галлий совпадал с экаалюминием, предсказанным Менделеевым. Но его вес оказался меньше предсказанного. Несмотря на это, Дмитрий Иванович послал во Францию письмо, настаивая на своем предсказании.
В 1886 г. К. Винклер в Германии открыл германий, который оказался экасилицием.
Но гениальность Дмитрия Ивановича Менделеева и его открытия — не только эти предсказания!
В четырёх местах периодической системы Д. И. Менделеев расположил элементы не в порядке возрастания атомных масс:
Ar – K, Co – Ni, Te – I, Th – Pa
Ещё в конце 19 века Д.И. Менделеев писал, что, по-видимому, атом состоит из других более мелких частиц. После его смерти в 1907 г. было доказано, что атом состоит из элементарных частиц. Теория строения атома подтвердила правоту Менделеева, перестановки данных элементов не в соответствии с ростом атомных масс полностью оправданы.
Современная формулировка периодического закона.
Свойства химических элементов и их соединений находятся в периодической зависимости от величины заряда ядер их атомов, выражающейся в периодической повторяемости структуры внешней валентной электронной оболочки.
И вот спустя более 130 лет после открытия периодического закона мы можем вернуться к словам Дмитрия Ивановича, взятым в качестве девиза нашего урока: «Периодическому закону будущее не грозит разрушением, а только надстройка и развитие обещаются». Сколько химических элементов открыто на данный момент? И это далеко не предел.
III. Периодическая система химических элементов
Графическим изображением периодического закона является периодическая система химических элементов. Это краткий конспект всей химии элементов и их соединений.
Изменения свойств в периодической системе с ростом величины атомных весов в периоде (слева направо):
1. Металлические свойства уменьшаются
2. Неметаллические свойства возрастают
3. Валентность элементов в формулах высших оксидов возрастает от I до VII, а в формулах летучих водородных соединений уменьшается от IV
Основные принципы построения периодической системы
|
Признак сравнения |
Д.И.Менделеев |
|
Как устанавливается последовательность элементов по номерам? (что положено в основу п.с.?) |
Элементы расставлены в порядке увеличения их относительных атомных масс. При этом есть исключения. Ar – K, Co – Ni, Te – I, Th – Pa |
|
Принцип объединения элементов в группы. |
Качественный признак. Сходство свойств простых веществ и однотипных сложных. |
|
Принцип объединения элементов в периоды. |
Совокупность элементов по мере роста относительной атомной массы от одного щелочного металла до другого. |
На сегодняшний день открыто 118 химических элементов, каждый из которых занял свою ячейку в Периодической системе. Новые открываемые элементы имеют большую относительную атомную массу, чем уже известные и попадают в конец таблицы. В настоящее время используются длинная и короткая формы периодических таблиц.
В ячейке таблицы записывается символ химического элемента, его название и порядковый номер, значение относительной атомной массы.
Рис. Информация о химическом элементе кислороде
При изучении школьного курса химии, как правило, пользуются короткой формой Периодической таблицы. Она содержит 8 вертикальных столбцов (групп), которые нумеруются римскими цифрами. Каждая группа включает в себя главную (А) и побочную (В) подгруппы.
У элементов главных подгрупп высшая валентность, как правило, равна номеру группы. Одними из исключений этого правила являются кислород (его валентность всегда равна II) и фтор (высшая валентность которого – I).
С помощью Периодической таблицы можно определить и низшую валентность элемента. Для этого из 8 (максимального числа групп) надо вычесть номер группы, в которой находится элемент. Например, высшая валентность фосфора равна V (т. к. фосфор находится в V группе), а низшая равна III. Только это правило применимо для элементов главных подгрупп V–VII групп.
Горизонтальные ряды химических элементов в Периодической таблице называются периодами. Пока их 7. Первые три периода называют малыми (первый период содержит всего 2 хим. элемента, а 2 и 3 – по 8 элементов). Периоды 4, 5, 6, 7 называются большими.
По положению элемента в Периодической системе можно определить его принадлежность к металлам или неметаллам. Для этого в короткой форме таблицы нужно провести диагональ от бериллия к астату. Элементы главных подгрупп, находящиеся выше этой диагонали (плюс водород), относятся к неметаллам. Все остальные элементы – металлы. Инертные газы He, Ne, Ar, Kr, Xe, Rn не относят ни к металлам, ни к неметаллам.
В длинной форме таблицы можно провести диагональ от бора к астату. Все элементы, которые находятся ниже этой диагонали, образуют простые вещества металлы.
Рис. Длинная форма периодической системы химических элементов
По положению элемента в периодической системе можно получить информацию о его высшем оксиде и гидроксиде. У неметаллов высший оксид и гидроксид имеют кислотный характер, у металлов – основный, у переходных металлов оксид и гидроксид, как правило, амфотерные (см. рис.).
Рис. Связь свойств элементов и образованных ими соединений
IV. Значение Периодического закона
Смотрите фильм: “Периодический закон Менделеева”
V. Тренажеры
Тренажёр №1 “Периодический закон и Периодическая система элементов Д. И. Менделеева”
Тренажёр №2. “Закономерности изменения свойств атомов элементов в периодах и группах Периодической системы элементов Д. И. Менделеева”
Тренажёр №3. “Периодический закон Д.И.Менделеева”
ЦОРы
Фильм оД.И. Менделееве
Видео фильм:“Периодический закон Менделеева”
Научные труды Д. И. Менделеева
Интересные ссылки о Д. И. Менделееве
Статья: С. И. Левченков “Краткий очерк истории химии: ПЗ и ПСХЭ”
Периодический закон Д. И. Менделеева
kardaeva.ru
Периодический закон и Периодическая система химических элементов Д.И. Менделеева

Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
Группы и периоды Периодической системы. Физический смысл порядкового номера химического элемента
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.
Закономерности изменения свойств элементов и их соединений в связи с положением в Периодической системе химических элементов Д.И. Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства.
Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
Тренировочные задания
1. Среди перечисленных химический элемент с максимальным радиусом атома — это
1) неон
2) алюминий
3) калий
4) кальций
2. Среди перечисленных химический элемент с минимальным радиусом атома — это
1) алюминий
2) бор
3) калий
4) неон
3. Наиболее ярко металлические свойства выражены у элемента
1) Rb
2) Li
3) Mg
4) Ca
4. Наиболее ярко неметаллические свойства выражены у элемента
1) F
2) S
3) O
4) N
5. Наибольшее число валентных электронов у элемента
1) фтор
2) водород
3) натрий
4) сера
6. Наименьшее число валентных электронов у элемента
1) кислород
2) кремний
3) водород
4) кальций
7. Металлические свойства элементов возрастают в ряду
1) Ba, Li, Cs, Mg
2) Al, Mg, Ca, K
3) Li, Cs, Mg, Ba
4) Na, Mg, Li, Al
8. Неметаллические свойства элементов ослабевают в ряду:
1) N, S, Br, Cl
2) O, S, Se, Te
3) Se, I, S, O
4) N, P, O, F
9. Химические элементы перечислены в порядке возрастания атомного радиуса в ряду
1) углерод, бериллий, магний
2) калий, магний, алюминий
3) хлор, натрий, фтор
4) азот, фосфор, фтор
10. Химические элементы перечислены в порядке убывания атомного радиуса в ряду
1) водород, бор, алюминий
2) углерод, кремний, калий
3) натрий, хлор, фтор
4) сера, кремний, магний
11. Кислотные свойства водородных соединений усиливаются в ряду
1) HI – PH3 – HCl – H2S
2) PH3 – H2S – HBr – HI
3) H2S – PH3 – HCl – SiH4
4) HI – HCl – H2S – PH3
12. Кислотные свойства водородных соединений ослабевают в ряду
1) HI – PH3 – HCl – H2S
2) PH3 – H2S – HBr – HI
3) H2S – PH3 – HCl – SiH4
4) HI – HBr – HCl – HF
13. Основные свойства соединений усиливаются в ряду
1) LiOH – KOH – RbOH
2) LiOH – KOH – Ca(OH)2
3) Ca(OH)2 – KOH – Mg(OH)2
4) LiOH – Ca(OH)2 – KOH
14. Основные свойства соединений ослабевают в ряду
1) LiOH – Ba(OH)2 – RbOH
2) LiOH – Ba(OH)2 – Ca(OH)2
3) Ca(OH)2 – KOH – Mg(OH)2
4) LiOH – Ca(OH)2 – KOH
15. Во втором периоде Периодической системы элементов Д.И. Менделеева с увеличением заряда ядра у химических элементов:
1) возрастает электроотрицательность
2) уменьшается заряд ядра
3) возрастает атомный радиус
4) возрастает степень окисления
16. Наиболее сильной кислотой, образованной элементом второго периода, является
1) угольная
2) азотная
3) фтороводородная
4) азотистая
17. Наиболее сильное основание образует химический элемент
1) магний
2) литий
3) алюминий
4) калий
18. Наиболее сильная бескислородная кислота соответствует элементу
1) селен
2) фтор
3) йод
4) сера
19. В ряду элементов Li → B → N → F
1) убывает атомный радиус
2) возрастают металлические свойства
3) уменьшается число протонов в атомном ядре
4) увеличивается число электронных слоёв
20. В ряду элементов Li → Na → K → Rb
1) убывает атомный радиус
2) ослабевают металлические свойства
3) уменьшается число протонов в атомном ядре
4) увеличивается число электронных слоёв
Ответы
himi4ka.ru
№ элемента | Химический знак | Название элемента | Электронная формула |
1 | H | водород | 1s1 |
2 | He | гелий | 1s2 |
II период | |||
3 | Li | литий | 1s22s1 |
4 | Be | бериллий | 1s22s2 |
5 | B | бор | 1s22s22p1 |
6 | C | углерод | 1s22s22p2 |
7 | N | азот | 1s22s22p3 |
8 | O | кислород | 1s22s22p4 |
9 | F | фтор | 1s22s22p5 |
10 | Ne | неон | 1s22s22p6 |
III период | |||
11 | Na | натрий | 1s22s22p63s1 |
12 | Mg | магний | 1s22s22p63s2 |
13 | Al | алюминий | 1s22s22p63s23p1 |
14 | Si | кремний | 1s22s22p63s23p2 |
15 | P | фосфор | 1s22s22p63s23p3 |
16 | S | сера | 1s22s22p63s23p4 |
17 | Cl | хлор | 1s22s22p63s23p5 |
18 | Ar | аргон | 1s22s22p63s23p6 |
IV период | |||
19 | K | калий | 1s22s22p63s23p64s1 |
20 | Ca | кальций | 1s22s22p63s23p64s2 |
21 | Sc | скандий | 1s22s22p63s23p64s23d1 |
22 | Ti | титан | 1s22s22p63s23p64s23d2 |
23 | V | ванадий | 1s22s22p63s23p64s23d3 |
24 | Cr | хром | 1s22s22p63s23p64s13d5 |
25 | Mn | марганец | 1s22s22p63s23p64s23d5 |
26 | Fe | железо | 1s22s22p63s23p64s23d6 |
27 | Co | кобальт | 1s22s22p63s23p64s23d7 |
28 | Ni | никель | 1s22s22p63s23p64s23d8 |
29 | Cu | медь | 1s22s22p63s23p64s13d10 |
30 | Zn | цинк | 1s22s22p63s23p64s23d10 |
31 | Ga | галлий | 1s22s22p63s23p64s23d104p1 |
32 | Ge | германий | 1s22s22p63s23p64s23d104p2 |
33 | As | мышьяк | 1s22s22p63s23p64s23d104p3 |
34 | Se | селен | 1s22s22p63s23p64s23d104p4 |
35 | Br | бром | 1s22s22p63s23p64s23d104p5 |
36 | Kr | криптон | 1s22s22p63s23p64s23d104p6 |
V период | |||
37 | Rb | рубидий | 1s 22s 22p 63s 23p64s 23d104p65s1 |
38 | Sr | стронций | 1s 22s 22p 63s 23p64s 23d104p65s2 |
39 | Y | иттрий | 1s 22s 22p 63s 23p64s 23d104p65s24d1 |
40 | Zr | цирконий | 1s 22s 22p 63s 23p64s 23d104p65s24d2 |
41 | Nb | ниобий | 1s 22s 22p 63s 23p64s 23d104p65s14d4 |
42 | Mo | молибден | 1s 22s 22p 63s 23p64s 23d104p65s14d5 |
43 | Tc | технеций | 1s 22s 22p 63s 23p64s 23d104p65s24d5 |
44 | Ru | рутений | 1s 22s 22p 63s 23p64s 23d104p65s14d7 |
45 | Rh | родий | 1s 22s 22p 63s 23p64s 23d104p65s14d8 |
46 | Pd | палладий | 1s 22s 22p 63s 23p64s 23d104p65s04d10 |
47 | Ag | серебро | 1s 22s 22p 63s 23p64s 23d104p65s14d10 |
48 | Cd | кадмий | 1s 22s 22p 63s 23p64s 23d104p65s24d10 |
49 | In | индий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p1 |
50 | Sn | олово | 1s 22s 22p 63s 23p64s 23d104p65s24d105p2 |
51 | Sb | сурьма | 1s 22s 22p 63s 23p64s 23d104p65s224d105p3 |
52 | Te | теллур | 1s 22s 22p 63s 23p64s 23d104p65s24d105p4 |
53 | I | йод | 1s 22s 22p 63s 23p64s 23d104p65s24d105p5 |
54 | Xe | ксенон | 1s 22s 22p 63s 23p64s 23d104p65s24d105p6 |
VI период | |||
55 | Cs | цезий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s1 |
56 | Ba | барий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s2 |
57 | La | лантан | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s25d1 |
58 | Ce | церий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f2 |
59 | Pr | празеодим | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f3 |
60 | Nd | неодим | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f4 |
61 | Pm | прометий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f5 |
62 | Sm | самарий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f6 |
63 | Eu | европий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f7 |
64 | Gd | гадолиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f75d1 |
65 | Tb | тербий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f9 |
66 | Dy | диспрозий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f10 |
67 | Ho | гольмий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f11 |
68 | Er | эрбий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f12 |
68 | Tm | тулий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f13 |
70 | Yb | иттербий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f14 |
71 | Lu | лютеций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d1 |
72 | Hf | гафний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d2 |
73 | Ta | тантал | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d3 |
74 | W | вольфрам | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d4 |
75 | Re | рений | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d5 |
76 | Os | осмий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d6 |
77 | Ir | иридий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d7 |
78 | Pt | платина | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d9 |
79 | Au | золото | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d10 |
80 | Hg | ртуть | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d10 |
81 | Tl | таллий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p1 |
82 | Pb | свинец | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p2 |
83 | Bi | висмут | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p3 |
84 | Po | полоний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p4 |
85 | At | астат | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p5 |
86 | Rn | радон | 1s 22s 22p 63s 23p64s 23d104p65s14d105p66s24f145d106p6 |
VII период | |||
87 | Fr | франций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s1 |
88 | Ra | радий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s2 |
89 | Ac | актиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d1 |
90 | Th | торий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d25f0 |
91 | Pa | протактиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f26d1 |
92 | U | уран | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f36d1 |
93 | Np | нептуний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f46d1 |
94 | Pu | плутоний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f56d1 |
95 | Am | америций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f7 |
96 | Cm | кюрий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f76d1 |
97 | Bk | берклий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f86d1 |
98 | Cf | калифорний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f10 |
99 | Es | эйнштейний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f11 |
100 | Fm | фермий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f12 |
101 | Md | менделеевий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f13 |
102 | No | нобелий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f14 |
103 | Lr | лоуренсий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d1 |
104 | Rf | резерфордий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d2 |
105 | Db | дубний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d3 |
106 | Sg | сиборгий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d4 |
107 | Bh | борий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d5 |
108 | Hs | хассий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d6 |
109 | Mt | мейтнерий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d7 |
s-элементы | p-элементы | d-элементы | f-элементы |
infotables.ru
Характеристика химических элементов по их месту в периодической системе и строению атома
Зная формулировка периодического закона и используя периодическую систему элементов Д. И. Менделеева, можно дать характеристику любому химическому элементу и его соединениям. Такую характеристику химического элемента удобно складывать по плану.
I. Символ химического элемента и его название.
II. Положение химического элемента в периодической системе элементов Д.И. Менделеева:
- порядковый номер;
- номер периода;
- номер группы;
- подгруппа (главная или побочная).
III. Строение атома химического элемента:
- заряд ядра атома;
- относительная атомная масса химического элемента;
- число протонов;
- число электронов;
- число нейтронов;
- число электронных уровней в атоме.
IV. Электронная и электронно-графическая формулы атома, его валентные электроны.
V. Тип химического элемента (металл или неметалл, s-, p-, d-или f-элемент).
VI. Формулы высшего оксида и гидроксида химического элемента, характеристика их свойств (основные, кислотные или амфотерные).
VII. Сравнение металлических или неметаллических свойств химического элемента со свойствами элементов-соседей по периоду и подгруппой.
VIII. Максимальная и минимальная степень окисления атома.
Например, предоставим характеристику химического элемента с порядковым номером 15 и его соединениям по положению в периодической системе элементов Д. И. Менделеева и строению атома.
I. Находим в таблице Д. И. Менделеева клетку с номером химического элемента, записываем его символ и название.
Химический элемент номер 15 — Фосфор. Его символ Р.
II. Охарактеризуем положение элемента в таблице Д. И. Менделеева (номер периода, группы, тип подгруппы).
Фосфор находится в главной подгруппе V группы, в 3-м периоде.
III. Предоставим общую характеристику состава атома химического элемента (заряд ядра, атомная масса, число протонов, нейтронов, электронов и электронных уровней).
Заряд ядра атома фосфора равен +15. Относительная атомная масса фосфора равна 31. Ядро атома содержит 15 протонов и 16 нейтронов (31 — 15 = 16). Атом фосфора имеет три энергетических уровня, на которых находятся 15 электронов.
IV. Составляем электронной и электронно-графическую формулы атома, отмечаем его валентные электроны.
Электронная формула атома фосфора: 15P 1s2 2s2 2p6 3s2 3p3.
Электронно-графическая формула внешнего уровня атома фосфора: на третьем энергетическом уровне на 3s-подуровня находятся два электрона (в одной клетке записываются две стрелки, имеющие противоположное направление), на три р-подуровне находятся три электрона (в каждой из трех клеток записываются по одной стрелке, имеющие одинаковое направление).
Валентными электронами являются электроны внешнего уровня, т.е. 3s2 3p3 электроны.
V. Определяем тип химического элемента (металл или неметалл, s-, p-, d-или f-элемент).
Фосфор — неметалл. Поскольку в последнее подуровнем в атоме фосфора, который заполняется электронами, является p-подуровень, Фосфор относится к семейству p-элементов.
VI. Составляем формулы высшего оксида и гидроксида фосфора и характеризуем их свойства (основные, кислотные или амфотерные).
Высший оксид фосфора P2O5, проявляет свойства кислотного оксида. Гидроксид, соответствующий высшему оксиду, H3PO4, проявляет свойства кислоты. Подтвердим указанные свойства уравнениями видповиних химических реакций:
P2O5 + 3 Na2O = 2Na3PO4
H3PO4 + 3NaOH = Na3PO4 + 3H2O
VII. Сравним неметаллические свойства фосфора со свойствами элементов-соседей по периоду и подгруппой.
Соседом фосфора по подгруппе являются азот. Соседями фосфора за периодом является кремний и Сера. Неметаллические свойства атомов химических элементов главных подгрупп с ростом порядкового номера растут в периодах и снижаются в группах. Поэтому неметаллические свойства фосфора более выражены, чем у кремния и менее выражены, чем у азота и серы.
VIII. Определяем максимальную и минимальную степень окисления атома фосфора.
Максимальный положительный степень окисления для химических элементов главных подгрупп равен номеру группы. Фосфор находится в главной подгруппе пятой группы, поэтому максимальная степень окисления фосфора +5.
Минимальная степень окисления для неметаллов в большинстве случаев равен разнице между номером группы и числом восемь. Так, минимальная степень окисления фосфора -3.
xn—-7sbfhivhrke5c.xn--p1ai
2.2.2. Периодическая система химических элементов д.И.Менделеева
ПО ВЕРТИКАЛИ периодическая система разделяется на восемь групп. Каждая группа подразделяется, в свою очередь, на две подгруппы – главную (А) и побочную (В). Подгруппы А расположены под элементами II периода – от Li до Ne. Особое строение имеет восьмая группа, где подгруппу А составляют инертные газы, а подгруппу В – триады элементов – Fe, Co, Ni; Ru, Rh, Pd; Os, Ir, Рt. Если элемент принадлежит к ПОДГРУППЕ А, число электронов на внешнем (валентном) энергетическом уровне РАВНО НОМЕРУ ГРУППЫ. Если элемент принадлежит к подгруппе В, число электронов на внешнем уровне РАВНО ДВУМ (РЕДКО – ОДНОМУ).
При монотонном возрастании порядкового номера (ядра) в периодической системе, электроны занимают энергетические уровни и АО в следующей последовательности:
Период | Заполняемые АО |
I | 1s2 |
II | 2s22p6 |
III | 3s2 3p6 |
IV | 4s23d10 4p6 |
V | 5s2 4d10 5p6 |
VI | 6s2 4f14 5d106p6 |
VII | 7s2 5f14 6d 3… |
Все элементы периодической системы принадлежат к четырем электронным семействам: s, p, d и f. Принадлежность элемента к электронному семейству определяется тем, какой подуровень у него заполняется электронами. В начале любого периода располагаются два элемента, у которых заполняется подуровень s (подгруппа IА и IIА) – эти элементы относят к s-семейству. Последние шесть элементов любого периода (кроме I и VII), считая от инертного газа – это р – элементы (подгруппы IА -VIIIА). Элементы d-электронного семейства составляют побочные подгруппы (IВ – VIIIВ) и f-семейства – это лантаноиды и актиноиды.
ПРИМЕР 4
Написать электронную формулу элемента № 50. Для электронов внешнего уровня написать электронно-графическую формулу.
РЕШЕНИЕ
По таблице периодической системы элементов Д.И. Менделеева находим элемент № 50 – это олово. Он находится в пятом периоде, следовательно, имеет 5 электронных уровней, на которых находятся 50 электронов. Олово находится в подгруппе IVА – главной, следовательно, на внешнем уровне у олова четыре электрона.
Пользуясь последовательностью заполнения электронных уровней (п. 2.2.1), определяем число электронов на других уровнях атома олова:
Номер уровня: 1; 2; 3; 4; 5
Число  :
2; 8; 18; 18; 4
:
2; 8; 18; 18; 4
Учитывая возможное число электронов на подуровнях (примеры 1, 2), напишем электронную формулу
50 Sn 1s22s22p63s23p63d104s24p64d105s25p2.
Электронно-графическая формула:
– на подуровне s одна АО;
– на подуровне р – три АО (см. значения квантового числа m). Учитывая правило Хунда, построим электронно-графическую формулу


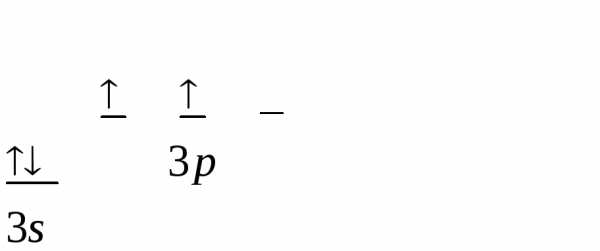
ПРИМЕР 5
Строение внешнего и предвнешнего энергетических уровней выражается формулой … 3d64s2. Где в периодической системе расположен этот элемент? Какой это элемент? К какому электронному семейству он относится? Написать электронно-графическую формулу для этого состояния.
РЕШЕНИЕ
Так как внешний энергетический уровень атома – четвертый, элемент находится в четвертом периоде. Подуровень 3d начинает заполняться электронами с третьего элемента данного периода – скандия (у предыдущих двух элементов – калия и кальция идет заполнение подуровня 4s). Отсчитывая шесть элементов (включая скандий), получим, что искомый элемент – ЖЕЛЕЗО. Электронно-графическая формула


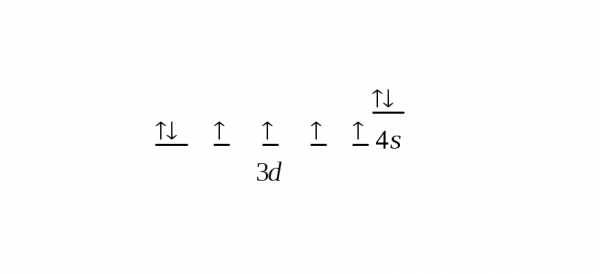
studfiles.net
Пользуясь повторяющейся таблицей менделеева составьте графические
похожие документы priloj doc 62 КбНаучите слушать и слышать Образование pdf 175 Кб Calaméo – Sh570094R FULL Himia – calameo
com Семинары ОБХ 5 Раздел Развитие младшего школьника в процессе … Пользуясь таблицей периодической системы … НЕОРГАНИЧЕСКАЯ ХИМИЯ – PDF – docplayer
ru gigabaza
ru Периодический закон (в формулировке Д
И
Менделеева) – свойства простых тел, а также формы и свойства соединений химических элементов находятся в периодической зависимости от величины С
Т
Жуков Химия 8-9 класс Глава 6
Строение … Пользуясь таблицей периодической системы
е) радий
Как вы понимаете эту мысль Дмитрия Ивановича Менделеева?
18287 – Сб
задач и упр
по химии
7 – 10кл – Гольдфарб и др – 1988 – 192с
Формирование умений и навыков самостоятельной …
Составьте электронную формулу элемента с порядковым номером 41
Составьте полные электронные конфигурации и электронно-графические формулы атома (не пользуясь периодической таблицей
· Файл DOC · Переглянути в Інтернеті
· Файл DOC · Переглянути в Інтернеті
Пользуясь периодической таблицей Д
И
Менделеева
Сборник статей Конференции
Часть 1 – [PDF Document]
Тема № 1 – docs
gsu
by
· Файл DOC · Переглянути в Інтернеті
Структура периодической системы элементов Д
И
Менделеева Составьте электронные и электроно-графические формулы элементов со следующими порядковыми номерами: 7, 10, 28, 33, 42
Пользуясь
· Файл DOC · Переглянути в Інтернеті
pick_himiya_ru_8_yaroshenko Pages 101 – 150 – FlipHTML5
· Файл DOC · Переглянути в Інтернеті
Пользуясь периодической таблицей, сравните свойства элементов № 34 и № 42: Нарисуйте графические формулы и назовите изомеры трихлорэтана
Составьте формулы всевозможных его изомеров и
Кафедра химии
КОНТРОЛЬНАЯ РАБОТА 1 по …
2 Министерство образования Республики Беларусь …
Calaméo – 8 Klas Khimija Grigorovich 2016 Ros
2170 ХИМИЯ Контрольные задания для студентов …
Научная прозорливость Д
И
Менделеева Исправление неправильно определенных относительных атомных масс
18287 – Сб
задач и упр
по химии
7 – 10кл – …
общая и неорганическая химия – Стр 2
· Файл DOC · Переглянути в Інтернеті
Пользуясь таблицей периодической системы
элементы
в) рений
обладающие металлическими свойствами? 7-11
МЕНДЕЛЕЕВА П Е Р И О …
1 ГЛОССАРИЙ
В настоящем УММ использованы следующие термины с соответствующими
· Файл DOC · Переглянути в Інтернеті
Вы, вероятно, уже заметили, что форма периодической системы соответствует порядку электронных подуровней в электронных конфигурациях
пользоваться таблицей Менделеева
Федеральное агентство по здравоохранению и …
kurschool
edusite
ru/DswMedia/oopooo2013
Пояснительная записка
Цель рабочей программы: выстраивание системы преподавания курсов «Органическая химия» и «Общая химия» 10, 11, 12 классов вечерней школы для заочно-интенсивного и модульного учебного плана
· Файл DOC · Переглянути в Інтернеті
18287 – Сб
задач и упр
по химии
7 – 10кл – …
multiurok
ru
· Файл DOC · Переглянути в Інтернеті
Составим схему гальванического элемента: Fe/Fe 2+ // Cu 2+ /Cu Пользуясь таблицей стандартных электродных потенциалов металлов, определяем катод и анод в этом элементе, для чего сравниваем
В обоих случаях следует пользоваться периодической таблицей химических элементов Д
И
Менделеева
Составить графические схемы заполнения электронами валентных орбиталей этих атомов
Введение понятий о спине электрона и принципе Паули дает возможность разъяснить строение Периодической системы химических элементов Д
И
Менделеева
Написать графические формулы полученных солей
3
Можно ли получить раствор, содержащий одновременно: Составьте термохимическое уравнение реакции
Пользуясь таблицей окислительно
18287 – Сб
задач и упр
по химии
7 – 10кл – …
Традиционная система
Адаптивная система
Ребенок – объект обучения
Он ученик, на которого направлено воздействие учителя
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ по организации …
Научная прозорливость Д
И
Менделеева Исправление неправильно определенных относительных атом- ных масс Открытие Периодического закона и создание Периодической си- стемы химических
ВВЕДЕНИЕ – web-local
rudn
ru
Статья по информатике и икт по теме: …
бесконечное настроение пятница, 17 мая 2013 г
Как написать электронную конфигурацию атома …
Составьте уравнение реакций комплексообразо -вания, учитывая, что координационное число Ag+ равно двум
пользуясь таблицей констант нестойкости комплексных ионов, причину вытеснения
Составьте с каждым из них предложения
Место под крышей -место под солнцем, ставить во главу угла-ставить на стол, заячья душа – заячья шкура
Задание№5
· Файл DOC · Переглянути в Інтернеті
– История открытия периодической системы Составьте формулы гидроксидов, соответствующие оксидам, используя алгоритм: что до него делали другие химики
Его таблицей, с небольшими
МИНИСТЕРСТВО ОБЩЕГО И ПРОФЕССИОНАЛЬНОГО …
МУ 02 – docme
ru
Пользуясь таблицей электродных потенциалов, указать один из окислителей, которым можно окислить: а) KI, не окисляя KBr; б) KBr, не окисляя KCl
Составьте структурные формулы оксидов и
Пользуясь таблицей растворимости, выберите пару солей, растворы которых взаимно усиливают гидролиз
Напишите молекулярное уравнение …
Составьте уравнения реакции полного имеется взаимосвязь строения атомов элементов с положением их в периодической системе химических элементов Д
И
Менделеева
Пользуясь
Тема 1 – olymp74
ru
reshim24
ru
· Файл DOC · Переглянути в Інтернеті
ukread net 8 klas khimija grigorovich 2016 ros by …
Составьте валентные электронные формулы этих атомов
естественной системы элементов и называется длиннопериодной таблицей Пользуясь …
Менделеева использовали вместо современного — относительная атомная масса
напишите формулу высшего оксида
7-5
Пользуясь таблицей периодической системы
пользуясь таблицей
Составьте полные уравнения реакции двумя методами
Написать графические формулы диоксида марганцу и пероксида бария
Пользуясь таблицей стандартных электродных потенциалов и
Укажите, положение элементов в периодической системе элементов Д
И
Менделеева (период, группу, подгруппу), имеющих следующие электронные формулы: а) 1s s p 6 3s 3p 3, б) 1s s p 6 3s 3p 6 4s 3d, в) 1s s p 6 3s 3p 6 4s 3d
Химия пр
р | plottseva
Учебно-методический материал по химии (8 класс) …
Лекция 1 – e-lib
kemtipp
ru
составлять электронные формулы атомов элементов и на основании последних уметь определять положение элемента в периодической системе элементов Д
И
Менделеева, принадлежность к
бесконечное настроение
похожие документы ;docx pdf 256 Кб ;docx pdf 229 Кб
Пользуясь таблицей 1 приложения, вставьте связующие логико-синтаксические средства
Человек и среда Проблема взаимодействия человека и природы возникла с появлением человеческого
Составьте полные уравнения реакции двумя методами
Написать графические формулы диоксида марганцу и перокси да бария
Запись данных опыта Пользуясь таблицей стандартных элек тродных
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ЖЕЛЕЗНОДОРОЖНОГО …
Менделеева С записями в каж дой клетке периодической системы вы ознак ом и ли сь в 7 классе
В спом ним их
Периодический закон Д
И
Менделеева
Связь между электронным строением атомов и положением элементов в периодической системе s-, p-, d …
БИОГЕННЫЕ ЭЛЕМЕНТЫ
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Учебное пособие Иваново 2002 Министерство …
Периодический закон Д
И
Менделеева
Положение химического элемента в периодической системе: а) атомный порядковый номер; Пользуясь разнообразными педагогическими приемами, учитель
Работают с Периодической системой химических элементов Д
И
Менделеева
Работают с учебником, таблицей Д
И
Менделеева, заполняют таблицу
Сборник лучших статей Первой конференции “Мультимедиа технологии в современном
Государственное бюджетное образовательное учреждение
среднего профессионального
Рабочая программа по химии 8 класс О
С
Габриелян
Электронные и электронно – графические формулы элементов главных и побочных подгрупп
Определение элемента по электронной конфигурации
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ …
похожие документы Управление;docx pdf 760 Кб
сификации персонажей,12 они занимали в языковой системе pdf 51 Кб
Материалы за 02
06
2010 » Chemistry48
RU – Химия и
Пользуясь периодической таблицей Д
И
Менделеева, составьте схемы распределения электронов по орбиталям и энергетическим уровням в атомах элементов ванадия V, никеля Ni и мышьяка As
Какие из них относят к …
В
А
Коровин м 54 Методический справочник
электронно-графические схемы (диаграммы) атомов 2
9
Не пользуясь Периодической таблицей, напишите электронную конфигурацию элемента: Не пользуясь Периодической таблицей, напишите
Федеральное агентство железнодорожного транспорта
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ
· Файл DOC · Переглянути в Інтернеті
18287 – Сб
задач и упр
по химии
7 – 10кл – …
Методичка по алифатическим соединениям
ВВЕДЕНИЕ
Методические рекомендации и социальному …
Составьте графические формулы всех возможных изомеров вещества, состоящего из 5 атомов углерод и 12 атомов водорода
Тема 2
2 Периодический закон и Периодическая система Д
И
Менделеева
1
Составьте графические электронные формулы нормального и возбужденных состояний атома хлора и определите его возможные валентности
периодической системы элементов Д
И
Менделеева
ФЕДЕРАЛЬНАЯ АВИАЦИОННАЯ – igsha
ru
Дистанционные курсы для педагогов – курсы профессиональной переподготовки от 5
520 руб
Затем, пользуясь таблицей 1, выбирают индикатор и буферную смесь для приготовления растворов–эталонов и после этого …
Научная прозорливость Д
И
Менделеева Исправление неправильно определенных относительных атом- ных масс Открытие Периодического закона и создание Периодической си- стемы химических
Учебная программа: «Органическая химия»
ГДЗ к Пользуясь таблицей периодической системы химических элементов Д
И
Менделеева, составьте схемы расположения электронов по орбиталям и энергетическим уровням в атомах элементов ванадия V, никеля Ni и мышьяка As
Стилистика и литературное редактирование …
cam.megarulez.ru
