Атом – это… Что такое Атом?
 Атом гелия
Атом гелияА́том (от др.-греч. ἄτομος — неделимый) — наименьшая, химически неделимая часть химического элемента, являющаяся носителем его свойств.[1] Атом состоит из атомного ядра и электронов. Ядро атома состоит из положительно заряженных протонов и незаряженных нейтронов, связанных между собой при помощи сильного взаимодействия. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. Атомы классифицируются по количеству протонов и нейтронов в ядре: количество протонов определяет принадлежность атома некоторому химическому элементу, а число нейтронов — изотопу этого элемента.
Атомы различного вида в разных количествах, связанные межатомными связями, образуют молекулы.
История становления понятия
Понятие об атоме как о наименьшей неделимой части материи было впервые сформулировано древнеиндийскими и древнегреческими философами (см.: атомизм). В XVII и XVIII веках химикам удалось экспериментально подтвердить эту идею, показав, что некоторые вещества не могут быть подвергнуты дальнейшему расщеплению на составляющие элементы с помощью химических методов. Однако в конце XIX — начале XX века физиками были открыты субатомные частицы и составная структура атома, и стало ясно, что атом в действительности не является неделимым.
На международном съезде химиков в Карлсруэ (Германия) в 1860 году были приняты определения понятий молекулы и атома. Атом — наименьшая частица химического элемента, входящая в состав простых и сложных веществ.
Модели атомов
- Кусочки материи
- Модель атома Томсона (модель «Пудинг с изюмом»). Дж. Дж. Томсон предложил рассматривать атом как некоторое положительно заряженное тело с заключёнными внутри него электронами. Была окончательно опровергнута Резерфордом после проведённого им знаменитого опыта по рассеиванию альфа-частиц.
- Ранняя планетарная модель атома Нагаоки
- Планетарная модель атома Бора-Резерфорда. В 1911 году[3] Эрнест Резерфорд, проделав ряд экспериментов, пришёл к выводу, что атом представляет собой подобие планетной системы, в которой электроны движутся по орбитам вокруг расположенного в центре атома тяжёлого положительно заряженного ядра («модель атома Резерфорда»). Однако такое описание атома вошло в противоречие с классической электродинамикой. Дело в том, что, согласно классической электродинамике, электрон при движении с центростремительным ускорением должен излучать электромагнитные волны, а, следовательно, терять энергию. Расчёты показывали, что время, за которое электрон в таком атоме упадёт на ядро, совершенно ничтожно. Для объяснения стабильности атомов Нильсу Бору пришлось ввести постулаты, которые сводились к тому, что электрон в атоме, находясь в некоторых специальных энергетических состояниях, не излучает энергию («модель атома Бора-Резерфорда»). Постулаты Бора показали, что для описания атома классическая механика неприменима. Дальнейшее изучение излучения атома привело к созданию квантовой механики, которая позволила объяснить подавляющее большинство наблюдаемых фактов.
Квантово-механическая модель атома
Современная модель атома является развитием планетарной модели. Согласно этой модели, ядро атома состоит из положительно заряженных протонов и не имеющих заряда нейтронов и окружено отрицательно заряженными электронами. Однако представления квантовой механики не позволяют считать, что электроны движутся вокруг ядра по сколько-нибудь определённым траекториям (неопределённость координаты электрона в атоме может быть сравнима с размерами самого атома).
Химические свойства атомов определяются конфигурацией электронной оболочки и описываются квантовой механикой. Положение атома в таблице Менделеева определяется электрическим зарядом его ядра (то есть количеством протонов), в то время как количество нейтронов принципиально не влияет на химические свойства; при этом нейтронов в ядре, как правило, больше, чем протонов (см.: атомное ядро). Если атом находится в нейтральном состоянии, то количество электронов в нём равно количеству протонов. Основная масса атома сосредоточена в ядре, а массовая доля электронов в общей массе атома незначительна (несколько сотых процента массы ядра).
Массу атома принято измерять в атомных единицах массы, равных 1⁄12 от массы атома стабильного изотопа углерода 12C.
Строение атома
Субатомные частицы
Хотя слово атом в первоначальном значении обозначало частицу, которая не делится на меньшие части, согласно научным представлениям он состоит из более мелких частиц, называемых субатомными частицами. Атом состоит из электронов, протонов, все атомы, кроме водорода-1, содержат также нейтроны.
Электрон является самой лёгкой из составляющих атом частиц с массой 9,11·10−31кг, отрицательным зарядом и размером, слишком малым для измерения современными методами.[4] Протоны обладают положительным зарядом и в 1836 раз тяжелее электрона (1,6726·10−27 кг). Нейтроны не обладают электрическим зарядом и в 1839 раз тяжелее электрона (1,6929·10−27 кг).[5]
При этом масса ядра меньше суммы масс составляющих его протонов и нейтронов из-за эффекта дефекта массы. Нейтроны и протоны имеют сравнимый размер, около 2,5·10
В стандартной модели элементарных частиц как протоны, так и нейтроны состоят из элементарных частиц, называемых кварками. Наряду с лептонами, кварки являются одной из основных составляющих материи. И первые и вторые являются фермионами. Существует шесть типов кварков, каждый из которых имеет дробный электрический заряд, равный +2⁄3 или −1⁄3 элементарного. Протоны состоят из двух u-кварков и одного d-кварка, а нейтрон — из одного u-кварка и двух d-кварков. Это различие объясняет разницу в массах и зарядах протона и нейтрона. Кварки связаны между собой сильными ядерными взаимодействиями, которые передаются глюонами.
Электроны в атоме
При описании электронов в атоме в рамках квантовой механики, обычно рассматривают распределение вероятности в 3n-мерном пространстве для системы n электронов.
Электроны в атоме притягиваются к ядру, между электронами также действует кулоновское взаимодействие. Эти же силы удерживают электроны внутри потенциального барьера, окружающего ядро. Для того, чтобы электрон смог преодолеть притяжение ядра, ему необходимо получить энергию от внешнего источника. Чем ближе электрон находится к ядру, тем больше энергии для этого необходимо.
Электронам, как и другим частицам, свойственен корпускулярно-волновой дуализм. Иногда говорят, что электрон движется по орбитали, что неверно. Состояние электронов описывается волновой функцией, квадрат модуля которой характеризует плотность вероятности нахождения частиц в данной точке пространства в данный момент времени, или, в общем случае, оператором плотности. Существует дискретный набор атомных орбиталей, которым соответствуют стационарные чистые состояния электронов в атоме.
Каждой орбитали соответствует свой уровень энергии. Электрон может перейти на уровень с большей энергией, поглотив фотон. При этом он окажется в новом квантовом состоянии с большей энергией. Аналогично, он может перейти на уровень с меньшей энергией, излучив фотон. Энергия фотона при этом будет равна разности энергий электрона на этих уровнях (см.: постулаты Бора).
Свойства атома
По определению, любые два атома с одним и тем же числом протонов в их ядрах относятся к одному химическому элементу. Атомы с одним и тем же количеством протонов, но разным количеством нейтронов называют изотопами данного элемента. Например, атомы водорода всегда содержат один протон, но существуют изотопы без нейтронов (водород-1, иногда также называемый протием — наиболее распространённая форма), с одним нейтроном (дейтерий) и двумя нейтронами (тритий).[9] Известные элементы составляют непрерывный натуральный ряд по числу протонов в ядре, начиная с атома водорода с одним протоном и заканчивая атомом унуноктия, в ядре которого 118 протонов.
Масса
Поскольку наибольший вклад в массу атома вносят протоны и нейтроны, суммарное число этих частиц называют массовым числом. Массу покоя атома часто выражают в атомных единицах массы (а. е. м.), которая также называется дальтоном (Да). Эта единица определяется как 1⁄12 часть массы покоя нейтрального атома углерода-12, которая приблизительно равна 1,66·10−24 г.[13]Водород-1 — наилегчайший изотоп водорода и атом с наименьшей массой, имеет атомный вес около 1,007825 а. е. м.
Так как массы даже самых тяжёлых атомов в обычных единицах (например, в граммах) очень малы, то в химии для измерения этих масс используют моли. В одном моле любого вещества по определению содержится одно и то же число атомов (примерно 6,022·1023). Это число (число Авогадро) выбрано таким образом, что если масса элемента равна 1 а. е. м., то моль атомов этого элемента будет иметь массу 1 г. Например, углерод имеет массу 12 а. е. м., поэтому 1 моль углерода весит 12 г.[13]
Размер
Атомы не имеют отчётливо выраженной внешней границы, поэтому их размеры определяются по расстоянию между ядрами соседних атомов, которые образовали химическую связь (Ковалентный радиус) или по расстоянию до самой дальней из стабильных орбит электронов в электронной оболочке этого атома (Радиус атома). Радиус зависит от положения атома в периодической системе, вида химической связи, числа ближайших атомов (координационного числа) и квантово-механического свойства, известного как спин.[17] В периодической системе элементов размер атома увеличивается при движении сверху вниз по столбцу и уменьшается при движении по строке слева направо.[18] Соответственно, самый маленький атом — это атом гелия, имеющий радиус 32 пм, а самый большой — атом цезия (225 пм).[19] Эти размеры в тысячи раз меньше длины волны видимого света (400—700 нм), поэтому атомы нельзя увидеть в оптический микроскоп. Однако отдельные атомы можно наблюдать с помощью сканирующего туннельного микроскопа.
Малость атомов демонстрируют следующие примеры. Человеческий волос по толщине в миллион раз больше атома углерода.[20] Одна капля воды содержит 2 секстиллиона (2·1021) атомов кислорода, и в два раза больше атомов водорода.[21] Один карат алмаза с массой 0,2 г состоит из 10 секстиллионов атомов углерода.[22] Если бы яблоко можно было увеличить до размеров Земли, то атомы достигли бы исходных размеров яблока.[23]
Учёные из Харьковского физико-технического института представили первые в истории науки снимки атома. Для получения снимков учёные использовали электронный микроскоп, фиксирующий излучения и поля (field-emission electron microscope, FEEM). Физики последовательно разместили десятки атомов углерода в вакуумной камере и пропустили через них электрический разряд в 425 вольт. Излучение последнего атома в цепочке на фосфорный экран позволило получить изображение облака электронов вокруг ядра.[24]
Радиоактивный распад
 Диаграмма времени полураспада (T½) в секундах для различных изотопов с Z протонами и N нейтронами.
Диаграмма времени полураспада (T½) в секундах для различных изотопов с Z протонами и N нейтронами.У каждого химического элемента есть один или более изотопов с нестабильными ядрами, которые подвержены радиоактивному распаду, в результате чего атомы испускают частицы или электромагнитное излучение. Радиоактивность возникает, когда радиус ядра больше радиуса действия сильных взаимодействий (расстояний порядка 1 фм[25]).
Существуют три основные формы радиоактивного распада[26][27]:
- Альфа-распад происходит, когда ядро испускает альфа-частицу — ядро атома гелия, состоящее из двух протонов и двух нейтронов. В результате испускания этой частицы возникает элемент с меньшим на два атомным номером.
- Бета-распад происходит из-за слабых взаимодействий, и в результате нейтрон превращается в протон или наоборот. В первом случае происходит испускание электрона и антинейтрино, во втором — испускание позитрона и нейтрино. Электрон и позитрон называют бета-частицами. Бета-распад увеличивает или уменьшает атомный номер на единицу.
- Гамма-излучение происходит из-за перехода ядра в состояние с более низкой энергией с испусканием электромагнитного излучения. Гамма-излучение может происходить вслед за испусканием альфа- или бета-частицы после радиоактивного распада.
Каждый радиоактивный изотоп характеризуется периодом полураспада, то есть временем, за которое распадается половина ядер образца. Это экспоненциальный распад, который вдвое уменьшает количество оставшихся ядер за каждый период полураспада. Например, по прошествии двух периодов полураспада в образце останется только 25 % ядер исходного изотопа.[25]
Магнитный момент
Элементарные частицы обладают внутренним квантовомеханическим свойством известным как спин. Оно аналогично угловому моменту объекта вращающегося вокруг собственного центра масс, хотя строго говоря, эти частицы являются точечными и нельзя говорить об их вращении. Спин измеряют в единицах приведённой планковской постоянной (), тогда электроны, протоны и нейтроны имеют спин равный ½ . В атоме электроны обращаются вокруг ядра и обладают орбитальным угловым моментом помимо спина, в то время как ядро само по себе имеет угловой момент благодаря ядерному спину.[28]
Магнитное поле, создаваемое магнитным моментом атома, определяется этими различными формами углового момента, как и в классической физике вращающиеся заряженные объекты создают магнитное поле. Однако, наиболее значительный вклад происходит от спина. Благодаря свойству электрона, как и всех фермионов, подчиняться правилу запрета Паули, по которому два электрона не могут находиться в одном и том же квантовом состоянии, связанные электроны спариваются друг с другом, и один из электронов находится в состоянии со спином вверх, а другой — с противоположной проекцией спина — состояние со спином вниз. Таким образом магнитные моменты электронов сокращаются, уменьшая полный магнитный дипольный момент системы до нуля в некоторых атомах с чётным числом электронов.[29]
В ферромагнитных элементах, таких как железо, нечётное число электронов приводит к появлению неспаренного электрона и к ненулевому полному магнитному моменту. Орбитали соседних атомов перекрываются, и наименьшее энергетическое состояние достигается, когда все спины неспаренных электронов принимают одну ориентацию, процесс известный как обменное взаимодействие. Когда магнитные моменты ферромагнитных атомов выравниваются, материал может создавать измеримое макроскопическое магнитное поле. Парамагнитные материалы состоят из атомов, магнитные моменты которых разориентированы в отсутствии магнитного поля, но магнитные моменты отдельных атомов выравниваются при приложении магнитного поля.[29][30]
Ядро атома тоже может обладать ненулевым полным спином. Обычно при термодинамическом равновесии спины ядер ориентированы случайным образом. Однако, для некоторых элементов (таких как ксенон-129) возможно поляризовать значительную часть ядерных спинов для создания состояния с сонаправленными спинами —состояния называемого гиперполяризацией. Это состояние имеет важное прикладное значение в магнитно-резонансной томографии.[31][32]
Энергетические уровни
Когда электрон находится в связанном состоянии в атоме, он обладает потенциальной энергией, которая обратно пропорциональна его расстоянию от ядра. Эта энергия обычно измеряется в электронвольтах (эВ) и равна энергии, которую надо передать электрону, чтобы сделать его свободным (оторвать от атома). Согласно квантовомеханической модели атома связанный электрон может занимать только дискретный набор разрешённых энергетических уровней — состояний с определённой энергией. Наинизшее из разрешённых энергетических состояний называется основным, а все остальные — возбуждёнными.[33]
Для перехода электрона с одного энергетического уровня на другой нужно передать ему или отнять у него энергию. Это происходит путём соответственно поглощения или испускания фотона, причём энергия этого фотона равна абсолютной величине разности энергий начального и конечного уровней электрона. Энергия испущенного фотона пропорциональна его частоте, поэтому переходы между разными энергетическими уровнями проявляются в различных областях электромагнитного спектра.[34] Каждый элемент имеет уникальный спектр испускания, который зависит от заряда ядра, заполнения электронных подоболочек, взаимодействия электронов, а также других факторов.[35]
Пример линейного спектра поглощенияКогда излучение с непрерывным спектром проходит через вещество (например, газ или плазму), некоторые фотоны поглощаются атомами или ионами, вызывая электронные переходы между энергетическим состояниями, разность энергий которых равна энергии поглощённого фотона. Затем эти возбуждённые электроны спонтанно переходят на уровень, лежащий ниже по энергии, снова испуская фотоны. Таким образом, вещество ведёт себя как фильтр, превращая исходный непрерывный спектр в спектр поглощения, в котором имеются серии тёмных полос. При наблюдении с тех углов, куда не направлено исходное излучение, можно заметить излучение с эмиссионным спектром, испускаемое атомами. Спектроскопические измерения энергии, амплитуды и ширины спектральных линий излучения позволяют определить вид излучающего вещества и физические условия в нём.[36]
Более детальный анализ спектральных линий показал, что некоторые из них обладают тонкой структурой, то есть расщеплены на несколько близких линий. В узком смысле «тонкой структурой» спектральных линий принято называть их расщепление, происходящее из-за спин-орбитального взаимодействия между спином и вращательным движением электрона.[37]
Взаимодействие магнитных моментов электрона и ядра приводит к сверхтонкому расщеплению спектральных линий, которое, как правило, меньше, чем тонкое.
Если поместить атом во внешнее магнитное поле, то также можно заметить расщепление спектральных линий на две, три и более компонент — это явление называется эффектом Зеемана. Он вызван взаимодействием внешнего магнитного поля с магнитным моментом атома, при этом в зависимости от взаимной ориентации момента атома и магнитного поля энергия данного уровня может увеличиться или уменьшиться. При переходе атома из одного расщеплённого состояния в другое будет излучаться фотон с частотой, отличной от частоты фотона при таком же переходе в отсутствие магнитного поля. Если спектральная линия при помещении атома в магнитное поле расщепляется на три линии, то такой эффект Зеемана называется нормальным (простым). Гораздо чаще в слабом магнитном поле наблюдается аномальный (сложный) эффект Зеемана, когда происходит расщепление на 2, 4 или более линий (аномальный эффект происходит из-за наличия спина у электронов). При увеличении магнитного поля вид расщепления упрощается, и аномальный эффект Зеемана переходит в нормальный (эффект Пашена — Бака).[38] Присутствие электрического поля также может вызвать сравнимый по величине сдвиг спектральных линий, вызванный изменением энергетических уровней. Это явление известно как эффект Штарка.[39]
Если электрон находится в возбуждённом состоянии, то взаимодействие с фотоном определённой энергии может вызвать вынужденное излучение дополнительного фотона с такой же энергией — для этого должен существовать более низкий уровень, на который возможен переход, и разность энергий уровней должна равняться энергии фотона. При вынужденном излучении эти два фотона будут двигаться в одном направлении и иметь одинаковую фазу. Это свойство используется в лазерах, которые могут испускать когерентный пучок света в узком диапазоне частот.[40]
Валентность
Внешняя электронная оболочка атома, если она не полностью заполнена, называется валентной оболочкой, а электроны этой оболочки называются валентными электронами. Число валентных электронов определяет то, как атом связывается с другими атомами посредством химической связи. Путём образования химических связей атомы стремятся заполнить свои внешние валентные оболочки.[41]
Чтобы показать повторяющиеся химические свойства химических элементов, их упорядочивают в виде периодической таблицы. Элементы с одинаковым числом валентных электронов формируют группу, которая изображается в таблице в виде столбца (движение по горизонтальному ряду соответствуют заполнению валентной оболочки электронами). Элементы, находящиеся в самом правом столбце таблицы, имеют полностью заполненную электронами внешнюю оболочку, поэтому они отличаются крайне низкой химической активностью и называются инертными или благородными газами.[42][43]
Дисперсионное притяжение
Важным свойством атома является его склонность к дисперсионному притяжению. Происхождение дисперсионных сил было объяснено в 1930 году Ф. Лондоном. Межатомное взаимодействие возникает вследствие флуктуаций заряда в двух атомах, находящихся близко друг от друга. Поскольку электроны движутся, каждый атом обладает мгновенным дипольным моментом, отличным от нуля. Если бы флуктуации электронной плотности в двух атомах были бы несогласованными, то не было бы результирующего притяжения между атомами. Однако мгновенный диполь на одном атоме наводит противоположно направленный диполь в соседнем атоме. Эти диполи притягиваются друг к другу за счёт возникновения силы притяжения, которая называется дисперсионной силой, или силой Лондона. Энергия такого взаимодействия прямо пропорциональна квадрату электронной поляризуемости атома α и обратно пропорциональна r6, где r — расстояние между двумя атомами.[44]
См. также
Примечания
- ↑ Атом — статья из Большой советской энциклопедии
- ↑ Демокрит // Школьная энциклопедия «Руссика». История Древнего мира / А. О. Чубарьян. — М.: Olma Media Group, 2003. — С. 281—282. — 815 с. — ISBN 5-948-49307-5
- ↑ http://www.ido.rudn.ru/nfpk/fizika/mkt/1.html Планетарная модель атома]
- ↑ Demtröder, 2002
- ↑ Woan, 2000
- ↑ MacGregor, 1992
- ↑ The Particle Adventure. Particle Data Group. Lawrence Berkeley Laboratory (2002). Архивировано из первоисточника 21 августа 2011. Проверено 3 января 2009.
- ↑ James Schombert. Elementary Particles. University of Oregon (18 апреля 2006). Архивировано из первоисточника 21 августа 2011. Проверено 3 января 2007.
- ↑ Howard S. Matis. The Isotopes of Hydrogen. Guide to the Nuclear Wall Chart. Lawrence Berkeley National Lab (9 августа 2000). Архивировано из первоисточника 21 августа 2011. Проверено 21 декабря 2007.
- ↑ Rick Weiss. Scientists Announce Creation of Atomic Element, the Heaviest Yet. Washington Post (17 октября 2006). Архивировано из первоисточника 21 августа 2011. Проверено 21 декабря 2007.
- ↑ 1 2 Sills, 2003
- ↑ Belle Dumé. Bismuth breaks half-life record for alpha decay. Physics World (23 апреля 2003). Архивировано из первоисточника 21 августа 2011. Проверено 21 декабря 2007.
- ↑ 1 2 Mills и др. (1993).
- ↑ Chung Chieh. Nuclide Stability. University of Waterloo (22 января 2001). Проверено 4 января 2007.
- ↑ Atomic Weights and Isotopic Compositions for All Elements. National Institute of Standards and Technology. Архивировано из первоисточника 21 августа 2011. Проверено 4 января 2007.
- ↑ G. Audi, A. H. Wapstra, C. Thibault. (2003). «The Ame2003 atomic mass evaluation (II)». Nuclear Physics A729: 337–676. Проверено 2008-02-07.
- ↑ R. D. Shannon. (1976). «Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides». Acta Crystallographica, Section A 32: 751. DOI:10.1107/S0567739476001551. Проверено 2007-01-03.
- ↑ Judy Dong. Diameter of an Atom. The Physics Factbook (1998). Архивировано из первоисточника 21 августа 2011. Проверено 19 ноября 2007.
- ↑ Zumdahl, 2002
- ↑ Small Miracles: Harnessing nanotechnology. Oregon State University (2007).(недоступная ссылка — история) Проверено 7 января 2007.(недоступная ссылка — история) — описывает толщину человеческого волоса как 105 нм и 10 углеродных атомов по толщине как 1 нм.
- ↑ «There are 2 000 000 000 000 000 000 000 (that’s 2 sextillion) atoms of oxygen in one drop of water—and twice as many atoms of hydrogen» // Padilla et al., 2002, p. 32
- ↑ Карат равен 200 миллиграмм. По определению, углерод-12 имеет 12 грамм на моль. Постоянная Авогадро равна 6,02·1023 атомов на моль.
- ↑ Feynman, 1995
- ↑ First Detailed Photos of Atoms. Inside Science News Service (14 сентября 2009).(недоступная ссылка — история) Проверено 16 сентября 2009.(недоступная ссылка — история)
- ↑ 1 2 Radioactivity. Splung.com. Архивировано из первоисточника 21 августа 2011. Проверено 19 декабря 2007.
- ↑ L’Annunziata (2003).
- ↑ Richard B. Firestone. Radioactive Decay Modes. Berkeley Laboratory (22 мая 2000). Архивировано из первоисточника 21 августа 2011. Проверено 7 января 2007.
- ↑ J. P. Hornak. Chapter 3: Spin Physics. The Basics of NMR. Rochester Institute of Technology (2006).(недоступная ссылка — история) Проверено 20 марта 2011.(недоступная ссылка — история)
- ↑ 1 2 Paul A. Schroeder. Magnetic Properties. University of Georgia (22 февраля 2000).(недоступная ссылка — история) Проверено 7 января 2007.(недоступная ссылка — история)
- ↑ Greg Goebel. [4.3] Magnetic Properties of the Atom. Elementary Quantum Physics. In The Public Domain website (1 сентября 2007). Архивировано из первоисточника 21 августа 2011. Проверено 7 января 2007.
- ↑ Lynn Yarris. (весна 1997). «Talking Pictures». Berkeley Lab Research Review. Проверено 2008-01-09.(недоступная ссылка — история)
- ↑ Liang, Haacke, 1999
- ↑ Bart J. Van Zeghbroeck. Energy levels. Shippensburg University (1998). Проверено 23 декабря 2007.
- ↑ Fowles, 1989
- ↑ W. C. Martin, W. L. Wiese. Atomic Spectroscopy: A Compendium of Basic Ideas, Notation, Data, and Formulas. National Institute of Standards and Technology (май 2007). Архивировано из первоисточника 21 августа 2011. Проверено 8 января 2007.
- ↑ Atomic Emission Spectra — Origin of Spectral Lines. Avogadro Web Site. Архивировано из первоисточника 21 августа 2011. Проверено 10 августа 2006.
- ↑ Richard Fitzpatrick. Fine structure. University of Texas at Austin (16 февраля 2007). Архивировано из первоисточника 21 августа 2011. Проверено 14 февраля 2008.
- ↑ Michael Weiss. The Zeeman Effect. University of California-Riverside (2001). Архивировано из первоисточника 21 августа 2011. Проверено 6 февраля 2008.
- ↑ Beyer, 2003
- ↑ Thayer Watkins. Coherence in Stimulated Emission. San José State University. Архивировано из первоисточника 21 августа 2011. Проверено 23 декабря 2007.
- ↑ William Reusch. Virtual Textbook of Organic Chemistry. Michigan State University (16 июля 2007). Архивировано из первоисточника 21 августа 2011. Проверено 11 января 2008.
- ↑ Husted Robert и др. Periodic Table of the Elements. Los Alamos National Laboratory (11 декабря 2003). Архивировано из первоисточника 21 августа 2011. Проверено 11 января 2008.
- ↑ Rudy Baum. It’s Elemental: The Periodic Table. Chemical & Engineering News (2003). Архивировано из первоисточника 21 августа 2011. Проверено 11 января 2008.
- ↑ Даниэльс Ф., Олберти Р. Физическая химия / под ред. К.В.Топчиевой. — М.: Мир, 1978. — С. 453. — 646 с.
Литература
- На английском языке
- Michael F. L’Annunziata. Handbook of Radioactivity Analysis. — 2003. — ISBN 0-12-436603-1
- H. F. Beyer, V. P. Shevelko. Introduction to the Physics of Highly Charged Ions. — CRC Press, 2003. — ISBN 0-75-030481-2
- Gregory R. Choppin, Jan-Olov Liljenzin, Jan Rydberg. Radiochemistry and Nuclear Chemistry. — Elsevier, 2001. — ISBN 0-75-067463-6
- J. Dalton. A New System of Chemical Philosophy, Part 1. — London and Manchester: S. Russell, 1808.
- Wolfgang Demtröder. Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics. — 1st ed. — Springer, 2002. — ISBN 3-540-20631-0
- Richard Feynman. Six Easy Pieces. — The Penguin Group, 1995. — ISBN 978-0-140-27666-4
- Grant R. Fowles. Introduction to Modern Optics. — Courier Dover Publications, 1989. — ISBN 0-48-665957-7
- Mrinalkanti Gangopadhyaya. Indian Atomism: History and Sources. — Atlantic Highlands, New Jersey: Humanities Press, 1981. — ISBN 0-391-02177-X
- David L. Goodstein. States of Matter. — Courier Dover Publications, 2002. — ISBN 0-48-649506-X
- Edward Robert Harrison. Masks of the Universe: Changing Ideas on the Nature of the Cosmos. — Cambridge University Press, 2003. — ISBN 0-52-177351-2
- Tatjana Jevremovic. Nuclear Principles in Engineering. — Springer, 2005. — ISBN 0-38-723284-2
- James Lequeux. The Interstellar Medium. — Springer, 2005. — ISBN 3-540-21326-0
- Z.-P. Liang, E. M. Haacke. Encyclopedia of Electrical and Electronics Engineering: Magnetic Resonance Imaging / J. G. Webster. — John Wiley & Sons, 1999. — Т. 2. — P. 412—26. — ISBN 0-47-113946-7
- Malcolm H. MacGregor. The Enigmatic Electron. — Oxford University Press, 1992. — ISBN 0-19-521833-7
- Oliver Manuel. Origin of Elements in the Solar System: Implications of Post-1957 Observations. — Springer, 2001. — ISBN 0-30-646562-0
- Robert M. Mazo. Brownian Motion: Fluctuations, Dynamics, and Applications. — Oxford University Press, 2002. — ISBN 0-19-851567-7
- Ian Mills, Tomislav Cvitaš, Klaus Homann, Nikola Kallay, Kozo Kuchitsu. Quantities, Units and Symbols in Physical Chemistry. — 2nd ed. — Oxford: International Union of Pure and Applied Chemistry, Commission on Physiochemical Symbols Terminology and Units, Blackwell Scientific Publications, 1993. — ISBN 0-632-03583-8
- Richard Myers. The Basics of Chemistry. — Greenwood Press, 2003. — ISBN 0-31-331664-3
- Michael J. Padilla, Ioannis Miaoulis, Martha Cyr. Prentice Hall Science Explorer: Chemical Building Blocks. — Upper Saddle River, New Jersey USA: Prentice-Hall, 2002. — ISBN 0-13-054091-9
- Linus Pauling. The Nature of the Chemical Bond. — Cornell University Press, 1960. — ISBN 0-80-140333-2
- Jeremy I. Pfeffer, Shlomo Nir. Modern Physics: An Introductory Text. — Imperial College Press, 2000. — ISBN 1-860-94250-4
- Leonid Ivanovich Ponomarev. The Quantum Dice. — CRC Press, 1993. — ISBN 0-75-030251-8
- J. Kenneth Shultis, Richard E. Faw. Fundamentals of Nuclear Science and Engineering. — CRC Press, 2002. — ISBN 0-82-470834-2
- Robert Siegfried. From Elements to Atoms: A History of Chemical Composition. — DIANE, 2002. — ISBN 0-87-169924-9
- Alan D. Sills. Earth Science the Easy Way. — Barron’s Educational Series, 2003. — ISBN 0-76-412146-4
- Boris M. Smirnov. Physics of Atoms and Ions. — Springer, 2003. — ISBN 0-38-795550-X
- Dick Teresi. Lost Discoveries: The Ancient Roots of Modern Science. — Simon & Schuster, 2003. — P. 213—214. — ISBN 0-74-324379-X
- Graham Woan. The Cambridge Handbook of Physics. — Cambridge University Press, 2000. — ISBN 0-52-157507-9
- Charles Adolphe Wurtz. The Atomic Theory. — New York: D. Appleton and company, 1881.
- Marco Zaider, Harald H. Rossi. Radiation Science for Physicians and Public Health Workers. — Springer, 2001. — ISBN 0-30-646403-9
- Steven S. Zumdahl. Introductory Chemistry: A Foundation. — 5th ed. — Houghton Mifflin, 2002. — ISBN 0-618-34342-3
Ссылки
dic.academic.ru
Атом. Понятие и структура
Вещества состоят из атомов. Атом — частица вещества очень малых размеров и массы. Это самая маленькая часть химического элемента, которая является носителем его свойств.
Слово «атом» происходит от греческого атород — «неделимый», и таковой эта частица считалась долгие века. Однако уже в начале XX в. стала известна структура атома.

Упрощенная модель атома. Красным цветом обозначены положительно заряженные протоны, серым — нейтральные нейтроны, голубым — отрицательно заряженные электроны.
Атом состоит из атомного ядра и электронной оболочки. Сто лет назад считалось, что электроны вращаются вокруг ядра, как планеты вокруг Солнца. Так часто изображают атом для упрощения. На самом деле невозможно определить точку, где в данный момент находится электрон. Электрон заряжен отрицательно, а ядро — положительно. Само ядро также состоит из элементарных частиц — протонов и нейтронов. Протоны имеют положительный заряд, а нейтроны электрически нейтральны. Обычно атом нейтрален. Это справедливо, когда число протонов в ядре такое же, как число электронов. Если у атома на внешней орбите имеется один или несколько дополнительных электронов, он превращается в отрицательно заряженный ион (анион). Если у атома на внешней орбите недостает одного или нескольких электронов, он превращается в положительно заряженный ион (катион). Таких ионов очень много в различных растворах.
Более 99% массы атома сосредоточено в ядре. На долю электронов приходится очень незначительная часть. Массу атома измеряют в атомных единицах массы, равных 1/12 массы атома стабильного изотопа углерода 12С.
Имеются атомы с одинаковым числом протонов, но с разным числом нейтронов.
Такие атомы называются изотопами (разновидностями) одного и того же элемента. Существует единственный из стабильных атомов, у которого в ядре вообще нет нейтронов, а имеется только один протон. Вокруг ядра вращается (точнее, создает оболочку) один электрон. Это легкий водород, или протий. Существует также тяжелый водород — дейтерий. У него в ядре имеются две частицы — протон и нейтрон. Есть еще и сверхтяжелый водород — тритий. У него в ядре имеются три частицы — один протон и два нейтрона. А электрон у всех этих изотопов один. Вода, образованная дейтерием, называется тяжелой водой.
Атомы образуют межатомные связи и формируют молекулы. Молекулы могут состоять как из одного вида атомов, так и из нескольких.

Атом водорода Н, состоящий из одного протона и одного электрона
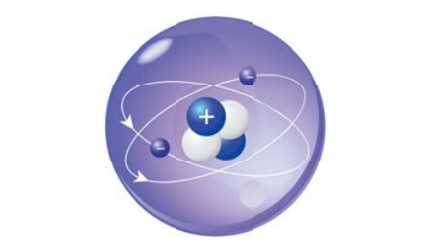
Атом гелия: его ядро состоит из двух протонов и двух нейтронов и окружено двумя электронами
Есть ли у атомов крючки?
Понятие об атоме как самой маленькой неделимой частице материи ввели более 2000 лет назад философы Древней Индии и Древней Греции. Греческий философ Демокрит говорил: «Нет ничего, кроме атомов, вечно движущихся в бесконечной пустоте». Он считал, что свойства вещества определяются формой, массой и другими свойствами атома. По Демокриту, огонь обжигает потому, что атомы огня острые, твердые тела такие потому, что их атомы шероховаты и намертво сцеплены друг с другом. Философ Эпикур писал, что этого не может быть, ведь крючки у атомов обломались бы. Но до открытия истинной структуры атома было еще далеко.

Демокрит (около 460-370 гг. до н.э.) — древнегреческий философ, один из основателей атомизма
Поделиться ссылкой
sitekid.ru
Понятие атом. Строение атома и атомного ядра

Как уже отмечалось,атом состоит из трех видов элементарныхчастиц: протонов, нейтронов и электронов.Атомное ядро – центральная часть атома,состоящая из протонов и нейтронов.Протоны и нейтроны имеют общее названиенуклон, в ядре они могут превращатьсядруг в друга. Ядро простейшего атома –атома водорода – состоит из однойэлементарной частицы – протона.
Диаметрядра атома равен примерно 10-13– 10-12см и составляет 0,0001 диаметра атома.Однако, практически вся масса атома (99,95 – 99,98 %) сосредоточена в ядре.
Еслибы удалось получить 1 см3чистого ядерного вещества, масса егосоставила бы 100 – 200 млн. т. Масса ядраатома в несколько тысяч раз превосходитмассу всех входящих в состав атомаэлектронов.
Протон– элементарная частица, ядро атомаводорода. Масса протона равна 1,6721х10-27кг, она в 1836 раз больше массы электрона.Электрический заряд положителен и равен1,66х10-19Кл. Кулон – единица электрическогозаряда, равная количеству электричества,проходящему через поперечное сечениепроводника за время 1с при неизменнойсиле тока 1А (ампер).

Каждый атом любогоэлемента содержит в ядре определенноечисло протонов. Это число постоянноедля данного элемента и определяет егофизические и химические свойства.
Тоесть, от количества протонов зависит,с каким химическим элементом мы имеемдело. Например, если в ядре один протон– это водород, если 26 протонов – этожелезо. Число протонов в атомном ядреопределяет заряд ядра (зарядовое числоZ) и порядковый номер элемента впериодической системе элементов Д.И.Менделеева (атомный номер элемента).
Нейтрон– электрическинейтральная частица с массой 1,6749х10-27кг,в 1839 раз больше массы электрона. Нейронв свободном состоянии – нестабильнаячастица, он самостоятельно превращаетсяв протон с испусканием электрона иантинейтрино. Период полураспаданейтронов (время, в течение которогораспадается половина первоначальногоколичества нейтронов) равен примерно12 мин.

Однако в связанном состояниивнутри стабильных атомных ядер онстабилен. Общее число нуклонов (протонови нейтронов) в ядре называют массовымчислом (атомной массой – А). Числонейтронов, входящих в состав ядра, равноразности между массовым и зарядовымчислами: N = A – Z.
Электрон– элементарнаячастица, носитель наименьшей массы –0,91095х10-27ги наименьшего электрического заряда –1,6021х10-19 Кл.Это отрицательно заряженная частица.Число электронов в атоме равно числупротонов в ядре, т.е. атом электрическинейтрален.
Позитрон– элементарная частица с положительнымэлектрическим зарядом, античастица поотношению к электрону. Масса электронаи позитрона равны, а электрическиезаряды равны по абсолютной величине,но противоположны по знаку.

Различныетипы ядер называют нуклидами. Нуклид –вид атомов с данными числами протонови нейтронов.
В природе существуют атомыодного и того же элемента с разнойатомной массой (массовым числом): 1735Cl, 1737Clи т. д. Ядра этих атомов содержат одинаковоечисло протонов, но различное числонейтронов.
Разновидности атомов одногои того же элемента, имеющие одинаковыйзаряд ядер, но различное массовое число,называются изотопами.Обладая одинаковым количеством протонов,но различаясь числом нейтронов, изотопыимеют одинаковое строение электронныхоболочек, т. е. очень близкие химическиесвойства и занимают одно и то же местов периодической системе химическихэлементов.

Изотопыобозначают символом соответствующегохимического элемента с расположеннымсверху слева индексом А – массовымчислом, иногда слева внизу приводитсятакже число протонов (Z). Например,радиоактивные изотопы фосфора обозначают32Р,33Рили 1532Ри 1533Рсоответственно. При обозначении изотопабез указания символа элемента массовоечисло приводится после обозначенияэлемента, например, фосфор – 32, фосфор– 33.
Большинствохимических элементов имеет по несколькоизотопов. Кроме изотопа водорода1Н-протия,известен тяжелый водород 2Н-дейтерийи сверхтяжелый водород 3Н-тритий.У урана 11 изотопов, в природных соединенияхих три (уран 238, уран 235, уран 233). У них по92 протона и соответственно 146,143 и 141нейтрон.
В настоящее времяизвестно более 1900 изотопов 108 химическихэлементов. Из них к естественным относятсявсе стабильные (их примерно 280) иестественные изотопы, входящие в составрадиоактивных семейств (их 46). Остальныеотносятся к искусственным, они полученыискусственным путем в результатеразличных ядерных реакций.

Термин«изотопы» следует применять только втех случаях, когда речь идет об атомаходного и того же элемента, например,изотопы углерода12С и 14С.Если подразумеваются атомы разныххимических элементов, рекомендуетсяиспользовать термин «нуклиды», например,радионуклиды 90Sr,131J, 137Cs.
Атом – это мельчайшая частица химического вещества, которая способна сохранять его свойства. Слово «атом» происходит от древнегреческого «atomos», что означает «неделимый». В зависимости о того, сколько и каких частиц находится в атоме, можно определить химический элемент.
Кратко о строении атома
Как можно вкратце перечислить основные сведения о строении атома? Атомявляется частицей с одним ядром, которое заряжено положительно.

Вокруг этого ядра расположено отрицательно заряженное облако из электронов. Каждый атом в своем обычном состоянии является нейтральным. Размер этой частицы полностью может быть определен размером электронного облака, которое окружает ядро.
Само ядро, в свою очередь, тоже состоит из более мелких частиц – протонов и нейтронов. Протоны являются положительно заряженными.
Нейтроны не несут в себе никакого заряда. Однако протоны вместе с нейтронами объединяются в одну категорию и носят название нуклонов. Если необходимы основные сведения о строении атома кратко, то эта информация может быть ограничена перечисленными данными.
Первые сведения об атоме
О том же, что материя может состоять из мелких частиц, подозревали еще древние греки. Они полагали, что все существующее и состоит из атомов. Однако такое воззрение носило чисто философский характер и не может быть трактовано научно.
Первым основные сведения о строении атома получил английский ученый Джон Дальтон.Именно этот исследователь сумел обнаружить, что два химических элемента могут вступать в различные соотношения, и при этом каждая такая комбинация будет представлять собой новое вещество. Например, восемь частей элемента кислорода порождают собой углекислый газ. Четыре части кислорода – угарный газ.
В 1803 году Дальтон открыл так называемый закон кратных отношений в химии. При помощи косвенных измерений (так как ни один атом тогда не мог быть рассмотрен под тогдашними микроскопами) Дальтон сделал вывод об относительном весе атомов.
Исследования Резерфорда
Почти столетие спустя основные сведения о строении атомов были подтверждены еще одним английским химиком — Эрнестом Резерфордом.Ученый предложил модель электронной оболочки мельчайших частиц.
На тот момент названная Резерфордом «Планетарная модель атома» была одним из важнейших шагов, которые могла сделать химия. Основные сведения о строении атома свидетельствовали о том, что он похож на Солнечную систему: вокруг ядра по строго определенным орбитам вращаются частицы-электроны, подобно тому, как это делают планеты.
Электронная оболочка атомов и формулы атомов химических элементов
Электронная оболочка каждого из атомов содержит ровно столько электронов, сколько находится в его ядре протонов. Именно поэтому атом является нейтральным. В 1913 году еще один ученый получил основные сведения о строении атома.

Формула Нильса Бора была похожа на ту, что получил Резерфорд. Согласно его концепции, электроны также вращаются вокруг ядра, расположенного в центре. Бор доработал теорию Резерфорда, внес стройность в ее факты.
Уже тогда были составлены формулы некоторых химических веществ. Например, схематически строение атома азота обозначается как 1s22s22p3, строение атома натрия выражается формулой 1s22s22p63s1. Через эти формулы можно увидеть, какое количество электронов движется по каждой из орбиталей того или иного химического вещества.
Модель Шредингера
Однако затем и эта атомная модель устарела. Основные сведения о строении атома, известные науке сегодня, во многом стали доступны благодаря исследованиям австрийского физика Э. Шредингера.

Он предложил новую модель его строения – волновую. К этому времени ученые уже доказали, что электрон наделен не только природой частицы, но обладает свойствами волны.
Однако у модели Шредингера и Резерфорда имеются и общие положения. Их теории сходны в том, что электроны существуют на определенных уровнях.
Такие уровни также называются электронными слоями.

При помощи номера уровня может быть охарактеризована энергия электрона. Чем выше слой, тем большей энергией он обладает. Все уровни считаются снизу вверх, таким образом, номер уровня соответствует его энергии.
Каждый из слоев в электронной оболочке атома имеет свои подуровни. При этом у первого уровня может быть один подуровень, у второго – два, у третьего – три и так далее (см. приведенные выше электронные формулы азота и натрия).
Еще более мелкие частицы
На данный момент, конечно, открыты еще более мелкие частицы, нежели электрон, протон и нейтрон. Известно, что протон состоит из кварков. Существуют и еще более мелкие частицы мироздания – например, нейтрино, который по своим размерам в сто раз меньше кварка и в миллиард раз меньше протона.
Нейтрино – это настолько мелкая частица, что она в 10 септиллионов раз меньше, чем, к примеру, тираннозавр. Сам тираннозавр во столько же раз меньших размеров, чем вся обозримая Вселенная.
Основные сведения о строении атома: радиоактивность
Всегда было известно, что ни одна химическая реакция не может превратить один элемент в другой. Но в процессе радиоактивного излучения это происходит самопроизвольно.
Радиоактивностью называют способность ядер атомов превращаться в другие ядра – более устойчивые. Когда люди получили основные сведения о строении атомов, изотопы в определенной мере могли служить воплощением мечтаний средневековых алхимиков.

В процессе распада изотопов испускается радиоактивное излучение. Впервые такое явление было обнаружено Беккерелем.
Главный вид радиоактивного излучения – это альфа-распад. При нем происходит выброс альфа-частицы. Также существует бета-распад, при котором из ядра атома выбрасывается, соответственно, бета-частица.
Природные и искусственные изотопы
В настоящее время известно порядка 40 природных изотопов. Их большая часть расположена в трех категориях: урана-радия, тория и актиния.

Все эти изотопы можно встретить в природе – в горных породах, почве, воздухе. Но помимо них, известно также порядка тысячи искусственно выведенных изотопов, которые получают в ядерных реакторах. Многие их таких изотопов используются в медицине, особенно в диагностике.
Пропорции внутри атома
Если представить себе атом, размеры которого будут сопоставимы с размерами международного спортивного стадиона, тогда можно визуально получить следующие пропорции.
Электроны атома на таком «стадионе» будут располагаться на самом верху трибун. Каждый из них будет иметь размеры меньше, чем булавочная головка. Тогда ядро будет расположено в центре этого поля, а его размер будет не больше, чем размер горошины.

Иногда люди задают вопрос, как в действительности выглядит атом. На самом деле он в буквальном смысле слова не выглядит никак – не по той причине, что в науке используются недостаточно хорошие микроскопы. Размеры атома находятся в тех областях, где понятие «видимости» просто не существует.
Атомы обладают очень малыми размерами. Но насколько малы в действительности эти размеры? Факт состоит в том, что самая маленькая, едва различимая человеческим глазом крупица соли содержит в себе порядка одного квинтиллиона атомов.
Если же представить себе атом такого размера, который мог бы уместиться в человеческую руку, то тогда рядом с ним находились бы вирусы 300-метровой длины. Бактерии имели бы длину 3 км, а толщина человеческого волоса стала бы равна 150 км.

В лежачем положении он смог бы выходить за границы земной атмосферы. А если бы такие пропорции были действительны, то человеческий волос в длину смог бы достигать Луны. Вот такой он непростой и интересный атом, изучением которого ученые продолжают заниматься и по сей день.
Атом является наименьшей частицей элемента, сохраняющей его характеристики.Строение атомного ядра.Атомы различных элементов отличаются друг от друга. Поскольку существует свыше 100 различных элементов, то существует и свыше 100 различных видов атомов.Рис 1-2. Части атома.Каждый атом имеет ядро, расположенное в центре атома.
Оно содержит положительно заряженные частицы – протоны и незаряженные частицы – нейтроны.Электроны, отрицательно заряженные частицы, вращаются вокруг ядер (см. Рис. 1-2).Количество протонов в ядре атома называется атомным номером элемента.Рис.

1-3. Электроны, расположенные на оболочках вокруг ядра.Атомные номера позволяют отличить один элемент от другого. Каждый элемент имеет атомный вес.
Атомный вес — это масса атома, которая определяется общим числом протонов и нейтронов в ядре. Электроны практически не дают вклада в общую массу атома, масса электрона составляет только 1/1845 часть массы протона и ею можно пренебречь.Электроны вращаются по концентрическим орбитам вокруг ядра. Каждая орбита называется оболочкой.
Эти оболочки заполняются в следующей последовательности: сначала заполняется оболочка К, затем L, М, N и т. д. (см.
Рис. 1-3). Максимальное количество электронов, которое может разместиться на каждой оболочке, показано на Рис.
1-4.Внешняя оболочка называется валентной, и количество электронов, содержащееся в ней, называется валентностью. Чем дальше от ядра валентная оболочка, тем меньшее притяжение со стороны ядра испытывает каждый валентный электрон. Таким образом, потенциальная возможность атома присоединять или терять электроны увеличивается, если валентная оболочка не заполнена и расположена достаточно далеко от ядра.Рис.
1-4 и 1-5. Состав атома.Электроны валентной оболочки могут получать энергию. Если эти электроны получат достаточно энергии от внешних сил, они могут покинуть атом и стать свободными электронами, произвольно перемещающимися от атома к атому.

Материалы, содержащие большое количество свободных электронов, называются проводниками.Рис. 1-6. Валентность меди.На Рис.
1-5 сравниваются проводимости различных металлов, используемых в качестве проводников. В таблице серебро, медь и золото имеют валентность, равную единице (см. Рис.
1-6). Однако серебро является лучшим проводником, поскольку его валентные электроны слабее связаны.Изоляторы, в противоположность проводникам, препятствуют протеканию электричества. Изоляторы стабильны благодаря тому, что валентные электроны одних атомов присоединяются к другим атомам, заполняя их валентные оболочки, препятствуя, таким образом, образованию свободных электронов.Рис.

1-7. Диэлектрические свойства различных материалов, используемых в качестве изоляторов.Материалы, классифицируемые как изоляторы, сравниваются на Рис. 1-7.
Слюда является наилучшим изолятором, потому что она имеет наименьшее число свободных электронов на своих валентных оболочках.Промежуточное положение между проводниками и изоляторами занимают полупроводники.Полупроводники не являются ни хорошими проводниками, ни хорошими изоляторами, но они важны, потому что их проводимость можно изменять от проводника до изолятора. Кремний и германий являются полупроводниковыми материалами.Об атоме, который имеет одинаковое число электронов и протонов, говорят, что он электрически нейтрален. Атом, получающий один или более электронов, не является электрически нейтральным.
Он становится отрицательно заряженным и называется отрицательным ионом. Если атом теряет один или более электронов, то он становится положительно заряженным и называется положительным ионом. Процесс присоединения или потери электронов называется ионизацией.Ионизация играет большую роль в протекании электрического тока.Поделитесь полезной статьей:

Первая страница статьи Э. Резерфорда в журнале Philosophical Magazine, 6, 21 (1911), в которой впервые водится понятие «атомное ядро».
Открытое 100 лет назад Э.Резерфордом атомное ядро является связанной системой взаимодействующих протонов и нейтронов.
Каждое атомное ядро по-своему уникально.Для описания атомных ядер разработаны различные модели, описывающие отдельные специфические особенности атомных ядер. Изучение свойств атомных ядер открыло новый мир – субатомный квантовый мир, привело к установлению новых законов сохранения и симметрии. Полученные в ядерной физике знания широко используются в естествознании от изучения живых систем до астрофизики.
1. 1911 г. Резерфорд открывает атомное ядро.
В июньском 1911 г. номере журнала «Philosophical Magazine» была опубликована работа Э. Резерфорда «Рассеяние α- и β-частиц веществом и строение атома», в которой впервые было введено понятие «атомное ядро».
Э.Резерфорд проанализировал результаты работы Г. Гейгера и Э.Марсдена по рассеянию α-частиц на тонкой золотой фольге, в которой совершенно неожиданно было обнаружено, что небольшое число α-частиц отклоняется на угол больше 90°. Этот результат противоречил господствовавшей в то время модели атома Дж.
Дж. Томсона, согласно которой атом состоял из отрицательно заряженных электронов и равного количества положительного электричества равномерно распределенного внутри сферы радиуса R ≈ 10-8 см. Для объяснения результатов, полученных Гейгером и Марсденом, Резерфорд разработал модель рассеяния точечного электрического заряда другим точечным зарядом на основе закона Кулона и законов движения Ньютона и получил зависимость вероятности рассеяния α-частиц на угол θ от энергии E налетающей α-частицы
Измеренное Гейгером и Марсденом угловое распределение α-частиц можно было объяснить только в том случае, если предположить, что атом имеет центральный заряд, распределенный в области размером <10-12 см.
Результирующий заряд ядра приблизительно равен Ae/2, где A – вес атома в атомных единицах массы, e – фундаментальная единица заряда. Точность определения величины заряда ядра золота составила ≈ 20%.Так возникла планетарная модель атома, согласно которой атом состоит из массивного положительно заряженного атомного ядра и вращающихся вокруг него электронов. Так как в целом атом электрически нейтрален – положительный заряд ядра компенсировался отрицательным зарядом электронов.
Число электронов в атоме определялось величиной заряда ядра Z.1909–1911 г.Опыты Г. Гейгера и Э. МарсденаВ 1910 г.
к Резерфорду в лабораторию приехал работать молодой ученый по имени Марсден. Он попросил Резерфорда дать ему какую-нибудь очень простую задачу.Резерфорд поручил ему считать α-частицы, проходящие через материю, и найти их рассеяние. При этом Резерфорд заметил, что по его мнению Марсден ничего заметного не обнаружит.
Свои соображения Резерфорд основывал на принятой в то время модели атома Томсона.В соответствии с этой моделью атом представлялся сферой размером 10–8см с равнораспределенным положительным зарядом, в которую были вкраплены электроны. Гармонические колебания последних определяли спектры лучеиспускания. Легко показать, что α-частицы должны были легко проходить через такую сферу, и особенного рассеяния их нельзя было ожидать.Всю энергию на пути своего пробега α-частицы тратили на то, чтобы выбрасывать электроны, которые ионизировали окружающие атомы.
Марсден под руководством Гейгера стал делать свои наблюдения и скоро заметил, что большинство α-частиц проходит через материю, но все же существует заметное рассеяние, а некоторые частицы как бы отскакивают назад. Когда это узнал Резерфорд, он сказал:— Это невозможно.Это так же невозможно, как для пули невозможно отскочить от бумаги. Эта фраза показывает, как конкретно и образно он видел явление.
Марсден и Гейгер опубликовали свою работу, а Резерфорд сразу решил, что существующее представление об атоме неправильно и его надо в корне пересмотреть.Изучая закон распределения отразившихся α-частиц, Резерфорд постарался определить, какое распределение поля внутри атома необходимо, чтобы определить закон рассеивания, при котором α-частицы могут даже возвращаться обратно. Он пришел к выводу, что это возможно тогда, когда весь заряд сосредоточен не по всему объему атома, а в центре. Размер этого центра, названного им ядром, очень мал: 10–12—10–13см в диаметре.
Но куда же тогда поместить электроны?Резерфорд решил, что отрицательно заряженные электроны надо распределить кругом — они могут удерживаться благодаря вращению, центробежная сила которого уравновешивает силу притяжения положительного заряда ядра. Следовательно, модель атома есть не что иное, как некая солнечная система, состоящая из ядра — солнца и электронов — планет. Так он создал свою модель атома.
Эта модель встретила полное недоумение, так как она противоречила некоторым тогдашним, казавшимся незыблемыми, основам физики.П.Л. Капица. «Воспоминания о профессоре Э. Резерфорде»1909–1911 г.Опыты Г.

Гейгера и Э. Марсдена1 – источник α-частиц, 3 – золотая фольга, 5 – микроскоп для наблюдения сцинтилляций, 7 – сцинтиллятор ZnSГ. Гейгер и Э.Марсден увидели, что при прохождении через тонкую фольгу из золота большинство α-частиц, как и ожидалось, пролетает без отклонения, но неожиданно было обнаружено, что часть α-частиц отклоняется на очень большие углы.
Некоторые α-частицы рассеивались даже в обратном направлении. Расчеты напряженности электрического поля атомов в моделях Томсона и Резерфорда показывают существенное различие этих моделей.Напряжённость поля положительного заряда распределенного по поверхности атома в случае модели Томсона ~1013 В/м. В модели Резерфорда положительный заряд, находящийся в центре атома в области R < 10-12см создаёт напряженности поля на 8 порядков больше.
Только такое сильное электрического поле массивного заряженного тела может отклонить α-частицы на большие углы, в то время как в слабом электрическом поле модели Томсона это было невозможно.Э. Резерфорд, 1911 г.«Хорошо известно, что α- и β-частицы при столкновении с атомами вещества испытывают отклонение от прямолинейного пути. Это рассеяние гораздо более заметно у β-частиц нежели у α-частиц, т. к.

они обладают значительно меньшими импульсами и энергиями. Поэтому нет сомнения в том, что столь быстро движущиеся частицы проникают сквозь атомы, встречающиеся на их пути, и что наблюдаемые отклонения обусловлены сильным электрическим полем, действующим внутри атомной системы.Обычно предполагалось, что рассеяние пучка α- или β-лучей при прохождении через тонкую пластинку вещества есть результат многочисленных малых рассеяний при прохождении атомов вещества. Однако наблюдения проведенные Гейгером и Марсденом показали, что некоторое количество α-частиц при однократном столкновении испытывают отклонение на угол больше 90°.
Простой расчет показывает, что в атоме должно существовать сильное электрическое поле, чтобы при однократном столкновении создавалось столь большое отклонение».1911 г.Э. Резерфорд. Атомное ядроα + 197Au → α + 197Au Эрнест Резерфорд(1891-1937)Исходя из планетарной модели атома, Резерфорд вывел формулу описывающую рассеяние α-частиц на тонкой фольге из золота, согласующуюся с результатами Гейгера и Марсдена. Резерфорд предполагал, что α-частицы и атомные ядра с которыми они взаимодействуют можно рассматривать как точечные массы и заряды и что между положительно заряженными ядрами и α-частицами действуют только электростатические силы отталкивания и что ядро настолько тяжелое по сравнению с α-частицей , что оно не смещается в процессе взаимодействия.
Электроны вращаются вокруг атомного ядра на характерных атомных масштабах ~10-8 см и из-за малой массы не влияют на рассеяние α-частиц.Вначале Резерфорд получил зависимость угла рассеяния θ α-частицы с энергией E от величины прицельного параметра b столкновения с точечным массивным ядром. b − прицельный параметр − минимальное расстояние на которое α-частица подошла бы к ядру, если бы между ними не действовали силы отталкивания, θ − угол рассеяния α-частицы, Z1e − электрический заряд α-частицы, Z2e − электрический заряд ядра.Затем Резерфорд рассчитал, какая доля пучка α-частиц с энергией E рассеивается на угол θ в зависимости от заряда ядра Z2e и заряда α-частицы Z1e. Так исходя из классических законов Ньютона и Кулона была получена знаменитая формула рассеяния Резерфорда.

Основным при получении формулы было предположение, что в атоме находится массивный положительно заряженный центр, размеры которого R < 10-12см.Э.Резерфорд, 1911 г.:«Наиболее простым является предположение, что атом имеет центральный заряд, распределенный по очень малому объему, и что большие однократные отклонения обусловлены центральным зарядом в целом, а не его составными частями. В то же время экспериментальные данные недостаточно точны, чтобы можно было отрицать возможности существования небольшой части положительного заряда в виде спутников, находящихся на некотором расстоянии от центра … Следует отметить, что найденное приближенное значение центрального заряда атома золота (100e) примерно совпадает с тем значением, который имел бы атом золота, состоящий из 49 атомов гелия, несущих каждый заряд 2e. Быть может, это лишь совпадение, но оно весьма заманчиво с точки зрения испускания радиоактивным веществом атомов гелия, несущих две единицы заряда».Дж.Дж.
Томсон и Э. РезерфордЭ. Резерфорд, 1921 г.:«Представление о нуклеарном строении атома первоначально возникло из попыток объяснить рассеяние α-частиц на большие углы при прохождении через тонкие слои материи.
Так как α частицы обладают большою массою и большою скоростью, то эти значительные отклонения были в высшей степени замечательны; они указывали на существование весьма интенсивных электрически! или магнитных полей внутри атомов.Чтобы объяснить эти результаты, необходимо было предположить, что атом состоит из заряженного массивного ядра, весьма малых размеров по сравнению с обычно принятой величиной диаметра атома. Это положительно заряженное ядро содержит большую часть массы атома и окружено на некотором расстоянии известным образом распределенными отрицательными электронами; число которых равняется общему положительному заряду ядра. При таких условиях вблизи ядра должно существовать весьма интенсивное электрическое поле и α-частицы, при встрече с отдельным атомом проходя вблизи от ядра, отклоняются на значительные углы.Допуская, что электрические силы изменяются обратно пропорционально квадрату расстояния в области, прилегающей к ядру, автор получил соотношение, связывающее число α-частиц, рассеянных на некоторый угол с зарядом ядра и энергией α-частицы.

Вопрос о том, является ли атомное число элемента действительной мерой его нуклеарного заряда, настолько важен, что для разрешения его должны быть применены все возможные методы. В настоящее время в кавендишевской лаборатории ведется несколько исследований с целью проверки точности этого соотношения.Два наиболее прямых метода основаны на изучения рассеяния быстрых α- и β-лучей. Первый метод применяется Chadwick’oм, пользующимся новыми приемами; последний – Crowthar’oм.
Результаты, полученные до сих пор Chadwick’oм, вполне подтверждают тождество атомного числа с нуклеарным зарядом в пределах возможной точности эксперимента, которая у Chadwick’a составляет около 1%».Несмотря на то, что комбинация двух протонов и двух нейтронов исключительно устойчивое образование, в настоящее время считается, что α-частицы не входит в состав ядра в качестве самостоятельного структурного образования. В случае α-радиоактивных элементов энергия связи α-частицы больше, чем энергия которую необходимо затратить на то, чтобы по отдельности удалить из ядра два протона и два нейтрона, поэтому α-частица может быть испущена из ядра, хотя она не присутствует в ядре как самостоятельное образование.Предположение Резерфорда о том, что атомное ядро может состоять из какого-то количества атомов гелия или о положительно заряженных спутниках ядра, было вполне естественным объяснением открытой им α радиоактивности. Представления о том, что частицы могут рождаться в результате различных взаимодействий, в это время еще не существовало.
Открытие атомного ядра Э.Резерфордом в 1911 г. и последующее изучение ядерных явлений радикально изменило наше представление об окружающем мире. Обогатило науку новыми концепциями, явилось началом исследования субатомной структуры материи.

Источники:
- studfiles.net
- fb.ru
- fazaa.ru
- nuclphys.sinp.msu.ru
blog-potolok.ru
АТОМ это что такое АТОМ: определение — Философия.НЭС
АТОМ
от греч. ?????? – неделимая частица)-мельчайшая частица химич. элемента. А. -сложная система, состоящая из атомного ядра и электронов.
Оцените определение:
Источник: Философская Энциклопедия. В 5-х т.
АТОМ
понятие древнегреческой философии, введенное Левкиппом для обозначения мельчайших, далее уже неделимых единиц бытия, из которых состоят все вещи.
Оцените определение:
Источник: Глоссарий философских терминов проекта Distance
Атом
наименьшая частица обычного вещества. Атом состоит из крошечного ядра (составленного из протонов и нейтронов) и обращающихся вокруг него электронов.
Оцените определение:
Источник: Краткая история времени. Глоссарий
АТОМ
от гр. а — отрицательная частица и temnein — разделять): наименьший элемент тела, являющийся, как показывает само слово, неделимым (по крайней мере так считалось вплоть до начала нашего века).
Оцените определение:
Источник: Философский словарь
ATOM
понятие др.-греч. философии, введенное Леекиппом для обозначения мельчайших, далее уже неделимых единиц бытия, из к-рых состоят все вещи (лат. пер.- Individuum). Согласно Левкиппу и Демокриту, А. не обладают к.-л. качествами, отличаясь друг от друга лишь фигурой, величиной и расположением в пространстве, и находятся в непрерывном движении (уподоблявшемся Демокритом движению пылинок в воздухе).
Понятие А. было заимствовано у Демокрита Эпикуром и его школой, а позднее вошло в арсенал науки нового времени. См. Атомистика.
Оцените определение:
Источник: Советский философский словарь
Атом
гр. неделимый) — мельчайшая частица химического элемента, сохраняющая его свойства. В центре атома находится положительно заряженное ядро, в котором сосредоточена почти вся масса атома; вокруг движутся электроны (см. Электрон), образующие электронные оболочки, размеры которых (10-8 см) определяют размеры атома. Ядро атома состоит из протонов и нейтронов. Число электронов равно числу протонов в ядре (заряд всех электронов атома равен заряду ядра), число протонов равно порядковому номеру элемента в периодической системе. Атомы могут присоединять или отдавать электроны, становясь отрицательно или положительно заряженными ионами. Химические свойства атома определяются в основном числом электронов во внешней оболочке; соединяясь химически, атомы образуют молекулы. Важная характеристика атома — его внутренняя энергия, которая может принимать лишь определенные (дискретные) значения, соответствующие устойчивым состояниям атома, и которая изменяется только скачкообразно, путем квантового перехода (см. Квант). Квантовые переходы обусловливают атомные спектры поглощения и испускания, индивидуальные для атомов всех химических элементов.
Оцените определение:
Источник: Концепции современного естествознания. Словарь основных терминов
АТОМ
(греч. ?????? — неделимый) — мельчайшая частица хим. элемента, сохраняющая его свойства. Понятие «А.» как мельчайшей неделимой частицы вещества (материи) было введено в V в. до н.э. Демокритом. Философы и естествоиспытатели XVI— XVIII вв. использовали это понятие наряду с терминами «корпускула» (лат. corpuscula — маленькое тельце) и «индивид» (лат. individuum — букв. неделимый) примерно в том же смысле. До конца XIX в. в физике и химии господствовало представление о неделимости А., но после открытия Дж.Дж.Томсоном электрона (1897) стало ясно, что А. имеет сложную структуру. В результате опытов Э.Резерфорда (1909—11) была установлена ядерная модель А. Первая квантовая теория А. была разработана Н.Бором (1911—13). По совр. представлениям А. состоит из ядра и электронных оболочек. Ядро состоит из протонов и нейтронов; в нем сосредоточена практически вся масса А. и весь положительный заряд: qя = Ze, где Z — порядковый номер элемента в табл. Менделеева, e = 1,6 · 10-19 Кл — элементарный заряд. Число протонов в ядре Np = Z. Электроны движутся вокруг ядра, образуя электронные оболочки. Число электронов в А. также равно Z. Их отрицательный заряд -Ze нейтрализует положительный заряд ядра, что и приводит к нейтральности А. Число нейтронов в ядре Nн = A–Z, где A — массовое число (целое число, ближайшее к массе А. в табл. Менделеева). Электроны по энергетическим состояниям и оболочкам распределяются в соответствии с принципом Паули. Средний размер А. равен ~10-10 м, его ядра ~10-15 м. Ф.М.Дягилев
Оцените определение:
Источник: История и философия науки. Энциклопедический словарь
АТОМ
от греч. atomos – неделимое) – мельчайшие составные частицы материи, из которых состоит все сущее, в т. ч. и душа, образованная из тончайших атомов (Левкипп, Демокрит, Эпикур). Атомы вечны, они не возникают и не исчезают, пребывая в постоянном движении; различаются по форме и величине, порядку и положению. Бойль и в особенности Дальтон (“Новая система философии химии”, ; 1808) ввели понятие атома в химию, что оказалось для нее весьма плодотворным. В настоящее время атом является предметом исследования со стороны физики (атомная физика). Оказалось, что атом не неделим. Он имеет планетообразную структуру (см. Микрофизика). Ядро атома состоит из протонов и нейтронов; оно окружено электронной оболочкой. Число протонов равно порядковому номеру данного элемента в периодической системе, число нейтронов равно разности между атомным весом и порядковым номером. Диаметр атома равен 10&8 см, диаметр ядра – 10&12 см. В ядре сосредоточена почти вся масса атома. Если мысленно представить себе электронные оболочки отсутствующими, то Земля, при сохранении того же веса, имела бы диаметр, равный 320 м. Атом можно “расщепить”, “выбивая” из ядра с помощью продуктов распада радиоактивных элементов протоны и нейтроны (которые в свою очередь могут быть разложены на мезоны). При этом высвобождается огромное количество энергии, которая применяется в первую очередь для производства электрического тока (для работы электростанций мощностью в 100 000 кет ежедневно требуется 400 г расщепляемого урана вместо 800 т каменного угля), для производства атомных бомб и для судовых силовых установок. См. также Волновая механика.
Оцените определение:
Источник: Философский энциклопедический словарь
terme.ru
Определение атома и молекулы. Определение атома до 1932 года
Начиная от периода античности и до средины 18-го века в науке господствовали представления о том, что атом – это частица материи, которую нельзя разделить. Английский ученый, а также и естествоиспытатель Д. Дальтон дал определение атома как наименьшей составной части химического элемента. М. В. Ломоносов в своем атомно-молекулярном учении смог дать определение атома и молекулы. Он был уверен в том, что молекулы, которые он называл «корпускулами», состоят из «элементов» – атомов – и находятся в постоянном движении.

Д. И. Менделеев считал, что эта субъединица веществ, составляющих материальный мир, сохраняет все свои свойства только в случае, если она не подвергается разделению. В данной статье мы дадим определение атома как объекта микромира и изучим его свойства.
Предпосылки создания теории строения атома
В 19 веке общепризнанным считалось утверждение о неделимости атома. Большинство ученых считали, что частицы одного химического элемента ни при каких условиях не могут превратиться в атомы другого элемента. Эти представления служили основой, на которой базировалось определение атома до 1932 года. В конце 19 столетия в науке были сделаны фундаментальные открытия, которые изменили эту точку зрения. Прежде всего в 1897 году английским физиком Д. Ж. Томсоном был открыт электрон. Этот факт в корне менял представления ученых о неделимости составной части химического элемента.
Как доказать, что атом сложно устроен
Еще до открытия электрона ученые единодушно сходились во мнении о том, что атомы не имеют зарядов. Потом было установлено, что электроны легко выделяются из какого угодно химического элемента. Их можно обнаружить в пламени, они являются переносчиками электрического тока, их выделяют вещества во время рентгеновского излучения.

Но если электроны входят в состав всех без исключения атомов и заряжены отрицательно, значит, в атоме есть еще какие-то частицы, которые обязательно имеют положительный заряд, в противном случае атомы не были бы электронейтральными. Помочь разгадать строение атома помогло такое физическое явление, как радиоактивность. Оно дало правильно определение атома в физике, а затем и в химии.
Невидимые лучи
Французским физиком А. Беккерелем было впервые описано явление испускания атомами некоторых химических элементов, визуально невидимых лучей. Они ионизируют воздух, проходят через вещества, вызывают почернение фотопластинок. Позже супруги Кюри и Э. Резерфорд установили, что радиоактивные вещества превращаются в атомы других химических элементов (например, уран – в нептуний).
Радиоактивное излучение неоднородно по составу: альфа-частицы, бета-частицы, гамма-лучи. Таким образом, явление радиоактивности подтвердило, что частицы элементов таблицы Менделеева имеют сложное строение. Этот факт послужил причиной изменений, внесенных в определение атома. Из каких частиц состоит атом, если учитывать полученные Резерфордом новые научные факты? Ответом на этот вопрос стала предложенная ученым ядерная модель атома, согласно которой вокруг положительно-заряженного ядра вращаются электроны.
Противоречия модели Резерфорда
Теория ученого, несмотря на ее выдающийся характер, не смогла объективно дать определение атома. Её выводы шли вразрез с фундаментальными законами термодинамики, согласно которым все электроны, вращающиеся вокруг ядра, теряют свою энергию и, как бы то ни было, рано или поздно должны упасть на него. Атом в этом случае разрушается. Этого на самом деле не происходит, так как химические элементы и частицы, из которых они состоят, существуют в природе очень долго. Необъяснимо такое определение атома, базирующиеся на теории Резерфорда, равно как и явление, возникающее при пропускании раскаленных простых веществ через дифракционную решетку. Ведь образующиеся при этом атомные спектры имеют линейную форму. Это вступало в противоречие с резерфордовской моделью атома, согласно которой спектры должны были бы быть сплошными. Согласно представлениям квантовой механики, в настоящее время электроны характеризуются в ядре не как точечные объекты, а как имеющие вид электронного облака.

Наибольшая его плотность в определенном локусе пространства вокруг ядра и считается местоположением частицы в данный момент времени. Также было выяснено, что в атоме электроны расположены послойно. Количество слоев можно определить, зная номер периода, в котором находится элемент в периодической системе Д. И. Менделеева. Например, атом фосфора содержит 15 электроном и имеет 3 энергетических уровня. Показатель, определяющий количество энергетических уровней, называют главным квантовым числом.
Экспериментально было установлено, что электроны энергетического уровня, расположенного ближе всех к ядру, имеют наименьшую энергию. Каждая энергетическая оболочка делится на подуровни, а они, в свою очередь, на орбитали. Электроны, расположенные на различных орбиталях, имеют равную форму облака (s, p, d, f).
Исходя из вышесказанного следует, что форма электронного облака не может быть произвольной. Она строго определена согласно орбитального квантового числа. Добавим еще и то, что состояние электрона в макрочастице определяется еще двумя значениями – магнитным и спиновым квантовыми числами. Первое базируется на уравнении Шредингера и характеризует пространственную ориентацию электронного облака исходя из трехмерности нашего мира. Второй показатель – спиновое число, по нему определяют вращение электрона вокруг своей оси по или против часовой стрелки.

Открытие нейтрона
Благодаря работам Д. Чедвика, проведенным им в 1932 году, было дано новое определение атома в химии и физике. В своих опытах ученый доказал, что при расщеплении полония возникает излучение, вызванное частицами, не имеющими заряда, с массой 1,008665. Новая элементарная частица была названа нейтроном. Её открытие и изучение её свойств позволило советским ученым В. Гапону и Д. Иваненко создать новую теорию строения атомного ядра, содержащего протоны и нейтроны.
Согласно новой теории, определение атома вещества имело следующий вид: это структурная единица химического элемента, состоящая из ядра, содержащего протоны и нейтроны и электронов, движущихся вокруг него. Число положительных частиц в ядре всегда равно порядковому номеру химического элемента в периодической системе.
В дальнейшем профессор А. Жданов в своих опытах подтвердил, что под влиянием жесткого космического излучения атомные ядра расщепляются на протоны и нейтроны. Кроме этого, было доказано, что силы, удерживающие эти элементарные частицы в ядре, чрезвычайно энергоемкие. Они действуют на очень коротких расстояниях (порядка 10-23 см) и называются ядерными. Как было сказано ранее, еще М. В. Ломоносов смог дать определение атома и молекулы исходя из известных ему научных фактов.

В настоящее время общепризнанной считают следующую модель: атом состоит из ядра и электронов, движущихся вокруг него по строго определенным траекториям – орбиталям. Электроны одновременно проявляют свойства и частицы, и волны, то есть, имеют дуальную природу. В ядре атома сосредоточена практически вся его масса. Она состоит из протонов и нейтронов, связанных ядерными силами.
Можно ли взвесить атом
Оказывается, каждый атом имеет массу. Например, у гидрогена она равна 1,67х10-24 г. Даже трудно представить насколько мала эта величина. Чтобы найти вес такого объекта, используют не весы, а осциллятор, представляющий собой углеродную нанотрубку. Для расчета веса атома и молекулы более удобной величиной является относительная масса. Она показывает, во сколько раз вес молекулы или атома больше чем 1/12 часть атома карбона, которая составляет 1,66х10-27 кг. Относительные атомные массы указаны в периодической системе химических элементов, и они не имеют размерности.
Ученые хорошо знают, что атомная масса химического элемента – это средняя величина массовых чисел всех его изотопов. Оказывается, в природе единицы одного химического элемента могут иметь различные массы. При этом заряды ядер таких структурных частиц одинаковы.
Учеными установлено, что изотопы различаются между собой количеством нейтронов в ядре, а заряд ядер у них одинаков. Например, у атома хлора, имеющего массу 35 содержится 18 нейтронов и 17 протонов, а с массой 37 – 20 нейтронов и 17 протонов. Многие химические элементы представляют собой смеси изотопов. Например, такие простые вещества, как калий, аргон, кислород содержат в своем составе атомы, представляющие 3 разных изотопа.
Определение атомарности
Оно имеет несколько трактовок. Рассмотрим, что понимают под этим термином в химии. Если атомы какого-либо химического элемента способны хотя бы кратковременно существовать обособленно, не стремясь к образованию более сложной частицы – молекулы, то говорят, что такие вещества имеют атомарное строение. Например, многостадийная реакция хлорирования метана. Она широко применяется в химии органического синтеза для получения важнейших галогеносодержащих производных: дихлорметана, четыреххлористого углерода. В ней происходит расщепление молекул хлора на атомы, обладающие высокой реакционной способностью. Они разрушают сигма-связи в молекуле метана, обеспечивая цепную реакцию замещения.
Еще один пример химического процесса, имеющего большое значение в промышленности – использование пероксида водорода в качестве дезинфицирующего и отбеливающего средства. Определение атомарного кислорода, как продукта расщепления перекиси водорода, происходит как в живых клетках (под действием фермента каталазы), так и в лабораторных условиях. Атомарный кислород качественно определяют по его высоким антиоксидантным свойствам, а также по способности разрушать патогенные агенты: бактерии, грибы и их споры.

Как устроена атомная оболочка
Нами было уже выяснено ранее, что структурная единица химического элемента имеет сложное строение. Вокруг положительно-заряженного ядра вращаются отрицательные частицы электроны. Лауреат Нобелевской премии Нильс Бор, основываясь на квантовой теории света, создал свое учение, в котором характеристика и определение атома имеют следующий вид: электроны двигаются вокруг ядра только по определенным стационарным траекториям, при этом не излучают энергию. Учение Бора доказало, что частицы микромира, к которым относятся атомы и молекулы, не подчиняются законам, справедливым для больших тел – объектов макрокосмоса.
Строение электронных оболочек макрочастиц было изучено в работах по квантовой физике таких ученых, как Хунд, Паули, Клечковский. Так стало известно, что электроны делают вращательные движения вокруг ядра не хаотично, а по определенным стационарным траекториям. Паули установил, что в пределах одного энергетического уровня на каждой из его орбиталей s, p, d, f в электронных ячейках может находиться не более двух отрицательно заряженных частиц с противоположным значением спина + ½ и – ½.
Правило Хунда объяснило, как правильно заполняются электронами орбитали с одинаковым уровнем энергии.
Правило Клечковского, называемое еще правилом n+l, объяснило, как заполняются орбитали многоэлектронных атомов (элементов 5, 6, 7 периодов). Все вышеперечисленные закономерности послужили теоретическим обоснованием системы химических элементов, созданной Дмитрием Менделеевым.
Степень окисления
Она является фундаментальным понятием в химии и характеризует состояние атома в молекуле. Современное определение степени окисления атомов звучит следующим образом: это условный заряд атома в молекуле, который рассчитывают исходя из представлений, что молекула имеет только ионный состав.
Степень окисления может выражаться целым или дробным числом, с положительным, отрицательным или нулевым значениями. Чаще всего атомы химических элементов имеют несколько степеней окисления. Например, у азота это -3, -2, 0, +1, +2, +3, +4, +5. А вот такой химический элемент, как фтор, во всех своих соединениях имеет только одну степень окисления, равную -1. Если он представлен простым веществом, то его степень окисления равна нулю. Этой химической величиной удобно пользоваться для классификации веществ и для описания их свойств. Чаще всего степенью окисления атома пользуются в химии при составлении уравнений окислительно-восстановительных реакций.
Свойства атомов
Благодаря открытиям квантовой физики, современное определение атома, базирующееся на теории Д. Иваненко и Е. Гапона, дополняется следующими научными фактами. Строение ядра атома не изменяется во время химических реакций. Изменению подвергаются только стационарные электронные орбитали. Их строением можно объяснить очень много физических и химических свойств веществ. Если электрон покидает стационарную орбиту и переходит на орбиталь с более высоким показателем энергии, такой атом называется возбужденным.

Нужно отметить, что электроны не могут длительное время находиться на таких несвойственных им орбиталях. Возвращаясь на свою стационарную орбиту, электрон излучает квант энергии. Изучение таких характеристик структурных единиц химических элементов, как сродство к электрону, электроотрицательность, энергия ионизации, позволило ученым не только дать определение атома, как важнейшей частице микромира, но также позволило им объяснить способность атомов образовывать стойкое и энергетически более выгодное молекулярное состояние материи, возможное вследствие создания различных типов устойчивой химической связи : ионной, ковалентно-полярной и неполярной, донорно-акцепторной (как разновидности ковалентной связи) и металлической. Последняя обуславливает важнейшие физические и химические свойства всех металлов.
Экспериментально установлено, что размер атома может изменяться. Всё будет зависеть от того, в какую молекулу он входит. Благодаря рентгеноструктурному анализу можно рассчитать расстояние между атомами в химическом соединении, а также узнать радиус структурной единицы элемента. Владея закономерностями изменения радиусов атомов, входящих в период или в группу химических элементов, можно спрогнозировать их физические и химические свойства. Например, в периодах с увеличением заряда ядра атомов их радиусы уменьшаются («сжатие атома»), поэтому металлические свойства соединений ослабевают, а неметаллические усиливаются.
Таким образом, знания о строении атома позволяют точно определить физические и химические свойства всех элементов, входящих в периодическую систему Менделеева.
fb.ru
атом, молекула, атомная и молекулярная массы, простое и сложное вещество, химический эквивалент. Моль.
Молекула – мельчайшая частица вещества, сохраняющая св-ва данного вещества.
Моль – кол-во вещества в граммах, численно равное атомной или молекулярной массе.
Простое вещество – это вещество, состоящее из атомо одного вида
Сложное вещество – из 2 и более атомов разного вида.
АТОМ (от греч. atomos — неделимый), мельчайшая частица химического элемента, сохраняющая его свойства. В центре атома находится положительно заряженное ядро, в котором сосредоточена почти вся масса атома; вокруг движутся электроны, образующие электронные оболочки, размеры которых (~10-8 см) определяют размеры атома. Ядро атома состоит из протонов и нейтронов. Число электронов в атоме равно числу протонов в ядре (заряд всех электронов атома равен заряду ядра), число протонов равно порядковому номеру элемента в периодической системе. Атомы могут присоединять или отдавать электроны, становясь отрицательно или положительно заряженными ионами. Химические свойства атомов определяются в основном числом электронов во внешней оболочке; соединяясь химически, атомы образуют молекулы. Важная характеристика атома — его внутренняя энергия, которая может принимать лишь определенные (дискретные) значения, соответствующие устойчивым состояниям атома, и изменяется только скачкообразно путем квантового перехода. Поглощая определенную порцию энергии, атом переходит в возбужденное состояние (на более высокий уровень энергии). Из возбужденного состояния атом, испуская фотон, может перейти в состояние с меньшей энергией (на более низкий уровень энергии). Уровень, соответствующий минимальной энергии атома, называется основным, остальные — возбужденными. Квантовые переходы обусловливают атомные спектры поглощения и испускания, индивидуальные для атомов всех химических элементов
Эквивалент – реальная или условная частица, которая
может присоединять, высвобождать или
быть каким-либо другим образом эквивалентна
одному иону водорода в кислотно-основных
реакциях или одному электрону в
окислительно-восстановительных реакциях. Фактор
эквивалентности  ,где
z валентность в простых соединениях и
степень окисления в сложных. Молярная
масса эквивалента – масса одного моля эквивалента вещества. ,
где
,где
z валентность в простых соединениях и
степень окисления в сложных. Молярная
масса эквивалента – масса одного моля эквивалента вещества. ,
где  молярная
масса эквивалента,
молярная
масса эквивалента,  фактор
эквивалентности, М – молярная масса
атома элемента
фактор
эквивалентности, М – молярная масса
атома элемента
2. Основные законы химии.
З-н Авогадро: Равные объемы газов при одинаковых температуре и давлении содержат одинаковое число молекул. Парциальное давление -давление, которое оказывает каждый компонент газовой смеси. PV=n*m/M*RT. З-н парциальных давлений: Давление смеси газов, химически не взаимодействующих друг с другом, равно сумме парциальных давлений газов, составляющих смесь. Понятие эквивалентной массы -Все элементы соединяются между собой в количествах прямопропорциональных их количественной массе(m1/m2=Э1/Э2). З-н эквивалентов: Вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам. З-н сохранения энергии: Энергия системы, включающей вещества, вступившие в реакцию, равна энергии системы, включающей вещества, образовавшиеся в результате реакции. З-н сохранения массы: Масса вещ-в, вступивших в реакцию равна массе вещ-в после реакции. Молярный объем газа -это отношение объема вещ-ва к количеству этого вещ-ва. Vmгаза(н.у.)=22,4 л/моль. 1а.е.м=по углеродной шкале 1/12 часть массы атома углерода изотопа (12).
studfiles.net
Атомы, понятие радиоактивности
Вся материя состоит из атомов. Отдельный атом слишком мал, чтобы его можно было увидеть даже в сильный микроскоп. Однако из объединенных атомов состоят все твердые тела, химические вещества и объекты во Вселенной. Например, в булавочной головке содержится приблизительно миллиард миллиардов атомов.
Атомы, способные легко передвигаться друг относительно друга, образуют жидкости и газы. Атомы, зафиксированные более жестко и не обладающие свободой передвижения, образуют твердые тела. В природе встречаются 92 вида атомов. Еще 17 видов ученые получили в лабораториях искусственно. У каждого вида атомов есть свои индивидуальные свойства. Вещество, состоящее только из одного вида атомов (химических элементов), называется простым.

Самый
простой — атом водорода (1) очень легкого газа, из которого в основном состоит
Солнце. Неон (2) — газ, используемый в рекламных газосветных трубках. В желтках
яиц содержится много серы (3). Кальций (4) необходим, чтобы наши кости были
здоровыми. Серебро (5) —драгоценный металл. В атоме свинца (6) много субатомных
частиц, поэтому свинец очень тяжелый. Его применяют для изготовления грузил и
дроби.
Основная доля объема атома приходится на пустоту. Однако в этой пустоте есть еще более мелкие частички материи, субатомные частицы. Это протоны, нейтроны и электроны. Протоны и нейтроны собраны вместе в центре атома и образуют его ядро. Электроны по размеру гораздо меньше, и они быстро вращаются вокруг ядра.
Элементы различаются числом субатомных частиц. Простейший химический элемент — водород, атом которого состоит лишь из двух частиц, одного протона я одного электрона. В любом атоме число протонов равно числу электронов.
Субатомные частицы, называемые протонами и нейтронами, собраны в ядре. Электроны быстро двигаются вокруг ядра, образуя различные электронные оболочки.
Слово «радиоактивность» придумала французская ученая польского происхождения Мария Кюри (1867—1934). Она исследовала минералы и дала такое название невидимым лучам, которые испускали некоторые образцы. Эти лучи воздействовали на фотобумагу и электрические приборы. Мария выделила те вещества, которые отвечали за повышенную радиоактивность, и открыла два новых элемента, полоний и радий.
Радиоактивность
Атомы в большинстве своем стабильны и не изменяются с течением времени. Однако есть и нестабильные атомы, подверженные распаду. Когда такие атомы распадаются, они выделяют некоторые частицы и излучают энергию. Такое явление называется радиоактивностью. Примерами радиоактивных химических элементов служат уран, плутоний и радий. Выделяя частицы и энергию, они превращаются в более простые атомы. Так, уран превращается в свинец. Это называется радиоактивным распадом. У радиоактивных элементов распад происходит с разной скоростью. Радиоактивность, она же радиация, может быть опасной, она вредит живым организмам. Но при тщательном контроле ее применение приносит много пользы в медицине и научных исследованиях.
Возраст древнеегипетских мумий определяется из измерений очень слабой радиации, которую испускает содержащийся в них углерод. Этот метод называется радиоуглеродным датированием.
www.what-this.ru
