ПСХЭ Википедия
Периодическая таблица химических элементовПериоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от их заряда атомного ядра. Система является графическим выражением периодического закона, открытого русским учёным Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от их атомного веса (в современных терминах, от атомной массы). Всего предложено несколько сотен[1] вариантов изображения периодической системы (аналитические кривые, таблицы, геометрические фигуры и т. п.). В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
История открытия[ | ]
К середине XIX века были открыты 63 химических элемента, и попытки найти закономерности в этом наборе предпринимались неоднократно. В 1829 году Дёберейнер опубликовал найденный им «закон триад»: атомная масса многих элементов близка к среднему арифметическому двух других элементов, близких к исходному по химическим свойствам (стронций, кальций и барий; хлор, бром и иод и др.). Первую попытку расположить элементы в порядке возрастания атомных весов предпринял Александр Эмиль Шанкуртуа (1862), который создал “Теллуров винт”, разместив элементы на винтовой линии и отметил частое циклическое повторение химических свойств по вертикали. Обе указанные модели не привлекли внимания научной общественности.
В 1866 году свой вариант периодической системы предложил химик и музыкант Джон Александр Ньюлендс, модель которого («закон октав») внешне немного напоминала менделеевскую, но была скомпрометирована настойчивыми попытками автора найти в таблице мистическую музыкальную гармонию. В этом же десятилетии появились ещё несколько попыток систематизации химических элементов; ближе всего к окончательному варианту подошёл Юлиус Лотар Мейер (1864). Однако главное отличие было в том, что за основу периодичности была взята валентность, которая не является единственной и постоянной для отдельно взятого элемента, в результате чего такая таблица не может претендовать на полноценное описание физики элементов и не отражала периодического закона.

ru-wiki.ru
Химический элемент – это… Периодическая система химических элементов :: SYL.ru
Химический элемент – это собирательный термин, описывающий совокупность атомов простого вещества, т. е. такого, которое не может быть разделено на какие-либо более простые (по структуре их молекул) составляющие. Представьте себе, что вы получаете кусок чистого железа с просьбой разделить его на гипотетические составляющие с помощью любого устройства или метода, когда-либо изобретенного химиками. Однако вы ничего не сможете сделать, никогда железо не разделится на что-нибудь попроще. Простому веществу – железу – соответствует химический элемент Fe.
Теоретическое определение
Отмеченный выше экспериментальный факт может быть объяснен с помощью такого определения: химический элемент – это абстрактная совокупность атомов (не молекул!) соответствующего простого вещества, т. е. атомов одного и того же вида. Если бы существовал способ смотреть на каждый из отдельных атомов в куске чистого железа, упомянутого выше, то все они были бы однаковыми – атомами железа. В противоположность этому, химическое соединение, например, оксид железа, всегда содержит по меньшей мере два различных вида атомов: атомы железа и атомы кислорода.
Термины, которые следует знать
Атомная масса: масса протонов, нейтронов и электронов, которые составляют атом химического элемента.
Атомный номер: число протонов в ядре атома элемента.
Химический символ: буква или пара латинских букв, представляющих обозначение данного элемента.
Соединение химическое: вещество, которое состоит из двух или более химических элементов, соединенных друг с другом в определенной пропорции.
Металл: элемент, который теряет электроны в химических реакциях с другими элементами.
Металлоид: элемент, который реагирует иногда как металл, а иногда и как неметалл.
Неметалл: элемент, который стремится получить электроны в химических реакциях с другими элементами.
Периодическая система химических элементов: система классификации химических элементов в соответствии с их атомными номерами.
Синтетический элемент: тот, который получен искусственно в лаборатории, и, как правило, не встречается в природе.
Природные и синтетические элементы
Девяносто два химических элемента встречаются в природе на Земле. Остальные были получены искусственно в лабораториях. Синтетический химический элемент – это, как правило, продукт ядерных реакций в ускорителях частиц (устройствах, используемых для увеличения скорости субатомных частиц, таких как электроны и протоны) или ядерных реакторах (устройствах, используемых для управления энергией, выделяющейся при ядерных реакциях). Первым полученным синтетическим элементом с атомным номером 43 стал технеций, обнаруженный в 1937 году итальянскими физиками К. Перрье и Э. Сегре. Кроме технеция и прометия, все синтетические элементы имеют ядра большие, чем у урана. Последний получивший свое название синтетический химический элемент – это ливерморий (116), а перед ним был флеровий (114).
Два десятка распространенных и важных элементов
| Название | Символ | Процент всех атомов * | Свойства химических элементов (при обычных комнатных условиях) | |||
| Во вселенной | В земной коре | В морской воде | В человеческом организме | |||
| Алюминий | Al | – | 6,3 | – | – | Легкий, серебристый металл |
| Кальций | Ca | – | 2,1 | – | 0,02 | Входит в состав природных минералов, ракушек, костей |
| Углерод | С | – | – | – | 10,7 | Базис всех живых организмов |
| Хлор | Cl | – | – | 0,3 | – | Ядовитый газ |
| Медь | Cu | – | – | – | – | Только красный металл |
| Золото | Au | – | – | – | – | Только желтый металл |
| Гелий | He | 7,1 | – | – | – | Очень легкий газ |
| Водород | Н | 92,8 | 2,9 | 66,2 | 60,6 | Самый легкий из всех элементов; газ |
| Йод | I | – | – | – | – | Неметалл; используется в качестве антисептического средства |
| Железо | Fe | – | 2,1 | – | – | Магнитный металл; используется для производства чугуна и стали |
| Свинец | Pb | – | – | – | – | Мягкий, тяжелый металл |
| Магний | Mg | – | 2,0 | – | – | Очень легкий металл |
| Ртуть | Hg | – | – | – | – | Жидкий металл; один из двух жидких элементов |
| Никель | Ni | – | – | – | – | Устойчивый против коррозии металл; используют в монетах |
| Азот | N | – | – | – | 2,4 | Газ, основной компонент воздуха |
| Кислород | О | – | 60,1 | 33,1 | 25,7 | Газ, второй важный компонент воздуха |
| Фосфор | Р | – | – | – | 0,1 | Неметалл; важен для растений |
| Калий | К | – | 1.1 | – | – | Металл; важен для растений; обычно называют “поташ” |
* Если величина не указана, то элемент составляет менее 0,1 процента.
Большой взрыв как первопричина образования материи
Какой химический элемент был самым первым во Вселенной? Ученые считают, что ответ на этот вопрос лежит в звездах и в процессах, с помощью которых формируются звезды. Вселенная, как полагают, возникла в какой-то момент времени от 12 до 15 миллиардов лет назад. До этого момента ничего сущего, кроме энергии, не мыслится. Но что-то произошло, что превратило эту энергию в огромный взрыв (так называемый Большой взрыв). В следующие секунды после Большого взрыва начала формироваться материя.
Первыми появившимися простейшими формами материи были протоны и электроны. Некоторые из них объединяются в атомы водорода. Последний состоит из одного протона и одного электрона; это самый простой атом, который может существовать. 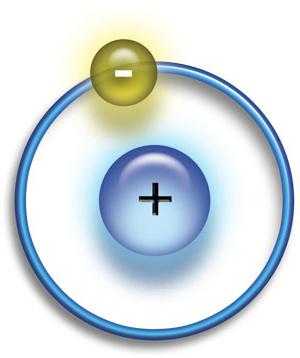 Медленно, в течение длительных периодов времени атомы водорода стали собираться вместе в определенных областях пространства, образуя плотные облака. Водород в этих облаках стягивался в компактные образования гравитационными силами. В конце концов эти облака водорода стали достаточно плотными, чтобы сформировать звезды..
Медленно, в течение длительных периодов времени атомы водорода стали собираться вместе в определенных областях пространства, образуя плотные облака. Водород в этих облаках стягивался в компактные образования гравитационными силами. В конце концов эти облака водорода стали достаточно плотными, чтобы сформировать звезды..
Звезды как химические реакторы новых элементов
Звезда – просто масса вещества, которая генерирует энергию ядерных реакций. Наиболее распространенная из этих реакций представляет комбинацию четырех атомов водорода, образующих один атом гелия. Как только звезды начали формироваться, то гелий стал вторым элементом, появившимся во Вселенной.
Когда звезды становятся старше, они переходят от водородно-гелиевых ядерных реакций на другие их типы. В них атомы гелия образуют атомы углерода. Позже атомы углерода образуют кислород, неон, натрий и магний. Еще позже неон и кислород соединяются друг с другом с образованием магния. Поскольку эти реакции продолжаются, то все более и более химических элементов образуются.
Первые системы химических элементов
Более 200 лет назад химики начали искать способы их классификации. В середине девятнадцатого века были известны около 50 химических элементов. Один из вопросов, который стремились разрешить химики. сводился к следующему: химический элемент – это полностью отличное от любого другого элемента вещество? Или некоторые элементы, связанные с другими в некотором роде? Есть ли общий закон, их объединяющий?
Химики предлагали различные системы химических элементов. Так, например, английский химик Уильям Праут в 1815 г. предположил, что атомные массы всех элементов кратны массе атома водорода, если принять ее равной единице, т. е. они должны быть целыми числами. В то время атомные массы многих элементов уже были вычислены Дж. Дальтоном по отношению к массе водорода. Однако если для углерода, азота, кислорода это примерно так, то хлор с массой 35,5 в эту схему никак не вписывался.
Немецкий химик Иоганн Вольфганг Доберайнер (1780 — 1849) показал в 1829 году, что три элемента из так называемой группы галогенов (хлор, бром и йод) могут классифицироваться по их относительным атомным массам. Атомный вес брома (79,9) оказался почти точно средним из атомных весов хлора (35,5) и йода (127), а именно 35,5 + 127 ÷ 2 = 81,25 (близко к 79,9). Это был первый подход к построению одной из групп химических элементов. Доберайнер обнаружил еще две таких триады элементов, но сформулировать общий периодический закон ему не удалось.
Как появилась периодическая система химических элементов
Большинство ранних классификационных схем было не очень успешными. Затем, около 1869 года, двумя химиками было сделано почти одно открытие и почти в одно время. Русский химик Дмитрий Менделеев (1834-1907) и немецкий химик Юлиус Лотар Мейер (1830-1895) предложили организовать элементы, которые имеют аналогичные физические и химические свойства, в упорядоченную систему групп, рядов и периодов. При этом Менделеев и Мейер указывали, что свойства химических элементов периодически повторяются в зависимости от их атомных весов.
Сегодня Менделеев, как правило, считается первооткрывателем периодического закона, потому что он сделал один шаг, который Мейер не сделал. Когда все элементы были расположены в периодической таблице, в ней появились некоторые пробелы. Менделеев предсказал, что это места для элементов, которые еще не были обнаружены.
Однако он пошел еще дальше. Менделеев предсказал свойства этих еще не открытых элементов. Он знал, где они расположены в периодической таблице, так что мог прогнозировать их свойства. Примечательно, что каждый предсказанный химический элемент Менделеева, будущие галлий, скандий и германий, были обнаружены менее чем через десять лет после опубликования им периодического закона.
Короткая форма периодической таблицы
Были попытки подсчитать, сколько вариантов графического изображения периодической системы предлагалось разными учеными. Оказалось, больше 500. Причем 80% общего числа вариантов – это таблицы, а остальное – геометрические фигуры, математические кривые и т. д. В итоге практическое применение нашли четыре вида таблиц: короткая, полудлинная, длинная и лестничная (пирамидальная). Последняя была предложена великим физиком Н. Бором.
На рисунке ниже показана короткая форма. 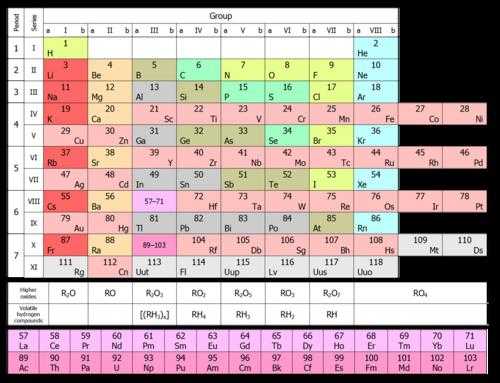 В ней химические элементы расположены по возрастанию их атомных номеров слева направо и сверху вниз. Так, первый химический элемент периодической таблицы водород имеет атомный номер 1 потому, что ядра атомов водорода содержит один и только один протон. Аналогично и кислород имеет атомный номер 8, так как ядра всех атомов кислорода содержат 8 протонов (см. рисунок ниже).
В ней химические элементы расположены по возрастанию их атомных номеров слева направо и сверху вниз. Так, первый химический элемент периодической таблицы водород имеет атомный номер 1 потому, что ядра атомов водорода содержит один и только один протон. Аналогично и кислород имеет атомный номер 8, так как ядра всех атомов кислорода содержат 8 протонов (см. рисунок ниже). 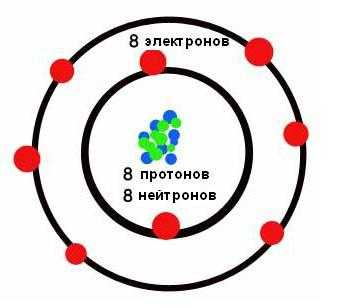
Главные структурные фрагменты периодической системы – периоды и группы элементов. В шести периодах все клетки заполнены, седьмой еще не завершен (элементы 113, 115, 117 и 118 хотя и синтезированы в лабораториях, однако еще официально не зарегистрированы и не имеют названий).
Группы подразделяются на главные (A) и побочные (B) подгруппы. Элементы первых трех периодов, содержащих по одному ряду-строке, входят исключительно в A-подгруппы. Остальные четыре периода включают по два ряда-строки.
Химические элементы в одной группе, как правило, имеют схожие химические свойства. Так, первую группу составляют щелочные металлы, вторую – щелочноземельные. Находящиеся в одном периоде элементы имеют свойства, медленно изменяющиеся от щелочного металла до благородного газа. Рисунок ниже показывает, как одно из свойств – атомный радиус – изменяется для отдельных элементов в таблице.
Длиннопериодная форма периодической таблицы
Она показана на рисунке ниже и делится в двух направлениях, по строкам и по столбцам. Есть семь строк-периодов, как и в короткой форме, и 18 столбцов, называемых группами или семьями. По сути, увеличение числа групп с 8 в короткой форме до 18 в длинной получено путем размещения всех элементов в периодах, начиная с 4-го, не в две, а в одну строку.
Две разных системы нумерации используются для групп, как показано в верхней части таблицы. Система на основе римских цифр (IA, IIA, IIB, IVB и т. д.) традиционно была популярна в США. Другая система (1, 2, 3, 4 и т. д.) традиционно используется в Европе, а несколько лет назад была рекомендована для использования в США.

Вид периодических таблиц на рисунках выше немного вводит в заблуждение, как и в любой такой опубликованной таблице. Причиной этого является то, что две группы элементов, показанных в нижней части таблиц, на самом деле должны быть расположены внутри них. Лантаноиды, например, принадлежат к периоду 6 между барием (56) и гафнием (72). Кроме того, актиноиды принадлежат периоду 7 между радием (88) и резерфордием (104). Если бы они были вставлены в таблицу, то она стала бы слишком широкой, чтобы поместиться на листе бумаги или настенной диаграмме. Поэтому принято эти элементы размещать в нижней части таблицы.
www.syl.ru
периодическая система химических элементов – это… Что такое периодическая система химических элементов?
- периодическая система химических элементов
- периоди́ческая систе́ма хими́ческих элеме́нтов
естественная система химических элементов, разработанная Д. И. Менделеевым на основе открытого им (1869) периодического закона. Современная формулировка этого закона звучит так: свойства элементов находятся в периодической зависимости от заряда их атомных ядер. Заряд ядра
Энциклопедический словарь. 2009.
- периодическая печать
- периодическая функция
Смотреть что такое “периодическая система химических элементов” в других словарях:
Периодическая система химических элементов
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ — создана Д. И. Менделеевым и состоит в расположении х. э. в строго определенном порядке по их атомному весу; свойства х. э. находятся в тесной связи с их местонахождением в п. с., а правильное расположение в последней х. э. дало возможность… … Словарь иностранных слов русского языка
Периодическая система химических элементов
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ — естеств. система хим. элементов, разработанная Д. И. Менделеевым на основе открытого им (1869) периодич. закона. Совр. формулировка этого закона звучит так: свойства элементов находятся в периодич. зависимости от заряда их атомных ядер. Заряд… … Естествознание. Энциклопедический словарь
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ — упорядоченное множество хим. элементов, их естеств. классификация, являющаяся табличным выражением периодического закона Менделеева. Прообразом пе риодич. системы хим. элементов (П. с.) послужила таблица Опыт системы элементов, основанной на их… … Химическая энциклопедия
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ — Относительные массы приведены по Международной таблице 1995 года (точность указана для последней значащей цифры). Для элементов, не имеющих стабильных нуклидов (за исключением Th, Ра и U, распространённых в земной коре), в квадратных скобках… … Естествознание. Энциклопедический словарь
Периодическая законность химических элементов — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
Периодическая таблица химических элементов — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
Система химических элементов периодическая — система химических элементов, разработанная русским учёным Д. И. Менделеевым (1834 1907) на основе открытого им (1869) периодического закона. Современная формулировка этого закона звучит так: свойства элементов находятся в периодической… … Концепции современного естествознания. Словарь основных терминов
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ — ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ, периодический закон. Уже с давних пор были делаемы попытки установить зависимость свойств элементов от их атомного веса: Деберейнер (Dobereiner, 1817) указал на триад ы подобных элементов, между атомными весами к… … Большая медицинская энциклопедия
dic.academic.ru
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ • Большая российская энциклопедия
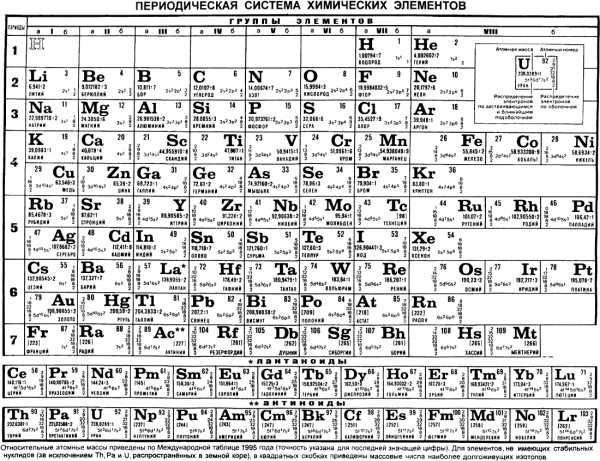
ПЕРИОДИ́ЧЕСКАЯ СИСТЕ́МА ХИМИ́ЧЕСКИХ ЭЛЕМЕ́НТОВ, упорядоченное множество химич. элементов и их естеств. классификация. Является табличным представлением периодического закона, открытого Д. И. Менделеевым. Прообразом П. с. х. э. служит таблица «Опыт системы элементов, основанной на их атомном весе и химическом сходстве», составленная Менделеевым в 1869 (рис. 1). По мере совершенствования этой таблицы Менделеев развил представления о периодах и группах элементов и о месте каждого элемента в системе. К 1871 в кн. «Основы химии» Менделеевым была включена «Естественная система элементов Д. Менделеева» – первая классич. короткая форма П. с. х. э. Опираясь на неё, Менделеев выполнил впоследствии оправдавшийся прогноз существования и свойств неизвестных в то время элементов (Ga, Sc, Ge).

Рис. 1. Таблица, составленная Д. И. Менделеевым 1. 3.1869.
Физич. смысл периодичности в свойствах элементов стал ясен после появления планетарной модели атома (Э. Резерфорд, 1911) и было показано (нидерл. физик А. ван ден Брук и Г. Мозли, 1913–14), что порядковый номер элемента в П. с. х. э. равен положительному заряду (Z) ядра атома. Теория П. с. х. э. в осн. создана Н. Бором (1913–21) на базе квантовой модели атома. Бор разработал схему построения электронных конфигураций атомов по мере возрастания Z, опирающуюся на определённую последовательность заполнения электронами оболочек и подоболочек в атомах с ростом числа Z.
Совр. П. с. х. э. включает более ста химич. элементов. Наиболее тяжёлые элементы получены ядерным синтезом. Порядок заполнения электронами уровней в атомах определяется правилами, совокупность которых называют «принципом построения»: заполнение атомных орбиталей (АО) происходит в порядке увеличения энергии орбиталей: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 6d и т. д.; согласно Паули принципу, каждая АО (характеризуется квантовыми числами n, l, m) может содержать не более 2 электронов; АО с одинаковыми l и n заполняются так, чтобы суммарный спин электронов был максимален (т. е. заполняется макс. число АО с разными m по Хунда правилу).
Рис. 2. Короткий вариант периодической системы химических элементов Д. И. Менделеева (в соответствии с данными ИЮПАК на 1973).
Согласно (n+l)-правилу Клечковского, построение электронных конфигураций гл. обр. происходит в соответствии с последовательным увеличением суммы (n+l). При этом в пределах каждой такой суммы сначала заполняются подоболочки с бóльшими l и меньшими n, затем с меньшими l и бóльшими n.
Опубликовано св. 500 вариантов П. с. х. э., что связано с попытками поиска решения некоторых частных проблем её структуры. Наиболее распространены две табличные формы П. с. х. э.: короткая (рис. 2) и длинная (разрабатывалась Д. И. Менделеевым, усовершенствована в 1905 А. Вернером; рис. 3). В структуре П. с. х. э. выделяют периоды (горизонтальные ряды) и группы (вертикальные столбцы) элементов.
Рис. 3. Длинная форма периодической системы химических элементов (в соответствии с данными ИЮПАК на 2013).
Совр. форма П. с. х. э. (в 1989 ИЮПАК рекомендована длинная форма П. с. х. э.) состоит из 7 периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма П. с. х. э. – из 8 групп. Число элементов в периодах, начиная со второго, попарно повторяется: 8, 8, 18, 18, 32, 32,… (первый период содержит два элемента). Номер группы элементов короткого варианта П. с. х. э. соответствует числу валентных электронов во внешней электронной оболочке атомов. В длиннопериодном варианте П. с. х. э. номер группы в бoльшей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химич. свойствам, их атомы характеризуются одинаковым строением внешних электронных оболочек. Элементы некоторых групп имеют собств. тривиальные названия: щелочные металлы (группа 1 длинной формы П. с. х. э.), щёлочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18). В П. с. х. э. для каждого элемента указывается его символ, название, порядковый номер и значение относит. атомной массы.
Первый период содержит два элемента – Н и Не. Водород имеет некоторое сходство как со щелочными элементами, так и с галогенами. В связи с этим символ Н помещают либо в подгруппу Iа, либо в подгруппу VIIa короткого варианта П. с. х. э., либо в обе одновременно.
Второй и третий периоды (Li – Ne; Na – Ar) содержат по 8 элементов, причём характер изменения химич. свойств вертикальных аналогов во многом близок. Элементы первых трёх периодов относятся к гл. подгруппам короткого варианта периодич. системы химич. элементов.
Элементы групп 1 и 2 длинной формы называются s-элементами, групп 13–18 – p-элементами, групп 3–12 – d-элементами; d-элементы (за исключением цинка, кадмия и ртути) называют также переходными элементами.
Четвёртый период (K–Kr) содержит 18 элементов. После K и Са (s-элементы) следует ряд из десяти (Sc – Zn) 3d-элементов (побочные подгруппы короткого варианта П. с. х. э.). Переходные элементы проявляют высшие степени окисления, в осн. равные номеру группы короткого варианта П. с. х. э. (исключая Co, Ni и Cu). Элементы от Ga до Kr относятся к гл. подгруппам (р-элементы).
Пятый период (Rb – Xe) построен аналогично четвёртому; в нём также имеется «вставка» из десяти переходных 4d-элементов (Y – Cd). Особенности изменения свойств в этом периоде: в триаде Ru – Rh – Pd рутений проявляет макс. степень окисления +8, родий +6, палладий +5; все элементы гл. подгрупп, включая Хе, проявляют высшие степени окисления, равные номеру группы.
Шестой период (Сs – Rn) содержит 32 элемента. В него, помимо десяти 5d-элементов (La, Hf – Hg), входит семейство из четырнадцати 4f-элементов – лантаноидов (лантанидов, Ln). В степени окисления +3, +4 они являются химич. аналогами актиноидов, в степени окисления +2 – щёлочноземельных элементов. Лантаноиды размещены в группе 3 длинной формы, клетка La, и для удобства вынесены под таблицу. Особенностью элементов шестого периода является то, что в триаде Os – Ir – Pt два элемента – осмий и иридий – проявляют степень окисления +8, платина +6 (для Ir – данные 2010).
Седьмой период, подобно шестому, содержит 32 элемента. Актиний – аналог лантана. После Ас следует семейство из четырнадцати 5f-элементов – актиноидов (актинидов, An) (Z= 90–103). В П. с. х. э. их размещают в клетке Ас и, подобно Ln, записывают отд. строкой под таблицей. Этот приём предполагает наличие существенного химич. сходства элементов двух f-семейств. Именно на этом основывалась «актинидная концепция» Г. Сиборга (1944), сыгравшая ведущую роль при разработке методов разделения продуктов деления урана и поиске новых элементов. Однако эта концепция справедлива лишь для трёх- и четырёхвалентных An. Актиноиды же проявляют степени окисления от +2 до +7 (последняя характерна для Np, Pu, Am) и +8 (для плутония). Для наиболее тяжёлых An характерна стабилизация низших степеней окисления (+2 или даже +1 для Md).
Эксперим. оценки химии элементов с Z=104 (резерфордий) и Z=105 (дубний) позволили заключить, что они являются аналогами соответственно Hf и Та, т. е. 6d-элементами (должны располагаться в IVб и Vб подгруппах короткой формы). Химич. идентификация элементов с Z=106–118 не проводилась из-за слишком коротких «времён жизни» синтезированных изотопов, но в соответствии со структурой П. с. х. э. можно считать, что элементы Rf, Db, Sg, Bh, Hs, Mt, Ds, Rg, Cn относятся к 6d-элементам, элементы c Z=113–118 близки соответственно вертикальным аналогам. Это же следует из совр. квантовохимич. расчётов.
П. с. х. э. является важным звеном эволюции атомно-молекулярного учения, способствует уточнению представлений о простых веществах и соединениях, оказала значит. влияние на разработку теории строения атомов. С П. с. х. э. связана постановка проблемы прогнозирования в химии, что проявилось в предсказании как существования неизвестных элементов и их свойств, так и особенностей химич. поведения известных элементов. П. с. х. э. – основа неорганич. химии; служит задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, в частности сверхпроводников и полупроводников, подбору специфич. катализаторов для разл. химич. процессов и др. П. с. х. э. – науч. база преподавания общей и неорганич. химии, а также некоторых разделов атомной физики.
bigenc.ru
Химические элементы. Периодическая Система химических элементов Д.И. Менделеева.
Что такое химический элемент?
В химических реакциях происходят превращения одних веществ в другие. Чтобы понять, как это происходит, нужно вспомнить из курса природоведения и физики, что вещества состоят из атомов.
Существует ограниченное число видов атомов. Атомы могут различным образом соединяться друг с другом. Как при складывании букв алфавита образуются сотни тысяч разных слов, так из одних и тех же атомов образуются молекулы или кристаллы разных веществ.
Атомы могут образовать молекулы – мельчайшие частицы вещества, которые сохраняют его свойства.
Известно, например, несколько веществ, образованных всего из двух видов атомов – атомов кислорода и атомов водорода, но разными видами молекул. К числу таких веществ относятся вода, водород и кислород.
Молекула воды состоит из трех частиц, связанных друг с другом. Это и есть атомы. К атому кислорода (атомы кислорода обозначаются в химии буквой О) присоединены два атома водорода (они обозначаются буквой Н).
Молекула кислорода состоит из двух атомов кислорода; молекула водорода – из двух атомов водорода. Молекулы могут образовываться в ходе химических превращений, а могут и распадаться.
Так, каждая молекула воды распадается на два атома водорода и один атом кислорода. Две молекулы воды образуют вдвое больше атомов водорода и кислорода. Одинаковые атомы связываются попарно в молекулы новых веществ – водород и кислород. Молекулы, таким образом, разрушаются, а атомы сохраняются.
Отсюда и произошло слово «атом», что значит в переводе с древнегреческого «неделимый».
Атомы – это мельчайшие химически неделимые частицы вещества
В химических превращениях образуются другие вещества из тех же атомов, из которых состояли исходные вещества.
Как микробы стали доступны наблюдению с изобретением микроскопа, так атомы и молекулы – с изобретением приборов, дающих еще большее увеличение и даже позволяющих атомы и молекулы фотографировать. На таких фотографиях атомы выглядят в виде расплывчатых пятен, а молекулы – в виде сочетания таких пятен.
Однако существуют и такие явления, при которых атомы делятся, атомы одного вида превращаются в атомы других видов. При этом получены искусственно и такие атомы, которые в природе не найдены.
Но эти явления изучаются не химией, а другой наукой – ядерной физикой.
Как уже говорилось, существуют и другие вещества, в состав которых входят атомы водорода и кислорода. Но, независимо от того, входят эти атомы в состав молекул воды, или в состав других веществ – это атомы одного и того же химического элемента.
Химический элемент – определенный вид атомов
Сколько всего существует видов атомов? На сегодняшний день человеку достоверно известно о существовании 118 видов атомов, то есть 118 химических элементов. Из них в природе встречаются 90 видов атомов, остальные получены искусственно в лабораториях.
Символы химических элементов
В химии для обозначения химических элементов используют химическую символику. Это язык химии. Для понимания речи на любом языке необходимо знать буквы, в химии точно так же. Чтобы понимать и описывать свойства веществ, и изменения, происходящие с ними, прежде всего, необходимо знать символы химических элементов.
В эпоху алхимии химических элементов было известно намного меньше, чем сейчас. Алхимики отождествляли их с планетами, различными животными, античными божествами.
В настоящее время во всем мире пользуются системой обозначений, введенной шведским химиком Йёнсом Якобом Берцелиусом. В его системе химические элементы обозначают начальной или одной из последующих букв латинского названия данного элемента. Например, элемент серебро обозначается символом – Ag (лат. Argentum). Ниже приведены символы, произношения символов, и названия наиболее распространенных химических элементов. Их нужно заучить на память!
Периодическая Система химических элементов Д.И. Менделеева
Русский химик Дмитрий Иванович Менделеев первым упорядочил разнообразие химических элементов, и на основании открытого им Периодического Закона составил Периодическую Систему химических элементов.
Как устроена Периодическая Система химических элементов?
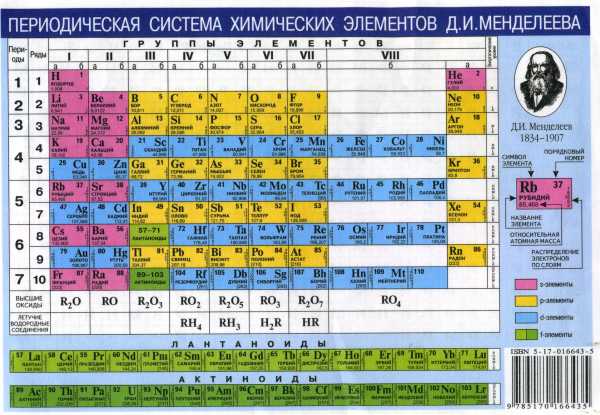
На рисунке 58 изображен короткопериодный вариант Периодической Системы.
Периодическая Система состоит из вертикальных столбцов и горизонтальных строк. Горизонтальные строки называются периодами. На сегодняшний день все известные элементы размещаются в семи периодах. Периоды обозначают арабскими цифрами от 1 до 7.
Периоды 1–3 состоят из одного ряда элементов – их называют малыми. Периоды 4–7 состоят из двух рядов элементов, их называют большими.
Вертикальные столбцы Периодической Системы называют группами элементов. Всего групп восемь, и для их обозначения используют римские цифры от I до VIII. Выделяют главные и побочные подгруппы.
Периодическая Система – универсальный справочник химика, с ее помощью можно получить информацию о химических элементах.
Существует еще один вид Периодической Системы – длиннопериодный.
В длиннопериодной форме Периодической Системы элементы сгруппированы иначе, и распределены на 18 групп. В данном варианте
Периодической Системы элементы сгруппированы по «семействам», то есть в каждой группе элементов расположены элементы со сходными, похожими свойствами. В данном варианте Периодической Системы, номера групп, как и периодов, обозначают арабскими цифрами.
Периодическая Система химических элементов Д.И. Менделеева
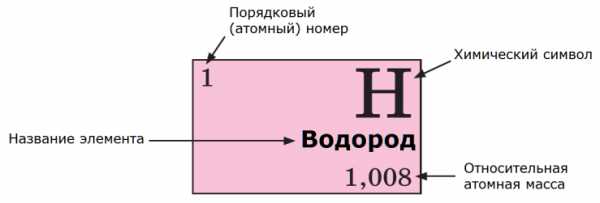
Характеристики элемента в Периодической Системе
Распространенность химических элементов в природе
Атомы элементов, встречающихся в природе, распределенные в ней очень неравномерно. В космосе самым распространенным элементом является водород – первый элемент Периодической Системы. На его долю приходится около 93% всех атомов Вселенной. Около 6,9% составляют атомы гелия – второго элемента Периодической Системы. Остальные 0,1% приходится на все остальные элементы.
Распространенность химических элементов в земной коре значительно отличается от их распространенности во Вселенной. В земной коре больше всего атомов кислорода и кремния. Вместе с алюминием и железом они формируют основные соединения земной коры. А железо и никель – основные элементы, из которых состоит ядро нашей планеты.
Живые организмы также состоят из атомов различных химических элементов. В организме человека больше всего содержится атомов углерода, водорода, кислорода и азота.
Делаем выводы из статьи про Химические элементы.
- Химический элемент – определенный вид атомов
- На сегодняшний день человеку достоверно известно о существовании 118 видов атомов, то есть 118 химических элементов. Из них в природе встречаются 90 видов атомов, остальные – получены искусственно в лабораториях
- Существует два варианта Периодической Системы химических элементов Д.И. Менделеева – короткопериодный и длиннопериодный
- Современная химическая символика образована от латинских названий химических элементов
- Периоды – горизонтальные строки Периодической Системы. Периоды разделяют на малые и большие
- Группы – вертикальные строки периодической таблицы. Группы разделяют на главные и побочные
idaten.ru
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ – это… Что такое ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ?
- ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
- ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
создана Д. И. Менделеевым и состоит в расположении х. э. в строго определенном порядке по их атомному весу; свойства х. э. находятся в тесной связи с их местонахождением в п. с., а правильное расположение в последней х. э. дало возможность предугадать нахождение в природе элементов, еще не открытых ко времени установления системы.
Словарь иностранных слов, вошедших в состав русского языка.- Павленков Ф., 1907.
.
- ПЕРИОДИЧЕСКАЯ ПЕЧАТЬ
- ПЕРИОДИЧЕСКИЕ ИЗДАНИЯ
Смотреть что такое “ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ” в других словарях:
Периодическая система химических элементов — Периодическая система химических элементов. Периодическая система хим. эл тов ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ, естественная классификация химических элементов, являющаяся табличным выражением периодического закона. Современная… … Иллюстрированный энциклопедический словарь
Периодическая система химических элементов — Памятник Д. И. Менделееву в Санкт Петербурге … Википедия
периодическая система химических элементов — естественная система химических элементов, разработанная Д. И. Менделеевым на основе открытого им (1869) периодического закона. Современная формулировка этого закона звучит так: свойства элементов находятся в периодической зависимости от заряда… … Энциклопедический словарь
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ — естеств. система хим. элементов, разработанная Д. И. Менделеевым на основе открытого им (1869) периодич. закона. Совр. формулировка этого закона звучит так: свойства элементов находятся в периодич. зависимости от заряда их атомных ядер. Заряд… … Естествознание. Энциклопедический словарь
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ — упорядоченное множество хим. элементов, их естеств. классификация, являющаяся табличным выражением периодического закона Менделеева. Прообразом пе риодич. системы хим. элементов (П. с.) послужила таблица Опыт системы элементов, основанной на их… … Химическая энциклопедия
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ — Относительные массы приведены по Международной таблице 1995 года (точность указана для последней значащей цифры). Для элементов, не имеющих стабильных нуклидов (за исключением Th, Ра и U, распространённых в земной коре), в квадратных скобках… … Естествознание. Энциклопедический словарь
Периодическая законность химических элементов — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
Периодическая таблица химических элементов — Периодическая система химических элементов (таблица Менделеева) классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона,… … Википедия
Система химических элементов периодическая — система химических элементов, разработанная русским учёным Д. И. Менделеевым (1834 1907) на основе открытого им (1869) периодического закона. Современная формулировка этого закона звучит так: свойства элементов находятся в периодической… … Концепции современного естествознания. Словарь основных терминов
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ — ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ, периодический закон. Уже с давних пор были делаемы попытки установить зависимость свойств элементов от их атомного веса: Деберейнер (Dobereiner, 1817) указал на триад ы подобных элементов, между атомными весами к… … Большая медицинская энциклопедия
dic.academic.ru
