Методы решения химических задач
Введение
«Математика – царица наук» – сказал когда-то великий французский математик Карл Фридрих Гаусс. В наше время никто не станет оспаривать это высказывание, ведь мы не можем представить свою жизнь без математики. Без её существования у нас не было бы компьютеров, телефонов, Интернета. Был бы невозможным быстрый обмен информацией, нельзя было бы преодолевать огромное расстояние с помощью автомобилей, поездов, самолетов. Человечество не смогло бы развить технику без развития математики. Одним словом, у людей не было бы ничего, к чему они привыкли. Также без математики немыслимо было бы развитие и других наук, не только точных, таких как физика, астрономия, информатика, но и гуманитарных, и естественных. Например, изучение химии не возможно представить себе без изучения математики.
Актуальность
Один из аспектов изучения химии – это умение решать задачи. Решение задач необходимо не только в учебе, но и в научно-производственной деятельности. Химические процессы являются основой многих производств,
где требуются детальные расчеты материального баланса: расход сырья и энергии, количество получаемой продукции, производственные потери и т.п. Знания взаимопревращений веществ и владение приемами расчета химических процессов очень важны для их реализации в лабораториях и на производстве. Поэтому при изучении химии большое внимание уделяется решению задач, они способствуют улучшению знаний и развитию логического мышления. Решение химических задач при помощи математических методов поможет ученикам лучше усвоить многие темы по таким предметам, как алгебра и химия.
Цель:
Изучить какими математическими методами можно решать расчетные химические задачи.
Задачи:
Ознакомиться с литературой по решению химических задач
Найти наиболее рациональные математические методы решения химических задач
Решить наиболее распространённые расчетные задачи по химии с помощью найденных методов
Категории химических задач
Все химические задачи можно условно разделить на две категории: качественные и расчетные.
Качественные задачи направлены на обнаружение, идентификацию и определение составных частей (атомов, ионов, радикалов, молекул, функциональных групп) анализируемого объекта, определение последовательности соединения и взаимного расположения отдельных составных частей в веществе, определение изменения природы и концентрации составных частей объекта во времени. Обычно такие задачи не связаны с математическими расчетами.
Для решения же расчетных задач нужно знать основные химические свойства соединений и уметь применять основные понятия и законы химии, подобрать наиболее рациональные методы вычислений, используя математический аппарат (системы уравнений с несколькими неизвестными, неравенства, степенные и логарифмические функции).
Расчетные задачи в свою очередь делятся еще на две категории:
Задачи, связанные с использованием формул веществ;
Расчеты по уравнениям реакций.
Среди задач первой категории можно выделить несколько типов:
Вычисление массы вещества по его количеству и обратный расчет.
Определение массовой доли элемента в веществе по его молекулярной массе и наоборот.
Расчет объемов и объемных долей газов с использованием газовых законов (Авогадро, Бойля – Мариотта, Гей-Люссака, Менделеева – Клапейрона).
Вывод формул соединений по количественному составу.
Задачи второй категории, как правило, основаны на применении закона сохранения массы вещества. Эти задачи также подразделяются на несколько типов:
Задачи на вычисление количеств, масс и объемов исходных веществ по количеству, массе и объему продуктов реакции и обратные расчеты.
Расчет количеств, масс и объемов продуктов реакции, если один из реагентов взят в избытке.
Вычисления количеств, масс и объемов продуктов реакции, если один из реагентов содержит примеси.
Задачи на определение выхода продукта реакции от теоретически возможного.
Вычисления по уравнениям реакций, протекающих в растворах и требующих учета концентрации реагентов.
Термохимические расчеты.
В этой работе хотелось бы рассмотреть только несколько типов задач.
Способы решения химических задач
Все перечисленные выше типы задач можно решать с помощью различных способов, как химических, так и математических.
Химические способы включают в себя использование законов химии (Авогадро, Гей-Люссака, Менделеева – Клапейрона и др.), химических уравнений и формул и т.п.
Математических методов существует множество, но самые используемые, которые будут рассмотрены – это:
Математические методы решения химических задач
Алгебраический
Различные задачи по химии решают с помощью составления уравнения или системы уравнений.
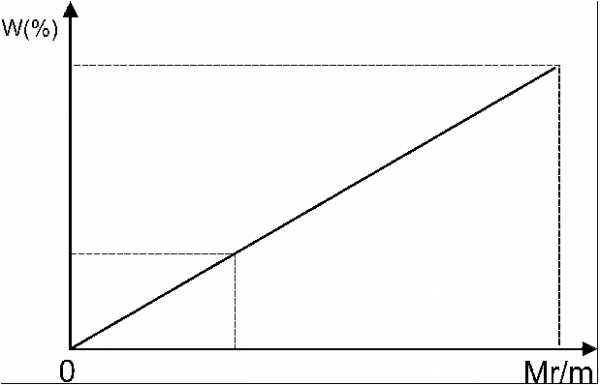
Графический
Отрезок прямой (основание графика) представляет собой массу смеси, а на осях ординат откладывают точки, соответствующие массовым долям растворенного вещества в исходных растворах. Соединив прямой точки на осях ординат, получают прямую, которая отображает функциональную зависимость массовой доли растворенного вещества в смеси от массы смешанных растворов в обратной пропорциональной зависимости:
Полученная функциональная прямая позволяет решать задачи по определению массы смешанных растворов и обратные, по массе смешанных растворов находить массовую долю полученной смеси.
Правило креста (конверт Пирсона)
“Правилом креста” называют диагональную схему правила смешения для случаев с двумя растворами.
Слева, на концах отрезков, записывают исходные массовые доли растворов (обычно слева вверху-большая), на пересечении отрезков – заданная массовая доля, а справа, на их концах, записываются разности между исходными и заданной массовыми долями. Получаемые массовые части показывают в каком отношении надо слить исходные растворы.
Такой метод обычно применяется для решения задач на смеси и сплавы.
Примеры решения задач математическими и химическими методами
После того, как мы изучили категории и типы химических задач, рассмотрели методы их решения, можно приступать к практическому решению.
Задача 1. Вычислить массу сульфита натрия, необходимого для реакции с серной кислотой, чтобы получить 16 г оксида серы (IV).
Решим задачу сначала с помощью химического уравнения:
Дано Решение
xг 16г
Na2SO3 + H2SO4 = Na2SO4 + H2
126г 64г
m(SO2)=16г Составим пропорцию: 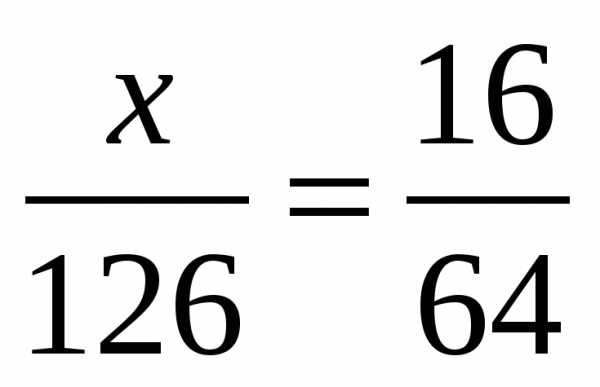
___________ x=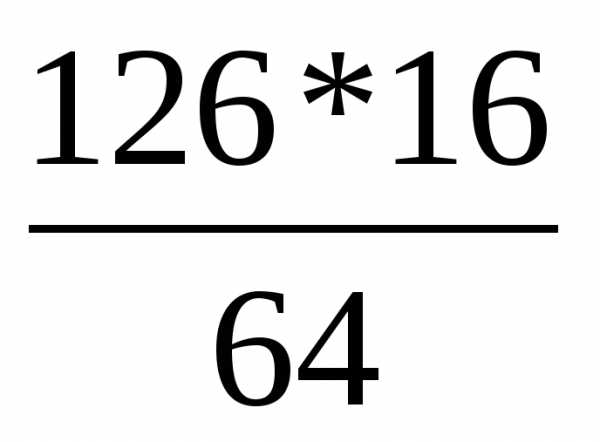 =31,5г
=31,5г
m(Na2SO3)=? Ответ: 31,5г
Также эту задачу можно решить при помощи графического метода.
Составим таблицу для составления графика прямой пропорциональности:
m(SO2) | 0 | 64 |
m(Na2SO3) | 0 | 126 |
Т.к. по уравнению реакции:
m(SO2) = 1 моль * 64 г/моль = 64г
m(Na2SO3) = 1 моль * 126 г/моль = 126г

Для решения задачи на оси абсцисс отмечаем точку, соответствующую числу 16, проводим прямую, до пересечения с графиком прямой пропорциональности. Из точки пересечения проводим перпендикуляр к оси ординат и получаем точку, которая указывает величину массы сульфита натрия, равную 31,5 г.
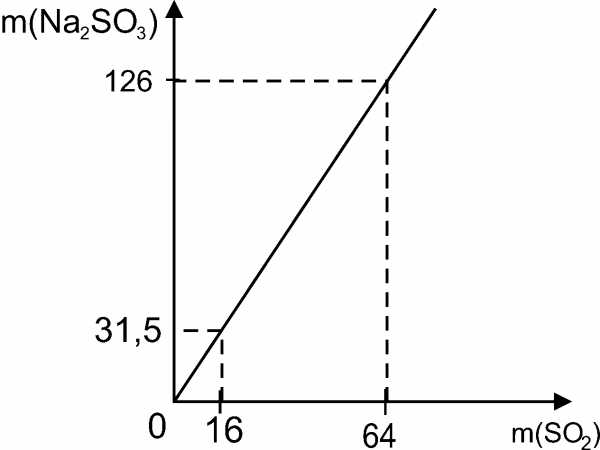
Ответ: 31,5г
Задача 2. Смешали 10%-ный и 25%-ный растворы соли и получили 3 кг 20%-ного раствора. Какое количество каждого раствора в килограммах было использовано?
Для начала, решим задачу алгебраическим методом:
Пусть x(кг) – масса 1-го раствора, а 3-x(кг) 2-го раствора,
тогда, 0,1x(кг) – масса соли в 1-ом растворе, а 0,25(3-
Масса соли в смеси 0,2*3(кг).
Учитывая, что масса соли в 1-ом и 2-ом растворах равна массе соли в смеси, составим и решим уравнение:
0,1x + 0,25(3-x) = 0,6
0,1x + 0,75 – 0,25x = 0,6
0,15x = 0,15
x = 1кг – масса 1-го раствора в смеси,
а масса 2-го раствора – 3-1 = 2кг
Ответ: 1кг, 2 кг.
Графический метод
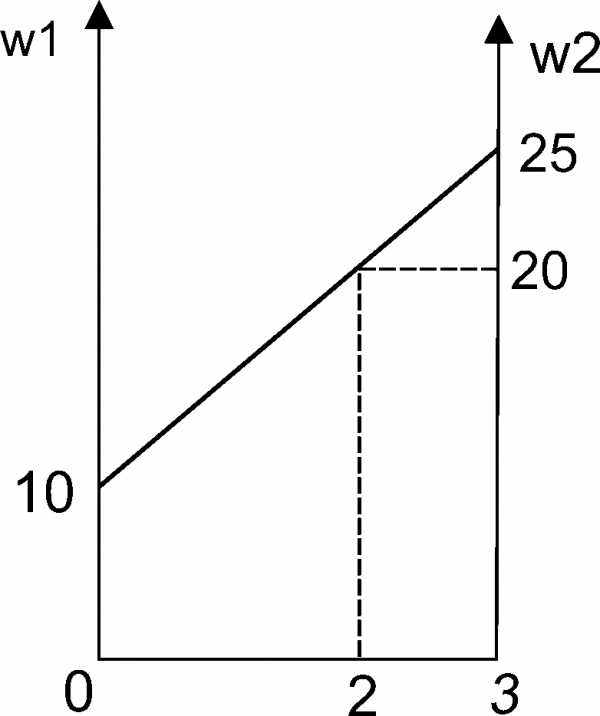
Ответ: 1кг, 2кг.
Правило креста (Конверт Пирсона)
Составим схему:
Следовательно: m1 : m2 = 0,1 : 0,05 = 2:1
Ответ: 1кг, 2кг.
Задача 3. Наиболее распространенный в природе фторапатит содержит 42,23% оксида фосфора, 50,03% оксида кальция и 7,74% фторида кальция. Напишите состав этого минерала в виде формул двух солей.
Графический метод
В одной построим три графика, выражающие соотношение между величинами системе координат относительных молекулярных масс и массовыми долями тех веществ, входящих в состав минерала.
Mr(P2O5) = 142 г/моль
Mr(CaO) = 56 г/моль
Mr(CaF2) = 78 г/моль
Mr(P2O5) | 0 | 142 |
w(P2O5) | 0 | 42,23 |
Mr(CaO) | 0 | 56 |
w(CaO) | 0 | 50,03 |
Mr(CaF2) | 0 | 78 |
w(CaF2) | 0 | 7,78 |
Пересечем все три функциональные прямые произвольной прямой линией, параллельной оси ординат. По отношению точек пересечения этой прямой и определяют индексы элементов в минерале.
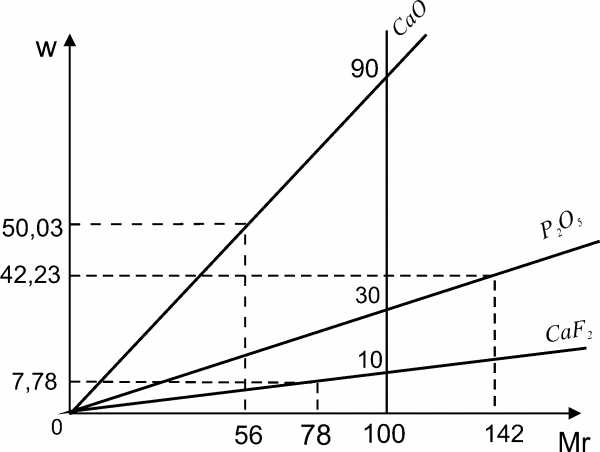
Отношение точек пересечений этой прямой с функциональными прямыми:
10:30:90 (CaF2 P2O5 CaO) или 1:3:9 (CaF2 P2O5 CaO).
Значит формула минерала: 3Ca3(PO4)2 CaF2
multiurok.ru
Методическое пособие по решению химических задач
Муниципальное автономное общеобразовательное учреждение
средняя общеобразовательная школа №32 г.Тюмени
имени Героя Советского Союза Битюкова Прокопия Семеновича
Подготовка к ЕГЭ:
ИСПОЛЬЗОВАНИЕ ГРАФИЧЕСКОГО СПОСОБА ПРИ РЕШЕНИИ ТЕОРЕТИЧЕСКИХ И ПРАКТИЧЕСКИХ ХИМИЧЕСКИХ ЗАДАЧ
( пособие по химии для учащихся 8 – 11 классов)

Составитель: Жмакина М.В., учитель химии МАОУ СОШ №32 города Тюмени
Методическое пособие написано в соответствии с программой
«Химия 8 – 11» для общеобразовательных школ.
Указания могут быть использованы на уроках химии для решения теоретических и практических задач, а также при проведении факультативных занятий или индивидуальной работе с учащимися, интересующимися химией.
Показаны дополнительные способы решения задач.
Введение
ЗАЧЕМ НУЖНО РЕШАТЬ ЗАДАЧИ? Овладеть знаниями, усвоить их – значит не только знать, но и уметь применять. Где может школьник применять знания? Главным образом в решении задач. Следовательно, решать задачи надо для того, чтобы, ЧТОБЫ НАУЧИТЬСЯ ПРИМЕНЯТЬ ЗНАНИЯ. Человек, пытающийся усвоить знания, не решая задач, подобен собаке Павлова, пытавшейся наесться с перерезанным пищеводом. Не менее важно то, что анализ условия задачи, поиск путей решения, осмысление результатов служит средством ДЛЯ РАЗВИТИЯ МЫШЛЕНИЯ ученика, готовит его к решению любых жизненных проблем, развивает рефлексию, самооценку.
Цель данного пособия не состоит в том, чтобы научить вас, учащихся, решать задачи. Задачи, приведенные здесь, достаточно просты, и каждый по-своему, конечно справится с их решением. Перед нами стоит задача научиться применять знания других предметов при решении химических задач.
На приведенных ниже примерах мы увидим, что самые разнообразные типы химических задач можно решить, используя графический метод решения. Однако хотелось бы добавить, что применение графического способа решения задач будет нецелесообразным для решения очень простых задач, так как на построение графика затрачивается больше усилий и времени, чем на математическое вычисление. Однако для некоторых учащихся такой способ объяснения задач может быть более доступен для понимания и применения. Кроме этого для любознательных учащихся, а также для тех, кто желает углубленно заниматься химией, данный способ решения задач будет очень полезен, т.к. по данному принципу можно решить и сложные, и межпредметные, и логические задачи.
2
1. ГРАФИЧЕСКИЙ МЕТОД РЕШЕНИЯ ХИМИЧЕСКИХ ЗАДАЧ
Современная химия настолько разнообразна как по объектам, так и по методам их исследования, что многие ее разделы представляют собой самостоятельные науки. Так, взаимодействие химии и физики дало сразу две науки: физическую химию и химическую физику. Самой молодой областью химии является возникшая буквально в последнее десятилетие математическая химия. Ее задача – применение математических методов для обработки химических закономерностей, поиска связей между строением и свойствами веществ, кодирования веществ по их молекулярной структуре, подсчета числа изомеров органических веществ.
Нас окружает множество изменяющихся величин. Многообразие меняющихся величин крайне велико. Некоторые из этих величин очень тесно связаны между собой. Значение одной из переменных и множества, которому она принадлежит, полностью определяет значение другой переменной и множество, которому принадлежат все ее значения. Функцией f называют правило, которое каждому элементу x принадлежит X ставит в соответствие единственный y принадлежит Y. Для наглядного изображения функций используют их графики. Если задана функция f с областью определения D(f), то каждому значению аргумента x принадлежит D(f) соответствует значение функции y=f(x). Алгебраические уравнения наглядно можно изобразить в виде линий- графиков этих уравнений /1 /.
3
1.1. Графики функцийДля наглядного изображения функций используют их графики. Если задана функция f с областью определения D(f), то каждому значению аргумента x принадлежит D(f) соответствует значение функции y = f(x).
По двум числам х0 и g0 = /(х0) можно построить на координатной плоскости точку
М (х0; f(x0)). Совокупность всех таких точек образует график функции f. ( рис 1)
Рис 1
Пример 1. Графиком функции у = 2х +1 является прямая, изображенная на рисунке 2. Равенство у=2х+1 является уравнением этой прямой.
Рис 2.

4
Пример 2. График функции у=1/x состоит из двух отдельных кривых и показан на рисунке 3. Равенство у =1/x — уравнение гиперболы.
Рис 3.
СПОСОБЫ ЗАДАНИЯ ФУНКЦИЙ
В определении функции говорится о том, что по заданному значению аргумента х с помощью некоторого правила находится соответствующее значение функции f(x). Задавать это правило можно различными способами.
Например, его можно задать таблицей, где перечисляются значения аргумента х и соответствующие им значения f(x). Так, функция, которая по величине х — диаметра окружности определяет ее длину 1(х), задается таблицей:
X1,0
1,1
1,2
1,3
1,4
1,5
1,6
l(x)
3,142
3,456
3,770
4,084
4,399
4,713
5,027
5
Этот способ задания функций, называемый табличным, широко распространен: результаты наблюдений за какой-либо характеристикой изучаемого процесса (температурой, давлением, влажностью, объемом и т. д.) приводят к табличному заданию изучаемых функций. Однако область определения функции чаще всего содержит бесконечное множество значений, и поэтому задать функцию с помощью таблицы в этом случае невозможно.
Другим способом задания функции является ее задание с помощью графика — графический способ.
Приведем примеры.
На рисунке 4 изображен график изменения ускорения силы тяжести g в зависимости от расстояния g до центра Земли (Земля принята за однородный шар радиуса R).
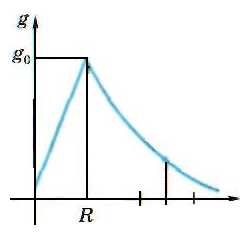

Рис. 4
На рисунке 5 представлена кардиограмма. Она показывает работу сердца.
Рис. 5
Третий способ задания функции – с помощью формулы (уравнения) 6
Графический способ задания функции позволяет увидеть функцию целиком всю сразу и наглядно представить ее свойства. Многочисленные сейсмограммы, кардиограммы, осциллограммы представляют примеры графического задания функции.
Применение координат дает наглядный и удобный способ графического изображения различных процессов. Умение читать графики является важным элементом математической культуры. Это нужно людям самых разных профессий: математикам, физикам, врачам, инженерам, сталеварам, морякам, криминалистам .
7
1.2. Применение графического метода при решении химических задач.I. Применение графического метода решения задач возможно при решении задач с использованием формулы и уравнения химической реакции.
Пример № 1
Решение задач с использованием формулы.
На завод была поставлена руда, содержащая 464 т магнитного железняка Fe3O4 . Какая масса железа содержится в руде?
Решение:
Данную задачу можно решить следующим образом:
Дано:
m (Fe3O4) = 464 т По формуле Fe3O4 находим массу вещества и элемента
т (Fe) -?
M(Fe3O4)=232 г/моль m(Fe3O4)=l моль*232 г/моль = 232 г
М (Fe) —56 г/моль
m(Fe) = 3 моль*56 г/моль=168 г. Строим график (рис. 6) согласно таблице:
т (Fe)0
168
т (Fe3O4)
0
232
8
Строим график зависимости содержания железа от массы используемой руды. Графиком является прямая. Найдем по графику ординату точки (m Fe), соответствующую абсциссе m (Fe2O3) 464. Для этого восстановим перпендикуляр из точки (464:0) до пересечения с графиком. Получаем точку, ордината которой соответствует числу 336, значит масса железа в оксиде железа равна 336т.
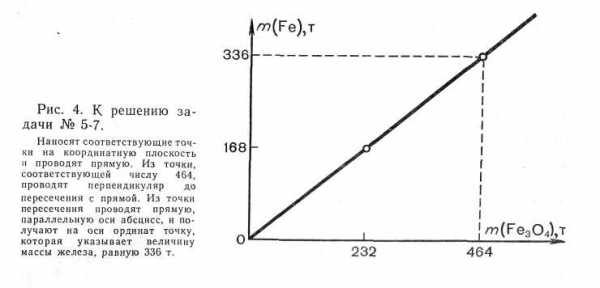
Рис.6 Зависимость массы железа от массы руды
Решение способом пропорции:
M(Fe3O4)=232 г/моль М (Fe) —56 г/моль
232г Fe3O4———– 168г Fe
464т ——————–х
232 : 464 = 168 : х
х = 464 * 168 : 232
х = 336
Ответ: 336 т Fe
9
Пример № 2Решение задач с использованием уравнения
Вычислите массу сульфата натрия, необходимую для реакции с серной кислотой, чтобы получить 16 г оксида серы (IV).
Дано: Решение:
m (SO2)=16г Na2SO3 + H2SO4 = Na2SO4 + SO2 + H2O
m (Na2SO3)-? По уравнению реакции:
M(SO2)=64 г/моль
m(SO2)=1моль*64 г/моль=64 г
M(Na2SO3)=126 г/моль – m(Na2SO3)=1моль*126г/моль=126г
Строим график согласно таблице:
т (Na2SO3)0
126
т (SO2)
0
64
Для решения задачи на оси ординат откладываем точку, соответствующую числу 16, проводим прямую, параллельную оси абсцисс, до пересечения с графиком прямой пропорциональности. Из точки пересечения опускаем перпендикуляр на ось абсцисс и получаем точку, которая указывает величину массы сульфита натрия, равную 31,5 г.
10

Рис. 7. Зависимость массы оксида серы(IV) от массы сульфата натрия.
Подобные графические способы химических расчетов широко используются на предприятиях химической промышленности при контроле технологического процесса и анализе готового продукта в химических лабораториях. При химическом анализе сырья и готового продукта используют графики функциональной зависимости для определенной химической реакции .
II. Использование графического метода при решении задач на растворы и растворимость.
Пример № 3
Какая минимальная масса воды требуется для растворения 7,5 г сульфата калия при 45 °С?
Чтобы решить такую задачу, необходимо по графику растворимости сульфата калия найти его растворимость при 45 °С (рис.9). Определяют, что в 1 л воды при 45 °С для приготовления насыщенного раствора нужно растворить 150 г K2SO4. Это первый и основной этап в решении задачи.
11
Решение:
т(K2SO4) = 7,5 г
т (Н2О) — ?
р (Н2О) = 1000 г/л
S(K2SO4) = 150 г/л


Рис.8.Зависимостьрастворимости сульфата калия от температуры
1-й способ (по алгебраической формуле)
В соответствии с определением растворимости записываем формулу
Отсюда
Подставляем значения известных величин:
m=V*p
m(h3O)=1000г/л*0.05=50г
Ответ. Для растворения 7,5 г K2SO4 минимально потребуется 50 г Н2О.
12
2-й способ (сравнение величин)7,5 г< 150 г в 20 раз, значит, воды нужно в 20 раз меньше, т.е. V(Н2О)=1 л : 20 = 0,05 л; m = Vp; т (Н2О)= 1000 г/л * 0,05 л = 50 г
3-й способ (решение пропорцией)
150 г K2 SO4 при 45 °С растворяются в 1 л Н2О,
7,5 г K2SO4 при 45 °С растворяются в х л Н2О.
Составляем пропорцию: 150:7,5=1 : х
III. Использование графического способа решения задач на смеси.
Пример № 4
При растворении в кислоте 2,33 г смеси железа и цинка было получено 896 мл водорода (при н. у.). Вычислите массу каждого из металлов, содержащихся в смеси.
Состав бинарной системы можно графически представить в виде отрезка прямой. Начало этого отрезка (точка А) соответствует содержанию в смеси одного компонента в чистом виде. Предположим, это 2,33 г цинка. Тогда конец отрезка (точка В) отвечает содержанию в смеси в чистом виде только второго компонента (в нашем примере 2,33 г железа). В направлении от точки А к точке В (рис. 10) возрастает содержание железа от 0 до 2,33 г и убывает содержание цинка от 2,33 г до 0. Таким образом, любая точка на данном отрезке будет представлять собой смесь, имеющую одну и ту же массу (2,33 г) с определенным содержанием каждого компонента, которое влияет на объем выделяющегося водорода. Отсюда объем выделившегося водорода есть функция от состава смеси.
13
Рис. 10. Состав смеси железа и цинка
Решение:
т (смеси) =2,33 г
V(H2) = 896 мл
m(Zn)—?
m(Fe)— ?
В задаче говорится о взаимодействии смеси металлов с кислотой. Значит, одновременно идут две реакции: цинка с кислотой и железа с кислотой — и при этом образуются соответствующие соли и выделяется водород, суммарный объем которого 896 мл:
Fe + 2HCl = FeCl2+ H2
Zn + 2HCl = ZnCl2 + H2
Для построения функциональной прямой нужно подсчитать объем водорода, выделяемый из кислоты каждым металлом, взятым массой 2,33 г. Для расчета целесообразно использовать алгебраическую формулу:
Определяем объем водорода, вытесненный цинком:
Определяем объем водорода, вытесненный железом:
14
Рис. 11. Зависимость объема выделившегося водорода от состава смеcи железа и цинка
На одной из осей ординат (любой) откладывают точку, соответствующую объему газа в 896 мл, и находят точку на функциональной прямой, проводя прямую, параллельную основанию графика, до пересечения с ней. Проецируя полученную точку на прямую состава смеси металлов, определяют массы металлов. В точках А и В строят ординаты, на которых откладывают объемы выделившегося водорода при взаимодействии кислоты 2,33 г цинка и 2,33 г железа. Полученные точки (804 и 932) соединяют прямой, которая отражает зависимость выделившегося объема водорода от соотношения масс металлов в 2,33 г смеси.
В рассмотренном примере масса железа — 1,68 г, а масса цинка —0,65 г (2,33 г— 1,68 г).
Ответ. В смеси было 1,68 г Fe и 0,65 г Zn.
IV. Использование графического способа при решении задач на смешивание растворов.
Еще удобнее графическим способом решать задачи на смешивание растворов. В этом случае отрезок прямой (основание графика) представляет собой массу смеси, а на осях ординат откладывают точки, соответствующие массовым долям растворенного
15
вещества в исходных растворах. Соединив прямой точки на осях ординат, получают прямую, которая отображает функциональную зависимость массовой доли растворенного вещества в смеси от массы смешанных растворов в обратной пропорциональной зависимости. Полученная функциональная прямая позволяет решать задачи по определению массы смешанных растворов и обратные, по массе смешанных растворов находить массовую долю полученной смеси.
Пример № 5
Смешаны 100 г 20%-ного раствора и 50 г 32%-ного раствора некоторого вещества. Какова массовая доля растворенного вещества в полученном растворе?
Дано: Решение:
m1 (р-ра 1) = 100 г Масса полученной смеси растворов равна 150 г – (100 г + 50 г).
т2 (р-ра 2) =50 г Строим график ( см. рис 12).
w1 =0,2, или 20% Ответ. В полученном растворе W3 = 0,24, или 24%.
w2 = 0,32, или 32%
W3 — ?
Рис.12. Зависимость массовой доли растворенного вещества от массы смесей растворов.
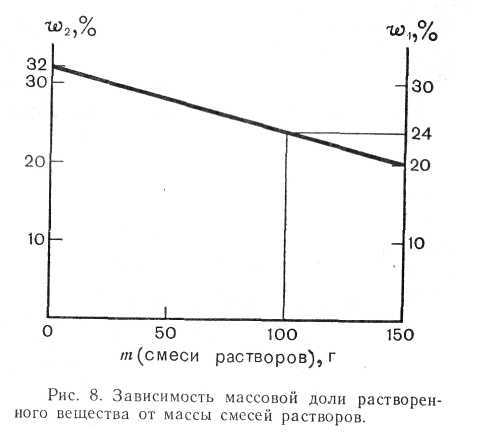
 16
16
Пример № 6
Требуется приготовить 1кг 15%-ного раствора аммиака из 25%-ного раствора. Определить массы 25%-ного раствора и воды, которые необходимо для этого взять.
Дано: Решение:
т3 (р-ра NH3) = 1 кг Строим график (см.рис.13)
W 3 (NH3) = 0,15, или 15%
m2 (25%-ного р-ра) — ?
m1 (Н2О)— ?

Рис. 13. Зависимость массовой доли аммиака от массы полученного раствора
Ответ. Нужно смешать 0,4 кг 25%-ного раствора NHз с 0,6 кг Н2О.
17
V. Использование графического способа решения задач на вывод формул веществ
Графический способ удобен и доступен учащимся для решения задач на вывод формул веществ.
Отношения индексов элементов в формуле вещества можно найти графически. Предположим, что даны b, с и d — массовые доли элементов В, С и D в веществе а, Аr (В), Аr (С) и Аr (D) — их относительные атомные массы. Зная, что массовая доля элемента в веществе определяется по формуле w=(n*Ar)/Mr, найдем значение n=(w*Mr)/Ar. Так как относительная молекулярная масса вещества не дана в условии, то отношение числа атомов соответствующих элементов выразится уравнением
Отношение массовой доли элемента к его относительной атомной массе представляют собой прямые, подобные функциональным прямым на рисунках и построенные в одной системе координат.
Таким образом, определяя отношения отрезков, находят отношения нескольких чисел:
п (В) : п (С) : п (D) =f : е : h, п(В) : n(C) : n(D)=8: 3 :2
Основной принцип решения задач на вывод химических формул следующий. При пересечении всех трех функциональных прямых произвольной линией, параллельной оси у, получим точки пересечения f, h, e. Отрезки на произвольной прямой линии, соответствуют величинам ординат: f, h, e, представляют собой отношение числа атомов: п (В) : п (С) : п (D)
Рис. 14. Принцип решения задач на вывод формул химических соединений
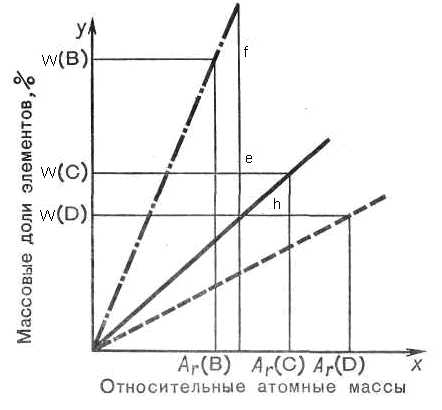 18
18
Пример № 7
Наиболее распространенный в природе фтораппатит «содержит» 42,23% оксида фосфора (V), 50,03% оксида кальция и 7,74% фторида кальция. Напишите состав этого минерала в виде формул двух солей.
w(Р2О6)
= 42,23% = 0,4223
w (СаО)
= 50,03% = 0,5003
w (CaF2)
= 7,74% = 0,774
Формула
минерала — ?
Мг (Р2О5) = 142 Мг (СаО) =56
Mr (CaF2)=78
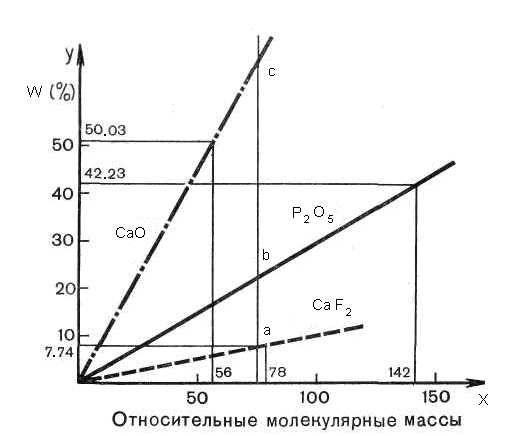 Рис. 15. Решение задачи на вывод химической формулы
Рис. 15. Решение задачи на вывод химической формулы
19
Решение:
В одной системе координат (координатной плоскости) строят три самостоятельных графика (рис. 15), выражающих соотношение между величинами относительных молекулярных масс и массовыми долями трех веществ, входящих в состав минерала фтороапатита, т. е. прямую функциональной зависимости 50,03% и 56 для СаО; 42,23% и 142 для Р2О5 и 7,74% и 78 для CaF2, учитывая во всех случаях, что если относительная молекулярная масса равна 0, то и массовая доля этого вещества в минерале равна 0, значит, все прямые начинаются в центре одной координатной плоскости.
Все три функциональные прямые пересекают произвольной прямой линией, параллельной оси у (ординат). Определяют по графику отношение точек пересечения функциональных прямых с произвольной прямой: 1:9:3 (CaF2, СаО, Р2О5).
Ответ. Формула минерала — СаF2 * 9СаО* 3Р2О5, или ЗСа3 (PO4)2 * CaF2.

20
infourok.ru
Алгоритмы решения химических задач | НООС Руководителю
Алгоритмы решения химических задач
Алгоритм 1
Вычисление массы вещества по известной массе другого
вещества, участвующего в реакции
Пример. Вычислите массу кислорода, выделившегося в результате разложения
порции воды массой 9 г.
Последовательность выполнения действий | Оформление решения задачи |
С помощью соответствующих обозначений запишем условие задачи, найдем молярные массы веществ, о которых идет речь в условии задачи | Дано: m(Н20) = 9г |
m(О2) = ? г М(Н2О) = 18 г/моль М(О2) = 32 г/моль | |
Найдем количество вещества, масса которого дана в условии задачи | Решение: n== 0.5 моль |
Запишем уравнение реакции. Расставим коэффициенты | 2Н2О = 2Н2↑+ О2↑ |
Над формулой в уравнении реакции запишем найденное значение количества вещества, а под формулами веществ — стехиометрические соотношения, отображаемые химическим уравнением | 0,5 моль ? моль 2Н2О = 2Н2 + О2 2 моль 1 моль |
Вычислим количество вещества, массу которого требуется найти. Для этого составляем пропорцию | =, откуда х = 0,25 моль. Следовательно, n(O2) = 0,25 моль |
Найдем массу вещества, которую требуется вычислить | m(O2)= n(O2)*M(O2) m(O2) = 0,25 моль • 32 г/моль = 8 г |
Запишем ответ | Ответ: m(О2) = 8 г |
Алгоритм 2
Вычисление объема вещества по известной массе
другого вещества, участвующего в реакции
Пример. Вычислите объем кислорода (н. у.), выделившегося в результате разложения порции воды массой 9 г.
Последовательность выполнения действий | Оформление решения задачи |
С помощью соответствующих обозначений запишем условие задачи, найдем молярную массу вещества, масса которого дана в условии задачи, приведем молярный объем газов | Дано: m(Н2О)=9г —————— V(02)=?л(н.у.) М(Н2О)=1 8 г/моль Vm=22,4л/моль |
Найдем количество вещества, масса которого дана в условии задачи | Решение: n(H2O)==0.5моль |
Запишем уравнение реакции. Расставим коэффициенты | 2Н2О = 2Н2 + О2 |
Над формулой в уравнении реакции запишем найденное значение количества вещества, а под формулами веществ — стехиометрические соотношения, отображаемые химическим уравнением | 0,5 моль ? моль 2Н2О = 2Н2 + О2 2 моль 1 моль |
Вычислим количество вещества, массу которого требуется найти. Для этого составим пропорцию | =, откуда х = 0,25 моль. Следовательно, n(O2) = 0,25 моль |
Найдем объем вещества, который требуется вычислить | V(02)=n(02)•Vm V(O2)=0,25моль•22,4л/моль=5,6л (н. у.) |
Запишем ответ | Ответ: V(O2)=05,6л(н. у.) |
Алгоритм 3
Расчет по химическому уравнению объемных отношений газов
Пример. Вычислите объем кислорода, необходимого для сжигания порции ацетилена объемом 50 л.
Последовательность выполнения действий | Оформление решения задачи |
С помощью соответствующих обозначений запишем условие задачи | Дано: V(С2Н2)=50 л ———- V(02)=? л |
Запишем уравнение реакции. Расставим коэффициенты | Решение: 2С2Н2 + 5О2 = 4СО2 + 2Н2О |
Над формулами веществ запишем данные об объемах газообразных веществ, известные из условия задачи, а под формулами — стехиометрические соотношения, отображаемые уравнением реакции, которые для газов, согласно закону Авогадро, равны их объемным отношениям | 50л ?л 2С2Н2 + 5О2 = 4СО2 + 2Н2О 2 моль 5 моль |
Вычислим объем вещества, который требуется найти. Для этого составим пропорцию | =,откуда х=125 л. Следовательно, V(О2)=125л. |
Запишем ответ | Ответ: V(O2) = 1 25 л |
Примечание. Необходимо заметить, что ответ является правильным, если объемы газообразных веществ рассчитаны в одних и тех же условиях.
Алгоритм 4
Вычисление относительной плотности газа по другому газу.
Пример. Вычислите плотность кислорода: а) по водороду; б) по воздуху.
Последовательность выполнения действий | Оформление решения задачи |
Найдем относительные молекулярные массы газов, о которых говорится в условии задачи | Mr(02)=32 Mr(Н2)=2 Mr(возд.)=29(условно) |
Относительная плотность газа X по газу Y равна отношению относительной молекулярной массы X к относительной молекулярной массе Y Вычислим это отношение | DH2(О2)=32/2=16 Dвозд(02)=32/29=1,103 |
Запишем ответ | Ответ:DH2(O2)=16; DВОЗД(О2)=1,103
|
Примечание. Понятие «относительная молекулярная масса воздуха» употребляется условно, так как воздух — это не индивидуальное вещество, а смесь газов.
Алгоритм 5
Вычисление массовой доли вещества в растворе
Пример. При выпаривании раствора массой 500 г образовалось 25 г кристаллической соли хлорида натрия. Вычислите массовую долю соли в исходном растворе.
Последовательность выполнения действий | Оформление решения задачи |
С помощью соответствующих обозначений запишем условие задачи | Дано: mр.ра(NaCI)=500г mв.ва(NaCI)=25г ————- w(NaCl) = ? |
Запишем формулу для расчета массовой доли вещества в растворе | Решение: w= |
Подставим цифровые значения в эту формулу и произведем расчет | w(NaCl)==0.05 |
Выразим массовую долю растворенного вещества в процентах. Для перехода от десятичной дроби к процентам умножим десятичную дробь на 100, перенеся запятую на два знака вправо | 0,05•100%=5% w(NaCl)=5 % |
Запишем ответ | Ответ: w(NaCl)=0,05, или 5% |
89
Алгоритм 6
Вычисление массы вещества в растворе по массе раствора
и массовой доле растворенного вещества
Пример. Вычислите массу гидроксида натрия, необходимого для приготовления
400 г 20%-го раствора гидроксида натрия.
Последовательность выполнения действий | Оформление решения задачи |
С помощью соответствующих обозначений запишем условие задачи. Выразим массовую долю вещества с помощью десятичной дроби (для этого значение массовой доли, выраженной в процентах, поделим на 1ОО, перенеся запятую на два знака влево) | Дано: mр.ра(NaOH)=400г wNaOH)=20%, или 0,2 ——————- mв-ва(NaOH)=?г |
Запишем формулу для расчета массовой доли вещества в растворе | Решение: w= |
Преобразуем данную формулу для расчета массы вещества | mв-ва=mр-ра•w |
Подставим цифровые данные в эту формулу и произведем расчет | mв.ва(МаОН)=400г•0,2=80 г |
Запишем ответ | Ответ: mв.ва(МаОН)=80 г |
Алгоритм 9
Расчеты по химическим уравнениям, если одно из реагирующих
веществ дано в избытке
Пример. Смешали два раствора, содержащих соответственно 33,3 г хлорида
кальция и 16,4 г фосфата натрия. Вычислите массу образовавшегося фосфата кальция.
Последовательность выполнения действий | Оформление решения задачи |
С помощью соответствующих обозначений запишем условие задачи, найдем молярные массы веществ, о которых идет речь в условии задачи
| Дано: m(СаСl2)=33,3 г m(Nа3РО4)=16,4 г ——————— m(Са3РО4)2)=? г М(СаСl2)=111 г/моль М(Nа3РО4)=164 г/моль М(Са3РО4)2)=310 г/моль |
Найдем количества веществ, масса которых дана в условии задачи | Решение: n(CaCl2)==0,3моль n(Na3PO4)==0,1моль |
Запишем уравнение реакции. Расставим коэффициенты | ЗСаСl2+2Nа3РО4=Са3(РО4)2↓+6МаС1 |
Над формулами веществ запишем данные о количествах веществ, найденных из условия задачи, а под формулами — стехиометрические соотношения, отображаемые уравнением реакции | 0,3моль 0,1 моль ?моль ЗСаСl2+2Nа3РО4=Са3(РО4)2↓+6NaCl 3моль 2моль 1моль |
Определим, какой из реагентов взят в избытке. Для этого сначала обозначим через а количество вещества одного из реагентов, оставив без изменений сведение о количестве вещества другого реагента | 0,3моль a моль ЗСаСl2+2Nа3РО4=Са3(РО4)2↓+6NaCl 3моль 2моль 3a=03•2 a=0,2 |
Распознаем, какой реагентов дан в избытке. Для этого сравним найденное значение а с количеством данного реагента по условию задачи | Для взаимодействия с 0,3 моль CaCl2 потребуется 0,2 моль Na3PO4. По условию имеем только 0,1 моль Na3PO4, что составляет недостаток по отношению к 0,3 моль CaCl2.Следовательно, CaCl2 дан в избытке. Расчет ведем по Na3PO4. |
Перепишем уравнение реакций с молярным соотношением веществ, по которым ведется расчет, обозначим реагент, данный в избытке | 0,1моль Xмоль ЗСаСl2+2Nа3РО4=Са3(РО4)2↓+6NаС1 изб. 2 моль 1 моль |
Вычислим количество вещества, массу которого требуется найти. Для этого составим пропорцию | = откуда х=0,05моль. Следовательно,n(Ca3(PO4)2)= 0,05 моль |
|
|
Найдем массу вещества, которую требуется вычислить | (Ca3(P04)2)=n(Ca3(P04)2)• •М(Са3(РО4)2) m(Са3(РО4)2)=0,05моль•310г/моль =15,5 г |
Запишем ответ | Ответ: m(Са3(РО4)2)=15,5г |
Алгоритм 10
Вычисление массы продукта реакции по известной массе
реагента, если известен выход продукта реакции
от теоретически возможного
Пример. Вычислите массу оксида серы(VI), который можно получить при окислении 160 г оксида серы(IV) кислородом, если выход продукта реакции составит 90 % от теоретически возможного.
Последовательность выполнения действий | Оформление решения задачи |
С помощью соответствующих обозначений запишем условие задачи, найдем молярные массы веществ, о которых идет речь в условии задачи | Дано: m(SO2)=160г η=90% —————– mnp(S03)=?% M(SO2)=64 г/моль M(SO3)=80 г/моль |
Найдем количество вещества исходного реагента | Решение: n(SO2)==2?5vjkm |
Запишем уравнение реакции. Расставим коэффициенты | 2SO2+О2=2SO3 |
Над формулами веществ запишем данные о количествах веществ, найденных из условия задачи, а под формулами — стехиометрические соотношения, отображаемые уравнением реакции | 2,5моль ? моль 2SO2 + O2 = 2SO3 2моль 2 моль |
Вычислим количество вещества образовавшегося продукта. Для этого составим пропорцию | =, откуда х= 2,5 моль. Следовательно, n(SO3)=2,5моль |
Найдем массу продукта реакции при 100%-м выходе продукта (теоретически возможную массу) | m(S03)=n(S03)•M(S03) mт(SO3)=2,5моль•80г/моль=200 г |
Найдем массу продукта реакции с учетом выхода (практически получаемую массу). Для этого составим пропорцию и решим уравнение | 200 г SO3 образуется при выходе 100 % а г SO3 образуется при выходе 90 %, а•100%=200•90 %, а=180г. Следовательно, mnp(SO3)=180г |
Запишем ответ | Ответ: mnp(SO3)=180г |
Алгоритм 7
Расчеты по термохимическим уравнениям.
Вычисление количества теплоты по известной массе вещества
Пример. По термохимическому уравнению
2Сu + О2 = 2СuО + 310 кДж
вычислите количество теплоты, выделяющейся в результате окисления порции
массой 16 г.
Последовательность выполнения действий | Оформление решения задачи |
С помощью соответствующих обозначений запишем условие задачи, найдем молярную массу вещества, о котором идет речь в условии задачи | Дано: mСu)=16г Qреакции=310кДж |
——————
q=? M(Cu)=64 г/моль |
|
Найдем количество вещества, масса которого дана в условии задачи | Решение: n(Cu)==0,25 моль |
Запишем термохимическое уравнение реакции | 2Сu+О2=2СuО+310кДж |
Над формулами веществ надпишем сведения о количестве вещества, найденном из условия задачи, а под формулой — соотношение, отображаемое уравнением реакции | 0,25 моль ? кДж 2Сu + О2 = 2СиО + 310 кДж 2 моль |
Вычислим количество вещества, массу которого требуется найти. Для этого составим пропорцию
| = откуда х=38,75. Следовательно, q=38,75 кДж |
Запишем ответ | Ответ: q=38,75 кДж |
director.edu54.ru
Решение задач по химии
Решение задач по химии
Химия – интересная наука, которая не терпит неточностей. В производственных и лабораторных условиях любая ошибка может привести к глобальной катастрофе, а неправильное решение задач по химии в классе, на экзаменах и контрольных, приведет к отсутствию аттестации.
Чтобы корректно выполнить любое задание по химии, нужно уметь пользоваться таблицей Менделеева, а также следует овладеть несколькими понятиями и формулами. Среди них – «количество моль», «молекулярная масса», «объем вещества» и формулы, необходимые для их расчета.
Моль – единица измерения количества вещества
Как определить количество атомов, содержащихся на конце грифеля карандаша? – Их большое количество, около тысячи. Для обозначения моль вещества в 2010 году было введено «число по договоренности», Na, равное произведению 6,02 и 1023. Число легко поддается запоминанию. Достаточно лишь знать, что каждый год химики Северной Америки отмечают «день моля». Он празднуется 23 октября между 6.02 утра и 6.02 вечера.
Молярная масса вещества
Молярная масса обозначается как Mr и представляет собой сумму атомных масс веществ. Атомные массы отдельных веществ можно узнать по периодической таблице химических элементов. Так, молярная масса воды h3O подсчитывается как Mr=1(атомная масса водорода)*2+16(атомная масса кислорода). Результат вычислений равняется 18 и выражается в граммах на моль.
Объем вещества
Объем веществ измеряется в литрах и использует закон Авогадро. Следуя этому правилу, 1 моль идеального газа имеет одинаковый объем, который соответствует 22, 413 г/моль. Таким образом, объем вещества вычисляется как n*22,4, где n – количество моль.
Путем овладения несколькими формулами можно понять основы химии. Это значит, что человек уже не будет бояться рисковать, смешивая в пробирках вещества и изготавливая растворы. В данном случае не произойдет взрыва, возгорания или выделения опасного для жизнедеятельности человека газа. Насколько это важно в условиях глобализации, решает каждый самостоятельно.
Увлекательное решение задач станет посильным занятием, когда учащийся овладеет основными понятиями предмета и периодической таблицей химических элементов Д.И.Менделеева. Кроме того, важным условием является интерес к этой науке, стремление познать новое. Только так можно использовать точную науку на благо деятельности или учебы человека.
Если материал был полезен, вы можете отправить донат или поделиться данным материалом в социальных сетях:
reshit.ru
