Типовые задачи по химии за курс 8 класса
Решение типовых задач
Моль. Молярная масса
Задача 1.
Определите кол-во в-ва атомного кислорода в оксиде меди (II) массой 159 г.
Ответ: 2моль
Задача 2.
Вычислите, какое кол-во в-ва карбоната кальция заключается в 80 г карбоната кальция.
Ответ: 0,8 моль
Задача 3.
Определите массу 3 моль нитрата кальция
Ответ: 492 г.
Задача 4.
Относительная атомная масса ртути равна 201. Определите массу одного атома ртути в граммах
Ответ: г.
Задача 5.
Вычислите, сколько молекул содержится в 34 г аммиака? Какова масса одной молекулы.
Ответ:
Химические формулы и расчеты по ним
Задача 1.
Напишите формулы соединений с водородом следующих элементов: азота, кремния, серы, брома
Задача 2.
Напишите формулы соединений с кислородом следующих элементов: Серебра(1), магния(2), фосфора(5), кремния(4), алюминия(3), марганца(7), серы(6), осмия(8)
Задача 3.
Рассчитайте массовую долю и в процентах по массе каждого элемента в сульфате аммония.
Задача 4.
Какая масса кальция потребуется для получения 148 г гидроксида кальция?
Задача 5.
Определите массовую долю кристаллизационной воды в медном купоросе?
Нахождение формулы вещества по результатам анализа
Задача 1.
Массовая доля серы в оксиде равна 40%. Определите формулу оксида.
Задача 2.
Состав оксида элемента выражается простейшей формулой ЭО2. Известно, что для получения оксида массой 22,2 г потребовался элемент массой 15,8 г. Какой элемент образует оксид?
Задача 3.
Вещество содержит 7,7% водорода и 92,3% углерода. Определите формулу этого в-ва, если его молярная масса составляет 26г/моль
Газовые законы. Молярный объем газа
Задача 1.
Какую массу будет иметь N2 объемом 60 л при н.у.?
Задача 2.
Определим массу и объем, занимаемый при н.у. молекулами кислорода
Задача 3.
Какой объем занимает при н.у. углекислый газ массой 22 г?
Задача 4.
Какой объем займет при температуре 20 и давлении 25 кПа аммиак массой 51 г.
Задача 5.
Относительная плотность галогеноводорода по воздуху равна 1,26. Определите плотность этого газа по водороду и назовите его
Задача 6.
Плотность газа по водороду 16. Определите плотность газа по воздуху
Задача 7.
Давление водяного пара при 25 составляет 3173 Па. Сколько молекул содержится в 1 мл этого пара?
Расчеты по химическим уравнениям
Задача 1.
Сколько граммов воды образуется при а) 10 г окиси мели б) 10 г CuO
Задача 2.
Определите массу брома, которая потребуется для получения бромида алюминия массой 53,4 г.
Задача 3.
Рассчитайте объем водорода, который выделится при растворении цинка массой 6,5 г в избытке соляной кислоты (н.у.)
Задача 4.
Вычислите объем оксида серы (6), который надо взять для реакции с кислородом, чтобы получить оксид серы (6) массой 20 г. Массовая доля выхода продукта равна 80%. Объем рассчитайте при н.у.
Задача 5.
Смесь медных и магниевых опилок массой 4,5 г обработали раствором соляной кислоты. В результате реакции выделился водород объемом 1,68 л (н.у.) Вычислите массовую долю меди в смеси.
Задача 6.
К раствору, содержащему 43,6 г нитрата серебра пропустили хлороводород объемом 5л. Выпавший осадок отделили, высушили и взвесили, его масса составила 29 г. Определите выход соли, выпавшей в осадок.
Задача 7.
К раствору, содержащему хлорид бария массой 41,6 г, прилили раствор, содержащий 35 г сульфата натрия. Рассчитайте массу полученного осадка.
infourok.ru
Как решать задачи по химии 8 класс
В большинстве случаев, у настоящих или бывших школьников имеются хоть какие-то теоретические представления о химических процессах. Но вот решение задачи по химии – это довольно сложная ситуация, если нет определенных навыков. А ведь химическая задача – это помощь на кухне при разведении, например, уксусной эссенции или же просто дружеская подсказка собственному сынишке или сестренке. Вспомним, как решать задачи по химии?
Обычно, в 8 классе, первые задачи с использованием уравнений химических реакций относятся к типу «Вычисление массы одного из продуктов реакции по известной массе одного из вступающих в реакцию веществ». Задача решается с помощью химических формул, потому что зачастую в заданиях ЕГЭ нужен именно такой способ.
Спонсор размещения P&G Статьи по теме “Как решать задачи по химии 8 класс” Как решать задачи по геометрии 7 класса Как решить задачу по математике по учебнику Виленкиной для 5 класса Как решить алгебру по учебнику 9 классаИнструкция
1
Задача. Вычислить массу сульфида алюминия, если в реакцию с серной кислотой вступило 2,7 г алюминия.
2
Записываем краткое условие
Дано:
m(Al) =2, 7 г
h3SO4
Найти:
m(Al2 (SO4) 3)-?
3
Перед тем как решать задачи по химии, составляем уравнение химической реакции. При взаимодействии металла с разбавленной кислотой образуется соль и выделяется газообразное вещество – водород. Расставляем коэффициенты.
2Al + 3h3SO4 = Al2 (SO4) 3 + 3h3
При решении всегда нужно обращать внимание только на вещества, для которых известны, а также необходимо найти, параметры. Все остальные в расчет не берутся. В данном случае это будут: Al и Al2 (SO4) 3
4
Находим относительные молекулярные массы этих веществ по таблице Д.И.Менделеева
Mr(Al2 (SO4) 3) =27•2(32•3+16•4•3) =342
Переводим эти значения в молярные массы (М), умножив на 1г/моль
M(Al) =27г/моль
M(Al2 (SO4) 3) =342г/моль
5
Записываем основную формулу, которая связывает между собой количество вещества (n), массу (m) и молярную массу (M).
n=m/M
Проводим расчеты по формуле
n(Al) =2,7г/27г/моль=0,1 моль
6
Составляем два соотношения. Первое соотношение составляется по уравнению на основании коэффициентов, стоящих перед формулами веществ, параметры которых даны или нужно найти.
Первое соотношение: на 2 моль Al приходится 1 моль Al2 (SO4) 3
(составляется, исходя из полученных расчетов)
Решаем пропорцию, учитывая, что Х – это количество вещества
Al2 (SO4) 3 и имеет единицу измерения моль
Отсюда
n(Al2 (SO4) 3)=0,1моль(Al)•1 моль(Al2 (SO4) 3):2моль Al=0,05 моль
7
Теперь имеется количество вещества и молярная масса Al2(SO4)3, следовательно, можно найти массу, которую выводим из основной формулы
m=nM
m(Al2 (SO4) 3)=0,05 моль•342г/моль=17,1 г
Записываем
Ответ: m(Al2 (SO4) 3)=17,1 г
8
На первый взгляд, кажется, что решать задачи по химии очень сложно, однако это не так. И чтобы проверить степень усвоения, для этого сначала попробуйте решить эту же задачу, но только самостоятельно. Затем подставьте другие значения, используя то же самое уравнение. И последним, завершающим этапом будет решение задачи по новому уравнению. И если удалось справиться, что же – вас можно поздравить!
masterotvetov.com
Решение задач по химическим уравнениям 8 класс
Решение задач по химическим уравнениям
№1 В реакцию с серной кислотой
вступило 20 г
гидроксида натрия. Рассчитайте массу образовавшейся
соли.
Дано: Решение:
m(NaOH) =20 г 1) Записываем уравнение реакции:
2NaOH + H2SO4 = Na2SO4 + 2H2OНайти: 2 моль 1 моль
m(соли)-? 2) Подчеркиваем вещества, по
которым
решаем задачу и подписываем
их
количества по уравнению реакции.
3) Определяем количество вещества NaOH
по
данным задачи:
n(NaOH) = m(NaOH):M(NaOH) = 20г :
40 г/моль = 0,5 моль
4) Составляем
соотношение количества
подчеркнутых веществ по
данным
задачи и по уравнению реакции:
0,5 моль х моль ( по данным задачи)
2NaOH + H2SO4 = Na2SO4 + 2H2O
2 моль 1 моль ( по уравнению реакции)
0,5 моль х моль
_________ = _________
2 моль 1 моль
х = 0,5 • 1 : 2 = 0,25 моль (n(Na2SO4))
m(Na2SO4) = n(Na2SO4) • M(Na2SO4)
=
0,25 моль • 142 = 35,5г
Ответ: m(Na2SO4) = 35,5г
95-element.blogspot.com
Задачи по химии 8 класса с решением
+1. Что из ниже перечисленного является смесью?
А) дистиллированная вода Б) кислород В)медь С) Сахар Д) воздух
+2. Какая из ниже перечисленных смесей гомогенна (однородна)?
А)Медные и железные опилки В)Молоко С)Туман Д)Крем Е)Столовый уксус
+3.Что из ниже перечисленного не является способом разделения смесей?
А) кристаллизация В) дистилляция С) плавление Д) фильтрование Е) центрифугирование
+4.Руда содержит пиралюзит MnО2 (массовая доля 30,4%)и манганозит MnО (массовая доля 6,3%) и не содержащие марганец примеси. Определите массовую долю марганца в руде.
А) 36,7% В) 18,35% С) 4,88% Д)24,1% Е)19,22%
+5. Смесь CuSO4 * 5 H2O и FeSO4 * 7H2O содержит 41,59% воды по массе. Рассчитайте массовую долю FeSO4 * 7H2O .
А) 50% В) 55% С) 60% Д) 65% Е)70%
+6.Минерал содержит 75% PbS. Какое количество этого минерала содержит 200 г свинца.
А) 231 В) 173 С) 308 Д)251 Е) 261
+7. Сколько атомов углерода содержится в 100 г доломита MgCO3*CaCO3 , содержащего 8% некарбонатных примесей.
А) 6,02 *1023 В) 3,01 *1023 С) 3,27*1023 Д) 6,54*1023 Е) 3,01 * 1022
+8.В избытке соляной кислоты растворили 6 г магния и 6,5 г цинка. Определите массу полученного при этом водорода.
А) 0,35 г Б)0,70 г С)1,40г Д)0,53 г Е) 1 г
+9. Какие вещества и в каком количестве получатся при сгорании 5,6 г порошка железа в 20 г паров брома.
А)0,04 моль FeBr2 , 0,06 моль FeBr3 В)0,05 моль FeBr2 , 0,05 моль FeBr3
С)0,1 моль FeBr Д) 0,1 моль FeBr2 Е)0,1 моль FeBr3
+10.На полное растворение 8 г смеси магния и алюминия требуется 196 г 20% раствора серной кислоты. Определите % содержание магния и алюминия в смеси.
А) 40% магния и 60% алюминия В) 50% и 50% С) 25% и 75% Д) 10% и 90% Е) 3% и 93%
+11. Вычислите массу 30% раствора азотной кислоты, который надо добавить к 300 г 15% раствора, чтобы получить 25% раствор.
А) 500 В) 400 С) 700 Д)800 Е)600
+ 12.Определите, какая масса 15% и какая масса 60% раствора серной кислоты потребуется для приготовления 500 30% раствора?
А) 333,33 г и 166,87г В) 233,33 и 266, 67 г С) 353,33 г и 146,67 г Д) 433,33 и 66, 67 Е)133,33 и 366, 67
+13. В сосуде смешали 18 г 10% раствора CaCl2 , 22 г 5% раствора MgCl2 , 16 г воды, 54 г 8% раствора BaCl2 . Вычислите массовые доли веществ, находящихся в растворе.
А) 1,4%, 1,2%, 3,9% В) 1,6, 1, 4,9% С) 1,6%, 1%, 3,9% Д) 1,9%, 1,5%, 3,9% Е)1,6%, 1,4%, 3,5%
+14. Что такое кристаллогидрат?
А)пересыщенные растворы веществ
В) сложные вещества с химически связанной водой
С) разбавленные растворы веществ
Д) твердая смесь воды и солей
Е) полутвердая смесь воды и солей
+15.Какую массу соли необходимо добавить к 400 г 20% раствору соли, чтобы раствор стал 25%?
А) 28 В) 26,67 С) 28,67 Д) 30 Е)24,67 г
+16.Что такое насыщенный раствор?
А) раствор вещества, в котором данное вещество больше не растворяется
В) раствор вещества, в котором возможно дальнейшее растворение
С) раствор вещества, насыщенного кислородом
Д) раствор вещества, насыщенного водой
Е) раствор вещества, в котором растворено больше возможного количества вещества
+17. Вычислите растворимость сулемы HgCl2 при 250С , если в 500 г воды при данной температуре удалось растворить 36,5 г сулемы?
А)7,3 г В) 8,4 г С)6,5 г Д) 6 г Е)5,4 г
+18. Вычислите количество вещества азотной кислоты, которая содержится в 400 мл 1,5М раствора азотной кислоты?
А) 0,5 моль В) 0,7 моль С) 0,45 моль Д) 0,333 моль Е)0, 6 моль
+19.Рассчитайте массовую долю хлорида натрия NaCl в растворе с молярной концентрацией этого вещества 2 М. Плотность такого раствора равна 1,12 г/ см3
А) 10,45% В) 10% С) 10,85% Д) 11,5% Е) 11,45%
+20.Вычислите молярную концентрацию азотной кислоты в ее 40%-ном растворе (плотность раствора – 1,1 г/ см 3)
А) 7,98М В) 6,6 М С) 6,98 М Д) 8,9 М Е) 1,9 М
+21.Вычислите массу медного купороса и массу 20%-ного раствора сульфата меди(II), необходимых для приготовления 150 г раствора сульфата меди(II) с массовой долей сульфата меди 30%?
А) 4 г и 146 г В) 48,1 г и 101,9 г С) 36 г и 114 г Д) 38,1 г и 111,9 г
Е)34,1 г и 115,9 г
Образец.Вычислите массу медного купороса и массу 10% раствора сульфата меди(II), необходимых для приготовления 200г раствора сульфата меди(II) с массовой долей сульфата меди 16%.
0,64 0,06
0,16 -конверт Пирсона; 0,64-это массовая доля CuSO4 в купоросе.
0,1 0,48
m(CuSO4*5h3O)=200 :/(0,06+0,48) *0,06=22,22г;
m(CuSO4)10%-ного р-ра = 200 :/(0,06+0,48) *0,48=177,78г;
+ 22.К 300 г 6%-ного раствора карбоната натрия добавили 30 г кристаллической соды. Вычислите массовую долю карбоната натрия в образовавшемся растворе? (кристаллическая сода-Na2CO3*10H2O)
А) 5,2% В) 6,55% С)8,4% Д) 8,82% Е) 9,73%
+23.Растворимость карбоната натрия при 20 0С составляет 21,8 г в 100 г воды, а при 40 0С-48,8 г. Вычислите массу кристаллической соды которая выпадает в осадок, если 300 г насыщенного при 40 0С раствора охладить до 20 0С.
А) 343,6 г В) 233,2 г С) 245,4 г Д) 153,2 г Е) 238 (?)
+ 24.Раствор с массовой долей нитрата серебра 82% является насыщенным при температуре 60 0С. При охлаждении этого раствора 140 г до температуры 10 0С в осадок выпала соль массой 71,2 г. Определите коэффициент растворимости нитрата серебра при температуры 10 0С.
А) 173 г В) 80 г С) 156 г Д) 220 г Е) 45,6 г
+25.К воде массой 200 г прилили раствор 2 М КСl объемом 40 мл и плотностью 1,09 г/мл. Определите молярную концентрацию и массовую долю KCl в полученном растворе, если его плотность равна 1,015 г/мл.
А) 0,456 М и 1,7% В) 0,234 М и 3,8% С) 0,25М и 1,5%
Д) 0,33 М и 2,45% Е) 0,267 М и 3,4%
Решение.
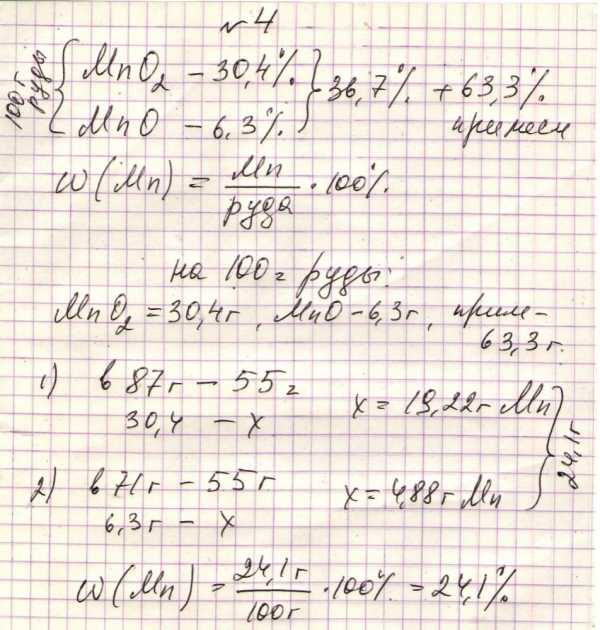
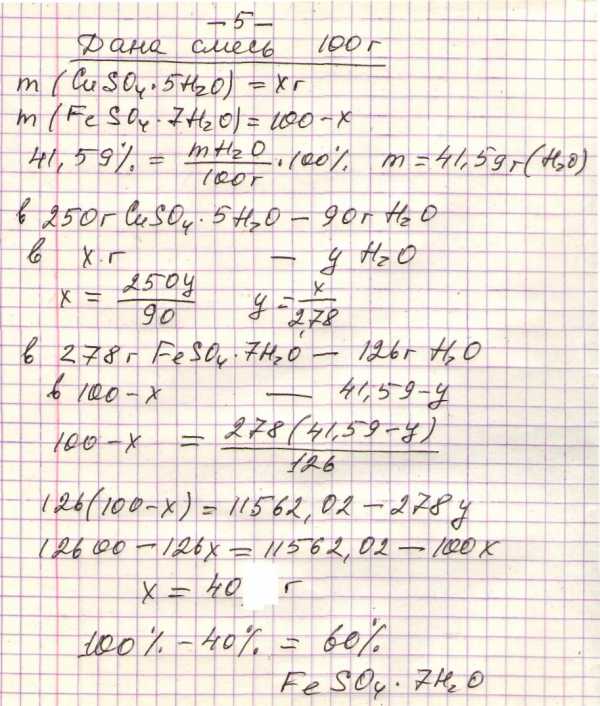












infourok.ru
Решение задач по химии с объяснением за 8 класс
Школьные знания.com это сервис в котором пользователи бесплатно «Начерти в тетради прямоугольник со сторонами 3 см и 6 см. Раскрась его третью часть и вычисли ее площадь. Нужен чертеж. Реклама. Попроси больше объяснений; Следить ? Отметить нарушение ? Пятусик 05.03.2012.
Решение задач по химии с объяснением за 8 класс
МБОУ СОШ №11 имени Г. С.Титова Щелковского муниципального района Московской области
Никогда не поздно поумнеть. Даниель Дефо
Учимся решать задачи 8 класс
Решение задач по теме: «Моль. Количество вещества».
N — количество вещества, ( моль, кмоль, ммоль)
M – масса, ( г, кг, мг)
M – молярная масса, ( г/ моль, кг/ кмоль, мг/ ммоль)
V – объем, ( л, м 3 , см 3 , мл)
V м – молярный объем ( л/ моль, м 3 / кмоль, мл/ ммоль) для любого газа при нормальных условиях (н. у.) равен 22,4 л/моль
N — число частиц (атомы, молекулы, ионы)
N А — постоянная Авогадро равна 6,02 . 10 23 частиц . моль -1
Задача 1 . Сколько молекул озона О3 содержится в 72 г его?
1) n (О3)= m / M = 72г:48г/моль=1,5моль
Задача 2. Какой объем занимают (при н. у.) 280 кг азота?
M ( N 2 ) = 14 . 2= 28 г/моль= 28кг/ кмоль
Задача 3 . Какую массу имеют 112л (при н. у.) углекислого газа?
Решите самостоятельно задачи:
1. Хлориду натрия массой 5,85 г соответствует количество вещества:
1) 1 моль ; 2) 0,5 моль ; 3) 0,1 моль ; 4 ) 0,01 моль.
2. Оксиду кальция массой 28 г соответствует количество вещества:
1) 1 моль ; 2) 0,1 моль ; 3 )2 моль ; 4) 0,5 моль.
3. Масса 0,25 моль хлорида меди ( II ) равна:
1) 64 г; 2) 24,75 г; 3) 24,875 г; 4) 33,75 г.
4. Какой объем при н. у. занимают 64г оксида серы ( IV )?
5. Какую массу имеют 3 • 10 24 молекул углекислого газа (оксида углерода ( IV ))?
6. Какую массу имеют 44,8 л при н. у. угарного газа (оксид углерода ( II ))?
7. Какой объем занимают 6 • 10 23 молекул сероводорода H 2 S?
9. Какой объем при н. у. занимают 96г озона О3?
10. Сколько молекул хлора CI 2 c одержится в 284г его?
Решение задач по химии с объяснением за 8 класс
Решение расчетных задач по химии (8 класс)
РЕШЕНИЕ РАСЧЕТНЫХ ЗАДАЧ ПО ХИМИИ (8 КЛАСС)
ИНСТРУКЦИОННАЯ КАРТА №1
№1. Задача: Какому количеству вещества соответствует 1,2*10 23 атомов кислорода?
N(O) = 1,2*10 23 атомов
N = ; Na = 6*10 23 1/моль
№2. 1 вариант: В каком количестве вещества содержится 1,8*10 23 атомов серебра?
2 вариант: В каком количестве вещества содержится 2,4*10 23 молекул воды?
№3. Задача: Сколько молекул содержится в 0,3 моль воды?
№4. 1 вариант: Сколько молекул содержится в 0,5 моль поваренной соли?
2 вариант: Сколько атомов содержится в 2 моль натрия?
РЕШЕНИЕ РАСЧЕТНЫХ ЗАДАЧ ПО ХИМИИ (8 КЛАСС)
ИНСТРУКЦИОННАЯ КАРТА №2
№1. Задача: Чему равна масса 4 моль воды?
Подсказка: m = M*n; M(h3O) = 1*2+16 = 18 г/моль
№2. 1 вариант: Сколько граммов весит 2,5 моль серной кислоты h3SO4?
2 вариант: Какова масса 5 моль углекислого газа CO2?
№3. Задача: Какое количество вещества оксида кальция CaO имеет массу 560 г?
Подсказка: n =
№4. 1 вариант: Какое количество вещества сульфида алюминия Al2S3 имеет массу 15 г?
2 вариант: Какому количеству вещества соответствует 8 г гидроксида натрия NaOH?
РЕШЕНИЕ РАСЧЕТНЫХ ЗАДАЧ ПО ХИМИИ (8 КЛАСС)
ИНСТРУКЦИОННАЯ КАРТА №3
КОЛИЧЕСТВО ВЕЩЕСТВА. МОЛЯРНАЯ МАССА.
N= N=Na*n m=M*n n=
№1. Задача. Сколько моль содержит 1,2*10 23 атомов серы? Найти массу данных атомов серы.
№2. Вариант 1. Рассчитайте количество вещества и массу 36*10 23 молекул оксида бария ВаО.
Вариант 2. Рассчитайте количество вещества и массу 0,6 *10 23 молекул фосфорной кислоты h4PO4.
№3. Задача. Сколько моль и молекул содержится в 28,4 г оксида фосфора (V) P2O5?
№4. Вариант 1. Сколько моль и молекул содержится в 12,6 г азотной кислоты HNO3?
Вариант 2. Сколько моль и молекул содержится в 26,4 г сульфида железа FeS?
№5. Задача. Найти массу 0,5 моль хлора. Сколько там содержится молекул?
№6. Вариант 1. Найти массу 0,1 моль водорода. Сколько содержится молекул в данном количестве водорода?
Вариант 2. Найти массу 0,3 моль кислорода. Сколько содержится молекул в данном количестве кислорода?
РЕШЕНИЕ РАСЧЕТНЫХ ЗАДАЧ ПО ХИМИИ (8 КЛАСС)
ИНСТРУКЦИОННАЯ КАРТА №4
№1. Задача. Какой объем (н. у.) займут а) 0,6 моль азота; б) 3 моль кислорода?
№2. Вариант 1. Какой объем (н. у.) займут 0,3 моль сероводорода?
Вариант 2. Какой объем (н. у.) займут 5 моль хлороводорода
№3. Задача. Сколько моль углекислого газа занимают объем 5,6 л (н. у.)?
Подсказка: N=
№4. Вариант 1. Сколько моль угарного газа занимают объем 89,6 л (н. у.)?
Вариант 2. Сколько моль аммиака занимают объем 11,2 л (н. у.)?
РЕШЕНИЕ РАСЧЕТНЫХ ЗАДАЧ ПО ХИМИИ (8 КЛАСС)
ИНСТРУКЦИОННАЯ КАРТА №5
МОЛЯРНАЯ МАССА. МОЛЯРНЫЙ ОБЪЕМ.
N= N=Na*n m=M*n n= V=Vm*n n=
№1. Задача. Найти количества вещества и массу: а) 6,72 л (н. у.) кислорода; б) 4,48 л (н. у.) хлора; в) 2,24 л (н. у.) водорода.
№2. Задача. Найти количество вещества и объем (н. у.): а) 6 г водорода; б) 6,4 г кислорода; в) 8,8 г углекислого газа.
№3. Задача. Найти массу и объем (н. у.): а) 0,5 моль азота; б) 2 моль углекислого газа; в) 0,3 моль кислорода.
№4. Задача. Найти количество вещества, массу и объем (н. у.): а) 12*10 23 молекул фтора; б) 3*10 23 молекул азота; в) 1,8*10 23 молекул хлора;
Решение задач по химии с объяснением за 8 класс
Как научиться решать задачи по химии 8 класс?(см.)
Например задача:Какой объем водорода (н. у.) образуется при взаимодействии соляной кислоты с 540 мг алюминия, содержащего 4% примесей? Какое количество вещества соли при этом получится? Только с объяснениями, пожалуйста ))))
Как научиться? только практикой, решаешь оду задачу, затем ещё одну подобную, и так до тех пор, пока не научишься решать моментально, едва взглянув на задачу. Потом переходишь к другому типу задач, и так далее, пока не научишься решать все типы задач. Для этого конечно нужно хорошо усвоить, что такое моль, и химические свойства различных классов соединений.
Вот, конкретно, с этой задачей.
Металлический алюминий реагирует с соляной кислотой следующим образом:
2 Al + 6 HCl ——> 2 AlCl3 + 3 h3.
Из уравнения реакции видно, что количество молей образовавшегося водорода больше количества молей израсходованного алюминия в 3/2=1,5 раза.
По условию задачи (масса алюминия задана, а ни масса ни концентрация соляной кислоты не заданы) ясно, что соляная кислота имеется в избытке, поэтому расчёт нужно вести по алюминию.
Теперь посчитаем, сколько молей алюминия. Алюминия взято 540 мг. Из них 4 %, т. е. 540*0,04=21,6 мг — примеси. Значит самого алюминия 540-21,6=518,4 мг (или 540*(1-0,04)=540*0,96=518,4 мг) или 0,5184 г. Атомная масса алюминия 27 г. Значит взято 0,5184/27=0,0192 моль алюминия. Водорода образовалось в 1,5 раза больше, т, е, 0,0192*1,5=0,0288 моль.
Из газовых законов мы знаем, что 1 моль ЛЮБОГО ИДЕАЛЬНОГО ГАЗА в нормальных условиях занимает объем 22,4 л. А в школьных химических задачах почти всегда, если не оговорено особо, газы рассматриваются (пересчитываются) в идеальных условиях.
Значит объем водорода будет 22,4*0,0288=0,64512 л или 645,12 мл.
Из 1 моля алюминия образуется 1 моль хлорида алюминия AlCl3. Молярная масса хлорида алюминия составляет 27+3*35,5=133,5 г, а из 0,0192 молей алюминия 133,5*0,0192=2,5632 г хлорида алюминия.

poiskvstavropole.ru
Решение задач по химии 8 класс
КГУ «Власовская средняя школа»
Открытый урок
по химии в 8 классе
Решение расчетных задач
Учитель химии: Литвинюк С.Н.
2014-2015уч.год
Химия 8 класс
Тема: Решение расчетных задач (2 урок)
Массовые отношения элементов. Массовая доля элемента в составе вещества. Вывод химических формул по массовым долям элементов
Цель: Совершенствовать умения решать задачи по массовым отношениям элементов сложных веществ, массовой доле элемента в составе вещества, выведение формулы вещества по массовым долям элементов.
Задачи: Образовательные: актуализировать знания и умения учащихся по теме через применение здоровьесберегающей технологии; повторить решение задач по теме; обратить их внимание на те вопросы, которые ими были недостаточно поняты, для наибольшей эффективности домашней подготовки к контрольной работе.
Развивающие: Формирование выстраивания логических цепочек, владеть химической терминологией, познавательной активности, умозаключений и суждений Воспитательные: Воспитывать интерес к предмету; активности на уроке.
Ход урока:
1.Организационный момент
Собирает нас звонок
на открытый второй урок
подравнялись тихо встали
взоры на меня подняли
улыбнитесь друг другу
садитесь
руки? На месте
ноги? на месте
локти у края
спина прямая
2.Актуализация знаний учащихся.
Сообщение темы и цели урока
А) Слови вопрос
Атом состоит из
Протоны заряжены
Электроны заряжены
Нейтроны
Заряд ядра равен
Число энергетических уровней равно
Число протонов равно
Число электронов равно
Число нейтронов равно
Изотопы – это
Ионы – это
Ионная связь – это
Ковалентная связь – это
Разновидности ковалентной связи
Электроотрицательность – это
Металлическая связь – это
Б) Валентность=хлопку
Н, Аl, Са, К, Сl Na Mg O
В) Достань задание
Назовите химические элементы, зная распределение электронов по энергетическим уровням.
2,8,7
2,8,8
2,6
2,8,1
2,4
2,8,3
2,8,8,1
2, 8,4
Г) Найди свой дом
Определите вид химической связи для следующих веществ:
Н2, Аl, К2S, H2O, НСl, О2, К, NaCl
3. Решение расчетных задач
1 тип задач Вычисление массовых отношений элементов сложных веществ
1. Вычисление массовых отношений элементов сложных веществ НNО3
Ar(H)=1 Ar(N)=14 Ar(O)=16
m(H) : m(N) : M(O)=1:14:48
2.Самостоятельно Н2S 2:32 или 1:16
Физминутка сегодня МЧС проводит учения. Мы тоже должны готовы к любой ситуации.
«Пожар» по сигналу учащиеся тушат пожар
2 тип задач Вычисление массовой доли элемента в составе сложного вещества
Как найти массовую долю элемента?
Как обозначается массовая доля элемента?
В чем выражается массовая доля элемента?
3. Массовая доля кислорода в карбонате натрия (Na2CO3)?
М(Na2CO3)=106 m(O)=48
ω(O)= 48:106=0,45=45%
4. Самостоятельно Вычислить массовую долю фосфора в оксиде Р2О5
М(Р2О5)=142 м(Р)=62 ω(Р)= 62: 142=0,44=44% устно массовую долю кислорода?
Глаза закроем
И расслабим их друзья
Обо всём забудем, но не навсегда
А теперь глаза откроем
Полной грудью все вздохнём
Что ж, немного отдохнули!
И работать вновь начнём.
3 тип задач Выведение формулы вещества по массовым долям элементов
5.Вывод формулы вещества по массовым долям элементов, входящих в его состав
Дано вещество, в состав которого входят алюминия 70% и кислород. Вывести формулу этого соединения
ω(O)= 100%-70%=30% 70:27 30:16=2,6:1,8=1,5:1=3:2 формула Аl2О3
6.Самостоятельно Выведите химическую формулу соединения, если известно, что ω(O)=60%, ω(S)= 40% M(SxOy)=80 60:16 40:32 3,75:1,25=3:1 SO3M=32+16.3=80
Дополнительно:
1. Массовая доля серы в сульфате калия (K2SO4)?
2. Что выгоднее использовать в качестве азотного удобрения: нитрат аммония (NH4NO3) или нитрат натрия (NaNO3)?
3. Из какой руды выгоднее получать железо: красного железняка (Fe2O3) или магнитного железняка (Fe3O4)? (
4. Найти формулу вещества, которое содержит 83,33% углерода и 16,67% водорода.
Домашнее задание в учебнике№1 стр 30 параграф 11
Итог урока
infourok.ru
Задания по химии для 8 класса
Инструкция по выполнению работы
Экзаменационная работа состоит из двух частей, включающих в себя 17 заданий. Часть 1 содержит 15 заданий с кратким ответом, часть 2 содержит 2 задания с развернутым ответом.
Ответы к заданиям 1-12 записываются в виде одной цифры, которая соответствует номеру правильного ответа.
Ответы к заданиям 13-15 записываются в виде последовательности цифр.
К заданиям 16-17 следует дать полный развернутый ответ, включающий в себя необходимые уравнения реакции и расчеты. Задания выполняются на отдельном листе.
Баллы, полученные за выполненные задания, суммируются.
Часть 1.
При выполнении заданий 1-15 в поле ответа запишите одну цифру, которая соответствует номеру правильного ответа.
В каком ряду химических элементов усиливаются неметаллические свойства соответствующих им простых веществ?
1)алюминий-фосфор-хлор
2)фтор-азот-углерод
3)хлор-бром-йод
4)кремний-сера-фосфор
Ответ:
В молекуле фтора химическая связь
1)ионная
2)ковалентная полярная
3)ковалентная неполярная
4)металлическая
Ответ:
В каком соединении степень окисления равна +3
1)Na3N
2)Nh4
3)Nh5Cl
4)HNO2
Ответ:
Вещества, формулы которых- ZnO,Na2SO4, являются соответственно
1)основным оксидом и кислотой
2)амфотерным гидроксидом и солью
3)амфотерным оксидом и солью
4)основным оксидом и основанием
Ответ:
Признаком протекания химической реакции между оксидом меди и водородом является
1)появление запаха
2)изменение цвета
3)выпадение осадка
4)выделение газа
Ответ:
Газ выделяется при взаимодействии
1)MgCl2 u Ba(No3)2
2)Na2CO3 u CaCl2
3)Nh5Cl u NaOH
4)CuSO4 u KOH
Ответ:
Не реагируют друг с другом
1)хлор и водород
2)кислород и кальций
3)азот и вода
4)железо и сера
Ответ:
Оксид цинка реагирует с каждым из двух веществ:
1)Na2O u h3O
2)SiO2 u Ag
3)NaOH u HCl
4)HNO3 u O2
Ответ:
В реакцию с соляной кислотой вступает
1)нитрат серебра и
2)нитрат бария
3)серебро
4)оксид кремния
Ответ:
Среди веществ NaCl, Na2S,Na2SO4- в реакцию с раствором Cu(NO3)2 вступают
1)только Na2S
2)NaCl u Na2S
3)Na2S u Na2SO4
4)NaCl u Na2SO4
Ответ:
Верны ли суждения о безопасном обращении с химическими веществами?
А. Разбитый ртутный термометр и вытекшую из него ртуть следует выбросить в мусорное ведро.
Б. Красками, содержащими соединения свинца, не рекомендуется покрывать детские игрушки и посуду.
1)верно только А
2)верно только Б
3)верны оба суждения
4)оба суждения неверны
Ответ:
Сера является окислителем в реакции
1)h3S+I2=S+2HI
2)3S+2Al=Al2S3
3)2SO2+O2=2SO3
4)S+3NO2=SO3+3NO
Ответ:
При выполнении задания 13 из предложенного перечня ответов выберите два правильных и запишите в таблицу цифр, под которыми они указаны
Общим для магния и кремния является
1)наличие трех электронных слоев в их атомах
2)существование соответствующих им простых веществ в виде двухатомных молекул
3)то, что они относятся к металлам
4)то, что значение их электроотрицательности меньше, чем у фосфора
5) образование ими высших оксидов с общей формулой ЭО2
Ответ:
При выполнении заданий 14, 15 к каждому элементу первого столбца подберите соответствующий элемент из второго столбца. Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества
Вещества реактив
А)Na2CO3 u Na2SiO3 1)CuCl2
Б)K2CO3 u Li2CO3 2)HCl
В)Na2SO4 u NaOH 3)MgO
4)K3PO4
Ответ:
Установите соответствие между названием вещества и реагентами, с которыми это вещество может взаимодействовать.
Название вещества реагенты
А)сера 1)CO2,Na2SO4(р-р)
Б)оксид цинка 2)HCl,NaOH(р-р)
В)хлорид алюминия 3)AgNO3(р-р),KOH(р-р)
4)h3SO4,O2
Часть 2
Для ответов на задания 16,17 используйте отдельный лист. Запишите сначала номер задания, а затем развернутый ответ к нему.
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
HI+h3SO4=I2+h3S+h3O
170 г раствора нитрата серебра смешали с избытком раствора хлорида натрия. Выпал осадок массой 8,61 г. Вычислите массовую долю соли в растворе нитрата серебра.
Схема оценивания экзаменационной работы по химии
Часть1
Верное выполнение каждого из заданий 1-13 оценивается 1 баллом.
За полный правильный ответ на каждое из заданий 14-15 ставится 2 балла; если допущена одна ошибка, то ответ оценивается в 1 балл. Если допущено 2 и более ошибок или ответа нет, то выставляется о баллов.
№ задания | ответ | номер задания | ответ |
1 | 1 | 11 | 2 |
2 | 3 | 12 | 2 |
3 | 4 | 13 | 14 |
4 | 3 | 14 | 241 |
5 | 2 | 15 | 423 |
6 | 3 | ||
7 | 3 | ||
8 | 3 | ||
9 | 1 | ||
10 | 1 |
Часть2
16.
Содержание верного ответа и указания по оцениванию | баллы |
Элементы ответа: 1)составлен электронный баланс 2)расставлены коэффициенты в уравнении реакции 3)Указано, что сера в степени окисления+6 является окислителем, а иод в степени окисления -1-восстановителем. | |
Ответ правильный и полный, содержит все названные выше элементы | 3 |
В ответе допущена ошибка только в одном из элементов | 2 |
В ответе допущены ошибки в двух элементах | 1 |
Все элементы ответа записаны неверно | 0 |
Максимальный балл | 3 |
17.
Содержание верного ответа и указания по оцениванию | баллы |
1)Составлено уравнение реакции AgNO3+NaCl=AgCl+NaNO3 2)Рассчитаны количество вещества и масса нитрата серебра, содержащегося в исходном растворе По уравнению реакции n(AgNO3)=n(AgCl)=m(AgCl)|M(AgCl)=8,61|143,5=0,06моль m(AgNO3)=n(AgNO3).M(AgNO3)=0,06.170=10,2г 3)Вычислена массовая доля нитрата серебра в исходном растворе: W(AgNO3)=m(AgNO3)|m(р-ра)=10,2/170=0,06или6% | |
Критерии оценивания | баллы |
Ответ правильный, полный, содержит все названные элементы | 3 |
Правильно записаны два первых элемента ответа | 2 |
Правильно записан один элемент ответа | 1 |
Все элементы ответа записаны неверно | 0 |
Максимальный балл | 3 |
multiurok.ru
