“Методика решения расчетных задач с использованием основных физических величин”
Разделы: Химия
Расчётные задачи по химии учащиеся решают с начала VIII класса и до конца обучения в школе. Решение задач позволяет:
- расширять кругозор учащихся;
- развивать умение логически мыслить;
- воспитывать самостоятельность, внимательность, умение анализировать, делать правильные выводы;
- устанавливать связь химии с другими науками: физикой, математикой, биологией, экологией и др.;
- способствует политехнической подготовке учащихся, готовиться к успешной аттестации по предмету (в том числе и в форме ЕГЭ).
Решая задачи, учащиеся более глубоко усваивают учебный материал, учатся применять приобретённые теоретические знания на практике.
Традиционная методика обучения решения химических задач (чаще всего – это решение задач методом составления пропорций) имеет ряд недостатков. В результате лишь немногие учащиеся сознательно и творчески овладевают общим подходом к решению, умеют оценивать свои действия в процессе решения, самостоятельно составлять условия задач, умеют выбирать рациональные способы решения и др.
Представленная методика обучения решения задач от общих приёмов к частным позволяет решить недостатки традиционных способов обучения. В данной работе показываются приёмы решения задач с использованием основных физических величин. Среди них величина n (или ν) – количество вещества – позволяет связать все основные физические величины друг с другом. Это даёт возможность составлять логические схемы решения задач с использованием этих физических величин
Задача учителя состоит в том, чтобы научить учащихся понимать смысл этих физических величин и применять физические формулы при решении расчётных задач различных типов, научить анализировать условия задач, через составление логической схемы решения конкретной задачи на основе знания общего подхода к решению. Составление логической схемы задачи предотвращает многие ошибки, которые допускают учащиеся.
Ниже приведены основные формулы физических величин и их взаимосвязи, которые учащиеся должны знать в обязательном порядке и использовать их при решении.
В данной работе показываются примеры решения некоторых основных типов задач, по которым можно понять методический подход при обучении учащихся.
1. Относительная атомная масса (Ar):
, где x – любой химический элемент.
2. Относительная молекулярная масса (Mr): ;
.
3. Плотность вещества (ρ) позволяет связать собой массу (m) и объем (V) вещества: .
4. Масса, объем, число частиц (N), количество теплоты (Q) связаны между собой универсальной физической величиной – количеством вещества – n(или ν):
5. Относительная плотность (D):
6. Массовая доля ω:
элемента в веществе: ; ;
примеси в веществе: ;
растворенного вещества в растворе: ; mр-ра = mр.в.+ mр-ля
mр-ра=Vр-ра· ρр-ра.
7. Объемная доля вещества в смеси (φ) (для газов): .
8. Молярная концентрация (Сm или С): .
9. Уравнение Клапейрона – Менделеева: .
Методика решения задач различных типов.
Расчеты по химическим формулам.
Решение данного типа задач начинается с осмысления понятия записи химической формулы, с осмыслением того, что учащиеся могут узнать по записи химической формулы. Рассмотрим примеры решения задач с использованием веществ только молекулярного строения. Молекулярная (истинная) формула показывает действительное число атомов каждого элемента в молекуле. В таблице №1 показано, какие сведения о веществе можно узнать по записи формулы вещества.
Таблица № 1.
Алгоритм решения базовой задачи.
- Заданный по условиям параметр переводим в количество вещества (n или ν).
- По индексам определяем количество вещества искомого химического элемента (n(х) или ν(х)).
- По формулам, отображающим взаимосвязь величин, рассчитываем неизвестный параметр.
Примеры задач
Задача 1. Рассчитайте число атомов углерода и кислорода в 11,2 л. (н.у.) углекислого газа.
Задача 2. В каком объеме углекислого газа содержится 9,03·1023 атомов кислорода?
Какова его масса?
Задача 3. Газ, плотность которого равна 1,96 г/л (н.у.), состоит из углерода и кислорода, причем ω(C) = 0,27. Определите формулу данного вещества.
Логическая схема решения задачи:
Расчёты по химическим уравнениям.
Химическими уравнениями называют условную запись химической реакции посредством химических знаков, формул и коэффициентов.
Уравнение химической реакции показывает, какие вещества вступают в реакцию и какие образуются, а также соотношение количеств этих веществ. Иными словами, химическое уравнение – это способ выражения (передачи) качественной и количественной информации о химическом явлении.
Запишем уравнение реакции в общем виде: aA + bB ® cC +dD, где А и В – исходные вещества, С и D – продукты реакции, a, b, c, d – стехиометрические коэффициенты.
Стехиометрические коэффициенты подбирают на основе того, что число атомов каждого элемента до и после реакции остается неизменным. Это можно рассматривать как следствие закона сохранения массы.
Рассмотрим информацию, содержащуюся в стехиометрических коэффициентах.
Отношение стехиометрических коэффициентов равно:
отношению числа частиц, вступивших в реакцию и образовавшихся в результате реакции
a : b : c : d = N(A) : N(B) : N(C) : N(D)
отношению молярных количеств веществ, вступивших в реакцию и образовавшихся в результате реакции a : b : c : d = n(A) : n(B) : n(C) : n(D)
отношению объемов, вступивших в реакцию и образовавшихся в результате реакции газообразных веществ a : b : c : d = V(A) : V(B) : V(C) : V(D).
Последнее отношение выполняется, если:
- это газообразные вещества, близкие по свойствам к идеальному газу,
- объемы этих газов измерены при одинаковом давлении и температуре.
Несмотря на большое разнообразие задач данного типа, принцип решения их одинаков: по известному параметру (N, m, V) одного вещества рассчитывается неизвестный параметр X (Nx, mx, Vx) другого вещества. Такая задача является простейшей (базовой).
Алгоритм решения базовой задачи (последовательность действий).
- Составляем уравнение химической реакции и выписываем мольные соотношения прореагировавших и получившихся веществ.
- По формулам, отображающим взаимосвязь физических величин, переводим заданную по условию величину в количество (n или ν) исходного вещества.
- По мольным отношениям рассчитываем n определяемого вещества (Х).
- По формулам, отображающим взаимосвязь физических величин, рассчитываем неизвестный параметр X.
Графическая схема решения базовой задачи.
В качестве базовых рассмотрим решение следующих задач:
Задача 1. Вычислите n, m, V углекислого газа, полученного при действии на 50 г карбоната кальция избытком раствора соляной кислоты.
Задача 2. При взаимодействии цинка с избытком раствора соляной кислоты выделилось 1,12 л водорода (н.у.). Вычислите массы растворившегося цинка и образовавшейся соли.
Задача 3. При взаимодействии с избытком соляной кислоты металла (валентность, которого во всех соединениях равна II) массой 12 г образовался водород объемом 6,72 л (н.у.).
Определите, какой это металл.
Усложнение базовой задачи.
Расчет массы реагирующих или образующихся химических соединений на практике осложнен. Это обусловлено несколькими причинами:
- Исходные вещества или продукты реакции задаются в условиях отличных от нормальных.
- Исходные вещества вводятся в виде растворов.
- Во многих случаях реагенты содержат примеси, которые в данной конкретной реакции либо не участвуют вообще, либо образуют отличные от целевого продукта вещества.
- Выход продуктов не соответствует теоретическому, т.к. очистка целевого вещества приводит не только к освобождению от многочисленных примесей, но и к частичной потери основного вещества.
Таким образом, перед использованием исходных данных для решения задачи и подстановки их в основную цепь расчетов необходимо провести те или иные дополнительные преобразования. Для перевода условий, отличных от нормальных (для газообразных веществ) используется исходная формула 9 – расчеты физико-химических величин по управлению Клапейрона – Менделеева.
1. Исходные вещества вводятся в виде раствора.
Задача. Сколько граммов 10%-ного раствора гидроксида натрия требуется для нейтрализации
20 г 4,9%-нго раствора серной кислоты?
2. Расчет количественных параметров продуктов реакции, если исходные вещества содержат примеси, расчет массовой доли примеси.
Абсолютно чистого вещества в природе не бывает, поэтому в химических производствах вынуждены использовать исходные вещества, содержащие примеси. Эти примеси обычно имеют отличные от основного вещества свойства и, поэтому не образуют в процессе производства нужные продукты.
В связи с этим, чтобы определить количественные параметры получаемого продукта, необходимо вначале рассчитать количественные параметры вступающего в реакцию чистого вещества, которое содержится в исходном объекте. После этого решается базовая задача.
Обратные задачи заключаются в оценке чистоты исходных веществ по количеству продуктов реакции.
Содержание примеси обычно выражают в частях от единицы (или выражают в %). Эта величина показывает массовую долю чистого вещества (примеси) в исходном образе (формула 1).
Для вычисления массы чистого вещества (или примесей), содержащегося в смеси, используют формулу 2.
(1)
m(смеси) = m(осн.в.) + m(прим.) (2)
Задача. При взаимодействии 10,8 г кальцинированной соды (безводный карбонат натрия)
с избытком раствора соляной кислоты получили 2,24 л (н.у.) оксида углерода (IV).
Вычислите содержание примеси в соде.
3. Расчеты по химическим уравнениям, если одно из реагирующих веществ дано в избытке.
Как быть, если одновременно заданы параметры нескольких реагирующих веществ? По какому из них вести расчет? Это определяют, сравнения отношения стехиометрических коэффициентов и отношение количеств вещества, взятых для данной реакции.
Если один из реагентов присутствует в количестве больше, чем стехиометрическое, то часть его остается неиспользованной после окончания реакции (избыток вещества). Очевидно, что расчеты нужно вести по веществу, которое в данной реакции расходуется полностью (т.е. находится в недостатке).
Задача. В реакционном сосуде смешали 6,72 л оксида углерода (II) и 2,24 л кислорода и смесь подожгли. Определите объемный состав полученной смеси.
Используемая литература:
- Кузнецова Н.Е., Лёвкин А.Н. Задачники по химии для учащихся 8 и 9 классов общеобразовательных учреждений. М.: Вентана-Граф, 2008.
- Лидин Р.А., Аликберова Л.Ю. Химия: Справочник для старшеклассников и поступающих в вузы – М.: АСТ-ПРЕСС ШКОЛА, 2002.
- Лидин Р.А., Аликберова Л.Ю. Задачи, вопросы и упражнения по химии: 8-11 кл.: Пособие для учащихся общеобразовательных учреждений. – М.: Просвещение, 2002.
xn--i1abbnckbmcl9fb.xn--p1ai
Как решить задачи по химии?
Химия это интересный, но сложный предмет. Учить химию по теории это бесполезно и не интересно. Для того, чтобы химия нравилась, необходимо проводить эксперименты и решать задачи. Если с проведением экспериментов все согласны, то вот задачи не всем по плечу. Но ведь это явная необходимость иллюстрировать на бумаге химические реакции, которые происходят между субстанциями и их результат. Что нужно для того, чтобы легко решать задачи по химии? Для начала необходимо проникнуться любовью к предмету, пытаться его понять, ну а также постоянно практиковаться. Химию легко полюбить, если любую часть теории показать на практике экспериментом, или еще как-то. Теория и практика в совмещении дают отличные результаты по усвоению материала. Но вернемся к задачкам по химии.
Один из способов научится решить задачи по химии это постоянно тренироваться. И не обязательно заниматься решением задач, достаточно просто «переваривать» готовые задачи. Решение задач по химии проще с такими помощниками как http://www.himzadachi.ru, например. Видеокурс по химии сделает так, чтобы задачи по химии были для вас понятным материалом, а не шок от неизвестности и боязни, что вы эту задачу никак не решите.
Практика показала, что изучение готовых примеров задач позволяет научиться понять, как это делается, и даже запомнить весь алгоритм. Важно ведь не только дойти до правильного результата, а еще и пользоваться правильным алгоритмом, чтобы вашу работу оценили по достоинству.
Необходимо научится разделять задачки по типу задач и выбрать соответствующий алгоритм для решения. Для этого нужно знать также виды алгоритмов и уметь ориентироваться в его правильном выборе. Учтите тот факт, что более сложные задачи могут потребовать совмещение техник и метод решения, а уж тут вам поможет не теория, а практика.
Простые правила решения задач по химии:
– Обязательно прочтите условия задачи вслух и вникайте в смысл задачи.
– Записывайте известные данные, то есть, то, что дано.
– Определите единицы измерения и доведите до единиц из системы СИ.
– Записать химическую реакцию при необходимости, уровнять реакцию и добавить нужные коэффициенты.
– Записывайте ответ.
– Проверьте правильность ответа, если есть такая возможность.
Если материал был полезен, вы можете отправить донат или поделиться данным материалом в социальных сетях:
reshit.ru
Готовые решения:
| Статистика Онлайн всего: 14 Гостей: 14 Пользователей: 0 | |||||||||
reshchem.ucoz.ru
Алгоритмы решения расчётных задач по химии
Алгоритм решения расчётных задач
Внимательно прочитайте условие задачи.
Слева, запишите слово «Дано», а под ним кратко данные задачи и что необходимо найти.
Правее запишите слово «Решение», и производите все остальные записи и расчёты под ним:
а)
в уравнении одной чертой подчёркните химические формулы веществ, данные которых (m, V, ) указаны в условиях задачи, а двумя чертами – формулы тех веществ, данные которых требуется вычислить;
по уравнению реакции определите: количество (моль) тех веществ, формулы которых подчёркнуты (одной или двумя чертами). Коэффициент, стоящий перед формулами подчёркнутых (в данном случае) веществ, будет показывать количества данных веществ (): Mr , M, V, Vm;
найденные значения запишите под соответствующими химическими формулами;
б) запишите расчётные формулы, необходимые для решения данной задачи;
в) произведите расчёты;
4. Запишите ответ.
I. Вывод химической формулы
1. Нахождение химической формулы вещества по массовым долям элементов.
Задача 1. Элементарный состав вещества следующий: массовая доля элемента железа 0,7241 (или 72,41 %), массовая доля кислорода 0,2759 (или 27,59 %). Выведите химическую формулу.
2. Нахождение химической формулы по отношению масс элементов, входящих в состав данного вещества.
Задача 2. Найдите химическую формулу вещества, в состав которого входит 9 массовых частей алюминия и 8 массовых частей кислорода.
Задача 3. В состав вещества входят 30,7 % калия, 25,2 % серы, 44 % кислорода. Вывести формулу этого соединения.
Задача 4. Подвергнув анализу вещество, установили, что в его состав входят: натрий с массовой долей 0,4207 (или 42,07 %), фосфор с массовой долей 0,1891 (или 18,91 %), кислород с массовой долей 0,3902 (или 39,02 %). Найдите форму соединения.
II. Расчёты по химическим формулам
Вычисление относительной молекулярной массы вещества Мr.
Задача 1. Найдите относительную молекулярную массу сульфата натрия Na2SO4.
2. Нахождение отношения масс элементов по химической формуле сложного вещества.
Задача 2. Найдите отношение масс элементов в гидроксиде кальция.
3. Нахождение содержания массовых долей элементов в сложном веществе.
Задача 3. Вычислите массовые доли элементов в гидроксиде натрия.
4. Нахождение массы элемента по известной массе сложного вещества.
Задача 4. Вычислите, сколько фосфора содержится в 10 т фосфата кальция Ca3(PO4)2.
5. Нахождение массы сложного вещества по заданной массе элемента.
Задача 5. В какой массе оксида меди (II) содержится 3,2 т меди?
III. Расчёты с использованием понятия «моль».
1. Вычисление количества вещества, соответствующего определённой массе вещества.
Задача 1. Какое количество вещества составляют 66 г оксида углерода (IV)?
Задача 2. В результате реакции получено 22 г сульфата железа (II). Какое количество сульфата железа (II) соответствует этой массе?
2. Вычисление массы вещества по известному числу молей вещества.
Задача3. Дано 2 моль серной кислоты. Вычислите массу серной кислоты.
Задача 4. В реакции с серой взаимодействует 0,5 моль железа. Определите массу железа, которую следует взять для реакции.
3. Вычисление числа атомов и молекул, содержащихся в определённой массе вещества.
Задача 5. Сколько молекул содержится в 36 г воды?
IV. Расчёты, связанные с использованием плотностей, относительных плотностей и молярного объёма газов
1. Нахождение плотности и относительной плотности газа по химической формуле данного газа.
Задача 1. Вычислите плотность и относительные плотности оксида углерода (IV) по водороду, метану, воздуху.
Вычисление объёма определённой массы газообразного вещества при н.у.
Задача 2. Какой объём занимают 48 г кислорода?
3. Вычисление массы газообразного вещества, занимающего определённый объём.
Задача 3. Вычислите массу газовой смеси, состоящей из 5,6 м3 метана и 2,24 м3 оксида углерода (II).
4. Вычисление массы вещества по уравнениям химических реакций, в которых участвуют или образуются газы.
Задача 4. Какой объём кислорода и воздуха потребуется, чтобы сжечь 224 м3 оксида углерода (II), если содержание в нём негорючих примесей в объёмных долях равно 0,25 (или 25 %).
Дано: Решение:
V (СО) = 224 м3 1) Вычисляем, сколько чистого оксида углерода (II) содержится в смеси
(прим.) = 25 % 100 % – 25 % = 75 % (чистого СО)
Найти: в 100 м3 смеси содержится 75 м3 СО
V (O2) -? в 224 м3 —————– x м3; x = 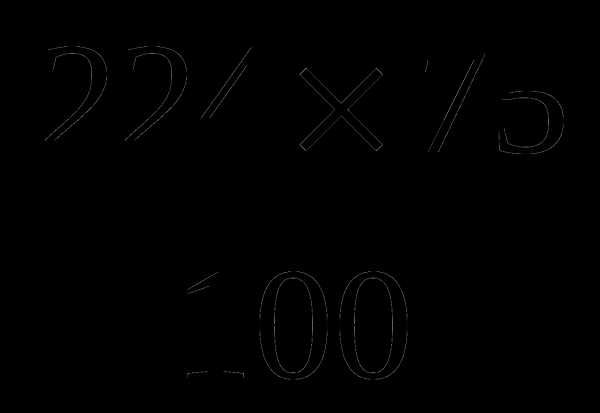 =168 (м3) – V(CO)
=168 (м3) – V(CO)
V (возд.) -? 2) Определяем, какой объём кислорода потребуется, чтобы сжечь 168 м3 оксида углерода (II).
Запишем уравнение химической реакции, расставим коэффициенты:
168 м3 у м3
2 СО + О2 = 2СО2
2 моль 1 моль
Vm 22,4 м3/моль
V (CO) = 2 22,4 =44,8 (м3) V (O2) = 122,4 = 22,4 (м3)
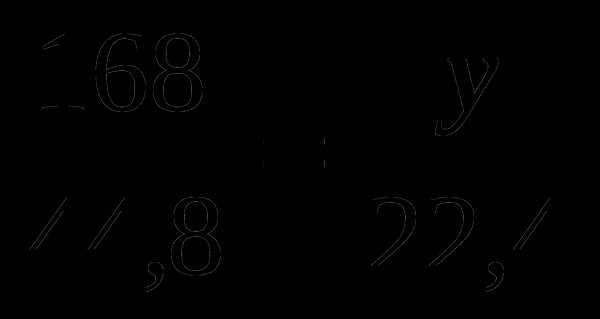 ; y =
; y =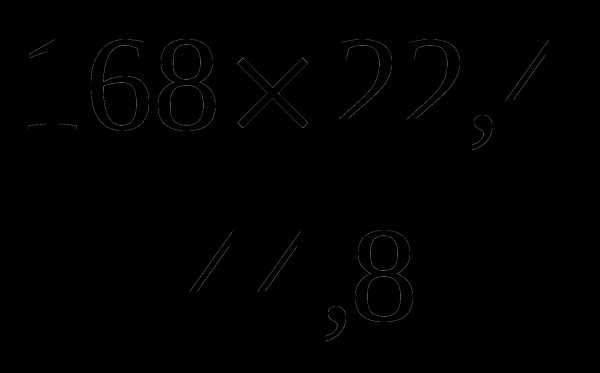 = 84 V (O2) = 84 м3
= 84 V (O2) = 84 м3
3) Находим объём воздуха, необходимый для реакции.
Воздух содержит 0,209 объёмных долей (или20,9 %) кислорода. Отсюда следует:
100 м3 воздуха содержит 20,9 м3 кислорода
z м3 ———————— 84 м3 кислорода
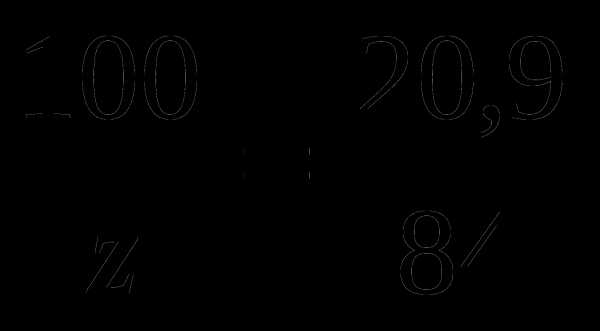 ; z =
; z = 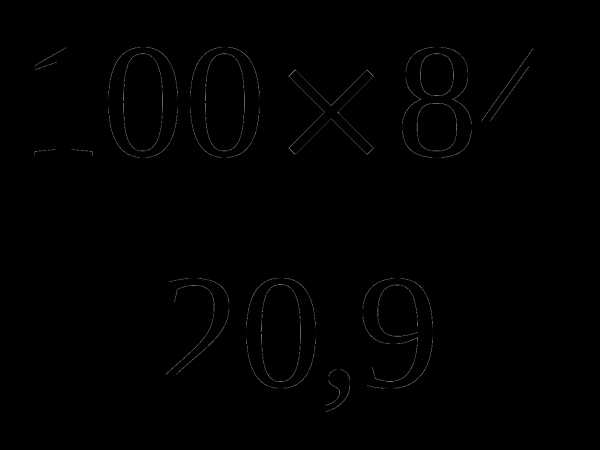 = 401,9 (м3) – V (возд.)
= 401,9 (м3) – V (возд.)
Ответ: 84 м3 кислорода; 401,9 м3 воздуха.
Задача 5. Сколько граммов воды образуется при взрыве смеси 2 г водорода и 20 г кислорода.
V. Расчёты, связанные с определением массовой доли растворённого вещества в растворе
1. Вычисление массы растворённого вещества и растворителя, если известны массовая доля растворённого вещества и масса раствора.
Задача 1. Вычислите массу хлорида натрия и воды, необходимых для приготовления 500 г раствора, в котором содержание хлорида натрия в массовых долях равно 0,05.
Задача 2. Какой объём хлороводорода (н.у.) и воды потребуется, чтобы приготовить 1 л раствора ( = 1,05 г/см3), в котором содержание хлороводорода равно 10 %?
Задача 3. Вычислите массовую долю растворённого вещества в растворе массой 5 кг, содержащем растворённое вещество массой 1 кг.
2. Вычисления, связанные с разбавлением растворов.
Задача 4. Какой объём раствора ( = 1,80 г/см3), в котором содержание H2SO4 в массовых долях равно 0,88, потребуется, чтобы приготовить 1 л раствора, содержащем 10 % серной кислоты ( = 1,069 г/см3)?
Задача 5. Какой объём воды потребуется для разбавления 200 мл раствора ( = 1,4 г/см3), содержание азотной кислоты в котором составляет 68 %, чтобы получить раствор с содержанием азотной кислоты, равным 10 %?
VI. Расчёты по уравнениям химических реакций
При решении задач по уравнениям химических реакций рекомендуется соблюдать указанную ниже последовательность:
Если вещества даны с примесями, то сначала вычислите массу чистого вещества, содержащегося в примеси.
Составьте уравнение соответствующей химической реакции.
В уравнении одной чертой подчёркните химические формулы веществ, данные которых (m, V, ) указаны в условиях задачи, а двумя чертами – формулы тех веществ, данные которых требуется вычислить.
По уравнению реакции определите: количество (моль) тех веществ, формулы которых подчёркнуты (одной или двумя чертами). Коэффициент, стоящий перед формулами подчёркнутых (в данном случае) веществ, будет показывать количества данных веществ (): Mr , M, V, Vm .
Найденные значения запишите под соответствующими химическими формулами и произведите вычисления (составив пропорцию).
Запишите ответ.
Задача 1. Какова масса воды, которая образовалась при сгорании 8 г водорода?
Дано: Решение:
m (Н2) = 8 г m = M 8 г x г
2 H2 + O2 = 2 H2O
2 моль 2 моль
Найти: Mr 2 18
m(H2O) – ? M 2 г/моль 18 г/моль
m 2 г/моль 2 моль 18 г/моль 2 моль
По уравнению реакции:
из 4 г Н2 образуется 36 г Н2О,
а из 8 г —————- x г
Составим пропорцию
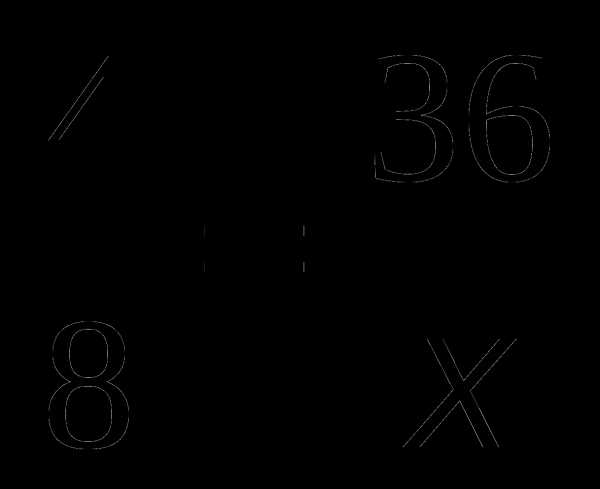 ;
; 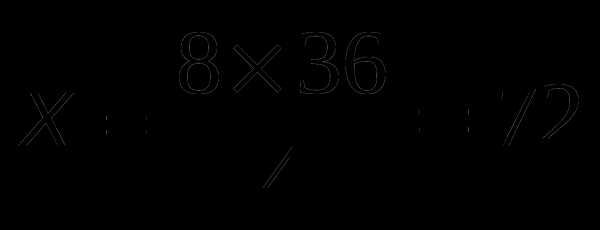 (г)
(г)
Ответ: m(H2O) = 72 г.
Задача 2. Какая масса гидроксида натрия образуется при взаимодействии 2,3 г натрия с водой?
Задача 3. Титан в промышленности получают магний – термическим методом:
Ti Cl4 + 2 Mg = Ti + 2 MgCl2
Сколько магния надо взять, чтобы из хлорида титана (IV) получить 9,6 кг титана?
Задача 4. Рассчитайте объём водорода, который выделится при растворении алюминия массой 10,8 г в избытке соляной кислоты (нормальные условия).
Задача 5. Смесь медных и магниевых опилок массой 1,5 г обработали избытком соляной кислоты. В результате реакции выделился водород объёмом 0,56 л (н.у.). Вычислите массовую долю меди в смеси.
VII. Расчёты по термохимическим уравнениям
1. Вычисление на основе термохимического уравнения количества поглощённой теплоты по известной массе одного из реагирующих веществ.
Задача 1. S + O2 = SO2 + 297 кДж
Вычислите по термохимическому уравнению количество теплоты, выделяемой при сгорании 1 кг серы.
Задача 2. Термохимическое уравнение реакции разложения известняка:
СаСО3 = СаО + СО2 – 157 кДж
Сколько теплоты затрачивается на разложение 1 кг известняка?
Задача 3. Термохимическое уравнение реакции ацетилена:
2 С2Н2 + 5 О2 = 4 СО2 + 2 Н2О + 2610 кДж
Сколько теплоты выделится, если будет израсходовано: а) 1 моль ацетилена; б) 13 г ацетилена; в) 1,12 л ацетилена?
2.Нахождение масс реагирующих веществ, если известно, какое количество теплоты выделилось в данной реакции.
Задача 4. По термохимическому уравнению реакции:
С + О2 = СО2 + 402,24 кДж
вычислите, сколько сгорело угля, если при реакции выделилось 33520 кДж теплоты.
Задача 5. Термохимическое уравнение реакции оксида меди (II) с соляной кислотой:
CuO + 2 HCl = CuCl2 + H2O + 63,6 кДж
Сколько теплоты выделится при растворении 200 г оксида меди в соляной кислоте?
VIII. Расчёты, связанные с понятием «избыток – недостаток»
Задача 1. К раствору, содержащему нитрат кальция массой 8,2 г, прилили раствор, содержащий карбонат натрия массой 6,36 г. Рассчитайте массу полученного оксида.
Задача 2. Для образования хлорида аммония было взято 11,2 л (н.у.) газообразного аммиака и 11,4 л (н.у.) хлороводорода. Какова масса образовавшегося продукта реакции?
Задача 3. 10,7 г хлорида аммония смешали с 6 г гидроксида кальция и смесь нагрели. Какой газ и сколько его по массе и объёму (н.у.) выделилось?
Задача 4. К 300 г раствора, содержащего 0,1 массовых долей гидроксида калия, прилили 400 г раствора, содержащего 0,1 массовых долей азотной кислоты. Сколько граммов соли образовалось?
Задача 5. К раствору, содержащему 40 г сульфата меди (II), прибавили 12 г железных опилок. Рассчитайте, останется ли в растворе сульфата меди после того, как закончится реакция.
IX. Расчёты, связанные с понятием «выход»
Алгоритм решения задач на выход продукта от теоретически возможного выхода
1) Прочитай внимательно условие задачи
2) Запиши: «Дано» и что «Найти».
!!! Если в условии задачи есть слова «получилось», «образовалось», то это практически полученное количество и масса.
3) Составьте уравнение реакции (не забудь расставить коэффициенты).
4) Помни: то, что считаем по уравнению – это теоретическое количество и масса.
5) Если выход продукта дан, то находим:
– по уравнению реакции количество, массу или объём теоретический;
– затем по формуле массу или объём практический.
6) Если дана масса или объём практический, то находим:
– по уравнению количество, массу или объём теоретический;
– затем по формуле массовую или объёмную долю выхода продукта реакции.
ω вых = m (практич.) или ω вых = V (практич.)
m (теоретич.) V (теоретич.)
Задача 1. Вычислите объём оксида серы (IV), который надо взять для реакции с кислородом, чтобы получить оксид серы (VI) массой 20 г. Массовая доля выхода продукта равна 80 %. Объём рассчитайте при нормальных условиях.
Задача 2. Сколько ортофосфорной кислоты можно получить из 31 тонны ортофосфата кальция, если выход кислоты составляет 80 % по сравнению с теоретическим?
Задача 3. Сколько граммов аммиака можно получить, нагревая смесь 20 г хлорида аммония с 20 г оксида кальция, приняв, что выход составляет 98 % от теоретического?
Задача 4. Титан в промышленности получают магний – термическим методом:
Ti Cl4 + 2 Mg = Ti + 2 MgCl2
Сколько граммов титана можно получить из хлорида титана (IV) массой 9,6 г, если выход от теоретического составляет 95 %?
Задача 5. Сколько азотной кислоты можно получить из 14 т аммиака, если выход кислоты составляет 87 % по сравнению с теоретическим?
infourok.ru
Курс “Решение расчётных задач по химии”
Вычисления по формулам веществ
Тема: Вычисление относительной молекулярной массы веществ, отношения масс атомов элементов в сложном веществе по его формуле.
Цели: Знать понятия формула вещества, атомная единица массы, относительная атомная масса, относительная молекулярная масса вещества, закон постоянства состава вещества.
Уметь вычислять относительную молекулярную массу вещества, отношения масс атомов элементов в сложном веществе по его формуле.
План
- Повторение основных понятий.
Что такое формула вещества?
Что такое атомная единица массы?
Что такое относительная атомная масса?
Вспомните формулировку закона постоянства состава вещества.
- Формула вещества – это условная запись состава вещества при помощи химических знаков и если необходимо индексов.
Н2О – формула воды, из неё видно, что молекула воды состоит из двух атомов водорода и одного атома кислорода.
- Абсолютная масса атома – масса атома, выраженная в граммах (или килограммах).
Масса атома кислорода равна 0,000000000000000000000026667 г (после запятой 22 нуля)
- Абсолютная масса молекулы – масса молекулы, выраженная в граммах (или килограммах).
Данные значения ничтожно малы ими пользоваться не удобно, поэтому были введены относительные величины, они показывают во сколько раз масса химического элемента больше 1/12 массы атома углерода с массовым числом 12 а.е.м. (это безразмерная величина, число)
- Атомная единица массы (а.е.м.) – одна двенадцатая часть массы атома изотопа углерода 12С (1 а.е.м. =1,66 *10-24……)
- Относительная атомная масса – это отношение усредненной массы естественной смеси изотопов, атомов химического элемента к атомной единице массы (одной двенадцатой части массы атомов изотопа углерода 12С)
Значения относительных атомных масс приведены в ПСХЭ Д.И. Менделеева под знаком химического элемента, например: m(C =12)
Зная относительную атомную массу элементов входящих в состав вещества можно вычислить относительную молекулярную массу данного вещества.
- Относительная молекулярная масса – сумма всех относительных атомных масс входящих в молекулу атомов химических элементов.
Мr = Аr1 * i1+ Ar2* i2+ Аr3 * i3…
Где Мr – относительная молекулярная масса вещества
Аr1 , Ar2, Аr3 … – относительные атомные массы элементов входящих в состав этого вещества
i1, i2, i3… – индексы при химических знаках химических элементов.
Например: Вычислим относительную молекулярную массу гидроксида кальция Ca(OH)2
Мr ( Ca(OH)2 )= Аr (Ca) *1+ Ar(O)* 2+ Аr(H) *2
Аr (Ca) =40
Ar(O)=16
Аr(H)=1 => Мr (Ca(OH)2)= 40*1 + 16*2 +1*2 = 74 или =>
Мr (Ca(OH)2 )= 40*1 + (16 +1)*2 = 74
Задание 1: Вычислите, относительны молекулярные массы следующих веществ: AL(OH)3; Cu(OH)2
Fe(OH)2 ; Rb2CO3; NaCl; HNO3
Французский ученый Ж. Пруст (1754-1826), работая в прекрасно оборудованной лаборатории в
Мадридском университете, исследовал количественный состав солей олова, меди, железа, никеля, сурьмы, кобольта, серебра и золота (1799-1806) и пришел к выводу: “Соединение есть привилегированный продукт, которому природа дала постоянный состав. Природа, даже через
посредство людей, не производит соединения иначе, как с весами в руках, – по мере и весу. От одного полюса Земли к другому соединения имеют тождественный состав. Никакой разницы мы не видим между окисью железа южного полушария и северного; японская киноварь имеет тот же состав, как испанская киноварь; хлористое серебро совершенно тождественно, происходит ли оно из Перу или из Сибири; во всем мире имеется только один хлористый натрий, одна селитра,одна сернокальциевая соль, одна сернобариевая соль. Анализ подтверждает эти факты на каждом шагу”.
Сейчас Закон постоянства состава формулируется так:
- “Каждое индивидуальное химическое вещество имеет постоянный качественный и количественный состав и определенное химическое строение независимо от способа его получения”.
Этот Закон утверждался Ж. Прустом в жесткой борьбе с соотечественником, признанным авторитетом того времени в химии – К. Бертолле (1748-1822). Научная дискуссия помогла химикам четко осознать различие между понятиями “соединение” и “смесь”.
Смеси веществ действительно могут иметь переменный состав. Изучая соотношения между азотом и кислородом в различных окислах азота, английский ученый (физик и химик) Джон Дальтон (1766-1844) пришел к выводу, который и составил основное содержание Закона кратных отношений:
- “Если два химических элемента дают несколько соединений, то весовые доли одного и того же элемента в этих соединениях, приходящиеся на одну и ту же весовую долю второго элемента, относятся между собой как небольшие целые числа”.
Пусть у нас имеются данные о процентном содержании азота и кислорода в трех оксидах: N2O, NO и NO2. Рассчитаем, сколько весовых частей кислорода приходится на одну весовую часть азота в этих соединениях: в N2O это 16/28, в NO -16/14 или 32/28 и в NO2 – 32/14 или 64/28. Между собой эти величины относятся как 1:2:4. Можно было бы таким же образом рассчитать весовые части азота, приходящиеся на одну весовую часть кислорода в этих окислах. Взяв их отношения, мы получим 4:2:1. Используя данные о процентном содержании углерода и кислорода в окислах CO и CO2, легко получить, что отношения весовых частей кислорода, приходящиеся на одну весовую часть углерода в этих оксидах, равно 1:2. Самое простое и естественное объяснение этим фактам дала атомная теория. Так как важнейшие исходные данные – процентное содержание химических элементов в рассматриваемых соединениях – были получены на основе химического анализа, а выводы касались атомного строения химических соединений, то все это учение получило название химической атомистики.
Основные положения этой теории Д. Дальтон сформулировал так :
1) материя состоит из мельчайших первичных частиц или атомов;
2) атомы неделимы и не могут создаваться или разрушаться;
3) все атомы данного элемента одинаковы и имеют один и тот же неизменный вес;
4) атомы разных элементов обладают различным весом;
5) частица или соединение сформированы из определенного числа атомов химических элементов составляющих их;
6) вес сложной частицы представляет собой сумму весов составляющих ее атомов”.
Д. Дальтон предложил первые химические формулы для некоторых простейших химических соединений. Не имея экспериментальных данных о числе атомов в молекуле, Д. Дальтон
был вынужден принять простейшие, как он считал, отношения, что в молекуле воды на один атом водорода приходится один атом кислорода, в аммиаке на один атом азота
приходится один атом водорода.
Д. Дальтон рассчитал относительные атомные веса для некоторых элементов, приняв атомный вес водорода за единицу.
Задание 2: Определите массовые отношения атомов в молекулах веществ:
Серная кислота, сульфид железа (II), оксид кальция, сульфат меди(II), оксид серы (IV) , оксид серы (VI).
Выполни тест, проверь усвоение материала, если тебя не удовлетворят результаты, ещё раз прочитай лекцию.
Успехов.
Тест:
Выберите правильный ответ .
Масса вещества формула которого равна:
- CaCO3 ;
- 68 ;
- 100;
- 90;
- 88
- Mg(NO3)2;
- 54
- 148
- 86
- 564
- CuSO4;
- 160
- 112
- 128
- 88
- Na2CO3;
- 51
- 74
- 106
- 92
- AlCl3;
- 62
- 48
- 133,5
- 205
- Выберите правильный овет: Массовые отношения химических элементов в формулах веществ равны:
А)CuSO4;
- 64 : 32: 64
- 2: 1 : 2
- 16: 8: 16
- 4: 2: 4 1.
Б)CaCO3
- 10: 3: 12
- 40: 12: 48
- 40: 12: 16
- 10: 3: 4
nsportal.ru
Решение типовых задач по химии.doc – Решение типовых задач по химии
3.15. Оксид диазота (“веселящий газ”), обладающий слабонаркотическим действием был
открыт английским химиком Гемфри Дэви в начале XIX века. Для получения N2O Дэви
использовал реакцию термического разложения нитрата аммония. При этом, помимо
основных продуктов разложения, образуются и другие газы (например, NO и NO2).
Рассчитайте практический выход оксида диазота, если масса нитрата аммония была равна
11,5 г, а объем полученного N2O 2,1 л (при н.у.).
3.16. Установлено, что для очистки газовых выбросов от диоксида азота применяется
карбонат натрия, который при взаимодействии с NO2 дает нитрат натрия, нитрит натрия и
углекислый газ. Рассчитайте массу карбоната натрия, который обезвреживает выбросы,
содержащие 5 л диоксида азота (при н.у.).
3.17. Органические вещества растений образуются из углекислого газа, присутствующего в
воздухе, и воды, поступающей из почвы. В зеленых листьях растений эти неорганические
вещества превращаются в органическое вещество глюкозу C6h22O6. Этот процесс
сопровождается выделением кислорода. Рассчитайте, какой объем кислорода (при н.у.)
выделяется в атмосферу зелеными растениями при образовании 1 кг глюкозы.
3.18. Сжигая органическое топливо, человечество ежегодно отправляет в атмосферу 12
млн. т оксида азота(II) NO. Какую массу азотной кислоты можно было бы получить из
всего этого количества NO при условии, что практический выход составит 80%?
3.19. Каждый автомобиль расходует в год примерно 4 т кислорода. Какую массу оксида
ртути(II) HgO следует подвергнуть разложению с выделением кислорода, чтобы
обеспечить годовую потребность одного автомобиля?
3.20. Известно, что сероводород, циркулируя в биосфере, может окисляться под действием
аэробных бактерий до свободной серы. Именно это, как полагают геохимики, было
причиной возникновения залежей самородной серы. Рассчитайте, какой объем (при н.у.)
сероводорода был поглощен и переработан бактериями, если образовалось 450 т серы.
Ответы
3.1. 0,093 моль (2,09 л) Nh4 и 0,093 моль (2,09 л) HCl
3.2. 50 кг серы и 153 кг h3SO4
3.3. 900 г CaCO3
3.4. 0,0020 моль CO; 18 м3 воздуха
3.5. 644 г железа,193,2 л O2
3.6. 1,33 л CO2
3.7. Практический выход 82%
3.8. 0,893, или 89,3% карбоната кальция в известняке
3.9. Практический выход 88,4%, масса серы 3,0 г
znanio.ru
