6. Спиновое квантовое число
СПИНОВОЕ КВАНТОВОЕ ЧИСЛО – квантовое число, определяющее величину спина квантовой системы (атома, иона, атомного ядра, молекулы), т. е. её собств. (внутр.) момента кол-ва движения (момента импульса). Спиновый момент импульса s квантуется: его квадрат определяется выражением, где s – С. к. ч. (называемое часто просто спином). Проекция вектора s на произвольное направлениеz также квантуется: для частиц с ненулевой массой(гдеms – магнитное спиновое число), т. е. принимает 2s + 1 значений. Число s может принимать целые, нулевые или полуцелые значения.
7)Принцип Паули: в пределах одной квантовой системы в данном квантовом состоянии может находиться только одна частица, состояние другой должно отличаться хотя бы одним квантовым числом. Следствием принципа является наличие электронных оболочек в структуре атома. Количество электронов в отдельном атоме равно количеству протонов. Так как электроны являются фермионами, принцип Паули запрещает им принимать одинаковые квантовые состояния.
8)Правило Гунда: определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: суммарное значение спинового квантового числа электронов данного подслоя должно быть максимальным. Сформулировано Фридрихом Хундом в 1925 году. Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон. При этом на одной орбитали находятся два электрона с полуцелыми спинами противоположного знака, которые спариваются (образуют двухэлектронное облако) и, в результате, суммарный спин орбитали становится равным нулю.
9. Квантовое число
Квантовое число n – главное. Оно определяет энергию электрона в атоме водорода и одноэлектронных системах (He+, Li2+ и т. д.). В этом случае энергия электрона
где n принимает значения от 1 до ∞. Чем меньше n, тем больше энергия взаимодействия электрона с ядром. При n = 1 атом водорода находится в основном состоянии, при n > 1 – в возбужденном.
В многоэлектронных атомах электроны с одинаковыми значениями n образуют слой или уровень, обозначаемый буквами K, L, M, N, O, P и Q. Буква K соответствует первому уровню, L – второму и т. д.
10. Распределение электронов по энергетическим уровням
Ниже приведено распределение электронов по энергетическим уровням и подуровням у элементов, принадлежащих к группам (семействам) S, Р, D И F.
S-Элементы. S-элементами являются элементы главных подгрупп I и II групп, а также водород и гелий. Водород относят к VII главной подгруппе P-элементов, а гелий – к VIII подгруппе инертных P-элементов. В атомах S-элементов пополняется электронами подуровень S Внешнего уровня: во внешнем квантовом слое S-подуровня они имеют 1 или 2 (S1 или S2) электрона, удаленных на значительное расстояние от ядра. При химических реакциях элементы основных подгрупп I и II групп проявляют резко выраженные восстановительные свойства.
studfiles.net
квантовые числа ( главное,побочное,магнитное,спиновое) их значение в объяснение строения атомов данного элемента
Квантовые числаГлавное квантовое число n обозначает номер уровня.
n = 1-7 (K-Q). Целое число, характеризует энергию электронов, занимающих данный уровень.
n = 1 – Энергия минимальна
n = 7 – Энергия максимальна, электроны слабо связаны с ядром.
N = 2n2,
где N – максимальное число электронов на уровне, n – номер уровня (главное квантовое число) .
Орбитальное = побочное квантовое число l – целое от 0 до n – 1, определяет форму орбитали.
ol = 0 – s-орбиталь, шарообразная форма
ol = 1 – p-орбиталь, форма объемной восьмерки («гантель» )
ol = 2 – d-орбиталь, более сложная форма
ol = 3 – f-орбиталь, -«-
Электроны с одинаковым l в пределах одного уровня образуют подуровни. Они отличаются энергией связи с ядром. Их число на уровне равно n, но не более 4.
Подуровни обозначают буквами:
os-подуровень – 1 орбиталь,
op-подуровень – 3 орбитали,
od-подуровень – 5 орбиталей,
of-подуровень – 7 орбиталей.
Элементы, у которых происходит заполнение определенного подуровня, называются соответственно s,p,d,f-элементами.
os-элементы – элементы главных подгрупп 1 и 2 групп и гелий.
op-элементы – элементы главных подгрупп 3-8 групп
od-элементы – элементы вставных декад (переходные элементы)
of-элементы – лантаноиды и актиноиды.
Магнитное квантовое число m определяет расположение орбитали в пространстве (по осям координат) .
m принимает значения от –l до +l, включая 0. Число значений, принимаемых m, определяет число орбиталей на подуровне:
l = 0, m = 0 – 1 s-орбиталь
l = 1, m = -1,0,+1 – 3 p-орбитали
l = 2, m = -2,-1,0, +1,+2 – 5 d-орбиталей
l = 3, m = -3,-2,-1,0,+1,+2,+3 – 7 f-орбиталей
Спиновое квантовое число s характеризует 2 возможных направления вращения электрона вокруг своей оси: s = -½ , s = +½
↑↓ – антипараллельные спины.
Принцип Паули. В атоме не может быть 2 электронов, все 4 квантовых числа которых были бы одинаковыми. Поэтому на каждой орбитали может находиться не более 2 электронов.
otvet.mail.ru
§ 225. Спин электрона. Спиновое квантовое число
О. Штерн и В. Герлах, проводя прямые измерения магнитных моментов (см. § 131), обнаружили в 1922 г., что узкий пучок атомов водорода, заведомо находящихся в s-состоянии, в неоднородном магнитном поле расщепляется на два пучка. В этом состоянии момент импульса электрона равен нулю (см. (223.4)). Магнитный момент атома, связанный с орбитальным движением электрона, пропорционален механическому моменту (см. (131.3)), поэтому он равен нулю и магнитное поле не должно оказывать влияния на движение атомов водорода в основном состоянии, т. е. расщепления быть не должно. Однако в дальнейшем при применении спектральных приборов с большой разрешающей способностью было доказано, что спектральные линии атома водорода обнаруживают тонкую структуру (являются дублетами)
Для объяснения тонкой структуры спектральных линий, а также ряда других трудностей в атомной физике американские физики Д. Уленбек (1900—1974) и С. Гаудсмит (1902—1979) предположили, что электрон обладает
Спин электрона (и всех других микрочастиц) — квантовая величина, у нее нет классического аналога; это внутреннее неотъемлемое свойство электрона, подобное его заряду и массе.
Если электрону приписывается собственный механический момент импульса (спин) Ls, то ему соответствует собственный магнитный моментрms. Согласно общим выводам квантовой механики,спин квантуется по закону
где s —
По аналогии с орбитальным моментом импульса, проекция Lszспина квантуется так, что векторLsможет принимать 2s+1 ориентации. Так как в опытах Штерна и Герлаха наблюдались только две ориентации, то 2s+1=2, откудаs= ½ . Проекция спина на направление внешнего магнитного поля, являясь квантованной величиной, определяется выражением, аналогичным (223.6):
где тs —магнитное спиновое квантовое число; оно может иметь только два значения:ms = ± ½.
Таким образом, опытные данные привели к необходимости характеризовать электроны (и микрочастицы вообще) добавочной внутренней степенью свободы. Поэтому для полного описания состояния электрона в атоме необходимо наряду с главным, орбитальным и магнитным квантовыми числами задавать еще магнитное спиновое квантовое число.
§ 226. Принцип неразличимости тождественных частиц. Фермионы и бозоны
Если перейти от рассмотрения движения одной микрочастицы (одного электрона) к многоэлектронным системам, то проявляются особые свойства, не имеющие аналога в классической физике. Пусть квантово-механическая система состоит из одинаковых частиц, например электронов. Все электроны имеют одинаковые физические свойства — массу, электрический заряд, спин и другие внутренние характеристики (например, квантовые числа). Такие частицы называют
Необычные свойства системы одинаковых тождественных частиц проявляются в фундаментальномпринципе квантовой механики —принципе неразличимости тождественных частиц, согласно которому невозможно экспериментально различить тождественные частицы.
В классической механике даже одинаковые частицы можно различить по положению в пространстве и импульсам. Если частицы в какой-то момент времени пронумеровать, то в следующие моменты времени можно проследить за траекторией любой из них. Классические частицы, таким образом, обладают индивидуальностью, поэтому классическая механика систем из одинаковых частиц принципиально не отличается от классической механики систем из различных частиц.
В квантовой механике положение иное. Из соотношения неопределенностей вытекает, что для микрочастиц вообще неприменимо понятие траектории; состояние микрочастицы описывается волновой функцией, позволяющей вычислять лишь вероятность (||2) нахождения микрочастицы в окрестностях той или иной точки пространства. Если же волновые функции двух тождественных частиц в пространстве перекрываются, то разговор о том, какая частица находится в данной области, вообще лишен смысла: можно лишь говорить о вероятности нахождения в данной области одной из тождественных частиц. Таким образом, в квантовой механике тождественные частицы полностью теряют свою индивидуальность и становятся неразличимыми. Следует подчеркнуть, что принцип неразличимости тождественных частиц не является просто следствием вероятностной интерпретации волновой функции, а вводится в квантовую механику как новый принцип, который, как уже указывалось, является фундаментальным.
Принимая во внимание физический смысл величины ||2,принцип неразличимости тождественных частиц можно записать в виде
(226.1)
где x1их2— соответственно совокупность пространственных и спиновых координат первой и второй частиц. Из выражения (226.1) вытекает, что возможны два случая:
т. е. принцип неразличимости тождественных частиц ведет к определенному свойству симметрии волновой функции. Если при перемене частиц местами волновая функция не меняет знака, то она называется cимметричной, если меняет —антисимметричной. Изменение знака волновой функции не означает изменения состояния, так как физический смысл имеет лишь квадрат модуля волновой функции. В квантовой механике доказывается, что характер симметрии волновой функции не меняется со временем. Это же является доказательством того, что свойство симметрии или антисимметрии — признак данного типа микрочастиц.
Установлено, что симметрия или антисимметрия волновых функций определяется спином частиц. В зависимости от характера симметрии все элементарные частицы и построенные из них системы (атомы, молекулы) делятся на два класса. Частицы с полуцелым спином (например, электроны, протоны, нейтроны) описываются антисимметричными волновыми функциями и подчиняются статистике Ферми — Дирака; эти частицы называются фермионами.Частицы с нулевым или целочисленным спином (например,-мезоны, фотоны) описываются симметричными волновыми функциями и подчиняются статистике Бозе — Эйнштейна; эти частицы называютсябозонами. Сложные частицы (например, атомные ядра), составленные из нечетного числа фермионов, являются фермионами (суммарный спив — полуцелый), а из четного — бозонами (суммарный спин целый).
Зависимость характера симметрии волновых функций системы тождественных частиц от спина частиц теоретически обоснована швейцарским физиком В. Паули (1900—1958), что явилось еще одним доказательством того, что спин является фундаментальной характеристикой микрочастиц.
studfiles.net
Квантовые числа спиновое – Справочник химика 21
Четвертое квантовое число — спиновое (т ) — характеризует вращение электрона вокруг собственной оси. Проекция собственного момента. количества движения электрона на избранное направление (например, на ось г) называется спиновым квантовым числом. Спиновое число имеет два значения +1/2 и —1/2, их изображают в виде противоположно направленных стрелок или . [c.11]Четвертое квантовое число — спиновое ( ) характеризует вращение электрона вокруг собственной оси. Подобно волчку, электрон может вращаться по часовой стрелке или против нее. Электроны, имеющие одинаковые квантовые числа п, I и т (занимаю- [c.27]
Четвертое квантовое число — спиновое число 5. Оно может иметь только два значения. Ведь мы уже говорили, что существует только два возможных направления вращения электрона вокруг своей оси. Принято два значения этого числа обозначать цифрами -f 7г и — /г- [c.141]
Четвертому квантовому числу — спиновому не придают какого-либо образа и считают его чисто квантово-механической величиной, принимающей два значения 1/2. [c.91]
Наличием собственных магнитных полей атома водорода удалось объяснить расщепление спектральных линий в магнитном поле (эффект Зеемана) и в электрическом поле (эффект Штарка). Для объяснения более тонких спектральных явлений введено еще одно квантовое число — спиновое квантовое число 5. Спин, или вращение электрона относительно собственной оси, может быть левым и правым [c.37]
Однако квантовое число спинового момента (х) в отличие от I может принимать лишь одно значение [c.58]
Детальное изучение атомных спектров в течение первой четверти двадцатого века привело к выводу, что поведение электрона в атоме может быть полностью описано совокупностью из четырех квантовых чисел. Полное решение волнового уравнения для атома водорода привело к трем из этих квантовых чисел, совершенно идентичным соответствующим эмпирическим квантовым числам старой квантовой теории (за исключением некоторых деталей). Развитие теории показало необходимость введения четвертого квантового числа спинового квантового числа). Четыре квантовых числа определяют не только энергию электрона, но также и характер волновой функции, описывающей его орбиту — ее размер и форму. [c.32]
Полное описание всех возможных орбиталей для первых трех оболочек с соответствующими квантовыми числами приведено в табл. 1-2. Существует ряд правил, которые позволяют определять возможные значения п, I и т1. Квантовое число п может иметь любое положительное целочисленное значение, за исключением нуля. Все возможные значения I, соответствующие данному п, передаются соотношением 1=п—1,. .., О, где многоточие означает все целые числа, необходимые для заполнения ряда. Возможными значениями т , соответствующими данному I, являются гп1= +1,1—1,. .., О,…, —/+1, —I. На каждой орбитали могут находиться два электрона, которые отличаются квантовым числом спинового магнитного момента т , равным либо ч- /2, либо — /2- [c.24]
Спин электрона, (механический и магнитный моменты его) характеризуется четвертым квантовым числом — спиновым (а). Последнее может принимать лишь два условных значения + Уа, —или, упрощенно, -Ь и —. [c.121]
В 1925 г. Уленбек и Гаудсмит предположили, что электрон ведет себя как вращающаяся частица и имеет внутренний угловой (спиновый) и связанный с ним магнитный моменты. Эта гипотеза позволила объяснить некоторые небольшие расщепления, наблюдавшиеся в атомных спектральных линиях. Уленбек и Гаудсмит нашли, что необходимо постулировать полуцелое квантовое число спинового углового момента (спина) [c.52]
Каждый электрон кроме движения в поле ядра обладает еще и внутренним движением. Момент количества движения, связанный с внутренним движением электрона, называют спином т,. Он характеризует четвертое квантовое число. Спиновое квантовое число показывает вращение электрона вокруг своей оси, которое может иметь два противоположных направления движение по часовой стрелке и движение против часовой стрелки Значение спина 4- /г и — /г соответственно. Два электрона с противоположно направленными спинами называются спаренными электронами, а с одинаковыми спинами или ЧI — неспаренны- [c.10]
Квантовые числа п, I п т принадлежат орбиталям, а электрону они принадлежат постольку, поскольку он находится в данной орбитали ( занимает данную орбиталь). Кроме них существует четвертое квантовое число — спиновое, более непосредственно принадлежащее электрону, определяющее ориентацию спина электрона относительно некоторого выделенного направления и имеющее лишь два возможных значения + /2 и —72- Чаще всего его обозначают буквой 5. Таким образом, полный набор квантовых чисел для электрона в атоме содержит четыре квантовых числа п, I, т, 5. Электроны атома с одинаковыми значениями квантовых чисел п и I называются эквивалентными. [c.224]
Спин электрона. В предыдущей главе было показано, что многие характерные черты водородного спектра можно объяснить на основе допущения, что состояние каждого электрона определяется тремя квантовыми числами п, I, т1. Это относится также и к спектрам многих других атомов, хотя в этом случае, конечно, имеет место значительное усложнение. Однако многие особенности спектров более сложных атомов и действие магнитного поляг на спектр водорода вызвали необходимость предположить, что электрон имеет четвертое квантовое число. Это четвертое квантовое число — спиновое квантовое число [1, 3, 4]. [c.83]
В 1925 г. Уленбек и Гаудсмит предположили, что электрон ведет себя как вращающаяся частица и имеет внутренний угловой (спиновый) и связанный с ним магнитный моменты. Эта гипотеза позволила объяснить некоторые небольшие расщепления, наблюдавшиеся в атомных спектральных линиях. Уленбек и Гаудсмит нашли, что необходимо постулировать по-луцелое квантовое число спинового углового момента (спина) 5 = 2 в противоположность целым значениям / = О, 1, 2,. .., которые может принимать квантовое число орбитального углового момента электрона. В предыдущей главе было показано, что орбитали с данным значением / вырождены 2/-+- 1-кратно, каждое из 2/-+- 1-состояний соответствует различным значениям т. По аналогии следует ожидать, что так как для электрона 5 = /2, то существует 25 + 1 2 разных компонент спина, т. е. Шз принимает значения /2 или — /2. Такова была гипотеза Уленбека и Гаудсмита. Позднее выяснилось, что еще за три года до их гипотезы Штерном и Герлахом были выполнены эксперименты, подтверждающие этот вывод. Эти ученые пропускали пучок атомов серебра через неоднородное магнитное поле и установили, что он расщепляется на два пучка, так как если бы атомы серебра имели именно два допустимых направления магнитных моментов относительно направления магнитного поля. Так как в атомах серебра имеется лишь один электрон на 5-орбитали сверх замкнутой (и поэтому сферической) оболочки, поведение атомов серебра в магнитном поле определяется свойствами этого электрона. Поэтому расщепление, наблюдавшееся Штерном и Герлахом, очевидно, обусловлено существованием двух возможных значений Шз для электрона. [c.52]
Мы ДОЛЖНЫ рассмотреть еще четвертое и последнее квантовое число — спиновое. В 1925 г. Уленбек и Гоудсмнт на основе тщательного анализа атомных спектров щелочных металлов [c.41]
У электронов со спином /г квантовое число спинового углового момента может принимать значения ms= 7г, что в отсутствие магнитного поля приводит к наличию дважды вырожденных спиновых энергетических состояний. При наложении магнитного поля это вырождение снимается. В состоянии с низщей энергией магнитный момент ориентирован по полю, что соответствует nls= —7г, тогда как в состоянии с более высокой энергией П1а= + Ч2 и магнитный момент направлен противоположно полю, в спектрах ЭПР и ЯМР имеется некоторое сходство, которое поможет нам понять основы ЭПР. В ЯМР два различных энергетических состояния возникают вследствие различной ориентации ядерных магнитных моментов относительно наложенного поля и переход Между ними происходил при наложении радиочастотного поля соответствующей частоты. В ЭПР переход между двумя различными энергетическими состояниями, различающимися ориентацией электронного спинового момента, происходит при поглощении кванта излучения в радиочастотной или микроволновой области. Энергия перехода передается выражением [c.353]
Но электрон способен также вращаться вокруг собственной оси — эффект, именуемый спином (по-английски spin—веретено). Возможно вращение или по часовой стрелке или против. Оно характеризуется третьим квантовым числом — спиновым квантовым [c.78]
Главное кван- товое число п Орби- тальное кванто- вое число 1 Магнитное квантовое число Спиновое квантовое число Число состоя- ний элек- трона Квантовое состояние электрона Общее число состоя- ний элек- трона [c.23]
Четвертое квантовое число — спиновое (х) характеризует вращение электрона вокруг собственной оси. Подобно волчку, электрон может вращаться по часовой стрелке или против нее. ЭлеК троны, имеющие одинаковые квантовые числа /г, / и т (занимающие одну электронную орбиталь), но различающиеся спином, образуют электронную пару. Далее мы узнаем, что именно электронные пары ответственны за образование связей в молекулах органических веществ. [c.29]
chem21.info
Спиновое квантовое число Википедия
Спин (от англ. spin, буквально — вращение, вращать(-ся)) — собственный момент импульса элементарных частиц, имеющий квантовую природу и не связанный с перемещением частицы как целого. Спином называют также собственный момент импульса атомного ядра или атома; в этом случае спин определяется как векторная сумма (вычисленная по правилам сложения моментов в квантовой механике) спинов элементарных частиц, образующих систему, и орбитальных моментов этих частиц, обусловленных их движением внутри системы.
Спин измеряется в единицах ħ[1] (приведённой постоянной Планка, или постоянной Дирака) и равен ħJ, где J — характерное для каждого сорта частиц целое (в том числе нулевое) или полуцелое положительное число — так называемое спиновое квантовое число, которое обычно называют просто спином (одно из квантовых чисел).
В связи с этим говорят о целом или полуцелом спине частицы.
Существование спина в системе тождественных взаимодействующих частиц является причиной нового квантово-механического явления, не имеющего аналогии в классической механике, обменного взаимодействия.
Вектор спина является единственной величиной, характеризующей ориентацию частицы в квантовой механике[2]. Из этого положения следует, что: при нулевом спине у частицы не может существовать никаких векторных и тензорных характеристик; векторные свойства частиц могут описываться только аксиальными векторами; частицы могут иметь магнитные дипольные моменты и не могут иметь электрических дипольных моментов; частицы могут иметь электрический квадрупольный момент и не могут иметь магнитный квадрупольный момент; отличный от нуля квадрупольный момент возможен лишь у частиц при спине, не меньшем единицы[3].
Спиновый момент электрона или другой элементарной частицы, однозначно отделённый от орбитального момента, никогда не может быть определён посредством опытов, к которым применимо классическое понятие траектории частицы[4].
Число компонент волновой функции, описывающей элементарную частицу в квантовой механике, растёт с ростом спина элементарной частицы. Элементарные частицы со спином 0{\displaystyle 0} описываются однокомпонентной волновой функцией (скаляр), со спином 12{\displaystyle {\frac {1}{2}}} описываются двухкомпонентной волновой функцией (спинор), со спином 1{\displaystyle 1} описываются четырёхкомпонентной волновой функцией (вектор), со спином 2{\displaystyle 2} описываются шестикомпонентной волновой функцией (тензор)[5].
Что такое спин — на примерах[ | ]
ru-wiki.ru
20. Магнитное и спиновое квантовые числа.
Установлено, что при помещении атома во внешнее магнитное или электрическое поле спектры атомов становятся еще более мультиплётными. С физической точки зрения это означает, что различные электронные облака находящиеся даже на одном подуровне, по разному реагируют на внешнее магнитное поле. Для обозначения этих подподуровней введено третье,магнитное квантовое число тl, принимающее значения всех целых чисел от –l через 0 до +l.
тl = –l,…-2,-1,0,+1.+2,…,+ l
То есть: магнитное квантовое число (тl) показывает реакцию орбит на внешнее магнитное или электрическое поле, зависит, от орбитального квантового числа и обозначается целыми числами от –l до +l.
Электрон помимо движения “вокруг ядра” вращается и вокруг собственной оси. Для обозначения направления этого вращения введено четвёртое квантовое число – cnuнoвoe (ms).Собственный момент вращения –(спин) имеет два значения, условно обозначенные как +1/2 и -1/2.
21.Многоэлектронные атомы
В атоме водорода электрон находится в силовом поле, которое создается только ядром. В многоэлектронных атомах на каждый электрон действует не только ядро, но и все остальные электроны. При этом электронные облака отдельных электронов как бы сливаются в одно общее многоэлектронное облако. Точное решение уравнения Шредингера для таких сложных систем связано с большими затруднениями и, как правило, недостижимо. Поэтому состояние электронов в сложных атомах и в молекулах определяют путем приближенного решения уравнения Шредингера.
Общим для всех приближенных методов решения этого уравнения является так называемое одноэлектронное приближение, т.е. предположение, что волновая функция многоэлектронной системы может быть представлена в виде суммы волновых функций отдельных электронов. Тогда уравнение Шредингера может решаться отдельно для каждого находящегося в атоме электрона, состояние которого, как и в атоме водорода, будет определяться значениями квантовых чисел n, l, m и s. Однако и при этом упрощении решение уравнения Шредингера для многоэлектронных атомов и молекул представляет весьма сложную задачу и требует большого объема трудоемких вычислений. В последние годы подобные вычисления выполняются, как правило, с помощью быстродействующих электронных вычислительных машин, что позволило произвести необходимые расчеты для атомов всех элементов и для многих молекул.
Исследование спектров многоэлектронных атомов показало, что здесь энергетическое состояние электронов зависит не только от главного квантового числа n, но и от орбитального квантового числа l. Это связано с тем, что электрон в атоме не только притягивается ядром, но и испытывает отталкивание со стороны электронов, расположенных между данным электроном и ядром. Внутренние электронные слои как бы образуют своеобразный экран, ослабляющий притяжение электрона к ядру, или, как принято говорить, экранируют внешний электрон от ядерного заряда. При этом для электронов, различающихся значением орбитального квантового числа l, экранирование оказывается неодинаковым.
studfiles.net
Спин электрона. Спиновое квантовое число
7
Л3-12Спин электрона. Спиновое квантовое число.При классическом движении по орбите электрон обладает магнитным моментом. Причем классическое отношение магнитного момента к механическому имеет значение
, (1)
где и
и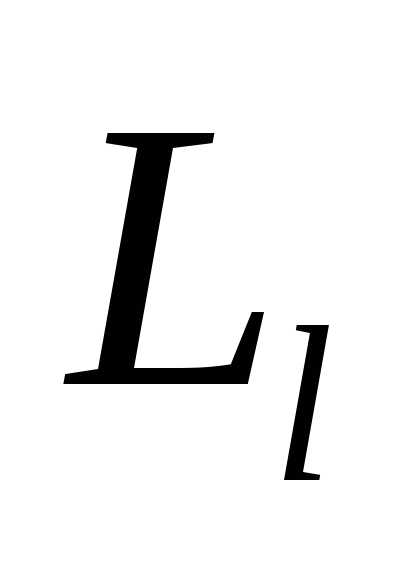 – соответственно магнитный и механический
момент. К аналогичному результату
приводит и квантовая механика. Так как
проекция орбитального момента на
некоторое направление может принимать
только дискретные значения, то это же
относится и к магнитному моменту.
Поэтому, проекция магнитного момента
на направление вектораBпри заданном значении орбитального
квантового числаlможет принимать значения
– соответственно магнитный и механический
момент. К аналогичному результату
приводит и квантовая механика. Так как
проекция орбитального момента на
некоторое направление может принимать
только дискретные значения, то это же
относится и к магнитному моменту.
Поэтому, проекция магнитного момента
на направление вектораBпри заданном значении орбитального
квантового числаlможет принимать значения
, где– так называемыймагнетон Бора.
О. Штерн и В. Герлах в своих опытах проводили прямые измерения магнитных моментов. Они обнаружили, что узкий пучок атомов водорода, заведомо находящихся в s-состоянии, в неоднородном магнитном поле расщепляется на два пучка. В этом состоянии момент импульса, а с ним и магнитный момент электрона равен нулю. Таким образом, магнитное поле не должно оказывать влияние на движение атомов водорода, т.е. расщепления быть не должно.
Для объяснения этого и других явлений
Гаудсмит и Уленбек выдвинули предположение,
что электрон обладает собственным
моментом импульса 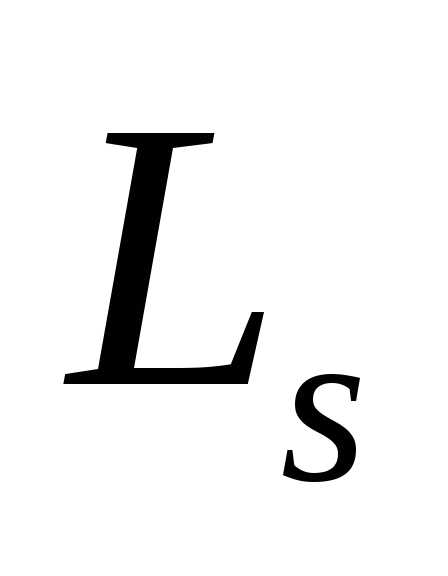 ,
не связанным с движением электрона в
пространстве. Этот собственный момент
был названспином.
,
не связанным с движением электрона в
пространстве. Этот собственный момент
был названспином.
Первоначально предполагалось, что спин обусловлен вращением электрона вокруг своей оси. Согласно этим представлениям для отношения магнитного и механического моментов должно выполняться соотношение (1). Экспериментально было установлено, что это отношение в действительности в два раза больше, чем для орбитальных моментов
. По этой причине, представление электрона как о вращающемся шарике оказывается несостоятельным. В квантовой механике спин электрона (и всех других микрочастиц) рассматривается как внутреннее неотъемлемое свойство электрона, подобное его заряду и массе.
Величина собственного момента импульса
микрочастицы определяется в квантовой
механике с помощью спинового квантового
числа s(для
электрона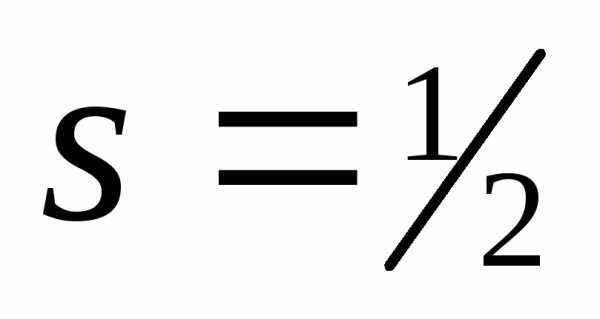 )
)
.
Проекция спина на заданное направление
может принимать квантованные значения,
отличающиеся друг от друга на .
Для электрона
.
Для электрона
,
где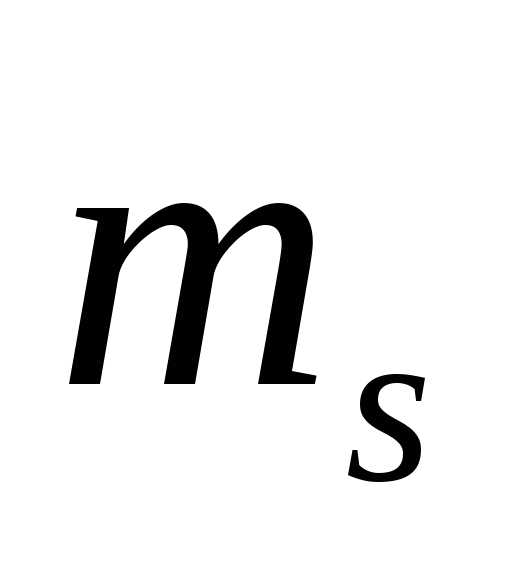 –магнитное спиновое квантовое число.
–магнитное спиновое квантовое число.
Для полного описания электрона в атоме, таким образом, необходимо наряду с главным, орбитальным и магнитным квантовыми числами задавать еще магнитное спиновое квантовое число.
Тождественность частиц.В классической механике одинаковые частицы (скажем, электроны), несмотря на тождественность их физических свойств, можно пометить, пронумеровав, и в этом смысле считать частицы различимыми. В квантовой механике ситуация кардинально меняется. Понятие траектории теряет смысл, и, следовательно, при движении частицы перепутываются. Это означает, что нельзя сказать, какой из первоначально помеченных электронов попал в ту или иную точку.
Таким образом, в квантовой механике одинаковые частицы полностью теряют свою индивидуальность и становятся неразличимыми. Это утверждение или, как говорят, принцип неразличимостиодинаковых частиц имеет важные следствия.
Рассмотрим систему, состоящую из двух одинаковых частиц. В силу их тождественности состояния системы, получающиеся друг из друга перестановкой обеих частиц должны быть физически полностью эквивалентными. На языке квантовой механики это означает, что
,
где ,
, – совокупности пространственных и
спиновых координат первой и второй
частицы. В итоге возможны два случая
– совокупности пространственных и
спиновых координат первой и второй
частицы. В итоге возможны два случая
. Таким образом, волновая функция либо симметрична (не меняется при перестановки частиц), либо антисимметрична (т.е. при перестановке меняет знак). Оба этих случая встречаются в природе.
Релятивистская квантовая механика устанавливает, что симметрия или антисимметрия волновых функций определяется спином частиц. Частицы с полуцелым спином (электроны, протоны, нейтроны) описываются антисимметричными волновыми функциями. Такие частицы называют фермионами, и говорят, что они подчиняются статистике Ферми-Дирака. Частицы с нулевым или целочисленным спином (например, фотоны) описываются симметричными волновыми функциями. Эти частицы называютбозонами, и говорят, что они подчиняются статистике Бозе-Эйнштейна. Сложные частицы (например, атомные ядра), состоящие из нечетного числа фермионов, являются фермионами (суммарный спин – полуцелый), а из четного – бозонами (суммарный спин целый).
Принцип Паули. Атомные оболочки.Если тождественные частицы имеют одинаковые квантовые числа, то их волновая функция симметрична относительно перестановки частиц. Отсюда следует, что два фермиона, входящих в эту систему, не могут находиться в одинаковых состояниях, так как для фермионов волновая функция должна быть антисимметричной.
Из этого положения вытекает принцип запрета Паули: любые два фермиона не могут одновременно находиться в одном и том же состоянии.
Состояние электрона в атоме определяется набором четырех квантовых чисел:
главного n(,
орбитального l(),
магнитного 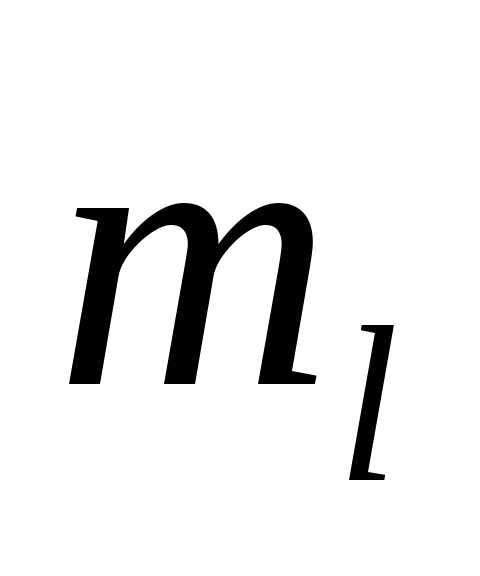 (),
(),
магнитного спинового  (
( ).
).
Распределение электронов в атоме по состояниям подчиняется принципу Паули, поэтому два электрона, находящихся атоме, различаются значениями, по крайней мере, одного квантового числа.
Определенному значению nсоответствует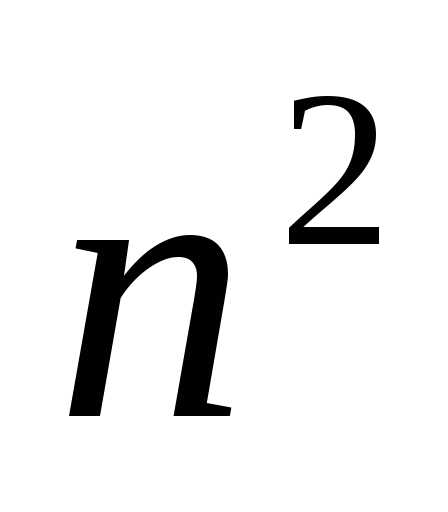 различных состояний, отличающихсяlи
различных состояний, отличающихсяlи .
Так как
.
Так как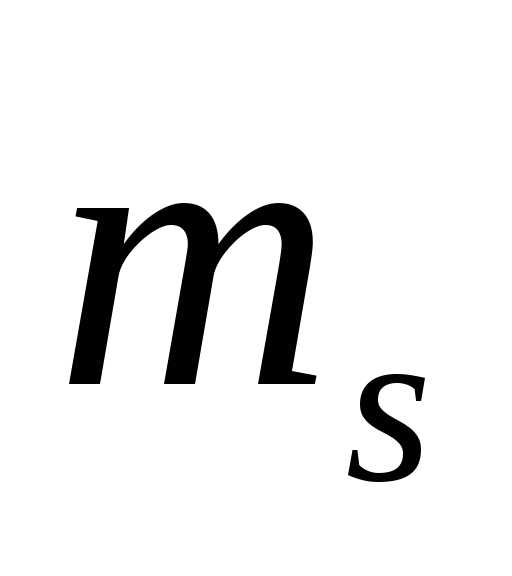 может принимать лишь два значения (
может принимать лишь два значения ( ),
то максимальное число электронов,
находящихся в состояниях с даннымn,
будет равно
),
то максимальное число электронов,
находящихся в состояниях с даннымn,
будет равно .
Совокупность электронов в многоэлектронном
атоме, имеющих одно и то же квантовое
числоn, называютэлектронной оболочкой. В каждой
электроны распределяются поподоболочкам,
соответствующих данномуl.
Максимальное число электронов в
подоболочке с даннымlравно
.
Совокупность электронов в многоэлектронном
атоме, имеющих одно и то же квантовое
числоn, называютэлектронной оболочкой. В каждой
электроны распределяются поподоболочкам,
соответствующих данномуl.
Максимальное число электронов в
подоболочке с даннымlравно .
Обозначения оболочек, а также распределение
электронов по оболочкам и подоболочкам
представлены в таблице.
.
Обозначения оболочек, а также распределение
электронов по оболочкам и подоболочкам
представлены в таблице.
Периодическая система элементов Менделеева.С помощью принципа Паули можно объяснить Периодическую систему элементов. Химические и некоторые физические свойства элементов определяются внешними валентными электронами. Поэтому периодичность свойств химических элементов непосредственно связана с характером заполнения электронных оболочек в атоме.
Элементы таблице отличаются друг от друга зарядом ядра и количеством электронов. При переходе к соседнему элементу последние увеличиваются на единицу. Электроны заполняют уровни так, чтобы энергия атома была минимальной.
В многоэлектронном атоме каждый отдельный
электрон движется в поле, которое
отличается от кулоновского. Это приводит
к тому, что вырождение по орбитальному
моменту снимается  .
Причемc увеличениемlэнергия уровней с одинаковымиnвозрастает. Когда число
электронов невелико, отличие в энергии
с различнымиlи
одинаковымиnне так
велико, как между состояниями с различнымиn. Поэтому,
сначала электроны заполняют оболочки
с меньшимиn, начиная
сsподоболочки,
последовательно переходя к большим
значениямl.
.
Причемc увеличениемlэнергия уровней с одинаковымиnвозрастает. Когда число
электронов невелико, отличие в энергии
с различнымиlи
одинаковымиnне так
велико, как между состояниями с различнымиn. Поэтому,
сначала электроны заполняют оболочки
с меньшимиn, начиная
сsподоболочки,
последовательно переходя к большим
значениямl.
Единственный электрон атома водорода находится в состоянии 1s. Оба электрона атомаHeнаходятся в состоянии 1sс антипараллельными ориентациями спина. На атоме гелия заканчивается заполнениеK-оболочки, что соответствует завершениюIпериода таблицы Менделеева.
Третий электрон атома Li(Z3)занимает наинизшее свободное энергетическое состояние сn2 (L-оболочка), т.е. 2s-состояние. Так как он слабее других электронов связан с ядром атома, то им определяются оптические и химические свойства атома. Процесс заполнения электронов во втором периоде не нарушается. Заканчивается период неоном, у которогоL-оболочка целиком заполнена.
В третьем периоде начинается заполнение M-оболочки. Одиннадцатый электрон первого элемента данного периодаNa(Z11) занимает наинизшее свободное состояние 3s. 3s-электронявляется единственным валентным электроном. В связи с этим оптические и химические свойства натрия подобны свойствам лития. У следующих за натрием элементов нормально заполняются подоболочки 3sи 3p.
Впервые нарушение обычной последовательности заполнения уровней происходит у K(Z19). Его девятнадцатый электрон должен был бы занять 3d-состояние вM-оболочке. При данной общей конфигурации подоболочка 4sоказывается энергетически ниже подоболочки 3d. В связи с чем, при незавершенном в целом заполнении оболочкиMначинается заполнение оболочкиN. В оптическом и химическом отношении атомKподобен атомамLiиNa. Все эти элементы имеют валентный электрон вs-состоянии.
С аналогичными отступлениями от обычной последовательности, повторяющимися время от времени, осуществляется застройка электронных уровней всех атомов. При этом периодически повторяются сходные конфигурации внешних (валентных) электронов (например, 1s, 2s, 3sи т.д.), чем обуславливается повторяемость химических и оптических свойств атомов.
Рентгеновские спектры.Самым
распространенным источником рентгеновского
излучения является рентгеновская
трубка, в которой сильно ускоренные
электрическим полем электроны бомбардируют
анод. При торможении электронов возникает
рентгеновское излучение. Спектральный
состав рентгеновского излучения
представляет собой наложение сплошного
спектра, ограниченного со стороны
коротких волн граничной длиной ,
и линейчатого спектра – совокупности
отдельных линий на фоне сплошного
спектра.
,
и линейчатого спектра – совокупности
отдельных линий на фоне сплошного
спектра.
Сплошной спектр обусловлен излучением электронов при их торможении. Поэтому его называют тормозным излучением. Максимальная энергия кванта тормозного излучения соответствует случаю, когда вся кинетическая энергия электрона переходит в энергию рентгеновского фотона, т.е.
,
гдеU– ускоряющая
разность потенциалов рентгеновской
трубки. Отсюда граничная
длина волны. (2)
Измерив коротковолновую границу
тормозного излучения, можно определить
постоянную Планка. Из всех методов
определения данный метод считается самым точным.
данный метод считается самым точным.
При достаточно большой энергии электронов на фоне сплошного спектра появляются отдельные резкие линии. Линейчатый спектр определяется только материалом анода, поэтому данное излучение называется характеристическим излучением.
Характеристические спектры отличается
заметной простотой. Они состоят из
нескольких серий, обозначаемых буквами K,L,M, NиO. Каждая
серия насчитывает небольшое число
линий, обозначаемых в порядке возрастания
частоты индексами,,… ( ,
, ,,
…;
,,
…;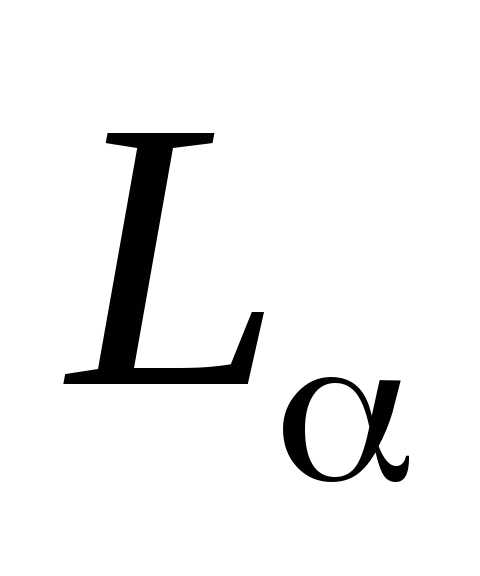 ,
, ,
,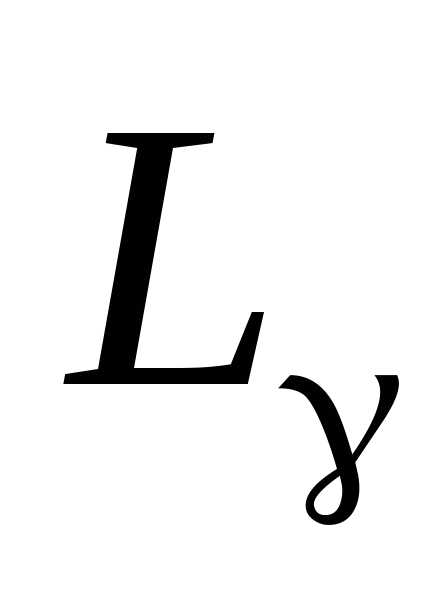 ,
… и т.д.). Спектры разных элементов имеют
сходный характер. При увеличении атомного
номераZвесь
рентгеновский спектр целиком смещается
в коротковолновую часть, не меняя своей
структуры (рис.). Это объясняется тем,
что рентгеновские спектры возникают
при переходах внутренних электронов,
которые для разных атомов являются
сходными.
,
… и т.д.). Спектры разных элементов имеют
сходный характер. При увеличении атомного
номераZвесь
рентгеновский спектр целиком смещается
в коротковолновую часть, не меняя своей
структуры (рис.). Это объясняется тем,
что рентгеновские спектры возникают
при переходах внутренних электронов,
которые для разных атомов являются
сходными.
Схема возникновения рентгеновских спектров дана на рис. Возбуждение атома состоит в удалении одного из внутренних электронов. Если вырывается один из двух электронов K-слоя, то освободившееся место может быть занято электроном из какого-либо внешнего слоя (L,M,Nи т.д.). При этом возникаетK-серия. Аналогично возникают и другие серии, наблюдаемые, впрочем, только для тяжелых элементов. СерияKобязательно сопровождается остальными сериями, так как при испускании ее линий освобождаются уровни в слояхL,Mи т.д., которые будут в свою очередь заполнятся электронами из более высоких слоев.
Исследуя рентгеновские спектры элементов, Г. Мозли установил соотношение, называемое законом Мозли
, (3) где– частота линии характеристического рентгеновского излучения,R– постоянная Ридберга,(определяет рентгеновскую серию),(определяет линию соответствующей серии), – постоянная экранирования.
Закон Мозли позволяет по измеренной длине волны рентгеновских линий точно установить атомный номер данного элемента; этот закон сыграл большую роль при размещении элементов в периодической таблице.
Закону Мозли можно дать простое
объяснение. Линии с частотами (3), возникают
при переходе электрона, находящегося
в поле заряда 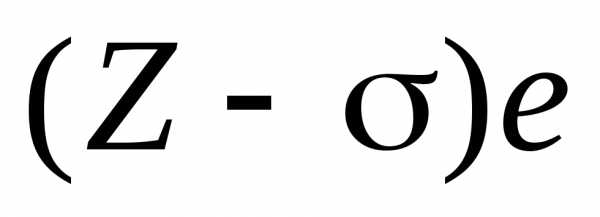 ,
с уровня с номеромnна уровень с номеромm.
Постоянная экранирования
возникает из-за экранирования ядраZeдругими электронами. Ее значение
зависит от линии. Например, для
,
с уровня с номеромnна уровень с номеромm.
Постоянная экранирования
возникает из-за экранирования ядраZeдругими электронами. Ее значение
зависит от линии. Например, для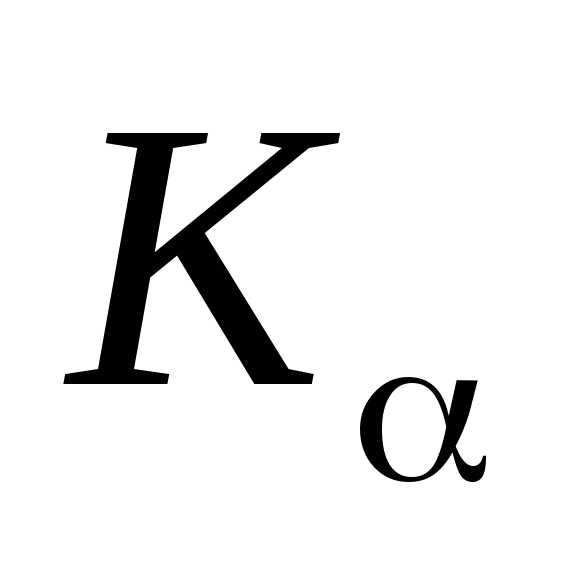 -линии
-линии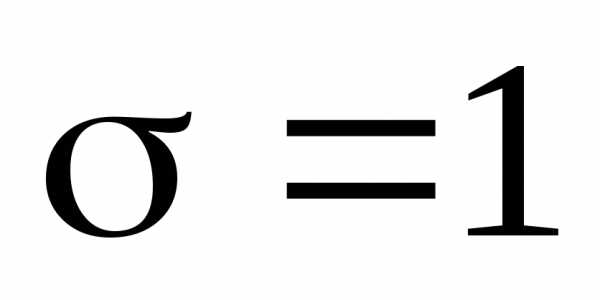 и закон Мозли запишется в виде
и закон Мозли запишется в виде
.
Связь в молекулах. Молекулярные спектры.Различают два вида связи между атомами в молекуле: ионную и ковалентную связь.
Ионная связь. Если два нейтральных атома постепенно сближать друг с другом, то в случае ионной связи наступает момент, когда внешний электрон одного из атомов предпочитает присоединиться к другому атому. Атом, потерявший электрон, ведет себя как частица с положительным зарядомe, а атом, приобретший лишний электрон, – как частица с отрицательным зарядомe. Примером молекулы с ионной связью может служитьHCl, LiF, идр.
Ковалентная связь.Другим распространенным типом молекулярной связи является ковалентная связь (например, в молекулахH2,O2,CO). В образовании ковалентной связи участвуют два валентных электрона соседних атома с противоположно направленными спинами. В результате специфического квантового движения электронов между атомами образуется электронное облако, которое обуславливает притяжение атомов.
Молекулярные спектрысложнее атомных спектров, так как кроме движения электронов относительно ядер в молекуле происходятколебательныедвижения ядер (вместе с окружающими их внутренними электронами) около положений равновесия ивращательные движения молекул.
Молекулярные спектры возникают в
результате квантовых переходов между
уровнями энергий  и
и молекул согласно соотношению
молекул согласно соотношению
,
где –энергия испущенного или поглощаемого
кванта частоты.
При комбинационном рассеянии света
–энергия испущенного или поглощаемого
кванта частоты.
При комбинационном рассеянии света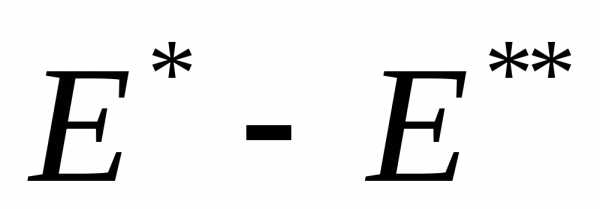 равна разности энергий падающего и
рассеянного фотона.
равна разности энергий падающего и
рассеянного фотона.
Электронному, колебательному и
вращательному движениям молекул
соответствуют энергии 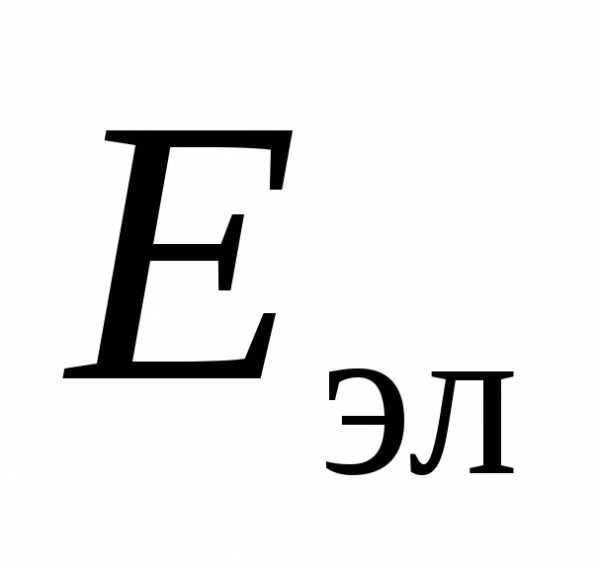 ,
, 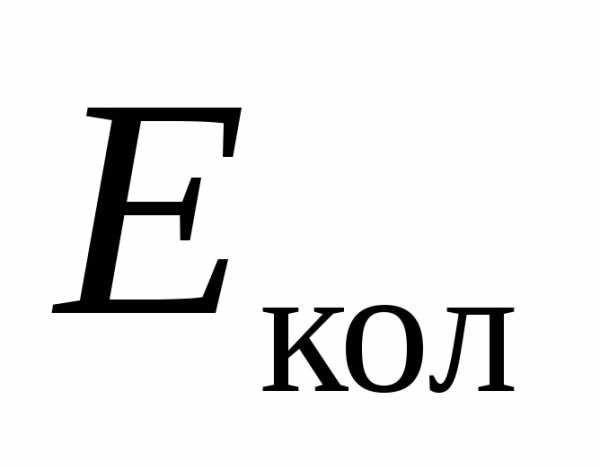 и
и .
Полная энергия молекулыEможет быть представлена в виде суммы
этих энергий
.
Полная энергия молекулыEможет быть представлена в виде суммы
этих энергий
, причем по порядку величины, гдеm– масса электрона,M– масса молекулы (). Следовательно. ЭнергияэВ, эВ,эВ.
Согласно законам квантовой механики, эти энергии принимают только квантованные значения. Схема энергетических уровней двухатомной молекулы представлена на рис. (для примера рассмотрены только два электронных уровня –показаны жирными линиями). Электронные уровни энергии далеко отстоят друг от друга. Колебательные уровни расположены значительно ближе друг к другу, а вращательные уровни энергии располагаются еще ближе друг к другу.
Типичные молекулярные спектры – полосатые, в виде совокупности полос различной ширины в УФ, видимой и ИК области спектра.
studfiles.net
