Атомная теория » HimEge.ru
Модель атома азота
Все тела окружающие нас, несмотря на их разнообразие, состоят из мельчайших частиц — атомов, состоящих, в свою очередь, из еще меньших частиц — протонов, нейтронов и электронов. Это стало известно относительно недавно, атом долгое время считался неделимой частицей, т.е простейшей (см историю развития представлений об атоме).
В основе современной теории строения атома лежат следующие основные положения:
- Атом состоит из ядра и электронной оболочки
- Электронная оболочка – совокупность движущихся вокруг ядра электронов
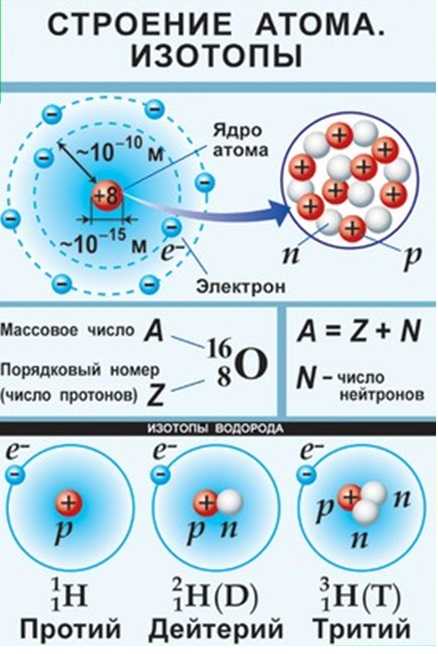
- Ядра атомов заряжены положительно, они состоят из протонов p и нейтронов n (вместе носят название нуклоны).Заряд ядра равен сумме протонов (обозначены красным цветом на рисунке).
- Атом в целом электронейтрален, число электронов е– равно числу протонов p+ , равно порядковому номеру элемента в таблице Менделеева. Именно заряд ядра является основной характеристикой атома и определяет его положение в таблице Менделеева. Хими́ческийэлеме́нт — совокупность атомов с одинаковым зарядом ядра.
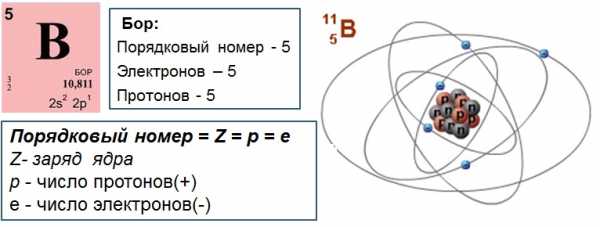 Например, водород, первый элемент таблицы, имеет самое простое строение – его ядро представляет собой одни протон, а электронная оболочка состоит из одного электрона. Атом бора имеет порядковый номер 5, это значит, что заряд ядра атома бора =+5, ядро содержит 5 протонов, электронная оболочка содержит 5 электронов.
Например, водород, первый элемент таблицы, имеет самое простое строение – его ядро представляет собой одни протон, а электронная оболочка состоит из одного электрона. Атом бора имеет порядковый номер 5, это значит, что заряд ядра атома бора =+5, ядро содержит 5 протонов, электронная оболочка содержит 5 электронов.
- Если атом присоединяет или отдает электроны (несущие отрицательный заряд) то его электронейтральность нарушается, он превращается в отрицательно или положительно заряженный ион соответственно.

Э0-ne—=Эn+
Э0+ne—=Эn-
В атомах имеются небольшие тяжелые ядра, в состав которых входят протоны и нейтроны и в которых сосредоточена почти вся масса атома. Большая часть атома заполнена электронами и представляет собой почти пустое пространство.
Помимо заряда ядра, ещё одной важной характеристикой атома является его масса или массовое число. Вся масса атома сосредоточена в маленьком ядре, массой электронов пренебрегают, тк масса электрона почти в 2000 раз меньше массы протона. Массовое число равно сумме числа протонов и нейтронов в ядре. Например, у кислорода, массовое число = 16, тк его ядро содержит 8 протонов (красные кружочки) и 8 нейтронов (белые кружочки).
В природе существуют атомы одного элемента, т.е имеющие одинаковый заряд ядра, но разные массовые числа — изотопы (от др.-греч. ισος — «равный», «одинаковый», и τόπος — «место», занимают одно и то же «место» в таблице Менделеева)
В таблице Менделеева приведена относительная атомная масса — среднее арифметическое масс изотопов с учетом их % содержания в земной коре.
Количество нейтронов не указывается в таблице, поэтому чтобы рассчитать число нейтронов, нужно из массы атома (указывается в задании) вычесть порядковый номер (число протонов).
В химических реакциях состав ядер атомов не изменяется (искл. ядерные реакции – не рассматриваются в данном курсе, область изучения физики), изменяться может только состав электронной оболочки (количество электронов). Поэтому нам важно знать, каким образом располагаются электроны в атоме, т.е строение электронных оболочек атомов.
Электроны расположены в трехмерном пространстве вокруг ядра атома. Внутри этого пространства имеются области, в которых могут располагаться электроны. Эти области называются орбиталями. Каждая орбиталь характеризуется размером, формой и ориентацией внутри атома, и каждой присвоено буквенно-цифровое обозначение.
Хотя в атоме имеется большое число орбиталей, в обычных условиях только сравнительно малая их часть занята электронами. Ниже приводится список общепринятых обозначений первых (т. е. ближайших к ядру) восемнадцати орбиталей. Цифра (номер) характеризует размер или средний диаметр орбитали, а буква — форму орбитали. s-Орбиталь представляет собой сферу, центр которой совпадает с центром (ядром) атома, а три р-орбитали напоминают объемные восьмерки, оси которых перпендикулярны друг другу. Таким образом, 1s-орбиталь — сферическая и наименьшая по размерам; 2s-орбиталь — также сферическая, но большего размера; 2р-орбитали имеют форму восьмерок и по размеру сопоставимы с 2s-орбиталью. d-Орбитали имеют более сложную форму.
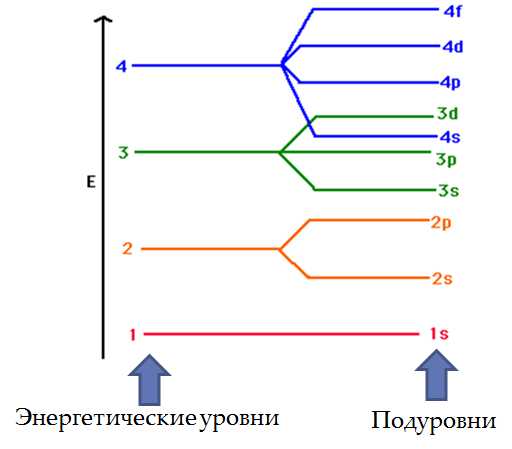

Орбитали группируются в соответствии с их размерами и эти группы называются слоями или оболочками или энергетическими уровнями. В первой электронной оболочке имеется лишь одна орбиталь — 1s. На второй оболочке их уже четыре, а на третьей — девять. Каждая орбиталь может быть свободной (пустой) или занятой одним или двумя электронами. Заметим, что в каждой оболочке (кроме первой) существует три р-орбитали и пять d-орбиталей (во всех оболочках, кроме двух первых). Поскольку на каждой орбитали может находиться по 2 электрона, группу р-орбиталей могут занимать не более 6 электронов, а группу d-oрбиталей — 10 электронов.
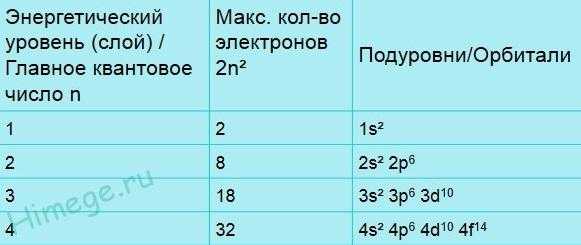 Электроны сначала занимают орбитали низших слоев и только затем — орбитали более высоких уровней. Легкость заполнения орбиталей уменьшается от начала к концу списка. Иными словами, электроны, занимающие более высокие орбитали, имеют большую энергию.
Электроны сначала занимают орбитали низших слоев и только затем — орбитали более высоких уровней. Легкость заполнения орбиталей уменьшается от начала к концу списка. Иными словами, электроны, занимающие более высокие орбитали, имеют большую энергию.
Ниже приведены электронная конфигурация атомов кислорода и серы.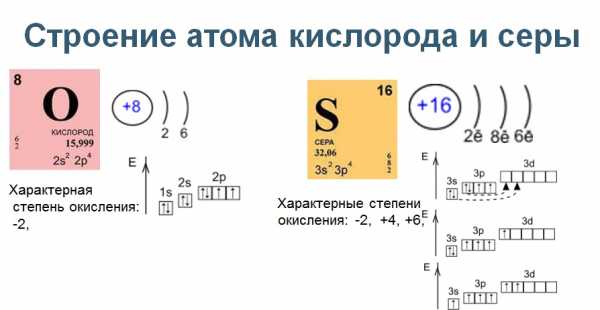
Подробнее про Строение электронных оболочек атомов
himege.ru
Современная теория – строение – атом
Современная теория – строение – атом
Cтраница 1
Современная теория строения атомов и молекул основана на законах, описывающих движение электронов и других частиц, обладающих весьма малой массой – микрообъектов. Эти законы были окончательно сформулированы в 1925 – 1926 гг. Они резко отличаются от законов, определяющих движение больших тел – макрообъектов, к которым принадлежат предметы, видимые в оптический микроскоп или невооруженным глазом. [1]
Современная теория строения атома уже не рассматривает электрон как материальную точку, движущуюся по законам классической механики. Доказано, что электроны сочетают в себе свойства частицы ( корпускулы) и волны, так как подвергаются дифракции. Под электронной орбитой в волновой механике понимают лишь ту сферу вокруг ядра, в которой нахождение электрона наиболее вероятно. [2]
Современная теория строения атома, основанная на квантовой ( волновой) механике, представляет поведение электрона в атоме очень сложным. Электрон – частица определенной массы, движущаяся с большой скоростью. [3]
Современная теория строения атомов и молекул основана на законах, описывающих движение электронов и других частиц, обладающих весьма малой массой, – микрообъектов. Эти законы были окончательно сформулированы в 1925 – 1926 гг.; они резко отличаются от законов, определяющих движение больших тел – макрообъектов, к числу которых принадлежат все предметы, видимые в оптический микроскоп или невооруженным глазом. [4]
Современная теория строения атомов и молекул основана на законах, описывающих движение электронов и других частиц, обладающих весьма малой массой, – микрообъектов. Эти законы были окончательно сформулированы в 1925 – 1926 гг. Они резко отличаются от законов, определяющих движение больших тел – макрообъектов, к которым принадлежат предметы, видимые в оптический микроскоп или невооруженным глазом. [5]
Современная теория строения атома
Современная теория строения атома позволила объяснить электронные структуры атомов всех элементов и показала, что в соответствии с квантовыми закономерностями конфигурация электронной структуры невозбужденного атома однозначно определяется зарядом ядра. Наиболее устойчивым состоянием атома является такое, в котором электроны находятся на наиболее близких к ядру энергетических уровнях. [8]
Современная теория строения атомов и молекул неопровержимо свидетельствует о том, что основой периодического закона является строение электронных оболочек атомов химических элементов. Важнейшая химическая характеристика элементов главных подгрупп – валентность атомов – определяется структурой внешнего электронного слоя, конкретнее – числом неспаренных электронов. [9]
Современная теория строения атомов и молекул основана на законах, описывающих движение электронов и других частиц, обладающих весьма малой массой, – микрообъектов. Эти законы были окончательно сформулированы-в 1925 – 1926 гг. Они резко отличаются от законов, определяющих движение больших тел-макрообъектов, к которым принадлежат предметы, видимые в оптический микроскоп или невооруженным глазом. [10]
Современная теория строения атомов и молекул основана на законах, описывающих движение электронов и других частиц, обладающих весьма малой массой, – микрообъектов. Эти законы были окончательно сформулированы в 1925 – 1926 гг.; они резко отличаются от законов, определяющих движение больших тел-макрообъектов, к числу которых принадлежат все предметы, видимые в оптический микроскоп или невооруженным глазом. [11]
Современная теория строения атомов и молекул основана на новых законах, описывающих движение электронов и других малых частиц – так называемых микрочастиц. Эти законы были сформулированы в 1925 – 1927 гг.; они резко отличаются от законов определяющих движение больших тел – макротел. [12]
Современная теория строения атома, принимающая, что атом состоит из ядерной массы и электронов, стремится свести силы химического сродства к электрическим силам. Эта теория предполагает, что электроны располагаются в определенном порядке вокруг ядра, образуя ряд сфер, с определенным количеством электронов в каждой. Электроны, находящиеся в наружной сфере, наиболее легко подвергаются внешним воздействям, в результате чего может происходить отделение электрона от данного атома и присоединение его на внешнюю сферу другого атома. Вследствие того, что наиболее устойчивым состоянием считается такое, когда на внешней сфере будет 8 электронов, количество присоединяющихся электронов к данному атому будет равно количеству, недостающему до 8 электронов. То же относится к числу отделяющихся электронов: могут отделиться только электроны, находящиеся на внешней сфере, так как за ней внутри находится сфера, обычно, с полным набором электронов. [13]
Современные теории строения атома объясняют эту особенность лантаноидов тем, что у них по мере увеличения атомных весов добавочные электроны располагаются не на внешней, а на одной из более глубоких внутренних электронных оболочек. Постоянство внешней сферы электронов определяет, таким образом, сравнительную неизменность и идентичность химических свойств. В этом отношении с лантаноидами сходна группа транс-урановых ( нептуний, плутоний и др.), связанная генетически с ураном аналогичным типом связи. [14]
Современная теория строения атома прежде всего исходит из представлений о корпускулярно-волновом дуализме электрона и описывает его состояние четырьмя параметрами – квантовыми числами. Предельное число электронов, которое может заселять одну орбиталь, равно двум, что соответствует принципу Паули. Электроны располагаются на одинаковых орбиталях так, чтобы суммарный спин был максимален. [15]
Страницы: 1 2 3
www.ngpedia.ru
2. Современная теория строения атома. Периодический закон и система элементов д.И. Менделеева
2.1. Общие положения
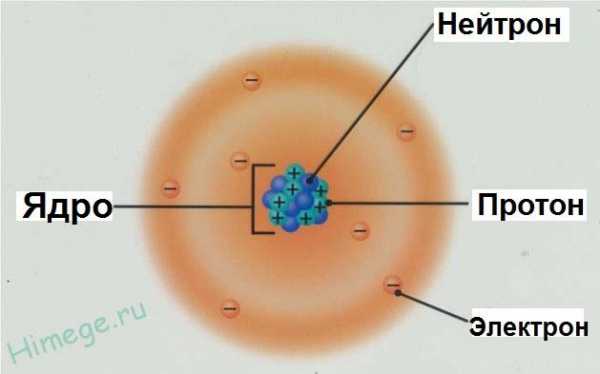
Согласно современным представлениям, атом – это наименьшая частица химического элемента, являющаяся носителем его химических свойств. Атом электрически нейтрален и состоит из положительно заряженного ядра и отрицательно заряженных электронов, которые движутся определённым образом вокруг ядра. Ядро атома, не изменяющееся в ходе химических реакций, составляет его фундаментальную основу и определяет индивидуальность элемента. Поэтому значение заряда ядра выбрали за основной признак, по которому атомы относят к разным видам – химическим элементам.
Ядра атомов включают два вида элементарных частиц: протоны и нейтроны.
Основные характеристики электрона, протона и нейтрона приведены в табл. 2.1.
Таблица 2.1
Сведения о некоторых элементарных частицах.
Частица | Символ | Масса | Заряд | |||
кг | а.е.м. | Кл. | Усл. | |||
протон | p | 1, 673 10-27 | 1, 007276 | 1, 602 10-19 | +1 | |
нейтрон | n | 1, 675 10-27 | 1, 008665 | 0 | 0 | |
электрон | e | 9, 109 10-31 | 0, 000547 | 1, 602 10-19 | -1 | |
Каждый протон несёт положительный заряд, численно равный заряду электрона. Нейтрон же не несёт никакого электрического заряда. Отсюда следует вывод: заряд ядра определяется числом протонов. Количество протонов в ядре атома совпадает с порядковым номером элемента (Z) в периодической системе элементов Д.И. Менделеева.
Как видно из данных табл. 2.1, масса электрона почти в 1840 раз меньше массы протона и нейтрона. В ядре сосредоточено 99,9% массы атома, поэтому масса атома практически равна массе ядра – сумме масс протонов и нейтронов.
Общее число протонов (Z) и нейтронов (N) в ядре называется массовым числом A:
A=Z+N.
Поскольку массы протона и нейтрона практически равны 1а.е.м., то масса атома в а.е.м., как и относительная атомная масса, численно совпадает со значением массового числа А.
Силы, удерживающие протоны и нейтроны в ядре, называют ядерными. Это чрезвычайно большие силы, действующие на очень коротких расстояниях (порядка 10-13 см) и превосходящие силы отталкивания. Природу этих сил изучает ядерная физика.
Исследования показали, что в природе атомы одного и того же элемента имеют различные атомные массы. Так, атомы хлора имеют массу 35 и 37. Ядра этих атомов содержат одинаковое число протонов, но разное число нейтронов. Атомы с одинаковым числом протонов, но с различным числом нейтронов называются изотопами. Для обозначения изотопов пользуются обычными символами соответствующих элементов, добавив к ним слева вверху индекс, указывающий массовое число изотопа, внизу – индекс, указывающий количество протонов, равное порядковому номеру (Z) элемента (). Пример – изотопы водорода:
–протий (1р, 0n)
–дейтерий (1р, 1n)
–тритий (1р, 2n)
В периодической таблице элементов Д.И. Менделеева приводятся усреднённые значения относительных атомных масс с учётом распространённости различных изотопов в природе.
Атомы с различным числом протонов Z и нейтронов N, но с одинаковым числом нуклонов (Z+N) называются изобарами, а с одинаковым числом нейтронов (N) – изотонами.
Примеры изобаров и изотонов:
Изобары Изотоны
Поскольку атом в целом является электронейтральным, а заряд электрона численно равен заряду протона и противоположен ему по знаку, то общее число электронов в атоме равно числу протонов и, следовательно, равно порядковому номеру элемента в периодической системе элементов.
studfiles.net
Современная модель строения атома
Количество просмотров публикации Современная модель строения атома – 82
В корне современной теории строения атома лежат работы Дж. Томсона (который в 1897 ᴦ. открыл электрон, а в 1904 ᴦ. предложил модель строения атома, согласно которой атом – ϶ᴛᴏ заряженная сфера с вкрапленными электронами (модель ʼʼкекс с изюмомʼʼ)), Э. Резерфорда (который в 1910 ᴦ. открыл ядро и предложил ядерную планетарную модель атома), М. Планка (который в 1900 ᴦ. высказал предложение, что вещества поглощают и пропускают энергию дискретными пропорциями, названными им квантами), Н. Бора (который в 1910 ᴦ. предложил модель строения атома водорода), А. Эйнштейна (который в 1905 г предсказал, что любое излучение представляет собой поток квантов энергии, назваными им фотонами), Луи де Брайля (который в 1924 ᴦ. выдвинул предложение, что электрон характеризуется также корпускулярно-волновым дуализмом), В. Гейзенберга (который в 1927 ᴦ. постулировал принцип неопределенности), Э. Шредингера (который в 1926 ᴦ. вывел математическое описание поведения электрона в атоме) и многих других. Работы этих ученых заложили основу квантовой механики, изучающей движение и взаимодействие микрочастиц.
Современная модель строения атома базируется на четырех положениях:
1. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома (к примеру, радиус атома водорода сост. 0,046 нм, а радиус протона или ядра атома водорода составляет 6,5.10-7 нм).
2. Положительный заряд и почти вся масса атома сосредоточены в ядре атома.
3. Ядра атомов состоят из протонов и нейтронов (общее название нуклоны). Число протонов в ядре равно порядковому номеру элемента͵ а сумма чисел протонов (p) и нейтронов (n) соответствует его массовому числу.
4. Вокруг ядра по орбиталям вращаются электроны. Число электронов в невозбужденном (основном) сост. равно заряду ядра (табл. 1).
Различные виды атомов имеют общее название – нуклиды. Нуклиды с одинаковым зарядом, различными массовыми числами и числом нейтронов в ядре принято называть изотопами. Нуклиды с одинаковыми массовыми числами, но различными зарядами ядра и числа нейтронов в ядре называются изобарами. Нуклиды с одинаковым числом нейтронов, но различным зарядом и массовым числом принято называть изотонами.
В соответствии с представлениями квантовой механики, электрон обладает двойственной природой, ᴛ.ᴇ. корпускулярно-волновым дуализмом: с одной стороны электрон – ϶ᴛᴏ частица, которая имеет массу, заряд и скорость движения; а с другой стороны электрон проявляет волновые свойства, такие как способность к дифракции, интерференции и особенности движения. Согласно принципу неопределенности В. Гейзенберга невозможно точно определить энергию и положение электрона, в связи с этим в квантовомеханической модели атома используют вероятностный подход для характеристики положения электрона. Вероятность нахождения электрона в определенной области пространства описывается квадратом волновой функции Ψ2 (пси), которая характеризует амплитуду волны, как функцию координат электрона. Электрон может находиться в любой части околоядерного пространства, однако вероятность его нахождения в разных частях этого пространства неодинакова.
Таблица 1.
Свойства электронных частиц образующих атомы
| Частицы | Обозна-чение | Масса покоя | Заряд | |||
| г | a. е м. | В единицах массы электрона | Кл | В единицах заряда электрона | ||
| Электрон | –0e или е | 9,110*10-28 | 0,000549 | -1,6*10-19 | -1 | |
| Протон | 1p или р | 1,673*10-24 | 1,007276 | 1,6*10-19 | +1 | |
| Нейтрон | 1n или n | 1,675*10-24 | 1,008665 |
Пространство вокруг ядра, в котором вероятность нахождения электрона достаточно велика, принято называть орбиталью.
Орбиталь характеризует вероятность нахождения электрона в определенном пространстве вокруг ядра. Она ограничена в трехмерном пространстве поверхностями какой-либо формы. Вероятность нахождения электрона внутри данной области пространства составляет не менее 95 %.
Волновая функция входит в уравнение Шредингера, решение которого позволяет описать поведение электрона в атоме. Точно это уравнение решено для атома H и ионов He+, Li2+, H2+. Оно имеет бесконечно большое число решений, поскольку энергия электрона может принимать бесконечно большое число квантовых значений, однако все решения можно разделить на три серии и ограничиться только теми значениями энергии, которые один электрон может принимать в поле ядра атома водорода (протона). Три серии решения уравнения объединяются значениями связанных между собой квантовых чисел, ᴛ.ᴇ. положения электрона в атоме описывается четырьмя квантовыми числами.
referatwork.ru
Современные представления о строении атома
Осознание содержания этого пункта позволяет:
характеризовать основные положения современной теории строения атома, состав атомных ядер;
объяснять значение понятий «нуклиды», «нуклоны», «изотопы», «орбиталь»;
уметь определять число протонов и нейтронов в ядре атома, число электронов в атоме, его массовое число.
За 25 веков, со времен философов Древней Греции и до конца XIX в., В науке господствовало мнение о том, что атом — наименьшая неделимая частица вещества, которая остается неизменной при любых процессов или явлений.
Однако в конце XIX в. в физике был сделан ряд открытий, которые показали сложное строение атома.
— Вспомните, какие открытия стали прямыми доказательствами сложности атома.
На основании новых открытий начала развиваться теория строения атома (модель строения атома Э. Резерфорда, 1911 г.; модель Н. Бора, 1913 г.).
— Объясните, что является общим для этих моделей и чем они отличаются друг от друга.
Современная теория строения атома возникла как результат переосмысления и дополнения теории Бора. Существенным нововведением стало понятие о электронное облако (атомную орбиталь), которое пришло на смену понятию о электрон лишь как частицу. Орбиталью называется пространство вокруг ядра, в котором пребывания электрона скорее. Современная квантовая теория строения атома учитывает волновые свойства электрона и других элементарных частиц — протонов, нейтронов и т.д..
Основные положения современной теории строения атома
1. Электрона свойственна двойственная (корпускулярно — волновая) природа. Как частица электрон имеет определенную массу и заряд, а как волна — способность к дифракции (огибания препятствия).
2. Для электрона невозможно одновременно и точно измерить координату и энергию. В каждый момент времени можно определить только одну из этих свойств.
3. Электрон в атоме не вращается вокруг ядра по определенной траектории, а может двигаться в любой части навколоядерного пространства. Однако вероятность нахождения его в разных частях пространства неодинакова.
4. Ядра атомов состоят из протонов и нейтронов. Число протонов равно атомному номеру элемента (протонное число), а сумма чисел протонов и нейтронов (нуклонов) соответствует его массовому числу.
Различные виды атомов имеют общее название — нуклиды. Важнейшие характеристики нуклидов — атомный номер и массовое число, их обозначают слева от символа элемента, например n Na — нуклид Натрия. Если нуклиды одного и того же элемента имеют одинаковый заряд ядра, но разные массовые числа, они называются изотопами.
Атом — сложная частица. Он состоит из положительно заряженного ядра и отрицательно заряженных электронов. Ядро атома содержит протоны и нейтроны, общее название которых — нуклоны.
Масса атома сосредоточена в его ядре. Количество протонов и нейтронов определяет массовое число элемента. Количество протонов в ядре равно атомному номеру (протонном числу) элемента, а число нейтронов — массовому числу минус атомный номер.
Электрон имеет корпускулярно — волновую природу. Число электронов в атоме также равно атомному номеру (протонном числу) элемента.
Электроны в атоме постоянно движутся, но определенной траектории движения они не имеют. Электрон может находиться в любом участке пространства около ядра, образуя электронное облако. Такая трехмерная участок пространства около ядра, где пребывание электрона скорее, называется орбиталью.
категория: Химияmoykonspekt.ru
Строение атома – Курс «Концепции современного естествознания». Шпаргалки
В конце XIXв. были проведены опыты, которые выявили, что атомы могут не только делиться, но и превращаться из одних в другие.
С тех пор в химии был выделен новый раздел, который получил название «Строение атома». Настоящее исследование строения атома началось примерно в 1897–1898 гг. В это время было достоверно установлено, что при электрических разрядах в разреженных газах возникают катодные лучи. Опыт с катодными лучами был проведен так: в стеклянные трубки, в которые были впаяны электроды, закачивали воздух, а затем пропускали через них электричество. Катодные лучи являются невидимыми для человеческого глаза, но те места, через которые они проходят, «горят» светло-зеленым светом.
Катодные лучи не распространяются вне трубки, так как стекло для них непроницаемо. Ученые выяснили, что катодные лучи состоят из мельчайших частиц. Эти мельчайшие частицы несут отрицательный заряд, а скорость их передвижения равняется половине скорости света. Известна масса и величина заряда атома. Так, масса атома составляет 0,00055 углеродной частицы, а заряд – 1,602 на 10 в минус 19 степени.
Между массой частиц, величиной их заряда и между природой газа, который они составляют, нет ни малейшей связи. Величина и заряд частиц не зависят от вещества, из которого сделаны электроды, а также от других условий опыта. Кроме того, катодные частицы известны только в заряженном состоянии и не могут существовать без своих зарядов, не могут быть превращены в электронейтральные частицы: электрический заряд составляет самую сущность их природы. Эти частицы называются электроны.
В 1911 г. Резерфорд предложил свою теорию строения атома:
1) атом состоит из атомного ядра, которое является положительно заряженным;
2) химическая связь между атомами различных элементов – это проявление взаимодействия между двумя внешними электронами соседних атомов.
Несмотря на то что модель Резерфорда была самой современной на то время, она не объяснила главное: почему один атом после столкновения с атомами других веществ всегда возвращается в свое исходное положение.
Объяснение этого постоянства дал Нильс Бор. Бор применил квантовую гипотезу Планка к модели Ре-зерфорда и доказал, что если атом может изменять свою энергию только прерывно, атом существует лишь в дискретных стационарных состояниях. Низшее из этих состояний и есть нормальное состояние для атома. Теперь в физике было объяснено то, что не смог объяснить Резерфорд.
Теория Бора была подтверждена в многочисленных теориях таких известных мировых ученых, как Франк, Герц, Штерн, Герлах, и ряда других.
students-library.com
Современная теория – строение – атом
Современная теория – строение – атом
Cтраница 2
В основе современной теории строения атома лежит представление о двойственной природе м: икрочастиц, и в частности электронов. Оказывается, электроны могут вести себя и как частицы, и как волны – электроны обладают одновременно и корпускулярными и волновыми свойствами. [16]
Основой и началом современной теории строения атома явилось квантово-механическое описание атома, предложенное Шредингером. Сущность его заключается в том, что движение микрообъекта описывается волновым уравнением, а определение местоположения объектов производится по вероятностным принципам. [18]
Бора, Шредингера и других создателей современной теории строения атома и химической связи описаны в гл. Здесь мы совершим путешествие в более далекое прошлое и сосредоточим внимание на двух ученых, революционизировавших химию: один из них, Антуан Лавуазье ( 1743 – 1794), продемонстрировал, что важнейшим свойством, сохраняющимся в любой химической реакции, является масса, а другой, Джон Дальтон ( 1766 – 1844), выдвинул предположение об атомах как об элементарных частицах, участвующих в химических реакциях. В принципе Дальтон не первым выдвинул предположение об атомах, но он первым убедительно показал, что атомы действительно существуют и что они создают удобную основу для понимания химических реакций. [19]
Как впервые показал Бор, работы которого лежат в основе современной теории строения атома, движение электрона вокруг ядра квантуется. Точное описание атома требует применения волновой механики. Однако общим приемом при описании атомных систем является рассмотрение, в первую очередь, движения электрона на основании классической механики, а затем уже вопроса о том, какие изменения вносит в это движение квантовая теория. Этот метод неоднократно применялся в гл. IV и будет применен также при обсуждении атома водорода. Использование классических представлений не только дает основу для дальнейшего обсуждения и установления удобной номенклатуры, но для многих целей является также достаточно хорошим приближением. Поэтому классическая трактовка излагается весьма подробно, после чего рассматривается квантование движения и, наконец, излагаются некоторые соображения, связанные с волновой теорией. [20]
Истинная оценка споров была дана позже с позиций диалектического материализма и на основе современной теории строения атома. [21]
Представление об этих полях дает ясное объяснение характера межмолекулярных сил, первоначально возникшее на чисто физической основе за десятки лет до создания современных теорий строения атома и молекулы. [22]
Изучение внутреннего строения металлов и сплавов позволило утеным сделать вывод о том, что изменения свойств металлов и сплавов определяются особенностями их внутреннего строения. По современной теории строения атомов каждый атом состоит из положительно заряженного ядра и вращающихся вокруг него с огромной скоростью отрицательно заряженных электронов. [23]
Прежде всего было обращено внимание на то обстоятельство, что при окислении всегда увеличивается положительная валентность того или иного атома окисляемого вещества, а при восстановлении эта валентность уменьшается. Но с точки зрения современной теории строения атома изменение валентности элемента зависит от изменения числа электронов во внешней электронной оболочке атомов. Стало быть, при окислении валентность окисляемого элемента повышается за счет отдачи электронов. [24]
Спектральный анализ был открыт более 100 лет тому назад ( I860 г.) Кирхгофом и Бунзеном. Теория спектров легла в основу современной теории строения атома. Методы и задачи спектрального анализа, с одной стороны, и анализа спектров – с другой, существенно различны. Однако при рассмотрении спектрального анализа необходимо знать основные положения теории спектров. [25]
В этом ряду сделано исключение только для калия, который должен был бы стоять впереди аргона. Как увидим впоследствии, это исключение находит полное оправдание в современной теории строения атома. [26]
В этом ряду сделано исключение только для калия, который должен был бы стоять впереди аргона. Как увидим впоследствии, это исключение находит полное, оправдание в современной теории строения атома. [27]
Теория химического строения, созданная А. М. Бутлеровым ( I860 г), и развитая его учениками В. В. Марковниковым, А. М. Зайцевым и др., впервые дала руководящие идеи для оформления органической химии как науки. Эта теория основана на таких представлениях, как пространственное расположение атомов в составе молекулы, взаимное влияние атомов, входящих в состав одной молекулы, зависящее от их взаимного расположения, изомерия и элементы стереохимии. Это нашло подтверждение и уточнение в современной теории строения атома и теории химической связи, одинаково необходимой как в неорганической, так и в органической химии. [28]
Теория химического строения, созданная А. М. Бутлеровым ( 1860) и развитая его учениками В. В. Марковниковым, А. М. Зайцевым и др., способствовала оформлению органической химии как науки. Эта теория основана на таких представлениях, как пространственное расположение атомов в молекуле, взаимное влияние атомов, зависящее от их расположения, изомерия и элементы стереохимии. Это нашло подтверждение и уточнение в современной теории строения атома и теории химической связи, одинаково необходимой как в неорганической, так и в органической химии. [29]
В 1925 – 1926 гг. Гейзенберг ( Германия) и Шредингер ( Австрия) предложили независимо друг от друга два варианта новой механики; впоследствии было показано, что оба варианта приводят к тождественным результатам. Метод Шредингера оказался более удобным для выполнения расчетов; современная теория строения атомов и молекул основывается на этом методе. [30]
Страницы: 1 2 3
www.ngpedia.ru