Строение атома сурьмы (Sb), схема и примеры
Общие сведения о строении атома сурьмы
Относится к элементам p-семейства. Полуметалл. Обозначение – Sb. Порядковый номер – 51. Относительная атомная масса – 121,75 а.е.м.
Электронное строение атома сурьмы
Атом сурьмы состоит из положительно заряженного ядра (+51), внутри которого есть 51 протон и 71 нейтрон, а вокруг, по пяти орбитам движется 51 электрон.
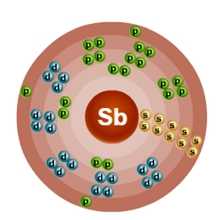
Рис.1. Схематическое строение атома сурьмы.
Распределение электронов по орбиталям выглядит следующим образом:
+51Sb)2)8)18)18)5;
1s22s22p63s23p63d104s24p64d105s25p3.
Внешний энергетический уровень атома сурьмы содержит 5 электронов, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
Наличие трех неспаренных электронов свидетельствует о том, что для сурьмы характерна степень окисления +3. За счет наличия вакантных орбиталей 5d-подуровня для атома сурьмы возможно возбужденное состояние (степень окисления +5):
Валентные электроны атома сурьмы можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
|
Подуровень |
n |
l |
ml |
s |
|
s |
5 |
0 |
0 |
+1/2 |
|
s |
5 |
0 |
0 |
|
|
p |
5 |
1 |
-1 |
+1/2 |
|
p |
5 |
1 |
0 |
+1/2 |
|
p |
5 |
1 |
+1 |
+1/2 |
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Строение атома цезия (Cs), схема и примеры
Общие сведения о строении атома цезия
Относится к семейству s-элементов. Металл. Обозначение – Cs. Порядковый номер – 55. Относительная атомная масса – 132,95 а.е.м.
Электронное строение атома цезия
Атом цезия состоит из положительно заряженного ядра (+55), внутри которого есть 55 протонов и 78 нейтронов, а вокруг, по шести орбитам движутся 55 электронов.
Рис.1. Схематическое строение атома цезия.
Распределение электронов по орбиталям выглядит следующим образом:
+55Cs)2)8)18)18)8)1;
1s22s22p6
Внешний энергетический уровень атома цезия содержит 1 электрон, который является валентным. Возбужденного состояния нет. Энергетическая диаграмма основного состояния принимает следующий вид:
Валентный электрон атома цезия можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
|
Подуровень |
n |
l |
ml |
s |
|
s |
6 |
0 |
0 |
+1/2 |
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Строение атома индия (In), схема и примеры
Общие сведения о строении атома индия
Относится к элементам p-семейства. Металл. Обозначение – In. Порядковый номер – 49. Относительная атомная масса – 114,82 а.е.м.
Электронное строение атома индия
Атом индия состоит из положительно заряженного ядра (+49), внутри которого есть 49 протонов и 66 нейтронов, а вокруг, по пяти орбитам движутся 49 электронов.
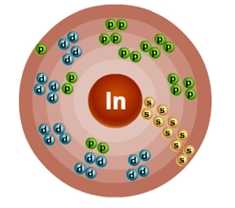
Рис.1. Схематическое строение атома индия.
Распределение электронов по орбиталям выглядит следующим образом:
+49In)2)8)18)18)3;
1s22s22p63s23p63d104s24p64d105s25p1.
Внешний энергетический уровень атома индия содержит 3 электрона, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
Валентные электроны атома индия можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
|
Подуровень |
n |
l |
ml |
s |
|
|
5 |
0 |
0 |
+1/2 |
|
s |
5 |
0 |
0 |
-1/2 |
|
p |
5 |
1 |
-1 |
|
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Строение атома рутения (Ru), схема и примеры
Общие сведения о строении атома рутения
Относится к элементам
Электронное строение атома рутения
Атом рутения состоит из положительно заряженного ядра (+44), внутри которого есть 44 протона и 57 нейтронов, а вокруг, по пяти орбитам движутся 44 электрона.
Рис.1. Схематическое строение атома рутения.
Распределение электронов по орбиталям выглядит следующим образом:
+44Ru)2)8)18)15)1;
1s22s22p63s23p63d104s24p64d75s1.
Валентными электронами атома рутения считаются электроны, расположенные на 4d— и 5s-орбиталях. Энергетическая диаграмма основного состояния принимает следующий вид:
Валентные электроны атома рутения можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
|
Подуровень |
n |
l |
ml |
s |
|
s |
5 |
0 |
0 |
+1/2 |
|
d |
4 |
2 |
-2 |
+1/2 |
|
d |
4 |
2 |
-1 |
+1/2 |
|
d |
4 |
2 |
0 |
+1/2 |
|
d |
4 |
2 |
+1 |
+1/2 |
|
d |
4 |
2 |
+2 |
+1/2 |
|
d |
4 |
2 |
-2 |
-1/2 |
|
d |
4 |
2 |
-1 |
-1/2 |
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Строение атома кремния (Si), схема и примеры
Общие сведения о строении атома кремния
Относится к элементам p-семейства. Неметалл. Обозначение – Si. Порядковый номер – 14. Относительная атомная масса – 28,086 а.е.м.
Электронное строение атома кремния
Атом кремния состоит из положительно заряженного ядра (+14), состоящего из 14 протонов и 14 нейтронов, вокруг которого по 3-м орбитам движутся 14 электронов.

Рис.1. Схематическое строение атома кремния.
Распределение электронов по орбиталям выглядит следующим образом:
+14Si)2)8)4;
1s22s22p63s23p2.
На внешнем энергетическом уровне кремния находится четыре электрона, все электроны 3-го подуровня. Энергетическая диаграмма принимает следующий вид:
Наличие двух неспаренных электронов свидетельствует о том, что кремний способен проявлять степень окисления +2. Также возможно возбужденное состояние для атома кремния за счет наличия вакантной 3d-орбитали. Электроны 3s -подуровня распариваются и занимают свободные d-орбитали:
Поэтому у кремния есть ещё одна степень окисления, равная +4.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Сурьма строение – Справочник химика 21
Известно множество продуктов присоединения пятифтористой сурьмы строение многих из них не объяснено. [c.273]Повышение анилиновой точки и понижение показателя лучепреломления фракции после обработки ее пятихлористой сурьмой указывало иа то, что фракция обогатилась парафиновыми углеводородами такого строения, которые не реагируют с пятихлористой сурьмой. По мнению авторов, этими углеводородами являются нли н-гептан (т. кип. 98,4°), или [c.117]
Опишите строение неметаллических и металлических модификаций азота, фосфора, мышьяка, сурьмы и висмута. [c.73]
Строение внешней электронной оболочки атома Азот Фосфор Мышьяк Сурьма Висмут [c.427]
Фосфор, мышьяк или сурьма (имеющие электронное строение внешнего энергетического уровня s pЗ и проявляющие валентность 5), будучи введенными в кристаллические решетки германия или олова (электронное строение внешнего уровня 5 р валентность 4) ведут себя как донорные примеси, т. е. отдают электроны и создают проводимость п-типа. Если же в германий или кремний ввести бор, алюминий, галлий или индий (электронное строение внешнего уровня 5 р, валентность 3), то атомы примеси захватывают четвертый электрон и полупроводник обнаруживает проводимость р-типа. [c.186]
Больщинство известных химических элементов, находясь в виде простых веществ, представляют собой металлы. Некоторые элементы (германий, мышьяк, сурьма, алюминий) в одних условиях ведут себя как металлы, в других условиях — как неметаллы. Все металлы имеют на внешнем энергетическом уровне небольшое число валентных электронов — электронные конфигурации металлов представлены в табл. I. Повторение химических свойств металлов обусловлено периодическим повторением строения электронных конфигураций внешних электронных уровней. [c.317]
Элементы подгруппы азота. Строение их атомов и химическая характеристика. Простые вещества азот, фосфор, мышьяк, сурьма, висмут. Их получение. [c.250]
По строению атомов (п. 4) можно судить, что элементы этой аналитической группы будут проявлять неметаллические свойства, которые усиливаются в ряду Sn—Sb—As. Очевидно, наибольшее сходство химических свойств будет у мышьяка и сурьмы как у элементов, находящихся в одной группе периодической системы Д. И. Менделеева. [c.274]
Сопоставляя температуры плавления с данными о строении плавящихся фаз, можно отметить следующие закономерности. Т ц неметаллов одной подгруппы и однотипной структуры растут с увеличением порядкового номера п. Это наблюдается у инертных газов, галогенов, кислорода и его аналогов, азота и фосфора. В подгруппе кислорода полоний — металл, в подгруппе азота — мышьяк, сурьма и висмут тоже металлы, поэтому они не следуют указанному правилу. [c.280]
У церия плавление сопровождается переходом к более плотной упаковке атомов и увеличением плотности на 2,5%. Плавление углерода, кремния, галлия, германия, мышьяка, сурьмы, теллура, висмута связано с большими изменениями их строения и свойств. Описание этих изменений имеется в гл. X. С ними связаны высокие значения [c.285]
Бензоилхлорид с хлоридом алюминия или пентахлоридом сурьмы образует комплексы, которые могут быть выделены в их ИК-спектрах наблюдаются интенсивные полосы в области 1560, 1575 и 1665 и 1656 см , а также слабые полосы в области 2215 см- . Каково нх строение и поглощению каких групп можно приписать указанные выще частоты [c.133]
Замещение хлора в различных по своему строению хлоридах на фтор осуществляется действием фтора, фтористого водорода, фтористого калия, фтористого серебра или трехфтористой сурьмы [c.204]
Комплексным соединениям сурьмы, представляющим собой производные пирокатехина, содержащим сульфогруппу, приписывается строение [c.210]
Исследованиями и на практике установлено, что разнообразные металлы и сплавы имеют при одних и тех же условиях трения различную склонность к схватыванию и что чистые металлы в большинстве своем имеют большую склонность к взаимному схватыванию. Исключение составляют висмут, сурьма и некоторые другие металлы, которые в связи с особенностями их атомного строения даже в чистом состоянии не проявляют склонности к схватыванию. [c.104]
Сурьма принадлежит к пятой группе периодической системы химических элементов Д. И. Менделеева и входит в подгруппу мышьяка. Атомная масса сурьмы равна 121,75 [213, 992], атомный номер 51. Строение электронной оболочки 1 , 2 , 2/) , З , Зр 45 , 4р , 4 1 , 5s 5р [c.7]
Ниже мы рассмотрим строение соединений ксенона без особого углубления в их стереохимию. Взаимное расположение связей большей частью отвечает простым соотношениям стереохимии непереходных элементов, изложенных в гл. 7, что делает очень сходными стереохимию ксенона и иода. Очевидно также, что осложнения, возникающие при наличии определенных валентных групп в стереохимии сурьмы, теллура и иода, обнаруживаются и здесь. [c.47]
Метод хлорирования предельных углеводородов пятихлористой сурьмой применяется для определения содержания парафинов нормального строения в нефтепродуктах (бензинах, керосинах, маслах, твердых парафинах) [100, 101]. Хлорирование углеводородных смесей проводилось в растворе I4 в следующих стандартизированных условиях, которые обеспечивали полное хлорирование третичного атома углерода при практически полном исключении хлорирования вторичного и первичного атомов. [c.73]
Комплексные соединения пентафторидов As, Sb и Bi обычно отвечают составу М[ЭРб], реже Мг[Эр7]. Ядерные расстояния ЭР в октаэдрических ионах [ЭРе] равны 1,78 (As) или 1,85 А (Sb). Тенденция к ком-плексообразованию по схеме Р + ЭРд = ЭР особенно сильно выражена у сурьмы. Поэтому при взаимодей-Рис. IX-61. Строение Хер2-zsbFs. ствии С другими фторидами SbFs обычно выступает в [c.476]
Валентная электронная конфигурация всех элементов VA-группы— ns np , т. е. на внешнем энергетическом (валентном) уровне они содержат 2 спаренных s-электрона и 3 неспаренных (в соответствии с правилом Гунда) электрона на трехкратно вырожденном р-уровне. Однако между элементами этой группы существуют и различия в электронном строении. Так, у фосфора в отличие от азота впервые появляется вакантный внешний М-уровепь, что обусловливает возможность промотирования одного 35-электрона с образованием пятиковалентного состояния, которое, как известно, отсутствует у азота. У мышьяка, сурьмы и висмута к вакантному -уровню добавляется еще в отличие от фосфора полностью завершенный внутренний (п—1) -уровень, а у висмута, следующего за лентаноидами, кроме того, и 4/ -уровень. [c.282]
Наличие заполненных предвнешних (п—l)d- и (п—2)/-уровней сверх оболочки предыдущего благородного газа накладывает отпечаток на свойства элементов подгруппы мышьяка. Отметим, что между собой мышьяк, сурьма и висмут являются полными электронными аналогами и отличаются с точки зрения электронного строения от типических элементов VA-группы — азота и фосфора, т. е. по отношению к ним являются неполными электронными аналогами. [c.282]
Свойства элементов и простых веществ закономерно изменяются в подгруппе с ростом радиуса атомов и уменьшением энергии ионизации, как это можно видеть из табл. 27. Азот и фосфор — типичные неметаллы, т. е. кислотообразователи. Различия в строении предвнеш-него электронного уровня у атомов фосфора и мышьяка меньше сказываются на изменении свойств элементов, чем при переходе от кремния к германию в IVA-подгруппе. У мышьяка сильнее выражены неметаллические свойства. У сурьмы неметаллические и металлические свойства проявляются приблизительно в одинаковой степени. Для висмута характерно преобладание металлических (основных) свойств. [c.339]
Исследовано 22 жидких металла. У 16 металлов вблизи точки плавления г находится в интервале от 8 до 9 (металлы подгруппы лития, алюминий, галлий, индий, таллий, железо, кадмий, ртуть, висмут, сурьма, германий, олово). Надо полагать, что в этих простых жидкостях относительно широко распространены фрагменты ОЦК структуры, В пяти случаях (медь, серебро, золото, свинец, цинк) 2 = 11, В этих жидких металлах, видимо, преобладают фрагменты плотноупакованных структур. Если твердая фаза имеет ОЦК структуру, то после плавления координационное число, как правило, сохраняется близким к 8 и нередко остается почти без изменений в больиюм интервале температур, достигающем несколько сот градусов (щелочные металлы, алюминий). Когда твердая фаза в точке плавления не имеет ОЦК структуры, во многих случаях после плавления г 8, Следовательно, строение жидкостей и в этих случаях можно охарактеризовать как ОЦК решетку, содержащую столь большое число дефектов, что дальняя упорядоченность атомов отсутствует. Таковы жидкие инертные газы, олово, алюминий, никель, висмут, германий, сурьма, галлий, индий, кадмий, ртуть. [c.269]
Подгруппа иьппьяка. Характеристика элементов УА-группы. Валентная электронная конфигурация всех элементов УА-Г1зуппы — пз пр , т.е. на внешнем энергетическом (валентном) уровне они содержат два спаренных -электрона и три неспаренных электрона на трехкратно вырожденном пр-уровне. Однако между элементами этой группы существуют и р личия в электронном строении. У мышьяка, сурьмы и висмута к вакантному пс(-уровню добавляется еще в отличие от фосфора полностью завершенный внутренний (п — 1) -уровень, а у висмута, следующего за лантаноидами, кроме того, и 4/ -уровень. В силу наличия внутренних и /оболочек, экранирующих внешние электроны, в ряду Аз — 8Ь — В1 проявляется вторичная периодичность. В результате этого для среднего элемента ряда — сурьмы — степень окисления +5 оказывается более стабильной, чем для мышьяка и висмута. [c.417]
Лекарственные вещества, содержащие сурьму в органической молекул напоминают по строению мышьякоргаиические соединения. Для определ( ния сурьмы ич подвергают минерализации с концентрнровапион серно кислотон в присутствии азотной кислоты. [c.211]
Присадка 0,12—0,63% ЗЬ устраняет дендритную структуру аустенита, растворимость углерода в аустените возрастает, наблюдается увеличенное количество игл вторичного цементита. Аустенит становится более склонным к переохлаждению, и эвтектоид приобретает тонкое строение. Однако присадка сурьмы в количествах более 0,45% приводит к нежелательным изменениям структуры. Вытянутые дендриты аустенита не образуются. Междендрит-иые пространства заполняются уже не эвтектикой, а полями струк- [c.70]
Сервантит. Белый, при нагревании желтеет, при прокаливании разлагается. Возможно, имеет строение (8ЬО )8ЬОз. Не реагируег с водой. Разлагается концентрированными кислотами, реагируег со щелочами при сплавлении. Восстанавливается водородом, углеродом, сурьмой. Получение см. 375 , 37б, 384. [c.196]
chem21.info
Строение атома радия (Ra), схема и примеры
Общие сведения о строении атома радия
Относится к элементам s-семейства. Металл. Обозначение – Ra. Порядковый номер – 88. Относительная атомная масса – 226,025 а.е.м.
Электронное строение атома радия
Атом радия состоит из положительно заряженного ядра (+88), внутри которого есть 88 протонов и 138 нейтронов, а вокруг, по семи орбитам движутся 88 электронов.
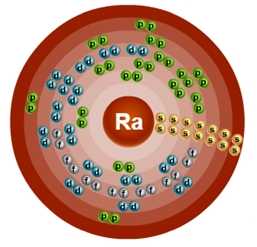
Рис.1. Схематическое строение атома радия.
Распределение электронов по орбиталям выглядит следующим образом:
+88Ra)2)8)18)32)32)8)2;
1s22s22p63s23p63d104s24p64f145s25p65d106s26p67s2.
На внешнем электронном уровне атома радия находится 2 электрона, которые являются валентными (расположены на 7s- подуровне). Энергетическая диаграмма основного состояния принимает следующий вид:
Валентные электроны атома радия можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
|
Подуровень |
n |
l |
ml |
s |
|
s |
7 |
0 |
0 |
+1/2 |
|
s |
7 |
0 |
0 |
-1/2 |
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
