Строение атома. Строение вещества. – Химия
Причины образования химической связи.
Энергия связи. Электроотрицательность
Все вещества образованы из атомов. Напомним: атомы состоят из положительно заряженного ядра и отрицательно заряженных электронов, располагающихся вокруг ядра на атомных орбиталях. Орбитали образуют подуровни (s, p, d, f), подуровни объединяются в энергетические уровни (первый, второй, третий и т. д.). На каждой орбитали может находиться не более двух электронов с противоположными спинами. На s-подуровне, состоящем из одной орбитали, может располагаться два электрона; на трех орбиталях p-подуровня – шесть электронов; на пяти орбиталях d-подуровня – десять. Соответственно в каждом периоде периодической системы имеются по два s-элемента, шесть p-элементов (начиная со второго периода) и десять d-элементов (четвертый и последующие периоды).
Казалось бы, этих знаний о строении атомов химических элементов вполне достаточно для понимания их свойств. А так как все вещества образованы из атомов, на этом можно завершить изучение теории строения вещества. Но, как это ни парадоксально, при обычных условиях атомы большинства химических элементов в свободном виде не существуют. Исключением являются лишь атомы благородных газов, существующие при обычных условиях в несвязанном виде. Во всех остальных случаях атомы входят в состав химических соединений, в которых они связаны посредством химических связей. Даже простые вещества всех химических элементов, кроме благородных газов, являются химическими соединениями. Например, простое вещество водород состоит из молекул Н2, в которых два атома водорода связаны одной ковалентной связью: Н–Н. В алмазе, одной из аллотропных модификаций углерода, каждый атом углерода связан с соседними атомами четырьмя ковалентными связями. Простые вещества металлов также являются химическими соединениями, в которых атомы связаны друг с другом металлическими связями (см. рисунки на стр. 83).
Химическая связь – это взаимодействие, связывающее отдельные атомы в химические соединения.
Таким образом, способность образовывать химические связи является важнейшим свойством атомов, без рассмотрения которого невозможно судить о строении и свойствах химических веществ.
Химические связи образуются за счет перераспределения электронов между электронными оболочками атомов. Участвовать в образовании химических связей могут только те электроны, которые слабее всего связаны с ядром, то есть электроны внешних электронных оболочек. Такие электроны называются валентными.
Валентные электроны принято обозначать точками, которые окружают химический символ элемента. Такие формулы называются электронными формулами:
Для атомов s- и p- элементов валентными являются s- и p-электроны внешнего энергетического уровня, причем для возбужденных состояний атомов s- и p-элементов третьего и последующих периодов валентными являются также электроны, перешедшие на d-подуровень (вспомните пятивалентный фосфор, шестивалентную серу, пяти- и семивалентный хлор).
В случае атомов d-элементов валентными являются s-электроны внешнего уровня и d-электроны предвнешнего уровня, которые завершают формирование электронной оболочки атома.
Пример. Валентные электроны атомов скандия и марганца
Sc: …3s23p63d14s2
Mn: …3s23p63d54s2
В приведенных формулах электронных конфигураций валентные электроны подчеркнуты. Таким образом, валентность скандия равна трем, а у марганца высшая валентность равна семи. Это согласуется с существованием соответствующих соединений: Sc2O3; Sc(OH)3; Mn2O7; KMnO4 (“марганцовка”).
Как было сказано выше, при обычных условиях устойчивы только атомы благородных газов. Из этого реально наблюдаемого явления можно сделать два важных вывода.
Во-первых, внешние электронные оболочки атомов благородных газов являются весьма устойчивыми. Такие электронные оболочки называются завершенными. Завершенная электронная оболочка атома гелия включает два электрона (1s2). Атомы остальных благородных газов имеют восьмиэлектронные завершенные оболочки (…ns2np6).
Во-вторых, все остальные атомы будут стремиться сформировать подобные стабильные завершенные оболочки за счет отдачи либо присоединения электронов. В зависимости от того, какая тенденция преобладает, элементы делятся на две большие группы: металлы и неметаллы.
Атомы металлов, валентные оболочки которых далеки до завершения, легко отдают электроны, тогда как атомы неметаллов, у которых валентные электронные оболочки близки к завершению, стремятся присоединять электроны. В каждом случае структуры электронных оболочек будут приближаться к устойчивым электронным конфигурациям атомов благородных газов, то есть к завершению.
Например, при образовании хлорида натрия из простых веществ атомы натрия отдают по одному электрону, а атомы хлора – принимают. В результате образуются ионы Na+ и Cl–, из которых состоят кристаллы NaCl. Электронные конфигурации ионов Na+ и Cl– такие же, как у атомов неона и аргона соответственно:
Na+ …2s22p6
Cl– …3s23p6.
Хлорид натрия, в котором ионы Na+ и Cl– имеют завершенные электронные оболочки, является устойчивым соединением, в отличие от отдельных атомов натрия и хлора.
При образовании химической связи всегда выделяется энергия. Эта энергия называется энергией связи.
Энергии большинства химических связей имеют значения порядка нескольких сотен кДж/моль. На практике энергию, выделяющуюся при образовании химической связи, измерить сложно, проще измерить количество энергии, которое необходимо затратить для разрыва связи. В соответствии с законом сохранения энергии эти величины будут равны.
Энергия связи – это энергия, которую необходимо затратить для разрыва химической связи.
При образовании химической связи валентные электроны перераспределяются между образующими ее атомами, то есть атомы в процессе взаимодействия могут отдавать либо принимать электроны. Обе эти тенденции – отдачи и присоединения электронов – характеризует электроотрицательность (ЭО).
Электроотрицательность – это величина, характеризующая способность атома в химическом соединении притягивать к себе электроны от других атомов.
Чаще всего на практике используется относительная шкала электроотрицательности, в которой максимальное значение электроотрицательности равно 4,10 у атома фтора. Наименьшие значения электроотрицательности, близкие к 1 – у атомов щелочных металлов.
Значения электроотрицательности атомов химических элементов приводятся во многих изданиях периодической таблицы Д. И. Менделеева.
Химическая связь образуется между атомами за счет перераспределения электронов между их валентными оболочками, поэтому тип образующейся связи будет определяться разностью значений электроотрицательности взаимодействующих атомов. Ее обозначают ЭО. Электроотрицательность является характеристикой атома, тогда как тип химической связи будет определяться значением ЭО.
Если химическая связь образована двумя одинаковыми атомами, ЭО равна нулю. Это значит, что валентные электроны будут в равной степени принадлежать каждому атому, связь будет ковалентной неполярной.
Примеры: ковалентные неполярные связи в молекулах N2, O2, Cl2, F2.
Таблица. Значения электроотрицательности некоторых химических
элементов
группа период | 1 (IA) | 2 (IIA) | 3 (IIIA) | 4 (IVA) | 5 (VA) | 6 (VIA) | 7 (VIIA) |
1 | H 2,20 | ||||||
2 | Li 0,97 | Be 1,47 | B 2,01 | C 2,50 | N 3,07 | O 3,50 | F 4,10 |
3 | Na 1,01 | Mg 1,23 | Al 1,47 | Si 1,74 | P 2,06 | S 2,44 | Cl 2,83 |
4 | K 0,91 | Ca 1,04 | Ga 1,82 | Ge 2,02 | As 2,20 | Se 2,48 | Br 2,74 |
5 | Rb 0,89 | Sr 0,99 | In 1,49 | Sn 1,72 | Sb 1,82 | Te 2,01 | I 2,21 |
6 | Cs 0,86 | Ba 0,97 | Тl 1,44 | Pb 1,55 | Bi 1,67 | Po 1,76 | At 1,90 |
7 | Fr 0,86 | Ra 0,97 |
В случае, если ЭО невелика и не превышает 0,5, между атомами образуются ковалентные малополярные связи.
Пример. Химическая связь в углеводородах
Каркасами органических соединений являются углеводороды. Молекулы их включают цепи из атомов углерода, связанных между собой неполярными связями. В углеводородах имеются связи С–Н, являющиеся малополярными (ЭО = 0,30).
Ковалентные малополярные связи могут образовываться также между атомами одного элемента. Например, в молекуле хлорэтана СН3–СН2Cl, связь С–С является ковалентной малополярной.
Ковалентные полярные связи образуются между атомами в случае не очень больших разностей электроотрицательностей.
Пример. Хлороводород HCl
Молекула H–Cl образована атомами водорода и хлора. Электроотрицательность водорода равна 2,20, хлора – 2,83. ЭО=0,63. Это значит, что электроны, образующие связь, будут смещены к более электроотрицательному атому хлора. Молекула является полярной. На атоме хлора будет частичный отрицательный заряд, на атоме водорода – частичный положительный. Частичный заряд обозначается греческой буквой :
+ –
H–Cl
Образовавшаяся молекула является диполем. Связь между атомами водорода и хлора ковалентная полярная.
Если разность значений электроотрицательности атомов, образующих химическую связь, достаточно велика, атом с высокой электроотрицательностью захватывает электроны у атома с низкой электроотрицательностью. При этом образуется ионная связь. Понятно, что это случай взаимодействия между атомами с различными свойствами, то есть между атомами металлов и неметаллов. Для образования ионной связи электроотрицательности атомов должны различаться примерно на 2 и более.
Можно заключить, что тип химической связи определяется свойствами взаимодействующих атомов, в первую очередь, значениями их электроотрицательности, и разностью этих значений. В следующих параграфах мы рассмотрим механизмы образования и основные характеристики химических связей различных типов.
urokidoma.org
Строение атомов и свойства химических элементов неметаллов
Из более сотни известных химических элементов простые вещества неметаллы образуют 22 элемента, причем все они находятся в главных (А) подгруппах.
Элементы-неметаллы находятся в правом верхнем углу Периодической таблицы, в главных подгруппах выше диагонали бериллий – астат. Причем с увеличением номера главной подгруппы число неметаллов в ней закономерно увеличивается на один (рис. 1).
Рис. 1. Расположение неметаллов среди элементов подгрупп А (выделены красным)
Неметаллические свойства связаны со способностью атомов элементов присоединять к себе электроны. Притяжение внешних электронов к ядру тем сильнее, чем меньше размеры атома и больше заряд ядра. В периоде с ростом заряда ядра от элемента к элементу радиус атома уменьшается, сильнее становится притяжение внешних электронов к ядру и неметаллические свойства усиливаются. Вместе с тем от периода к периоду радиус атома увеличивается из-за увеличения числа электронных слоев, и ядра этих атомов все слабее притягивают к себе внешние электроны. Поэтому
На внешнем электронном слое в атомах неметаллов большее число электронов, чем в атомах металлов. Электроотрицательность атомов неметаллов существенно выше, чем атомов металлов.
Элементы VIII-А подгруппы завершают каждый период.
Особенностью строения атомов неона, аргона, криптона, ксенона и радона является устойчивый восьмиэлектронный внешний слой (октет), а гелия – двухэлектронный (дуплет). При обычных условиях их простые вещества, как правило, не вступают в химические реакции и представляют собой одноатомные газы. Поэтому их часто называют инертными, или благородными, газами. Последнее название более целесообразно, так как известны некоторые соединения этих элементов (например, оксид ксенона, фторид радона и др.).
В группах с увеличением заряда ядра увеличивается радиус атома, т. к. растет число электронных слоев в атоме. Следовательно, способность притягивать электроны, электроотрицательность и окислительные свойства уменьшаются.
В периодах же, наоборот, с увеличением заряда ядра электроотрицательность и окислительные свойства увеличиваются, т. к. уменьшается радиус атома.
Самый электроотрицательный элемент – это фтор. Поэтому он и самый активный неметалл.
Изменение некоторых свойств элементов неметаллов рассмотрено в таблице на рис. 2 на примере элементов третьего периода.
|
Свойства |
Si |
P |
S |
Cl |
|
Порядковый номер |
14 |
15 |
16 |
17 |
|
Число внешних электронов |
4 |
5 |
6 |
7 |
|
Радиус атома в нм |
0,117 |
0,111 |
0,104 |
0,099 |
|
Высшая степень окисления |
+4 (SiO |
+5 (Р2О5) |
+6(SO3) |
+7 (Cl2O7) |
|
Низшая степень окисления |
-4 (SiH4) силан |
-3 (PH3) фосфин |
-2 (H2S) сероводород |
-1 (HCl) хлороводород |
Неметаллический характер |
усиливается |
|||
Рис. 2. Сравнение свойств неметаллов третьего периода
Распространенность неметаллов в космосе и на земле различна.
Самый распространенный элемент земной коры – кислород, он составляет примерно половину общей массы элементов, образующих земную кору (49,13 %). Кислород также является составной частью атмосферы, он занимает 21 % ее объема.
Вторым по распространенности на земле элементом является кремний. Его в земной коре 27,6 % по массе. Кремний с кислородом образует самые разнообразные природные соединения вследствие своего особенного родства с кислородом.
К распространенным элементам неметаллам следует отнести и азот. В земной коре его 0,01 % по массе, а в атмосфере – 78 % по объему.
Водород распространен в земной коре незначительно – всего 1 % по массе. Но во Вселенной он является господствующим элементом. Его особая роль в жизни Вселенной заключается в том, что водород является источником энергии, питающей Солнце и другие звезды.
В значительно меньших количествах, чем перечисленные элементы, в природе встречаются углерод, фосфор, сера. Но эти элементы наряду с кислородом, углеродом и водородом входят в состав живых организмов и выполняют важные биологические функции. Поэтому их называют биогенными элементами.
Подведение итогов урока
Из материалов урока вы узнали, почему химических элементов-неметаллов намного меньше, чем металлов, как различаются по строению атомы металлов и неметаллов, а также какими свойствами обладают неметаллические элементы.
Список литературы
1. Оржековский П.А. Химия: 9-й класс: учеб для общеобр. учрежд. / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. – М.: Астрель, 2013. (§16)
2. Рудзитис Г.Е. Химия: неорган. химия. Орган.химия: учеб. для 9 кл. / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§§ 7, 15, 24)
3. Хомченко И.Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008.
4. Энциклопедия для детей. Том 17. Химия / Глав.ред. В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Фоксфорд. Учебник (Источник)
2. Л.Н. Мишенина. Неорганическая химия. Учебно-методический комплекс (Источник)
Домашнее задание
1.с. 113 №№ 3–6из учебника П.А. Оржековского «Химия: 9-й класс» / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. – М.: Астрель, 2013.
2. Почему элементов неметаллов значительно меньше, чем металлов?
3. Сравните свойства простых веществ, образованных элементами V-А подгруппы – азотом и фосфором.
interneturok.ru
Химия. 8 класс. Строение атомов « МКОУ средняя общеобразовательная школа д.Васькино
Разработка урока химии в 8 классе по теме «Строение атомов» по программе О.С. Габриеляна.
Содержание: Атомы как форма существования химических элементов. Основные сведения о строении атомов. Доказательства сложности строения атомов. Опыты Резерфорда. Планетарная модель строения атома. Состав атомных ядер: протоны, нейтроны. Относительная атомная масса. Взаимосвязь понятий «протон», «нейтрон», «относительная атомная масса».
Задачи урока: организовать деятельность учащихся по изучению и первичному закреплению состава и строения атомов химических элементов;
обеспечить понимание сложности вопроса строения атома;
создать условия для развития у школьников представлений об исторической эволюции понятий.
Оборудование: персональный компьютер, мультимедийный проектор, экран.
Лабораторная работа “Анализ содержимого “черного ящика”.
План урока:
1. Постановка цели и задач урока, составление плана работы.
2. Актуализация знаний учащихся:
а) что изучает химия?
б) что называют химической реакцией?
в) перечислите формы существования химического элемента.
г) дайте определение понятия «атом».
3. Изучение нового материала.
Выдающийся физик современности, лауреат Нобелевской премии Роберт Фейнман говорил: «Если бы в результате какой-то мировой катастрофы все накопленные знания вдруг оказались уничтоженными, и к грядущим поколениям живых существ перешла только одна фраза, то какое утверждение, составленное из наименьшего количества слов, принесло бы наибольшую информацию? Я считаю, что это атомная гипотеза: все тела состоят из атомов – маленьких телец, которые находятся в беспрерывном движении, притягиваются на небольшом расстоянии, но отталкиваются, если одно из них плотнее прижать к другому».
Почему утверждение об атомном строении веществ так высоко оценено? Попробуем ответить на этот вопрос.
Вспомним, что понятие «атом» впервые появилось в работах древнегреческих философов Демокрита и Левкипта. Под атомом они понимали мельчайшую частицу вещества (atomos – неделемый). К атомной гипотезе они пришли только на основании размышлений, т.к. в то время люди не владели современными физическими методами исследования.
Если считать атом неделимой частицей, тогда невозможно объяснить образование химических связей в веществах. В ходе химических реакций атомы элементов не изменяются. Сущность химической реакции заключается в разрыве связей в исходных веществах и образовании связей в продуктах реакции. Как атомы соединяются в молекулы? Ответить на этот вопрос можно только в том случае, если изучим строение атомов.
Лабораторная работа “Анализ содержимого “черного ящика”.
Группам учащихся выдаются закрытые “черные ящики”, содержащие некоторую геометрическое тело.
Задание: определить какое тело находится в ящике, его размеры, цвет.
Данная работа показывает сложность познания строения атома.
Предположение о сложном строении атома было высказано на основании результатов нескольких экспериментов. В первую очередь это открытие электрона – частицы, которая переносит электрический ток. Масса электрона оказалась в 1840 раз меньше массы самого легкого атома – атома водорода. Исследования показали, что электрон несет на себе электрический заряд (–1,6∙10–19 Кл), который принят за единицу (–1), т.к. является наименьшим отрицательным зарядом. Условное обозначение электрона .
Следующим шагом в познании атома стало открытие явления радиоактивности. Анри Беккерель обнаружил, что соли урана излучают невидимые лучи, которые вызывают засвечивание фотопластинки. Позднее были установлены три вида радиоактивных лучей. a–лучи представляют собой частицы, масса которых в 4 раза больше массы атома водорода и несущие положительный заряд (+2). b–лучи представляют собой поток электронов, а g–лучи –коротковолновое электромагнитное излучение.
В 1911 году английский физик Эрнест Резерфорд проводил опыты с a–лучами. Он направил поток a–частиц на очень тонкую золотую фольгу, за которой поместил экран. Было установлено, что большая часть a–частиц проходила через фольгу, не изменяя своего направления движения, т.е. не встречая на своем пути препятствий. Но небольшая доля a–частиц отклонялась от прямолинейного пути на различные углы. Самым интересным оказалось то, что приблизительно одна из 10000 a–частиц отскакивала от металлической фольги обратно почти под углом 180°.
Какие выводы сделал Резерфорд? Он предположил, что в атомах большая часть «пустая», а отлетающие обратно a–частицы встречают на своем пути «сгусток» положительно зараженной массы. Этот сгусток был назван ядром атома.
Проанализировав результаты проведенных экспериментов, Резерфорд сделал ряд выводов, которые составили основу планетарной модели строения атома. В центре атома находится положительно заряженное ядро, которое имеет достаточно малые размеры, но в нем заключена почти вся масса, приходящаяся на атом. Вокруг ядра по круговым орбитам двигаются отрицательно заряженные электроны, подобно планетам вокруг Солнца.
Ядро – внутренняя часть атома, имеет положительный заряд и весьма малый объем, но невероятно высокую плотность вещества: 1014–1015 г/см3 (в 1 см3 ~ 100 млн т). Электроны образуют электронную оболочку, которая определяет размеры атома, имеет отрицательный заряд.
Позднее было установлено, что ядро атома состоит из частиц двух видов – протонов ( или р+) и нейтронов ( или n°). Массы этих частиц почти одинаковы, но протон несет на себе единичный положительный заряд, а нейтрон не имеет заряда.
Протоны, нейтроны и электроны определяют важнейшие свойства атома: массу, заряд ядра и заряд электронной оболочки. Масса атома имеет очень маленькое значение. Например, масса атома водорода равна 1,674∙10–24 г, атома кислорода – 2,667∙10–23 г. Принято использовать не абсолютные, а относительные атомные массы, показывающие сколько единиц массы содержит данный атом. В качестве атомной единицы массы (а.е.м.) была выбрана 1/12 массы атома углерода, в ядре которого содержится 6 протонов и 6 нейтронов.
1 а.е.м. = 1,661∙10–24 г
Наряду с относительной атомной массой используют так называемое массовое число (А) – сумму протонов и нейтронов, входящих в состав ядра атома.
Заряд ядра (зарядовое число) обозначается Z. Величина заряда ядра равна числу протонов в атоме. Заряд электронной оболочки равен числу электронов.
Массовое и зарядовое числа используют при обозначении атома: . Например, обозначение говорит о том, что масса атома водорода равна 1, а ядро имеет заряд +1.
Как определить состав атома? Оказалось, что число протонов в ядре атома равно порядковому (атомному) номеру химического элемента в Периодической системе. Так как атом электронейтрален (не имеет заряда), то число протонов равно числу электронов. Число нейтронов равно разности между массой атома и порядковым номером химического элемента в Периодической системе. Например, определим состав и характеристики атома кислорода : 6р+, 6n0, 6е–; Z(ядра) = + 6, Z(эл.об.) = – 6.
Обобщим полученные сведения о частицах, входящих в состав атома:
Название частиц | |||
протоны | нейтроны | электроны | |
| обозначение | р+ | n0 | е– |
| масса | 1 | 1 | 0 |
| заряд | +1 | 0 | –1 |
число протонов равно порядковому номеру элемента. | число нейтронов находят по формуле: N=A–Z | число электронов равно порядковому номеру элемента | |
4. Закрепление изученного на уроке. Коррекция знаний учащихся.
5. Итоги урока.
.pdf (1 130 КБ)
vaskino-sch.ru
Первоначальные сведения о строении атомов. Химические элементы
Все вещества образованы мельчайшими частицами, которые называются атомами.
Атомы имеют сложное строение.
В центре любого атома находится ядро. Ядро атома состоит из протонов и нейтронов, которые имеют общее название — нуклоны (от англ. nucleus — ядро).
Протон — это частица, которая имеет положительный заряд. Заряд протона в условных единицах равен +1. Символ протона – 1р.
Нейтрон — нейтральная частица, заряд нейтрона равен 0. Символ нейтрона — оn.
Ядра атомов имеют положительный заряд, так как состоят из протонов с положительным зарядом и нейтральных нейтронов.
Вокруг ядра движутся электроны, которые имеют отрицательный заряд. Заряд электрона в условных единицах равен -1. Символ электрона – ē.
Протоны, нейтроны и электроны называются элементарными частицами.
Любой атом содержит равное число протонов и электронов, поэтому сумма положительных зарядов в атоме равна сумме отрицательных зарядов. Следовательно, атомы являются электронейтральными частицами.
Ядра различных атомов содержат разное число протонов и нейтронов.
Главной характеристикой любого атома является заряд ядра, который обозначается буквой Z и равен числу протонов.
Вид атомов с одинаковым зарядом ядер называется химическим элементом.
Каждый элемент имеет свое название и свой символ (знак).
В настоящее время известно более 100 химических элементов. Среди них есть элементы, которые встречаются в природе (примерно 90), и элементы, которые получают искусственным путем (около 20).
Каждый элемент имеет свое название и свой символ (химический знак). Символы элементов состоят из одной или двух букв латинского названия элементов и являются интернациональными. Названия элементов в каждом языке различны.
Например, элемент с русским названием водород имеет символ Н (читается «аш»), который является первой буквой латинского названия этого элемента — Hydrogenium. Элемент с русским названием хлор имеет символ Сl (читается «хлор»), который образован первой и третьей буквами латинского названия — Chlorum.
В данной таблице содержатся русские и латинские названия важнейших химических элементов, их символы и произношение символов в химических формулах.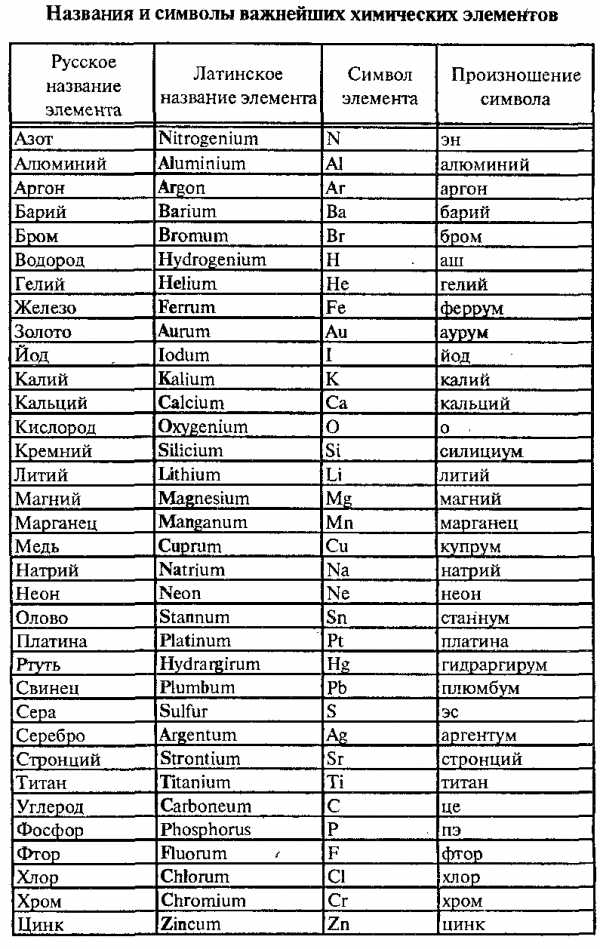
Рассмотрим примеры произношения символов в химических формулах:
Н2О — «аш-два-о»
Ca3(PO4)2 — «кальций-три-пэ-о-четыре-дважды»
NaCl — «натрий-хлор»
Al2(SO4)3— «алюминий-два-эс-о-четыре-трижды»
AgNO3 — «аргентум-эн-о-три»
Все химические элементы делятся на металлы и неметаллы. Причиной этого деления являются различия в строении атомов. Они будут рассматриваться при изучении соответствующей темы. Однако уже сейчас следует запомнить, какие элементы относятся к металлам и какие — к неметаллам.


Распространенность различных химических элементов в природе неодинаковая.
В земной коре наиболее распространенными элементами являются: кислород О (= 49%), кремний Si(= 27%), алюминий Al(= 8%), железо Fe(= 5%), кальций Са, натрий— Na, калий K, магний Mg, титан Ti, водород Н. Эти десять элементов составляют более 99% массы земной коры. Важнейшими элементами морской воды являются О, Н, Na, Cl, а живого вещества — О, С и Н.
Похожее
al-himik.ru
Строение атомов химических элементов – Научные статьи – Авторские материалы – Каталог статей
Первая модель атома была предложена Томсоном (1904 г.). В рамках этой модели атом напоминал арбуз с вкраплёнными семечками-электронами в заполняющую весь его объём электрически положительную массу.
Вторую модель атома предложил Резерфорд (1911 г.) на основе исследования по рассеянию на тонкой металлической мишени альфа-частиц (ядер атомов гелия) при радиоактивном распаде атомов. Теоретически эта модель была обоснована Бором в 1913 г.
Предлагались и другие модели атомов, но они не пользовались особой популярностью в научной среде.
По представлению Резерфорда атом состоит из электрически положительного ядра, расположенного в центре атома, содержащего весь его положительный заряд, и движущихся вокруг ядра, подобно планетам вокруг Солнца, электронов, суммарный отрицательный заряд которых был равен заряду положительного ядра. Движущихся потому, что именно движение не даёт им упасть на притягивающее их ядро.
Хотя обе модели атомов противоречили известным к тому времени законам физики, в качестве основной была принята «планетарная» модель Резерфорда. На первый взгляд, в рамках этой модели атомы должны были бы быстро разрушаться из-за так называемого «синхротронного» излучения, возникающего при движении электрона по криволинейной траектории. Излучения электронов при движении по таким траекториям сопровождается потерей ими кинетической энергии, приводящей к уменьшению радиуса их кругового вращения вокруг ядра и их падения на него.
Чтобы обойти это противоречие, Бором было высказано предположение, что электроны могут вращаться вокруг ядра без потери энергии по круговым орбитам, радиусы которых соответствовали отношению квадратов ряда натуральных чисел.
Относительно строения ядра атома тоже не всё ясно, кроме того, что оно состоит из примерно равного числа протонов и нейтронов. Не найдено пока объяснение, почему имеющие одинаковый знак электрического заряда протоны не отталкиваются друг от друга, как это следует из закона Кулона. Получается ситуация, при которой атомы существуют, хотя приемлемого объяснения для их существования до сих пор нет. Ведь непонятен сам принцип появления таких эксклюзивных орбит, находясь на которых электроны обладают особыми свойствами.
Поэтому вполне понятно, что более приближенная к действительности модель атома не должна иметь этого недостатка. Мною и предлагается такая модель, полностью соответствующая известным законам физики.
Начнём со строения ядра атома. Зададим естественный вопрос: для чего необходимы в ядре атома в дополнение к протонам электрически нейтральных нейтронов? Не зная истинного строения протона и нейтрона на этот вопрос не ответить. В статье «Электрон-позитронная Вселенная», возвращён в физику мировой эфир, единственным структурным элементом которого является частица позитроний, состоящая из позитрона и электрона и являющаяся электрическим диполем.
Протон представляет собой «свободный» позитрон, окружённый «облаком» из 920 поляризованных им частиц позитрония. При перемещении позитрона в пространстве, окружающее его «облако» сохраняется, в нём только происходит замена одних частиц позитрония на другие, расположенные вдоль траектории его движения. Следовательно, протон состоит из незаменяемого «свободного» позитрона и 920 заменяющих друг друга частиц позитрония, составляющих Мировой эфир.
Пока позитрон окружён поляризованными им частицами позитрония, он является протоном. Таким образом, частицы-позитронии, которые входят в состав окружающего позитрон «облака», принадлежат одновременно и протону, и мировому эфиру.
Нейтрон – это тот же протон, «захвативший» «свободный» электрон или электрон из электронной оболочки атома в результате процесса «к-захвата», если сам находится в составе ядра этого атома.
В нейтроне электрон движется по траектории, смещаясь относительно сформировавшего протон позитрона как относительно центра, имеющего положительный электрический заряд. Отсюда становится ясна роль электрона в ядре атома. По существу пара протон + нейтрон представляет собой ядро атома «тяжёлого» водорода – дейтерия, и называется такое ядро дейтроном. Стабильное ядро дейтерия формирует и стабильный изотоп водорода.
Чем же обусловлена стабильность дейтрона? Она обусловлена беспрерывным превращением протона в нейтрон и обратно посредством перехода электрона, имевшегося первоначально в составе нейтрона. Следовательно, назначение нейтрона в составе ядер атомов обеспечит формирование устойчивой пары из двух протонов, связанных воедино одним электроном, подобно тому, как это имеет место в положительном ионе молекулы водорода. Отличие состоит лишь в расстоянии между протонами. Меньшее их расстояние в дейтроне по сравнению с их расстоянием в положительном ионе молекулы водорода приводит к сильной поляризации того из протонов, который в данный момент времени находится в состоянии нейтрона, то есть в момент обладания им электроном. Сильное поляризующее воздействие протона на нейтрон приводит к тому, что вместе с электроном он «вырывает» из нейтрона и некоторое количество поляризованных им частиц позитрония, содержащихся в нейтроне. Совместное многократное перемещение электрона с некоторым количеством частиц позитрониев в пространстве между частицами, составляющими дейтрон, воспринимается до сих пор как обмен особыми элементарными частицами «минус пи-мезонами».
Ядро каждого последующего после дейтерия в таблице Менделеева атома химического элемента формируется добавлением к его ядру по одному дейтрону. Следовательно, дейтрон, частица, состоящая их протона и нейтрона, является структурным элементом ядер атомов химических элементов. Из двух дейтронов формируется второй структурный элемент ядер атомов – альфа-частица. Таким образом, ядра атомов всех химических элементов в зависимости от их порядкового номера в таблице Менделеева, состоят или только из одних ядер гелия, или из ядер гелия и одного дейтрона, если порядковый номер нечётный. Поскольку большинство химических элементов имеет изотопы, то кроме двух основных структурных элементов ядра атомов содержат и третий – нейтроны. Назначение нейтронов двойное – связать в ядрах атомов сначала протоны и нейтроны в дейтрон и альфа-частицы составляющие их ядра гелия и дейтрона. Именно по этой причине к примеру ядро атома свинца кроме 40 ядер гелия имеет дополнительно от 40 до 46 нейтронов, из которых 40 нейтронов находятся в ядрах, а остальные 6, добавляясь к ядру по одному, образуют 6 его изотопов.
Удивительный факт, физики-ядерщики и физики-атомщики до сих пор не поняли назначение и механизм деятельности элементарных и некоторых «особых» частиц в строении и формировании атомных ядер, а, соответственно, и атомов химических элементов.
Открыв Периодический закон зависимости свойств химических элементов от их массы, Д.И. Менделеев утверждал, что увеличение массы атома приводит и к изменению самого химического элемента. В опубликованной им в феврале 1869 г. статье «Опыт системы элементов, основанный на их атомном весе и химическом сходстве» он пишет: «Величина атомного веса определяет характер (химического) элемента, как величина частицы определяет свойства сложного тела».
Лишь в 1912 году Мозли на основе опытов удалось установить, что истинной основой Периодического закона является не масса атома, а количество положительных электрических зарядов – протонов, содержащихся в ядре атома, поскольку равную массу атома могут иметь различные химические элементы, называемые «изомерами». С тех пор числовое значение порядкового номера химического элемента совпадало с числом протонов (зарядов) в ядре атомов. В результате до сих пор химическим элементом № 1 считается протий – изотоп атома водорода, имеющий в ядре 1 протон, а, следовательно, и нижнюю величину и электрического заряда и массы атома в целом. В результате до настоящего времени не признана и не понята определяющая роль в формировании атомов различных химических элементов, а точнее в формировании определяющих их атомных ядер, особых частиц: нейтрон, дейтрон (состоящий из протона и нейтрона), являющийся ядром изотопа атома водорода – дейтерия, тритон – ядра третьего изотопа водорода – трития, состоящего из протона и двух нейтронов, и альфа-частица – ядро атома гелия-4, состоящее из двух дейтронов. Не поняв их роль, невозможно познать ни истинное строение атомов (их ядер и электронных оболочек), ни механизма их формирования и преобразования из одних химических элементов в другие.
Строение ядер атомов химических элементов. Прежде всего необходимо ответить на вопрос – имеют ли ядра атомов определённую структуру, то есть состоят ли они только из протонов и нейтронов, или из этих двух типов частиц ещё и формируются какие-либо более сложные структурные элементы ядер, из которых также состоят ядра атомов?
Известно сто с лишним химических элементов, распределённых в Периодической системе Д.И. Менделеева на 7 периодов в зависимости от различия их свойств и на 9 групп по совпадающим свойствам. Известно также, что все химические элементы имеют по несколько (до 25) изотопов, различающихся атомным весом, и, как следствие, другими свойствами. Два этих факта свидетельствуют о наличие у ядер атомов определённой структуры, сформированной из двух основных элементов ядра атома – протонов и нейтронов. Количество протонов в ядрах атомов меняется в соответствии с рядом натуральных чисел, состоящих из нечётных и чётных чисел.
Анализ Периодической системы химических элементов и Периодической системы их изотопов позволил выявить определённые закономерности.
1. В среднем, атомы химических элементов до порядкового номера 20 – кальция – увеличиваются последовательно по атомному весу на два. Такую же величину массы имеет дейтрон, состоящий из протона и нейтрона. Поскольку, последовательное прибавление к первому химическому элементу (по справедливости) изотопу водорода дейтерия, имеющего величину электрического заряда, равного единице, а массу, равную двум, удовлетворяет закономерностям Периодической системы химических элементов, следовательно, ядро атома дейтерия – дейтрон – является структурным элементом ядер атомов.
2. Химический элемент водород имеет три известных изотопа: протий, дейтерий и тритий, и их ядра – протон, дейтрон и тритон имеют одну и ту же величину электрического заряда (единицу), а их атомные веса соответственно имеют величину 1, 2 и 3 атомных единицы. С первыми двумя изотопами ясно, а тритон может состоять из дейтрона и нейтрона. Но дейтрон легко соединяется с нейтроном и естественно, их длительное и близкое соседство приведёт к возникновению изотопа водорода – тритию, ядром которого является тритон. Следовательно, в химических элементах с нечётными порядковыми номерами один из изотопов обязательно будет содержать тритон, а, значит, и он является структурным элементом ядер атомов.
3. Анализ графика (рис. 1) изменения ядерной энергии связи элементов ядер атомов, в котором последовательно выделяются максимумы энергии связи у гелия, углерода, кислорода, неона, ядра которых по электрическому заряду и массе кратны ядру гелия – альфа-частице (2 и 4 соответственно) позволяет утверждать, что и она является структурным элементом ядер атомов.
Дальнейший анализ Периодических систем химических элементов и их изотопов не выявил каких-то других закономерностей ни в строении атомов, ни их ядер, что исключает вероятность наличия в них других структурных элементов.
Однако, есть ещё одна частица, заслуживающая внимание и имеющая (хотя и косвенно) отношение к атомам и их ядрам. Речь идёт о частице, называемой позитроний (не путать с позитроном – электроном с положительным зарядом), состоящей из электрона и позитрона, и являющаяся по моему мнению структурным элементом Мирового эфира и протона. В статье «Электрон-позитронная Вселенная» дано обоснование тому, что двумя единственными поистине элементарными частицами являются только электрон и позитрон. А всё остальное – начиная от Мирового эфира и до звёзд и галактик – их производные. Соединившись в пару, они сформировали частицу – позитроний, являющуюся электрическим диполем. Эти частицы заполняют весь объём Вселенной, обеспечивая не только распространение электромагнитных излучений, электрического и магнитного взаимодействия объектов Вселенной друг с другом, но и являются переменной частью «массы» протона, состоящего из «свободного» позитрона и окружающего его и поляризованного им концентрированного «облака» из 920 частиц позитрония, находящихся в составе Мирового эфира. Из электрона и такого же «облака» формируется антипротон, а из них посредством присоединения к протону электрона формируется нейтрон. А к антипротону посредством присоединения позитрона формируется антинейтрон.
Из этих частиц (протона, нейтрона и свободного электрона) формируются атомы химических элементов, а из них – молекулы и так далее, до звёзд и галактик, объекты флоры и фауны Земли.
В начале статьи уже отмечалось, что до сих пор основной моделью строения атома является планетарная, при которой электроны его оболочки вращаются вокруг ядра атома по круговой или эллипсовидной траектории. То, что при этом электрон неизбежно теряет энергию, все понимают. Но куда денешься, если ничего другого не придумали?
По нашему мнению, электронные оболочки атомов имеют не криволинейное движение вокруг его ядра, а возвратно-поступательное через его центр. При этом все идентичные пары электронов (находящиеся, якобы, каждая пара на своей орбите) согласованно в определённой последовательности встречаются в центре ядра атома одновременно. Таким образом, радиус орбиты каждой пары электронов на самом деле является расстоянием максимального удаления каждого электрона пары от центра ядра атома. Это обеспечивает одновременность начала каждого цикла их возвратно-поступательного прямолинейного движения, обеспечивая абсолютное равенство их кинетических энергий в момент взаимодействия. Интенсивное торможение электронов до полной остановки, обусловленное одинаковым знаком их электрического заряда, приводит к излучению обоими электронами в направлении их движения по одному фотону равных энергий. Это приводит к взаимному поглощению ими фотонов посредством комптоновского их рассеивания на свободных электронах, обеспечивая возвратное движение в исходное положение.
Таков механизм сохранения электронами их энергий посредством её непрерывного преобразования из кинетической в потенциальную и обратно. Именно такой моделью строения атома обусловлена разбивка электронов, составляющих его оболочку, на пары. Атомы с нечётным числом протонов в ядре и электронов в оболочке всегда активно и быстро находят недостающий электрон посредством объединения таких атомов в молекулы. Например, при химическом методе получения атомарного водорода его атомы или мгновенно образуют молекулу, или в результате взаимодействия электрона с ядерным протоном преображаются в нейтрон.
Изложенный механизм возвратно-поступательного движения пар электронов в центр ядра и на исходную позицию подтверждает широко распространённый вариант ядерной реакции так называемого «К-захвата» электрона своей же собственной оболочки одним из протонов ядра атома. При этом «захватываются» электроны не только из ближайшего к ядру атома К-слоя, но, фактически, и из любого другого, более удалённого от ядра при наличие электронов и на более близких от ядра расстояний. Именно при таком строении атомов движение их электронов в центре ядра, состоящего из положительных электрических зарядов – протонов, и обратно, исключается распад атомных ядер в результате расталкивания составляющих их протонов в связи с одинаковостью знаков электрических зарядов.
neophysics.at.ua
Строение атомов химических элементов. Состав атомного ядра. Строение электронных оболочек атомов первых 20 химических элементов периодической системы Д. И. Менделеева
Атом – наименьшая частица вещества, неделимая химическим путем. В XX веке было выяснено сложное строение атома. Атомы состоят из положительно заряженного ядра и оболочки, образованной отрицательно заряженными электронами. Общий заряд свободного атома* равен нулю, так как заряды ядра и электронной оболочки уравновешивают друг друга. При этом величина заряда ядра равна номеру элемента в периодической таблице (атомному номеру) и равна общему числу электронов (заряд электрона равен -1).
Атомное ядро состоит из положительно заряженных протонов и нейтральных частиц – нейтронов, не имеющих заряда. Обобщенные характеристики элементарных частиц в составе атома можно представить в виде таблицы:
| Название частицы | Обозначение | Заряд | Масса |
| протон | p | +1 | |
| нейтрон | n | ||
| электрон | e– | -1 | принимается равной 0 |
Число протонов равно заряду ядра, следовательно, равно атомному номеру. Чтобы найти число нейтронов в атоме, нужно от атомной массы (складывающейся из масс протонов и нейтронов) отнять заряд ядра (число протонов).
Например, в атоме натрия 23Na число протонов p = 11, а число нейтронов n = 23 – 11 = 12
Число нейтронов в атомах одного и того же элемента может быть различным. Такие атомы называют изотопами.
Электронная оболочка атома также имеет сложное строение. Электроны располагаются на энергетических уровнях (электронных слоях).
Номер уровня характеризует энергию электрона. Связано это с тем, что элементарные частицы могут передавать и принимать энергию не сколь угодно малыми величинами, а определенными порциями – квáнтами. Чем выше уровень, тем большей энергией обладает электрон. Поскольку чем ниже энергия системы, тем она устойчивее (сравните низкую устойчивость камня на вершине горы, обладающего большой потенциальной энергией, и устойчивое положение того же камня внизу на равнине, когда его энергия значительно ниже), вначале заполняются уровни с низкой энергией электрона и только затем – высокие.
Максимальное число электронов, которое может вместить уровень, можно рассчитать по формуле: N = 2n2, где N – максимальное число электронов на уровне,
n – номер уровня.
Тогда для первого уровня N = 2 · 12 = 2,
для второго N = 2 · 22 = 8 и т.д.
Число электронов на внешнем уровне для элементов главных (А) подгрупп равно номеру группы.
В большинстве современных периодических таблиц расположение электронов по уровням указано в клеточке с элементом. Очень важно понимать, что уровни читаются снизу вверх, что соответствует их энергии. Поэтому столбик цифр в клеточке с натрием :
1
8
2
следует читать так:
на 1-м уровне – 2 электрона,
на 2-м уровне – 8 электронов,
на 3-м уровне – 1 электрон
Будьте внимательны, очень распространенная ошибка!
Распределение электронов по уровням можно представить в виде схемы:
11Na ) ) )
2 8 1
Если в периодической таблице не указано распределение электронов по уровням, можно руководствоваться:
· максимальным количеством электронов: на 1-м уровне не больше 2 e–,
на 2-м – 8 e–,
на внешнем уровне – 8 e–;
· числом электронов на внешнем уровне (для первых 20 элементов совпадает с номером группы)
Тогда для натрия ход рассуждений будет следующий:
1. Общее число электронов равно 11, следовательно, первый уровень заполнен и содержит 2 e–;
2. Третий, наружный уровень содержит 1 e– (I группа)
3. Второй уровень содержит остальные электроны: 11 – (2 + 1) = 8 (заполнен полностью)
* Ряд авторов для более четкого разграничения свободного атома и атома в составе соединения предлагают использовать термин «атом» только для обозначения свободного (нейтрального) атома, а для обозначения всех атомов, в том числе и в составе соединений, предлагают термин «атомные частицы». Время покажет, как сложится судьба этих терминов. С нашей точки зрения, атом по определению является частицей, следовательно, выражение «атомные частицы» можно рассматривать как тавтологию («масло масляное»).
Задача. Вычисление количества вещества одного из продуктов реакции, если известна масса исходного вещества.
Пример:
Какое количество вещества водорода выделится при взаимодействии цинка
с соляной кислотой массой 146 г?
Решение:
1. Записываем уравнение реакции: Zn + 2HCl = ZnCl2 + H2↑
2. Находим молярную массу соляной кислоты: M (HCl) = 1 + 35,5 = 36,5 (г/моль)
(молярную массу каждого элемента, численно равную относительной атомной массе, смотрим в периодической таблице под знаком элемента и округляем до целых, кроме хлора, который берется 35,5)
3. Находим количество вещества соляной кислоты: n (HCl) = m/M = 146 г / 36,5 г/моль = 4 моль
4. Записываем над уравнением реакции имеющиеся данные, а под уравнением – число моль согласно уравнению (равно коэффициенту перед веществом):
4 моль x моль
Zn + 2HCl = ZnCl2 + H2↑
2 моль 1 моль
5. Составляем пропорцию:
4 моль – x моль
2 моль – 1 моль
(или с пояснением:
из 4 моль соляной кислоты получится x моль водорода,
а из 2 моль – 1 моль)
6. Находим x:
x = 4 моль • 1 моль / 2 моль = 2 моль
Ответ: 2 моль.
Билет № 4
1. Металлы: положение этих химических элементов в периодической системе, строение их атомов (на примере атомов натрия, магния, алюминия). Характерные физические свойства металлов. Химические свойства металлов: взаимодействие с кислородом, водой, кислотами.
Элементы, образующие простые вещества – металлы, занимают левую нижнюю часть периодической системы (для наглядности можно сказать, что они расположены влево от диагонали, соединяющей Be и полоний, №84), также к ним относятся элементы побочных (Б) подгрупп.
Для атомов металлов характерно небольшое число электронов на внешнем уровне. Так, у натрия на внешнем уровне расположен 1 электрон, у магния – 2, у алюминия – 3 электрона. Эти электроны сравнительно слабо связаны с ядром, что обуславливает характерные физические свойства металлов:
· электрическую проводимость,
· хорошую теплопроводность,
· ковкость, пластичность.
· Металлы также отличает характерный металлический блеск.
В химических реакциях металлы выступают в роли восстановителей:
1. При взаимодействии с кислородом металлы образуют оксиды, например, магний сгорает с образованием оксида магния:
2Mg + O2 = 2MgO
Наиболее активные металлы (щелочные) при горении на воздухе образуют пероксиды:
2Na + O2 = Na2O2 (пероксид натрия)
2. Активные металлы, например, натрий, реагируют с водой с образованием гидроксидов:
2Na + 2HOH = 2NaOH + H2↑
или оксидов, как магний при нагревании:
Mg + H2O = MgO + H2↑
3. Металлы, расположенные в электрохимическом ряду напряжений левее водорода (Н), вытесняют водород из кислот (кроме азотной). Так, цинк реагирует с соляной кислотой с образованием хлорида цинка и водорода:
Zn + 2HCl = ZnCl2 + H2↑
Металлы, в том числе правее водорода, за исключением золота и платины, реагируют с азотной кислотой, с образованием различных соединений азота:
Cu + 4HNO3 (конц.) = Cu(NO3)2 + 2H2O + 2NO2↑
Коэффициенты в этих уравнениях легче расставить методом электронного баланса. Проставляем степени окисления:
Cu0 + 4HN+5O3 = Cu+2(NO3)2 + 2H2O + 2N+4O2↑
Записываем элементы с изменившейся степенью окисления:
| Cu0 – 2e– → Cu+2 | 2* | 1** | – восстановитель |
| N+5 + 1e– → N+4 | – окислитель |
* наименьшее общее кратное для добавленных и отнятых электронов
** коэффициент для вещества, содержащего этот элемент, получаем делением наименьшего общего кратного на число добавленных или отнятых электронов
Опыт. Получение и собирание кислорода. Доказательство наличия кислорода в сосуде.
В школьной лаборатории кислород чаще получают разложением перекиси водорода
в присутствии оксида марганца (IV):
2H2O2 = 2H2O + O2↑
или разложением перманганата калия при нагревании:
2KMnO4 = K2MnO4 + MnO2 + O2↑
Чтобы собрать газ, сосуд закрывают пробкой с газоотводной трубкой.
Чтобы доказать наличие кислорода в сосуде, вносят в него тлеющую лучинку – она ярко вспыхивает.
Билет № 5
1. Неметаллы: положение этих химических элементов в периодической системе, строение их атомов (на примере атомов хлора, кислорода, азота). Отличие физических свойств неметаллов от свойств металлов. Реакции неметаллов с простыми веществами: металлами, водородом, кислородом.
Простые вещества – неметаллы образуют элементы главных подгрупп, расположенные в правой верхней части периодической системы (правее диагонали, соединяющей бор и астат).
Для их атомов характерно наличие на внешнем уровне 4-8 электронов. Так, у азота на внешнем уровне 5 электронов (соответствует номеру группы), у кислорода – 6, у хлора – 7 электронов.
Электроны в атомах этих элементов прочнее связаны с ядром, поэтому для неметаллов характерны такие физические свойства, как
· отсутствие электрической проводимости (исключение – графит),
· низкая, по сравнению с металлами, теплопроводность,
· хрупкость.
Химические свойства
В реакциях с металлами и водородом неметаллы являются окислителями.
1. Например, порошок серы при нагревании реагирует с железными опилками с образованием сульфида железа:
Fe0 + S0 = Fe+2S-2
2. При высокой температуре сера реагирует с водородом (например, если пропускать водород через расплавленную серу). Образуется газ с запахом тухлых яиц – сероводород:
H20 + S0 = H2+1S-2
В реакциях с кислородом неметаллы являются восстановителями:
3. S0 + O20 = S+4O2-2 (при горении серы образуется оксид серы (IV), или сернúстый газ)
C0 + O20 = C+4O2-2 (графит сгорает с образованием оксида углерода (IV), или углекислого газа)
Галогены не соединяются с кислородом напрямую, но можно получить их оксиды, в которых они проявляют положительную степень окисления, например, оксид хлора (VII) Cl2O7.
Фторид кислорода O+2F2-1 – соединение, в котором кислород проявляет положительную степень окисления
infopedia.su
