Строение атома водорода (H), схема и примеры
Общие сведения о строении атома водорода
Относится к неметаллам. Заряд ядра равен 1. Атомный вес может варьироваться: 1, 2, 3, что связано с наличием изотопов дейтерия и трития.
Электронное строение атома водорода
В атоме водорода имеется положительно заряженное ядро (+1), 1 протон и один электрон. Поскольку водород имеет самое простейшее строение атома из всех элементов Периодической системы, он хорошо изучен. В 1913 году Нильс Бор предложил схему строения атома водорода, согласно которой положительно заряженное ядро находится в центре, а вокруг него по единственной орбитали движется электрон (рис. 1). В соответствии с этой схемой он вывел спектр излучения этого химического элемента. Который был позже доказан с помощью квантово-механических расчетов уравнения Шредингера (1925-1930 годы).

Рис. 1. Схема строения атома водорода.
Электронная конфигурация атома водорода будет выглядеть следующим образом:
1s
Водород относится к семейству s-элементов. Энергетическая диаграмма атома водорода имеет вид:
Единственный электрон, который имеется у водорода является валентным, т.к. участвует в образовании химических связей. В результате взаимодействия водород может как терять электрон, т.е. являться его донором, так и принимать, т.е. быть акцептором. В этих случаях атом превращается либо в положительно, либо отрицательно заряженный ион (H+/Н—):
H0 –e →H+;
H0 +e →H—.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Строение атома. Видеоурок. Химия 11 Класс
Тема: Строение атома. Периодический закон Д.И. Менделеева
Урок: Строение атома
В переводе с греческого языка, слово «атом» означает «неделимый». Однако, были открыты явления, которые демонстрируют возможность его деления. Это испускание рентгеновских лучей, испускание катодных лучей, явление фотоэффекта, явление радиоактивности. Электроны, протоны и нейтроны – это частицы, из которых состоит атом. Они называются
Табл. 1
|
атом |
||
|
ядро |
электроны |
|
|
протоны |
нейтроны |
|
|
|
no |
e– |
|
Масса протона |
Масса нейтрона |
Масса электрона |
|
1,0073 а.е.м. |
1,0087 а.е.м. |
0,0005 а.е.м. |
|
Заряд протона |
Заряд нейтрона |
Заряд электрона |
|
+1 |
0 |
-1 |
Кроме протонов, в состав ядра большинства атомов входят нейтроны, не несущие никакого заряда. Как видно из табл. 1, масса нейтрона практически не отличается от массы протона. Протоны и нейтроны составляют ядро атома и называются нуклонами ( nucleus – ядро). Их заряды и массы в атомных единицах массы (а.е.м.) показаны в таблице 1. При расчете массы атома массой электрона можно пренебречь.
Масса атома (массовое число) равна сумме масс, составляющих его ядро протонов и нейтронов. Массовое число обозначается буквой
Здесь A – массовое число атома (сумма протонов и нейтронов), Z – заряд ядра (число протонов в ядре), N – число нейтронов в ядре. Согласно учению об изотопах, понятию «химический элемент» можно дать такое определение:
Химическим элементом называется совокупность атомов с одинаковым зарядом ядра.
Некоторые элементы существуют в виде нескольких изотопов. «Изотопы» означает «занимающий одно и тоже место». Изотопы имеют одинаковое число протонов, но отличаются массой, т. е. числом нейтронов в ядре (числом N). Поскольку нейтроны практически не влияют на химические свойства элементов, все изотопы одного и того же элемента химически неотличимы.
Изотопами называются разновидности атомов одного и того же химического элемента с одинаковым зарядом ядра (то есть с одинаковым числом протонов), но с разным числом нейтронов в ядре.
Изотопы отличаются друг от друга только массовым числом. Это обозначается либо верхним индексом в правом углу, либо в строчку: 12С или С-12
Аr(Cl)=0,75.35+0,25.37=35,5
Для тяжёлых искусственно-синтезированных атомов приводится одно значение атомной массы в квадратных скобках. Это атомная масса наиболее устойчивого изотопа данного элемента.
Основные модели строения атома
Исторически первой в 1897 году была модель атома Томсона.
Рис. 1. Модель строения атома Дж. Томсона
Английский физик Дж. Дж. Томсон предположил, что атомы состоят из положительно заряженной сферы, в которую вкраплены электроны (рис. 1). Эту модель образно называют «сливовый пудинг», булочка с изюмом (где «изюминки» – это электроны), или «арбуз» с «семечками» – электронами. Однако от этой модели отказались, т. к. были получены экспериментальные данные, противоречащие ей.
Рис. 2. Модель строения атома Э. Резерфорда
В 1910 году английский физик Эрнст Резерфорд со своими учениками Гейгером и Марсденом провели эксперимент, который дал поразительные результаты, необъяснимые с точки зрения модели Томсона. Эрнст Резерфорд доказал на опыте, что в центре атома имеется положительно заряженное ядро (рис. 2), вокруг которого, подобно планетам вокруг Солнца, вращаются электроны. Атом в целом электронейтрален, а электроны удерживаются в атоме за счет сил электростатического притяжения (кулоновских сил). Эта модель имела много противоречий и главное, не объясняла, почему электроны не падают на ядро, а также возможность поглощения и излучения им энергии.
Датский физик Н. Бор в 1913 году, взяв за основу модель атома Резерфорда, предложил модель атома, в которой электроны-частицы вращаются вокруг ядра атома примерно так же, как планеты обращаются вокруг Солнца.
Рис. 3. Планетарная модель Н. Бора
Бор предположил, что электроны в атоме могут устойчиво существовать только на орбитах, удаленных от ядра на строго определенные расстояния. Эти орбиты он назвал стационарными. Вне стационарных орбит электрон существовать не может. Почему это так, Бор в то время объяснить не мог. Но он показал, что такая модель (рис. 3) позволяет объяснить многие экспериментальные факты.
В настоящее время для описания строения атома используется квантовая механика. Это наука, главным аспектом в которой является то, что электрон обладает свойствами частицы и волны одновременно, т. е. корпускулярно-волновым дуализмом. Согласно квантовой механике,
Рис. 4. Формы атомных орбиталей
В электронной оболочке любого атома ровно столько электронов, сколько протонов в его ядре, поэтому атом в целом электронейтрален. Электроны в атоме размещаются так, чтобы их энергия была минимальной. Чем дальше электрон находится от ядра, тем больше орбиталей и тем сложнее они по форме. На каждом уровне и подуровне может помещаться только определенное количество электронов. Подуровни, в свою очередь, состоят из одинаковых по энергии
На первом энергетическом уровне, наиболее близком к ядру, может существовать одна сферическая орбиталь (1s). На втором энергетическом уровне – сферическая орбиталь, большая по размеру и три р-орбитали: 2s2ppp. На третьем уровне: 3s3ppp3ddddd.
Кроме движения вокруг ядра, электроны обладают еще движением, которое можно представить, как их движение вокруг собственной оси. Это вращение называется спином (в пер. с англ. «веретено»). На одной орбитали могут находиться лишь два электрона, обладающих противоположными (антипараллельными) спинами.
Максимальное число электронов на энергетическом уровне определяется по формуле N=2n2.
Где n – главное квантовое число (номер энергетического уровня). См. табл. 2
Табл. 2
|
Энергетический уровень |
N |
Электронная конфигурация |
|
1-ый |
2 |
1s2 |
|
2-ой |
8 |
2s22p6 |
|
3-ий |
18 |
3s23p63d10 |
|
4-ый |
32 |
4s24p64d104f14 |
В зависимости от того, на какой орбитали находится последний электрон, различают s, p-, d-элементы. Элементы главных подгрупп относятся к s, p-элементам. В побочных подгруппах находятся d-элементы
Графическая схема строения электронных слоев атомов (электронно-графическая формула).
Для описания расположения электронов на атомных орбиталях используют электронную конфигурацию. Для её написания в строчку пишутся орбитали в условных обозначениях (s-, p-, d-, f-орбитали), а перед ними – числа, обозначающие номер энергетического уровня. Чем больше число, тем дальше электрон находится от ядра. В верхнем регистре, над обозначением орбитали, пишется количество электронов, находящихся на данной орбитали (Рис. 5).
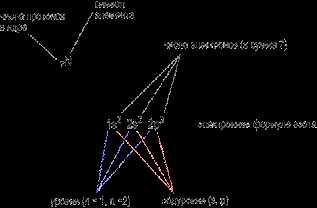
Рис. 5
Графически распределение электронов на атомных орбиталях можно представить в виде ячеек. Каждая ячейка соответствует одной орбитали. Для р-орбитали таких ячеек будет три, для d-орбитали – пять, для f-орбитали – семь. В одной ячейке может находиться 1 или 2 электрона. Согласно правилу Гунда, электроны распределяются на одинаковых по энергии орбиталях (например, на трех p-орбиталях) сначала по одному, и лишь когда в каждой такой орбитали уже находится по одному электрону, начинается заполнение этих орбиталей вторыми электронами. Такие электроны называют спаренными. Объясняют это тем, что в соседних ячейках электроны меньше отталкиваются друг от друга, как одноименно заряженные частицы.
См. рис. 6 для атома 7N.
Рис. 6
Электронная конфигурация атома скандия
21Sc: 1s2 2s22p63s23p64s23d1
Электроны внешнего энергетического уровня называются валентными. 21Sc относится к d-элементам.
Подведение итога урока
На уроке было рассмотрено строение атома, состояние электронов в атоме, введено понятие «атомная орбиталь и электронное облако». Учащиеся узнали, что такое форма орбиталей (s, p-, d-орбитали), каково максимальное число электронов на энергетических уровнях и подуровнях, распределение электронов по энергетическим уровням, что такое s-, p– и d-элементы. Приведена графическая схема строения электронных слоев атомов (электронно-графическая формула).
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
2. Попель П.П. Химия: 8 кл.: учебник для общеобразовательных учебных заведений / П.П. Попель, Л.С.Кривля. – К.: ИЦ «Академия», 2008. – 240 с.: ил.
3. А.В. Мануйлов, В.И. Родионов. Основы химии. Интернет-учебник.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Internerurok.ru (Источник).
2. Hemi.nsu.ru (Источник).
3. Chemport.ru (Источник).
4. Химик (Источник).
Домашнее задание
1. №№5-7 (с. 22) Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – 14-е изд. – М.: Просвещени
interneturok.ru
Урок 3. Схема образования молекул – HIMI4KA
В уроке 3 «Схема образования молекул» из курса «Химия для чайников» выясним из чего состоят молекулы и как образуется ковалентная химическая связь; кроме того рассмотрим структурную и молекулярную формулы молекулы; научимся вычислять относительную молекулярную массу веществ. Настоятельно рекомендую перед тем, как приступить к прочтению данного урока, внимательно изучить предыдущие, так как они содержат необходимые основы химии для начинающих и буду весьма полезны в изучении курса. Напомню, что в прошлом уроке мы обсуждали изотопы элементов.

Молекулы состоят из атомов
Здесь все просто и понятно: все вещества во вселенной состоят из молекул, в свою очередь молекулы состоят из атомов, а атомы состоят из положительно заряженного ядра и электронных оболочек, на которых расположены отрицательно заряженные электроны.
Представьте, что два атома достаточно сблизились друг с другом. В таком случае электроны на внешней оболочке одного атома начинают взаимодействовать с внешними электронами другого. Подобное взаимодействие внешних электронов и образует молекулы, так как оно способно удерживать взаимодействующие атомы вместе, притягивая их друг к другу.
Связь атомов в молекулах
Как было сказано выше, образование молекул происходит из-за внешних электронов взаимодействующих атомов, так как они создают силы притяжения между ними. Когда образуются данные силы притяжения происходит образование химической связи. В природе существует несколько видов химической связи атомов в молекулах, но пока рассмотрим простейший из них.
Ковалентная химическая связь
Химическая связь, возникающая при обобществлении внешних электронов взаимодействующих атомов, называется ковалентной химической связью. Обобществленные электроны называются электронной парой. Объяснение ковалентной химической связи простыми словами: два атома положили в общую копилку по монетке (электрону) и схватились за нее «руками», причем оба атома не хотят отдавать копилку друг другу, поэтому так и продолжают держаться за нее.
Ковалентная химическая связь подразделяется на два вида: неполярную и полярную. В этом уроке рассмотрим ковалентную неполярную химическую связь, которая возникает, когда в состав молекулы входят два абсолютно одинаковых атома неметалла, потому как одинаковые атомы владеют электронной парой в равной степени. А «Неполярная» — означает что заряд атомов не изменился, после образовании ковалентной связи. Приведем примеры молекул, образованных ковалентной неполярной химической связью: H2, O2, N2, Cl2. В редких случаях ковалентная химическая связь может образовываться между атомами разных неметаллов, но подробнее об этом в следующем уроке, где мы изучим электроотрицательность, и вам станет понятнее механизм образования химических связей атомов в молекулах.
Молекулярная и структурная формула
Графическое изображение структуры молекулы называется структурной формулой. Обычно ковалентная химическая связь в структурных формулах молекул изображается прямой линией, которая соединяет связанные атомы.
Структурную формулу молекулы воды H2O, к примеру, изображают двумя способами. Второй вариант структурной формулы воды, учитывает тот факт, что на самом деле молекула воды не линейна; две связи Н—О образуют угол 105° друг с другом. Молекулы газообразного водорода, сероводорода, аммиака, метана и метанола (метилового спирта) имеют следующие структурные формулы:

Структурная формула молекулы лишь схематично изображает связи между атомами, но не дает информации о реальной форме молекулы. Заметим, что угол между связями в молекулах, содержащих более двух атомов, может принимать различные значения. Так, угол между связями в молекуле воды равен 105°, а угол в молекуле сероводорода равен 92°; четыре атома, присоединенных к центральному атому углерода в метане и метаноле, направлены к четырем вершинам тетраэдра. Структурная формула неразветвленного октана, одного из компонентов бензина, такова:
Изображение ниже дает более реальное представление о форме и относительном объеме некоторых простых молекул. Каждая пара связанных атомов как бы проникает друг в друга, потому что их электронные облака перекрываются между собой. Принято изображать молекулы таким образом, что расширяющаяся линия указывает связь, направленную от плоскости рисунка в сторону наблюдателя, а пунктирная линия указывает связь, уходящую за плоскость рисунка в сторону от наблюдателя.

Каждая из указанных выше структурных формул может быть сведена к сжатой молекулярной формуле, которая указывает, сколько атомов каждого элемента имеется в молекуле, но совсем или почти совсем не дает сведений о том, как эти атомы соединены между собой. Молекулярная формула водорода Н2, воды Н2O, сероводорода H2S, аммиака NH3, метана СН4, метанола (метилового спирта) СН3ОН или СН4O, а октана С8Н18. Формула октана может быть также записана в такой форме:
Относительная молекулярная масса вещества
Под молекулярной массой вещества понимается масса молекулы, вычисленная через сумму всех атомных масс, входящих в нее атомов; измеряется, как и атомная масса, в а.е.м. Если молекулярную массу вещества вычислять через относительные атомные массы, то и называться масса молекулы будет относительной молекулярной массой вещества. Относительная молекулярная масса — величина безразмерная.
Пример 1: Какая относительная молекулярная масса у воды?
Решение: Заходим в таблицу Менделеева и выписываем относительные атомные массы водорода и кислорода, округляя до целого значения. У водорода = 1, а у кислорода = 16. Так как молекулярная формула воды имеет вид H2O, то ее молекулярная масса равна:
Ответ: относительная молекулярная масса воды равна 18.
Пример 2: Вычислите молекулярную массу метанола (метилового спирта).
Решение: Молекулярная формула метанола СН3ОН или СН4O. Следовательно,
- 1 углерод: 1 × 12,011 а.е.м. = 12,011 а.е.м.
- 4 водорода: 4 × 1,008 а.е.м. = 4,032 а.е.м.
- 1 кислород: 1 × 15,999 а.е.м. = 15,999 а.е.м.
Ответ: Суммарная молекулярная масса равна 32,04 а.е.м.
В примере 2 следует обратить внимание на то, что естественная атомная масса углерода равна не 12,000, а 12,011 а.е.м., поскольку природный углерод представляет собой смесь, содержащую 98,89% углерода-12 и 1,11% углерода-13, а также следы углерода-14.
Пример 3: Чему равна молекулярная масса чистого октана?
Решение: Молекулярная формула октана С8Н18, поэтому его молекулярная масса равна
- (8 × 12,011) + (18 × 1,008) = 114,23 а.е.м.
Надеюсь урок 3 «Схема образования молекул» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
Схемы строения атомов – Справочник химика 21
Схему строения атомов можно изобразить следующим образом [c.376]
Составить электронные схемы строения атомов калия и цезия. Какой из этих элементов является более сильным восстановителем Почему [c.263]
Изобразите электронные схемы строения атомов элементов с порядковыми номерами 15, 20, 36, 40, 47. Укажите расположение этих элементов в периодической системе Д. И. Менделеева и их высшую валентность. [c.44]Изобразите электронные схемы строения атомов натрия, хлора, хрома, кальция и железа. [c.44]
Составить электронные схемы строения атомов щелочных металлов. Какой из них является наиболее сильным восстановителем Почему [c.231]
Нарисуйте схемы строения атомов С и 81. Разъясните, чем сходны и чем отличаются свойства этих элементов [c.357]
Нарисуйте схемы строения атомов элементов с № I по [c.44]
Срисуйте себе в тетрадь эту схему строения атома лития. [c.82]
Изобразить в виде схем строение атомов элементов, имеющих порядковые номера а) 6 б) 11 в) 20. [c.40]
Представить с помощью схем строения атомов процессы образования молекул следующих простых веществ а) водорода б) кислорода в) азота г) фтора. [c.42]
Наиболее проста схема строения атома водорода (порядковый номер равен 1). Его ядро имеет один элементарный положительный заряд и в поле ядра вращается один электрон. [c.41]
В электронных схемах строения атомов следующих элементов подчеркнуть атомные остовы и указать число валентных электронов в атоме каждого элемента [c.36]
Подсчитать общее число электронов в каждом случае, указать положительный заряд ядра представ ить электронные схемы строения атомов подобно тому, как это сделано в задаче 17, Назвать элементы, схемы строения электронных оболочек которых даны выше. [c.37]
Представить схемы строения атомов и отвечающих им ионов следующих элементов с разбивкой электронов по квантовым уровням, атомные остовы подчеркнуть, как это выполнено в примере (а) [c.38]
Начертите электронные схемы строения атомов элементов, имеющих порядковые номера 14, 15, 16 и 17. [c.176]
Изобразите схемы строения атома и иона натрия. [c.44]
Неправильно. Вы только что сами срисовывали схему строения атома водорода и записывали символы составляющих его частиц. [c.73]
Второй учащийся запишите в тетради схемы строения атомов кремния (порядковый № 14) и олова (№ 50). [c.130]
Составить электронные схемы строения атомов бериллия, магния и щелочноземельных металлов. [c.330]
Неправильно. Вы сами только что срисовывали схему строения атома водорода, поэтому должны знать, что он состоит всего из двух частиц. [c.88]
Наиболее проста схема строения атома водорода (порядковый номер равен 1). Его ядро имеет один элементарный положительный заряд, и вокруг ядра вращается один электрон. Ядро атома водорода — элементарная частица, которую называют протоном. [c.67]
Начертите электронные схемы строения атомов первых четырех элементов четвертого периода, укажите наибольшую валентность этих элементов и изобразите символами соответствующие ионы., [c.176]
Цель на основе использования ранее приобретенных знаний о строении атомов составить схемы строения атомов элементов подгруппы углерода, сделать заключение о сходстве и различии строения этих атомов и предположение о свойствах данных элементов. [c.130]
Первый учащийся запишите в тетради схемы строения атомов углерода (порядковый № 6) и германия (№ 32). [c.130]
Изобразить схему строения атома серы. [c.97]
Содержание пособия используют для иллюстрации высказанной мысли, ее конкретизации с целью создания более ясного представления об изучаемом явлении. В этом отношении большое значение имеют экранные пособия, в которых последовательность видеоряда соответствует последовательности содержания изложения. Такие экранные средства особенно эффективны для закрепления и совершенствования знаний учащихся. В их отдельные кадры или графопособия включаются закономерности изменения физических констант веществ, схемы строения атомов и молекул, процессы разрыва и образования новых химических связей, энергетические эффекты химических взаимодействий. [c.120]
При составлении таблицы учащимся разрещается пользоваться учебником. Из него они могут извлечь данные о строении атома хрома. Затем по аналогии, а также с учетом числа электронных слоев и максимального количества электронов для каждого слоя записывают схемы строения атомов молибдена и вольфрама. [c.147]
А1. Еслн химическому элементу соответствует схема строения атома [c.5]
Ц м о л и п ычуг- “. Jтo важное-положение-тгостгг-нгтзва ние правила Хиноа. Из двух приведенных схем строения атома азота устойчивому состоянию (с наименьшей энергией) отвечает первая, где все р-электроны занимают разные орбитали. [c.29]
Наряду с проблемным обучением, постоянно используется в процессе изучения периодического закона работа с карточками, на которых учащиеся записывают известные им сведения о каждом элементе. Работа с карточками не ограничивается только этапом выведения периодического закона. Учащиеся пользуются ими постоянно в ходе изучения темы на разных дидактических этапах. На карточке отмечают химический знак элемента, характер его свойств, высшую валентность в оксидах, формулы оксидов, валентность в летучих водородных соединениях и гидридах, схемы строения атомов, степень окисления элементов и т. д. Карточки позволяют эффективно организовать самостоятельную работу. Они используются как справочные материалы, способствуют выработке умений пользоваться периодической системой. [c.228]
Привести схему строения атомов хрома, молибдена и вольфрама. Какой из этих элементов должен проявлять металлические свойства в меньшей степени Ответ мотивировать. [c.274]
На рис. 20 приведены схемы строения атомов элементов, имеющих заряд ядра от 1 до 18. [c.58]
Привести схемы строения атомов водорода (1), гелия (2), калия (19). В скобках указан заряд ядра атома. [c.59]
На рис. 29, 30 и 31 даны схемы строения атомов гелия, неона и натрия по Бору с орбитами, по которым движутся электроны. Ядро обозначено точкой внутри системы. [c.175]
Изобразить с помош,ьго схем строения атомов образование молекул следующих ветцеств а) фтористого калия КР б) хлористого магиия Mg l2 в) сернистого алюминия А125з г) азотного ангидрида N265. [c.42]
Каждому квадрату (называемому каОнтовой ячейкой) соответствует определенная орбиталь. В первой схеме все р-электроны имеют разные значения /я во второй – у двух р-электронов они одинаковы. Квантовая механика и анализ атомных спектров показывают, что заполнение орбиталей, отвечающее низшему энергетическому состоянию атома, происходит следующим образом. При заполнении подуровня электроны сначала располагаются по орбиталям, отвечающим различным значениям магнитного квантового числа, и только после того как все орбитали подуровня однократно заполнены, в орбиталях появляется по два электрона с противоположно направленными спинами . Иными словами, заполнение энергетических подуровней происходит таким образом, чтобы суммарный спин был максимальным. Это важное положение носит название правила Хунда. Из двух приведенных схем строения атома азота устойчивому состоянию (с наименьшей энергией) отвечает первая, где все р-электроны занимают разные орбитали. [c.32]
Составить э.пектронные схемы строения атомов щелочноземельных металлов. Какая степень окисления характерна для этих элементов Чем объяснить их более низкую восстановительную способность по сравнению со щелочными металлами [c.241]
chem21.info
