Строение атома лития (Li), схема и примеры
Общие сведения о строении атома лития
Порядковый номер равен 3. Заряд ядра равен +3. Атомный вес – 6,941а.е.м.
Электронное строение атома лития
Поскольку литий расположен во втором периоде, он имеет две оболочки, одна из которых носит название внешней. Электроны, расположенные на внешней оболочке, называются валентными и участвуют в образовании химических связей. Атом лития имеет положительно заряженное ядро (+3), в котором имеется 3 протона и 4 нейтрона (разница между атомным весом и порядковым номером). По орбитам вокруг ядра движутся 3 электрона.
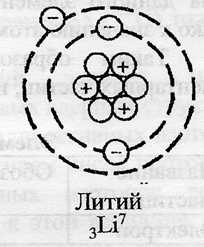
Рис. 1. Схематичное изображение строения атома лития.
Электронную конфигурацию атома лития можно записать двояко:
+3 Li)2)1;
1s22s1.
Литий, так же, как и водород и гелий относится к семейству s-элементов. Энергетическая диаграмма атома лития (на ней изображаются только валентные электроны) имеет вид:
В результате химического взаимодействия литий теряет свой валентный электрон, т.е. является его донором, и превращается в положительно заряженный ион (Li+):
Li0 –e → Li+;
В соединениях литий проявляет степень окисления +1.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Строение электронных оболочек атомов — Знаешь как
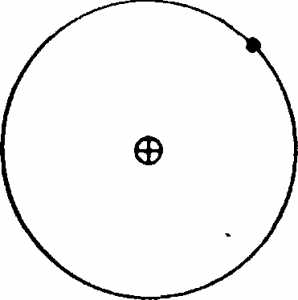
Рис. 21. Схема строения водорода
Теория Бора позволила разрешить очень важный вопрос о расположении электронов в атомах различных элементов и установить зависимость свойств элементов от строения электронных оболочек их атомов.
В настоящее время разработаны схемы строения атомов всех химических элементов. При построении этих схем ученые исходили из богатейшего опытного материала, накопленного при изучении оптических и рентгеновых спектров, а также из общих соображений об устойчивости различных комбинаций электронов. Но основной путеводной нитью служил им периодический закон.Мы уже видели, что число электронов, вращающихся вокруг ядра атома,равно порядковому номеру элемента в периодической системе. Первоначально предполагалось, что электроны движутся группами по одним и тем же круговым орбитам, образующим несколько концентрических колец. Впоследствии пришлось допустить, что каждый электрон имеет свою орбиту, которая может быть кругом или эллипсом, и что все эти орбиты различно расположены в пространстве, т. е. наклонены друг к другу под разными углами, окружая ядро со всех сторон.Расположение электронов по кольцам заменено теперь их группировкой по электронным слоям. Каждому слою принадлежит определенно заполняющее или как бы насыщающее его число» электронов.
Электроны одного и того же слоя характеризуются почти одинаковым запасом энергии, т. е. находятся примерно на одинаковом энергетическомуровне. Вся электронная оболочка атома распадается на несколькослоев, или энергетических уровней, обозначаемых буквами К, L, М,
N=2n2
где п — номер слоя. Таким образом, первый ближайший к ядру слой Кможет содержать не больше двух электронов, второй слой L — небольше восьми, третий слой М — не больше восемнадцати и т. д. Крометого, установлено, что число электронов в наружном слое для всех элементов, кроме палладия, не превышает восьми, а в предпоследнем слое — восемнадцати.
Электроны наружного слоя, как наиболее удаленные от ядра и,следовательно, наименее прочно связанные с ядром, могут отрыватьсяот атома и присоединяться к другим атомам, входя в состав наружногослоя последних. Атомы, лишившиеся одного или нескольких электронов, становятся заряженными положительно, так как заряд ядра атома превышает сумму зарядов оставшихся электронов. Наоборот,атомы, присоединившие к себе лишние электроны, заряжаются отрицательно. Образующиеся таким путем заряженные частицы,качественно отличные от соответствующих атомов, называются ионами.
Величина заряда иона зависит от числа потерянных или приобретенных атомом электронов. Например, если атом алюминия,имеющий в своей оболочке всего 13 электронов, потеряет триэлектрона наружного слоя, то образовавшийся ион алюминия будетиметь заряд +3, так как от потери электронов заряд ядра, равный +13,не изменится, а общий заряд, оставшихся электронов станет равным—10 (заряд иона будет —10 +13 = +3). Атом серы имеет всего 16 электронов, из которых шесть находятся в наружном слое. Если онприсоединит к себе еще два электрона, то получится отрицательныйдвухзарядный ион серы, так как общий заряд электронов станетравным —18, а заряд ядра + 16 (заряд иона будет —18 + 16 = —2).
Ионы принято обозначать теми же символами, что и атомы,добавляя к ним справа вверху столько знаков плюс или минус,скольким единицам равняется заряд иона. Например, положительный трехзарядный. ион алюминия обозначается символом Al
Многие ионы в свою очередь могут терять или присоединять электроны, превращаясь при этом или в электронейтральные атомы,или в новые ионы с другим зарядом.
При потере электронов положительный заряд иона увеличивается, а отрицательный уменьшается или становится равным нулю(т. е. ион превращается в электронейтральный атом). Наоборот, присоединение электронов к иону уменьшает его положительный заряд и увеличивает отрицательный. Так, например, положительный двухзарядный ион железа Fe
Переход наружных электронов от одних атомов к другим совершается при самых разнообразных химических процессах, о чеммы подробно будем говорить в следующей главе. От числа этих электронов и зависит, главным образом, различие в химических свойствах атомов. Только электроны наружного слоя принимают участие в выделении и поглощении лучей видимого света и близких к ним по длине волны инфракрасных и ультрафиолетовых лучей.
Посмотрим теперь, как расположены электроны в атомах отдельных элементов.
22. Рис. Схема строения атома гелия
В атоме водорода имеется только один электрон, который ивращается вокруг ядра по кругу, как изображено на рис. 21. Атом водорода легко может отдавать свой электрон другим атомам, превращаясь в положительный однозарядный ион водорода,состоящий только из ядра, которое получило название протон. Следующий за водородом элемент гелий имеет два электрона, образующих первый слой K. Оба электрона вращаются по круговым орбитам, наклоненным друг к другу под некоторым углом (рис. 22), и характеризуются одинаковым запасом энергии, т. е. находятся на одном и том же энергетическом уровне (первом).
Этим и объясняется химическая инертность гелия. После гелия идет литий с тремя электронами. Электронный слой гелия, как очень устойчивый, остается и здесь; третий же электрон располагается на значительно вытянутой эллиптической орбите,начиная собой построение второго электронного слоя (рис. 23). Этот электрон связав с ядром слабее двух первых, и атом лития легко отдает его, превращаясь в по
Рис. 23. Схема строения атома лития
ложительно заряженный ион.
Следующие после лития элементы бериллий, бор, углерод и т. д. сохраняют гелиевый слой из двух электронов, но число электронов в их втором слое L последовательно увеличивается на единицу, пока не достигнет восьми в атоме неона. Тогда получается очень устойчивое, симметричное расположение электронов (рис 24), вследствие чего неон, подобно гелию, не может ни отдавать, ни присоединять электроны. В атомах же элементов, расположенных между гелием и неоном, электроны L-слоя связаны непрочно и у первых членов ряда могут отщепляться, что-приводит к превращению этих атомов в ионы.
Рис. 25. Схема строения атома натрия
Вслед за неоном идет натрий. Десять его электронов расположены так же, как в атоме неона (два на первом энергетическое Уровне и восемь на втором), а одиннадцатый электрон занимает сильно вытянутую эллиптическую орбиту и находится уже на третьем энергетическом уровне (рис. 25). Атом натрия имеет, таким образом,структуру, подобную атому лития, что делает понятным химическое сходство этих элементов. При переходе от натрия к магнию, алюминию и следующим за ним элементам, так же как и при переходе от лития к неону, происходит последовательное увеличение числа электронов, но уже в третьем слое, и у аргона опять получается устойчивая структура с восьми электронным третьим слоем.
Дальнейшее нарастание электронных слоев и их заполнение электронами будет подробно рассмотрено в гл. VII.
Представленные на рисунках 21—26 атомные модели,отображающие расположение электронных орбит в атомах различных элементов, очень громоздки и неудобны. Для химических целей совершенно достаточными являются упрощенные схемы строения атомов, изображенные на рис. 27.
Нужно только иметь в виду, что эти схемы отнюдь не дают представления о действительном расположении электронов в атомах, а лишь указывают число электронов в слоях: каждая окружность соответствует одному слою электронов, т. е. одному энергетическому уровню.
Вы читаете, статья на тему Строение электронных оболочек атомов
znaesh-kak.com
Строение электронных оболочек атома
Разделы: Химия
Цель урока: Сформировать представления учащихся о строении электронной оболочки атома на примере химических элементов 1–3 периодов периодической системы. Закрепить понятия “периодический закон” и “периодическая система”.
Задачи урока: Научиться составлять электронные формулы атомов, определять элементы по их электронным формулам, определять состав атома.
Оборудование: Периодическая система химических элементов Д.И. Менделеева, классная доска, мультимедиа-проектор, персональный компьютер, макет и презентация “Составление электронных формул строения атомов”.
Тип урока: комбинированный
Методы: словесный, наглядный.
Ход урока
I. Организационный момент.
Приветствие. Отметка отсутствующих. Активизация класса на усвоение новой темы.
Учитель проговаривает и записывает тему урока на доске “Строение электронных оболочек атома”.
II. Объяснение нового материала
Учитель: В начале XX века была принята планетарная модель строения атома, предложенная Резерфордом, согласно которой вокруг очень малого по размерам положительно заряженного ядра движутся электроны, как планеты вокруг Солнца. (Презентация. Слайд 1. Модель Резерфорда).
Следовательно, в атоме есть траектории, по которым движется электрон. Однако дальнейшие исследования показали, что в атоме не существует траекторий движения электронов. Движение без траектории означает, что мы не знаем, как электрон движется в атоме, но можем установить область, где чаще всего встречается электрон. Это уже не орбита, а орбиталь. Двигаясь вокруг атома, электроны образуют в совокупности его электронную оболочку.
Давайте выясним, как движутся электроны вокруг ядра? Беспорядочно или в определенном порядке? Исследования Нильса Бора – основоположника современной атомной физики, а также ряда других ученых позволили сделать вывод: электроны в атомах располагаются определенными слоями – оболочками и в определенном порядке.
Строение электронных оболочек атомов имеют важную роль для химии, так как именно электроны обуславливают химические свойства веществ. Важнейшей характеристикой движения электрона на определенной орбитали является энергия его связи с ядром. Электроны в атоме различаются определенной энергией, и, как показывают опыты, одни притягиваются к ядру сильнее, другие слабее. Объясняется это удаленностью электронов от ядра. Чем ближе электроны к ядру, тем больше связь их с ядром, но меньше запас энергии. По мере удаления от ядра атома сила притяжения электрона к ядру уменьшается, а запас энергии увеличивается. Так образуются электронные слои в электронной оболочке атома. Электроны, обладающие близкими значениями энергии образуют единый электронный слой, или энергетический уровень. Энергия электронов в атоме и энергетический уровень определяется главным квантовым числом n и принимает целочисленные значения 1, 2, 3, 4, 5, 6 и 7. Чем больше значение n, тем больше энергия электрона в атоме. Максимальное число электронов, которое может находиться на том или ином энергетическом уровне, определяется по формуле:
N = 2n2
Где N – максимальное число электронов на уровне;
n – номер энергетического уровня.
Установлено, что на первой оболочке располагается не более двух электронов, на второй – не более восьми, на третьей – не более 18, на четвертой – не более 32. Заполнение более далеких оболочек мы рассматривать не будем. Известно, что на внешнем энергетическом уровне может находиться не более восьми электронов, его называют завершенным. Электронные слои, не содержащие максимального числа электронов, называют незавершенными.
Число электронов на внешнем энергетическом уровне электронной оболочки атома равно номеру группы для химических элементов главных подгрупп.
Как ранее было сказано, электрон движется не по орбите, а по орбитали и не имеет траектории.
Пространство вокруг ядра, где наиболее вероятно нахождение данного электрона, называется орбиталью этого электрона, или электронным облаком.
Орбитали, или подуровни, как их еще называют, могут иметь разную форму, и их количество соответствует номеру уровня, но не превышает четырех. Первый энергетический уровень имеет один подуровень (s), второй – два (s,p), третий – три (s,p,d) и т.д. Электроны разных подуровней одного и того же уровня имеют разную форму электронного облака: сферическую (s), гантелеобразную (p) и более сложную конфигурацию (d) и (f). Сферическую атомную орбиталь ученые договорились называть s-орбиталью. Она самая устойчивая и располагается довольно близко к ядру.
| S – орбиталь |
Чем больше энергия электрона в атоме, тем быстрее он вращается, тем сильнее вытягивается область его пребывания, и, наконец, превращается в гантелеобразную p-орбиталь:
Электронное облако такой формы может занимать в атоме три положения вдоль осей координат пространства x, y и z. Это легко объяснимо: ведь все электроны заряжены отрицательно, поэтому электронные облака взаимно отталкиваются и стремятся разместиться как можно дальше друг от друга.
| Три p – орбитали |
Итак, p-орбиталей может быть три. Энергия их, конечно, одинакова, а расположение в пространстве – разное.
Составить схему последовательного заполнения электронами энергетических уровней
Теперь мы можем составить схему строения электронных оболочек атомов:
- Определяем общее число электронов на оболочке по порядковому номеру элемента.
- Определяем число энергетических уровней в электронной оболочке. Их число равно номеру периода в таблице Д. И. Менделеева, в котором находится элемент.
- Определяем число электронов на каждом энергетическом уровне.
- Используя для обозначения уровня арабские цифры и обозначая орбитали буквами s и p, а число электронов данной орбитали арабской цифрой вверху справа над буквой, изображаем строение атомов более полными электронными формулами. Ученые условились обозначать каждую атомную орбиталь квантовой ячейкой – квадратиком на энергетической диаграмме:
На s-подуровне может находиться одна атомная орбиталь
а на p–подуровне их может быть уже три –
(в соответствии с тремя осями координат):
Орбиталей d– и f–подуровня в атоме может быть уже пять и семь соответственно:
Пример:
Ядро атома водорода имеет заряд +1, поэтому вокруг его ядра движется только один электрон на единственном энергетическом уровне. Запишем электронную конфигурацию атома водорода
Чтобы установить связь между строением атома химического элемента и его свойствами, рассмотрим еще несколько химических элементов.
Следующий за водородом элемент-гелий. Ядро атома гелия имеет заряд +2, поэтому атом гелия содержит два электрона на первом энергетическом уровне:
Так как на первом энергетическом уровне может находиться не более двух электронов, то он считается завершенным.
Элемент № 3 – литий. Ядро лития имеет заряд +3, следовательно, в атоме лития три электрона. Два из них находятся на первом энергетическом уровне, а третий электрон начинает заполнять второй энергетический уровень. Сначала заполняется s-орбиталь первого уровня, потом s-орбиталь второго уровня. Электрон, находящийся на втором уровне слабее связан с ядром, чем два других.
Далее формирование электронных оболочек у элементов 2-го периода происходит следующим образом:
Для атома углерода уже можно предположить три возможных схемы заполнения электронных оболочек в соответствии с электронно-графическими формулами:
Анализ атомного спектра показывает, что правильна последняя схема. Пользуясь этим правилом, нетрудно составить схему электронного строения для атома азота:
Этой схеме соответствует формула 1s22s22p3. Затем начинается попарное размещение электронов на 2p-орбиталях. Электронные формулы остальных атомов второго периода:
У атома неона заканчивается заполнение второго энергетического уровня, и завершается построение второго периода системы элементов.
Найдите в периодической системе химический знак лития, от лития до неона Ne закономерно возрастает заряд ядер атомов. Постепенно заполняется электронами второй слой. С ростом числа электронов на втором слое металлические свойства элементов постепенно ослабевают и сменяются неметаллическими.
Третий период, подобно второму, начинается с двух элементов (Na, Mg), у которых электроны размещаются на s-подуровне внешнего электронного слоя. Затем следуют шесть элементов (от Al до Ar), у которых происходит формирование p-подуровня внешнего электронного слоя. Структура внешнего электронного слоя соответствующих элементов второго и третьего периодов оказывается аналогичной. Иначе говоря, с увеличением заряда ядра электронная структура внешних слоев атомов периодически повторяется. Если элементы имеют одинаково устроенные внешние энергетические уровни, то и свойства этих элементов подобны. Скажем, аргон и неон содержат на внешнем уровне по восемь электронов, и потому они инертны, то есть почти не вступают в химические реакции. В свободном виде аргон и неон – газы, которые имеют одноатомные молекулы.
Атомы лития, натрия и калия содержат на внешнем уровне по одному электрону и обладают сходными свойствами, поэтому они помещены в одну и ту же группу периодической системы.
Далее, учитель вместе с учениками делают выводы по пройденной теме и повторяют материал.
III. Выводы.
1. Свойства химических элементов, расположенных в порядке возрастания заряда ядра, периодически повторяются, так как периодически повторяется строение внешних энергетических уровней атомов элементов.
2. Плавное изменение свойств химических элементов в пределах одного периода можно объяснить постепенным увеличением числа электронов на внешнем энергетическом уровне.
3. Причина сходства свойств химических элементов, принадлежащих к одному семейству, заключается в одинаковом строении внешних энергетических уровней их атомов.
IV. Закрепление нового материала.
Задание для класса:
1. Изобразите строение атомов следующих элементов:
а) натрия;
б) кремния
2. Сравните строение атомов азота и фосфора.
3. По данным о распределении валентных электронов найдите элемент:
а) 1s2 2s1
б) 1s2 2s22p63s23p6
в) 1s22s22p63s23p4
г) 1s2 2s22p4
д) 1s22s22p63s23p64s1
4. Используя компьютерную презентацию “Составление электронных формул строения атомов” составьте электронные формулы атомов а) азота; б) серы.
5. Используя макет “Составление электронных формул строения атомов” электронные формулы атомов: а) магния; б) кислорода.
V. Домашнее задание: § 8, Стр. 28-33.
Нарисуйте схемы строения электронных оболочек атомов: бора, хлора, лития, алюминия.
Приложение.
xn--i1abbnckbmcl9fb.xn--p1ai
Структура атома лития
Мы уже показали, что большинство ядер атомов лития имеют 4 нейтрона и три протона. Причем, все протоны имеют свободные магнитные полюса для соединения с магнитными полюсами электронов при образовании атома (рис. 92).
Связь устанавливается путем взаимодействия разноименных электрических полей протонов и электронов, которые сближают их, и одноименных магнитных полюсов, которые ограничивают это сближение. Получается так, что каждый электрон взаимодействует только с одним протоном ядра атома (рис. 92).
| a) | b) |
Рис. 92. Схемы ядра и атома лития
Анализ схемы на рис. 92 показывает, что симметрично расположенные электроны будут иметь одинаковые энергии связи с ядром. На электрон, расположенный справа от ядра, будут действовать электростатические силы отталкивания двух других электронов, поэтому он будет расположен дальше от ядра и его энергия ионизации будет наименьшей. Этому электрону мы присваиваем первый номер и обратим внимание на то, что энергия ионизации его меньше соответствующей энергии ионизации атома водорода . Схема атома лития (рис. 92) позволяет понять причину такого различия. Как видно, два симметрично расположенных осевых электрона (2 и 3) своими электростатическими полями удаляют первый электрон от ядра, уменьшая его энергию связи с протоном, а значит и его энергию ионизации.
Выпишем энергии связи первого электрона атома лития с его ядром из табл. 17, а второго – из табл. 16. Энергии связи с ядром третьего электрона атома лития возьмем из табл. 12. Составим сводную таблицу энергий связи электронов атома лития с его ядром (табл. 35). Анализируя таблицу 35, видим близость энергий связи электрона атома водорода и первого электрона атома лития на первом, втором и третьем энергетических уровнях и почти полное совпадение на всех остальных. Это – одно из доказательств того, что первый электрон атома лития взаимодействует с одним протоном ядра его атома. Соотношение (217) также подтверждает это.
Таблица 35. Энергии связи электрона атома водорода и первого, второго и третьего электронов атома лития с ядром
| n | |||||||||
| 13,6 | 3,40 | 1,51 | 0,85 | 0,54 | 0,38 | 0,28 | 0,21 | 0,17 | |
| 14,06 | 3,51 | 1,56 | 0,88 | 0,56 | 0,39 | 0,29 | 0,22 | 0,17 | |
| 54,16 | 13,54 | 6,02 | 3,38 | 2,17 | 1,50 | 1,10 | 0,85 | 0,67 | |
| 122,5 | 30,6 | 13,6 | 7,65 | 4,90 | 3,40 | 2,50 | 1,91 | 1,51 | |
| n | |||||||||
| 0,14 | 0,11 | 0,09 | 0,08 | 0,07 | 0,06 | 0,05 | 0,05 | 0,04 | |
| 0,14 | 0,12 | 0,10 | 0,08 | 0,06 | 0,06 | 0,05 | 0,05 | 0,04 | |
| 0,54 | 0,45 | 0,38 | 0,32 | 0,28 | 0,24 | 0,21 | 0,19 | 0,17 | |
| 1,23 | 1,01 | 0,85 | 0,72 | 0,63 | 0,54 | 0,48 | 0,42 | 0,38 |
Постепенное уменьшение разницы между энергиями связи электрона атома водорода и первого электрона атома лития по мере увеличения номера энергетического уровня объясняется уменьшением взаимного влияния всех трех электронов атома лития друг на друга. Начиная с 9-го энергетического уровня это влияние исчезает, и энергии связи этих электронов со своими протонами оказываются одинаковыми.
Нетрудно видеть, что если в атоме лития останется один (третий) электрон, то он начнет взаимодействовать сразу с тремя протонами и его энергия связи с ядром, соответствующая первому энергетическому уровню, определится по формуле (219).
, (222)
что совпадает со значениями этой энергии в табл. 35 и подтверждает нашу гипотезу о том, что если в атоме остаётся один электрон, то он взаимодействует одновременно со всеми протонами ядра.
Рассчитаем по формуле (220) энергию связи третьего электрона атома лития с ядром в момент пребывания его на 5 энергетическом уровне
. (223)
Как видно, это значение согласуется с аналогичной энергией связи третьего электрона атома лития с ядром в момент пребывания его на пятом энергетическом уровне (табл. 35). Поскольку атом лития с одним электроном – это водородоподобный атом, то для убедительности рассчитаем энергию связи второго электрона этого атома с ядром в момент его пребывания на седьмом энергетическом уровне.
. (224)
Этот результат также согласуется с энергией связи второго электрона атома лития в момент пребывания его на седьмом энергетическом уровне (табл. 35).
Если бы нам удалось измерить энергии связи с ядром двух остальных электронов атома лития, не удаляя из него первый электрон, то оказалось бы, что все три электрона имеют одинаковые энергии связи с ядром на соответствующих энергетических уровнях. Однако, постановка такого эксперимента вряд ли возможна на данном этапе научных исследований. Но гипотетическое объяснение этого явления мы уже привели.
Совпадение результатов расчетов по формуле (220) с экспериментальными результатами, представленными в табл. 35, доказывает жизнеспособность такого объяснения.
Нетрудно представить, что различные значения энергий связи разных электронов атома лития (табл. 35), соответствующие первому энергетическому уровню ( ), получаются потому, что после удаления из атома первого электрона освободившийся протон начинает взаимодействовать со вторым электроном, увеличивая его энергию связи до величины, близкой к энергии связи второго электрона атома гелия (табл. 34, 35) .
После удаления из атома и второго электрона в ядре оказываются два свободных протона, которые немедленно начинают взаимодействовать с оставшимся третьим электроном, увеличивая его энергию связи с ядром в раз.
Если мы начнем последовательно возвращать все электроны в атом, то количество протонов, взаимодействовавших ранее с одним электроном, начнет уменьшаться. Уменьшится и энергия связи этого электрона до величины, примерно равной энергии связи с ядром электрона атома водорода.
Похожие статьи:
poznayka.org
Литий электронное строение – Справочник химика 21
Если сопоставить электронное строение атомов, то можно заметить, что структура внешних энергетических уровней периодически повторяется (сравним литий и натрий Зл бериллий 2. и магний 3 , бор 25 2р и алюминий и т. д.). Такая [c.52]Если сопоставить электронное строение атомов, то можно заметить, что структура внешних энергетических уровней периодически повторяется (сравним литий 2 и натрий 3 бериллий 2 и магний 3 , бор 2 2p и алюминий 3 3р и т. д.). Такая закономерность будет соблюдаться и в последующих периодах. Именно этим объясняется периодическая повторяемость свойств элементов в периодах. В этом сущность и причина периодичности, обнаруженной Д. И. Менделеевым, который не располагал сведениями о строении атома. Итак, теория строения атома подтвердила истинность менделеевского открытия, подвела под него мощную базу. [c.44]
Электронное строение атома бериллия в газообразном состоянии — 15 25% Увеличение заряда ядра атома бериллия по сравнению с зарядом ядра атома лития наряду с тем, что 25-электроны только частично экранируют друг друга, приводит к двум эффектам 1) атом Ве имеет металлический радиус только 0,89 А, значительно меньше, чем в случае лития (1,22 А) 2) потенциалы ионизации Ве, 9,32 и 18,21 эв, гораздо большие, чем у Ы (5,39 эе), делают Ве значительно менее электроположительным, если рассматривать его хилшческие свойства в сравнении со свойствами Действительно, не существует никаких кристаллических соединений или растворов, в которых ионы Ве + существовали бы как таковые. Все соединения, строение которых было определено, даже соединения с наиболее электроотрицательными элементами, такие, как ВеО и ВеР.,, по крайней мере частично обладают ковалентным характером связи. Электронное строение атомов других элементов II группы (Mg, Са, 5г, Ва и Ка) подобно строению атома Ве. Однако больший размер этих ато.мов уменьшает влияние заряда ядра на валентные электроны. Так, их потенциалы ионизации ниже, чем у Ве они в основном более электроположительны, а ионная природа их соединений законо-.мерно возрастает в группе сверху вниз. [c.67]
Рассмотрим теперь взаимодействие двух атомов Li. Электронное строение атома лития (ls 2s) выражается схемой [c.157]
Таким образом, третий период, подобно второму, начинается с двух s-элементов, за которыми следует шесть р-элементов. Структура внешнего электронного слоя соответствующих элементов второго п третьего периодов оказывается, следовательно, аналогичной. Так, у атомов лития и натрия во внешнем электронном слое находится по одному s-электрону, у атомов азота и фосфора — по два S- и по три р-электрона и т. д. Иначе говоря, с увеличением заряда ядра электронная структура внешних электронных слоев атомов периодически повторяется. Ниже мы увидим, что это справедливо и для элементов последующих периодов. Отсюда следует, что расположение элементов в периодической системе соответствует электронно.пу строению их атомов. Но электронное строение атомов определяется зарядом их ядер и, в свою очередь, определяет свойства элементов п lix соединений. В этом и состоит сущность периодической зависимости свойств элементов от заряда ядра их атомов, выражаемой периодическим законом. [c.92]
Все щелочные металлы — очень сильные восстановители, их стандартные электродные потенциалы (E ) отрицательные. Наиболее отрицателен Е° лития (см. табл. 6.1). Это связано с особенностями электронного строения атома лития (ls 2s ), наименьшим его радиу- [c.252]
Сопоставление рис. ХП.2 и ХП.З показывает, что электронное строение внешней оболочки атомов элементов следующих за неоном в точности повторяет строение атомов, предшествующих ему, т. е. второго периода. Так, натрий имеет во внешнем слое один электрон подобно литию. Химические свойства этих элементов сходны они являются активными одновалентными металла- [c.150]
Не составляет труда записать волновое уравнение Шрёдингера для атома лития, состоящего из ядра и трех электронов, или атома урана, состоящего из ядра и 92 электронов. Однако, к сожалению, эти дифференциальные уравнения невозможно решить. Нет ничего утешительного в том, что строение атома урана в принципе может быть найдено путем расчетов, если математические (хотя отнюдь не физические) трудности препятствуют получению этого решения. Правда, физики и физикохимики разработали для решения уравнения Шрёдингера множество приближенных методов, основанных на догадках и последовательных приближениях. Проведение последовательных приближений существенно облегчается использованием электронно-вычислительных машин. Однако главное достоинство применения теории Шрёдингера к атому водорода заключается в том, что она позволяет получить ясную качественную картину электронного строения многоэлектронных атомов без проведения дополнительных расчетов. Теория Бора оказалась слишком упрошенной и не смогла дать таких результатов, даже после ее усовершенствования Зом-мерфельдом. [c.374]
Для описания электронного строения атомов в основном состоянии часто применяется условное обозначение их электронной конфигурации группами символов п/, где п—главное квантовое число, указывающее энергетический уровень электрона, /—орбитальное квантовое число подуровня (вместо него обычно указывается соответствующий символ 5, р, 4 или а X — число электронов на данном подуровне. Например, электронное строение атома лития описывается конфигурацией 1.5 25 . Приведем еще не- [c.82]
Рассматривая электронное строение атомов различных элементов в порядке возрастания их порядкового номера, мы убедились (с. 28), что атом водорода (1в ) одновалентен, тогда как валентность атома гелия (1з ) равна нулю. Валентность атома лития (ls 2s ) во всех соединениях равна единице, тогда как бериллий (18 2в ) становится двухвалентным благодаря переходу атома в возбужденное состояние (18 28 2р ). Это объясняется тем, что энергия, затрачиваемая на возбуждение атома, с избытком компенсируется при образовании [c.42]
Эта энергетическая стабильность молекулы Lia связана с электронным строением атома лития Li(ls 2s ) или Li (K2s ) (здесь К—атомный остов, не принимающий участия в образовании МО). Образование молекулы можно в первом приближении схематически изобразить так [c.294]
Таким образом, электронную структуру всех рассмотренных элементов можно записать общей формулой п— 1)5 р /г5, которая не описывает электронное строение лишь атома лития, имеющего формулу п—1)52/15. Разница заключается в том, что, в отличие от всех других рассмотренных элементов, на предыдущем электронном слое атома лития находится два, а ие восемь электронов. На внешнем же электронном уровне число и характер электронов одни и те же — один электрон на 5-орбитали. [c.72]
Формирование -слоя (п = 2) начинается с лития, у которого имеется три электрона. Два электрона, как у гелия, заполняют А -слой. Третий электрон лития не может находиться в этом слое, так как на 1 -орбитали электронных вакансий нет. Помещение третьего электрона на -орбиталь, максимальная электронная емкость которой равна двум, противоречило бы принципу Паули. У последнего элемента второго периода — неона — все я- и р-орбитали при и = 2 заполнены. Электронное строение атомов элементов в нормальном состоянии приведено в табл. 2. В ней квадратные скобки символизируют электронные структуры благородных газов, которые органически входят в строение атомов последующих элементов. [c.40]
Литий имеет три электрона, два из которых находятся на уровне 15, а третий — на уровне 2 (п=2, /=0). Так как 25-электрон расположен гораздо дальше от ядра и частично экранирован двумя внутренними электронами от заряда ядра, равного +3, этот внешний электрон легко удалить и получить ион с электронным строением гелия. При переходе от лития к неону надо расположить восемь элементов этот ряд заканчивается неоном, который характеризуется устойчивой конфигурацией с восемью электронами (п=2). Следующий элемент, натрий, имеет один 35-электрон (п = 3, 1—0), который экранирован 10 внутренними электронами от заряда ядра, равного +И1 поэтому этот электрон связан слабо. [c.400]
Отсюда становится понятным принцип электронного строения атомов элементов периодической системы Менделеева. У самого легкого элемента — водорода — первая оболочка занята одним электроном. У следующего элемента — гелия — имеется два электрона, и, следовательно, первая оболочка занята полностью. С лития, имеющего три электрона, начинается заполнение второй оболочки, в которой может находиться 2-2 =8 электронов. Дальнейшее заполнение этой оболочки осуществляется в ряду элементов Ве, В, С, N. О, Р и заканчивается в элементе Ке. Далее начинается заполнение третьей оболочки, в которой может находиться 2-3 = 18 электронов, затем четвертой оболочки (2-4 =32 электрона) и т. д. [c.162]
Щелочные металлы первой подгруппы имеют на внешней электронной оболочке по одному электрону и, следовательно, одновалентны. Электронное строение лития показано на рисунке 58. [c.333]
Далее рассмотрим взаимодействие двух атомов Li. Электронное строение атома лития (ls 2i) таково (см. рис. 1.33), что в этом атоме имеется один неспаренный 25-электрон, поэтому за счет спаривания таких одиночных s-электронов можно ожидать образования молекулы Liz, аналогичной молекуле Нг. Действительно, молекула Уг существует. Энергия связи в молекуле Liz (1,03 эВ) приблизительно в четыре раза меньше энергии связи в молекуле Нг (4.48 эВ). Это обусловлено наличием около ядра лития первого электронного слоя, из-за чего связь Li – Li значительно более длинная (267 пм), чем связь Н-Н (74 пм) кроме того, две пары электронов первого слоя в молекуле Liz сильно экранируют ядра и отталкиваются друг от друга. Все это приводит к значительному ослаблению связи Li – U. [c.87]
Согласно представлениям Гейтлера и Лондона, водород способен к образованию молекулы Нг потому, что в его атоме имеется один неспаренный электрон, а гелий не может образовать молекулу Нб2 ввиду того, что оба электрона в атоме Не являются спаренными. Аналогично рассмотрим взаимодействие двух атомов Li. Электронное строение атома лития (ls 2s) (рнс. 1.34) таково, что в этом атоме имеется один неспаренный 25-электрон, поэтому за счет спаривания одиночных s-электронов можно ожидать образования молекулы LI2, аналогичной молекуле Нз. Действительно, молекула, LI2 существует. Энергия связи в молекуле Lis (1,03 эВ) приблизительно в четыре раза меньше энергии связи в молекуле Нг (4,48 эВ). Это обусловлено наличием около ядра лития перв ого электронного слоя, поэтому связь Li —Li значительно более длин-” ная, чем связь Н—Н (267 пм вместо 74 пм в молекуле Нг) кроме того, две пары электронов первого слоя сильно экранируют заряд ядра и отталкипаются друг от друга. Все это приводит к значи- тельному ослаблению связи. [c.81]
Гипотеза Григоровича. По мнению В. К. Григоровича, расположение атомов в твердых и жидких простых веществах определяется, в основном, их электронным строением [8]. В металлической решетке, где внешние электроны положительных ионов сильно возбуждены вследствие возмущающего действия соседних атомов, сравнительно небольшой прирост температуры может быть достаточным для наступления перекрытия и обменного взаимодействия внешних р оболочек ионов, не перекрывающихся при низких температурах ([8], стр. 202). Так, например, объемноцентрированная кубическая структура натрия, область существования которой простирается от 30 К до температуры плавления, по Григоровичу, может быть объяснена с помощью следующих соображений. Из экспериментальных данных (об оптических свойствах, эффекте Холла и т. д.) известно, что натрий в твердом и жидком состоянии имеет один электрон проводимости на атом. Это означает, что его валентный электрон с Зз уровня переходит в электронный газ. Атомы натрия в конденсированном состоянии имеют внешнюю 25 2р оболочку. Взаимодействие ионов с электронным газом приводит к сближению и перекрыванию р-орбиталей внешних р оболочек ионов, в результате чего возникают обменные / вухэлектронные о-связи, направленные по трем осям прямоугольных координат. Образование шести связей каждым атомом со своими соседями приводит к простой кубической ячейке со свободным объемом в центре, который может быть заполнен таким же ионом. Так, из двух простых кубических под-решеток, энергетически невыгодных, а потому редко реализующихся в металлах, образуется ОЦК структура, одна из трех типичных металлических структур. Гипотеза Григоровича иллюстрируется рис. 43. Точно так же обосновывается возникновение ОЦК структур и у других щелочных металлов. Для лития, ионы которого имеют 15 оболочку, возникновение ОЦК структуры связывается с предположением о переходе 8 электронов на р уровни. [c.175]
Лит. Григорович В. К. Периодический закон Менделеева и электронное строение металлов. М., 1966 Корнилов И. И. [и др.]. Метаплохимические свойства элементов периодической системы. М., 1966 О р м о н т Б. Ф. Современное содержание стехиометрических законов. Фазы и соединения переменного состава. Нестехиометрические соединения. В кн. Соединения переменного состава. Л., 1969 Сивертсен Д. М., Николь-с о н М. Е. Структура и свойства твердых растворов. Пер. с англ. М., 1964 Шуберт К. Объяснение химической связи пространственной корреляцией электронов. В кн. Интерметаллические соединения. Пер. с англ. М., 1970 Гольдшмидт X. Дж, Сплавы внедрения, в, 1. Пер. с англ. М., 1971 Тейлор К., Дарби М. Физика редкоземельных соединений. Пер. с англ. М., 1974. [c.487]
Из этой таблицы можно, в частности, видеть, что при одинаковом электронном строении анионы обладают большими размерами, чем катионы. Если взять ряд солей типа АБ, в которых анион Б остается неизменным, а размер катиона А последовательно увеличивается, то в таком ряду при достижении определенной величины отношения радиуса А к радиусу Б может произойти изменение структуры кристаллической решетки. Так, например, случае хлоридов щелочных металлов при достижении отношения радиуса катиона к радиусу аниона, равного 0,91, кристаллическая решетка типа Na l (в которой кристаллизуются хлориды лития, натрия и калия) ме1няется на тип s l (в которой кристаллизуется хлорид цезия). [c.14]
chem21.info
