Строение атома циркония (Zr), схема и примеры
Общие сведения о строении атома циркония
Относится к элементам d-семейства. Металл. Обозначение – Zr. Порядковый номер – 40. Относительная атомная масса – 91,22 а.е.м.
Электронное строение атома циркония
Атом циркония состоит из положительно заряженного ядра (+40), внутри которого есть 40 протонов и 51 нейтрона, а вокруг, по пяти орбитам движутся 40 электронов.
Рис.1. Схематическое строение атома циркония.
Распределение электронов по орбиталям выглядит следующим образом:
+40Zr)2)8)18)10)2;
1s22s22p63s23p63d104s24p64d25s2.
Внешний энергетический уровень атома циркония содержит 4 электрона, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
Валентные электроны атома циркония можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
|
Подуровень |
n |
l |
ml |
s |
|
s |
5 |
|
0 |
+1/2 |
|
s |
5 |
0 |
0 |
-1/2 |
|
d |
4 |
2 |
-2 |
+1/2 |
|
d |
4 |
2 |
-1 |
+1/2 |
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Строение атома – материалы для подготовки к ЕГЭ по Химии
Автор статьи — профессиональный репетитор И. Давыдова (Юдина).
Атом – в переводе с древнегреческого – неделимый – это наименьшая частица химического элемента, являющаяся носителем его свойств. Современные представления о строении атома требуют для понимания знаний основ квантовой механики, поэтому мы ограничимся упрощенной моделью.
Атом состоит из ядра (в составе которого протоны и нейтроны) и электронов. Несмотря на то, что ядро составляет большую часть массы атома, оно очень мало.
| Заряд z | Масса m | |
| Протон p+ | +1 | 1 |
| Нейтрон n0 | 0 | 1 |
| Электрон e– | -1 | 0 |
Количество протонов равно количеству электронов и равно номеру атома в периодической таблице. Число нейтронов равно разности атомной массы и номера элемента.
Бор – пятый элемент периодической таблицы, в его атоме 5 протонов и 5 электронов. Атомная масса ≈ 11, количество нейтронов равно 11 – 5 = 6.
Элементы, имеющие одинаковое количество протонов в ядре, но различающиеся числом нейтронов, называются изотопами.
Например, 35Cl и 37Cl – изотопы, различающиеся атомной массой и количеством нейтронов.
| Число протонов | Число нейтронов | Число электронов | |
| 35Cl | 17 | 18 | 17 |
| 37Cl | 17 | 20 | 17 |
Вокруг ядра по различным траекториям – орбиталям движутся электроны. Каждой орбитали соответствует определенный уровень энергии, чем ближе орбиталь к ядру, тем меньшей энергией должен обладать электрон, чтобы находиться на ней.
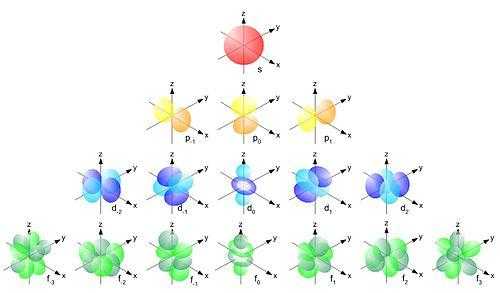
Порядок заполнения орбиталей:
Электроны располагаются на орбиталях в соответствии со следующими правилами:
- Принцип наименьшей энергии: в первую очередь электроны заполняют наиболее низкие по энергии уровни (ближайшие к ядру).
Энергия орбиталей на уровнях и подуровнях изменяется следующим образом: 1s < 2s < 2р < Зs < Зр < 4s < 3d < 4р < 5s <4d < 5р < 6s < 4f ≈ 5d < 6p < 7s < 5f ≈6d < 7p . (●)
| Тип орбитали | Число орбиталей на энергетическом уровне | Максимальное количество электронов на этих орбиталях |
| s | 1 | 2 |
| p | 3 | 6 |
| d | 5 | 10 |
| f | 7 | 14 |
Перед оставшимися двумя принципами введем понятие спина электрона. Спин – характеристика самого электрона, представить его (это упрощенная модель, а ненастоящий физический смысл понятия спин!) можно как направление движения электрона вокруг своей оси: по или против часовой стрелки. Возможных значений всего два: +1/2 и -1/2.
- Принцип Паули: на каждой орбитали может быть не более двух электронов, причем их спины должны быть различными.
- Правило Хунда: суммарный спин системы должен быть максимально возможным.
Рассмотрим заполнение орбиталей электронами на нескольких примерах. У каждого следующего элемента таблицы Менделеева на один протон и один электрон больше, чем у предыдущего. У элементов n-го периода заполнены предыдущие n-1 электронные уровни.
– магний – двенадцатый элемент, имеет по 12 протонов и электронов. Распределим эти электроны в соответствии с (●), не забывая, что на каждом подуровне может быть не более двух электронов.
Магний – элемент третьего периода, следовательно, первый и второй энергетические уровни полностью заполнены – 1s22s22p6.Магний находится во второй группе, значит, на третьем уровне у него два электрона – 3s2. Итого получаем1s22s22p63s2.
В атоме магния в основном состоянии нет неспаренных электронов.
Если атому сообщили дополнительную энергию (например, нагрели), то электронная пара может распарится и один из электронов переходит на свободную орбиталь того же энергетического уровня. В возбужденном состоянии атом магния имеет два неспаренных электрона и может образовать две связи (валентность II).
– фосфор – пятнадцатый элемент, распределяем 15 электронов: Фосфор – элемент третьего периода, следовательно, первый и второй энергетические уровни полностью заполнены – 1s22s22p6.Фосфор находится в пятой группе, значит, на третьем уровне у него пять электронов – 3s23p3. Итого получаем1s22s22p63s23p3
В атоме фосфора в основном состоянии 3 неспаренных электрона. В возбужденном состоянии атом фосфора имеет пять неспаренных электронов и может образовать пять связей (валентность V).
– цирконий – сороковой элемент, распределяем 40 электронов. Цирконий – элемент пятого периода, следовательно, первые четыре энергетических уровня полностью заполнены – 1s22s22p63s23p64s23d104p6.Заполнение пятого уровня начинается с 5s2. Цирконий – второй d – элемент в пятом периоде, значит, он содержит 2 электрона на 4d – подуровне. Итого получаем: 1s22s22p63s

В атоме циркония в основном состоянии 2 неспаренных электрона.
В возбужденном состоянии цирконий имеет четыре неспаренных электрона.
Исключениями из общего порядка заполнения электронных подуровней являются хром, марганец, медь, серебро и золото – у них наблюдается «провал» электрона с внешного s – подуровня на предвнешний d. Например, электронные конфигурации хрома и меди вместо 4s23d4 и 4s23d9 имеют вид 4s13d5 и 4s13d10.
Задания для тренировки:
- Сколько протонов и электронов содержит ион NO2–
1) 46p, 46e
2) 23p, 24e
3) 23р, 23e
4) 46p, 47e - Чем отличаются изотопы одного и того же химического элемента?
1) Числом протонов
2) Числом электронов
3) Зарядом ядра
4) Массовым числом - Укажите атом, в котором больше всего электронов:
1) 2Н
2) 40Аr
3) 41Ar
4) 39К - Изобразить электронно-графическую схему атома хлора в основном и всех возможных возбужденных состояниях. Какие валентности способен проявлять хлор?
- Объяснить, почему сера проявляет валентность VI, а кислород – не проявляет, хотя оба эти элемента содержат по 6 электронов на внешнем слое.
Звоните нам: 8 (800) 775-06-82 (бесплатный звонок по России) +7 (495) 984-09-27 (бесплатный звонок по Москве)
Или нажмите на кнопку «Узнать больше», чтобы заполнить контактную форму. Мы обязательно Вам перезвоним.
ege-study.ru
Цирконий электронное строение – Справочник химика 21
Благодаря тому, что атомы и ионы аналогичных элементов побочных подгрупп пятого и шестого периодов имеют не только сходное электронное строение, но и практически совпадающие размеры,— а их химических свойствах наблюдается гораздо более близкое сходство, чем в случае элементов четвертого и пятого периодов. Так, цирконий по своим свойствам значительно ближе к гафнию, чем к титану, ниобий сходен с танталом в большей степени, чем с ванадием и т. д. [c.642]В V периоде элемент IV группы — цирконий — непосредственно следует за элементом П1 группы —. иттрием, а в VI пер1Иоде между элементом III группы — лантаном — и элементом IV группы — гафнием — вклиии-вается длииный ряд лантанидов. У лантанидов происходит достройка электродами третьего снаружи электронного слоя. С возрастанием за1ряда атомного ядра у них электронные оболочки все более стягиваются к ядру, и радиус атома уменьшается (табл. 13). Из-за этого, и у элементов, следующих за лантанидами, атомные радиусы оказываются относительно малым и близкими к атомным радиусам соответствующих элементов V периода. Сходство строения атомов здесь дополняется близостью. их радиусов. Поэтому и по химическим свойствам элементы цирконий и гаф,ний, ниобий и тантал, молибден и вольфрам и т. д. оказываются попарно чрезвычайно сходными. [c.152]
Рассмотрим возможные причины сходства элементов. Сходство элемента с его соседями сверху и снизу есть внутригрупповое сходство элементов-аналогов оно обусловлено прежде всего близким строением самых внешних электронных оболочек. Наибольшее сходство и изоморфизм проявляют тяжелые аналоги с близким строением внешних электронных оболочек, например калий и рубидий, серебро и золото, кальций и стронций, цинк и кадмий, скандий и иттрий, иттрий и гадолиний-лютеций, цирконий и гафний, ниобий и тантал, железо и никель, кобальт и никель и т. д. Значительные же различия свойств элементов-аналогов в высших валентных состояниях, когда все электроны уходят с внешней оболочки, большей частью обусловлено несходством строения внешних оболочек ионов (литий и натрий, бериллий и магний, бор и алюминий, углерод и кремний и т. д.). [c.158]
Работы Г. Мозли (1887—1915) показали, что действительной основой периодического закона являются не атомные массы, а положительные заряды ядер атомов, численно равные порядковому номеру элемента в периодической системе. На основании периодического закона и работ Г. Мозли был решен важный вопрос о числе еще неоткрытых злементов. Было установлено, например, что между водородом и гелием или между натрием и магнием новых элементов быть не может. Открытие и дальнейшее развитие периодического закона не только избавило исследователей во многих случаях от бесполезной и трудоемкой работы по поиску новых элементов, но и позволило установить число неоткрытых элементов и их порядковые номера в периодической системе. Однако знание только порядкового номера не давало еще оснований помещать элемент в определенную группу периодической системы. Этот вопрос решался с помощью электронной теории строения атома. Применение этой теории показало, например, что неоткрытый элемент № 72 должен быть аналогом циркония, а не лантаноидов. Элемент № 72 (гафний) действительно был найден в циркониевом минерале в 1923 г., а не в лантаноидах, где его много лет безуспешно искали, ошибочно считая аналогом лантаноидов. Даже спустя 70 лет после открытия периодического закона в таблице элементов до урана пустовали четыре клетки с номерами 43, 61, 85 и 87. Эти элементы — технеций, прометий, астат и франций — были [c.14]
Заполнение 4/ -оболочки оказывает весьма существенное влияние на строение электронных оболочек, атомные радиусы и физико-химические свойства металлов, следующих за лантаноидами (гафний, тантал, рений, вольфрам и т. д.), т. е. лантаноидное сжатие проявляется и за лантаноидами. Действительно, оно приводит, например, к тому, что металлический и ионный радиусы, возрастающие от титана к цирконию, от ванадия к ниобию и от хрома к молибдену, почти не изменяются при переходе к гафнию, танталу, вольфраму. Точно так же почти не увеличиваются металлические радиусы и ионные радиусы, отвечающие высшим валентным состояниям, при переходе от элементов ряда технеций—палладий к их аналогам рению—платине соответственно. Именно лантаноидное сжатие, происходящее в результате заполнения 4/ -оболочки, приводит к сближению свойств 5d- и 4с -переходных металлов, резко отличающихся по свойствам от более легких Зй-переходных металлов. Оно проявляется и на теплотах образования ионных соединений этих металлов и других химических характеристиках (см. главу II). Лантаноидное сжатие, а также заполнение 5й -оболочки, заканчивающееся у платины—золота, приводит к дополнительному сжатию внешних оболочек у последующих элементов ряда золото—радон, что отражается на возрастании ионизационных потенциалов последующих элементов. Вследствие этого потенциалы ионизации франция, радия, актиния оказываются соответственно выше потенциалов ионизации цезия, бария и лантана (см. рис. 6). В результате этого первые более тяжелые элементы оказываются менее электроположительными, чем последние. Сжатие внешних оболочек вследствие заполнения внутренних Af – и 5й -оболочек приводит к повышению энергии связи внешних электронов актиноидов по сравнению с их аналогами — лантаноидами. На это указывают данные, правда, пока довольно ограниченные по их потенциалам ионизации и имеющиеся уже более подробные сведения об их атомных радиусах (см. главу III). [c.51]
Между титаном и цирконием имеется несомненное сходство, но есть и различие. Между цирконием и гафнием наблюдается исключительное химическое родство, объясняемое не только подобием строения электронных оболочек, но и тем, что их атомные и ионные радиусы почти одинаковы (следствие лантаноидного сжатия ). Атом же титана значительно меньше, поэтому валентные электроны у циркония и гафния расположены на больших расстояниях от ядра, более эффективно экранированы от него внутренними электронными оболочками и, следовательно, менее прочно связаны с ядром. Потенциалы иониза- [c.208]
Гафний. Гафний непосредственно, следует за редкоземельными металлами. До появления теории строения атомов элемент с порядковым. номером 72 искали в редкоземельных минералах. Но из теории строения атомов следовало, что достройка третьего (снаружи) электронного слоя у редкоземельных металлов заканчивается у элементов с порядковым номером 71, и элемент с порядковым номером 72 должен по строению атома быть сходным уже не с редкоземельными металлами, а с ти-таном и цирконием. После этого гафний незамедлительно и был открыт при помощи рентгеноспектрального анализа в циркониевых рудах. [c.481]
Физические свойства. Одним из важнейших свойств гафния является способность испускать электроны как в металлическом, так и в солеобразном состояниях. Поэтому он применяется в рентгено- и радиотехнике. По физическим свойствам он больше всего похож на цирконий, ближайшим аналогом которого является, что обусловливается одинаковым построением электронной оболочки, близкими величинами радиусов атомов и ионов одинаковой зарядности и одинаковым кристаллическим строением. Место его в таблице Менделеева определено на основании рентгеновского спектра. В чистом виде гафний, как и цирконий, — металл серебристо-белого цвета, твердый, хрупкий плотность 13,31, очень тугоплавкий (т. пл. 2222° С). [c.302]
Необходимо отметить весьма важные свойства металлов переходных групп, с которыми, несомненно, связаны и их высокая способность к пассивированию и их растворение. Известно, что поведение этих металлов в водных растворах является весьма сложным и зависит от множества факторов. Оно определяется возможностью протекания различных процессов на их поверхности комплексообразования, гидролиза, а также полимеризации, что обусловливается особенностью строения их электронных оболочек. Многие металлы, в том числе титан, цирконий, ниобий, тантал, молибден, ванадий, [c.74]
Введение в ионообменную хроматографическую систему комплексообразующих реагентов кардинально расширило возможности метода. В образовании комплексных соединений проявляются тонкие особенности электронного строения атомов элементов, более полно выявляется индивидуальность их свойств, поэтому резко повысилась степень однократного разделения смесей, во многом определяющая эффективность хроматографического опыта в целом. Образование многими металлами отрицательно заряженных комплексов не только позволило облегчить перемещение многозарядных катионов по слою катионита, но и широко использовать аниониты. Не случайно поэтому именно хроматографические системы с комплексообразующими реагентами привлекли особое внимание как специалистов в области комплексных соединений [7], так и аналитиков. В качестве иллюстрации достаточно упомянуть хроматографическое разделение смесей, включающих цинк, кадмий, индий, галлий, титан, цирконий, торий [8—И]. Заслуживают также упоминания систематические исследования хроматографических свойств практически всех метал,лов в растворах фто- [c.231]
Гафний Hf (4,5-10 % по массе) очень походит по свойствам на цирконий и только с большим трудом может быть от него отделен. По-видимому, такое близкое сходство объясняется, помимо аналогии в строении электронных оболочек, еще и очень небольшим различием в величине радиусов атомов обоих элементов. Тягучесть металла, тугоплавкость и высокая электронная эмиссия (способность испускать электроны при нагревании) гафния поз- [c.275]
Сплавы титана с металлами. К числу наиболее существенных факторов, определяющих взаимодействие в металлических системах и поддающихся сценке, относятся соотношение размеров атомов, электронное строение и число валентных электронов, тип кристаллической структуры. Сходство ЕО взаимодействии титана, циркония и гафния с другими металлами обусловлено аналогичным строением их атомов, совпадением структур обеих полиморфных модификаций, а небольшое различие — тем, что атом титана имеет несколько мень- [c.237]
Высокие Гк, одинаковая кристаллическая структура нитридов циркония и ниобия свидетельствуют о возможном подобии их электронного строения, однако различный характер изменения Гк в областях гомогенности этих соединений указывает на их определенные различия. [c.160]
Цирконий соответственпо строению электронной оболочки н, следовательно, своему месту в периодической системе элементов Д. И. Менделеева является аналогом титана в физико-химическом отношении. Для металла циркония это выражается в подобии его титану в отношении физических, механических, технологических, коррозионных свойств и характера образуемых сплавов. Особенность циркония — низкое сечение захвата тепловых нейтронов — в сочетании с высокими конструкционными и коррозионными свойствами, тугоплавкостью сделала его очень ценным металлом в некоторых отраслях иромышленности. Поэтому в последние 15—20 лет происходит широкое освоение циркония разработка методов получения и осуществление производства циркония высокой чистоты, детальное исследование его свойств и сплавов. [c.3]
Нитриды. Нитрид титана (как и нитриды циркония и гафния) во многих отношениях близок к карбиду. Для нитридов характерно преобладание металлической связи они изоструктурны карбидам, имеют достаточно высокие температуры плавления и твердость. Однако существуют и различия, обусловленные особенностями строения атомов углерода и азота. Оболочка L атома азота имеет 5 электронов — 2s 2p , т. е. она более достроена до октета, чем оболочка L атома углерода, следовательно, более стабильна, поэтому у азота ослаблена до-норная и усилена акцепторная способность. В основном состоянии атом азота имеет три неспаренных (2р ) электрона, которые прежде [c.235]
Строение электронных оболочек атомов и ионов позволяет объяснить и предсказать действия многих реагентов. Если рассмотреть деление периодической системы на четыре блока (s-блок, р-блок, d-блок и f-блок), элементы -блока и /-блока образуют комплексные соединения. Для них также характерно взаимодействие с органическими реагентами и образование большого числа окрашенных соединений. Цирконий и торий (d- и /-блок) образуют с арсеназо 1П устойчивые комплексные соединения зеленого цвета. Магний и алюминий (s-и р-блок) не взаимодействуют с арсеназо П1. В s-блоке расположены элементы, в которых строится s-оболочка над электронной структурой инертного газа — это щелочные и щелочноземельные элементы. Элементы s-блока [c.283]
Подгруппа титана (Ti, Zr, Hf). Кристаллы каждого из этих элементов существуют в двух модификациях. Низкотемпературная а-модификация характеризуется гексагональной плотной упаковкой атомов -модификация обладает ОЦК структурой. Отношение параметров решетки da у гексагональных упаковок составляет около 1,59 оно несколько меньше, чем при гексагональной плотной упаковке шаров. Энтропия плавления титана, циркония и гафния мала. Хотя дифракционные исследования строения жидких фаз еще не производились, можно думать, что в окрестности температуры плавления среднее координационное число атомов жидкости остается почти таким же, как в ОЦК кристаллах (см. табл. 16). Температурный интервал существования жидкой фазы очень велик. У циркония он составляет более 2500 К, а у гафния — более 3000 К. Можно предполагать, что в жидкой фазе четыре валентных s- и d-электрона обобществлены и таким образом концентрация электронного газа (или электронной жидкости ) велика. Поэтому жидкая фаза сохраняет устойчивость до температур 4—5 тыс. градусов. С этих позиций можно пытаться истолковать и аномально большие энтропии испарения. Они могут быть обусловлены иониза- [c.189]
Д. И. Менделеев предсказал существование гафния Н1. Свойства его были определены Н. Бором на основании периодической системы элементов, истолкованной им с точки зрения электронной теории строения атома. По Н. Бору, этот элемент, если исходить из строения атома, должен находиться в четвертой группе, быть аналогом циркония Ъх и сопутствовать этому элементу в природе. Основываясь на указании Н. Бора, венгерский химик Г. Хевеши совместно с голландским физиком Д. Костером рентгеноспектральным путем открывают этот элемент как спутник циркония. [c.120]
Вплоть до 1922 г. не было известно. Что цирконий и его соединения всегда содержат небольшие количества химического элемента с атомным номером 72. Существование этого элемента было предсказано Д. И. Менделеевым еще в 1870 г. На основании электронной теории строения атомов Н. Бор предсказал важнейшие свойства гафния. В 1922 г. Г. Хевеши и Д. Костер при рентгеноспектральном обследовании норвежских и гренландских цирконов обнаружили новые рентгеновские линии, которые совпали с характерными линиями, вычисленными для элемента с порядковым номером 72. [c.5]
К этому времени электронная модель атома, была разработана уже настолько, что на ее основе Нильс Бор смог объяснить периодичность строения атомов, объяснить особенности и порядок размещения элементов в периодической системе. На основании своих расчетов Бор заключил, что последним редкоземельным элементом должен быть элемент № 71 — лютеций, а элемент № 72, но его мнению, должен быть аналогом циркония. [c.120]
Одновременно раскрыта и причина деления элементов каждой группы периодической системы на главную и побочную подгруппы. У атомов элементов больших периодов после заполнения электронами подуровня наружного энергетического уровня очередные электроны размещаются на подуровне 3 второго снаружи энергетического уровня (стр. 41). Строение же наружного энергетического уровня в основном сохраняется у десяти элементов подряд. В каждой группе появляются элементы, в атомах которых строение наружного энергетического уровня не сходно с таковым для типических элементов группы. Например, структура наружного энергетического уровня у атомов типических элементов четвертой группы — углерода и кремния — пз пр у германия, олова и свинца — такая же структура — п8 пр -, у титана, циркония и гафния на наружном энергетическом уровне имеется только 2 -электрона (и ), а два электрона находятся на -подуровне второго снаружи энергетического уровня. Однако эти электроны принимают участие в образовании химической связи, поэтому максимальная валентность всех элементов этой группы одинакова и равна четырем. [c.51]
Подгруппа титана. Электронное строение атомов элементов подгруппы титапа (титап, цирконий, гафний и торий) характеризуется наличием восьми электронов на -орбите. У тория, вероятио, правильнее предполагать существование ( /-структуры. Однако, по входя глубоко в рассмотрение правильности представлений о группе актинидов, в плане данной статьи удобнее рассматривать торий как член подгруппы титана, поскольку но своим химическим свойствам он во многом близок к цирконию и гафнию. В свете представлений об электронных оболочках атомов этот факт отвечает тому, что энергии s d – и /-электроиов весьма близки между собой, вследствие чего цирконий, гафний и торий во всех своих соединениях яв-.1ЯЮТСЯ, как правило, четырехвалептпыми. Лишь титан можно восстановить до трех- и даже до двухвалентного состояния. Ионные радиусы элементов подгруппы титана, как это видно из приводимых ниже данных, закономерно возрастают от титана к торию [c.185]
В 1922 г. Нильс Бор на основании предложенной им теории строения электронных оболочек атома показал, что группа редкоземельных элементов заканчивается лютецием — элементом с атомным номером 71. Дополнительный электрон элемента 72 должен находиться на пятой электронной оболочке и действовать как валентный электрон. Поэтому элемент 72 должен быть четырехвалентным аналогом циркония, а не трехвалентным, как редкоземельные элементы [8, 9]. [c.5]
Из элементов подгруппы титана особенно близки друг к другу в химическом отношении цирконий и гафний. Большое сходство двух этих элементов объясняется тем, что атомы их имеют не только аналогичное строение электронных оболочек, но и вследствие лантаноидного сжатия, происходящего в семействе лантаноидов, очень близкие размеры радиусы атомов циркония и гафния соот- [c.443]
Из этих примеров видно, что основным во всяком ионообменном процессе является подыскание подходящих условий разделег ния ионов. Сорбируемость ионов определяется положением соответствующих им элементов в периодической системе Д. И. Менделеева. Кроме расположения элементов по группам, для хроматографического разделения существенным является и принадлежность элементов к различным семействам по горизонтальному направлению (А. Е. Фep мaн) Таковы семейство железа, включающее элементы от титана до меди, семейство молибдена, включающее элементы от циркония до палладия, и семейство вольфрама, включающее элементы от тантала до платины и золота. Сходство химических свойств в горизонтальном направлении зависит от сходства в строении их электронных оболочек (заполнение электронами более глубоких слоев). Элементы, принадлежащие к различным семействам, например железо и молибден, ванадий и молибден, молибден и рений, ниобий и вольфрам и другие, можно разделять хроматографически, решая тем самым наиболее трудные задачи количественного анализа. [c.119]
Исследования элементов при высоких давлениях, кардинальным образом изменяющих строение и степень перекрытия внешних электронных оболочек, привели к обнаружению неизвестных ранее модификаций рубидия, цезия, бария, галлия, индия, таллия, кремния, германия, олова, свинца, сурьмы, висмута, титана, циркония и других элементов. Круг полиморфных металлов расширился настолько, что можно полагать, что в природе вообще не существует элементов, сохраняющих одну и ту же структуру в достаточно широком диапазоне давлений и температур. [c.196]
Разногласия между результатами исследований Урбэна и теоретическими выводами Бора заинтересовали химика Хевеши и физика Костера, и они начали поиски элемента 72. Основываясь на выводах Бора, предсказавшего электронное строение атома элемента 72 и его основную валентность (4), и руководствуясь периодическим законом Д. И. Менделеева, они искали аналог циркония в минералах, содержащих последний. С этой целью методом рентгеноспектрального анализа были исследованы минералы циркония и в образце циркона из Норвегии установлено наличие нового элемента. Из циркониевых препаратов методом фракционной кристаллизации комплексных фтористых солей циркония с примесью гафния и калия или аммония были сконцентрированы и выделены препараты нового элемента. Совпадение линий рентгеновских спектров нового элемента с вычисленными по закону Мозли для элемента 72 позволило Хевеши и Костеру в январе 1923 г. сообщить об открытии нового элемента (10—12]. В честь города, в котором было совершено это открытие, элемент 72 назвали гафнием (Hafnia — латинское название Копенгагена). [c.6]
Отвечая на второй вопрос, учащиеся должны отметить, что в отлнчие от строения атомов всех другнх элементов атомы элементов главной подгруппы IV группы на внещнем слое имеют четыре электрона. Этим элементы подгруппы углерода отличаются п от элементов подгруппы титана. Атомы титана, циркония, гафния, курчатовия имеют во внешнем слое лишь два электрона. [c.131]
Близость химических свойств циркония и тафнйя Обмсняеэся, наряду с Другими причинами, сходством строения внешних электронных оболочек и близостью размеров атомов циркония и гафния. Атомные и ионные (для Ме ) раДиусы и атомный объем этих элементов (в А) следующие [7371 [c.8]
Цирконий существует в двух аллотропических модификациях до 860°С а-цирконий с гексагональной нлопюупаковаипой кристаллической решеткой, имеющей периоды а = 0,3223 пм с = 0,5147 нм координационное число 6 6 выше 862 С — Р-циркоиий с о. ц. к. решеткой, имеющей период а = 0,361 нм. Строение внешних электронных оболочек 4р 4й . [c.251]
Такое сложное поведение циркония в растворе объясняется большой химической активностью этого элемента. Препаративный цирконий (очищенный от гЮа) вступает во множество реакций, образуя простые и сложные соединения. Секрет повышенной химической активности циркония кроется в строении его электронных оболочек. Атомы циркония построены таким образом, что им свойственно стремление присоединить к себе как можно больше других ионов если таких ионов в растворе недостаточно, то ионы циркония соединяются между собой и происходит полимеризация. При этом химическая активность циркония утрачивается реакционная способность полимеризованных ионов циркония намного ниже, чем неполимеризованных. При полимеризации лшеньшается и активность раствора в целом. [c.201]
chem21.info
Цирконий строение электронных слоев – Справочник химика 21
В V периоде элемент IV группы — цирконий — непосредственно следует за элементом П1 группы —. иттрием, а в VI пер1Иоде между элементом III группы — лантаном — и элементом IV группы — гафнием — вклиии-вается длииный ряд лантанидов. У лантанидов происходит достройка электродами третьего снаружи электронного слоя. С возрастанием за1ряда атомного ядра у них электронные оболочки все более стягиваются к ядру, и радиус атома уменьшается (табл. 13). Из-за этого, и у элементов, следующих за лантанидами, атомные радиусы оказываются относительно малым и близкими к атомным радиусам соответствующих элементов V периода. Сходство строения атомов здесь дополняется близостью. их радиусов. Поэтому и по химическим свойствам элементы цирконий и гаф,ний, ниобий и тантал, молибден и вольфрам и т. д. оказываются попарно чрезвычайно сходными. [c.152]Отвечая на второй вопрос, учащиеся должны отметить, что в отличие от строения атомов всех других элементов атомы элементов главной подгруппы IV группы на внещнем слое имеют четыре электрона. Этим элементы подгруппы углерода отличаются п от элементов подгруппы титана. Атомы титана, циркония, гафния, курчатовия имеют во внешнем слое лишь два электрона. [c.131]
Гафний. Гафний непосредственно, следует за редкоземельными металлами. До появления теории строения атомов элемент с порядковым. номером 72 искали в редкоземельных минералах. Но из теории строения атомов следовало, что достройка третьего (снаружи) электронного слоя у редкоземельных металлов заканчивается у элементов с порядковым номером 71, и элемент с порядковым номером 72 должен по строению атома быть сходным уже не с редкоземельными металлами, а с ти-таном и цирконием. После этого гафний незамедлительно и был открыт при помощи рентгеноспектрального анализа в циркониевых рудах. [c.481]
Из этих примеров видно, что основным во всяком ионообменном процессе является подыскание подходящих условий разделег ния ионов. Сорбируемость ионов определяется положением соответствующих им элементов в периодической системе Д. И. Менделеева. Кроме расположения элементов по группам, для хроматографического разделения существенным является и принадлежность элементов к различным семействам по горизонтальному направлению (А. Е. Фep мaн) Таковы семейство железа, включающее элементы от титана до меди, семейство молибдена, включающее элементы от циркония до палладия, и семейство вольфрама, включающее элементы от тантала до платины и золота. Сходство химических свойств в горизонтальном направлении зависит от сходства в строении их электронных оболочек (заполнение электронами более глубоких слоев). Элементы, принадлежащие к различным семействам, например железо и молибден, ванадий и молибден, молибден и рений, ниобий и вольфрам и другие, можно разделять хроматографически, решая тем самым наиболее трудные задачи количественного анализа. [c.119]
Введение в ионообменную хроматографическую систему комплексообразующих реагентов кардинально расширило возможности метода. В образовании комплексных соединений проявляются тонкие особенности электронного строения атомов элементов, более полно выявляется индивидуальность их свойств, поэтому резко повысилась степень однократного разделения смесей, во многом определяющая эффективность хроматографического опыта в целом. Образование многими металлами отрицательно заряженных комплексов не только позволило облегчить перемещение многозарядных катионов по слою катионита, но и широко использовать аниониты. Не случайно поэтому именно хроматографические системы с комплексообразующими реагентами привлекли особое внимание как специалистов в области комплексных соединений [7], так и аналитиков. В качестве иллюстрации достаточно упомянуть хроматографическое разделение смесей, включающих цинк, кадмий, индий, галлий, титан, цирконий, торий [8—И]. Заслуживают также упоминания систематические исследования хроматографических свойств практически всех метал,лов в растворах фто- [c.231]
Подобный ход образования электронной оболочки с возвратом назад был теоретически доказан Н. Бором, определившим энергетическую устойчивость атомных систем с точки зрения квантовой теории. Рассматривая на основе этой теории строение лантанидов. Бор пришёл к следующему важному заключению лантан пмеет 57 электронов, причём, хотя у него начата постройка 5-го и даже 6-го слоя, в 4-м слое остались незаполненными 14 мест. У лантанидов как раз и происходит заполнение этих мест, что является характерным признаком всего пх семейства. Отсюда можно определить и общее число лантанидов. Оно равно 14. Следовательно, последний пх член доолжеп иметь 71 Это будет лютеций. У него 4-й слой достроен полностью. Отсюда следует, что 72-й электрон должен включаться уже не в 4-й слой, а в 5-й. Вследстеие этого ожидаемый элемент К 72 должен принадлежать не к лантанидам, а к IV группе менделеевской системы, т. е. быть аналогом циркония и тория. Как видим, индивидз альные и групповые признаки элемента № 72 Бор определил, исходя из общей закономерной связи между все ми элементами. [c.71]
chem21.info
Цирконий атом, строение – Справочник химика 21
Между титаном и цирконием имеется несомненное сходство, но есть и различие. Между цирконием и гафнием наблюдается исключительное химическое родство, объясняемое не только подобием строения электронных оболочек, но и тем, что их атомные и ионные радиусы почти одинаковы (следствие лантаноидного сжатия ). Атом же титана значительно меньше, поэтому валентные электроны у циркония и гафния расположены на больших расстояниях от ядра, более эффективно экранированы от него внутренними электронными оболочками и, следовательно, менее прочно связаны с ядром. Потенциалы иониза- [c.208]ГАФНИЙ (Hafnium, от древнего названия Копенгагена) Hf — химический элемент IV группы 6-го периода периодической системы элементов Д. И. Менделеева, п. н. 72, ат. м. 178,49 природный Г. состоит из шести изотопов. Положение Г. в периодической системе предсказал Д. И. Менделеев задолго до его открытия. Основываясь на выводах Н, Бора о строении атома 72-го элемента, Д. Костер и Г. Хевеши обнаружили этот элемент в минералах циркония и назвали его. Г.— рассеянный элемент, не имеет собственных минералов, в природе сопутствует цирконию (I — 7%). Г.— серебристо-белый металл, т. нл. 2222 30 С чистый Г. очень пластичен и ковок, легко поддается холодной и горячей обработке. По своим химическим свойствам очень близок к цирконию, потому их трудно разделить. В соединениях Г. четырехвалентен. Металлический Г. легко поглощает газы. На воздухе Г. покрывается тонкой пленкой оксида HfOj. При нагревании реагирует с галогенами, а при высоких температурах — с азотом и углеродом, [c.65]
Нитриды. Нитрид титана (как и нитриды циркония и гафния) во многих отношениях близок к карбиду. Для нитридов характерно преобладание металлической связи они изоструктурны карбидам, имеют достаточно высокие температуры плавления и твердость. Однако существуют и различия, обусловленные особенностями строения атомов углерода и азота. Оболочка L атома азота имеет 5 электронов — 2s 2p , т. е. она более достроена до октета, чем оболочка L атома углерода, следовательно, более стабильна, поэтому у азота ослаблена до-норная и усилена акцепторная способность. В основном состоянии атом азота имеет три неспаренных (2р ) электрона, которые прежде [c.235]
Сплавы титана с металлами. К числу наиболее существенных факторов, определяющих взаимодействие в металлических системах и поддающихся сценке, относятся соотношение размеров атомов, электронное строение и число валентных электронов, тип кристаллической структуры. Сходство ЕО взаимодействии титана, циркония и гафния с другими металлами обусловлено аналогичным строением их атомов, совпадением структур обеих полиморфных модификаций, а небольшое различие — тем, что атом титана имеет несколько мень- [c.237]
На основе периодического закона и периодической системы, Д. И. Менделеева быстро развивалось учение о строении атома. Оно вск ьмо физический смысл периодического закона и объяснило расположение элементов в периодической системе. Правильность учения о строении атома всегда проверялась периодическим законом. Вот еще один пример. В 1921 г. Н. Бор показал, что элемент с 2=72, существование которого предсказано Д. И. Менделеевым в 1870 г., должен иметь строение атома, аналогичное атому циркония (2г— 2.8.18.10.2, а НГ — 2.8.18.32.10.2), а потому искать его следует среди минералов циркония. Следуя этому предсказанию, в 1922 г. венгерский химик Д. Хевеши и голландский физик Д. Костер в норвежской циркониевой руде открыли элемент с 2=72, назвав его гафнием (от лат. названия г. Копенгагена — места открытия элемента). Это был величайший триумф теории строения [c.50]
В кристаллической решетке 2гОа каждый атом 2г окружен восемью атомами кислорода, а каждый атом О связан с четырьмя атомами 2г в результате кристалл имеет природу гигантской молекулы. Такое строение кристаллической двуокиси циркония определяет ее высокую стабильность, выражающуюся в большой твердости (6,5 по шкале [c.280]
Количество воды, остающейся в осадках гидроокисей циркония и гафния, зависит от способа получения и длительности процесса старения. При медленном нагревании гидроокиси циркония обезвоживание, происходящее в широком интервале температур и заканчивающееся при 300°, сопровождается непрерывным уменьшением давления пара над осадком. Непрерывно уменьшается и число молекул воды, приходящихся на один атом 2г,что указывает на отсутствие гидратов определенного состава. Гидроокись циркония, полученная осаждением из растворов и подвергнутая длительному старению, обнаруживает признаки кристаллического строения. Это позволило ряду авторов рассматривать ее как гидратированную двуокись циркония (2г02- гНгО) . Основой ее структуры являются фрагменты 2гОа- 2Н2О и 2гО(ОН), связанные между собой донорно-акцепторной связью и образующие кристаллический скелет [c.283]
Соединения с кислородом. Окислы. Цирконий и гафний образуют с кислородом только по одному соединению 2гОг и НЮ2. В цирконии может растворяться до 29 ат. % кислорода с образованием твердого раствора. Двуокись циркония, как и двуокись гафния, существует в трех кристаллических модификациях моноклинной, тетрагональной и кубической, имеющих параметры решеток а=5,17А, й = 5,27А, с=5,31А и р = 80,8° а = 5,07А, с=5,1бА а=5,06 А. Моноклинная модификация циркония устойчива при низких температурах. Моноклинная модификация в тетрагональную превращается при 1075°. При этом увеличивается плотность с 5,31 до 5,72, что соответствует объемному сжатию на 7,7%, Кубическая модификация устойчива выше ЭОО . Моноклинная двуокись гафния, имеющая параметры решетки а=5,10А, 6=5,13 А, с=5,27А, Р = 80,2°, превращается в тетрагональную при 1600—1700°. Превращение также сопровождается увеличением плотности с 9,68 до 10,01. В кристаллической решетке 2гОг каждый атом циркония окружен восемью атомами кислорода, а каждый атом кислорода связан с четырьмя атомами циркония, в результате кристалл имеет природу гигантской молекулы. Такое строение кристаллической двуокиси циркония определяет ее высокую стабильность, выражающуюся в большой твердости, высокой температуре плавления, низком давлении пара и низкой химической активности. Температуры плавления ЕгОг и НЮг — соответственно 2960 и 2810°. [c.206]
Особенностью этой группы ВКС является неплоское строение металлоциклов, найденное не только в открытых плоских структурах типа салицилальдегидата меди, где атом меди занимает центры симметрии и находится в одной плоскости с атомами кислорода, но также в молекулах дигидратов ацетилацетонатов никеля и кобальта (II) ив молекуле ацетилацетоната циркония. Причина такого перегиба цикла пока еще неясна возможно, что это в некоторых случаях отвечает минимуму энергии цикла. [c.59]
Для ряда ВКС с донорными атомами кислорода, а также кислорода и азота установлено неплоское строение металлоцикла атом металла не лежит в плоскости легких атомов металлоцикла. Такое строение металлоцикла наблюдается в ВКС различных металлов — меди, никеля, цинка, кобальта, циркония. Оно не связано ни с природой атома металла, ни с конфигурацией молекулы ВКС. Смещение атома металла приводит к перегибу цикла по линии О. .. О или N. .. О. Молекулы, в которых такие неплоские циклы связаны центром симметрии, имеют в этих случаях ступенчатое строение, форму кресла . В указанных группах ВКС перегибы металлоциклов встречаются в соединениях с шести- и пятичленными циклами (ацетилацетонаты, салицилал-Ы-иминаты, 8-оксихинолинаты). [c.99]
Такое же строение имеет и система цирконий—водород с эвтек-тоидной точкой при 42 (32) ат. % водорода и температуре 560 10 °С 143, 169]. Однако в этой системе установлено существование двух фаз гидрида — б и е, имеющих кубическую и тетрагональную структуру, соответственно. Показано, что для г-фазы (более богатой водородом и достигающей стехиометрического состава ZrHj) тетрагональное искажение решетки уменьшается с повышением температурьв (как и в системе Ti—Н) [189]. О системе гафний—водород сведений очень мало. Установлено только на основании рентгенографических и нейтронографических исследований [136, 137], что в этой системе имеются три гидридные фазы — псевдокубическая, кубическая и тетрагональная, которые появляются в этой же последовательности при увеличении содержания водорода. Утверждается также, что- [c.155]
chem21.info
Цирконий — Мегаэнциклопедия Кирилла и Мефодия — статья
Цирко́ний (лат. Zirconium), Zr (читается «цирконий»), химический элемент с атомным номером 40, атомная масса 91, 224. Расположен в группе IVB, в 5-м периоде периодической системы. Является смесью пяти стабильных нуклидов с массовыми числами 90 (51, 46%), 91 (11, 23%), 92 (17, 11%), 94 (17, 40%) и 96 (2, 80%). Значение эффективного сечения захвата тепловых нейтронов 1, 8·10-29 м2. Конфигурация внешнего электронного слоя атома 4s2p6d25s2. Проявляет степени окисления +4 (валентность IV), +3, +2 и +1 (валентности III, II и I; кластеры малоустойчивы).
Радиус атома Zr 0, 139 нм, радиус иона Zr4+0, 073 нм (координационное число 4), 0, 086 нм (координационное число 6) и 0, 098 нм (координационное число 8). Энергии последовательной ионизации атома циркония — 6, 837, 13, 13, 22, 98, 34, 32 и 82, 3 эВ. Электроотрицательность по Полингу 1, 4.В 1789 М. Г. Клапрот выделил из драгоценного камня циркона (перс. «циркон» — золотистый) оксид нового элемента. Элемент цирконий получил в 1829 швед Й. Я. Берцелиус, восстанавливая фторцирконат калия K2[ZrF 6] металлическим натрием:K2[ZrF6] + 4Na = Zr + 2KF + 4NaF
Этот цирконий имел много примесей. Чистый цирконий был получен в 1925 А. ван Аркелем.
Содержание в земной коре 0, 02% по массе. В свободном виде не встречается. Образует более 30 минералов, из которых важнейшими являются циркон ZrSiO4, бадделеит ZrO2и эвдиалит (Na, Ca)6ZrOH(Si3O9)2(OH, C1)2 .Обогащенную циркониевую руду спекают при 600-700°C с фторсиликатом калия K2SiF6 (фторидный способ):
K2SiF6 + ZrSiO4 = K2ZrF6 + 2SiO2
Далее фторцирконат калия K2ZrF6 (вместе с фторцирконатом гафния K2HfF6) выщелачивают водой, подвергают дробной кристаллизации (для очистки от примеси гафния). Затем в расплаве цирконий восстанавливают электролизом.
При хлоридном способе руду хлорируют в присутствии кокса, полученный тетрахлорид циркония ZrCl4 очищают сублимационно-десублимационным методом, затем восстанавливают магнием:
ZrCl4 + 2Mg = Zr + 2MgCl2
При использовании щелочного способа руду спекают с гидроксидом натрия NaOH, содой Na2CO3 или смесью карбоната кальция CaCO3 и хлорида кальция. Затем проводят кислотное выщелачивание Na2ZrO3 или CaZrO3. Чистый Zr получают термическим разложением тетраиодида ZrI4 в парах.
Цирконий — серебристо-серый металл.
Существует в двух модификациях. Ниже 863°C устойчива гексагональная a-модификация с параметрами элементарной ячейки a = 0, 3231 нм, c = 0, 5146 нм. Плотность a-Zr 6, 51 кг/дм3. Выше 863°C устойчива кубическая объемно-центрированная b-модификация с параметрами решетки а = 0, 361 нм. Температура плавления 1855°C, температура кипения 4350°C.
Чистый Zr пластичен, сваривается в инертной атмосфере. Наличие примесей кислорода, азота, углерода, водорода ухудшает пластичность, твердость, прочность на разрыв. При обычной температуре образует поверхностную оксидную пленку ZrO2. При 400-500°C Zr реагирует с кислородом:
Zr + O2 = ZrO2
С азотом при 400°C образует нитрид циркония ZrN:
2Zr + N2 = 2ZrN
Тетрагалогениды циркония (ZrCl4, ZrBr4 и ZrI4) образуются из простых веществ при нагревании до 200-400°C. При нагревании с сильными восстановителями металлическим порошкообразным цирконием тетрагалогениды циркония переходят в галогениды циркония низших степеней окисления (в ZrCl3, ZrCl2 и ZrCl).
При нагревании выше 250°C Zr поглощает водород с образованием соединения переменного состава ZrHх, выше 400°C водород из этого соединения освобождается.
Цирконий взаимодействует с кислотами, если возможно образование его анионных комплексов. Так, мелко раздробленный цирконий растворяется в плавиковой кислоте:
Zr + 6HF = H2[ZrF6] + 2H2,
в смеси азотной и плавиковой кислот:
3Zr + 4HNO3 + 18HF = 3H2[ZrF6] + 4NO + 8H2O,
3Zr + 4HNO3 + 18HCl = 3H2[ZrCl6] + 4NO + 8H2O
Цирконий устойчив к растворам щелочей.
Диоксид ZrO2 не реагирует с водой, концентрированными соляной HCl и азотной HNO3 кислотами. Взаимодействует с концентрированной плавиковой HF и серной H2SO4 кислотами. С расплавленными щелочами ZrO2 реагирует с образованием солей — цирконатов:
ZrO2 + 2КOH = К2ZrO3 + H2O
При подкислении растворов цирконатов выделяется гидратированный гелеобразный оксид ZrO2·xH2O (гидроксид циркония):
Na2ZrO3 + HCl = NaCl + ZrO2·xH2O
При нагревании ZrO2·xH2O теряет воду, превращаясь в ZrO2.
Входит в состав сплавов, служащих конструкционными материалами в ядерном реакторостроении (сплав циркония и алюминия — циркалой). Из циркония изготовляют ответственные узлы химических реакторов, искусственные суставы и протезы. Диоксид циркония ZrO2, используется для получения высокотемпературных керамик.
- Зотова З. А. Современное состояние технологии переработки циркониевых концентратов за рубежом. М., 1976.
- Металлургия циркония и гафния / Под ред. Л. Г. Нехамкина. М., 1979.
- Руднева В. В. Синтез, строение и свойства сорбентов на основе оксигидрата циркония. – Москва: Флинта: Наука, 2006.
- Технология формирования покрытий на основе окислов циркония и титана. – Минск: Учреждение образования «Белорус. гос. ун-т информатики и радиоэлектроники», 2001.
- Ниобий, тантал и цирконий в минералах. – М.: Ин-т минералогии, геохимии и кристаллохимии ред. элементов, 1999.
megabook.ru
Электронное строение – атом – Большая Энциклопедия Нефти и Газа, статья, страница 2
Электронное строение – атом
Cтраница 2
Электронное строение атомов при сближении в кристалле претерпевает существенные изменения. Энергетические подуровни превращаются в зоны, которые, перекрываясь, делают возможным обмен и обобществление валентных электронов. Плотность заполнения электронами валентных зон определяет электрические и тепловые свойства. [16]
Электронное строение атома гелия Is2 объясняет его диамагнетизм и химическую инертность. [17]
Электронное строение атома железа ( Fe – Is22s22p63s23p63d54s2) и относительно малые размеры как нейтральных атомов Fe ( 1 26A) в металлическом железе, так и ионов Fe2, Fe3 ( 0 74 и 0 64 А соответственно, см. табл. 1.15) в сложных соединениях обусловливают многообразие валентных состояний железа. Как будет показано ниже, при обсуждении строения и свойств наиболее важных соединений железа, для него характерно – и преобладающе ионное, и преобладающе кова-лентное состояние. [18]
Электронное строение атомов Cr ( 3d54s) и Mo ( 4d55s) соответствует их потенциальной шестивалентности уже в основном состоянии. Напротив, атом W ( 5c / 46s2) сам по себе четырехвалентен, но возбуждение его шестивалентного состояния ( 5d56s) требует затраты лишь 8 ккал / г-атом. Последовательные ионизационные потенциалы ( в) хрома и его аналогов сопоставлены ниже. [19]
Электронное строение атомов Сг ( 3d4s) и Mo ( 4d55s) соответствует их потенциальной шестивалентности уже в основном состоянии. Напротив, атом W ( 5d46s2) сам по себе четырехвалентен, но возбуждение его щестивалентного состояния ( 5d56s) требует затраты лишь 8 ккал / г-атом. [20]
Электронное строение атома водорода изображается следующим образом. [22]
Электронное строение атомов элементов подгруппы титана ( титан, цирконий, гафний и торий) характеризуется наличием восьми электронов на й-орбите. У тория, вероятно, правильнее предполагать существование А2 / – структуры. Однако, не входя глубоко в рассмотрение правильности представлений о группе актинидов, в плане данной статьи удобнее рассматривать торий как член подгруппы титана, поскольку по своим химическим свойствам он во многом близок к цирконию и гафнию. [23]
Такое электронное строение атома и расположение углерода посередине шкалы электроотрицательно-стей обусловливают уникальные свойства данного элемента, благодаря которым существует огромное многообразие органических соединений. [24]
Напишите электронное строение атомов азота и фосфора и укажите, какие степени окисления они проявляют в своих соединениях. [25]
Рассмотрим электронное строение атомов элементов первых трех периодов периодической системы. [27]
Изобразите электронное строение атомов азота и фосфора и укажите, какие степени окисления они проявляют в своих соединениях. [28]
Рассмотрим электронное строение атомов элементов первых трех периодов периодической системы. [29]
Рассмотрите электронное строение атома I и молекулы 12 ( по методу молекулярных орбиталей) и укажите электрон, который теряется при ионизации. [30]
Страницы: 1 2 3 4
www.ngpedia.ru
