3. Физические свойства
Серебро — элемент, который был известен еще за 3000 лет до нашей эры в Египте, Персии, Китае. Основные физические свойства серебра:

Серебро имеет гранецентрированную кубическую кристаллическую решетку с параметром a= 4,0772А (при 20° С). По внешнему виду серебро — красивый металл белого цвета, очень пластичный и легко полируется. Из всех металлов серебро имеет наивысшую отражательную способность, равную в оранжево-красной части спектра 95%, наивысшую электропроводность и теплопроводность.
Ионный радиус серебра (Ag+) составляет, по Гольдшмидту и Полингу, 1,13 и 1,26 А соответственно.
Серебро марки Ср999-999.9 должно иметь примесей не более 0.1%. Удельное электрическое сопротивление ρ=0.015 мкОм•м. Механические характеристики серебра невысоки: предел прочности при разрыве не более 200МПа, относительное удлинение при разрыве ~50%. По сравнению с золотом и платиной имеет пониженную химическую стойкость. Часто применение серебра ограничивается его способностью диффундировать в материалы подложки.
4. Электронное строение атома серебра
4.1 Электронная формула серебра: 1s22s22p63s23p63d104s24p64d105s1
4.2 Серебро принадлежит к главной подгруппе
первой группы периодической системы
элементов Д. И. Менделеева и располагается
в пятом периоде (большом) между палладием
и кадмием. Номер группы, как правило,
указывает число электронов, которые
могут участвовать в образовании
химических связей (валентных электронов).
У атома серебра это электроны внешнего
электронного уровня. Номер периода
равен общему числу энергетических
уровней, заполняемых электронами, у
атомов элемента – в нашем случае серебра.
Порядковый номер серебра 47. Порядковый
номер показывает заряд ядра атома, у
серебра, следовательно, он будет +47. По
своим химическим свойствам и условиям
нахождения в природе серебро является
благородным металлом. Серебро относится
к «Б» группе. У серебра возможен эффект
провала электрона, т.к. один электрон с
5s
Атомная масса серебра по углеродной шкале равна 107,868. Элемент представляет естественную смесь двух устойчивых изотопов с массовыми числами 107 и 109.
4.3 Валентным подуровнем у серебра будет являться 5s1 подуровень, так как только он в данном случае может участвовать в образовании химических связей (подуровень 5s1 является незаполненным ему не хватает одного электрона). Серебро относится к типу d – элементов, так как в его атомах происходит заполнение электронами d – подуровень второго снаружи уровня.
4.4 5S1
4.5 Степени окисления серебра: 0, +1, +2, +3. Серебро в своих соединениях проявляет преимущественно степень окисления +1. Окисление до двухвалентного состояния может быть произведено действием озона или персульфата на соли серебра (I). Серебро (П) устойчиво преимущественно в комплексных соединениях. Для серебра известна также степень окисления +3. Серебро в степени окисления +3 известно в виде соединений Ag203 и KAgF4. Первое получается при анодном окислении фторида серебра, второе — фторированием смеси КСl и AgCl при высоких температурах. Прямым фторированием смеси 2CsCl + KCl + AgN03 получается соединение Cs2
Синтезированы также периодаты серебра, например Na5H2Ag(JO6)2•16Н20. Серебро относится к металлам.
4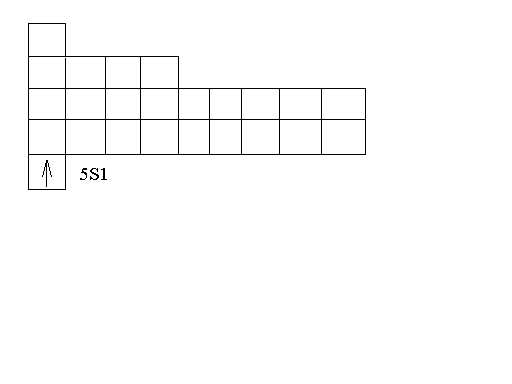 .6
.6
Валентный 5S1 подуровень серебра.
5.1 С водородом:
Ag + H2 ≠ реакция не идет
Ag 2O+ H2 = H2O + 2Ag
5.2 С галогеном(Br2):
2Ag + Br2 = 2AgBr – бромид серебра
5.3 С серой:
2Ag
+ S
= Ag
5.4 С азотом:
Ag + N2 ≠
5.5 С углеродом:
4Ag + C ≠
5.6 С кислородом
Ag + O2 = Ag2O – Оксид серебра
6.1 Оксиды серебра: Ag2O, AgO, Ag2O3, причем более или менее устойчивым является Ag2O. В комплексных соединениях оксид серебра более или менее устойчив:
AgNO3 + KOH + 2NH3h3OKNO3 + [Ag(NH3)2]OH
6.2 Оксид серебра является амфотерным оксидом, так как серебро является металлом и проявляет ярко выраженные металлические свойства – следовательно, он не может быть кислотным. Щелочным металлом серебро тоже не является. Электроотрицательность серебра по шкале равна 1,9.
6.3 Гидроксиды серебра: AgOH, Ag(OH)2, Ag(OH)3 . Гидроксиды серебра являются слабыми электролитами, так как они легко разлагаются водой.
6.4 AgOH – амфотерный
2AgOH → Ag2O + H2O
AgOH + NaOH → Na[Ag(OH)2]
AgOH + Na+ + OH– → Na+ + [Ag(OH)2]–
AgOH + 2HNO3 → H[Ag(NO3)2] + H2O
AgOH + 2H+ + 2NO–3→ H+ + [Ag(NO3)2]– + H2O
AgOH + 2NO–3→ [Ag(NO3)2]– + H2O
2AgOH + H2SO4 → Ag2SO4 + 2H2O
2AgOH + 2H+ +SO–4 → 2Ag+ + SO–4
2AgOH + 2H+ → 2Ag+ + 2H2O
6.5
2AgOH → Ag2O∙H2O
7. Сеpебpо обладает склонностью к образованию комплексных соединений.
Многие неpаствоpимые в воде соединения сеpебpа (напpимеp: оксид сеpебpа(I) — Ag2O и хлоpид сеpебpа — AgCl), легко pаствоpяются в водном pаствоpе аммиака. Комплексные цианистые соединения сеpебpа пpименяются для гальванического сеpебpения, так как пpи электpолизе pаствоpов этих солей на повеpхности изделий осаждается плотный слой мелкокpисталлического сеpебpа. Все соединения сеpебpа легко восстанавливаются с выделением металлического сеpебpа. Если к аммиачному pаствоpу оксида сеpебpа(I), находящемуся в стеклянной посуде, пpибавить в качестве восстановителя немного глюкозы или фоpмалина, то металлическое сеpебpо выделяется в виде плотного блестящего зеpкального слоя на повеpхности стекла. Этим способом готовят зеркала, а также серебрят внутреннюю поверхность стекла в сосудах для уменьшения потери тепла лучеиспусканием.
Примеры: Na3[Ag(S2O3)2]
[Ag(NH3)2]OH
[Ag(NH3)2]2
K[Ag(CN)2]
Na[Аg(SCN)2]; Na2[Ag(SCN)3]; Na3[Аg(SСN)4]
(NН4)5[Аg(SСN)6]
Сs3Ba[Ag(NО2)6]·2Н2О
(NН4)9[Аg(S2O3)4Cl2]
8.
AgNO3 + H2O ↔ AgOH + HNO3
Ag+ + NO–3 + H2O
↔ AgOH↓ + H
Ag+ + H2O ↔ AgOH↓ + H+
[H+] = 1∙10-14/[oh–]
[OH–] = c(AgNO3) = 0,01 моль/л = 10-2
pH = 1/2∙lgKн2о∙Ссоли /Кдис.=12
Повышение температуры и уменьшение концентрации соли увеличат полноту гидролиза.
9.1
При увеличении pH от кислой среды до щелочной увеличиваются окислительные свойства, а восстановительные уменьшаются, так как серебро в ряду напряжений находится правее водорода. Чем меньше алгебраическая величина электродного потенциала металла, тем выше восстановительная способность этого металла и тем ниже окислительная способность его ионов.
φAg2+/Ag+ = 1,980B pH ≤ 7
φAg+/Ag= 0,799B
Так как φAg2+/Ag+ > φAg+/Agследовательно восстановительная способность ионов Ag+/Ag выше, чем у Ag2+/Ag+
φAgO/Ag2O= 0,607B pH ≥ 7
φAgO/Ag2O= 1,398B pH ≤ 7 Ионы серебра в AgO/Ag2O при pH ≥ 7 проявляют более сильные восстановительные свойства, чем при pH ≤ 7.
9.2
0 + +7 -2 + -2 + -2 + +5 -2 + -2
1) 2Ag + K(ClO4)– + H2O Ag2O + K(ClO3)– + H2O
red ox нейтр. pH=7
0 + -2 + -2
red 2Ag – 2e +H2O Ag2O + 2H+ 2 1 окисление
+7 -2 + -2 +5 -2
ox (ClO4)– + 2e + H2O (ClO3)– + 2OH– 2 1 восстановление
0 +7 -2 + -2 + -2 +5 -2
2Ag + (ClO4)– + 2H2O Ag2O + (ClO3)– +2H+ + 2OH–
0 +7 -2 + -2 +5 -2
2Ag + (ClO4)– Ag2O + (ClO3)–
E0,B = φAg/Ag2O – φ(ClO4)–/(ClO3)–= 1,173 – 0,360 = 0,813B
+ -2 0 + -2 + 0 + +4 -2 + -2
2) 2Ag2O + Ti + 2NaOH 4Ag + Na2(TiO3)2- + H2O
ox red щелочн. pH>7
+ -2 + -2 0
ox Ag2O + 2e + H2O 2Ag + 2OH– 4 2 восстановление
0 +4 -2 + -2
red Ti – 4e + 6OH– (TiO3)2- + 3H2O 2 1 окисление
+ -2 0 + -2 0 +4 -2 + -2
2Ag2O + Ti + 2H2O + 6OH– 4Ag + (TiO3)2- + 4OH– + 3H2O
+ -2 0 0 +4 -2 + -2
2Ag2O + Ti + 2OH– 4Ag + (TiO3)2- + H2O
E0,B = φTi/(TiO3)2- – φAg2O/Ag = -1,250 – 1,173 = -2,423B
0 + +6 -2 + +5 -2 + -2 +3 +5 -2 + -2
3) 6Ag +K2CrO7 + HNO3 3Ag2O + 2Cr(NO3)3 + 4H2O
red ox кислотн. pH<7
0 + -2 + -2
red 2Ag – 2e + H2O Ag2O + 2H+ 6 3 окисление
+6 -2 + -2
ox (Cr2O7)2- + 6e + 14H+ 2Cr3+ + 7H2O 2 1 восстановление
0 +6 -2 + -2 + -2
6Ag + (Cr2O7)2- + 8H+ 3Ag2O + 2Cr3+ + 4H2O
0 +6 -2 + -2 + -2
6Ag + (Cr2O7)2- + 8H+ 3Ag2O + 2Cr3+ + 4H2O
E0,B = φAg/Ag2O– φ(Cr2O7)2-/Cr3+ = 1,173 – 1,330 = -0,157B
10.1
Серебро — малоактивный металл. В атмосфере воздуха оно не окисляется ни при комнатных температурах, ни при нагревании. Часто наблюдаемое почернение сеpебpяных предметов — результат образования на их поверхности черного сульфида сеpебpа – AgS2. Это происходит под влиянием содержащегося в воздухе сеpоводоpода, а также пpи соприкосновении
сеpебpяных предметов с пищевыми продуктами, содержащими соединения сеpы.
4Ag + 2H2S + O2 → 2Ag2S +2H2O
В ряду напряжения серебро расположено значительно дальше водорода. Поэтому в растворах таких кислот, как НСl, Н2SO4 и т. п., при отсутствии окислителей не растворяется. В кислотах, одновременно являющихся окислителями (НNО3, горячая концентрированная Н2SO4 и т. п.) серебро растворяется легко. С водородом, азотом и углеродом Аg не реагирует даже при высоких температурах. Под нормальным давлением кислорода серебро не только с ним практически не реагирует, но и крайне мало его растворяет. Напротив, жидкое серебро растворяет кислород довольно хорошо. Поэтому при затвердевании Аg происходит выделение из него газообразного кислорода, иногда сопровождающееся разбрызгиванием металла.
При нагревании металлического серебра в атмосфере и хлористого водорода имеет место обратимая реакция:
2 Аg + 2 НСl = 2 АgСl + Н2 + 71 кДж
Равновесие быстро устанавливается уже при 200 С. Если проводить процесс в замкнутом сосуде под атмосферным давлением, то при 600 С газовая смесь содержит по объему 92,8 % НСl и 7,2 % Н2, а при 700 С соответственно 95 % и 5 %.
Ag + HCl ≠
3Ag + 4HNO3 = 3AgNO3 + NO↑ + 2H2O
2Ag + NaOH + 2H2O = Na[Ag(OH)2] + H2↑
2Ag + 2NaOH → 2NaAgO + H2↑
10.2
Непосредственно измерить потенциал отдельного электрода (в частности серебра) невозможно. Обычно применяют так называемый стандартный водородный электрод, значение потенциала которого условно принимают за 0. Пластину серебра погружают в раствор его соли (например: AgNO3), содержащей 1 моль ионов Ag в 1000г воды, соединяют с водородным электродом и измеряют ЭДС при 25°с. Эта ЭДС и есть стандартный электродный потенциал.
_ 0
Ag+ + 1e → Ag
ΔE = – ΔC1/nF = +0,799
F – постоянная Фарадея = 96493
n – число электронов
10.3
Ag+/Ag ; Zn2+/Zn
c| Ag+/Ag || Zn2+/Zn|c
ЭДС = Е0Ag+/Ag – Е0AgZn2+/Zn = 0,799 – (-0,763) = 1,562
Гальванические элементы – устройства, применяемые для непосредственного преобразования энергии химической реакции в электрическую энергию. Действие гальванического элемента основано на протекании в нём окислительно – восстановительных процессов. В простейшем случае гальванический элемент состоит из двух пластин или стержней (электродов), изготовленных из различных металлов (в данном случае Ag и Zn) и погружённых в раствор электролита. Такая система позволяет пространственно разделить окислительно – восстановительные реакции: окисление происходит на одном электроде, а восстановление на другом (при этом электроны передаются от окислителя к восстановителю по внешней цепи).
Эта гальваническая пара состоит из серебряной пластины, опущенной в раствор сульфата серебра (Ag2SO4) – серебряный электрод и сульфата цинка (ZnSO4) – цинковый электрод и. Растворы соприкасаются друг с другом, но для предупреждения смешивания разделены пористой перегородкой.
При замкнутой внешней цепи серебро окисляется и переходит в раствор Ag2SO4.
0
Ag – 1e → Ag+
Электрод на котором происходит окисление называется анодом.
На цинковом катоде происходит восстановление ионов цинка и раствора ZnSO4 за счёт электронов, приходящих от серебряного электрода
0
Zn – 2e → Zn2+
Образующиеся атомы цинка выделяются в виде металла на цинковом электроде. Электрод на котором происходит восстановление называется катодом. При работе гальванического элемента электроны от восстановителя переходят к окислителю по внешней цепи, на электродах идут электрохимические процессы в растворе происходит движение ионов.
Чем меньше алгебраическая величина электродного потенциала металла, тем выше восстановительная способность этого металла и тем ниже окислительная способность его ионов.
E0Ag=+0,799 ; E0Zn=-0,763
Из этого следует, что Zn более сильный восстановитель, чем Ag.
10.4
Электрохимическая коррозия:
В паре Ag/Sn катодом будет серебро, а анодом олово, так как потенциал серебра значительно выше, чем у олова.
Анод:
0 2+
Sn – 2e → Sn 4 2
0 + –
O2 + 4e + 2H2O → 4OH– 2 1
0 0 + -2 +4 -2 +
2Sn + O2 + 2H2O → 2Sn(OH)2
Катод:0
Ag+ + 1e → Ag 2
0
2H+ +2e → H21
0 0
2Ag + 2H+ → 2Ag+ + H2
Eкор.= 1,23 – 0,059pH + ηO2/Ag– φ0Sn(OH)2 = 1,23 – 0,059∙7 + 0,97 + 0,900 = 2,687
При электрохимической коррозии поток электронов направлен от более активного металла к менее активному и более активный металл коррозирует. Металл с более отрицательным потенциалом разрушается – его ионы переходят в раствор, а электроны переходят к менее активному металлу, на котором происходит восстановление водорода или восстановлённого в воде кислорода. Электроны переходят от олова к серебру. Будет происходить разрушение олова, а на серебре, как на менее активном металле выделятся водород.
10.5 A-C ; K-C
AgF(р–в)= Ag+ + F– pH=7
K–0 А+0
2Ag+ + 2e → 2Ag 2F– – 2e → F2
восстановление окисление
ток 0 0
2AgF= 2Ag + F2
К– А+
AgF(р-р)
K– А+
Ag+ 0
2H2O ↔ 2H+ + 2OH– 2F– – 2e → F2
0
2H+ + 2e → 2H
0 0
2H → H2
2AgF + 2H2O = H2 + 2Ag(OH) + F2
K–А+
studfiles.net
3. Физические свойства
Серебро — элемент, который был известен еще за 3000 лет до нашей эры в Египте, Персии, Китае. Основные физические свойства серебра:

Серебро имеет гранецентрированную кубическую кристаллическую решетку с параметром a= 4,0772А (при 20° С). По внешнему виду серебро — красивый металл белого цвета, очень пластичный и легко полируется. Из всех металлов серебро имеет наивысшую отражательную способность, равную в оранжево-красной части спектра 95%, наивысшую электропроводность и теплопроводность.
Ионный радиус серебра (Ag+) составляет, по Гольдшмидту и Полингу, 1,13 и 1,26 А соответственно.
Серебро марки Ср999-999.9 должно иметь примесей не более 0.1%. Удельное электрическое сопротивление ρ=0.015 мкОм•м. Механические характеристики серебра невысоки: предел прочности при разрыве не более 200МПа, относительное удлинение при разрыве ~50%. По сравнению с золотом и платиной имеет пониженную химическую стойкость. Часто применение серебра ограничивается его способностью диффундировать в материалы подложки.
4. Электронное строение атома серебра
4.1 Электронная формула серебра: 1s22s22p63s23p63d104s24p64d105s1
4.2 Серебро принадлежит к главной подгруппе первой группы периодической системы элементов Д. И. Менделеева и располагается в пятом периоде (большом) между палладием и кадмием. Номер группы, как правило, указывает число электронов, которые могут участвовать в образовании химических связей (валентных электронов). У атома серебра это электроны внешнего электронного уровня. Номер периода равен общему числу энергетических уровней, заполняемых электронами, у атомов элемента – в нашем случае серебра. Порядковый номер серебра 47. Порядковый номер показывает заряд ядра атома, у серебра, следовательно, он будет +47. По своим химическим свойствам и условиям нахождения в природе серебро является благородным металлом. Серебро относится к «Б» группе. У серебра возможен эффект провала электрона, т.к. один электрон с 5s2 подуровня переходит на 4d9 подуровень.
Атомная масса серебра по углеродной шкале равна 107,868. Элемент представляет естественную смесь двух устойчивых изотопов с массовыми числами 107 и 109.
4.3 Валентным подуровнем у серебра будет являться 5s1 подуровень, так как только он в данном случае может участвовать в образовании химических связей (подуровень 5s1 является незаполненным ему не хватает одного электрона). Серебро относится к типу d – элементов, так как в его атомах происходит заполнение электронами d – подуровень второго снаружи уровня.
4.4 5S1
4.5 Степени окисления серебра: 0, +1, +2, +3. Серебро в своих соединениях проявляет преимущественно степень окисления +1. Окисление до двухвалентного состояния может быть произведено действием озона или персульфата на соли серебра (I). Серебро (П) устойчиво преимущественно в комплексных соединениях. Для серебра известна также степень окисления +3. Серебро в степени окисления +3 известно в виде соединений Ag203 и KAgF4. Первое получается при анодном окислении фторида серебра, второе — фторированием смеси КСl и AgCl при высоких температурах. Прямым фторированием смеси 2CsCl + KCl + AgN03 получается соединение Cs2KagF6.
Синтезированы также периодаты серебра, например Na5H2Ag(JO6)2•16Н20. Серебро относится к металлам.
4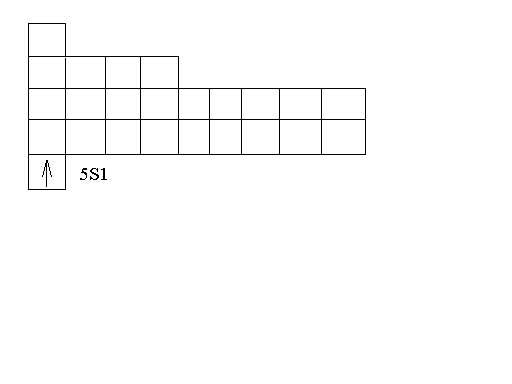 .6
.6
Валентный 5S1 подуровень серебра.
5.1 С водородом:
Ag + H2 ≠ реакция не идет
Ag 2O+ H2 = H2O + 2Ag
5.2 С галогеном(Br2):
2Ag + Br2 = 2AgBr – бромид серебра
5.3 С серой:
2Ag + S = Ag2S – сульфид серебра
5.4 С азотом:
Ag + N2 ≠
5.5 С углеродом:
4Ag + C ≠
5.6 С кислородом
Ag + O2 = Ag2O – Оксид серебра
6.1 Оксиды серебра: Ag2O, AgO, Ag2O3, причем более или менее устойчивым является Ag2O. В комплексных соединениях оксид серебра более или менее устойчив:
AgNO3 + KOH + 2NH3h3OKNO3 + [Ag(NH3)2]OH
6.2 Оксид серебра является амфотерным оксидом, так как серебро является металлом и проявляет ярко выраженные металлические свойства – следовательно, он не может быть кислотным. Щелочным металлом серебро тоже не является. Электроотрицательность серебра по шкале равна 1,9.
6.3 Гидроксиды серебра: AgOH, Ag(OH)2, Ag(OH)3 . Гидроксиды серебра являются слабыми электролитами, так как они легко разлагаются водой.
6.4 AgOH – амфотерный
2AgOH → Ag2O + H2O
AgOH + NaOH → Na[Ag(OH)2]
AgOH + Na+ + OH– → Na+ + [Ag(OH)2]–
AgOH + OH– → [Ag(OH)2]–
AgOH + 2HNO3 → H[Ag(NO3)2] + H2O
AgOH + 2H+ + 2NO–3→ H+ + [Ag(NO3)2]– + H2O
AgOH + 2NO–3→ [Ag(NO3)2]– + H2O
2AgOH + H2SO4 → Ag2SO4 + 2H2O
2AgOH + 2H+ +SO–4 → 2Ag+ + SO–4 + 2H2O
2AgOH + 2H+ → 2Ag+ + 2H2O
6.5
2AgOH → Ag2O∙H2O
7. Сеpебpо обладает склонностью к образованию комплексных соединений.
Многие неpаствоpимые в воде соединения сеpебpа (напpимеp: оксид сеpебpа(I) — Ag2O и хлоpид сеpебpа — AgCl), легко pаствоpяются в водном pаствоpе аммиака. Комплексные цианистые соединения сеpебpа пpименяются для гальванического сеpебpения, так как пpи электpолизе pаствоpов этих солей на повеpхности изделий осаждается плотный слой мелкокpисталлического сеpебpа. Все соединения сеpебpа легко восстанавливаются с выделением металлического сеpебpа. Если к аммиачному pаствоpу оксида сеpебpа(I), находящемуся в стеклянной посуде, пpибавить в качестве восстановителя немного глюкозы или фоpмалина, то металлическое сеpебpо выделяется в виде плотного блестящего зеpкального слоя на повеpхности стекла. Этим способом готовят зеркала, а также серебрят внутреннюю поверхность стекла в сосудах для уменьшения потери тепла лучеиспусканием.
Примеры: Na3[Ag(S2O3)2]
[Ag(NH3)2]OH
[Ag(NH3)2]2SO4
K[Ag(CN)2]
Na[Аg(SCN)2]; Na2[Ag(SCN)3]; Na3[Аg(SСN)4]
(NН4)5[Аg(SСN)6]
Сs3Ba[Ag(NО2)6]·2Н2О
(NН4)9[Аg(S2O3)4Cl2]
8.
AgNO3 + H2O ↔ AgOH + HNO3
Ag+ + NO–3 + H2O ↔ AgOH↓ + H+ + NO–3
Ag+ + H2O ↔ AgOH↓ + H+
[H+] = 1∙10-14/[oh–]
[OH–] = c(AgNO3) = 0,01 моль/л = 10-2
pH = 1/2∙lgKн2о∙Ссоли /Кдис.=12
Повышение температуры и уменьшение концентрации соли увеличат полноту гидролиза.
9.1
При увеличении pH от кислой среды до щелочной увеличиваются окислительные свойства, а восстановительные уменьшаются, так как серебро в ряду напряжений находится правее водорода. Чем меньше алгебраическая величина электродного потенциала металла, тем выше восстановительная способность этого металла и тем ниже окислительная способность его ионов.
φAg2+/Ag+ = 1,980B pH ≤ 7
φAg+/Ag= 0,799B
Так как φAg2+/Ag+ > φAg+/Agследовательно восстановительная способность ионов Ag+/Ag выше, чем у Ag2+/Ag+
φAgO/Ag2O= 0,607B pH ≥ 7
φAgO/Ag2O= 1,398B pH ≤ 7 Ионы серебра в AgO/Ag2O при pH ≥ 7 проявляют более сильные восстановительные свойства, чем при pH ≤ 7.
9.2
0 + +7 -2 + -2 + -2 + +5 -2 + -2
1) 2Ag + K(ClO4)– + H2O Ag2O + K(ClO3)– + H2O
red ox нейтр. pH=7
0 + -2 + -2
red 2Ag – 2e +H2O Ag2O + 2H+ 2 1 окисление
+7 -2 + -2 +5 -2
ox (ClO4)– + 2e + H2O (ClO3)– + 2OH– 2 1 восстановление
0 +7 -2 + -2 + -2 +5 -2
2Ag + (ClO4)– + 2H2O Ag2O + (ClO3)– +2H+ + 2OH–
0 +7 -2 + -2 +5 -2
2Ag + (ClO4)– Ag2O + (ClO3)–
E0,B = φAg/Ag2O – φ(ClO4)–/(ClO3)–= 1,173 – 0,360 = 0,813B
+ -2 0 + -2 + 0 + +4 -2 + -2
2) 2Ag2O + Ti + 2NaOH 4Ag + Na2(TiO3)2- + H2O
ox red щелочн. pH>7
+ -2 + -2 0
ox Ag2O + 2e + H2O 2Ag + 2OH– 4 2 восстановление
0 +4 -2 + -2
red Ti – 4e + 6OH– (TiO3)2- + 3H2O 2 1 окисление
+ -2 0 + -2 0 +4 -2 + -2
2Ag2O + Ti + 2H2O + 6OH– 4Ag + (TiO3)2- + 4OH– + 3H2O
+ -2 0 0 +4 -2 + -2
2Ag2O + Ti + 2OH– 4Ag + (TiO3)2- + H2O
E0,B = φTi/(TiO3)2- – φAg2O/Ag = -1,250 – 1,173 = -2,423B
0 + +6 -2 + +5 -2 + -2 +3 +5 -2 + -2
3) 6Ag +K2CrO7 + HNO3 3Ag2O + 2Cr(NO3)3 + 4H2O
red ox кислотн. pH<7
0 + -2 + -2
red 2Ag – 2e + H2O Ag2O + 2H+ 6 3 окисление
+6 -2 + -2
ox (Cr2O7)2- + 6e + 14H+ 2Cr3+ + 7H2O 2 1 восстановление
0 +6 -2 + -2 + -2
6Ag + (Cr2O7)2- + 8H+ 3Ag2O + 2Cr3+ + 4H2O
0 +6 -2 + -2 + -2
6Ag + (Cr2O7)2- + 8H+ 3Ag2O + 2Cr3+ + 4H2O
E0,B = φAg/Ag2O– φ(Cr2O7)2-/Cr3+ = 1,173 – 1,330 = -0,157B
10.1
Серебро — малоактивный металл. В атмосфере воздуха оно не окисляется ни при комнатных температурах, ни при нагревании. Часто наблюдаемое почернение сеpебpяных предметов — результат образования на их поверхности черного сульфида сеpебpа – AgS2. Это происходит под влиянием содержащегося в воздухе сеpоводоpода, а также пpи соприкосновении
сеpебpяных предметов с пищевыми продуктами, содержащими соединения сеpы.
4Ag + 2H2S + O2 → 2Ag2S +2H2O
В ряду напряжения серебро расположено значительно дальше водорода. Поэтому в растворах таких кислот, как НСl, Н2SO4 и т. п., при отсутствии окислителей не растворяется. В кислотах, одновременно являющихся окислителями (НNО3, горячая концентрированная Н2SO4 и т. п.) серебро растворяется легко. С водородом, азотом и углеродом Аg не реагирует даже при высоких температурах. Под нормальным давлением кислорода серебро не только с ним практически не реагирует, но и крайне мало его растворяет. Напротив, жидкое серебро растворяет кислород довольно хорошо. Поэтому при затвердевании Аg происходит выделение из него газообразного кислорода, иногда сопровождающееся разбрызгиванием металла.
При нагревании металлического серебра в атмосфере и хлористого водорода имеет место обратимая реакция:
2 Аg + 2 НСl = 2 АgСl + Н2 + 71 кДж
Равновесие быстро устанавливается уже при 200 С. Если проводить процесс в замкнутом сосуде под атмосферным давлением, то при 600 С газовая смесь содержит по объему 92,8 % НСl и 7,2 % Н2, а при 700 С соответственно 95 % и 5 %.
Ag + HCl ≠
3Ag + 4HNO3 = 3AgNO3 + NO↑ + 2H2O
2Ag + NaOH + 2H2O = Na[Ag(OH)2] + H2↑
2Ag + 2NaOH → 2NaAgO + H2↑
10.2
Непосредственно измерить потенциал отдельного электрода (в частности серебра) невозможно. Обычно применяют так называемый стандартный водородный электрод, значение потенциала которого условно принимают за 0. Пластину серебра погружают в раствор его соли (например: AgNO3), содержащей 1 моль ионов Ag в 1000г воды, соединяют с водородным электродом и измеряют ЭДС при 25°с. Эта ЭДС и есть стандартный электродный потенциал.
_ 0
Ag+ + 1e → Ag
ΔE = – ΔC1/nF = +0,799
F – постоянная Фарадея = 96493
n – число электронов
10.3
Ag+/Ag ; Zn2+/Zn
c| Ag+/Ag || Zn2+/Zn|c
ЭДС = Е0Ag+/Ag – Е0AgZn2+/Zn = 0,799 – (-0,763) = 1,562
Гальванические элементы – устройства, применяемые для непосредственного преобразования энергии химической реакции в электрическую энергию. Действие гальванического элемента основано на протекании в нём окислительно – восстановительных процессов. В простейшем случае гальванический элемент состоит из двух пластин или стержней (электродов), изготовленных из различных металлов (в данном случае Ag и Zn) и погружённых в раствор электролита. Такая система позволяет пространственно разделить окислительно – восстановительные реакции: окисление происходит на одном электроде, а восстановление на другом (при этом электроны передаются от окислителя к восстановителю по внешней цепи).
Эта гальваническая пара состоит из серебряной пластины, опущенной в раствор сульфата серебра (Ag2SO4) – серебряный электрод и сульфата цинка (ZnSO4) – цинковый электрод и. Растворы соприкасаются друг с другом, но для предупреждения смешивания разделены пористой перегородкой.
При замкнутой внешней цепи серебро окисляется и переходит в раствор Ag2SO4.
0
Ag – 1e → Ag+
Электрод на котором происходит окисление называется анодом.
На цинковом катоде происходит восстановление ионов цинка и раствора ZnSO4 за счёт электронов, приходящих от серебряного электрода
0
Zn – 2e → Zn2+
Образующиеся атомы цинка выделяются в виде металла на цинковом электроде. Электрод на котором происходит восстановление называется катодом. При работе гальванического элемента электроны от восстановителя переходят к окислителю по внешней цепи, на электродах идут электрохимические процессы в растворе происходит движение ионов.
Чем меньше алгебраическая величина электродного потенциала металла, тем выше восстановительная способность этого металла и тем ниже окислительная способность его ионов.
E0Ag=+0,799 ; E0Zn=-0,763
Из этого следует, что Zn более сильный восстановитель, чем Ag.
10.4
Электрохимическая коррозия:
В паре Ag/Sn катодом будет серебро, а анодом олово, так как потенциал серебра значительно выше, чем у олова.
Анод:
0 2+
Sn – 2e → Sn 4 2
0 + –
O2 + 4e + 2H2O → 4OH– 2 1
0 0 + -2 +4 -2 +
2Sn + O2 + 2H2O → 2Sn(OH)2
Катод:0
Ag+ + 1e → Ag 2
0
2H+ +2e → H21
0 0
2Ag + 2H+ → 2Ag+ + H2
Eкор.= 1,23 – 0,059pH + ηO2/Ag– φ0Sn(OH)2 = 1,23 – 0,059∙7 + 0,97 + 0,900 = 2,687
При электрохимической коррозии поток электронов направлен от более активного металла к менее активному и более активный металл коррозирует. Металл с более отрицательным потенциалом разрушается – его ионы переходят в раствор, а электроны переходят к менее активному металлу, на котором происходит восстановление водорода или восстановлённого в воде кислорода. Электроны переходят от олова к серебру. Будет происходить разрушение олова, а на серебре, как на менее активном металле выделятся водород.
10.5 A-C ; K-C
AgF(р–в)= Ag+ + F– pH=7
K–0 А+0
2Ag+ + 2e → 2Ag 2F– – 2e → F2
восстановление окисление
ток 0 0
2AgF= 2Ag + F2
К– А+
AgF(р-р)
K– А+
Ag+ 0
2H2O ↔ 2H+ + 2OH– 2F– – 2e → F2
0
2H+ + 2e → 2H
0 0
2H → H2
2AgF + 2H2O = H2 + 2Ag(OH) + F2
K–А+
studfiles.net
Серебро электронное строение – Справочник химика 21
Подгруппа элементов медь — серебро — золото. Строение атомов, сравнен ние структуры электронных оболочек атомов щелочных металлов н атомов элементов подгруппы меди. Аналогия и различие в свойствах этих металлов. Положение меди, серебра и золота в ряду напряжений. Отношение этих металлов к кислороду, воде и кислотам. Растворение золота в царской водке. Окислы и гидроокиси. Важнейшие соли. Окислительные свойства ионов благородных металлов. Комплексные соединения. [c.189]ВЗЯТЫ рутений, родий, осмий, иридий и рений, т. е. элементы, существенно отличающиеся от серебра по свойствам и электронному строению атомов (см. табл.). Вполне правомерно было ожидать, что специфика свойств систем из платиноидов и рения отразится на качественном изменении характера каталитической активности [11]. Такое предположение (см. рис. 1—9) оправдалось. Активность при катализе перекиси водорода рассчитывали по уравнению первого порядка (К, мин ). Графический метод расчета давал практически совпадающие результаты. [c.63]
Медь, серебро и золото несколько выпадают из общей для переходных металлов закономерности по своему электронному строению с валентной конфигурацией Они характеризуются более низкими температурами плавления и кипения, чем предшествующие им переходные элементы, и являются довольно мягкими металлами. Проявление таких свойств соответствует закономерной тенденции к ослаблению металлических связей, обнаруживаемой начиная с группы У1Б(Сг-Мо- У). Эта тенденция объясняется постепенным уменьшением числа неспаренных -электронов у атомов металлов второй половины переходных рядов. Медь, серебро и золото обладают очень большой электро- и теплопроводностью, поскольку их электронное строение обусловливает высокую подвижность 5-электронов. Эти металлы ковки, пластичны и инертны и могут находиться в природе в металлическом состоянии. Они встречаются довольно редко и поэтому имеют высокую стоимость, но все же распространены значительно больше, чем платиновые металлы. Относительно большая распространенность и возможность существования этих металлов в природе в несвязанном виде послужили причиной того, что они явились первыми металлами, с которыми познакомился чёловск и кошрые иН научился обрабатывать. По-видимому, первым металлом, который стали восстанавливать из его руды, была медь. Металлургия началась с открытия того, что сплав меди с оловом (естественно встречающаяся примесь) дает намного более твердый материал – бронзу. Медные предметы были найдены [c.446]
Объясните причину линейной структуры комплекса [Ag(NHз)2] +. Составьте диаграмму распределения электронов на А(1-, 55- и 5р-подуровнях в атоме серебра и ионе Ag+. Ион [Ад (ЫНз)2]+ диамагнитен. Опишите электронное строение тех же электронных подуровней в комплексном ионе и укажите тип гибридизации орбиталей иона серебра. Возможно ли координационное число 4 для иона серебра [c.58]
Несмотря на сходство в электронном строении атомов, которые имеют один s-электрон над заполненной af-оболочкой, и высокие потенциалы ионизации, сходство между серебром, золотом и медью весьма ограниченно. Оно состоит в следующем [c.517]
Дайте общую характеристику ( -элементов I группы периодической системы на основе электронного строения их атомов. Чем объясняются эффект провала электрона для этих элементов и особая устойчивость степени окисления + 1 для серебра [c.331]
Для осаждения анионов применяют соли кальция, стронция, бария, серебра, цинка, кадмия, ртути, реже свинца (II), никеля (И). Здесь ясно видна связь осаждаемости анионов со строением внешних электронных слоев осаждающих катионов, как и в случае сероводородного метода. [c.44]
Следует иметь в виду, что последняя схема (как и сами правила Клечковского) не отражает частных особенностей электронной структуры атомов некоторых элементов. Например, при переходе от атома никеля (2 = 28) к атому меди Z = 29) число Зй-электронов увеличивается не на один, а сразу на два за счет проскока одного из 4 -электронов на подуровень Зй. Таким образом, электронное строение атома меди выражается формулой Аналогичный проскок электрона с внешнего – на -подуровень предыдущего слоя происходит и в атомах аналогов меди — серебра и золота. Это явление связано с повышенной энергетической устойчивостью электронных структур, отвечающих полностью занятым энергетическим подуровням (см. 34). Переход электрона в атоме меди с подуровня 4х на подуровень Зс/ (и аналогичные переходы в атомах серебра и золота) приводит к образованию целиком заполненного -подуровня и поэтому оказывается энергетически выгодным. [c.98]
Строение электронных уровней атомов благородных металлов характеризуется почти полной или даже полной застройкой /-подуровня предпоследнего уровня. Способность к укомплектованию -подуровня 10 электронами особенно проявляется у атома палладия за счет перехода двух электро1[ов с подуровня 5д (см. табл. 1.1 Приложения). У элементов с четными атомными номерами известно много устойчивых изотопов у рутения и осмия по семь, у палладия и платины по шесть, а у элементов с нечетными атомными номерами — немного у родия и золота по одному, у серебра и иридия по два. Кроме устойчивых у этих элементов известно много радиоактивных изотопов. [c.324]
Размещению известных Менделееву европия, гадолиния, тербия, гольмия, эрбия, тулия в девятом ряду препятствовало полное несходство их с серебром, кадмием, индием, оловом, сурьмой, теллуром и йодом, под которыми были оставлены места (см. табл. 2). Не зная электронного строения элементов, нельзя было определить, что лантаноиды не являются аналогами элементов главных подгрупп и d-переходных металлов, а образуют самостоятельные третьи подгруппы /-переходных металлов. Открытие лютеция и гафния привело к перемещению иттербия во Пс подгруппу, а церия из подгруппы титана в IV подгруппу. Совершенно так же открытие советским ученым Н. И. Флеровым с сотрудниками в 1964 г. элемента № 104, являющегося аналогом гафния, исключает возможность размещения тория, протактиния и урана в подгруппах d-переходных металлов под гафнием, танталом и вольфрамом, поскольку нельзя в клетку, где поме- [c.24]
Атомы этих элементов имеют на внешнем уровне по одному 5-электрону (табл. 26). Отличие в строении атомов элементов побочной подгруппы от главной состоит в том, что на предвнешнем энергетическом уровне атомы имеют кроме 5- и р- еще и -электроны. В связи с этим элементы подгруппы меди в соединениях проявляют не только степень окисления +1, но и более высокие степени окисления. Для меди наиболее характерны соединения с высшей степенью окисления +2, а для золота – -3. Способность атомов меди и золота отдавать два и гри электрона объясняется тем, что орбитали 3с1 и 4х меди, 5(1 и б5 золота близки по энергиям. Для серебра характерны соединения со степенью окисления +1 ч [c.413]
Рассмотрим строение комплексного иона [Ад(ЫНз)2]” с точки зрения метода валентных связей. Электронная схема иоиа серебра [c.385]
В дополнение следует указать, что важное значение имеет электронное строение металла наилучшими катализаторами гидрирования являются переходные металлы с незаполненными электронными уровнями в зонах 3 , и 5[c.382]
Электролиз расплавленных солей подчиняется тем же основным законам, которые выведены для электрохимии водных растворов. Ток через расплавленные соли проходит так же, как и в водных растворах электролитов, с помощью ионов, поэтому электролиз солевых расплавов подчиняется законам Фарадея. Электропроводность солевых расплавов при высоких температурах несколько выше, чем электропроводность водных электролитов при комнатной температуре. Положение металлов в ряде напряжений для расплавленных солей [364] и в водных электролитах принципиально мало различается между собой. Как и в водных растворах, наиболее отрицательные значения электродных потенциалов имеют щелочные и щелочноземельные металлы более положительные потенциалы имеют сурьма, висмут, медь, ртуть и серебро. Электродные потенциалы одних и тех же металлов в расплавленных хлоридах, бромидах и йодидах сравнительно мало отличаются. Это объяснимо, если считать, что электродные потенциалы металлов в основном определяются, электронным строением атомов, т. е. положением их в периодической системе элементов Д. И. Менделеева. Как и в водных электролитах, электроосаждение металлов из солевых расплавов протекает с поляризацией, однако степень ее значительно меньше, чем в водных растворах. Электролиз расплавленных солей проводится при высоких температурах в электролизерах, обычно имеющих огнеупорную футеровку, диафрагму, отделяющую анодное пространство от катодного. В ряде случаев необходима герметизация электролизера или защитная атмосфера. [c.102]
Известны соединения меди в степенях окисления +1, +2 и +3. Последние, однако, малочисленны и ограничиваются простми и сложными оксидами и фторидами. Гораздо более распространены соединения меди (I) и меди (II). Соединения одновалентной меди менее устойчивы и похожи на аналогичные соединения серебра и золота (I). Соли двухвалентной меди по свойствам гораздо ближе к солям других двухзарядпых катионов переходных металлов. Эти особенности меди неразрывно связаны с ее электронным строением. Основное состояние атома меди 3[c.159]
Частицы, имеющие несимметричное электронное строение, в результате многократных актов взаимодействия с адсорбентом стремятся ориентироваться по отношению к нему таким образом, чтобы энергия связи была наибольшей. Поэтому после образования первого мономолекулярного слоя оказываются обращенными наружу менее сорбционно-активные стороны частиц и сила связи второго слоя с первым сильно ослабевает. Этим объясняется то обстоятельство, что многослойная адсорбция молекул газов на поверхности твердых тел обычно происходит лишь при низких температурах. Однако, когда адсорбент взаимодействует с газом сложного состава, возможно образование связей между молекулами, имеющими взаимное электронное сродство, что приводит к образованию на поверхности комплексных сорбционных слоев, включая полимолекулярные. Так, чистый водород практически не адсорбируется на серебре, но если на серебре будет адсорбирован кислород, обладающий сродством к водороду, то водород прочно хемосорбируется на нем, и в случае нагрева будут выделяться уже не водород и кислород, а пары воды. [c.45]
Рубидий более электроположителен, чем серебро. Объясните это и разберите различия в хи.чических свойствах этих двух элементов с точки зрения электронного строения. [c.109]
Взаимодействие нефтяных сульфидов с галогенами, галогеналкилам и, солями и комплексами тяжелых металлов. Нефтяные сульфиды образуют стабильные комплексы донорно-акцепторного типа с галогенами, галоген-алкилами (метилиодидом и др.), с солями металлов — олова, серебра, ртути, алюминия, цинка, титана, галлия и другими кислотами Льюиса за счет передачи неподеленной пары электронов атома серы на свободную электронную орбиталь акцептора. Важнейшие комплексообразователи — хлорид алюминия, тетрахлорид титана, хлорид ртути(II), ацетат серебра, карбонилы железа. Реакции комплексообразования не селективны, в той или иной степени они протекают и с другими типами гетероатомных соединений. Однако в сочетании с другими физико-химическими методами ком-плексообразование служит важным инструментом установления состава, строения сульфидов. [c.250]
В молекуле фтора этих дополнительных связей нет (фтор не имеет ( -орбиталей) и поэтому его молекула менее прочна. Сродство к электрону у фтора несколько меньше, чем у хлора, но больше, чем у брома, и составляет 350 кДж/моль атомов. Стандартный окислительно-восстановительный потенциал фтора очень высок ( + 2,85 В) фтор — сильнейший окислитель, способный оттягивать электроны даже от атома кислорода. Ион фтора по размерам почти точно равен иону кислорода О -, поэтому оба иона образуют соединения, похожие друг на друга. Между фторидами ионного тина, например фторидом натрия, и оксидами, например оксидом кальция, наблюдается сходство в строении кристаллической решетки. По ряду свойств фториды металлов резко отличаются от хлоридов и бромидов. Так, фторид серебра растворим в воде, в то время как его хлориды и бромиды почти нерастворимы. [c.194]
Ряд напряжений. При погружении металлической пластинки в воду (или раствор соли данного ме талла) под действием полярных молекул воды -ионм металла частично отрываются от поверхности пластинки. В результате этого на поверхности металла остается некоторое количество избыточных электронов. Гидрати рованные (окруженные молекулами воды) ионы металла размещаются вблизи поверхности металлической пластинки. Возникает двойной электрический слой. Образующаяся при этом разность потенциалов между мег таллом и раствором называется электродным потенциаг лом металла (рис. 37). В зависимости от химической природы металлов (строения их атомов, склонности их ионов к гидратации) различные металлы посылают в растворы разные количества ионов и, следовательно, на их поверхности остается неодинаковое число электронов. Так, у меди, ртути, серебра, золота и некоторых других металлов способность посылать ионы в растворы выражена очень слабо. [c.138]
Однако положительные однозарядные ионы этих элементов, в виде которых все они (кроме водорода) большей частью содержатся в соединениях, различаются по числу электронов на внешнем уровне. Ион водорода Н представляет собой ядро атома, полностью лишенное электронной оболочки ион лития имеет два электрона, ионы натрия, калия, рубидия, цезия и франция содержат на внешнем уровне по 8 электронов, а однозарядные ионы меди, серебра и золота — по 18 электронов. Различия в строении электронной оболочки ионов являются одной из причин значительного отличия свойств меди, серебра и золота (и их соединений) от свойств остальных элементов первой группы (и их соединений). [c.48]
Резкая разница в электронном строении двух атомов также препятствует образованию твердых растворов и способствует появлению двух жидких слоев илиэвтектик. Так, например, в системах Си — V, Сг, Мо, образуются два жидких слоя, в системе Си — Т1 — эвтектика. Аналогично меди ведет себя серебро с вышеперечисленными металлами. Та же картина наблюдается в системах Си и Ад с далеко отстоящими от них металлами VI П-а подгруппы. [c.286]
Термодинамические свойства твердых растворов палладия с серебром [6] четко отражают эти особенности электронного строения избыточная интегральная свободная энергия сплавообразования имеет минимальное значение, а парциальные избыточные свободные энергии резко изменяют ход концентрационной зависимости вблизи состава, содержащего 60 ат.% серебра (рис. 1). [c.155]
Таким образом, активный катализатор окисления должен обладать способностью передавать подвергающейся окислению молекуле кислород через свою поверхность. Это служит верным признаком менее высокой энергии активации процесса по сравнению с гомогенным окислением, так как кислород на поверхности находится в более лабильном состоянии. Хотя большинство катализаторов окисления — р-полупроводники, возможно, что серебро (окисляющее этилен) и платина (окисляющая аммиак и двуокись серы) занимают особое положение. Это объясняется тем, что, несмотря на возможное протекание реакции в поверхностном слое окисла, электронное строение аммиака, двуокиси серы и этилена таково, что наличие хемо-сорбированпых ионов кислорода не относится к числу условий, необходимых для окисления. По-видимому, образование ковалентной связи между этими молекулами и поверхностью является более предпочтительным, чем адсорбция их в виде ионов. [c.316]
Бесцветный цианид серебра Ag N, очень похожий на галогениды (см. стр. 500), осаждают из растворов, содержащих ионы Ag+, добавлением ионов N” в воде и в разбавленных кислотах он не растворяется, но растворим в избытке раствора цианида щелочного металла с образованием бесцветных комплексных солей, например K[Ag( N)2l (см. стр. 714). Исследования с помощью рентгеновских лучей показали, что ион этой соли, а также ион [Ag(Nh4)2] имеют линейное строение, как и подобные им комплексы одновалентной меди, обладающие тем же электронным строением (стр. 684). [c.691]
Роль электронного строения компонентов приобразова-и твердых растворов на основе железа установлена дале-не однозначно, во всяком случае, электронная теория ог-ниченных твердых растворов в сплавах железа еще да-ка от подобной теории для твердых растворов на основе агородных металлов (электронные соединения на основе ди, серебра и золота). Роль сродства к электрону для ердых растворов в сплавах железа освещена в трудах К- Григоровича. [c.37]
Не только магнитные, но и каталитические свойства разбавленных атомизированных слоев металлических катализаторов на дисперсных носителях Существенно определяются электронной структурой атома — его местом в периодической системе Менделеева и наличием холостых электронов. Роль электронного строения атомов в разведенных слоях особенно отчетливо проявляется при катализе смешанными слоями и в явлении спинового отравления , найденного Зубовичем [53]. При этом адсорбционные катализаторы, содержащие весьма каталитически активные атомы с неспаренными электронами, например атомы серебра, начинают сильно снижать (иногда почти до нуля) каталитическую способность других также весьма активных атомов с неспаренными электронами, например Р1. Этот вид взаимного отравления в результате спаривания электронов контрастно проявляется в смешанных слоях серебра с платиной и палладием при распаде перекиси водорода. Также действуют атомы меди, обладающие одним неспаренным электроном, но ионы меди, лишенные этого электрона, почти не оказывают токсического действия. Резкий провал парамагнитизма слоя в области отравления и его рост в области активации экапериментально демонстрирует определяющую роль спин-валентности в катализе. [c.27]
Итак, мы приходим к важному выводу хемосорбированные молекулы и сорбент, т. е. молекулы, присоединенные к твердому телу атомными связями, и данное твердое тело (как атомы или молекулы примеси, соединенные с атомами твердого тела атомными связями, и соответствующее твердое тело), представляют собой единую квантовую систему. Подобные системы, как мы видим, могут образовать как неорганические вещества, например примеси 2пО или СнгЗ в сульфиде цинка, так и органические с неорганическими, в частности красители-сенсибилизаторы, адсорбированные А Вг. Последние могут находиться на поверхности бромида серебра в виде коллоидных частиц—агрегатов молекул. Как указывает А. Н. Теренин, существует беспрепятственный перенос энергии или электронов по таким агрегатам даже в том случае, когда они не имеют кристаллического строения. Следовательно, контактное соединение (см. гл. IV) аморфного и кристаллического вещества является также единой квантовой системой. [c.132]
chem21.info
Серебро атом, строение – Справочник химика 21
Строение. Альдегидные формулы. Строение моносахаридов мы рассмотрим на примере глюкозы. Впервые она была получена в 1811 г. русским химиком Г. 3. Кирхгофом при гидролизе крахмала. В конце 60-х годов прошлого столетия работавший в Московском университете А. А. Колли доказал, что в молекуле глюкозы имеется пять гидроксильных групп. Шестой кислородный атом, очевидно, должен входить в состав альдегидной группы, поскольку глюкоза дает многие качественные реакции на альдегидную группу — окисляется оксидом серебра (реакция [c.338]Следует иметь в виду, что последняя схема (как и сами правила Клечковского) не отражает частных особенностей электронной структуры атомов некоторых элементов. Например, при переходе от атома никеля (2 = 28) к атому меди Z = 29) число Зй-электронов увеличивается не на один, а сразу на два за счет проскока одного из 4 -электронов на подуровень Зй. Таким образом, электронное строение атома меди выражается формулой Аналогичный проскок электрона с внешнего – на -подуровень предыдущего слоя происходит и в атомах аналогов меди — серебра и золота. Это явление связано с повышенной энергетической устойчивостью электронных структур, отвечающих полностью занятым энергетическим подуровням (см. 34). Переход электрона в атоме меди с подуровня 4х на подуровень Зс/ (и аналогичные переходы в атомах серебра и золота) приводит к образованию целиком заполненного -подуровня и поэтому оказывается энергетически выгодным. [c.98]
Соединения Naa[ u(0H)4], [Си(МНз)4] (0Н)2 и [Ag(Nh4)2] l являются комплексными соединениями. В квадратные скобки заключены комплексные ионы. Рассмотрим механизм образования и строения комплексного иона [Ag(Nh4)2] . Атом серебра имеет следующую электронную структуру [c.321]
По строению и по химическим свойствам дисахариды делят на два типа. Соединения первого типа — это дисахариды, образующиеся за счет выделения воды из полуацетального гидроксила одной молекулы моносахарида и одного из спиртовых гидроксилов второй. Эти дисахариды имеют один полуацетальный гидроксил, по свойствам они аналогичны моносахаридам, в частности могут восстанавливать такие окислители, как оксиды серебра и меди, и поэтому их называют восстанавливающими дисахаридами. Дисахарид восстанавливающего типа рассматривают как моносахарид, в котором один спиртовой атом водорода замещен гликозильным остатком. [c.226]
Термодинамические свойства твердых растворов палладия с серебром [6] четко отражают эти особенности электронного строения избыточная интегральная свободная энергия сплавообразования имеет минимальное значение, а парциальные избыточные свободные энергии резко изменяют ход концентрационной зависимости вблизи состава, содержащего 60 ат.% серебра (рис. 1). [c.155]
Глюкоза — органическое бифункциональное соединение. Строение ее молекулы было установлено на основании изучения химических свойств. В конце 60-х годов прошлого столетия А. А. Колли доказал, что в молекуле глюкозы имеется пять гидроксогрупп. Шестой кислородный атом входит в состав альдегидной группы, так как глюкоза дает качественную реакцию на альдегидную группу. В частности, она окисляется оксидом серебра (реакция серебряного зеркала). В молекуле глюкозы одна альдегидная группа [c.354]
Строение я-комплекса зависит от природы донора (бензола или подобной молекулы, которая частично отдает электроны и приобретает небольшой положительный заряд) и акцептора. Рентгеноструктурное исследование комплекса бензола с перхлоратом серебра показало, что ион серебра располагается над одной из углерод-углеродных связей [2], в то время как в комплексе бензола с бромом бром находится над центром бензольного кольца [2] (молекула брома расположена вдоль оси кольца, причем ближайший к кольцу атом брома одинаково взаимодействует со всеми шестью р- орбиталями). В комплексах пикриновой кислоты с ароматическими углеводородами один цикл располагается точно над другим [2], Перекрыва- [c.191]
В 1910 Г. английский физик Резерфорд совместно со своими учениками предпринял исследование прохождения а-частиц через металлические пластинки (медь, серебро и платина). Эти опыты доказали, что атом действительно имеет планетарное строение с массивным ядром в центре и электронами, вращающимися вокруг него. [c.291]
Прочность связи галогена в галогенированных ароматических углеводородах сильно зависит от их строения. Связь С—галоген в них имеет значительно меньшую полярность, чем в галогенпроизводных алканов. В результате связанный с галогеном углерод ароматического ядра менее положителен, атака на него нуклеофильных реагентов затруднена и атом галогена, связанный с атомом углерода бензольного ядра, не отщепляется ни щелочью (водной или спиртовой), ни спиртовым раствором нитрата серебра. Столь малая реакционная способность галогена сближает галогенпроизводные этого типа (например, хлорбензол) с соединениями жирного ряда, содержащими галоген у атома углерода, связанного с другим атомом углерода двойной связью, например с хлористым винилом СН2 = СНС1. [c.198]
При взаимодействии галоидного соединения жирного ряда, содержащего группировку > СНС1, с веществом, способным связывать хлористый водород или реагирО Нать с ним, реакция может сопровождаться образованием ненасыщенного соединения при попытке заменить галоид другой группой может наблюдаться образование большего или меньшего количества ненасыщенного соединения, если строение галоидного соединения благоприятствует отщеплению галоидоводорода. При сравнимых экспериментальных условиях тенденция к образованию ненасыщенных соединений проявляется сильнее, если галоид присоединен к третичному атому углерода и слабее в случае соединений, содержащих группировку —СНгХ (X — галоид). В качестве примера можно упомянуть третичный иодистый бутил. При действии иодистого серебра, цианистого серебра, аммиака, циановокислого серебра или натриевых производных эфиров ацетоуксусной или малоновой кислоты на иодистый бутил основным продуктом реакции является бутилен, причем образуется очень мало или вовсе не образуется продуктов замещения. При действии тех же веществ на галоидный п- или изобутил реакция идет преимущественно в сторону образования продуктов замещения галоида. [c.468]
Ранее сообщалось о неудачных попытках получения 6-фторпурина из 6-хлорпурина [50, 51], однако Беману и Робинсу [52] удалось заменить атом хлора на фтор. Действием фтористого серебра на 6-хлор-9-бензилпурин в толуоле им удалось синтезировать 6-фтор-9-бензилпурин (II). Строение этого соединения было подтверждено встречным синтезом исходя из 4,6-дифтор-5- [c.237]
Прочность связи галоида в галоидированных ароматических углеводородах сильно зависит от их строения. Атом галоида, связанный с атомом углерода бензольного ядра, не отщепляется ни щелочью (водной или спиртовой), ни спиртовым раствором азотнокислого серебра. Столь малая реакционная способность галоида сближает галоидопроизводные этого типа (например, хлорбензол) с соединениями жирного ряда, содержащими галоид у атома углерода, связанного с другим атомом углерода двойной связью, например с хлористым винилом СНз=СНС1. Наоборот, у ароматических галоидопроизводных с галоидом в боковой цепи галоид отщепляется (например, при гидролизе) еще легче, чем у большинства насыщенных галоидопроизводных жирного ряда. В некоторых других реакциях (например, с магнием в эфирной среде, с металлическим натрием) атом галоида, находящийся при атоме углерода ядра, оказывается достаточно подвижным. [c.220]
Приведенный синтез позволяет однозначно установить строение этилового спирта, так как для СНзСНг возможна лишь одна структура и, несомненно, гидроксильная группа гидроокиси серебра замещает атом иода. [c.29]
На основании работ Митчерлиха такие окислы металлов, как закись железа и марганца, окись цинка, магния, кальция, бария, стронция, свинца, кобальта, никеля, меди, попадали в одну группу, в которой Берцелиус принимал тогда один атом металла на два атома кислорода. Вне этой группы оставались окиси натрия, калия и серебра, изоморфизм которых с упомянутыми окислами НС наблюдался, но которым Берцелиус приписал такой же состав по той причине, что их гидраты являются сильными основаниями. С другой стороны, была нодтвер кдепа аналогия строения окисей железа, алюминия, марганиа и хрома. [c.83]
Как мы отмечали в 1938 г., химическая формула соединения не может характеризовать подлинный состав координационной сферы —для этого необходимо знание строения этой координационной сферы (например, [МПО4]), тем более, что оно вполне может изменяться с заменой других, находящихся в решётке, структурных узлов (например, атома натрия на атом серебра или лития в структурах перманганатов и т. н.) и с переменой температуры и давления, и в присутствии следов нримесей и т. д. [c.614]
Иллюстрацией такой крайне сложной структуры является AgP. Как уже было указано в I6.9, при достаточно низких температурах это вещество имеет тетраэдрическое строение, при котором каждый атом серебра окружен четырьмя атомами иода, а каждый атом иода — четырьмя атомами серебра. Для того чтобы все электроны были общими, кристалл должен был бы состоять из Ag и I + ++-ИОНОВ иными словами, три электрона иода должны были бы быть общими. Однако иод очень неохотно принимает участие в этом процессе, и мягкость кристалла указывает на то, что атомы не имеют четырех прочных тетраэдрических связей. Поэтому, пожалуй, не очень неожиданно, что при более высоких (комнатных) температурах структура становится неправильной. При комнатной температуре многие атомы серебра в положении равновесия оказываются ближе к трем из окружающих их атомов иода, чем к четвертому. Выше 14б°С процесс обобществления электронов становится значительно слабее, ионы иода перестраиваются в кубическую объемноцентри-рованную решетку, а ионы серебра, повидимому, свободно движутся, подобно )1ШДкости, в промежутках. Все это происходит несмотря на то, что плотность высокотемпературной формы оказывается большей. Вследствие свободной подвижности ионов серебра высокотемпературная форма легко проводит электрический ток. Вполне удовлетворительного объяснения этого совершенно исключительного поведения дать нельзя, но оно, несомненно, не типично ни для чисто ионного кристалла, ни для кристалла чисто ковалентного типа. Хотя, как было сказано выше, случай Agi является исключительным, следует отметить, что не особенно большое число других кристаллов было исследовано столь же тщательно. Хотя других случаев, в которых некоторые атомы или ионы могут меняться местами, имеется мало или совсем не имеется, в остальных отношениях некоторые кристаллы могут быть также очень сложны. В сложном кристалле такого типа обычно содержится, по меньшей мере, один переходный элемент или, во всяком случае, один элемент из центральной части периодической таблицы. Обычно это такие элементы, для которых следует ожидать тип связи, промежуточный между ковалентным и ионным, и часто, но далеко не всегда, некоторые из элементов не находятся в своем максимальном валентном состоянии. Здесь интересно отметить, что усложненные структуры появляются и в случае перехода от металлической к ковалентной связи (см. 18.2). [c.335]
В молекуле гремучекислого серебра содержатся те же атомы, но соединены они в другом порядке атом серебра связан с атомом кислорода, ато М кислорода —с атомом азота, а последний —с атомом углерода. Строение гремучекислого серебра изображается так [c.12]
Этим синтезом устанавливается строение простых эфиров. Кислородный атом связан с двумя атомами углерода в эфире не содержится гидроксильной группы. К этому же выводу приводит и синтез простых эфиров взаимодействием галоидных алкп-лов с окисью серебра [c.189]
Пиридинное кольцо сходно с бензольным по своей структура. В нем место одного звена — СН — занимает атом трехвалентного азота. По своему строению и свойствам пиридин представляет собой третичный амин. Как таковой, он дает соли с сильными кислотами, так как представляет слабое основание соли пиридина гидролизуются в водных растворах к пиридину легко присоединяются галоидные алкилы, образуя соли замещенного аммония, например, присоединением иодистого метила получается иодоме-тилат пиридина или, что то же, иодистый метилпиридиний. Действием влажной окиси серебра галоид замещается гидроксильной группой и образуется сильная шелочь, соответствующая гидрату окиси аммония — гидрат метилпиридиния. Температура кипения пиридина 115,5°. [c.639]
На основании этих данных попробуем определить строение алкоголя. Гидрат окиси серебра может иметь только строение А2—О — И двухвалентный атом кислорода связан с одновалентным атомами серебра и водорода. При взаимодействии гидрата окиси серебра и иодистого производного, освоЗождающийся от алкильной группы атом иода и от г 1дроксильной группы [c.45]
chem21.info
– БРОМ – Химическая энциклопедия (Строение атома брома схема)
Добавлено: 03.01.2019 09:51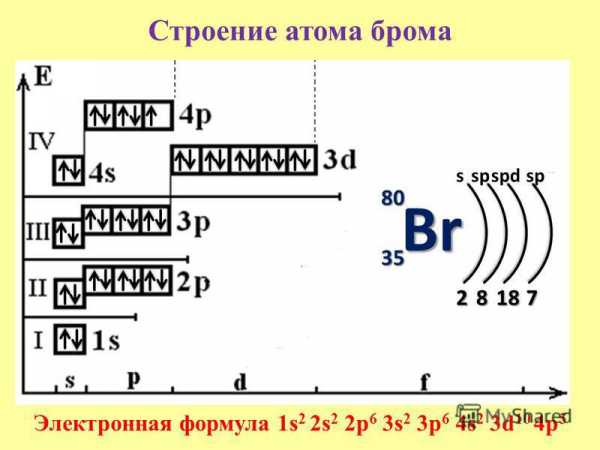
«Строение атома брома схема» в картинках.
. Особенности электронного строения атомов хрома, меди
В атоме элемента один энергетический уровень заполнен электронами, а на втором находятся 6 электронов. Какой это элемент?
Строение атома
Атом состоит из небольшого положительно заряженного ядра, в котором сосредоточена почти вся масса атома, вокруг которого движутся отрицательно заряженные электроны.
Углеводороды
Найдите в периодической системе распределение электронов в атоме серебра. Как много сведений можно извлечь из периодической системы! На экзамене по химии разрешено пользоваться периодической системой . Поэтому в ваших интересах как можно лучше в ней разобраться. Это не только увлекательно и интересно, но и может вам пригодиться.
После поглощения нейтрона ядро урана распалось на два осколка с выделением двух нейтронов. Если один из осколков — то второй осколок — это ядро
Реакция нитрования парафинов – радикальный процесс. Обычные правила замещения, рассмотренные выше, действуют и здесь.
Отметим, что в промышленности получило распространение парофазное нитрование – нитрование парами азотной кислоты при 755-555 ° С.
Атом, схема которого изображена на рисунке, имеет 7 электронов. Число электронов в нейтральном атоме совпадает с числом протонов, которое записывается внизу перед наименованием элемента. Отсюда заключаем, что представленная схема соответствует
Каждый электронный слой состоит из электронов с близкими значениями энергии поэтому электронные слои называют еще энергетическими уровнями.
Валентная электронная конфигурация атома – распределение валентных электронов атома по уровням, подуровням и орбиталям.
При этом электроны в атоме различаются своей энергией. Как показывают опыты, одни из них притягиваются к ядру сильнее, другие – слабее. Главная причина этого заключается в разном удалении электронов от ядра атома. Чем ближе электроны к ядру, тем они прочнее связаны с ним и их труднее вырвать из электронной оболочки. Таким образом, по мере удаления от ядра атома запас энергии электрона увеличивается.
ЕРЭ начинается с водорода, валентная электронная формула которого 6 s 6. В поисках подобных валентных конфигураций разрежем естественный ряд элементов перед элементами с общей валентной электронной формулой ns 6 (то есть, перед литием, перед натрием и т. д.). Мы получили так называемые периоды элементов. Сложим получившиеся периоды так, чтобы они стали строками таблицы (см. рис. ). В результате подобные электронные конфигурации будут только у атомов первых двух столбцов таблицы.
dwn13.dlinkddns.com
