Теории строение атома
С давних времен человека занимал вопрос: из чего состоят все тела? Есть ли что-то общее в строении воздуха и камня, воды и огня?
Еще древнегреческий философ Демокрит высказывал мысль о том, что должна существовать мельчайшая неделимая частичка вещества, которую он называл атомом. Атомы, по его мнению, были кирпичиками мироздания. И до начала ХIХ века больше об атоме ничего не было известно.
Первым попытался построить научную теорию атома английский химик Джон Дальтон. Он обнаружил, что все газы, так же, как твердые вещества и жидкости, состоят из невероятно крохотных частичек — атомов. Дальтон определил относительные атомные массы всех известных в то время химических элементов и обнаружил, что при любых химических реакциях атомы элементов не изменяются.
Основываясь на законах механики, физики разработали так называемую молекулярно-кинетическую теорию, с помощью которой им удалось описать строение твердых, жидких и газообразных тел. На основании этой теории удалось объяснить такие понятия, как температура тела и давление газа. Появилась надежда на то, что эта теория объяснит, как из атомов образуются молекулы, и даже позволит описать любое природное явление с помощью законов механики.
В 1911 году Эрнест Резерфорд провел серию опытов, надеясь с помощью уточнить строение атома.
Суть его опытов заключалась в следующем. На пути узкого пучка альфа-частиц, испускаемых радиоактивным веществом, помещала очень тонкая металлическая фольга из золота. Прошедшие сквозь фольгу альфа-частицы регистрировались с помощью люминесцентного экрана, расположенного вокруг мишени.
На деле все оказалось совсем не так. Большая часть альфа-части проходила сквозь металл, как будто на их пути ничего не было. было небольшое количество частиц, которые отклонялись на очень большие угль и даже отскакивали назад.
Эти наблюдения и расчеты привели Резерфорда к идее о планетарной модели атома. Согласно этой модели, атом по структуре аналогичен Солнечной системе. В его центре находится очень тяжелое положительно заряженное ядро, а вокруг него вращаются электроны, подобно тому,
Но на этом история создания атома не закончилась, дело в том, что планетарная модель атома имела существенный изъян. Согласно законам классической физики, вращаясь вокруг ядра, электрон должен был излучать электромагнитные волны, теряя при этом часть своей энергии. В результате электрон должен был упасть на ядро, что означало почти мгновенную «смерть атома.
Новую теорию атома создал Нильс Бор. Он предположил, что электроны могут двигаться только по определенным орбитам. В таком состоянии атом не излучает и не поглощает энергии. Когда электрон перемещается с одной орбиты на другую, расположенную ближе к ядру, атом излучает порцию энергии, названную квантом.
В 1922 году за работы по квантовой теории строения атома водорода и его излучения Бор получил Нобелевскую премию. Бору удалось объяснить не только спектр атома водорода. Он предугадал структуру заполнения электронных оболочек, что позволило глубже понять физическую природу периодичности химических свойств элементов, отраженную в таблице Менделеева.
bookbug.ru
Основные сведения по теории строения атома
В 1897 г. Дж. Томсон открыл электрон; в 1909 г. Р. Малликен определил его заряд, который равен 1,6·10-19 Кл. В 1910 г. Э. Резерфорд провел опыты по бомбардировке металлической фольги a-частицами, в результате опытов было установлено, что некоторые a-частицы рассеиваются фольгой. Отсюда Э. Резерфорд предложил ядерную планетарную модель атома, согласно которой атом состоит из положительно заряженного ядра, в котором сосредоточена основная часть массы атома, и электронов, вращающихся вокруг ядра по орбитам, подобно планетам солнечной системы. Однако
В 1913г. датский ученый Н. Бор, используя модель Резерфорда и теорию Планка, предложил модель строения атома водорода.
Основные положения своей теории Н. Бор сформулировал в виде постулатов (утверждений, принимаемых без доказательств):
I постулат.
Электрон в атоме находится на определенных стационарных орбитах и при этом не излучает и не поглощает энергии.
Каждая орбита имеет номер n (1, 2, 3, 4, …), который назвали главным квантовым числом. Бор вычислил радиусы орбит. Радиус первой орбиты (боровский радиус r0) был 5,29 ·10-13 м, радиус других орбит вычислялся по формуле:
rn =5,29·10-13 · n 2
Энергия электрона (эВ) зависела от значения главного квантового числа п:
Еп= — 13,6(1/n2)
Атом водорода обладает минимальной энергией, когда электрон находится на первой орбите (
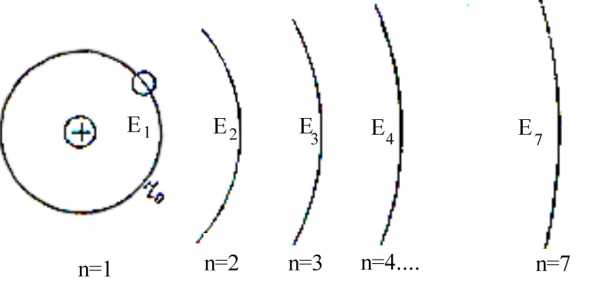
Рис.1 Схема энергетических состояний атома водорода
II постулат.
При переходе электрона с одного стационарного состояния (энергетического уровня) на другой происходит излучение или поглощение энергии в виде кванта, энергия которого равна разности энергий в конечном и начальном состояниях.
Ek— EH = hn ,
где h — постоянная Планка; h = 6,626 · 10
Экспериментально квантование энергии атомов обнаруживается в их спектрах поглощения и испускания. Атомные спектры имеют линейчатый характер (рис. 2) .
Рис. 2 Линии видимого спектра атомного водорода (серия Бальмера).
Возникновение линий в спектре обусловлено тем, что при возбуждении атомов (нагревании газа, электроразряде и пр.) электроны, принимая соответствующие порции энергии, переходят в состояние с более высокими энергетическими уровнями. В таком возбужденном состоянии атомы находятся лишь ничтожные доли секунды. Переход электронов в состояния с более низкими энергетическими уровнями сопровождается выделением кванта энергии. Это отвечает появлению в спектре отдельных линий, соответствующих излучению определенной частоты колебаний (длины волны). Поскольку газообразный атомный водород содержит множество атомов в разных степенях возбуждения, спектр состоит из большого числа линий.
Видимый спектр водорода (рис. 2) возникает при переходе возбужденных электронов в состояние с главным квантовым числом n=2 (серия Бальмера).
Теория Бора была усовершенствована его учеником А. Зоммерфельдом. Он предположил что электроны могут вращаться в атоме не только по круговым, но и по эллиптическим орбитам.
hron.com.ua
Строение атома
Первые указания о сложном строении атома были получены при изучении процессов прохождения электрического тока через жидкости и газы. Опыты выдающегося английского ученого М. Фарадея в 30-х гг. XIX в. навели на мысль о том, что электричество существует в виде отдельных единичных зарядов.
Величины этих единичных зарядов электричества были определены в более поздних экспериментах по пропусканию электрического тока через газы (опыты с так называемыми катодными лучами). Было установлено, что катодные лучи — это поток отрицательно заряженных частиц, которые получили название
Прямым доказательством сложности строения атома было открытие самопроизвольного распада атомов некоторых элементов, названное радиоактивностью. В 1896 г. французский физик А. Беккерель обнаружил, что материалы, содержащие уран, засвечивают в темноте фотопластинку, ионизируют газы, вызывают свечение флюоресцирующих веществ. В дальнейшем выяснилось, что этой способностью обладает не только уран. Титанические усилия, связанные с переработкой огромных масс урановой смоляной руды, позволили П. Кюри и М. Склодовской-Кюри открыть два новых радиоактивных элемента: полоний и радий. Последовавшее за этим установление природы , - и -лучей, образующихся при радиоактивном распаде (Э. Резерфорд, 1899—1903 гг.), открытие ядер атомов диаметром 10-6 нм, занимающих незначительную долю объема атома (Э. Резерфорд, 1909— 1911гг.), определение заряда электрона (Р. Милликен, 1909—1914 гг.) и доказательство дискретности его энергии в атоме (Дж. Франк, Г. Герц, 1912 г.), открытие того факта, что заряд ядра равен номеру элемента (Г. Мозли, 1913 г.), и, наконец, открытие протона (Э. Резерфорд, 1920 г.) и нейтрона (Дж. Чедвик, 1932 г.) позволили предложить следующую модель строения атома:
1. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома.
2. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре (масса электрона равна l/1823 а.е.м.).
3. Ядра атомов состоят из протонов и нейтронов (общее название — нуклоны). Число протонов в ядре равно порядковому номеру элемента, а сумма чисел протонов и нейтронов соответствует его массовому числу.
4. Вокруг ядра вращаются электроны. Их число равно положительному заряду ядра (см. табл.1).
Таблица 1. Свойства элементарных частиц, образующих атом
Частица | Заряд | Масса | ||
Кл | условн.ед. | г | а.е.м. | |
Электрон | -1,6 • 10-19 | -1 | 9,1 • 10-28 | 0.00055 |
Протон | 1,6 • 10-19 | +1 | 1,67 • 10-24 | 1,00728 |
Нейтрон | 0 | 0 | 1,67 • 10-24 | 1,00866 |
Различные виды атомов имеют общее название — нуклиды. Нуклиды достаточно характеризовать любыми двумя числами из трех фундаментальных параметров:
А — массовое число, Z — заряд ядра, равный числу протонов, и N — число нейтронов в ядре. Эти параметры связаны между собой соотношениями:
Z = A – N, N = A – Z, A = Z + N
Нуклиды с одинаковым Z, но различными А и N, называют изотопами.
Данная модель строения атома получила название планетарной модели Резерфорда. Она оказалась очень наглядной и полезной для объяснения многих экспериментальных данных. Но эта модель сразу же обнаружила и свои недостатки. В частности, электрон, двигаясь вокруг ядра с ускорением (на него действует центростремительная сила), должен был бы, согласно электромагнитной теории, непрерывно излучать энергию. Это привело бы к нарушению равновесия между электроном и ядром. Электрон, постепенно теряя свою энергию, должен был бы двигаться вокруг ядра по спирали и в конце концов неизбежно упасть на него. Никаких доказательств того, что атомы непрерывно исчезают, не было (все наблюдаемые явления говорят как раз об обратном), отсюда следовало, что модель Резерфорда в чем-то ошибочна.
Теория Бора. В 1913 г. датский физик Н. Бор предложил свою теорию строения атома. При этом Бор не отбрасывал полностью старые представления о строении атома:
как и Резерфорд, он считал, что электроны двигаются вокруг ядра подобно планетам, движущимся вокруг Солнца, однако в основу новой теории были положены два необычных предположения (постулата):
1. Электрон может вращаться вокруг ядра не по произвольным, а только по строго определенным (стационарным) круговым орбитам. Радиус орбиты г и скорость электрона u связаны квантовым соотношением Бора:
mur = n ħ,
где т — масса электрона, n — номер орбиты, ħ — постоянная Планка (h = 1,05 • 10-34 Дж • с).
2. При движении по этим орбитам электрон не излучает и не поглощает энергию.
Таким образом. Бор предположил, что электрон в атоме не подчиняется законам классической физики. Согласно Бору, излучение или поглощение энергии определяется переходом из одного состояния, например с энергией Е1. в другое — с энергией Е2, что соответствует переходу электрона с одной стационарной орбиты на другую. При таком переходе излучается или поглощается энергия Е, величина которой определяется соотношением
Е = Е1 – Е2 = hv
где v — частота излучения, h = 2 ħ = 6,62 • 10-34 Дж • с.
Бор, используя это уравнение, рассчитал частоты линий спектра атома водорода, которые очень хорошо согласовывались с экспериментальными значениями. Такое же согласие теории и эксперимента было получено и для многих других атомов элементов, но было обнаружено также и то, что для сложных атомов теория Бора не давала удовлетворительных результатов. После Бора многие ученые пытались усовершенствовать его теорию, но все усовершенствования предлагались исходя из тех же законов классической физики.
Квантовая теория строения атома. В последующие годы некоторые положения теории Бора были переосмыслены, видоизменены, дополнены. Наиболее существенным нововведением явилось понятие об электронном облаке, которое пришло на смену понятию об электроне только как частице. На смену теории Бора пришла квантовая теория строения атома, которая учитывает волновые свойства электрона.
В основе современной теории строения атома лежат следующие основные положения:
1. Электрон имеет двойственную (корпускулярно-волновую) природу. Он может вести себя и как частица, и как волна: подобно частице, электрон обладает определенной массой и зарядом; в то же время движущийся поток электронов проявляет волновые свойства, например характеризуется способностью к дифракции. Длина волны электрона и его скорость u связаны соотношением де Бройля:
= h / mu
где т — масса электрона.
2. Для электрона невозможно одновременно точно измерить координату и скорость. Чем точнее мы измеряем скорость, тем больше неопределенность в координате, и наоборот. Математическим выражением принципа неопределенности служит соотношение
х • т • u > ħ /2
где х — неопределенность положения координаты, u — погрешность измерения скорости.
3. Электрон в атоме не движется по определенным траекториям, а может находиться в любой части околоядерного пространства, однако вероятность его нахождения в разных частях этого пространства неодинакова. Пространство вокруг ядра, в котором вероятность нахождения электрона достаточно велика, называют орбиталъю.
Эти положения составляют суть новой теории, описывающей движение микрочастиц, — квантовой механики. Наибольший вклад в развитие этой теории внесли француз Л. де Бройль, немец В. Гейзенберг, австриец Э. Шре-дингер и англичанин П. Дирак.
Квантовая механика имеет очень сложный математический аппарат, поэтому сейчас нам важны лишь те следствия квантово-механической теории, которые помогут нам разобраться в вопросах строения атома и молекулы, валентности элементов и т. п. С этой точки зрения наиболее важным следствием из квантовой механики является то, что вся совокупность сложных движений электрона в атоме описывается пятью квантовыми числами: главным п, побочным l, магнитным mi, спиновым s и проекцией спина тs. Что же представляют собой квантовые числа?
Квантовые числа электронов. Главное квантовое число п определяет общую энергию электрона на данной орбитали. Оно может принимать любые целые значения, начиная с единицы (п = 1,2, 3,…). Под главным квантовым числом, равным , подразумевают, что электрону сообщена энергия, достаточная для его полного отделения от ядра (ионизация атома).
Кроме того, оказывается, что в пределах определенных уровней энергии электроны могут отличаться своими энергетическими подуровнями. Существование различий в энергетическом состоянии электронов, принадлежащих к различным подуровням данного энергетического уровня, отражается побочным (иногда его называют орбитальным) квантовым числом l. Это квантовое число может принимать целочисленные значения от 0 до n – 1 {l = 0, 1,…, п – 1). Обычно численные значения l принято обозначать следующими буквенными символами:
Значение l 0 1 2 3 4
Буквенное обозначение s p d f g
В этом случае говорят о s-, p-, d-, f-, g-состояниях электронов, или о s-, p-, d-, f-, g-орбиталях.
Орбиталь — совокупность положений электрона в атоме, т. е. область пространства, в которой наиболее вероятно нахождение электрона.
Побочное (орбитальное) квантовое число l характеризует различное энергетическое состояние электронов на данном уровне, определяет форму электронного облака, а также орбитальный момент p — момент импульса электрона при его вращении вокруг ядра (отсюда и второе название этого квантового числа — орбитальное)
Таким образом, электрон, обладая свойствами частицы и волны, с наибольшей вероятностью движется вокруг ядра, образуя электронное облако, форма которого в s-,p-,d-, f-, g- состояниях различна.
Рис.1. Форма электронного облака s-орбитали
Еще раз подчеркнем, что форма электронного облака зависит от значения побочного квантового числа l. Так, если l = 0 (s-орбиталь), то электронное облако имеет сферическую форму (шаровидную симметрию) и не обладает направленностью в пространстве (рис. 1).
При l = 1 (р-орбиталь) электронное облако имеет форму гантели, т. е. форму тела вращения, полученного из «восьмерки» (рис. 2). Формы электронных облаков d-, f-, g-электронов намного сложнее.
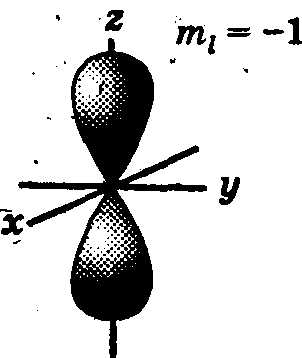


Рис. 2. Формы электронных облаков р-орбиталей
Движение электрического заряда (электрона) по замкнутой орбите вызывает появление магнитного поля. Состояние электрона, обусловленное орбитальным магнитным моментом электрона (в результате его движения по орбите), характеризуется третьим квантовым числом — магнитным тi. Это квантовое число характеризует ориентацию орбитали в пространстве, выражая проекцию орбитального момента импульса на направление магнитного поля.
Соответственно ориентации орбитали относительно направления вектора напряженности внешнего магнитного поля магнитное квантовое число тi может принимать значения любых целых чисел, как положительных, так и отрицательных, от -l до +l, включая 0, т. е. всего (2l + 1) значений. Например, при l = 0 тi, = 0; при l = 1 mi = -1, 0, +1; при l = 3, например, магнитное квантовое число может иметь семь (2l + 1= 7) значений: -3, -2, -1, 0,+1, +2, +3.
Таким образом, mi характеризует величину проекции вектора орбитального момента количества движения на выделенное направление. Например, р-орбиталь («гантель») в магнитном поле может ориентироваться в пространстве в трех различных положениях, так как в случае l = 1 магнитное квантовое число может иметь три значения: -1, 0, +1. Поэтому электронные облака вытянуты по координатным осям х. у я г, причем ось каждого из них перпендикулярна двум другим (рис. 2).
Для полного объяснения всех свойств атома в 1925 г. была выдвинута гипотеза о наличии у электрона так называемого спина (сначала в самом простом приближении — для наглядности — считалось, что это явление аналогично вращению Земли вокруг своей оси при движении ее по орбите вокруг Солнца). Спин — это чисто квантовое свойство электрона, не имеющее классических аналогов. Строго говоря, спин — это собственный момент импульса электрона, не связанный с движением в пространстве. Для всех электронов абсолютное значение спина всегда равно s = 1/2. Проекция спина на ось z (магнитное спиновое число ms,) может иметь лишь два значения: тs = + 1/2 или тs = – 1/2.
Поскольку спин электрона s является величиной постоянной, его обычно не включают в набор квантовых чисел, характеризующих движение электрода в атоме, и говорят о четырех квантовых числах.
studfiles.net
Теории строение атома
С давних времен человека занимал вопрос: из чего состоят все тела? Есть ли что-то общее в строении воздуха и камня, воды и огня?
Еще древнегреческий философ Демокрит высказывал мысль о том, что должна существовать мельчайшая неделимая частичка вещества, которую он называл атомом. Атомы, по его мнению, были кирпичиками мироздания. И до начала ХIХ века больше об атоме ничего не было известно.
Первым попытался построить научную теорию атома английский химик Джон Дальтон. Он обнаружил, что все газы, так же, как твердые вещества и жидкости, состоят из невероятно крохотных частичек — атомов. Дальтон определил относительные атомные массы всех известных в то время химических элементов и обнаружил, что при любых химических реакциях атомы элементов не изменяются.
Основываясь на законах механики, физики разработали так называемую молекулярно-кинетическую теорию, с помощью которой им удалось описать строение твердых, жидких и газообразных тел. На основании этой теории удалось объяснить такие понятия, как температура тела и давление газа. Появилась надежда на то, что эта теория объяснит, как из атомов образуются молекулы, и даже позволит описать любое природное явление с помощью законов механики.
И вдруг выяснилось, что атом вовсе не мельчайшая частичка вещества, он имеет достаточно сложную структуру. Этот переворот в науке совершил Джон Томсон. В 1897 году он исследовал катодные лучи и установил, что они представляют собой поток частиц, масса которых во много раз меньше массы атома. На основании своих опытов Томсон создал первую в мире модель атома. Он представилатом в виде сплошного шарик с равномерно распределённым по всему объему положительным зарядом. Внутри атома, по мнению ученого, как изюм в пудинг должны были находиться электроны. Такая модель атома была названа «пудинговой».
Электроны внутри этого «теста» могли колебаться, благодаря чему, по мнению Томсона, в окружающем эфире возникали световые волны. Эта модель атома хоть как-то объясняла происхождение света, валентность химических элементов, а главное – не противоречила механике Ньютона.
В 1911 году Эрнест Резерфорд провел серию опытов, надеясь с помощью уточнить строение атома.
Суть его опытов заключалась в следующем. На пути узкого пучка альфа-частиц, испускаемых радиоактивным веществом, помещала очень тонкая металлическая фольга из золота. Прошедшие сквозь фольгу альфа-частицы регистрировались с помощью люминесцентного экрана, расположенного вокруг мишени.
Если бы атомы золота были сплошными шариками, как предлагал Томсон, то следовало ожидать, что альфа-частицы будут растаскивать атомы золота или отскакивать от них, разлетаясь в разные стороны. В любом случае альфа-частицы должны были рассеиваться, есть вылетать из золотой фольги в различных направлениях.
На деле все оказалось совсем не так. Большая часть альфа-части проходила сквозь металл, как будто на их пути ничего не было. было небольшое количество частиц, которые отклонялись на очень большие угль и даже отскакивали назад.
Эти наблюдения и расчеты привели Резерфорда к идее о планетарной модели атома. Согласно этой модели, атом по структуре аналогичен Солнечной системе. В его центре находится очень тяжелое положительно заряженное ядро, а вокруг него вращаются электроны, подобно тому,
как движутся планеты вокруг Солнца. Причем ядро занимает ничтожно малую часть объема всего атома, примерно одну стотысячную его диаметра. Атом оказался пуст!
Но на этом история создания атома не закончилась, дело в том, что планетарная модель атома имела существенный изъян. Согласно законам классической физики, вращаясь вокруг ядра, электрон должен был излучать электромагнитные волны, теряя при этом часть своей энергии. В результате электрон должен был упасть на ядро, что означало почти мгновенную «смерть атома.
В действительности этого не происходит. Атом – очень устойчивая система.
Новую теорию атома создал Нильс Бор. Он предположил, что электроны могут двигаться только по определенным орбитам. В таком состоянии атом не излучает и не поглощает энергии. Когда электрон перемещается с одной орбиты на другую, расположенную ближе к ядру, атом излучает порцию энергии, названную квантом.
В 1922 году за работы по квантовой теории строения атома водорода и его излучения Бор получил Нобелевскую премию. Бору удалось объяснить не только спектр атома водорода. Он предугадал структуру заполнения электронных оболочек, что позволило глубже понять физическую природу периодичности химических свойств элементов, отраженную в таблице Менделеева.
Но, как известно, нет предела совершенству. И на смену теории Бора пришла современная квантовая теория атома, которая позволила объяснить строение не только атома водорода, но и атомов других химических элементов.
bookbug.ru
61. Теория строения атома по Бору.
В 1913 г. великий датский физик Нильс Бор применил принцип квантования при решении вопроса о строении атома и характеристике атомных спектров, устранив тем самым противоречия, которые возникали при планетарной модели атома Э. Резерфорда. Модель атома, предложенная Резерфордом в 1911 г., напоминала солнечную систему: в центре находится атомное ядро, а вокруг него но своим орбитам движутся электроны. Ядро имеет положительный заряд, а электроны — отрицательный. Вместо сил тяготения, действующего в Солнечной системе, в атоме действуют электрические силы. Электрический заряд ядра атома, численно равный порядковому номеру в периодической системе Менделеева, уравновешивается суммой зарядов электронов — атом электрически нейтрален.
Неразрешимое противоречие этой модели заключалось в том, что электроны, чтобы не потерять устойчивость, должны двигаться вокруг ядра. В то же время они, согласно законам электродинамики, обязательно должны излучать электромагнитную энергию. Но в таком случае электроны очень быстро потеряли бы всю свою энергию и упали на ядро.
Следующее противоречие связано с тем, что спектр излучения электрона должен быть непрерывным, так как электрон, приближаясь к ядру, менял бы свою частоту. Опыт же показывает, что атомы излучают свет только определенных частот. Именно поэтому атомные спектры называют линейчатыми. Другими словами, планетарная модель атома Резерфорда оказалась несовместимой с электродинамикой Дж. К. Максвелла.
Модель атома Н. Бора, разрешавшая эти противоречия, базировалась на планетарной модели Э. Резерфорда и на разработанной им самим квантовой теории строения атома. Н. Бор выдвинул гипотезу строения атома, основанную на двух постулатах, совершенно несовместимых с классической физикой:
1) в каждом атоме существует несколько стационарных состояний (говоря языком планетарной модели, несколько стационарных орбит) электронов, двигаясь по которым электрон может существовать, не излучая;
2) при переходе электрона из одного стационарного состояния в другое атом излучает или поглощает порцию энергии.
Постулаты Бора объясняют устойчивость атомов: находящиеся в стационарных состояниях электроны без внешней на то причины не излучают электромагнитной энергии.
Теория атома Н. Бора позволяла дать точное описание атома водорода, состоящего из одного протона и одного электрона трудностями. Чем подробнее теоретики пытались описать движение электронов в атоме, определить их орбиты, тем большим было расхождение теоретических результатов с экспериментальными данными. Как стало ясно в ходе развития квантовой теории, эти расхождения главным образом были связаны с волновыми свойствами электрона. Т. е., следует учитывать, что электрон не точка и не твердый шарик, он обладает внутренней структурой, которая может изменяться в зависимости от его состояния. При этом детали внутренней структуры электрона неизвестны.
Следовательно, точно описать структуру атома на основании представления об орбитах точечных электронов принципиально невозможно, поскольку таких орбит в действительности не существует. Вследствие своей волновой природы электроны и их заряды как бы размазаны по атому, однако не равномерно, а таким образом, что в некоторых точках усредненная по времени электронная плотность заряда больше, а в других — меньше.
Теория Н. Бора представляет собой как бы пограничную полосу первого этапа развития современной физики. Это последнее усилие описать структуру атома на основе классической физики, дополняя ее лишь небольшим числом новых предположений. Введенные Бором постулаты ясно показали, что классическая физика не в состоянии объяснить даже самые простые опыты, связанные со структурой атома. Постулаты, чужеродные классической физике, нарушили ее цельность, но позволили объяснить лишь небольшой круг экспериментальных данных.
Со временем выяснилось, что атомную модель Н. Бора не следует понимать буквально, как это было вначале. Процессы в атоме, в принципе, нельзя наглядно представить в виде механических моделей по аналогии с событиями в макромире. Даже понятия пространства и времени в существующей в макромире форме оказались неподходящими для описания микрофизических явлений. Атом физиков-теоретиков все больше и больше становился абстрактно-ненаблюдаемой суммой уравнений.
studfiles.net
Теории строение атома
С давних времен человека занимал вопрос: из чего состоят все тела? Есть ли что-то общее в строении воздуха и камня, воды и огня?
Еще древнегреческий философ Демокрит высказывал мысль о том, что должна существовать мельчайшая неделимая частичка вещества, которую он называл атомом. Атомы, по его мнению, были кирпичиками мироздания. И до начала ХIХ века больше об атоме ничего не было известно.
Первым попытался построить научную теорию атома английский химик Джон Дальтон. Он обнаружил, что все газы, так же, как твердые вещества и жидкости, состоят из невероятно крохотных частичек — атомов. Дальтон определил относительные атомные массы всех известных в то время химических элементов и обнаружил, что при любых химических реакциях атомы элементов не изменяются.
Основываясь на законах механики, физики разработали так называемую молекулярно-кинетическую теорию, с помощью которой им удалось описать строение твердых, жидких и газообразных тел. На основании этой теории удалось объяснить такие понятия, как температура тела и давление газа. Появилась надежда на то, что эта теория объяснит, как из атомов образуются молекулы, и даже позволит описать любое природное явление с помощью законов механики.
И вдруг выяснилось, что атом вовсе не мельчайшая частичка вещества, он имеет достаточно сложную структуру. Этот переворот в науке совершил Джон Томсон. В 1897 году он исследовал катодные лучи и установил, что они представляют собой поток частиц, масса которых во много раз меньше массы атома. На основании своих опытов Томсон создал первую в мире модель атома. Он представилатом в виде сплошного шарик с равномерно распределённым по всему объему положительным зарядом. Внутри атома, по мнению ученого, как изюм в пудинг должны были находиться электроны. Такая модель атома была названа «пудинговой».
Электроны внутри этого «теста» могли колебаться, благодаря чему, по мнению Томсона, в окружающем эфире возникали световые волны. Эта модель атома хоть как-то объясняла происхождение света, валентность химических элементов, а главное – не противоречила механике Ньютона.
В 1911 году Эрнест Резерфорд провел серию опытов, надеясь с помощью уточнить строение атома.
Суть его опытов заключалась в следующем. На пути узкого пучка альфа-частиц, испускаемых радиоактивным веществом, помещала очень тонкая металлическая фольга из золота. Прошедшие сквозь фольгу альфа-частицы регистрировались с помощью люминесцентного экрана, расположенного вокруг мишени.
Если бы атомы золота были сплошными шариками, как предлагал Томсон, то следовало ожидать, что альфа-частицы будут растаскивать атомы золота или отскакивать от них, разлетаясь в разные стороны. В любом случае альфа-частицы должны были рассеиваться, есть вылетать из золотой фольги в различных направлениях.
На деле все оказалось совсем не так. Большая часть альфа-части проходила сквозь металл, как будто на их пути ничего не было. было небольшое количество частиц, которые отклонялись на очень большие угль и даже отскакивали назад.
Эти наблюдения и расчеты привели Резерфорда к идее о планетарной модели атома. Согласно этой модели, атом по структуре аналогичен Солнечной системе. В его центре находится очень тяжелое положительно заряженное ядро, а вокруг него вращаются электроны, подобно тому,
как движутся планеты вокруг Солнца. Причем ядро занимает ничтожно малую часть объема всего атома, примерно одну стотысячную его диаметра. Атом оказался пуст!
Но на этом история создания атома не закончилась, дело в том, что планетарная модель атома имела существенный изъян. Согласно законам классической физики, вращаясь вокруг ядра, электрон должен был излучать электромагнитные волны, теряя при этом часть своей энергии. В результате электрон должен был упасть на ядро, что означало почти мгновенную «смерть атома.
В действительности этого не происходит. Атом – очень устойчивая система.
Новую теорию атома создал Нильс Бор. Он предположил, что электроны могут двигаться только по определенным орбитам. В таком состоянии атом не излучает и не поглощает энергии. Когда электрон перемещается с одной орбиты на другую, расположенную ближе к ядру, атом излучает порцию энергии, названную квантом.
В 1922 году за работы по квантовой теории строения атома водорода и его излучения Бор получил Нобелевскую премию. Бору удалось объяснить не только спектр атома водорода. Он предугадал структуру заполнения электронных оболочек, что позволило глубже понять физическую природу периодичности химических свойств элементов, отраженную в таблице Менделеева.
Но, как известно, нет предела совершенству. И на смену теории Бора пришла современная квантовая теория атома, которая позволила объяснить строение не только атома водорода, но и атомов других химических элементов.
bookbug.ru
Квантовая теория строения атомов
Абсолютно все тела живой и неживой природы, несмотря на их строение и разнообразие, включают в себя мельчайшие частицы — атомы. Первым, кто высказал научное предположение об этом, считается философ Древней Греции Демокрит. Именно этот ученый определил атом как мельчайший неделимый элемент, который образует вещество.
Только в конце XIX столетия были сделаны уникальные открытия, которые смогли продемонстрировать сложность строения указанного элемента, распадающейся на более мелкие элементарные частицы. Тем не менее, это определение широко применяется в современной физике и химии, несмотря на несовпадение его этимологии нынешним представлениям о строении атома.
Демокрит утверждал, что если разделить яблоко на две равные половины, а затем одну из них еще на две части, и продолжать осуществлять деление подобным образом до того момента, как объект исследования перестанет быть яблоком, то мельчайшая частица будет выступать в данном случае атомом яблока.
Группу греческих мыслителей, которые поддерживали теорию о существовании аналогичных крошечных неделимых частиц, называли атомистами.
Определение 1
Атомизм — натурфилософская уникальная гипотеза, которая предполагала, что все чувственно материальные вещи состоят из определенных химически неделимых частиц — атомов.
В современной науке вопрос об атомизме считается до сих пор открытым. Некоторые теоретики выступают за принципы атомизма, однако под атомами подразумевают конкретные фундаментальные частицы, которые далее невозможно разделить.
Квантовая гипотеза строения атома
В основе квантовой теории строения атома можно выделить следующие ключевые положения:
- электрон имеет двойственную природу, следовательно, может вести себя и как волна, и как частица, обладающая определенным зарядом и массой;
- точно и одновременно измерить скорость и координату для электрона невозможно одновременно, так как, чем точнее будет данный показатель, тем больше неопределенности появится в самой координате;
- электрон в атоме не может двигаться по определенным траекториям, а может располагаться в любой части ядерного пространства, но возможность его нахождения в разных местах такой среды неодинакова.
Стоит отметить, что пространство вокруг ядра, в котором возможно наблюдать нахождение электрона с большой вероятностью, называют орбиталью.
Правильное формулирование вышеуказанных основ в квантовой теории строения атома составляют суть новой концепции, описывающей постоянное движение микрочастиц, — квантовой механики. Наибольший вклад в развитие указанной гипотезы внесли такие ученые: немец В.Гейзенберг, француз Л. де Бройль, австриец Э.Шредингер и англичанин П.Дирак. В результате своей интеллектуальной деятельности каждый из этих физиков был удостоен Нобелевской премии.
Определение 2
Квантовая механика — очень сложная теория с математической точки зрения, процессы которой описывают принципы построения микромира и являются недоступными не только восприятию органами чувств человека, но и воображению.
Основы атомной теории строения вещества

Рисунок 1. Квантовая модель строения атома. Автор24 — интернет-биржа студенческих работ
В начале 1808 года известный физик Дальтон Джон возродил атомизм как научное течение в физике, доказав действительность существования атомов. Исследователь считал, что мельчайшие частицы представляют собой элементарные химические элементы, которые нельзя заново создать, разделить на более мелкие элементы или же ликвидировать посредством физических превращений. Любая химическая реакция способна только изменить порядок соборности атомов.
Джон Дальтон представил обществу понятие «атомный вес», а затем первым рассчитал атомные массы целого ряда элементов и разработал первую таблицу их относительных координат, заложив своими работами хорошую основу атомной теории строения элементов.
Физик по праву считается одним из самых уважаемых и знаменитых ученых своего времени, который приобрел невероятную популярность благодаря своим новаторским, уникальным работам в разных сферах знания.
Замечание 1
В 1794 году он смог провести многочисленные исследования и описать цветовую слепоту – дефект зрения, позже официально названный в его честь дальтонизмом.
Ученый также открыл закон парциальных явлений и систему равномерного расширения газов при определенной температуре нагревания, концепцию растворимости частиц в жидкости и установил закон кратных систематических отношений, обнаружив процесс полимеризации на примере бутилена и этилена.
В те времена вопрос о внутреннем строении атомом никогда не возникал, так как эти мельчайшие частицы считались неделимыми. В 1897 г. английский исследователь Дж. Томсон исследуя катодные световые лучи, определил, что атомы любого химического элемента содержат только отрицательно заряженные частицы, названные электронами. Огромной заслугой Томсона в области физики стало доказательство того, что все вещества, которые формируют катодные лучи, входят в состав атома и тождественны друг другу.
По утверждениям данного ученого, положительный заряд в атоме занимает практически весь объем этой частицы и распределен в полном объеме с постоянной плотностью, следовательно, в положительно заряженной атмосфере находится сразу несколько электронов, так что атом можно сравнить с кексом, в котором роль изюминок играют электроны.
Планетарная модель атома
Квантовая теория строения атомов имела огромное количество трактовок и методов использования. Электроны, которые входят в состав атомов, в результате критической массы не могут кардинально изменить общую траекторию $α$-частицы. Рассеяние или изменение направления движения элементов, может вызвать только положительно заряженная часть атома с тяжелой массой.
Вскоре стало понятно, что огромное количество $α$-частиц регулярно проходит через тонкий слой металла, однако при этом практически не испытывает отклонений в траектории движения. Такое небольшое количество частиц постепенно отклоняется на значительные углы, превышающие 30°. Эти соображения привели ученых к выводу, что атом практически пустой, и вся его положительная энергия сосредоточена в крайне малом объеме. Эту часть атома в науке называют атомным ядром.
Так появилась первая планетарная модель атома:
- в центре самого атома расположено положительно заряженное ядро, которое занимает ничтожно малую часть пространства внутри этого вещества;
- весь положительный заряд и практически вся масса атома сосредоточены и взаимосвязаны в его ядре;
- вокруг ядра постоянно вращаются электроны, количество которых равно положительному заряду ядра.
Однако на основе данной модели невозможно объяснить факт существования самого атома, его стабильность. Ведь хаотичное движение электронов по орбитам происходит с постоянным и немалым ускорением. Быстро движущийся элемент по законам электродинамики обязан терять энергию и постепенно приближаться к ядру.
Законы микромира и квантовых гипотез в начале 20 столетия еще не были представлены обществу и установлены наукой. Бор смог первым сформулировать их в виде трех известных постулатов, дополняющих атом Резерфорда. Его учение впоследствии привело к возникновению стройной концепции движения микрочастиц — квантовой механики.
spravochnick.ru
