основные положения, первое, второе и третье начало

Термодинамика (греч. θέρμη – «тепло», δύναμις – «сила») – раздел физики, изучающий наиболее общие свойства макроскопических систем и способы передачи и превращения энергии в таких системах.
В термодинамике изучаются состояния и процессы, для описания которых можно ввести понятие температуры. Термодинамика (Т.) – это феноменологическая наука, опирающаяся на обобщения опытных фактов. Процессы, происходящие в термодинамических системах, описываются макроскопическими величинами (температура, давление, концентрации компонентов), которые вводятся для описания систем, состоящих из большого числа частиц, и не применимы к отдельным молекулам и атомам, в отличие, например, от величин, вводимых в механике или электродинамике.
Современная феноменологическая термодинамика является строгой теорией, развиваемой на основе нескольких постулатов. Однако связь этих постулатов со свойствами и законами взаимодействия частиц, из которых построены термодинамические системы, даётся статистической физикой. Статистическая физика позволяет выяснить также и границы применимости термодинамики.
Законы термодинамики носят общий характер и не зависят от конкретных деталей строения вещества на атомарном уровне. Поэтому термодинамика успешно применяется в широком круге вопросов науки и техники, таких как энергетика, теплотехника, фазовые переходы, химические реакции, явления переноса и даже чёрные дыры. Термодинамика имеет важное значение для самых разных областей физики и химии, химической технологии, аэрокосмической техники, машиностроения, клеточной биологии, биомедицинской инженерии, материаловедения и находит своё применение даже в таких областях, как экономика.
Важные годы в истории термодинамики
- Зарождение термодинамики как науки связано с именем Г. Галилея (G. Galilei), корый ввёл понятие температуры и сконструировал первый прибор, реагирующий на изменения температуры окружающей среды (1597).
- Вскоре Г. Д. Фаренгейт (G. D. Fahrenheit, 1714), Р. Реомюр (R. Reaumur, 1730} и А. Цельсий (A. Celsius, 1742) создали температурные шкалы в соответствии с этим принципом.
- Дж.Блэк (J. Black) в 1757 году уже ввёл понятия скрытой теплоты плавления и теплоемкости (1770). А Вильке (J. Wilcke, 1772) ввёл определение калории как количества тепла, необходимого для нагревания 1 г воды на 1 °С.
- Лавуазье (A. Lavoisier) и Лаплас (P. Laplace) в 1780 сконструировали калориметр (см. Калориметрия) и впервые экспериментально определили уд. теплоёмкости ряда веществ.
- В 1824 С. Карно (N. L, S. Carnot) опубликовал работу, посвящённую исследованию принципов работы тепловых двигателей.
- Б. Клапейрон (В. Clapeyron) ввёл графическое представление термодинамических процессов и развил метод бесконечно малых циклов (1834).
- Г. Хельмгольц (G. Helmholtz) отметил универсальный характер закона сохранения энергии (1847). Впоследствии Р. Клаузиус (R. Clausius) и У. Томсон (Кельвин; W. Thomson) систематически развили теоретический аппарат термодинамики, в основу которого положены первое начало термодинамики и второе начало термодинамики.
- Развитие 2-го начала привело Клаузиуса к определению энтропии (1854) и формулировке закона возрастания энтропии (1865).
- Начиная с работ Дж. У. Гиббса (J. W. Gibbs, 1873), предложившего метод термодинамических потенциалов, развивается теория термодинамического равновесия.
- Во 2-й пол. 19 в. проводились исследования реальных газов. Особую роль сыграли эксперименты Т. Эндрюса (Т. Andrews), который впервые обнаружил критическую точку системы жидкость-пар (1861), её существование предсказал Д. И. Менделеев (1860).
- К концу 19 в. были достигнуты большие успехи в получении низких температур, в результате чего были ожижены О2, N2 и Н2.
- В 1902 Гиббс опубликовал работу, в которой все основные термодинамические соотношения были получены в рамках статистической физики.
- Связь между кинетич. свойствами тела и его термодинамич. характеристиками была установлена Л. Онсагером (L. Onsager, 1931).
- В 20 в. интенсивно исследовали термодинамику твёрдых тел, а также квантовых жидкостей и жидких кристаллов, в которых имеют место многообразные фазовые переходы.
- Л. Д. Ландау (1935-37) развил общую теорию фазовых переходов, основанную на концепции спонтанного нарушения симметрии.
Разделы термодинамики
Современную феноменологическую термодинамику принято делить на равновесную (или классическую) термодинамику, изучающую равновесные термодинамические системы и процессы в таких системах, и неравновесную термодинамику, изучающую неравновесные процессы в системах, в которых отклонение от термодинамического равновесия относительно невелико и ещё допускает термодинамическое описание.
Равновесная (или классическая) термодинамика
В равновесной термодинамике вводятся такие переменные, как внутренняя энергия, температура, энтропия, химический потенциал. Все они носят название термодинамических параметров (величин). Классическая термодинамика изучает связи термодинамических параметров между собой и с физическими величинами, вводимыми в рассмотрение в других разделах физики, например, с гравитационным или электромагнитным полем, действующим на систему. Химические реакции и фазовые переходы также входят в предмет изучения классической термодинамики. Однако изучение термодинамических систем, в которых существенную роль играют химические превращения, составляет предмет химической термодинамики, а техническими приложениями занимается теплотехника.

Классическая термодинамика включает в себя следующие разделы:
- начала термодинамики (иногда также называемые законами или аксиомами)
- уравнения состояния и свойства простых термодинамических систем (идеальный газ, реальный газ, диэлектрики и магнетики и т. д.)
- равновесные процессы с простыми системами, термодинамические циклы
- неравновесные процессы и закон неубывания энтропии
- термодинамические фазы и фазовые переходы
Кроме этого, современная термодинамика включает также следующие направления:
- строгая математическая формулировка термодинамики на основе выпуклого анализа
- неэкстенсивная термодинамика
В системах, не находящихся в состоянии термодинамического равновесия, например, в движущемся газе, может применяться приближение локального равновесия, в котором считается, что соотношения равновесной термодинамики выполняются локально в каждой точке системы.
Неравновесная термодинамика
В неравновесной термодинамике переменные рассматриваются как локальные не только в пространстве, но и во времени, то есть в её формулы время может входить в явном виде. Отметим, что посвящённая вопросам теплопроводности классическая работа Фурье «Аналитическая теория тепла» (1822) опередила не только появление неравновесной термодинамики, но и работу Карно «Размышления о движущей силе огня и о машинах, способных развивать эту силу» (1824), которую принято считать точкой отсчёта в истории классической термодинамики.
Основные понятия термодинамики
Термодинамическая система – тело или группа тел, находящихся во взаимодействии, мысленно или реально обособленные от окружающей среды.
Гомогенная система – система, внутри которой нет поверхностей, разделяющих отличающиеся по свойствам части системы (фазы).
Гетерогенная система – система, внутри которой присутствуют поверхности, разделяющие отличающиеся по свойствам части системы.
Фаза – совокупность гомогенных частей гетерогенной системы, одинаковых по физическим и химическим свойствам, отделённая от других частей системы видимыми поверхностями раздела.
Изолированная система – система, которая не обменивается с окружающей средой ни веществом, ни энергией.
Закрытая система – система, которая обменивается с окружающей средой энергией, но не обменивается веществом.
Открытая система
Совокупность всех физических и химических свойств системы характеризует её термодинамическое состояние. Все величины, характеризующие какое-либо макроскопическое свойство рассматриваемой системы – параметры состояния. Опытным путем установлено, что для однозначной характеристики данной системы необходимо использовать некоторое число параметров, называемых независимыми; все остальные параметры рассматриваются как функции независимых параметров. В качестве независимых параметров состояния обычно выбирают параметры, поддающиеся непосредственному измерению, например температуру, давление, концентрацию и т.д. Всякое изменение термодинамического состояния системы (изменения хотя бы одного параметра состояния) есть
Обратимый процесс – процесс, допускающий возможность возвращения системы в исходное состояние без того, чтобы в окружающей среде остались какие-либо изменения.
Равновесный процесс – процесс, при котором система проходит через непрерывный ряд равновесных состояний.
Энергия – мера способности системы совершать работу; общая качественная мера движения и взаимодействия материи. Энергия является неотъемлемым свойством материи. Различают потенциальную энергию, обусловленную положением тела в поле некоторых сил, и кинетическую энергию, обусловленную изменением положения тела в пространстве.
Внутренняя энергия системы – сумма кинетической и потенциальной энергии всех частиц, составляющих систему. Можно также определить внутреннюю энергию системы как её полную энергию за вычетом кинетической и потенциальной энергии системы как целого.
Формы перехода энергии
Формы перехода энергии от одной системы к другой могут быть разбиты на две группы.
- В первую группу входит только одна форма перехода движения путем хаотических столкновений молекул двух соприкасающихся тел, т.е. путём теплопроводности (и одновременно путём излучения). Мерой передаваемого таким способом движения является теплота. Теплота есть форма передачи энергии путём неупорядоченного движения молекул.
- Во вторую группу включаются различные формы перехода движения, общей чертой которых является перемещение масс, охватывающих очень большие числа молекул (т.е. макроскопических масс), под действием каких-либо сил. Таковы поднятие тел в поле тяготения, переход некоторого количества электричества от большего электростатического потенциала к меньшему, расширение газа, находящегося под давлением и др. Общей мерой передаваемого такими способами движения является работа – форма передачи энергии путём упорядоченного движения частиц.
Теплота и работа характеризуют качественно и количественно две различные формы передачи движения от данной части материального мира к другой. Теплота и работа не могут содержаться в теле. Теплота и работа возникают только тогда, когда возникает процесс, и характеризуют только процесс. В статических условиях теплота и работа не существуют. Различие между теплотой и работой, принимаемое термодинамикой как исходное положение, и противопоставление теплоты работе имеет смысл только для тел, состоящих из множества молекул, т.к. для одной молекулы или для совокупности немногих молекул понятия теплоты и работы теряют смысл. Поэтому термодинамика рассматривает лишь тела, состоящие из большого числа молекул, т.е. так называемые макроскопические системы.

Три начала термодинамики
Начала термодинамики – совокупность постулатов, лежащих в основе термодинамики. Эти положения были установлены в результате научных исследований и были доказаны экспериментально. В качестве постулатов они принимаются для того, чтобы термодинамику можно было построить аксиоматически.
Необходимость начал термодинамики связана с тем, что термодинамика описывает макроскопические параметры систем без конкретных предположений относительно их микроскопического устройства. Вопросами внутреннего устройства занимается статистическая физика.
Начала термодинамики независимы, то есть ни одно из них не может быть выведено из других начал. Аналогами трех законов Ньютона в механике, являются три начала в термодинамике, которые связывают понятия «тепло» и «работа»:
- Нулевое начало термодинамики говорит о термодинамическом равновесии.
- Первое начало термодинамики – о сохранении энергии.
- Второе начало термодинамики – о тепловых потоках.
- Третье начало термодинамики – о недостижимости абсолютного нуля.
Общее (нулевое) начало термодинамики
Общее (нулевое) начало термодинамики гласит, что два тела находятся в состоянии теплового равновесия, если они могут передавать друг другу теплоту, но этого не происходит.
Нетрудно догадаться, что два тела не передают друг другу теплоту в том случае, если их температуры равны. Например, если измерить температуру человеческого тела при помощи термометра (в конце измерения температура человека и температура градусника будут равны), а затем, этим же термометром измерить температуру воды в ванной, и при этом окажется, что обе температуры совпадают (наблюдается тепловое равновесие человека с термометром и термометра с водой), можно говорить о том, что человек находится в тепловом равновесии с водой в ванной.
Из сказанного выше, можно сформулировать нулевое начало термодинамики следующим образом: два тела, находящиеся в тепловом равновесии с третьим, также находятся в тепловом равновесии между собой.
С физической точки зрения нулевое начало термодинамики устанавливает точку отсчета, поскольку, между двумя телами, которые имеют одинаковую температуру, тепловой поток отсутствует. Другими словами, можно сказать, что температура есть не что иное, как индикатор теплового равновесия.
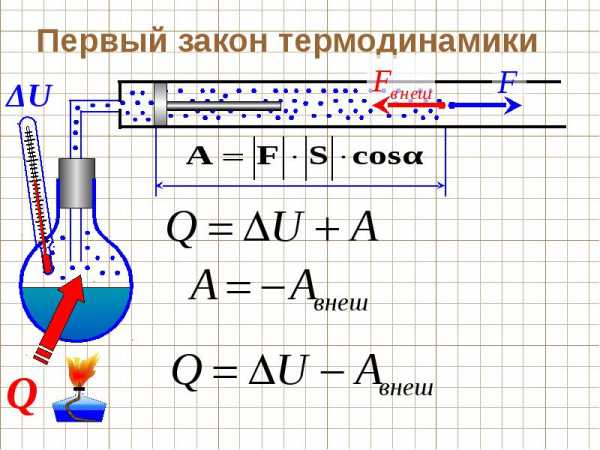
Первое начало термодинамики
Первое начало термодинамики есть закон сохранения тепловой энергии, утверждающий, что энергия никуда не девается бесследно.
Система может либо поглощать, либо выделять тепловую энергию Q, при этом система выполняет над окружающими телами работу W (или окружающие тела выполняют работу над системой), при этом внутренняя энергия системы, которая имела начальное значение Uнач, будет равна Uкон:
Uкон-Uнач = ΔU = Q-W
Тепловая энергия, работа и внутренняя энергия определяют общую энергию системы, которая является постоянной величиной. Если системе передать (забрать) некое кол-во тепловой энергии Q, при отсутствии работы кол-во внутренней энергии системы U, увеличится (уменьшится) на Q.
Второе начало термодинамики
Второе начало термодинамик гласит, что тепловая энергия может переходить только в одном направлении – от тела с более высокой температурой, к телу, с более низкой температурой, но не наоборот.
Третье начало термодинамики
Третье начало термодинамики гласит, что любой процесс, состоящий из конечного числа этапов, не позволит достичь температуры абсолютного нуля (хотя к нему можно существенно приблизиться).
Видео
Источники
mfina.ru
это… Определение, законы, применение и процессы
Что такое термодинамика? Это раздел физики, который занимается изучением свойств макроскопических систем. При этом под изучение также попадают способы превращения энергии и методы ее передачи. Термодинамика – это раздел физики, который изучает процессы, происходящие в системах, и их состояния. О том, что еще попадает в список изучаемых ей вещей, мы сегодня и поговорим.
Определение
На картинке ниже можно увидеть пример термограммы, полученной при изучении кувшина с горячей водой.

Термодинамика – это наука, которая опирается на обобщенные факты, полученные опытным путем. Происходящие в термодинамических системах процессы описываются при помощи использования макроскопических величин. В их список входят такие параметры, как концентрация, давление, температура и тому подобные. Понятное дело, что к отдельным молекулам они неприменимы, а сводятся к описанию системы в общем ее виде (в отличие от тех величин, которые используются в электродинамике, например).
Термодинамика – это раздел физики, который также имеет и свои законы. Они, подобно остальным, носят общий характер. Конкретные детали строения того или иного выбранного нами вещества не окажут значительного влияния на характер законов. Именно поэтому говорят, что данный раздел физики является одним из наиболее применимых (или, вернее сказать, успешно применимых) в науке и технике.
Применение

Перечислять примеры можно очень долго. Например, много решений, основанных на термодинамических законах, можно встретить в области тепловой техники или электроэнергетики. Что и говорить об описании и понимании химических реакций, фазовых переходов, явлений переноса. В некотором роде термодинамика “сотрудничает” с квантовой динамикой. Сфера их соприкосновения – это описание явления черных дыр.
Законы
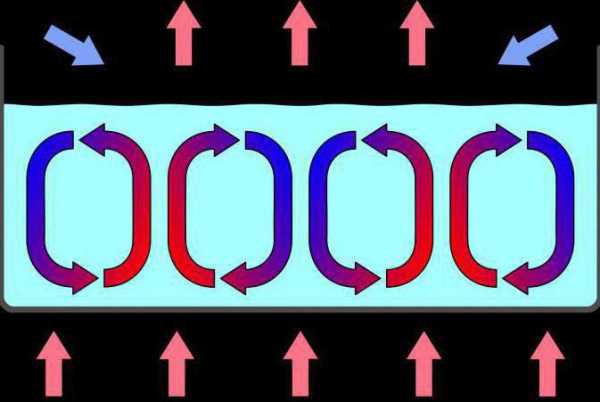
Картинка выше демонстрирует суть одного из термодинамических процессов – конвекции. Теплые слои вещества поднимаются наверх, холодные – опускаются вниз.
Альтернативное название законов, которое, кстати, употребляется не в пример чаще, это начала термодинамики. На сегодняшний день их известно три (плюс одно “нулевое“, или “общее”). Но перед тем как говорить о том, что предполагает каждый из законов, попытаемся ответить на вопрос о том, что такое начала термодинамики.
Они представляют собой совокупность определенных постулатов, которые ложатся в основу понимания происходящих в макросистемах процессов. Положения начал термодинамики устанавливались эмпирическим путем по мере проведения целых серий опытов и научных исследований. Таким образом, существуют определенные доказательства, позволяющие нам взять постулаты на вооружение без единого сомнения в их точности.
Некоторые люди задаются вопросом о том, зачем термодинамике нужны эти самые законы. Ну, можно сказать, что необходимость их использования обусловлена тем, что в данном разделе физики макроскопические параметры описываются в общем виде, без какого-либо намека на рассмотрения их микроскопической природы или особенностей того же плана. Это сфера не термодинамики, а уже статистической физики, если говорить конкретнее. Еще одной важной вещью является тот факт, что начала термодинамики не зависят друг от друга. То есть одно из второго вывести не получится.
Применение

Применение термодинамики, как было сказано ранее, идет по многим направлениям. За основу берется, кстати, одно из ее начал, которое иначе интерпретируется в форме закона сохранения энергии. Термодинамические решения и постулаты успешно внедряются в такие отрасли, как энергетическая промышленность, биомедицина, химия. Вот в биологической энергетике повсеместно используется закон сохранения энергии и закон вероятности и направленности термодинамического процесса. Наряду с этим, там используются три наиболее распространенных понятия, на которых базируется вся работа и ее описание. Это термодинамическая система, процесс и фаза процесса.
Процессы
Процессы в термодинамике имеют разную степень сложности. Их насчитывается семь штук. Вообще, под процессом в таком случае следует понимать не что иное, как изменение макроскопического состояния, в которое система была приведена ранее. Следует понимать, что разница между условным начальным состоянием и конечным результатом может быть ничтожной.
Если разница бесконечно мала, то произошедший процесс мы вполне можем назвать элементарным. Если мы будем обсуждать процессы, то придется прибегнуть к упоминанию дополнительных терминов. Один из них – это “рабочее тело”. Рабочим телом называется система, в которой происходит один тепловой процесс или несколько.
Условно процессы подразделяются на неравновесные и равновесные. В случае с последним все состояния, через которые предстоит пройти термодинамической системе, являются, соответственно, неравновесными. Зачастую изменение состояний идет в таких случаях быстрыми темпами. А вот равновесные процессы близки к квазистатическим. В них изменения проходят на порядок медленнее.
Тепловые процессы, происходящие в термодинамических системах, могут быть как обратимыми, так и необратимыми. Для того чтобы понять суть, разобьем в своем представлении последовательность действий на определенные промежутки. Если мы можем сделать тот же процесс в обратном направлении с теми же “промежуточными станциями”, то его можно назвать обратимым. В противном случае сделать это не получится.
fb.ru
Главное в разделе «Термодинамика» | Физика. Закон, формула, лекция, шпаргалка, шпора, доклад, ГДЗ, решебник, конспект, кратко
В основу термодинамического подхода положено определение функции состояния тела, которая бы связывала природу тепловых явлений, обусловленную внутренним строением тела, с легкоизмеряемыми макропараметрами. Такой функцией состояния является внутренняя энергия, которая однозначно определяется температурой T, давлением p и объемом V термодинамической системы.
Внутренняя энергия тела может быть изменена вследствие теплообмена или выполнения работы. Количество теплоты, переданное телу (или забранное у него), определяется в зависимости от сопровождающего его теплового процесса:
- при нагревании (охлаждении) Q = cmΔT;
- при плавлении (кристаллизации) Q = λm;
- при парообразовании (конденсации) Q = rm;
- при испарении твердых тел и кристаллизации из газообразного состояния.
Работа газа при незначительных изменениях давления (p = const) равна: A’ = pΔV и изменяет знак на противоположный в случае выполнения работы внешними силами над газом:
A = —pΔV.
Первый закон термодинамики устанавливает, что количество теплоты, предоставленное термодинамической системе, ведет к изменению ее внутренней энергии или выполнению работы либо является причиной того и другого одновременно:
Q = ΔU + pΔV.
Он является фундаментальным законом сохранения энергии, отрицающим возможность создания вечного двигателя: нельзя создать машину, которая бы неограниченно выполняла работу, не получая энергию извне.
Естественное течение тепловых процессов указывает на то, что все они являются необратимыми. Второй закон термодинамики устанавливает, что в природе невозможен процесс, при котором теплота самопроизвольно переходила бы от менее нагретых к более нагретым телам; или (следуя формулировке У. Томсона): невозможно осуществить такой периодический процесс, единым результатом которого будет выполнение работы за счет теплоты, отобранной у нагревателя.
Законы термодинамики имеют широкое практическое применение, в частности в технике, в конструировании тепловых машин. С. Карно установил, что наиболее энергетически выгодным является циклический процесс, построенный на основе последовательных изотермических и адиабатных процессов (так называемый цикл идеальной машины).
Коэффициент полезного действия идеальной машины имеет максимальное значение и равен отношению разности абсолютных температур ее нагревателя T1 и охладителя T2 к абсолютной температуре нагревателя T1:
η = (T1 – T2) / T1. Материал с сайта http://worldofschool.ru
Все тепловые машины (двигатели внутреннего сгорания, реактивные двигатели, паровые и газовые турбины, холодильные машины и т. п.) построены по принципу преобразования части тепловой энергии в механическую работу. Их КПД всегда меньше, чем КПД идеальной машины, и равен:
η = A’ / Q1 = |Q1| — |Q2| / |Q1| = 1 — |Q2| / |Q1|.
Таким образом, термодинамика как теория основывается на обобщении многочисленных наблюдений и многовекового опыта познания сущности тепловых явлений и процессов. Ее законы и принципы имеют широкое практическое значение, и их положено в основу теплотехники и инженерии тепловых машин.
На этой странице материал по темам:Физика термодинамика главное
Количествотеплоты переданное телу или забранное у него определяется
worldofschool.ru
1.Статистический и термодинамический методы
13
Молекулярная физика. Термодинамика.
1.Статистический и термодинамический методы
2.Молекулярно-кинетическая теория идеальных газов
2.1.Основные определения
2.2.Опытные законы идеального газа
2.3.Уравнение состояния идеального газа (уравнение Клапейрона-Менделеева
2.4.Основное уравнение молекулярно-кинетической теории идеального газа
2.5.Распределение Максвелла
2.6.Распределение Больцмана
3.Термодинамика
3.1.Внутренняя энергия. Закон равномерного распределения энергии по степеням свободы
3.2.Первое начало термодинамики
3.3.Работа газа при изменении его объема
3.4.Теплоемкость
3.5.Первое начало термодинамики и изопроцессы
3.5.1.Изохорный процесс (V = const)
3.5.2.Изобарный процесс (p = const)
3.5.3.Изотермический процесс (T = const)
3.5.4. Адиабатический процесс (dQ = 0)
3.5.5. Политропные процессы
3.6.Круговой процесс (цикл). Обратимые и необратимые процессы. Цикл Карно.
3.7.Второе начало термодинамики
3.8.Реальные газы
3.8.1.Силы межмолекулярного взаимодействия
3.8.2.Уравнение Ван-дер-Ваальса
3.8.3.Внутренняя энергия реального газа
3.8.4.Эффект Джоуля-Томсона. Сжижение газов.
Молекулярная физика и термодинамика – разделы физики, в которых изучаются макроскопические процессы, связанные с огромным числом содержащихся в телах атомов и молекул. Для изучения этих процессов применяют два принципиально различающихся (но взаимно дополняющих друг друга) метода: статистический (молекулярно-кинетический) и термодинамический.
Молекулярная физика – раздел физики, изучающий строение и свойства вещества исходя из молекулярно-кинетических представлений, основывающихся на том, что все тела состоят из молекул, находящихся в непрерывном хаотическом движении. Процессы, изучаемые молекулярной физикой, являются результатом совокупного действия огромного числа молекул. Законы поведения огромного числа молекул изучаются с помощью статистического метода, который основан на том, что свойства макроскопической системы определяются свойствами частиц системы, особенностями их движения и усредненными значениями динамических характеристик этих частиц (скорости, энергии и т.д.). Например, температура тела определяется средней скоростью хаотического движения его молекул и нельзя говорить о температуре одной молекулы.
Термодинамика – раздел физики, изучающий общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями. Термодинамика не рассматривает микропроцессы , которые лежат в основе этих превращений, а основывается на двух началах термодинамики – фундаментальных законах, установленных экспериментальным путем.
Статистические методы физики не могут быть использованы во многих разделах физики и химии, тогда как термодинамические методы универсальны. Однако статистические методы позволяют устанавливать микроскопическое строение вещества, тогда как термодинамические методы лишь устанавливают связи между макроскопическими свойствами. Молекулярно-кинетическая теория и термодинамика взаимно дополняют друг друга, образуя единое целое, но отличаясь методами исследования.
2.Молекулярно-кинетическая теория идеальных газов
2.1.Основные определения
Объектом исследования в молекулярно-кинетической теории является газ. Считается, что молекулы газа, совершая беспорядоченые движения, не связаны силами взаимодействия и поэтому они движутся свободно, стремясь, в результате соударений, разлететься во все стороны, заполняя весь предоставленный им объем. Таким образом, газ принимает объем того сосуда, который газ занимает.
Идеальный газ – это газ, для которого: собственный объем его молекул пренебрежимо мал по сравнению с объемом сосуда; между молекулами газа отсутствуют силы взаимодействия; столкновения молекул газа между собой и со стенками сосуда абсолютно упругие. Для многих реальных газов модель идеального газа хорошо описывает их макро свойства.
Термодинамическая система – совокупность макроскопических тел, которые взаимодействуют и обмениваются энергией как между собой, так и с другими телами (внешней средой).
Состояние системы – совокупность физических величин (термодинамических параметров, параметров состояния), которые характеризуют свойства термодинамической системы: температура, давление, удельный объем.
Температура – физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы. В системе СИ разрешено использование термодинамической и практической шкалы температур. В термодинамической шкале тройная точка воды (температура, при которой лед, вода и пар при давлении 609 Па находятся в термодинамическом равновесии) считается равной Т = 273.16 градуса Кельвина [K]. В практической шкале температуры замерзания и кипения воды при давлении 101300 Па считаются равными, соответственно, t = 0 и t =100 градусов Цельсия [C]. Эти температуры связаны между собой соотношением
T = 273.15 + t.
Температура Т = 0 К называется нулем Кельвин, согласно современным представлениям эта температура недостижима, хотя приближение к ней сколь угодно близко возможно.
Давление – физическая величина, определяемая нормальной силой F, действующей со стороны газа (жидкости) на единичную площадку, помещенную внутрь газа (жидкости) p = F/S, где S – размер площадки. Единица давления – паскаль [Па]: 1 Па равен давлению, создаваемому силой 1 Н, равномерно распределенной по нормальной к ней поверхности площадью 1 м2 (1 Па = 1 Н/м2).
Удельный объем – это объем единицы массы v = V/m = 1/r, где V – объем массы m, r – плотность однородного тела. Поскольку для однородного тела v ~ V, то макроскопические свойства однородного тела можно характеризовать как v, так и V.
Термодинамический процесс – любое изменение в термодинамической системе, приводящее к изменению хотя бы одного из ее термодинамических параметров. Термодинамическое равновесие – такое состояние макроскопической системы, когда ее термодинамические параметры не изменяются с течением времени. Равновесные процессы – процессы, которые протекают так, что изменение термодинамических параметров за конечный промежуток времени бесконечно мало.
Изопроцессы – это равновесные процессы, при которых один из основных параметров состояния сохраняется постоянным. Изобарный процесс – процесс, протекающий при постоянном давлении (в координатах V,t он изображается изобарой). Изохорный процесс – процесс, протекающий при постоянном объеме (в координатах p,t он изображается изохорой). Изотермический процесс – процесс, протекающий при постоянной температуре (в координатах p,V он изображается изотермой). Адиабатический процесс – это процесс, при котором отсутствует теплообмен между системой и окружающей средой (в координатах p,V он изображается адиабатой).
Постоянная (число) Авогадро – число молекул в одном моле NA=6.022.1023.
Нормальные условия: p = 101300 Па, Т = 273.16 К.
studfiles.net
Термодинамика | Физика
Термодинамика — наука о наиболее общих тепловых свойствах макроскопических тел.
В термодинамике не вводятся упрощенные модели изучаемых явлений, поэтому выводы термодинамики имеют универсальный характер.
В частности, в термодинамике не учитывается молекулярное строение тел.
Термодинамика возникла при изучении оптимальных условий использования теплоты для совершения работы.
Основные понятия термодинамики:
— макроскопическая система — система, состоящая из большого числа частиц, причем чем большее число частиц входит в термодинамическую систему, тем точнее описание свойств системы;
— замкнутая система — это система, изолированная от любых внешних воздействий;
— телом в термодинамике называют макроскопическую систему, заключенную в определенный объем;
— равновесное состояние — это состояние макроскопической системы, при котором параметры, характеризующие ее состояние, остаются неизменными во всех частях системы, т. е. отсутствуют потоки (импульса, энергии, массы и т. д.) между ее частями;
— равновесное состояние термодинамической системы однозначно определяется несколькими параметрами состояния, или термодинамическими параметрами. К ним относятся, в первую очередь, температура, объем и давление. В равновесном состоянии параметры состояния не зависят от времени и координат. Связь между параметрами равновесных термодинамических систем определяется уравнением состояния;
— процессом в термодинамике называется изменение состояния тела со временем. Важными характеристиками процесса являются поглощенное телом количество теплоты Q , совершенная над ним работа А.
Главное содержание термодинамики состоит в двух ее началах (законах) — первом и втором; первое распространяет закон сохранения энергии на тепловые явления, второе же указывает направление возможных энергетических превращений в природе.
Как уже было сказано, термодинамика не учитывает молекулярное строение вещества при изучении тепловых свойств макроскопических тел и в этом смысле является макроскопической теорией.
ibrain.kz
Законы термодинамики
Раздел физики, который изучает соотношение и превращение теплоты и других энергий, называется термодинамикой. В ней работают не с отдельными молекулами, а с телами макроскопических размеров, которые состоят из огромного числа частиц. Называются такие тела термодинамическими системами. В этой статье мы будем вспоминать законы термодинамики.
Первый закон
Этот закон обобщает закон превращения и сохранения энергии для термодинамической системы. Говорит он о том, что изменение внутренней энергии термодинамической системы, которая является неизолированной, будет равно разности количества теплоты, передаваемой системе, и работы, совершаемой системой над внешними объектами. Количество теплоты, которое получает система, идет на изменение внутренней ее энергии и совершение ею работы над внешними объектами. Рассмотрим этот закон термодинамики применительно к изопроцессам газов.
- При изохорном процессе газ работу не совершает. Значит количество теплоты, передаваемое системе, будет равняться изменению внутренней энергии. То есть, при изохорном нагревании, тепло будет поглощаться газом и, соответственно, будет увеличиваться его внутренняя энергия. При охлаждении, тепло будет отдаваться внешним телам.
- При изобарном расширении, тепло газом поглощается, и он совершает работу положительную. При изобарном сжатии, температура газа уменьшается, тепло отдается внешним объектам, внутренняя энергия при этом убывает.
- При изотермическом процессе, изменения температуры газа не происходит, следовательно, не происходит и изменения внутренней энергии. В процессе изотермического расширения количество теплоты, которую получает газ, превращается в работу над внешними объектами. Работа внешних сил, которая производится газом, при изотермическом сжатии превращается в тепло, передающееся окружающим телам.
- Рассмотрим первый закон термодинамики при адиабатическом процессе. Адиабатические процессы – это процессы сжатия или расширения газа в адиабатических оболочках. Такими оболочками называют сосуды, в которых отсутствует теплообмен с окружающими объектам
elhow.ru
Термодинамика | Virtual Laboratory Wiki
Термодинамика (от греч. Therme — тепло + Dynamis — сила) — раздел физики, изучающий соотношения и превращения теплоты и других форм энергии. В отдельные дисциплины выделились химическая термодинамика, изучающая физико-химические превращения, связанные с выделением или поглощением тепла, а также теплотехника.
В теоретической физике наряду с феноменологической термодинамикой, изучающей феноменологию тепловых процессов, выделяют термодинамику статистическую, которая была создана для механического обоснования термодинамики и была одним из первых разделов статистической физики.
Разделы термодинамики Править
Классическая термодинамика состоит из разделов:
Кроме этого, современная термодинамика включает также следующие направления:
Физический смысл термодинамики Править
Необходимость термодинамики Править
Термодинамика исторически возникла как эмпирическая наука об основных способах преобразования внутренней энергии тел для совершения механической работы. Однако в процессе своего развития термодинамика проникла во все разделы физики, где возможно ввести понятие «температура» и позволила теоретически предсказать многие явления задолго до появления строгой теории этих явлений.
Законы термодинамики Править
Термодинамика основывается на трёх законах, которые сформулированы на основе экспериментальных данных и поэтому могут быть приняты как постулаты.
* 1-й закон термодинамики. Представляет собой формулировку обобщённого закона сохранения энергии для термодинамических процессов. В наиболее простой форме его можно записать как $ \delta Q=\delta A+dU $, где $ dU $ есть полный дифференциал внутренней энергии системы, а $ \delta Q $ и $ \delta A $ есть элементарное количество теплоты, переданное системе, и элементарная работа, совершенная системой соответственно. Нужно учитывать, что $ \delta A $ и $ \delta Q $ нельзя считать дифференциалами в обычном смысле этого понятия, поскольку эти величины существенно зависят от типа процесса, в результате которого состояние системы изменилось.
* 2-й закон термодинамики: Второй закон термодинамики исключает возможность создания вечного двигателя второго рода. Имеется несколько различных, но в тоже время эквивалентных формулировок этого закона. 1 — Постулат Клаузиуса. Процесс, при котором не происходит других изменений, кроме передачи теплоты от горячего тела к холодному, является необратимым, то есть теплота не может перейти от холодного тела к горячему без каких либо других изменений в системе. Это явление называют рассеиванием или дисперсией энергии. 2 — Постулат Кельвина. Процесс, при котором работа переходит в теплоту без каких либо других изменений в системе, является необратимым, то есть невозможно превратить в работу всю теплоту, взятую от источника с однородной температурой, не проводя других изменений в системе.
* 3-й закон термодинамики: Теорема Нернста: Энтропия любой системы при абсолютном нуле температуры всегда может быть принята равной нулю.
* Основной закон (нулевое начало) термодинамики:
Для каждой изолированной термодинамической системы существует состояние термодинамического равновесия, которого она при фиксированных внешних условиях с течением времени самопроизвольно достигает.
Парадоксы Править
Парадокс Гиббса.
- Гиббс Дж. В. Термодинамика. Статистическая механика. Серия: Классики науки. М.: Наука 1982. 584 с.
- Базаров И. П. Термодинамика. М.: Высшая школа, 1991, 376 с.
- Базаров И. П., Геворкян Э. В., Николаев П. Н. Неравновесная термодинамика и физическая кинетика. М.: Изд-во МГУ, 1989.
- Базаров И. П. Заблуждения и ошибки в термодинамике. Изд. 2-ое испр. М.: Едиториал УРСС, 2003. 120 с.
- Базаров И. П. Методологические проблемы статистической физики и термодинамики. М.: Изд-во МГУ, 1979.
- Де Гроот С. Р. Термодинамика необратимых процессов. М.: Гос. Изд.-во техн.-теор. лит., 1956. 280 с.
- Де Гроот С., Мазур П. Неравновесная термодинамика. М.: Мир, 1964. 456 с.
- Гуров К. П. Феноменологическая термодинамика необратимых процессов (физические основы). — М.: Наука, Глав. ред. физ-мат лит-ры, 1978. 128 с.
- Дьярмати И. Неравновесная термодинамика. Теория поля и вариационные принципы. М.: Мир, 1974. 404 с.
- Карно С., Клаузиус Р., Томсон В. (лорд Кельвин), Больцман Л., Смолуховский М. Под ред. и комментариями и предисловием: Тимирязев А. К. Второе начало термодинамики. Антология. Изд.2. Серия: Физико-математическое наследие: физика (термодинамика и статистическая механика). — М.: Изд-во ЛКИ, 2007. — 312 с.
- Квасников И. А. Термодинамика и статистическая физика. Т.1: Теория равновесных систем: Термодинамика. Том.1. Изд. 2, испр. и доп. М.: УРСС, 2002. 240 с.
- Кубо Р. Термодинамика. М.: Мир, 1970
- Пригожин И. Введение в термодинамику необратимых процессов М.: Изд-во иностр. лит-ры, 1960. 160 c.
- Пригожин И., Кондепуди Д. Современная термодинамика. От тепловых двигателей до диссипативных структур. М.: Мир, 2002. 464 с.
Gladyshev Georgi P. The Principle of Substance Stability is Applicable to all Levels of Organization of Living Matter // Int. J. Mol. Sci.- 2006.- 7.- P. 98-110.http://www.mdpi.org/ijms/papers/i7030098.pdf
Гладышев Г.П. Термодинамика и макрокинетика природных иерархических процессов. М.: Наука, 1988. – 287 с.; Gladyshev G.P. Thermodynamics and Macrokinetics of Natural Hierarchical Processes . M.: Nauka Publ., 1988.
- Gladyshev Georgi P. Thermodynamics Theory of the Evolution of Living Beings.- Commack, New York: Nova Science Publishers, Inc.- 1997.- 142 P.
- Гладышев Г.П. Супрамолекулярная термодинамика – Ключ к осознанию явления жизни. Издание второе – М – Ижевск. ISBN: 59397-21982. 2003.
- Стратонович Р. Л. Нелинейная неравновесная термодинамика. М.: Наука, 1985. 480 с.
- Сычев В. В. Дифференциальные уравнения термодинамики. Изд. 2-е. М.: Высшая школа, 1991. 224 с.
- Шредингер Э. Статистическая термодинамика Ижевск: РХД, 1999. 96 с.
ru.vlab.wikia.com
