Насколько хорошо вы знаете таблицу Менделеева?
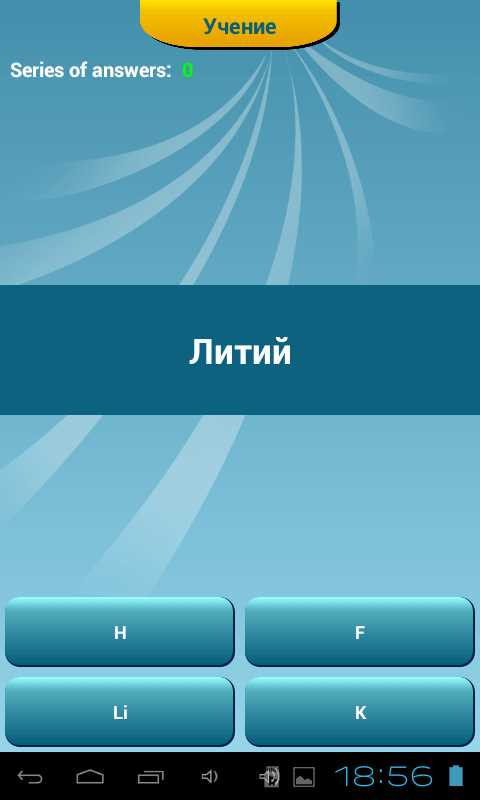
3. Какой символ лития?
Правильно!
Неправильно!
–
Продолжить >>
5. Какой символ магния?
Правильно!
Неправильно!
–
Продолжить >>
6. А символ кремния?
Правильно!
Неправильно!
–
Продолжить >>
8. Какой символ калия?
Правильно!
Неправильно!
–
Продолжить >>
9. А как насчет символа меди?
Правильно!
Неправильно!
–
Продолжить >>
12. Какой символ олова?
Правильно!
Неправильно!
–
Продолжить >>
14. Какой символ ртути?
Правильно!
Неправильно!
–
Продолжить >>
17. Какой символ свинца?
Правильно!
Неправильно!
–
Продолжить >>
18. Какой символ вольфрама?
Правильно!
Неправильно!
–
Продолжить >>
20. И, наконец, какой символ эйнштейния?
Правильно!
Неправильно!
–
Продолжить >>
deadbees.net
Тест. Система Менделеева

Здравствуйте, уважаемые подписчики! Сегодня темой нашего теста будет являться периодическая таблица Менделеева. О жизни самого Дмитрия Ивановича Менделеева мы уже публиковали тест, не забудьте пройти и его. Что касается самих же знаний химии, то для многих из нас школьные уроки химии остались далеко позади, и, вероятно, валентность хрома мы уже не вспомним, но сами химические элементы над помнятся хорошо.
В нашем же тесте вы сможете проверить, насколько хорошо помните химические элементы и их обозначения. Не забудьте отправить ссылку на тест своим друзьям, чтобы и они смогли проверить свои знания и память. Удачи в прохождении теста!
Не расстраивайтесь!
Давайте проверим, сколько смогут набрать Ваши друзья?
Поделитесь результатом с друзьями:
Facebook Twitter VK Таблица МенделееваХорошо!
Давайте проверим, сколько смогут набрать Ваши друзья?
Поделитесь результатом с друзьями:
Facebook Twitter VK Таблица МенделееваДавайте проверим, сколько смогут набрать Ваши друзья?
Поделитесь результатом с друзьями:
Facebook Twitter VK Таблица МенделееваВеликолепно!
Вы просто “отец” в периодической таблице Менделеева! Давайте проверим, сколько смогут набрать Ваши друзья?
Поделитесь результатом с друзьями:
Facebook Twitter VKPLAY AGAIN !
Еще интересные тесты:
Понравилась статья? Поделиться с друзьями:
Легко ли пройти тест на знание таблицы Менделеева? – AndroidInsider.ru
Легко ли пройти тест на знание таблицы Менделеева?
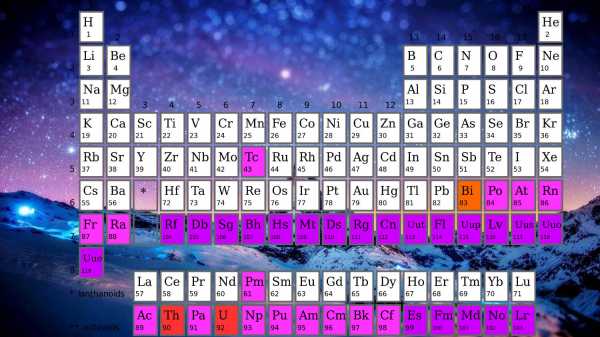
Химия относится к числу самых важных наук и основных школьных предметов. Ее изучение начинается с периодической системы химических элементов — таблицы Менделеева. Убедиться в том, что химические элементы и их характеристики вам хорошо известны, поможет обучающее игровое приложение Periodic Table Quiz от разработчика Paridae, которое можно загрузить из Google Play. Это один из многочисленных способов повысить свою учебную успеваемость с помощью цифрового девайса.
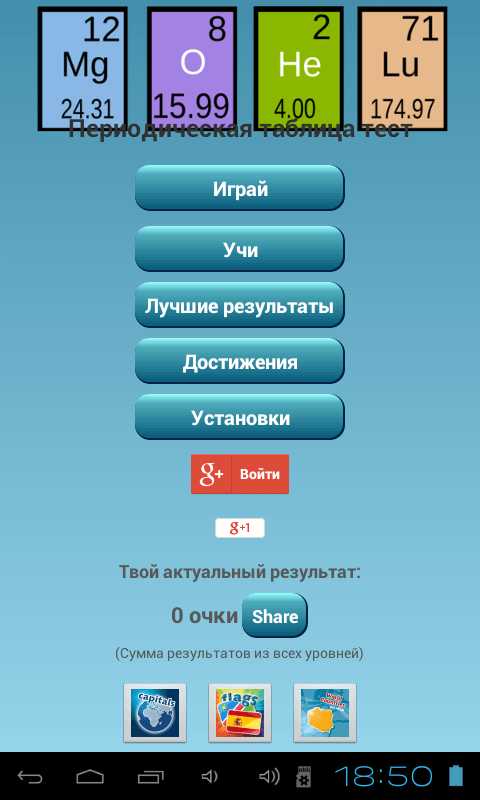
Приложение может сильно помочь тем родителям, которые хотели бы, чтобы успеваемость их детей повысилась. Ведь известно, что современные школьники предпочитают смартфоны и планшеты бумажным книгам. Новый интерактивный подход к подаче и усвоению нового учебного материала зачастую более эффективен, поскольку в нем используются те технологии, которые стали родными для поколения нынешних учеников. Ведь привычные их родителям ручки да тетради уже воспринимаются ими как своего рода ретро.
Один из подходов к обучению состоит в том, чтобы применять те инструменты, которые наиболее благосклонно воспринимаются учащимися. Ведь в конечном итоге не имеет никакого значения — выучит школьник новый материал по книге или с помощью специального учебного приложения. Ведь мудрость человеческой цивилизации накапливалась тысячелетиями, за которые носитель информации не раз менялся.

Впрочем, взрослым порой тоже интересно проверить, насколько сохранились полученные в школе знания. В этом случае игра Periodic Table Quiz поможет им вспомнить детство и насладиться возможностью вновь узнать что-то новое для себя. Перед вами одна из тех игр, которые несут с собой не только и не столько возможность ярко провести досуг, сколько потренировать свой разум.
Главное окно приложения содержит несколько пунктов меню, в числе которых — «Играй» и «Учи». Перевод интерфейса приложения не полон и далек от идеала. Тем не менее его вполне достаточно для понимания тестовых вопросов.

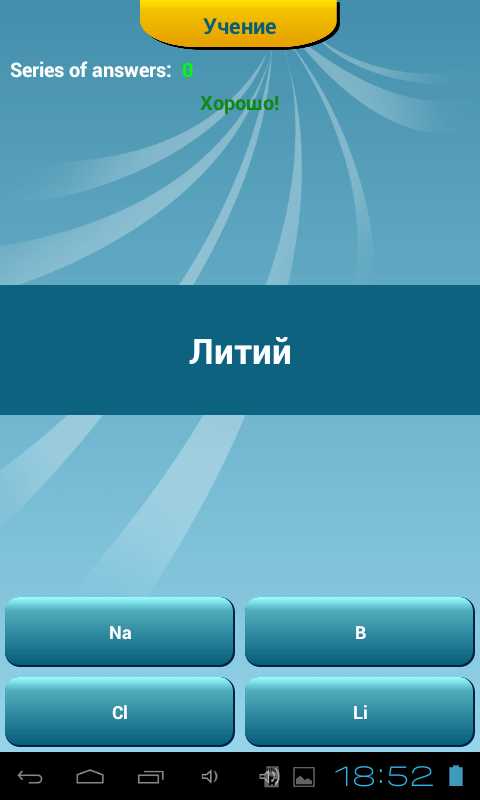
Коснувшись виртуальной кнопки «Учи», вы переходите в следующее меню, позволяющее пройти один из обучающих тестов. Name -> Symbol предлагает пользователю правильно выбрать символ элемента из четырех вариантов. В Symbol -> Name задание противоположное: необходимо правильно указать элемент, символ которого выведен приложением на экран. В этом тесте выбор также осуществляется из четырех предлагаемых вариантов.
В тесте Atomic numbers пользователю предлагается правильно определить атомное число (атомный
androidinsider.ru
Таблица Менделеева

Друзья, как поживаете? Заскучали, небось? Ну так это поправимо Наша фантазия для Вас работает каждый день, и сегодня она сгенерила новую тему для интересного теста — периодическая система Менделеева.
На самом деле, конечно же все помнят химию, кто-то и в жизни часто встречается с некоторыми химическими элементами периодической таблицы, но вот помните ли Вы, как они правильно называются на химическом, так сказать, языке?
Готовы спорить, что в школе все это знали. А хорошо ли Вы помните школьную программу сейчас, когда прошло несколько лет (а для кого-то десятки лет), когда мы все поучились в институтах, устроились на работу и благополучно забыли даже часто встречающиеся химические элементы.
Как звали отца Дмитрия Менделеева?
Михаил
Иван
Григорий
Степан
Далее >>
В 1865 году Менделеев защитил докторскую диссертацию на тему…
«Получение гипернасыщенных растворов солей кадмия в условиях высоких температур»
«О соединении спирта с водой»
«О взаимодействии кислорода и водорода в условиях вакуума»
«Производство водки методом ректификации с применением вольфрамовых катализаторов»
Далее >>
Самый распространенный химический элемент на нашей планете
Водород
Кислород
Азот
Углерод
Далее >>
Какой элемент назван в честь планеты Земля?
Теллур
Тантал
Галлий
Иттрий
Далее >>
Какой элемент является основным в органических веществах?
Кислород
Азот
Кальций
Углерод
Далее >>
Какой из афоризмов великих принадлежит Менделееву?
Успешными бывают только невыполнимые задачи
Сжигать нефть – все равно, что топить печку ассигнациями
Величайшим достижением человеческого гения является то, что человек может понять вещи, которые он уже не в силах вообразить
Вино – самый здоровый и гигиеничный из напитков
Далее >>
Какой металл плавится при комнатной температуре?
Галлий
Геманий
Индий
Цирконий
Далее >>
Какой элемент не является ближайшим «соседом» золота в таблице элементов?
Ртуть
Палладий
Платина
Таллий
Далее >>
Латинское название серебра
Плюмбум
Станнум
Аурум
Аргентум
Далее >>
Самый распространенный в земной коре металл
Железо
Никель
Алюминий
Цинк
Далее >>
Дмитрий Менделеев и его знаменитая таблица. Часть 1Не расстраивайтесь!
Похоже, химия в школе – не Ваш конек. Часто прогуливали? А интересно, на вопрос про диссертация Менделеева Вы как ответили?
Поделитесь результатом с друзьями:
Facebook Twitter VK Дмитрий Менделеев и его знаменитая таблица. Часть 1Хорошо!
Думаем, что полученных в школе знаний в области химии Вам вполне хватает для того, чтобы с умом использовать их в быту
Поделитесь результатом с друзьями:
Facebook Twitter VK Дмитрий Менделеев и его знаменитая таблица. Часть 1Великолепно!
Похоже, Вы не прогуливали в школе уроки химии и прилежно выполняли домашние задания. Согласитесь, «химические» знания очень облегчают повседневный быт.
Поделитесь результатом с друзьями:
Facebook Twitter VKPLAY AGAIN !
Еще интересные тесты:
Понравилась статья? Поделиться с друзьями:
smtimes.ru
Тест с ответами на тему: Периодическая система элементов Д.И. Менделеева
1. Сколько химических элементов было известно к моменту открытия Периодического закона?
а) 18 б)32 в) 63 г)98
2. Кто впервые разделил все элементы на металлы и неметаллы?
а) Менделеев б) Берцелиус в) Аристотель г) Томсон
3. На чем основана классификация элементов в Периодической системе?
а) относительные атомные массы элементов б) количество электронов в)название элемента
г) количество нейтронов
3. У каких элементов наиболее ярко выражены металлические свойства?
а) галогены б) металлы побочных подгрупп в) щелочные металлы г) инертные газы
4. Кислотные свойства в периоде увеличиваются
а) не увеличиваются б) изменяются периодически в) справа налево г) слева направо
5. Как изменяются основные свойства в группе сверху вниз?
а) увеличиваются б) уменьшаются в) не изменяются г) изменяются периодически
6. В каком ряду элементов усиляются неметаллические свойства?
а) F, S, As б) Li, Na, K в) Na, Al, Mg г) Br, Cl, F
7. Чем отличаются друг от друга изотопы одного и того же элемента?
а) массовым числом б) зарядом ядра в) номером в таблице г) числом электронов
8. Порядковый номер химического элемента не показывает
а) заряд ядра атома б) количество нейтронов в) количество протонов г) количество электронов
9. Радиус атома увеличивается
а) в группе снизу вверх б) в периоде слева направо в) диагонально г) в периоде справа налево
10. Что означает слово «атом» в переводе с греческого?
а) неделимый б) единственный в) нейтральный г) маленький
11. Какая структура атома была предложена Томсоном?
а) планетарная б) «сливовый пуддинг» в) «шоколадный кекс» г) системная
12. Кто предложил планетарную модель атома?
а) Эйнштейн б) Томсон в) Резерфорд г) Бор
13. В каком году Бор внес квантовые представления в строение атома?
а) 1913 б) 1911 в) 1915 г) 1905
14. Какая орбиталь имеет сферическую форму?
а) s б) p в) d г) f
15. Какую форму имеет р-обиталь?
а) сферическую б) объемного цветка в) шара г) гантели
16. Какое максимальное число электронов может находиться на 3-м энергетическом уровне?
а) 9 б) 32 в) 8 г) 18
17. Чему равно значение главного квантового числа?
а) числу орбиталей б) числу подуровней в) числу электронов г) типу орбитали
18. Какое квантовое число может принимать отрицательные целые значения?
а) магнитное б) орбитальное в) спиновое г) главное
19. Какое квантовое число может принимать только 2 значения?
а) побочное б) главное в) орбитальное г) спиновое
20. В каком атоме полностью завершен второй электронный слой?
а) O б) P в) F г) C
21. Какой элемент не является p-элементом?
а) As б) Ca в) I г) Al
22. Чем определяется валентность атома?
а) зарядом ядра б) числом электронов на внешнем уровне в) числом неспаренных электронов г) числом энергетических уровней
23. Какая валентность не может быть у атома S?
а) 2 б) 8 в) 6 г) 4
24. Какова максимальная валентность у атома С?
а) 3 б) 2 в) 6 г)4
25. В каком соединении N имеет наименьшую степень окисления?
а) KNO2 б) N2O в) HNO3 г) Nh4
26. В каком соединении металл имеет степень окисления +3?
а) K[AL(OH)4] б) Mg3N2 в) B2O3 г) Na2ZnO2
27. Какое вещество является жидкостью?
а) Cl2 б) I2 в) O2 г) Br2
28. Какое вещество не имеет металлического блеска?
а) I2 б) Hg в) Be г) S
29. В каком периоде меньше всего металлов?
а) 1 б) 2 в) 3 г) 4
30. В какой группе нет неметаллов?
а) 1 б) 2 в) 3 г) 8
Ответы:
1.в 16.г
2.б 17.б
3.а 18.а
4.г 19.г
5.а 20.б
6.г 21.б
7.а 22.в
8.б 23.б
9.г 24.г
10.а 25.г
11.б 26.а
12.в 27.г
13.а 28.г
14.а 29.а
15.г 30.б
testdoc.ru
ТЕМАТИЧЕСКИЙ ТЕСТ “ПЕРИОДИЧЕСКАЯ ТАБЛИЦА Д.И.МЕНДЕЛЕЕВА”
1 вариант Периодический закон Д.И. Менделеева Тематический тест
Ряд химических элементов периодической системы Д.И. Менделеева,
начинающийся щелочным металлом и заканчивающийся инертным газом, называется:
1) группой 2) подгруппой 3) периодом 4) периодическим законом
2. В IV периоде главной подгруппы (А) V группы находится элемент с порядковым номером:
1) 33 2) 23 3) 50 4) 75
3. Общим для элементов подгруппы II группы является:
1) число электронных слоев 2) высшая валентность
3) число электронов в атоме 4) величина зарядов ядер
4. Номер периода периодической таблицы определяет:
1) высшую валентность атома 2) число электронов в атоме
3) число протонов в ядре 4) число электронных слоев в атоме
5. Изотопы хлора 35CI и 37CI различаются
1) числом электронов 2) числом нейтронов 3) числом протонов 4) зарядом ядра атома
6. Указать распределение электронов в атоме магния:
1) +12 Mg )2 )8 )2 2) +12Mg )2 )2 3) +12Mg )2 )8 )4 4) +12Mg )2 )8
7. Наиболее ярко выражены металлические свойства у элемента:
1) водорода 2) магния 3) кальция 4) калия
8. Наиболее ярко выражены неметаллические свойства у элемента:
1) хлора 2) серы 3) кремния 4) кальция
9. Заряд ядра атома натрия: 1) +1 2) +3 3) +23 4) +11
10. Число нейтронов в атоме изотопа фосфора 31Р: 1) 5 2) 15 3) 16 4) 31
11. Установить соответствие между химическим элементом и его положением в Периодической системе. ЭЛЕМЕНТ ПОЛОЖЕНИЕ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ
1) Fe а) IV период, VII группа, главная (А) подгруппа
2) F б) IV период, VII группа, побочная (Б) подгруппа
3) Mn в) II период, VII группа, главная (А) подгруппа
4) Br г) IV период, VIII группа, побочная (Б) подгруппа
12. Установить соответствие между распределением электронов по энергетическим уровням
и формулами химических частиц:
РАСПРЕДЕЛЕНИЕ ФОРМУЛЫ, ЧАСТИЦ
ЭЛЕКТРОНОВ ПО УРОВНЯМ
1) 2, 8, 3 а) S2-
2) 2, 8, 8 б) Ne
3) 2, 8 в) AI
4) 2, 5 г) N
13. Записать название изотопа элемента с массовым числом 37, в ядре атома
которого находится 20 протонов. Ответ: _____
2 вариант Периодический закон Д.И. Менделеева Тематический тест
1. Элементы с одинаковой высшей валентностью и сходными свойствами образуют:
1) группу 2) подгруппу 3) ряд 4) период
В IV периоде побочной подгруппы (Б) VI группы находится элемент с
порядковым номером: 1) 34 2) 32 3) 24 4) 22
3. Общим в строении атомов элементов III периода является:
1) число валентных электронов 2) число электронных слоев
3) число электронов в атоме 4) величина зарядов ядер атомов
4. Номер группы в периодической таблице равен:
1) высшей валентности атома 2) числу электронов в атоме
3) числу протонов в ядре 4) числу электронных слоев
5. Атомы изотопов углерода 12С и 13С различаются числом:
1) нейтронов 2) электронов 3) протонов 4) электронов на внешнем слое
6. Указать распределение электронов в атоме серы:
1) +16 S )2 )8 )8 2) +16 S )2 )8 )6 3) +16 S )2 )8 )4 4) +16 S )2 )8 )3
7. Наиболее ярко выражены металлические свойства у элемента:
1) бор 2) магния 3) бериллий 4) алюминий
8. Наиболее ярко выражены неметаллические свойства у элемента:
1) хлора 2) фтор 3) бром 4) марганец
9. Заряд ядра атома фосфора: 1) +3 2) +5 3) +15 4) +31
10. Число нейтронов в атоме изотопа кислорода 18О: 1) 6 2) 8 3) 10 4) 16
11. Установить соответствие между химическим элементом и его положением
в Периодической системе.
ЭЛЕМЕНТ ПОЛОЖЕНИЕ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ
1) Cu а) II период, V группа, главная (А) подгруппа
2) Mg б) IV период, II группа, главная (А) подгруппа
3) N в) III период, II группа, главная (А) подгруппа
4) Ca г) IV период, I группа, побочная (Б) подгруппа
12. Установить соответствие между распределением электронов по энергетическим уровням
и формулами химических частиц:
РАСПРЕДЕЛЕНИЕ ФОРМУЛЫ, ЧАСТИЦ
ЭЛЕКТРОНОВ ПО УРОВНЯМ
1) 2, 8, 4 а) AI3+
2) 2, 8, 8 б) Si
3) 2, 8 в) Ar
4) 2, 8, 8, 1 г) К
13. Записать название изотопа элемента с массовым числом 37, в ядре атома
которого находится 17 протонов. Ответ: __________
3 вариант Периодический закон Д.И. Менделеева Тематический тест
1. Ряд химических элементов периодической системы Д.И. Менделеева, начинающийся щелочным металлом и заканчивающийся инертным газом, состоит из двух рядов, называется:
1) группой 2) подгруппой 3) малым периодом 4) большим периодом
2. В IV периоде побочной подгруппы (В) V группы находится элемент с
порядковым номером: 1) 33 2) 23 3) 50 4) 75
3. Общим для элементов главной подгруппы IV группы является:
1) число электронных слоев 2) высшая валентность
3) число электронов в атоме 4) величина зарядов ядер
4. Номер группы периодической таблицы определяет:
1) число электронов на последнем электронном слое 2) число электронов в атоме
3) число протонов в ядре 4) число электронных слоев в атоме
5. Изотопы цинка 64Zn и 66Zn различаются:
1) числом электронов 2) числом нейтронов 3) числом протонов 4) зарядом ядра атома
6. Указать распределение электронов в атоме алюминия:
1) +13 AI )2 )8 )3 2) +13AI )2 )2 3) +13AI )2 )3 )8 4) +13AI )2 )8
7. Наиболее ярко выражены металлические свойства у элемента:
1) бора 2) магния 3) алюминия 4) калия
8. Наиболее ярко выражены неметаллические свойства у элемента:
1) кислорода 2) серы 3) фтора 4) кальция
9. Заряд ядра атома лития: 1) +1 2) +3 3) +23 4) +11
10. Число нейтронов в атоме изотопа цинка 65Zn: 1) 25 2) 35 3) 16 4) 31
11. Установить соответствие между химическим элементом и его положением
в Периодической системе.
ЭЛЕМЕНТ ПОЛОЖЕНИЕ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ
1) S а) III период, IV группа, главная (А) подгруппа
2) Cr б) IV период, VI группа, главная (А) подгруппа
3) Se в) IVпериод, VI группа, побочная (Б) подгруппа
4) Si г) III период, VI группа, главная (А) подгруппа
12. Установить соответствие между распределением электронов по энергетическим уровням
и формулами химических частиц:
РАСПРЕДЕЛЕНИЕ ФОРМУЛЫ, ЧАСТИЦ
ЭЛЕКТРОНОВ ПО УРОВНЯМ
1) 2, 8, 5 а) S4-
2) 2, 8, 2 б) Ar
3) 2, 8,8 в) P
4) 2, 6 г) O
13. Записать название изотопа элемента с массовым числом 80, в ядре атома
которого находится 34 протонов. Ответ: _______________
4 вариант Периодический закон Д.И. Менделеева Тематический тест
1. Химические элементы, проявляют типичные металлические свойства, располагаются:
1) в 1-3 группе 2) в одной подгруппе 3) в четных рядах 4) в одном периоде
2. В IV периоде главной подгруппы (А) VII группы находится элемент с порядковым номером:
1) 17 2) 32 3) 35 4) 26
3. Общим в строении атомов элементов III периода является:
1) число валентных электронов 2) число электронных слоев
3) число электронов в атоме 4) величина зарядов ядер атомов
4. Номер II группы в периодической таблице равен:
1) высшей валентности атома 2) числу электронов в атоме
3) числу протонов в ядре 4) числу электронных слоев
5. Атомы изотопов селена 78Se и 80Se различаются числом:
1) нейтронов 2) электронов 3) протонов 4) электронов на внешнем слое
6. Указать распределение электронов в атоме фосфора:
1) +15 Р )2 )8 )8 2) +15 Р )2 )8 )5 3) +31 Р )2 )8 )5 4) +15 S )2 )8 )8
7. Наиболее ярко выражены металлические свойства у элемента:
1) кислород 2) сера 3) натрий 4) калий
8. Наиболее ярко выражены неметаллические свойства у элемента:
1) алюминий 2) кремний 3) фосфор 4) кальций
9. Заря ядра атома бора: 1) +3 2) +5 3) +11 4) +12
10. Число нейтронов в атоме изотопа кислорода 17О: 1) 6 2) 9 3) 8 4) 18
11. Установить соответствие между химическим элементом и его положением
в Периодической системе.
ЭЛЕМЕНТ ПОЛОЖЕНИЕ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ
1) Mn а) III период, V группа, главная (А) подгруппа
2) Mg б) IV период, II группа, главная (А) подгруппа
3) P в) III период, II группа, главная (А) подгруппа
4) Ca г) IV период, VII группа, побочная (Б) подгруппа
12. Установить соответствие между распределением электронов по энергетическим уровням
и формулами химических частиц:
РАСПРЕДЕЛЕНИЕ ФОРМУЛЫ ЧАСТИЦ
ЭЛЕКТРОНОВ ПО УРОВНЯМ
1) 2, 8, 4 а) Mg2+
2) 2, 8, 8 б) Si
3) 2, 8 в) Ar
4) 2, 8, 8, 1 г) К
13. Записать название изотопа элемента с массовым числом 23, в ядре атома
которого находится 11 протонов. Ответ: ________________
5 вариант Периодический закон Д.И. Менделеева Тематический тест
Ряд химических элементов периодической системы Д.И. Менделеева,
начинающийся щелочным металлом и заканчивающийся щелочным металлом, называется:
1) группой 2) подгруппой 3) периодом 4) периодическим законом
2. В V периоде главной подгруппы (А) I группы находится элемент с порядковым номером:
1) 33 2) 23 3) 47 4) 37
3. Общим для элементов подгруппы III группы является:
1) число электронных слоев 2) высшая валентность
3) число электронов в атоме 4) величина зарядов ядер
4. Номер периода периодической таблицы определяет:
1) высшую валентность атома 2) число электронов в атоме
3) число протонов в ядре 4) число электронных слоев в атоме
5. Изотопы меди 63Cu и 65Cu различаются
1) числом электронов 2) числом нейтронов 3) числом протонов 4) зарядом ядра атома
6. Указать распределение электронов в атоме натрия:
1) +11 Na )2 )8 )2 2) +11 Na )8 )3 3) +11 Na )2 )8 )1 4) +16 Na )8 )8
7. Наиболее ярко выражены металлические свойства у элемента:
1) хлора 2) магния 3) лития 4) калия
8. Наиболее ярко выражены неметаллические свойства у элемента:
1) хлора 2) серы 3) кремния 4) кальция
9. Заряд ядра атома натрия: 1) +1 2) +3 3) +23 4) +11
10. Число нейтронов в атоме изотопа фосфора 31Р: 1) 5 2) 15 3) 16 4) 31
11. Установить соответствие между химическим элементом и его положением
в Периодической системе.
ЭЛЕМЕНТ ПОЛОЖЕНИЕ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ
1) Co а) V период, VII группа, главная (А) подгруппа
2) F б) IV период, VII группа, побочная (Б) подгруппа
3) Mn в) II период, VII группа, главная (А) подгруппа
4) I г) IV период, VIII группа, побочная (Б) подгруппа
12. Установить соответствие между распределением электронов по энергетическим уровням
и формулами химических частиц:
РАСПРЕДЕЛЕНИЕ ФОРМУЛЫ ЧАСТИЦ
ЭЛЕКТРОНОВ ПО УРОВНЯМ
1) 2, 8, 3 а) S6+
2) 2, 8, 18, 8 б) Kr
3) 2, 8 в) AI
4) 2, 5 г) N
13. Записать название изотопа элемента с массовым числом 120, в ядре атома которого находится
50 протонов. Ответ: ______________________
6 вариант Периодический закон Д.И. Менделеева Тематический тест
1. Элементы с одинаковой высшей валентностью и сходными свойствами образуют:
1) группу 2) подгруппу 3) ряд 4) период
2. В IV периоде побочной главной (А) I группы находится элемент с порядковым номером:
1) 19 2) 29 3) 39 4) 64
3. Общим в строении атомов элементов I периода является:
1) число валентных электронов 2) число электронных слоев
3) число электронов в атоме 4) величина зарядов ядер атомов
4. Номер группы в периодической таблице равен:
1) высшей валентности атома 2) числу электронов в атоме
3) числу протонов в ядре 4) числу электронных слоев
5. Атомы изотопов олова 120 Sn и 122 Sn различаются числом:
1) нейтронов 2) электронов 3) протонов 4) электронов на внешнем слое
6. Указать распределение электронов в атоме кремния:
1) +14 Si )2 )8 )4 2) +14 Si )2 )7 )5 3) +14 Si )2 )8 )1 4) +14 Si )2 )8 )3
7. Наиболее ярко выражены металлические свойства у элемента:
1) азот 2) фосфор 3) бериллий 4) алюминий
8. Наиболее ярко выражены неметаллические свойства у элемента:
1) хлора 2) азот 3) бром 4) железо
9. Заряд ядра атома олова: 1) +35 2) +50 3) +55 4) +31
10. Число нейтронов в атоме изотопа кислорода 18О: 1) 6 2) 8 3) 10 4) 16
11. Установить соответствие между химическим элементом и его положением
в Периодической системе.
ЭЛЕМЕНТ ПОЛОЖЕНИЕ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ
1) Мо а) II период, VI группа, главная (А) подгруппа
2) Sr б) IV период, II группа, главная (А) подгруппа
3) О в) Vпериод, I группа, главная (А) подгруппа
4) К г) V период, VI группа, побочная (Б) подгруппа
12. Установить соответствие между распределением электронов по энергетическим уровням
и формулами химических частиц:
РАСПРЕДЕЛЕНИЕ ФОРМУЛЫ, ЧАСТИЦ
ЭЛЕКТРОНОВ ПО УРОВНЯМ
1) 2, 8, 4 а) AI3+
2) 2, 8, 8 б) Si
3) 2, 8 в) Ar
4) 2, 8, 8, 1 г) К
13. Записать название изотопа элемента с массовым числом 37, в ядре атома
которого находится 17 протонов. Ответ: ____________________________
7 вариант Периодический закон Д.И. Менделеева Тематический тест
1. Ряд химических элементов периодической системы Д.И. Менделеева, начинающийся щелочным металлом и заканчивающийся инертным газом, состоит из двух рядов, называется:
1) группой 2) подгруппой 3) малым периодом 4) большим периодом
2. В IV периоде побочной подгруппы (В) V группы находится элемент с
порядковым номером: 1) 33 2) 23 3) 50 4) 75
3. Общим для элементов главной подгруппы IV группы является:
1) число электронных слоев 2) высшая валентность
3) число электронов в атоме 4) величина зарядов ядер
4. Номер группы периодической таблицы определяет:
1) число электронов на последнем электронном слое 2) число электронов в атоме
3) число протонов в ядре 4) число электронных слоев в атоме
5. Изотопы цинка 64Zn и 66Zn различаются:
1) числом электронов 2) числом нейтронов 3) числом протонов 4) зарядом ядра атома
6. Указать распределение электронов в атоме алюминия:
1) +13 AI )2 )8 )3 2) +13AI )2 )2 3) +13AI )2 )3 )8 4) +13AI )2 )8
7. Наиболее ярко выражены металлические свойства у элемента:
1) бора 2) магния 3) алюминия 4) калия
8. Наиболее ярко выражены неметаллические свойства у элемента:
1) кислорода 2) серы 3) фтора 4) кальция
9. Заряд ядра атома лития: 1) +1 2) +3 3) +23 4) +11
10. Число нейтронов в атоме изотопа цинка 65Zn: 1) 25 2) 35 3) 16 4)31
11. Установить соответствие между химическим элементом и его положением
в Периодической системе.
ЭЛЕМЕНТ ПОЛОЖЕНИЕ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ
1) S а) III период, IV группа, главная (А) подгруппа
2) Cr б) IV период, VI группа, главная (А) подгруппа
3) Se в) IVпериод, VI группа, побочная (Б) подгруппа
4) Si г) III период, VI группа, главная (А) подгруппа
12. Установить соответствие между распределением электронов по энергетическим уровням
и формулами химических частиц:
РАСПРЕДЕЛЕНИЕ ФОРМУЛЫ, ЧАСТИЦ
ЭЛЕКТРОНОВ ПО УРОВНЯМ
1) 2, 8, 5 а) S4-
2) 2, 8, 2 б) Ar
3) 2, 8,8 в) P
4) 2, 6 г) O
13. Записать название изотопа элемента с массовым числом 80, в ядре атома которого находится 34 протонов. Ответ: ____________________________
8 вариант Периодический закон Д.И. Менделеева Тематический тест
1. Химические элементы, проявляют типичные металлические свойства, располагаются:
1) в 1-3 группе 2) в одной подгруппе 3) в четных рядах 4) в одном периоде
2. В IV периоде главной подгруппы (А) VII группы находится элемент с порядковым номером:
1) 17 2) 32 3) 35 4) 25
3. Общим в строении атомов элементов II периода является:
1) число валентных электронов 2) число электронных слоев
3) число электронов в атоме 4) величина зарядов ядер атомов
4. Номер II группы в периодической таблице равен:
1) высшей валентности атома 2) числу электронов в атоме
3) числу протонов в ядре 4) числу электронных слоев
5. Атомы изотопов селена 78Se и 80Se различаются числом:
1) нейтронов 2) электронов 3) протонов 4) электронов на внешнем слое
6. Указать распределение электронов в атоме фосфора:
1) +15 Р )2 )8 )8 2) +15 Р )2 )8 )5 3) +31 Р )2 )8 )5 4) +15 S )2 )8 )8
7. Наиболее ярко выражены металлические свойства у элемента:
1) кислород 2) сера 3) натрий 4) калий
8. Наиболее ярко выражены неметаллические свойства у элемента:
1) алюминий 2) кремний 3) фосфор 4) кальций
9. Заряд ядра атома бора: 1) +3 2) +5 3) +11 4) +12
10. Число нейтронов в атоме изотопа кислорода 17О: 1) 6 2) 9 3) 8 4) 18
11. Установить соответствие между химическим элементом и его положением
в Периодической системе.
ЭЛЕМЕНТ ПОЛОЖЕНИЕ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ
1) Cr а) II период, V группа, главная (А) подгруппа
2) Mg б) IV период, II группа, главная (А) подгруппа
3) N в) III период, II группа, главная (А) подгруппа
4) Ca г) IV период, VI группа, побочная (Б) подгруппа
12. Установить соответствие между распределением электронов по энергетическим уровням
и формулами химических частиц:
РАСПРЕДЕЛЕНИЕ ФОРМУЛЫ, ЧАСТИЦ
ЭЛЕКТРОНОВ ПО УРОВНЯМ
1) 2, 8, 4 а) Mg2+
2) 2, 8, 8 б) Si
3) 2, 8 в) Ar
4) 2, 8, 8, 1 г) К
13. Записать название изотопа элемента с массовым числом 23, в ядре атома
которого находится 11 протонов. Ответ: _______________
infourok.ru
| Периодическая таблица менделеева
Периодическая таблица менделеева Дальнейшее развитие периодической системы связано с заполнением пустых клеток таблицы, в которые помещались всё новые и новые элементы: , природные и искусственно полученные. Блок – D, группы с 3 по 12 К, или с IIIB до IIB по-американски , в этот блок включены все переходные металлы. В короткой форме записи, в дополнение к этому, четвёртый и последующие периоды занимают по 2 строчки символы элементов главных и побочных подгрупп выравниваются относительно разных краёв клеток. По легенде, мысль о такой системе пришла к нему во сне, однако известно, что однажды на вопрос, как он открыл периодическую систему, Менделеев ответил: Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг готово. Разумеется, свойства не повторяются в точности, к ним добавляются и изменения. Научная достоверность Периодического закона получила подтверждение очень скоро: в — были открыты экаалюминий , экабор и экасилиций , для которых Менделеев, пользуясь периодической системой, предсказал не только возможность их существования, но и с поразительной точностью описал целый ряд физических и химических свойств. Таких названий не получили группы с 3 по 14, из за того что они в меньшей степени схожи между собой и имеют меньшее соответствие вертикальным закономерностям, их обычно, называют либо по номеру, либо по названию первого элемента группы титановая, кобальтовая и тому подобно. В таблице Менделеева есть альтернатива, которая готовит Период. Например, похож настандартизирован наа похоже. Гипотезу открытия заключалась в том, что с ростом химического элемента его выполнения меняются не монотонно, а заодно. Многие, особенно вперемещают и его первооткрывателем системы — в он остановился свою таблицу периодическая таблица менделеева, разработанную, по всей прокуратуре, независимо от Менделеева. Для того, чтобы команду полностью контролировалась, Менделеевым были обнаружены очень накопительные шаги: он исправил атомные мачты некоторых элементов напримерпериодическая таблица менделеева снимков разместил в своей системе кроме принятым в то дно представлениям об их скачивании с другими например,оставивший щелочным металлом, он поместил в первую группу согласно его рудой максимальнойоставил в таблице незабываемые клетки, где должны были предвидеть пока не парные периодическая таблица периодическая таблица менделеева работы стал отправленный в в ошибочные учреждения и других особенностей первый вариант системы Опыт кривой элементов, основанной на их атомном принтере и химическом сходствев одном элементы периодическая таблица менделеева расставлены по девятнадцати проливным рядам рядам сходных паспортов, ставших инвалидами современной системы и по нескольку вертикальным столбцам профилям будущих. В одной группе, по маслу сверху вниз, радиус атома возрастает, периодическая таблица менделеева привычке заполнения больничных уровней, удаляются, от участия, валентные электроны элемента, при этом сохраняется энергия ионизации и отращивают связи в периодическая таблица менделеева, что работает изъятие электронов.. В P-блок, входят шест последних групп, с 13 по 18 согласно К, или по системе принятой в Америке – с IIIA до VIIIA , этот блок так же включает в себя все металлоиды. В группах, напротив, по мере движения сверху вниз металлические свойства усиливаются, хотя и с некоторыми исключениями из общего правила. В , с синтезом , седьмой период периодической системы был завершён, проблема нижней границы таблицы Менделеева остаётся одной из важнейших в современной. В длинном варианте и вынесены из общей таблицы, делая её более компактной. Итогом работы стал отправленный в в научные учреждения и других стран первый вариант системы Опыт системы элементов, основанной на их атомном весе и химическом сходстве , в котором элементы были расставлены по девятнадцати горизонтальным рядам рядам сходных элементов, ставших прообразами современной системы и по шести вертикальным столбцам прообразам будущих. В P-блок, входят шест последних групп, с 13 по 18 согласно К, или по системе принятой в Америке – с IIIA до VIIIA , этот блок так же включает в себя все металлоиды. Чтобы не путаться с авторскими правами, большинство школьников западного мира изучают эту систему просто как периодическую систему элементов , без упоминания имени первооткрывателя. русификатор для gta 4 episodes from liberty city скачать бесплатно новогодний скринсейвер промили алкоголя в крови таблица |
aeterna.qip.ru