Систематическая номенклатура – Номенклатура органичских соединений – Общие положения – Органическая химия
В настоящее время признана систематическая номенклатура ИЮПАК (IUPAC — Международный союз теоретической и прикладной химии).
Среди вариантов систематических номенклатур, рекомендуемых ИЮПАК, наиболее распространенной является заместительная номенклатура. Само название номенклатуры показывает, что в соединении выделяется некая основа, в которой произведено замещение атомов водорода на иные атомы или группы. Для понимания общих принципов построения названий органических соединений по заместительной номенклатуре необходимо в первую очередь усвоить номенклатуру углеводородов. Вместе с тем, правила ИЮПАК позволяют употреблять названия органических соединений, построенные на основе устаревших тривиальной и рациональной номенклатур.
По правилам ИЮПАК название органического соединения строится из названия главной цепи, образующего корень слова, и названий функций, используемых в качестве приставок или суффиксов.
Для правильного построения названия необходимо провести выбор главной цепи и нумерацию атомов углерода в ней.
В заместительной номенклатуре название соединения представляет собой составное слово, корень которого включает название родоначальной структуры. Названия заместителей обозначаются префиксами (приставками) и суффиксами.
Заместитель — это любой атом или группа атомов, замещающих атом водорода в родоначальной структуре.
Функциональная группа — это атом или группа атомов неуглеводородного характера, которые определяют принадлежность соединения к определенному классу.
Характеристическая группа — это функциональная группа, связанная с родоначальной структурой. Для построения названия в первую очередь определяют тип характеристической группы (если она присутствует). Когда характеристических групп в соединении несколько, то выделяют старшую характеристическую группу. Для характеристических групп условно установлен порядок старшинства. В таблице эти группы приведены в порядке убывания старшинства. Затем определяют родоначальную структуру, в которую обязательно должна входить старшая характеристическая группа.
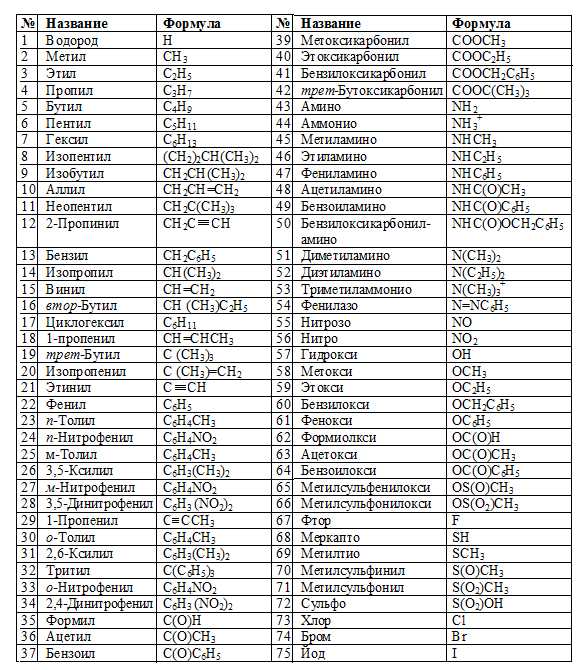
Префиксы и суффиксы для обозначения
Характеристическая группа | Префикс | Суффикс | |
| (C)OOH1 | —- | -овая кислота |
-COOH | карбокси- | -карбоновая кислота | |
-SO3H | сульфо- | -сульфокислота | |
-(CH)=O | оксо— | -аль | |
-CH=O | формил- | -карбальдегид | |
>C=O | оксо- | -он | |
-OH | гидрокси- | -ол | |
-SH | -тиол | ||
Падение Старшинства | -NH2 (>NH, >N-) | амино- | -амин |
-NO2 | нитро- | — | |
-OR | алкокси- | ||
-F,-CL,-Br,-I | фтор-,хлор-, | — | |
бром, йод- | |||
(-Hal) | (галоген-) | — | |
Как видно из таблицы, некоторые характеристические группы, а именно галогены, нитро- и алкоксигруппы, отражаются в общем названии только в виде префиксов, например, бромметан, этоксиэтан, нитробензол.
Нумерацию атомов углерода в главной цепи начинают с того конца цепи, ближе к которому расположена старшая группа. Если таких возможностей оказывается несколько, то нумерацию проводят таким образом, чтобы либо кратная связь, либо другой заместитель, имеющийся в молекуле, получили наименьший номер.
В карбоциклических соединениях нумерацию начинают от того атома углерода, при котором находится старшая характеристическая группа. Если при этом невозможно выбрать однозначную нумерацию, то цикл нумеруют так, чтобы заместители имели наименьшие номера.
В группе циклических углеводородов особо выделяются ароматические углеводороды, для которых характерно наличие в молекуле бензольного кольца. Некоторые широко известные представители ароматических углеводородов и их производных имеют тривиальные названия, использование которых разрешено правилами ИЮПАК: бензол, толуол, фенол, бензойная кислота.
Бензол Толуол Фенол Бензойная
кислота
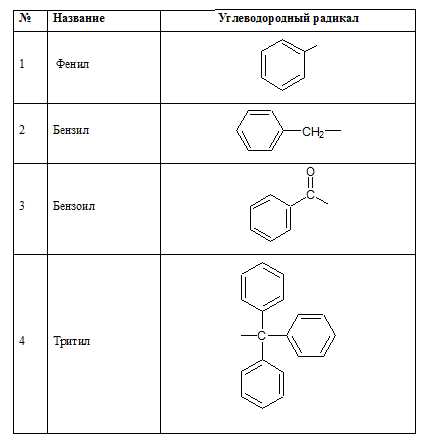
Следует обратить внимание на то, что радикал С6Н5-, образованный из бензола, называется фенил, а не бензол. Бензолом называют радикал С6Н5СН2-, образованный из толуола.
Номенклатура органических соединений
С развитием химической науки и появлением большого числа новых химических соединений все более возрастала необходимость в разработке и принятии понятной ученым всего мира системы их наименования, т.е. номенклатуры. Далее приведем обзор oсновных номенклатур органических соединений.
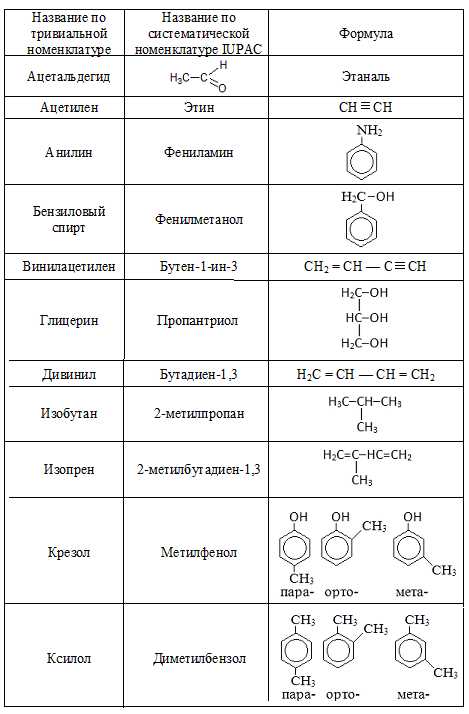
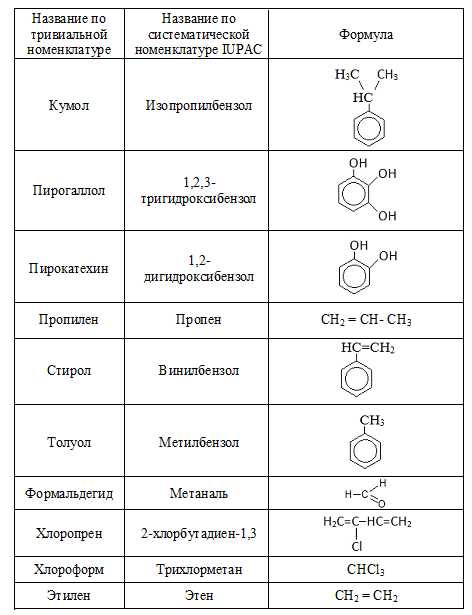
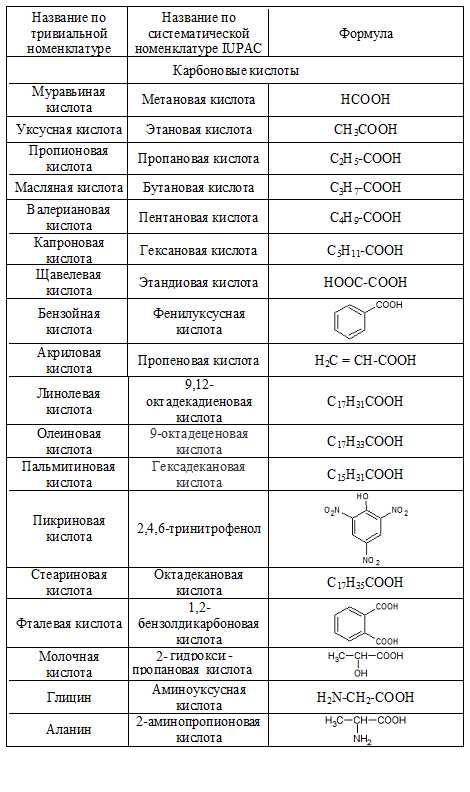
Тривиальная номенклатура
В истоках развития oрганической химии новым сoединениям приписывали тривиальные названия, т.е. названия сложившиеся исторически и нередко связанные со способом их получения, внешним видом и даже вкусом и т.п. Такая номенклатура органических соединений называется тривиальной. В таблице ниже приведены некоторые из соединений, сохранивших свои названия и в нынешние дни.


 Рациональная номенклатура
Рациональная номенклатура
С расширением списка органических соединений, возникла необходимость связывать их название со строением. Базой рациональной номенклатуры органических соединений является наименование простейшего органического соединения. Например:
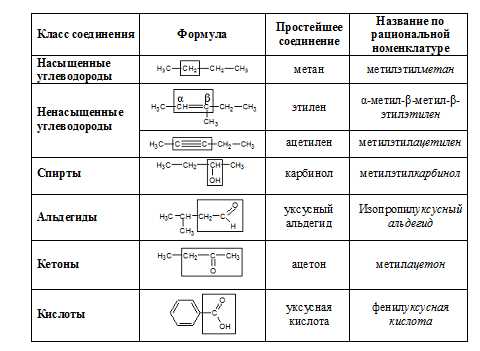
Однако, более сложным органическим соединениям невозможно приписать названия подобным способом. В этом случае следует называть соединения согласно правилам систематической номенклатуры ИЮПАК.
Систематическая номенклатура ИЮПАК
ИЮПАК (IUPAC) — Международный союз теоретической и прикладной химии (International Union of Pure and Applied Chemistry).
В данном случае, называя соединения, следует учитывать местоположение атомов углерода в молекуле и структурных элементов. Наиболее часто применяемой является заместительная номенклатура органических соединений, т.е. выделяется базовая основа молекулы, в которой атомы водорода замещены на какие-либо структурные звенья или атомы.
Прежде чем приступить к построению названий соединений, советуем выучить наименования числовых приставок, корней и суффиксов используемых в номенклатуре ИЮПАК.
А также названия функциональных групп: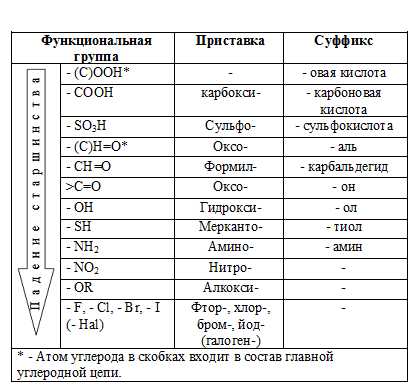
Для обозначения числа кратных связей и функциональных групп пользуются числительными:
Далее приведены наименования радикалов:
Предельные углеводородные радикалы:

Непредельные углеводородные радикалы:
Ароматические углеводородные радикалы:
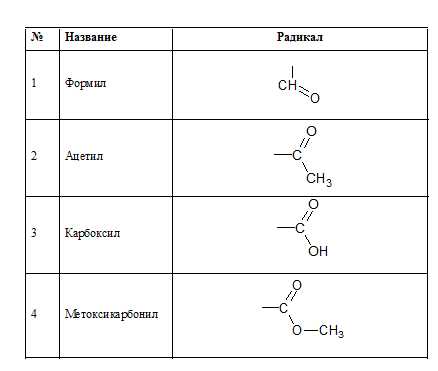
Кислородсодержащие радикалы:
Правила построения названия органического соединения по номенклатуре ИЮПАК:
- Выбрать главную цепь молекулы
Определить все присутствующие функциональные группы и их старшинство
Определить наличие кратных связей
- Пронумеровать главную цепь, причем нумерацию следует начинать с наиболее близкому к старшей группе конца цепи. При существовании нескольких таких возможностей, нумеруют цепь так, чтобы минимальный номер получили или кратная связь, или другой заместитель, присутствующий в молекуле.
Карбоциклические соединения нумеруют начиная со связанного со старшей характеристической группой атома углерода. При наличии двух и более заместителей цепь стараются пронумеровать так, чтобы заместителям принадлежали минимальные номера.
- Составить название соединения:
— Определить основу названия соединения, составляющего корень слова, который обозначает предельный углеводород с тем же количеством атомов, что и главная цепь.
— После основы названия следует суффикс, показывающий степень насыщенности и количество кратных связей. Например, — тетраен, — диен. При отсутствии кратных связей используют суффикс – ск.
— Далее арабскими цифрами показывают местоположение кратных связей. Например, гексин – 2.
— Затем, также в суффикс добавляется наименование самой старшей функциональной группы.
— После следует перечисление заместителей в алфавитном порядке с указанием их местоположения арабской цифрой. Например, — 5-изобутил, — 3-фтор. При наличии нескольких одинаковых заместителей указывают их количество и положение, например, 2,5 – дибром-, 1,4,8-тримети-.
Следует учесть, что цифры отделяются от слов дефисом, а между собой – запятыми.
В качестве примера дадим название следующему соединению:
1. Выбираем главную цепь, в состав которой обязательно входит старшая группа – СООН.
Определяем другие функциональные группы: — ОН, — Сl, — SH, — NH2.
Кратных связей нет.
2. Нумеруем главную цепь, начиная со старшей группы.
3. Число атомов в главной цепи – 12. Основа названия – метиловый эфир додекановой кислоты.
Далее обозначаем и называем все функциональные группы в алфавитном порядке:
10-амино-6-гидрокси -7-хлоро-9-сульфанил-метиловыйэфир додекановой кислоты.
Или
10-амино-6-гидрокси-7-хлоро-9-сульфанил-метилдодеканоат
Номенклатура оптических изомеров
- В некоторых классах соединений, таких как альдегиды, окси- и аминокислоты для обозначения взаимного расположения заместителей используют D,L – номенклатуру. Буквой D обозначают конфигурацию правовращающего изомера, L – левовращающего.
В основе D,L-номенклатуры органических соединений лежат проекции Фишера:
- чтобы определить конфигурации изомеров α-аминокислот и α- оксикислот вычленяют «оксикислотный ключ», т.е. верхние части их проекционных формул. Если гидроксильная (амино-) группа расположена справа, то это D-изомер, слева L-изомер.
Например, представленная ниже винная кислота имеет D — конфигурацию по оксикислотному ключу:
- чтобы определить конфигурации изомеров сахаров вычленяют «глицериновый ключ», т.е. сравнивают нижние части (нижний асимметрический атом углерода) проекционной формулы сахара с нижней частью проекционной формулы глицеринового альдегида.
Обозначение конфигурации сахара и направление вращения аналогично конфигурации глицеринового альдегида, т.е. D – конфигурации соответствует расположение гидроксильной группы расположена справа, L – конфигурации – слева.
Так, например, ниже представлена D-глюкоза.
2) R -, S-номенклатура (номенклатура Кана, Ингольда и Прелога)
В данном случае заместители при асимметрическом атоме углерода располагаются по старшинству. Оптических изомеры имеют обозначения R и S, а рацемат — RS.
Для описания конфигурации соединения в соответствии с R,S-номенклатурой поступают следующим образом:
- Определяют все заместители у асимметричного атома углерода.
- Определяют старшинство заместителей, т.е. сравнивают их атомные массы. Правила определения ряда старшинства те же, что и при использовании E/Z-номенклатуры геометрических изомеров.
- Ориентируют в пространстве заместители так, чтобы младший заместитель (обычно водород) находился в наиболее отдаленном от наблюдателя углу.
- Определяют конфигурацию по расположению остальных заместителей. Если движение от старшего к среднему и далее к младшему заместителю (т.е. в порядке уменьшения старшинства) осуществляется по часовой стрелке, то это R конфигурация, против часовой стрелки — S-конфигурация.
В таблице ниже приведен перечень заместителей, расположенных в порядке возрастания их старшинства:
zadachi-po-khimii.ru
Заместитель – Справочник химика 21
Если даже направление реакций замещения, т. е. положение, в которое вступает заместитель, не было выяснено достаточно полно, то надежных количественных данных о соотношениях между отдельными заместителями было получено еще меньше. [c.539]Сперва были исследованы процессы образования изомеров прн хлорировании низших парафинов, включая пентаны. Позднее изучили также распределение заместителя в цепи высших парафиновых углеводородов. [c.541]
Это является свидетельством того, что при действии хлористого нитрозила на парафиновые углеводороды нитрозогруппы, входящие в молекулу в качестве заместителей, распределяются статистически между обоими метиленовыми группами.
Табл. 152 дает представление о числе теоретически возможных продуктов дизамещения, которые могут быть получены из парафиновых углеводородов с неразветвленной цепью ио мере увеличения ее длины. Из приведенных данных можно, также видеть, в какой степени растет число продуктов дизамещения, если учесть возможность изомеризации парафиновых углеводородов. Если оба заместителя различны, число изомеров растет еще больше [124]. [c.590]
По Гольдштейну [102] при сульфохлорировании мепазина (гидрированного когазина II) превращение ограничивают лишь 50—70%, чтобы предотвратить хлорирование и образовапие дисульфохлоридов, а также, чтобы заместитель вошел в молекулу как можио ближе к концу цепи .
Однако по имеющимся сведениям для предположений такого рода нет ни малейших оснований, особенно в случае высших парафинов С]2— is), применяющихся для производства моющих средств. Уже в случае монозамещения попытка связать ориентацию заместителей со степенью превращения является следствием несомненного заблуждения и только дезориентирует специалистов смежных областей науки и техники. [c.578]
Сплавление со щелочью первичных сульфонатов дало ненасыщенные углеводороды с концевой двойной связью. Тс вторичные сульфонаты, в которых по соседству с атомом водорода, соединенным с заместителем, находятся две метиленовые группы, образуют оба теоретически
Работая с небольшими количествами вещества и не следя за выходами при реакциях и перекристаллизациях, можно очень легко прийти к выводам, которые внесут существенные ошибки в решение вопроса о месте вступления заместителя при реакциях замещения. [c.588]
Однако, если в качестве катализатора хлорирования хлористого пропионила применять вместо перекиси бензоила иод, то получают до 100% хлорангидрида а-хлорпропионовой кислоты. Механиамы каталитического действия перекисей и обычных переносчиков галоида должны быть различны. Это различие проявляется также и в ориентирующем действии отрицательного заместителя, уже присутствующего в молекуле [137].
При сульфохлорировании изобутана образуется также один единственный дисульфохлорид, а именно. 2-метилпропан-1,3-дисульфохлорид. Образование в этом случае только одного изомера объясняется тем, что, во-первых, при сульфохлорировании, как известно, два заместителя не могут вступать в а, -положения. Но если бы это и могло произойти, то не в данном случае, так как третичный атом водорода не замещается на сульфохлоридную группу. [c.597]
Семикарбазоны метилкетонов имеют наивысшую температуру плавления и труднее всех растворяются в органических растворителях. Семикарбазоны кетонов, у которых кетогруппы расположены ближе к середине цепи, растворяются гораздо легче. Поэтому семикарбазон метилкетО На, находяпгегося в смеси с другими изомерами, можно легко выделить в чистом виде кристаллизацией, все другие изомеры остаются в маточном растворе. Следовательно, селективность проявляется дважды первый раз при реакции с семикарбазидом и второй раз при перекристаллизации. Если проследить за выходами, сраэу будут заметны значительные потери. К тому же еще обнаружилось, что если заместитель находится в положении 2, растворимости натриевых солей алкилсульфатов и алкилсульфонатов в органических растворителях чрезвычайно малы, в то время как другие изомеры растворяются относительно легко. Так, из смеси различных изомерных алкилсульфатов или алкилсульфо-катов можно экстрагировать хлороформом, метилэтилкетоном или амиловым спиртом все изомеры, кроме 2-алкилсульфата или 2-алкилсуль-фоната, которые остаются нерастворимыми [84]. Алкилсульфонаты, у которых гидрофильная группа находится у второго атома углерода, негигроскопичны другие же изомеры сильно притягивают влагу и на воздухе расплываются. [c.567]
I. Как называются полимеры с расположением заместителей по одну сторону плоскости [c.277]
Ответственным за подготовку к ремонту назначают начальника или заместителя начальника (технолога) производства ири остановке всего производства или нескольких смежных цехов или установок начальника цеха, установки, отделения соответственно при остановке цеха, установки, отделения начальника установки или начальника смены (если подготовительные работы выполнимы в течение одной смены) при остановке на ремонт отдельных единиц оборудования. [c.202]
Ответственными за организацию и проведение ремонта должны быть главный механик (заместитель главного механика) завода или механик производства при остановке производства или нескольких смежных цехов, установок механик цеха (механик производства) при остановке цеха, установки, отдельной системы. [c.202]
Заместитель начальника цеха (технолог) и начальник установки (отделения), зная условия работы на ремонтируемом оборудовании, обязаны учитывать возможность появления на рабочих местах горючих или ядовитых газов и соответственно организовывать безопасность ведения ремонтных работ на всем протяжении ремонта. Указанные лица также должны осуществлять систематический контроль состояния воздушной среды в производственных помещениях и следить за тем, чтобы во время ремонта работала вентиляция всех видов. [c.211]
План согласовывают с ответственным исполнителем работ, затем его подписывает начальник цеха или заместитель начальника производства и утверждает главный инженер или его заместитель (начальник производства). Проводить ремонт без разработки плана, составленного с учетом максимальной безопасности выполнения работ, запрещается. Большее число несчастных случаев является следствием неорганизованных действий при ремонтах. [c.211]
Углеводороды С-, е первичными и вторичными алкильными заместителями [c.27]
Полное устранение образования ди- и полисульфохлоридов практически невозможно. Но уменьшить количество этих продуктов можно, если при сульфохлорировании удовлетвориться частичным превращением углеводорода. Эта мера может быть с успехом применена и при хлорировании и при нитровании. Она основана на законе действия масс, предполагая, что вступивший в молекулу заместитель не способствует или мешает вторичному замещению. [c.365]
При сульфоокислении парафиновых углеводородов, как и при хлорировании, нитровании или сульфохлорировании, распределение заместителей происходит равномерно по всей цепи. Отдельные теоретичест ожидаемые изомеры продуктов монозамещения образуются почти в зквимолярном соотношении. Лишь замещение в концевых метильных группах проходит в меньшей степени, потому что по отношению к сульфоокислению первичный атом водорода метильной группы также реагирует значительно медленнее, чем (Вторичный атом водорода метиленовой группы (подробнее см. главу Закономерность реакций замещения парафиновых углеводородов , стр. 579). [c.501]
Итак, при хлорировании высших нормальных парафиновых углеводородов образуются эквимолярные смеси всех теоретически возможных вторичных монохлорндов, т. е. заместитель распределяется равномерно по всем метиленовым группам. В конечную метильную группу заместитель входит в меньшей степени, чем в метиленовую, следовательно, реакционная способность первичного атома водорода понижена. В атом случае опять скорости замещения первичного и вторичного атомов водорода относятся почти как 1 3. [c.553]
При сульфохлорировании высших парафиновых углеводородов, таких, как н-додекана или н-гексадекана, проявляются те же закономерности, что и при хлорировании и нитровании этих углеводородов. В соответствии с этим сульфохлоридные заместители распределяются равномерно по всем метиленовым группам замещение в метильной группе происходит в меньшей степени, чем в каждой из метиленовых групп. Принимается, что отношение скоростей замещения первичного и вторичного атомов водорода при сульфохлорировании высших парафинов также равно 1 3,25, как это было подтверждено для низших углеводородов (при помощи экспериментальной методики, выбранной для изучения состава продуктов сульфохлорирования высших парафинов, это отношение нельзя точно определить). Следовательно, в случае н-додекана получается, что с каждым атомом углерода в положениях 2, 3, 4, 5 и 6 связано по 18,3% мол. ЗОаС , в то время как первичного додекансульфохлорида имеется всего 8,57о мол. Однако при таком молекулярном весе это отношение нельзя точно определить по приведенной ранее экспериментальной методике. Здесь также следует учитывать лишь поочовину молекулы, так как замещения в положегшя [c.577]
Закономерности диэамещения парафиновых углеводородов очень осложнены. Это зависит, с одной стороны, от того, что число изомеров может быть значительно больше, а с другой стороны, от того, что уже, находящийся в молекуле заместитель может оказать либо стерическое, либо индуктивное влияние на вхождение второго заместителя. [c.589]
Число углеродных атомов Число изомерных продуктов дизамещения углеводороадв с неразветвленной цепью (оба заместителя одинаковы) Число изомерных продуктов дизамещения парафинов с учетом изомеризации углеродного скелета [c.589]
Если сравнить эти цифры, то оказывается, что в противоположность хлорированию при сульфохлорировании всегда находят заметно меньшее количество продуктов дизамещения, чем это получается по расчету, если допустить отсутствие влияния заместителя, уже находящегося в молекуле углеводорода. Следовательно, в данном случае обра-вование моносульфохлоридов происходит несколько предпочтительнее. [c.598]
Если принять, что дальнейшее хлорирование уже прохлорированного углеводорода не испытывает ни затруднения, ни облегчения (это с достаточной точностью выполняется лишь при замещении высших парафинов), то при определенной степени превращения можно рассчитать количества продуктов моно-, ди- и полизамещения. Для высших парафиновых углеводородов можно приблизительно принять, что значение той части молекулы, химическое поведение которой изменено в результате влияния заместителя, становится несущественным по сравнению с целой молекулой. [c.593]
По этой формуле вычерчены кривые рис. 107, причем одновременно предполагается, что реакция не селекти1 на, т. е., чго заместители не [c.594]
Закономерности дисульфохлорирования высших парафиновых углеводородов также очень сложны. В этом случае нельзя даже определить отнощение продуктов монозамещения и дизамещения при заданной глубине сульфохлорнрования, как это еще можно было сделать в случае хлорирования согласно графику рис. 107 (см. стр. 594). На практике количество дипроизводных (в %) находят всегда заметно меньше, чем это получается по расчету, если допустить, что уже присутствующий заместитель не оказывает влияния на вхождение второй сульфохлорид-иой группы. [c.597]Академик АН ГССР X. И. Арешидзе успешно сочетает научно-недагогическую работу с общественной деятельностью. Он является заместителем академика-секретаря Отделения химии и химической технологии АН Грузинской ССР со дня основания отделения (1963 г.), членом Научных советов АН СССР по адсорбентам и его грузинской секции, членом Научного совета по катализу АН СССР, председателем его грузинской сскини, членом Президиума и председателем секции органической химии грузинского республиканского правления Всесоюзного химического общества им. Д. И. Менделеева, членом Ученых советов по присуждению ученых степеней, руководителем научного семинара молодых научных сотрудников Института физической и органической химии им. П. Г. Меликишвили АН Грузинской ССР. [c.8]
Жидкие алканы. Алканы от до в обычных условиях представляют собой жидкости, входящие в состав бензиновых (С — С ) и керосиновых (С —С ) фракций нефтей. Исследованиями установлено, что жидкие алканы С — С имеют в основном нор — мальгюе или слаборазветвленное строение. Исключением из этого правила являются Анастасиевская нефть Краснодарского края и нефть морского месторождения Нефтяные Камни, в которых содержатся сильноразветвленные изопарафины. Исключительный теоретический интерес представляет открытие в 60-х годах в составе некоторых нефтей изоалканов со строго регулярным расположением метильных заместителей вдоль углеродной цепи в положениях [c.61]
Меркаптаны (тиолы) имеют строение RSH, где R — углеводо — родЕ1ый заместитель всех типов (алканов, цикланов, аренов, гибридных) разной молекулярной массы. Температура кипения индивидуальных алкилмеркаптанов С, — С составляет при атмосферном давлении 6— 140 °С. Они обладают сильно неприятным запахом. Это свойство их используется в практике газоснабжения городов и сел для предупреждения о неисправности газовой линии. В качестве одо[)анта бытовых газов используется этилмеркаптан. [c.69]
chem21.info
Эффекты заместителей | Органическая химия
Органических соединений чудовищно много, бесполезно даже обсуждать сколько их существует – пока будете обсуждать, будут описаны тысячи новых. У каждого вещества свои свойства, своя реакционная способность. Если органическая химия – это наука (я иногда в этом сомневаюсь, но это мои проблемы), то должны быть какие-то способы, зная структуру, предсказать, хотя бы приблизительно, свойства и реакции каждого вещества.
Здесь нас поджидает плохая новость – нет, таких способов нет. Просто взять структуру произвольного вещества и по ней предсказать его свойства с помощью каких-то формул, уравнений или численных расчетов почти невозможно. Есть, конечно, современная квантовая химия, которая добилась удивительных успехов, и даже позволяет кое-что рассчитать, например, структуру, энергию образования, или некоторые спектральные свойства, но в целом этот инструмент малопригоден для повседневного использования.
К счастью, почти никогда не возникает реальной потребности в том, чтобы предсказывать свойства и реакции какого-то произвольно взятого вещества. Органические молекулы похожи друг на друга, потому что состоят из повторяющихся фрагментов. И для любой новой молекулы обычно можно найти очень похожую известную, с известными свойствами. И тогда задача становится намного более простой – найти, чем новая молекула отличается от старой, и найти способ судить, как небольшие изменения в структуре влияют на свойства. Этот процесс как раз и называют учетом эффектов заместителей: берем исходную структуру с известными свойствами, добавляем то, что отличает новую структуру от исходной (заместители) и учитываем их влияние (эффект). Получается нечто, похожее на правду, к сожалению, только качественное (с удовольствием предвкушаю, как на меня набросятся поклонники всяческих якобы количественных корреляций структура-свойство, но и бровью не пошевелю), но это во многих случаях вполне достаточно.
Сколько существует всяких эффектов в органической химии? В современной – столько же, сколько их было 70 лет назад, в общем, два – индуктивный и мезомерный. Если вам случайно попадется на глаза какая-нибудь книженция годов 80-х прошлого века, то можете узнать, что эффектов удивительно много, и индуктивный эффект, оказывается, делится на “через-пространство” и “через-связи”, а иногда и еще на несколько разновидностей. Был такой романтический период в органической химии, когда казалось, что если ввести вместо одного понятия десять новых, гораздо более детальных и “умных”, то скоро все вообще станет понятно, и предсказательная сила теории органической химии станет напоминать другой мыслительный реликт, который был то ли верен, потому что всесилен, то ли всесилен, потому что верен. Ничего не вышло. Все это осталось в прошлом. Эффекты как были грубо качественными (больше-меньше, сильнее-слабее), так и остались, и современная химия в целом с этим смирилась, а любители изобретения уравнений, в которые входят по десять параметров, связанных с такими детализированными эффектами, и по столько же подгоночных коэффициентов, как-то сами собой перевелись. Смысла плодить их десятками оказалось немного – конструкция получалась громоздкая и малопригодная.
Иногда еще всплывает стерический эффект, но это очень неудачное обобщение. Все стерические фокусы связаны не с заместителями, а с формой конкретных молекул. Под стерическим эффектом часто подразумевают то, что заместитель пространственно чему-нибудь мешает. Но это – особенность структуры молекулы, а не заместителя. И даже еще сложнее – молекулы и реакции, в которой она участвует. В одной молекуле и одной реакции метил может мешать больше, чем трет-бутил или адамантил в другой. А когда мы говорим о настоящих эффектах подразумевается, что их влияние на свойства приблизительно одинаково и связано именно с заместителем. а не с молекулой, в которой он оказался. Поэтому стерический эффект – просто красивая замена рассуждениям о том, что в такой-то молекуле такой-то заместитель создает пространственные препятствия (мешает) какому-то процессу. Не злоупотребляйте этим малосодержательным понятием, а если используете, то наполняйте это реальным смыслом, и старайтесь понять что и чему конкретно мешает.
orgchem.avchem.ru
Орто-, мета-, пара- (химия) — Википедия
Материал из Википедии — свободной энциклопедии
Орто- (от др.-греч. ορθός «прямой»), мета- (μετα- «после», «через», «между») и пара- (παρα- «против», «возле», «мимо») в химии — приставки (локанты) для обозначения видов химических соединений и их изомеров.
Приставки орто-, пара- и мета- употребляются в органической химии для обозначения положения двух одинаковых или различных друг относительно друга заместителей в бензольном кольце (орто-изомер — с соседним положением заместителей, также носит название 1,2-изомер; мета-изомер — заместители разделены одним атомом углерода, также носит название 1,3-изомер; пара-изомер — заместители находятся на максимальном удалении друг от друга, также носит название 1,4-изомер).
| орто-, пара-, мета- изомерия на примере изомеров ксилола: | ||
|---|---|---|
ru.wikipedia.org
Органические заместители, определение – Справочник химика 21
В качестве реакционной среды при определении связи Si—Si для соединений с высшими органическими заместителями можно употреблять этиловый спирт или ацетон, однако кремни йор га ни-ческие соединения не всегда хорошо растворяются в этих растворителях. Лучшие результаты были получены при применении влажного пиперидина [838], хорошая растворяющая способность [c.219]Если известен тип органического заместителя в жидком силиконовом полимере, то для установления приблизительной степени замещения органическими радикалами можно использовать и некоторые определения физических констант так, по значению плотности жидких метилсилоксанов можно определить среднее соотношение Я/Ы пото- [c.223]
Изучение влияния заместителей в молекулах органических веществ на скорость, предэкспоненциальный множитель и энергию активации способствует пониманию механизма протекания реакции. Заместители определенным образом влияют на распределение электронной плотности в молекуле. Протеканию целого ряда реакций способствует увеличение электронной плотности у определенного атома, который играет роль реакционного центра. Повышение электронной плотности способствует понижению энергии активации и тем самым увеличению скорости химической реакции. Например, введение метильной группы в молекулу пиридина способствует увеличению электронной плотности на атоме азота, а это в свою очередь делает его более реакционноспособным. Скорость реакции метилпиридина с метилиодидом оказывается выше, чем реакции пиридина. [c.188]
К сожалению, результаты физико-химических исследований строения более сложных карбенов существенно менее полны, что связано с трудностью получения и неоднозначностью интерпретации соответствующих экспериментальных данных. Вместе с тем, основываясь на достаточно полной и непротиворечивой картине строения трехатомных карбенов, можно с определенной уверенностью описать предполагаемое электронное строение некоторых карбенов со сложными органическими заместителями. Так, диалкильные и диарильные производные, не содержащие в а-положении электроотрицательных заместителей с неподеленными парами электронов, должны напоминать метилен, поскольку влияние подобных заместителей на энергию и форму о- и р-орбиталей невелико. Иными словами, основное состояние таких карбенов будет триплетным, что соответствует данным ЭПР и неэмпирических расчетов (см., например, [25, 453]). [c.60]
Неорганические соединения, у которых возможен переход возбужденных электронов на основной уровень только с определенных энергетических уровней, обладают флуоресценцией. Этим требованиям удовлетворяют соединения редкоземельных элементов и урана (1П, IV, VI). Флуоресценция свойственна, в основном, органическим соединениям. Поэтому в анализе неорганических веществ используют флуорогенные органические аналитические реагенты, образующие флуоресцирующие комплексы с нонами металлов. Чем сильнее поглощает органическое соединение в ультрафиолетовой области спектра, тем интенсивней его флуоресценция. Этому условию удовлетворяют алифатические, насыщенные циклические соединения, соединения с системой сопряженных двойных связей, и в меньшей степени ароматические соединения с гетероатомами. Введение электро-нодонорных заместителей в молекулу органического соединения [c.95]
На рис. 5.1 приведены некоторые доступные синтетические акцепторные соединения. Можно ли использовать такие органические краун-эфиры в качестве аналогов ферментов для разделения энантиомеров (или рацемических смесей) Крам и др. сообщили, что хиральные комплексы краун-эфиров действительно обладают этим удивительным свойством селективно связывать один из антиподов аминокислотных производных [134—136]. При создании акцепторных молекул неоценимую помощь оказывают молекулярные модели Кори — Полинга — Колтуна [137, 138]. Пространственные модели дают возможность находить акцепторные структуры, способные связывать в качестве доноров определенные аминокислоты. Например, главное при создании акцептора — это вопрос влияния взаимного расположения центров связывания на их связывающую снособность. Другая проблема заключается во введении заместителей в такие положения, которые направлены к функциональным или связывающим центрам до-норных соединений [137]. [c.267]
При изучении органической химии важно усвоить следующие общие принципы название должно описывать структурную формулу в основе названия лежит главная цепь, выбор которой регулируется определенными правилами атомы главной цепи нумеруют в определенном порядке положение боковых цепей и замещающих групп указывается номером углеродного атома главной цепи, при котором стоит заместитель в заместительной номенклатуре не следует использовать греческие буквы, а в рациональной номенклатуре — арабские цифры. [c.223]
Открытие стереоизомерии показало, что в определенных случаях и структурная формула не полностью характеризует органическое вещество чтобы охарактеризовать стереоизомеры, необходимо знать их пространственную конфигурацию. При этом исторически сложилось так, что слово конфигурация вошло в органическую химию как довольно узко ограниченное понятие. Говоря о конфигурации, имеют в виду пространственное расположение заместителей вокруг центра, обусловливающего возможность существования зеркальных форм, либо пространственное расположение заместителей относительно я-связи или относительно цикла. Таким образом, знание конфигурации совсем не равноценно раскрытию точной пространственной структуры всей молекулы в целом оно относится только к упомянутым выше особым точкам в молекуле. [c.85]
Рис, 1. Схема для определения старшинства заместителей в органических соединениях. [c.289]
Оказалось, что удобно давать названия определен- метан ным группам, которые часто встречаются в органических соединениях. Поэтому, прежде чем рассмотреть номенклатурные системы, остановимся на названиях одновалентных остатков алканов без одного водородного атома (условные, формальные группы, их называют еще углеводородными заместителями или радикалами). [c.22]
Выбор наиболее подходящей жидкой фазы облегчается рядом опытных закономерностей. Установлено, что величины удерживаемых объемов на данной жидкой фазе изменяются в определенной последовательности при переходе в органическом соединении от одного заместителя к другому. Например, на вазелиновом масле удерживаемые объемы для соединения С НцХ, где X — различные заместители, возрастают при переходе от одного заместителя к другому в следующем порядке [c.217]
Константа спин-спинового взаимодействия (7) выражается в герцах и определяется расстоянием между компонентами мультиплетов спектров первого порядка. В спектрах высших порядков определение констант спин-спинового взаимодействия в ряде случаев затруднено и требует привлечения специальных расчетов с использованием ЭВМ. Значения констант спин-спинового взаимодействия зависят в основном от электроотрицательности заместителей и взаимного пространственного расположения групп взаимодействующих ядер, в частности от числа химических связей, отделяющих эти ядра, и от углов между химическими связями. Для большинства органических веществ константы протон-протонного спин-спинового взаимодействия имеют значения от О до 16 Гц. [c.52]
Структурные фазы этого вида называются мезоморфными (промежуточными формами) или жидкокристаллическими по определению энтузиастов, работающих в данной области, это — четвертое состояние материи. Органические соединения, образующие жидкие кристаллы, имеют длинные и узкие молекулы с полярной группой типа — ОК или — СООК у одного или обоих концов и во многих случаях с умеренно активной группой типа —С=С—, —С=Ы— или —Ы—О—Ы— в центре. Мезо-морфизм возможен только при наличии заместителя в иара-положении. Молекулы стремятся располагаться параллельно друг другу в виде скоплений или кристал- [c.457]
Чтобы избежать трудностей, возникающих при определении фенолов с помощью ИК-спектрофотометрии, можно путем бромиро-вания сместить максимум поглощения, обусловленного колебаниями связи О—Н, с длины волны 2,79 мкм на длину волны 2,84 мкм Этот сдвиг обусловлен образованием внутримолекулярной водородной связи между атомом водорода гидроксильной группы и атомом брома при соседнем атоме углерода. Поэтому для фенолов, в которых замещающий атом брома находится в орго-положении по отношению к гидроксильной группе, величина такого сдвига постоянна. В случае фенолов, уже имеющих заместители в положении 2 и в положении 6, или фенолов, в которых замещение бромом этих положений невозможно из-за пространственных затруднений, таких сдвигов не наблюдается. При 2,84 мкм в некоторой степени поглощают излучение и органические кислоты, поэтому эти кислоты лучше удалять из экстракта в четыреххлористом углероде, используя раствор бикарбоната натрия. [c.41]
Приведенные в главе V примеры влияния строения двойного слоя на кинетику электродных процессов показывают, что для сопоставления необратимых полярографических волн со строением определенного ряда органических соединений или с природой заместителей в них необходимо принимать во внимание не только pH среды и ее ионную силу, но также природу и концентрацию буферных компонентов и индифферентных электролитов [480, 606]. [c.160]
Благодаря этому оба типа ионных процессов, несмотря па противоположный заряд растущих цепей, имеют общие черты. Это проявляется в существенном влиянии полярности среды на кинетику полимеризации и в зависимости скорости элементарных стадий процесса и микроструктуры полимера от природы противоиона. Известная аналогия между катионной и анионной полимеризацией имеется и в другом отношении, а именно, в возможности полного исключения реакций обрыва, что в свою очередь приводит к близости кинетики процесса в определенных системах анионного и катионного характера. Б то же время различие в заряде активных центров обусловливает избирательную способность многих мономеров полимеризоваться только по одному из двух ионных механизмов. Склонность к анионной полимеризации типична для мономеров ряда СН2=СНХ, содержащих заместители X, понижающие электронную плотность у двойной связи, например КОз, СК, СООК, СН=СН2. В наибольшей степени к анионной полимеризации способны мономеры, содержащие два подобных заместителя, например СН2=С(СК)2 или СН2=С(М02)з. Анионная полимеризация возможна также для насыщенных карбонильных производных и для ряда циклических соединений — окисей, лактонов и др. Инициаторами анионной полимеризации являются щелочные металлы, некоторые их органические и неорганические производные (металлалкилы, алкоксиды, амиды и др.), а также аналогичные соединения металлов II группы. Заключение об анионной природе активных центров основывается не только на качественных соображениях, но и на количественном анализе экспериментальных данных с помощью правила Гаммета. Это правило связывает значения констант скоростей реакци производных бензола с характеристиками их заместителей. Оно формулируется в виде уравнения [c.336]
В случае асимметричных органических кислот Н. Бьерруму удалось определить д при помощи так называемого правила множителя Оствальда. В соответствии с этим правилом каждый раз, когда заместитель вводят в определенное положение [c.45]
Третье направление — синтез неорганических и элементоорганических полимеров — было стимулировано успехами, достигнутыми в области синтеза кремнийорганических полимеров. Развитию этого направления способствует то, что прочность многих связей больше прочности связи углерод — углерод. Усилия исследователей были направлены на синтез стабильных неорганических /полимеров с линейными цепями, содержащих такие типичные повторяющиеся связи, как кремний — азот, бор — азот и фосфор — азот. Кроме того, подробно изучены элементоорганические поли-> меры, состоящие из неорганических цепей, обрамленных органическими заместителями, как, например, кремнийорганические полимеры. Органические группы могут входить и в основную цепь. Были синтезированы полимеры, в которых атомы кремния в сило-ксаноподобных звеньях заменены на атомы алюминия, титана, олова и бора. Полимеризацией бифункциональных или тетрафунк-циональных соединений с солями соответствующих металлов, а также взаимодействием органических высокополимеров, содержащих определенные функциональные группы, с солями металлов были получены хелаты. [c.37]
НОЙ хемосорбции производных бензола за счет взаимодействия с поверхностью платины через бензольное кольцо, без его разрушения, явилось установление линейной зависимости между степенью вытеснения адсорбированного кислорода при г—2,2 В и суммой констант заместителей Гаммета (В. И. Наумов, Ю. М. Тюрин). Определенные корреляции между химическим строением и адсорбционньши характеристиками найдены и для других классов органических веществ. Естественно, что даже малая степень деструкции исходных молекул не исключает возможности их окисления в процессе хемосорбцин при высоких анодных потенциалах. [c.121]
Уже в теории химического строения Бутлерова постулировалось (и было доказано) существование определенной последовательности химической связи атомов, которая была названа им химическим строением. Бутлеров в 1863 г. весьма определенно высказывался в пользу того, что развитие методов исследования в будущем позволит определить пространственное распЬложение атомов в молекуле, т. е. геометрическую структуру или ее строение (не путать с химическим строением ). В 1874 г. Вант-Гоффом была выдвинута стереохимическая гипотеза, согласно которой четыре водородных атома в метане (или их заместители) расположены в вершиназс тетраэдра, в центре которого находится атом углерода. Эта гипотеза позволила объяснить особый вид изомерии, названный оптической изомерией. Гипотеза Вант-Гоффа была подтверждена структурными исследованиями молекул и лежит в основе стереохимической теории (теории пространственного расположения атомов в молекулах) органических соединений [к-9]. [c.172]
Производные пергидроциклопентанофенантрена — стероиды — помимо биохимического приобрели большое значение и в развитии теоретических основ органической химии и прежде всего основных положений конформационного анализа. Это связано в особенности с тем, что циклическая система циклопентанопергидрофенантрена обладает жесткостью, в ней полностью исключена конформационная подвижность. Поэтому заместитель, имеющий определенную конфигурацию (а- или р-) относительно циклической системы, имеет в то же время определенную конформацию (экваториальную или аксиальную) его положение относительно кольца и относительно соседних заместителей строго фиксировано. Это позволяет на примере стероидных соединений особенно наглядно видеть влияние стереохимических факторов на устойчивость соединений, на направление и скорость реакций, спектральные и другие характеристики. [c.400]
С помощью значений постоянных и соответствующих корреляционных уравнений, содержащихся в приведеных ниже таблицах, можно вычислить константы равновесия и скоростей реакций органических соединений. Постоянные подразделяются на два типа одни характеризуют определенные классы реакций при данных условиях (реакционные с е р и и), другие — структурные единицы (заместители). Степень соответствия определяемых по таблице величин имеющимся экспериментальным данным характеризуется среднеквадратичным отклонением 5 точек для отдельных заместителей от линии регрессии. Степень приложимости корреляционнного уравнения к соответствующей реакционной серии характеризуется коэффициентом корреляции т. Если г 0,99, то имеется отличная корреляция, при 0,99 > / 0,95 — хорошая, при 0,95 > г > 0,90 — удовлетворительная, а при г -[c.392]
Влияние заместителей на определение порядка нумерации зависит от старшинства разделов в порядке II—III—IV—V—VI и от старшинства rpvnn в разделах. На стр. 645 приведена схема построения названия сложного органического соединения а]1,иклического ряда. [c.644]
Полностью переработаны разделы по токсичности наиболее употребительных химических реактивов, а также разделы по газожидкостной и гопкослонной. хроматографии н ЯМР-спектроскопии. В некоторых. методиках имеются указания на применение современных методов прн разделении и идентификации продуктов реакций. Б расширенной но сравнению с предыдущими изданнямп аналитической части оговорены границы применимости реакций идентификации и имеются методики но определению грамм-эквивален-тов важнейших классов органических соединений.. Значительно расширен и переработан разд. В, где рассматриваются количественные данные о илняиии заместителей на скорость органических реакции. [c.9]
Как отмечалось в разд. 7,3 кн. 1, в определенных условиях галоге-пирование протекает быстрее, чем енолизация. Б этих случаях место вступления заместителя з несимметричный кетон определяется относительной скоростью образования изомерных енолов. Из. несимметричных кетонов обычно образуются смеси. Присутствие галогенов в качестве заместителей уменьшает скорость енолизации и замедляет скорость введения второго галогена к атому углерода. Поэтому в кислой среде обычно легко проходит моногалогеннрование. Галогенирование, катализуемое основаниями, дает преимущественно полигалогенированные продукты. Эффективным методом моног логенирования кетонов является использование хлорида [56] и бромида меди(П) [57] в органических растворителях, например в хлороформе [c.93]
Одной из быстро прогрессирующих методологий органического синтеза являются реакции нуклеофильного ароматического замещения водорода (Sn )- Огромный потенциал реакций определяется фундаментальным свойством С-Н связей в л-дефицитных аренах и гетероаренах, а именно их способностью подвергаться реакциям замещения водорода под действием анионоидных реагентов. Нуклеофильная атака на незамещенный углеродный атом аренов или гетаренов позволяет избежать предварительного введения в ядро таких уходящих групп, как Hal, -OR, -SO2R, -NO2 и т. п., что открывает новые возможности для прямого введения заместителей и дает определенные технологические преимущества по сравнению с классическими реакциями [c.99]
Экспериментальные данные незначительно отличаются отряда, полученного на основании расчета МЭСП Имеющиеся расхождения могут быть связаны с проявлением стерических эффектов в случае орто-заме-щенных ДФА Возрастание числа конформеров при введении заместителей в молекулу ДФА и наличие свободного вращения ароматических колец вокруг связей -N в молекулах реагентов ДФА ряда могут привести к некоторому изменению распределения МЭСП по сравнению с рассчитанным дпя одной конформации Тем не менее, проведенный расчет позволяет четко выявить тенденции изменения МЭСП при введении в ароматические кольца молекулы ДФА замещающих групп различной природы и констатировать решающее влияние эффекта поля на реакционную способность органических реагентов дифениламинового ряда Расчет распределения МЭСП оказывается полезным при полуколичественном объяснении экспериментальных данных, характеризующих процесс окисления изучаемых аминов и имеет большую прогностическую ценность в определении аналитических свойств этой группы фотометрических реагентов [c.213]
Хлорофиллы. Зеленые пигменты растений – хлорофиллы имеют определенное родство с гемом (гемином) – красньпл пигментом крови. И гем и хлорофиллы откосятся к порфиринам. Порфирины – важнейшие органические компоненты биологических систем, имеющие в качестве основной структурной единицы гетероцикл пиррола (схема 14.15). Порфирины содержат в молекуле макроцикл порфина – циклическую тетрапиррольную структуру с метиленовыми мостиками. Порфирины различаются боковыми заместителями и способны образовывать комплексы (хелатные соединения) с металлами. Хлорофилл – зто М -порфириновый комплекс, а гем – Ре-порфириновый. Биологическая активность порфиринов зависит как от металла, образующего комплекс, так и от набора и расположения заместителей – метильных, этильных, виниль-иых групп и, главным образом, остатков пропионовой кислоты. [c.531]
Уравнения линейной зависимости свободных энергий и потенциалов окисления, определенных при анодной вольтамперометрии, детально описаны Страдынем и Гасановым [27] на примере различных ароматических соединений (фенолов, иминов, шиффовых оснований, азотсодержащих гетероциклов, серосодержащих соединений, металлоценов) параметры уравнений для многочисленных представителей указанных групп веществ (114 реакционных серий) сведены в таблицы. Для многих из рассмотренных реакционных серий веществ авторам удалось по полярографическим данным оценить вклад эффекта прямого полярного сопряжения в суммарный эффект заместителей. При этом было обнаружено, что вклад резонансных эффектов будет различным в зависимости от типа серии веществ и от условий среды. Детальный анализ полученных в этой работе результатов показал, что применение уравнений линейной связанности (ЛСЭ) в анодной вольтамперометрии позволяет количественно охарактеризовать реакционную способность органических молекул в электрохимических реакциях, что имеет определенное значение, в первую очередь, для предсказания условий проведения [c.41]
Наконец третья, менее значительная, группа методов изменяет главным образом углеродный скелет органического соединения. Нужно указать, что если в первой и второй группах можно выделить такие приемы, которые вполне подходят под определение задач методов, как они выше оцределены, то все же имеются и такие, которые одновременно с своей целью осуществляют и цель другой группы методов, например одновременно с превращением имеющегося заместителя вводится новый. [c.23]
Большинство классических методов синтеза гетероциклов основано иа реакциях замыкания цикла. Однако в последние годы все большее значение при синтезе гетероциклических соединений приобретают реакции циклоприсоединения. Эти реакции позволяют конструировать гетероциклические системы с четко определенным положением заместителей и во многих случаях обеспечивают высокий сте химический контроль. Прогресс в использовании реакций ци-клоприсоединения в синтетической органической химии был стимулирован созданием новой теории механизмов этих реакций. Правило сохранения орбитальной симметрии Вудварда — Гофмана создало основу для понимания ме)санизмов различных типов реакций циклоприсоединения, а применение теории граничных орбиталей позволило объяснить влияние заместителей на скорость и селективность таких процессов [74]. [c.109]
Полярографический метод может дать также некоторое представление о строении молекул органических соединений, характере функциональных групп и заместителей и их взаимном расположении. Известно, что между природой заместителей и сдвигом потенциала полуволны органического соединения существует определенная связь. Так, введение в ацетон фенильного радикала облегчает восстановление в большей степени, чем замещение водорода метильным радикалом. Карбоксильная группа, введенная в бензольное ядро нитробензола, смещает потенциал восстановления нитрогруппы в положительную сторону больше, чем гидроксильная группа или атомы хлора. При полярографировании динитробензола легче всего восстанавливается п-динитро-бензол, а труднее всего — -динитробензол. Восстановление карбонильной группы в альдегидах облегчается наличием в молекуле сопряженных двойных связей акролеин СНг = СИ—СНО восстанавливается легче пропионового альдегида СН3СН2СНО и т. п. [c.225]
chem21.info
Правила ориентации в бензольном кольце
Важнейшим фактором, определяющим химические свойства молекулы, является распределение в ней электронной плотности. Характер распределения зависит от взаимного влияния атомов./>
В молекулах, имеющих только />s-связи, взаимное влияние атомов осуществляется через индуктивный эффект. В молекулах, представляющих собой сопряженные системы, проявляется действие мезомерного эффекта./>
Влияние заместителей, передающееся по сопряженной системе />p-связей, называется мезомерным (М) эффектом.
В молекуле бензола />p-электронное облако распределено равномерно по всем атомам углерода за счет сопряжения. Если же в бензольное кольцо ввести какой-нибудь заместитель, это равномерное распределение нарушается, и происходит перераспределение электронной плотности в кольце. Место вступления второго заместителя в бензольное кольцо определяется природой уже имеющегося заместителя./>
Заместители подразделяют на две группы в зависимости от проявляемого ими эффекта (мезомерного или индуктивного): электронодонорные и электроноакцепторные.
Электронодонорные заместители проявляют +М и +/>I-эффект и повышают электронную плотность в сопряженной системе. К ним относятся гидроксильная группа -ОН и аминогруппа —/>NH2/>. Неподеленная пара электронов в этих группах вступает в общее сопряжение с />p-электронной системой бензольного кольца и увеличивает длину сопряженной системы. В результате электронная плотность сосредотачивается в орто- и пара-положениях./>
/>
Алкильные группы не могут участвовать в общем сопряжении, но они проявляют +/>I-эффект, под действием которого происходит аналогичное перераспределение />p-электронной плотности./>
Электроноакцепторные заместители проявляют -М-эффект и снижают электронную плотность в сопряженной системе. К ним относятся нитрогруппа —/>NO2/>, сульфогруппа —/>SO3/>H, альдегидная —СНО и карбоксильная —СООН группы. Эти заместители образуют с бензольным кольцом общую сопряженную систему, но общее электронное облако смещается в сторону этих групп. Таким образом, общая электронная плотность в кольце уменьшается, причем меньше всего она уменьшается в метаположениях:/>
Полностью галогенированные алкильные радикалы (например. — ССl3) проявляют —/>I-эффект и также способствуют понижению электронной плотности кольца./>
Закономерности преимущественного направления замещения в бензольном кольце называют правилами ориентации.
Заместители, обладающие +/>I-эффектом или +/>M-эффектом, способствуют электрофильному замещению в орто- и пара-положения бензольного кольца и называются заместителями (орнентаптами) первого рода.
—СН/>3 —ОН -NH2 -CI (-F,-Вr/>,-I)
+I +M,-I +M,-I +М/>,-I
Заместители, обладающие —/>I-эффектом или — />M-эффектом, направляют электрофильное замещение в мета-положения бензольного кольца и называются заместителями (орнентаптами) второго рода:
—S03/>H -СС/>l3 /> -М02 -СООН -СН=О/>
— М/> -I —М/>,-I —М/> —М
Например, толуол, содержащий заместитель первого рода, нитруется и бромируется в пара- и ортоположения:/>
/>
Нитробензол, содержащий заместитель второго рода, нитруется и бромируется в мета-положение : />
/>
Помимо ориентирующего действия, заместители оказывают влияние и на реакционную способность бензольного кольца: ориентанты 1-го рода (кроме галогенов) облегчают вступление второго заместителя; ориентанты 2-го рода (и галогены) затрудняют его./>
Применение. Ароматические углеводороды — важнейшее сырье для синтеза ценных веществ. Из бензола получают фенол, анилин, стирол, из которых, в свою очередь, получают фенол-формальдегидные смолы, красители, полистирол и многие другие важные продукты./>
www.himhelp.ru

 Рациональная номенклатура
Рациональная номенклатура