Внутренняя энергия термодинамической системы
Термодинамика изучает количественные закономерности превращения энергии, обусловленные тепловым движением молекул. Основу термодинамики составляют два фундаментальных закона, являющиеся обобщением многовекового опыта человеческой деятельности и называемых началами термодинамики. Первое начало описывает количественную и качественную стороны процессов превращения энергии; второе начало позволяет судить о направлении этих процессов.
Одним из основных понятий термодинамики является внутренняя энергия.
Под внутренней энергией U в термодинамикепонимают энергию теплового движения частиц, образующих систему, и потенциальную энергию их взаимного положения.
Для идеального газа потенциальная энергия взаимодействия молекул считается равной нулю, и внутренняя энергия идеального газа представляет собой только кинетическую энергию теплового движения. Поэтому внутренняя энергия одного моля идеального газа равна:
| (8.1.1) |
внутренняя энергия для ν молей:
| (8.1.2) |
Из формулы (8.1.1) видно, что внутренняя энергия идеального газа пропорциональна абсолютная температуре.
Внутренняя энергия обладает следующими свойствами:
– в состоянии теплового равновесия частицы системы движутся так, что их полная энергия все время равна внутренней энергии;
– внутренняя энергия – величина аддитивная, т.е. внутренняя энергия системы тел равна сумме внутренних энергий образующих систему тел;
– внутренняя энергия системы является
| , |
где U2 и U1 – значения внутренней энергии в состояниях 1 и 2. Здесь dU – полный дифференциал. Изменение внутренней энергии системы может произойти, если: 1) система получает извне или отдает окружающим телам некоторую энергию в какой-либо форме; 2) система совершает работу против действующих на нее внешних сил.
Первое начало термодинамики.
Работа в термодинамике.
Первое начало термодинамики выражает закон сохранения энергии для тех макроскопических явлений, в которых одним из существенных параметров, определяющих состояние тел, является температура. Существует две формулировки первого начала термодинамики.
1) Приращение внутренней энергии системы всегда равно сумме совершаемой над системой работы
2) Обычно вместо работы А’, совершаемой внешними телами над системой, рассматривают работу А, равную (-А’), совершаемую системой над внешними телами. Подставив (-А) вместо А’ и выразив Q в уравнении (1), получаем:
Уравнение (8.2.1,б) выражает первое начало термодинамики: теплота, сообщенная системе в процессе изменения ее состояния, расходуется на изменение ее внутренней энергии и на совершение работы против внешних сил.
Внутренняя энергия может и увеличиваться и уменьшаться при передаче теплоты системе. Если энергия убывает (
Часто приходится разбивать рассматриваемый процесс на ряд элементарных процессов, каждый из которых соответствует весьма малому изменению параметров системы. Запишем уравнение (8.2.1,б) для элементарного процесса в дифференциальном виде:
где dU – малое изменение внутренней энергии; δQ – элементарное количество теплоты; δА – элементарная работа.
Между dU, δQ и δ
Из уравнений (8.2.1,б) и (8.2.2) видно, что если процесс круговой, т.е. в результате него система возвращается в исходное состояние, то DU = 0 и, следовательно, Q=А. В круговом процессе все тепло, полученное системой, идет на производство внешней работы.
Если U1=U2 и Q=0, то А=О. Это значит, что невозможен процесс, единственным результатом которого является, производство работы без каких бы то ни было изменений в других телах, т.е. невозможен перпетуум мобиле – вечный двигатель первого рода.
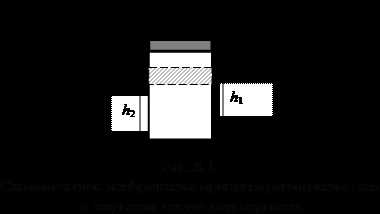 |
Рассмотрим процесс расширения газа. Пусть в цилиндрическом сосуде заключен газ, закрытый подвижным поршнем (рис.8.1).
Предположим, что газ расширяется. Он будет перемещать поршень, и совершать над ним работу. При малом смещении dh=h2-h1газ совершит работу
δA=F·dh,
где F –сила, с которой газ действует на поршень.
Учитывая, что
F=p·S
получим что, элементарная работа
δA= p·S·dh = p·dV, (8.2.3)
где dV= S·dh – малое изменение объема газа, р – давление газа в начале пути dh.
Работа, совершаемая при конечных изменениях объема, должна вычисляться путем интегрирования. Полная работа расширения:
(8.2.4)
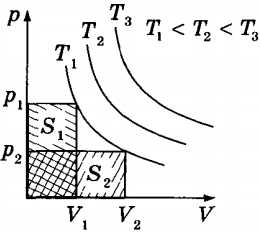
На графике зависимости давления газа от объема (рис.8.2.) работа равна площади фигуры, ограниченной двумя ординатами и функцией p(V).
Предположим, система переходит из одного состояния в другое, совершая работу по расширению, но двумя различными путями I и II: p1(V) и p2(V).
 |
Работа AI численно равна площади фигуры, ограниченной кривой I, АII – площади фигуры, ограниченной кривой II: AI № АII. Работа различна, следовательно, работа не является функцией состояния.
infopedia.su
Глава IV. Физические основы термодинамики
§22. Термодинамический метод исследования систем. Исходные положения термодинамики
Термодинамический метод исследования в отличие от статистического не учитывает внутреннего строения систем, а изучает превращения энергии в них. При этом изучаются преимущественно системы, находящиеся в состоянии равновесия, а также равновесные термодинамические процессы (§12).
Термодинамическая система называется изолированной, если она не может обмениваться энергией с другими системами (окружающей средой).
Если нет обмена энергией в форме теплоты, то система называется теплоизолированной.
К простейшим процессам, изучаемым в термодинамике, относятся следующие:
–изотермический, происходящий при постоянной температуре;
–изохорический
–изобарический (изобарный), происходящий при постоянном давлении;
–адиабатический (адиабатный), происходящий в системе без теплообмена с внешней средой.
Термодинамика в качестве основного исходного положения принимает (постулирует) следующее положение, вытекающее из опыта: изолированная термодинамическая система с течением времени всегда приходит в состояние термодинамического равновесия и никогда самопроизвольно выйти из него не может.
Следовательно, если система вначале была не изолирована и не находилась в равновесном состоянии, то после осуществления изоляции она, по истечении некоторого времени, перейдет в состояние равновесия.
Другое исходное положение термодинамики связанно с одним из основных понятий физики – температурой.
Опыт показывает, что если привести в соприкосновение два различно нагретых тела (две равновесные системы), то независимо от того, одинаковы или различны у них объемы (внешние параметры), более нагретое тело будет охлаждаться, менее нагретое – нагреваться. С течением времени новая система, образованная из двух, придет в другое равновесное состояние. Отсюда следует, что состояние каждой системы определяется не только ее внешними параметрами, но и еще одной величиной, характеризующей внутреннее состояние системы. Численные значения этой величины для различных равновесных систем при их тепловом контакте выравниваются. Эта величина, выражающая состояние внутреннего движения равновесной системы, определяемая внешними параметрами и энергией системы, называется температурой. Температура в этом смысле является мерой интенсивности теплового движения.
Существование параметра системы, называемого температурой, утверждается следующим исходным положением термодинамики:
состояние термодинамической системы определяется не только внешними условиями, но и температурой – внутренним параметром системы.
Это свойство обнаруживается как степень нагретости тела – холодное, теплое, горячее.
§23. Внутренняя энергия системы
Любая
термодинамическая система обладает
полной энергией W,
которая складывается из кинетической
энергии механического движения системы
как целого 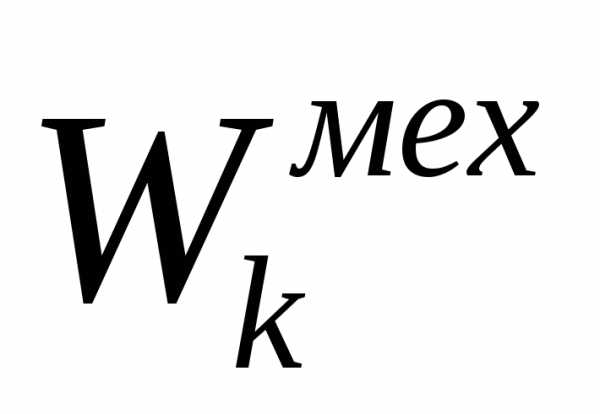 ,
потенциальной энергии
,
потенциальной энергии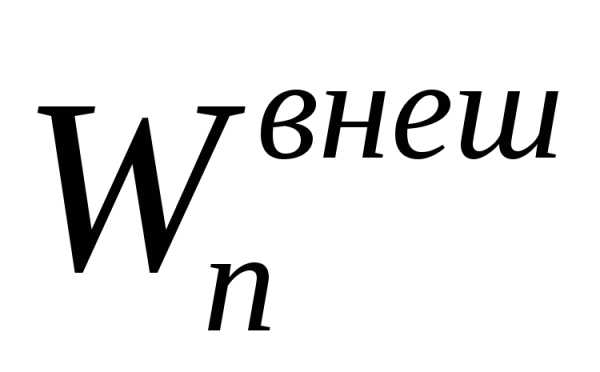 ,
зависящей от положения системы во
внешнем силовом поле (гравитационном,
электрическом или магнитном) и внутренней
энергии
,
зависящей от положения системы во
внешнем силовом поле (гравитационном,
электрическом или магнитном) и внутренней
энергии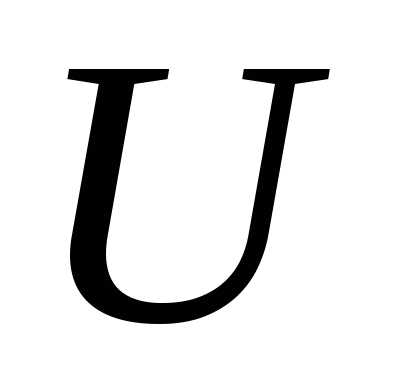 ,
зависящей только от термодинамического
состояния системы:
,
зависящей только от термодинамического
состояния системы:
. (23.1)
В термодинамике обычно рассматривают макроскопически неподвижные системы, не подверженные воздействию внешних полей. Поэтому, рассматривая процессы изменения энергетических состояний термодинамических систем, имеют в виду именно их внутреннюю энергию.
Под внутренней энергией системы понимают сумму энергий всех видов внутренних движений частиц в системе и энергию их взаимодействия. Например, внутренняя энергия газа многоатомных молекул (аммиак, углекислый газ и т.п.) состоит из
-кинетической энергии теплового поступательного и вращательного движений молекул;
-кинетической и потенциальной энергии колебаний атомов в молекулах;
-потенциальной энергии межмолекулярного взаимодействия;
-энергии электронных оболочек атомов и ионов;
-кинетической и потенциальной энергии взаимодействия нуклонов в ядрах атомов.
Р
1
а
b 2
V
Рис.23.1
Теоретически и опытным путем доказано, что внутренняя энергия термодинамической системы целиком и полностью определяется ее состоянием и не зависит от того, каким путем система пришла в это состояние.То есть внутренняя энергия является функцией состояния системы.
Иначе
говоря, изменение внутренней энергии
(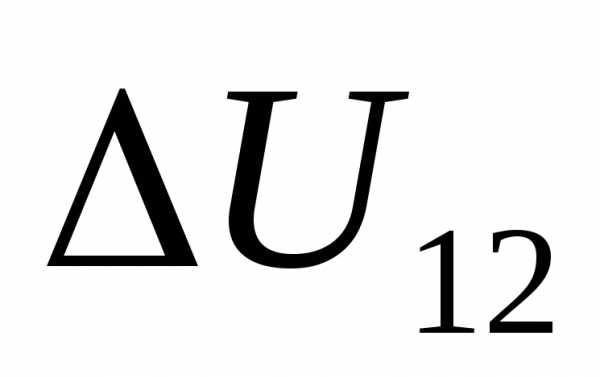 ),
равное разности внутренней энергии в
этих состояниях (
),
равное разности внутренней энергии в
этих состояниях ( ),
при переходе системы из состояния 1 в
состояние 2 (рис.23.1) не зависит от вида
перехода, то есть
),
при переходе системы из состояния 1 в
состояние 2 (рис.23.1) не зависит от вида
перехода, то есть
. (23.2)
В частности, если в результате какого-либо процесса система возвращается в исходное состояние (совершается круговой процесс), то полное изменение ее внутренней энергии всегда равно нулю:
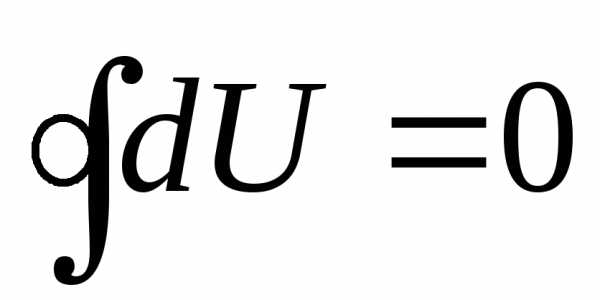 . (23.3)
. (23.3)
Внутренняя энергия системы, находящейся в термодинамическом равновесии, зависит только от ее температуры и внешних параметров. Например, внутренняя энергия газа постоянной массы зависит от температуры Т и объема V системы:
, (23.4)
так как энергия теплового движения молекул газа зависит от его температуры, а энергия взаимодействия молекул – от среднего расстояния между ними, то есть при данной массе газа – от его объема.
В дальнейшем не будем рассматривать процессы, сопровождающиеся изменением энергии электронных оболочек атомов и ионов, а также изменением внутриядерной энергии. Кроме того, в случае идеального газа нет сил межмолекулярного взаимодействия, а связи между атомами в многоатомных молекулах абсолютно жесткие.
Следовательно, внутренняя энергия идеального газа равна суммарной кинетической энергии хаотического движения молекул.
На
основании закона равномерного
распределения энергии по степеням
свободы (20.1) выражение для внутренней
энергии  одного моля идеального газа запишется
как
одного моля идеального газа запишется
как
, (23.5)
где <Wk> – средняя кинетическая энергия молекулы; NA – постоянная Авогадро; i – число степеней свободы молекулы. Выражение для внутренней энергии U идеального газа массой М можно записать как
, (23.6)
где = M/ – количество вещества (число молей) газа; – его молярная масса.
Как следует из (23.6), внутренняя энергия идеального газа зависит только от его температуры (все остальные величины для определенного газа считаем постоянными), то есть
. (23.7)
studfiles.net
4. Внутренняя энергия термодинамической системы
В механике вводится понятие работа, которая в системе СИ измеряется в джоулях. Работа – это произведение силы на расстояние, т.е.
1 Дж = 1 Н · 1 м.
По определению энергия – это возможность совершения работы (в греческом энергия означает деятельность).
Всякая термодинамическая система в любом состоянии обладает запасом внутренней энергии.
Все термодинамические системы состоят из множества элементов (атомов, молекул и т.п.).
Внутренняя энергия системы – это суммарная энергия всех её элементов.
Внутренняя энергия системы экспериментально определяется в такой системе координат, в которой сама термодинамическая система как целое покоится
Пример: Для объема идеального газа, состоящего из молекул – упругих сфер, внутренняя энергия равна сумме кинетических энергий всех молекул газа в системе координат, жестко привязанной к центру масс (ЦМ) этого объема.
Для реального газа к кинетической энергии молекул следует добавить: потенциальную энергию взаимодействия между молекулами; вращательную и колебательную энергию молекул; энергию электронов; энергию ядер и др.
Примечание:
Термодинамический анализ опирается на феноменологический подход. Поэтому при рассмотрении явлений на макроуровне нет необходимости знать микроструктуру внутренней энергии. Например, из опыта известно, что для анализа процессов энергообмена между термодинамической системой и окружающей средой достаточно иметь сведения об изменении основных параметров состояния системы р, υ и Т. То есть можно говорить, что внутренняя энергия простой системы зависит только от её состояния и, следовательно, однозначно определяется любыми двумя (из трёх) параметров состояния р, υ и Т. (В случае сложных, например, многофазных систем вводится соответствующие дополнительные параметры).
Экспериментально установлено, что внутренняя энергия любой простой термодинамической системы U, Дж, состоит из двух слагаемых. Одно из этих слагаемых является непрерывной функцией двух параметров состояния, например, р и Т. Второе слагаемое не зависит от параметров состояния.
Таким образом, можем записать:
U (р, Т) = Е (р, Т) + const. (4.1)
где U (р, Т) – внутренняя энергия системы, которая является непрерывной функцией двух параметров состояния или, для краткости, просто является функцией состояния, Дж; Е (р, Т) – часть внутренней энергии, которая зависит от параметров состояния, Дж; const – часть внутренней энергии, которая не зависит от параметров состояния (энергия ядер, энергия потенциального взаимодействия между молекулами и др.), Дж.
Неопределенность, которая возникает в (4.1) из-за неизвестной константы (второго слагаемого) представляет собой существенную особенность понятия внутренняя энергия. Но так как на практике всегда рассматривается только изменение энергии в ходе процесса, то есть конечная разность энергий (либо бесконечно малое её изменение – дифференциал), то эта константа не влияет на окончательный результат.
В термодинамике обычно пользуются удельными величинами:
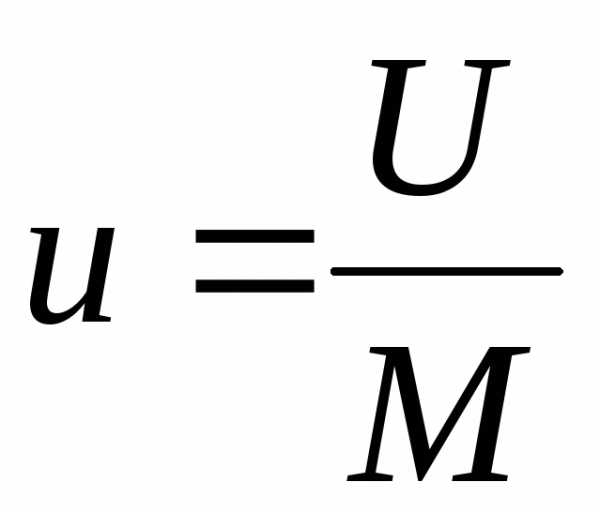 , (4.2)
, (4.2)
где U – внутренняя энергия системы, Дж; u – удельная внутренняя энергия системы, Дж/кг; М – масса системы, кг.
Удельная внутренняя энергия различных веществ определяется экспериментально и приводится в таблицах справочной литературы, например, как функция р и Т.
studfiles.net
Внутренняя энергия термодинамической системы. Первое начало термодинамики.
Внутренняя энергия тела складывается из кинетической энергии поступательного и вращательного движений, кинетической и потенциальной энергий колебательного движения атомов, молекулы, внутренней молекулярной энергии, потенциальной энергии взаимодействия молекул тела. Во внутреннюю энергию не входит кинетическая энергия тела как целого и потенциальная энергия тела во внешнем силовом поле. если система состоит из 2-ух тел, то обычно энергия взаимодействия между телами значит меньше внутренней энергии тел, поэтому энергией взаимодействия можно пренебречь, значит, внутренняя энергия системы . Внутренняя энергия зависит только от состояния тела, т.е. её значение определяется параметрами состояния. Поэтому можно говорить о приращении внутренней энергии в ходе термодинамического процесса. Для элементарных процессов заменяется на . Изменение внутренней энергии может происходить в основном за счёт 2-ух процессов:
1) Внешние тела, действующие на систему, совершают некую работу над системой. соответственно термодинамическая система в силу 3-его закона Ньютона совершает работу .
Изменение внутренней энергии может происходить за счёт передачи телу теплоты. Когда отдельные молекулы более нагретого тела передают часть своей энергии отдельным молекулам менее нагретого тела. Совокупность микропроцессов, приводящих к передаче энергии от одного тела к другому, называется теплоотдачей. Она может происходить за счёт конвекции теплопроводности излучения (перенос энергии за счёт движения частиц вещества). Количество энергии, переданное телу за счёт микропроцессов, называется количеством теплоты Q. Исходя из всеобщего ЗСЭ можем записать 1-ое начало термодинамики: . Количество теплоты, получаемое системой, идёт на приращение внутренней энергии системы и совершение его работы над внешними телами для элементарных процессов .
Внутренняя энергия и теплоёмкость идеального газа. Адиабатический процесс.
Количество теплоты, необходимое для нагревания тела на 1 кельвин Количество теплоты, необходимое для нагревания тела на 1 кельвин единицы массы тела (вещества), называется удельной теплоёмкостью: . Количество теплоты, необходимое для нагревания тела на 1 кельвин 1 моля вещества, называется молярной теплоёмкостью. Теплоёмкость зависит от условий, при которых происходит нагревание тела. Выделяют теплоёмкость при постоянном объёме и при постоянном давлении. Экспериментально установлено, что не зависит от температуры, следовательно, внутренняя энергия 1 моля идеального газа . Для молей в силу аддитивной внутренней энергии . Молярная теплоёмкость при постоянном давлении р – уравнение Мойера. Отношение является характеристикой газа, оно определяется числом степеней молекулы газа и характером. .
Уравнение адиабаты идеального газа. Работа, совершаемая газом при различных процессах.
Термодинамический процесс, при котором не происходит теплообмена с внешней средой, называется адиабатическим. и в соответствии с 1-ым началом термодинамики можно записать: . Отсюда получаем . Окончательно получаем уравнение адиабаты . Уравнение адиабаты с переменными : – называется уравнением Пуассона.
Вычислим работу идеального газа для некоторых процессов:
1) изобарический процесс : ;
2) изохорический процесс : ;
3) изотермический процесс : ;
4) адиабатический процесс выполняется уравнение Пуассона: , .
Барометрическая формула.
Барометрическая формула даёт зависимость атмосферного давления от высоты, отсчитанной от поверхности Земли. Предполагается, что температура атмосферы с высотой не меняется. Для вывода формулы выделим вертикальный цилиндр: поперечное сечение S. В нём выделяется небольшой цилиндрический объём высотой dh. Он находится в равновесии: на него действуют сила тяжести mg, вертикально направленная вверх сила давления газа F1 и вертикально направленная вниз сила давления F2. Их сумма = 0. В проекции: -mg+ F1-. F2=0 . Из уравнения Клапейрона-Менделеева . Интегрируем в пределах от 0 до и получаем: – барометрическая формула, используемая для определения высоты. Изменением в температуре можно пренебречь.
Давление газа на стенку.
Распределение Максвелла.
Пусть имеется n тождественных молекул, находящихся в состоянии беспорядочного теплового движения при определенной температуре. После каждого акта столкновения между молекулами, их скорости меняются случайным образом. В результате невообразимо большого числа столкновений устанавливается стационарное равновесное состояние, когда число молекул в заданном интервале скоростей сохраняется постоянным.
В результате каждого столкновения проекции скорости молекулы испытывают случайное изменение на , , , причем изменения каждой проекции скорости независимы друг от друга. Будем предполагать, что силовые поля на частицы не действуют. Найдем в этих условиях, каково число частиц dn из общего числа n имеет скорость в интервале от υ до υ+Δυ. При этом мы не можем ничего определенного сказать о точном значении скорости той или иной частицы υi, поскольку за столкновениями и движениями каждой из молекул невозможно проследить ни в опыте, ни в теории. Такая детальная информация вряд ли имела бы практическую ценность.
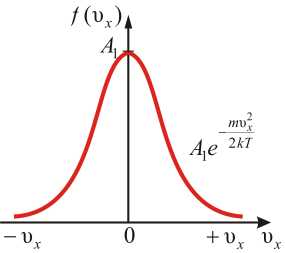 Скорость – векторная величина. Для проекции скорости на ось х (x-й составляющей скорости) имеем тогда где А1 – постоянная, равная
Скорость – векторная величина. Для проекции скорости на ось х (x-й составляющей скорости) имеем тогда где А1 – постоянная, равная
Графическое изображение функции показано на рисунке. Видно, что доля молекул со скоростью не равна нулю. При , (в этом физический смысл постоянной А1).
Приведённое выражение и график справедливы для распределения молекул газа по x-компонентам скорости. Очевидно, что и по y- и z-компонентам скорости также можно получить:
Вероятность того, что скорость молекулы одновременно удовлетворяет трём условиям: x-компонента скорости лежит в интервале от , до + ,; y-компонента, в интервале от до + ; z-компонента, в интервале от до +d будет равна произведению вероятностей каждого из условий (событий) в отдельности: где , или ) – это число молекул в параллелепипеде со сторонами , , d , то есть в объёме dV= d , находящемся на расстоянии от начала координат в пространстве скоростей. Эта величина ( ) не может зависеть от направления вектора скорости . Поэтому надо получить функцию распределения молекул по скоростям независимо от их направления, то есть по абсолютному значению скорости. Если собрать вместе все молекулы в единице объёма, скорости которых заключены в интервале от υ до υ+dυ по всем направлениям, и выпустить их, то они окажутся через одну секунду в шаровом слое толщиной dυ и радиусом υ. Этот шаровой слой складывается из тех параллелепипедов, о которых говорилось выше.
Объём этого шарового слоя . Общее число молекул в слое: Отсюда следует закон распределения молекул по абсолютным значениям скоростей Максвелла: где – доля всех частиц в шаровом слое объема dV, скорости которых лежат в интервале от υ до υ+dυ. При dυ = 1 получаем плотность вероятности, или функцию распределения молекул по скоростям: Эта функция обозначает долю молекул единичного объёма газа, абсолютные скорости которых заключены в единичном интервале скоростей, включающем данную скорость. Обозначим: и получим: График этой функции показан на рисунке. Это и есть распределение Максвелла. Или по-другому
.
Рекомендуемые страницы:
lektsia.com
Термодинамическая система и ее внутренняя энергия
Внутренняя энергия
Термодинамических систем
Тема 2 Энергетические характеристики
Внутренняя энергиятермодинамической системы представляет собой сумму всех видов энергии движения и взаимодействия частиц, составляющих систему.
Это означает, что независимо от предыстории системы её энергия в данном состоянии имеет присущее этому состоянию значение, поэтому приращение внутренней энергии при переходе системы из одного состояния в другое всегда равно разности значений внутренней энергии в конечном и начальном состояниях независимо от пути перехода.
Таки образом,
. (2.1)
Внутренняя энергия является величиной аддитивной, т.е. внутренняя энергия системы равна сумме внутренних энергий отдельных ее частей.
В термодинамике часто используется понятие удельной внутренней энергии, т.е. внутренней энергии для массы системы равной 1кг.
(2.2)
где ¾ масса системы, кг.
Вопрос 45.1
Первый закон термодинамики
Первое начало (первый закон)термодинамики — это закон сохранения и превращения энергии для термодинамической системы.
Согласно первому началу термодинамики, работа может совершаться только за счет теплоты или какой-либо другой формыэнергии. Следовательно, работу и количество теплоты измеряют в одних единицах — джоулях (как и энергию).
Первое начало термодинамики было сформулировано немецким ученым Ю. Л. Манером в 1842 г. и подтверждено экспериментально английским ученым Дж. Джоулем в 1843 г.
Первый закон термодинамики формулируется так:
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил иколичества теплоты, переданного системе:
ΔU=A+Q,
где ΔU — изменение внутренней энергии, A — работа внешних сил, Q — количество теплоты, переданной системе.
Из (ΔU=A+Q) следует закон сохранения внутренней энергии. Если систему изолировать от внешних воздействий, то A= 0 иQ= 0, а следовательно, и ΔU = 0.
При любых процессах, происходящих в изолированной системе, ее внутренняя энергия остается постоянной.
Если работу совершает система, а не внешние силы, то уравнение (ΔU = A + Q) записывается в виде:
,
где A’ — работа, совершаемая системой (A’ = -A).
Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами.
Первое начало термодинамики может быть сформулировано как невозможность существования вечного двигателя первого рода, который совершал бы работу, не черпая энергию из какого-либо источника (т. е. только за счет внутренней энергии).
Действительно, если к телу не поступает теплота (Q – 0), то работа A’, согласно уравнению , совершается только за счет убыли внутренней энергии А’ = -ΔU. После того, как запас энергии окажется исчерпанным, двигатель перестает работать.
Следует помнить, что как работа, так и количество теплоты, являются характеристиками процесса изменения внутренней энергии, поэтому нельзя говорить, что в системе содержится определенное количество теплоты или работы. Система в любом состоянии обладает лишь определенной внутренней энергией.
Применение первого закона термодинамики к различным процессам.
Рассмотрим применение первого закона термодинамики к различным термодинамическим процессам.
Изохорный процесс.
Зависимость р(Т) на термодинамической диаграмме изображается изохорой.
Изохорный (изохорический) процесс — термодинамический процесс, происходящий в системе при постоянном объеме.
Изохорный процесс можно осуществить в газах и жидкостях, заключенных в сосуд с постоянным объемом.
При изохорном процессе объем газа не меняется (ΔV= 0), и, согласно первому началу термодинамики ,
ΔU=Q,
т. е. изменение внутренней энергии равно количеству переданного тепла, т. к. работа (А = рΔV=0) газом не совершается.
Если газ нагревается, то Q > 0 и ΔU > 0, его внутренняя энергия увеличивается. При охлаждении газа Q < 0 и ΔU < 0, внутренняя энергия уменьшается.
Изотермический процесс.
Изотермический процесс графически изображается изотермой.
Изотермический процесс — это термодинамический процесс, происходящий в системе при постоянной температуре.
Поскольку при изотермическом процессе внутренняя энергия газа не меняется, см. формулу , (Т = const), то все переданное газу количество теплоты идет на совершение работы:
Q = A’,
При получении газом теплоты (Q > 0) он совершает положительную работу (A’ > 0). Если газ отдает тепло окружающей среде Q <0 и A’ < 0. В этом случае над газом совершается работа внешними силами. Для внешних сил работа положительна. Геометрически работа при изотермическом процессе определяется площадью под кривой p(V).
Изобарный процесс.
Изобарный процесс на термодинамической диаграмме изображается изобарой.
Изобарный (изобарический) процесс— термодинамический процесс, происходящий в системе с постоянным давлением р.
Примером изобарного процесса является расширение газа в цилиндре со свободно ходящим нагруженным поршнем.
При изобарном процессе, согласно формуле , передаваемое газу количество теплоты идет на изменение его внутренней энергии ΔUи на совершение им работы A’ при постоянном давлении:
Q = ΔU + A’.
Работа идеального газа определяется по графику зависимости p(V) для изобарного процесса (A’ = pΔV).
Для идеального газа при изобарном процессе объем пропорционален температуре, в реальных газах часть теплоты расходуется на изменение средней энергии взаимодействия частиц.
Адиабатический процесс.
Адиабатический процесс (адиабатный процесс) — это термодинамический процесс, происходящий в системе без теплообмена с окружающей средой (Q= 0).
Адиабатическая изоляция системы приближенно достигается в сосудах Дьюара, в так называемых адиабатных оболочках. На адиабатически изолированную систему не оказывает влияния изменение температуры окружающих тел. Ее внутренняя энергия Uможет меняться только за счет работы, совершаемой внешними телами над системой, или самой системой.
Согласно первому началу термодинамики (ΔU = А + Q), в адиабатной системе
ΔU = A,
где A — работа внешних сил.
При адиабатном расширении газа А< 0. Следовательно,
,
что означает уменьшение температуры при адиабатном расширении. Оно приводит к тому, что давление газа уменьшается более резко, чем при изотермическом процессе. На рисунке ниже адиабата 1-2, проходящая между двумя изотермами, наглядно иллюстрирует сказанное. Площадь под адиабатой численно равна работе, совершаемой газом при его адиабатическом расширении от объема V1, до V2.
Адиабатное сжатие приводит к повышению температуры газа, т. к. в результате упругих соударений молекул газа с поршнем их средняя кинетическая энергия возрастает, в отличие от расширения, когда она уменьшается (в первом случае скорости молекул газа увеличиваются, во втором — уменьшаются).
Резкое нагревание воздуха при адиабатическом сжатии используется в двигателях Дизеля.
infopedia.su
1.2. Внутренняя энергия и температура термодинамической системы
Полная энергия термодинамической системы представляет собой сумму кинетической энергии движения всех тел, входящих в систему, потенциальной энергии взаимодействия их между собой и с внешними телами и энергии, содержащейся внутри тел системы. Если из полной энергии вычесть кинетическую энергию, характеризующую макроскопическое движение системы как целого, и потенциальную энергию взаимодействия её тел с внешними макроскопическими телами, то оставшаяся часть будет представлять собой внутреннюю энергию термодинамической системы.
Внутренняя энергия термодинамической системы включает в себя энергию микроскопического движения и взаимодействия частиц системы, а так же их внутримолекулярную и внутриядерную энергии.
Полная энергия системы (а, следовательно, и внутренняя энергия) также как потенциальная энергия тела в механике может быть определена с точностью до произвольной константы. Поэтому, если любые макроскопические движения в системе и взаимодействия её с внешними телами отсутствуют, можно принять “макроскопические” составляющие кинетической и потенциальной энергий равными нулю и считать внутреннюю энергию системы равной её полной энергии. Такая ситуация имеет место в случае, когда система находится в состоянии термодинамического равновесия.
Введём характеристику состояния термодинамического равновесия – температуру. Так называется величина, зависящая от параметров состояния, например, от давления и объёма газа, и являющаяся функцией внутренней энергии системы. Эта функция обычно имеет монотонную зависимость от внутренней энергии системы, то есть растёт с ростом внутренней энергии.
Температура термодинамических систем, находящихся в состоянии равновесия, обладает следующими свойствами:
Если две равновесные термодинамические системы, находятся в тепловом контакте и имеют одинаковую температуру, то совокупная термодинамическая система находится в состоянии термодинамического равновесия при той же температуре.
Если какая-либо равновесная термодинамическая система имеет одну и ту же температуру с двумя другими системами, то эти три системы находятся в термодинамическом равновесии при одной и той же температуре.
Таким образом, температура есть мера состояния термодинамического равновесия. Для установления этой меры уместно ввести понятие теплопередачи.
Теплопередачей называется передача энергии от одного тела к другому без переноса вещества и совершения механической работы.
Если между телами, находящимися в тепловом контакте друг с другом, теплопередача отсутствует, то тела имеют одинаковые температуры и находятся в состоянии термодинамического равновесия друг с другом.
Если в изолированной системе, состоящей из двух тел, эти тела находятся при разных температурах, то теплопередача будет осуществляться таким образом, чтобы энергия передавалась от более нагретого тела менее нагретому. Этот процесс будет продолжаться до тех пор, пока температуры тел не сравняются, и изолированная система из двух тел не достигнет состояния термодинамического равновесия.
Для возникновения процесса теплопередачи необходимо создание потоков теплоты, то есть требуется выход из состояния теплового равновесия. Поэтому равновесная термодинамика не описывает процесс теплопередачи, а только его результат – переход в новое равновесное состояние. Описание самого процесса теплопередачи выполнено в шестой главе, посвящённой физической кинетике.
В заключении необходимо отметить, что если одна термодинамическая система обладает более высокой температурой, чем другая, то она не обязательно будет обладать и большей внутренней энергией, несмотря на возрастание внутренней энергии каждой системы с повышением её температуры. Например, больший объём воды может обладать большей внутренней энергией даже при более низкой температуре, чем у меньшего объёма воды. Однако, в этом случае теплопередача (перенос энергии) будет происходить не от тела с большей внутренней энергией к телу с меньшей внутренней энергией, а наоборот, так как направление переноса энергии определяется не величинами внутренних энергий систем, а их температурами.
studfiles.net
Внутренняя энергия – материалы для подготовки к ЕГЭ по Физике
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: внутренняя энергия, теплопередача, виды теплопередачи.
Частицы любого тела — атомы или молекулы — совершают хаотическое непрекращающееся движение (так называемое тепловое движение). Поэтому каждая частица обладает некоторой кинетической энергией.
Кроме того, частицы вещества взаимодействуют друг с другом силами электрического притяжения и отталкивания, а также посредством ядерных сил. Стало быть, вся система частиц данного тела обладает ещё и потенциальной энергией.
Кинетическая энергия теплового движения частиц и потенциальная энергия их взаимодействия вместе образуют новый вид энергии, не сводящийся к механической энергии тела (т.е. кинетической энергии движения тела как целого и потенциальной энергии его взаимодействия с другими телами). Этот вид энергии называется внутренней энергией.
Внутренняя энергия тела — это суммарная кинетическая энергия теплового движения его частиц плюс потенциальная энергия их взаимодействия друг с другом.
Внутренняя энергия термодинамической системы — это сумма внутренних энергий тел, входящих в систему.
Таким образом, внутреннюю энергию тела образуют следующие слагаемые.
1. Кинетическая энергия непрерывного хаотического движения частиц тела.
2. Потенциальная энергия молекул (атомов), обусловленная силами межмолекулярного взаимодействия.
3. Энергия электронов в атомах.
4. Внутриядерная энергия.
В случае простейшей модели вещества — идеального газа — для внутренней энергии можно получить явную формулу.
Внутренняя энергия одноатомного идеального газа
Потенциальная энергия взаимодействия частиц идеального газа равна нулю (напомним, что в модели идеального газа мы пренебрегаем взаимодействием частиц на расстоянии). Поэтому внутренняя энергия одноатомного идеального газа сводится к суммарной кинетической энергии поступательного (у многоатомного газа приходится ещё учитывать вращение молекул и колебания атомов внутри молекул) движения его атомов. Эту энергию можно найти, умножив число атомов газа на среднюю кинетическую энергию одного атома:
или
Мы видим, что внутренняя энергия идеального газа (масса и химический состав которого неизменнны) является функцией только его температуры. У реального газа, жидкости или твёрдого тела внутренняя энергия будет зависеть ещё и от объёма — ведь при изменении объёма изменяется взаимное расположение частиц и, как следствие, потенциальная энергия их взаимодействия.
Функция состояния
Важнейшее свойство внутренней энергии заключается в том, что она является функцией состояния термодинамической системы. А именно, внутренняя энергия однозначно определяется набором макроскопических параметров, характеризующих систему, и не зависит от «предыстории» системы, т.е. от того, в каком состоянии система находилась прежде и каким конкретно образом она оказалась в данном состоянии.
Так, при переходе системы из одного состояния в другое изменение её внутренней энергии определяется лишь начальным и конечным состояниями системы и не зависит от пути перехода из начального состояния в конечное. Если система возвращается в исходное состояние, то изменение её внутренней энергии равно нулю.
Опыт показывает, что существует лишь два способа изменения внутренней энергии тела:
• совершение механической работы;
• теплопередача.
Попросту говоря, нагреть чайник можно только двумя принципиально разными способами: тереть его чем-нибудь или поставить на огонь 🙂 Рассмотрим эти способы подробнее.
Изменение внутренней энергии: совершение работы
Если работа совершается над телом, то внутренняя энергия тела возрастает.
Например, гвоздь после удара по нему молотком нагревается и немного деформируется. Но температура — это мера средней кинетической энергии частиц тела. Нагревание гвоздя свидетельствует об увеличении кинетической энергии его частиц: в самом деле, частицы разгоняются от удара молотком и от трения гвоздя о доску.
Деформация же есть не что иное, как смещение частиц друг относительно друга; гвоздь после удара испытывает деформацию сжатия, его частицы сближаются, между ними возрастают силы отталкивания, и это приводит к увеличению потенциальной энергии частиц гвоздя.
Итак, внутренняя энергия гвоздя увеличилась. Это явилось результатом совершения над ним работы — работу совершили молоток и сила трения о доску.
Если же работа совершается самим телом, то внутренняя энергия тела уменьшается.
Пусть, например, сжатый воздух в теплоизолированном сосуде под поршнем расширяется и поднимает некий груз, совершая тем самым работу (процесс в теплоизолированном сосуде называется адиабатным. Мы изучим адиабатный процесс при рассмотрении первого закона термодинамики). В ходе такого процесса воздух будет охлаждаться — его молекулы, ударяя вдогонку по движущемуся поршню, отдают ему часть своей кинетической энергии. (Точно так же футболист, останавливая ногой быстро летящий мяч, делает ею движение от мяча и гасит его скорость.) Стало быть, внутренняя энергия воздуха уменьшается.
Воздух, таким образом, совершает работу за счёт своей внутренней энергии: поскольку сосуд теплоизолирован, нет притока энергии к воздуху от каких-либо внешних источников, и черпать энергию для совершения работы воздух может только из собственных запасов.
Изменение внутренней энергии: теплопередача
Теплопередача — это процесс перехода внутренней энергии от более горячего тела к более холодному, не связанный с совершением механической работы. Теплопередача может осуществляться либо при непосредственном контакте тел, либо через промежуточную среду (и даже через вакуум). Теплопередача называется ещё теплообменом.
Различают три вида теплопередачи: теплопроводность, конвекция и тепловое излучение.
Сейчас мы рассмотрим их более подробно.
Теплопроводность
Если железный стержень сунуть одним концом в огонь, то, как мы знаем, долго его в руке не продержишь. Попадая в область высокой температуры, атомы железа начинают колебаться интенсивнее (т.е. приобретают добавочную кинетическую энергию) и наносят более сильные удары по своим соседям.
Кинетическая энергия соседних атомов также возрастает, и теперь уже эти атомы сообщают дополнительную кинетическую энергию своим соседям. Так от участка к участку тепло постепенно распространяется по стержню — от помещённого в огонь конца до нашей руки. Это и есть теплопроводность (рис. 1)(Изображение с сайта educationalelectronicsusa.com).
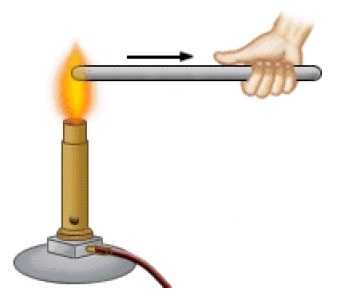
Рис. 1. Теплопроводность
Теплопроводность — это перенос внутренней энергии от более нагретых участков тела к менее нагретым за счёт теплового движения и взаимодействия частиц тела.
Теплопроводность разных веществ различна. Высокую теплопроводность имеют металлы: лучшими проводниками тепла являются серебро, медь и золото. Теплопроводность жидкостей гораздо меньше. Газы проводят тепло настолько плохо, что относятся уже к теплоизоляторам: молекулы газов из-за больших расстояний между ними слабо взаимодействуют друг с другом. Вот почему, например, в окнах делают двойные рамы: прослойка воздуха препятствует уходу тепла).
Плохими проводниками тепла являются поэтому пористые тела — такие, как кирпич, вата или мех. Они содержат в своих порах воздух. Недаром кирпичные дома считаются самыми тёплыми, а в мороз люди надевают меховые шубы и куртки с прослойкой пуха или синтепона.
Но если воздух так плохо проводит тепло, то почему тогда прогревается от батареи комната?
Происходит это вследствие другого вида теплопередачи — конвекции.
Конвекция
Конвекция — это перенос внутренней энергии в жидкостях или газах в результате циркуляции потоков и перемешивания вещества.
Воздух вблизи батареи нагревается и расширяется. Действующая на этот воздух сила тяжести остаётся прежней, а выталкивающая сила со стороны окружающего воздуха увеличивается, так что нагретый воздух начинает всплывать к потолку. На его место приходит холодный воздух (тот же процесс, но в куда более грандиозных масштабах, постоянно происходит в природе: именно так возникает ветер), с которым повторяется то же самое.
В результате устанавливается циркуляция воздуха, которая и служит примером конвекции — распространение тепла в комнате осуществляется воздушными потоками.
Совершенно аналогичный процесс можно наблюдать и в жидкости. Когда вы ставите на плиту чайник или кастрюлю с водой, нагревание воды происходит в первую очередь благодаря конвекции (вклад теплопроводности воды тут весьма незначителен).
Конвекционные потоки в воздухе и жидкости показаны на рис. 2 (изображения с сайта physics.arizona.edu).
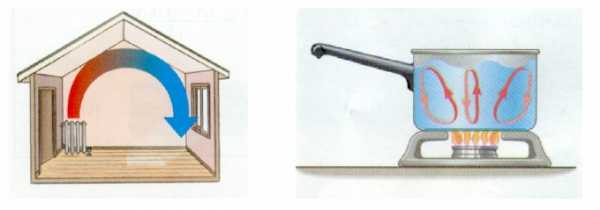
Рис. 2. Конвекция
В твёрдых телах конвекция отсутствует: силы взаимодействия частиц велики, частицы колеблются вблизи фиксированных пространственных точек (узлов кристаллической решётки), и никакие потоки вещества в таких условиях образоваться не могут.
Для циркуляции конвекционных потоков при отоплении комнаты необходимо, чтобы нагретому воздуху было куда всплывать. Если радиатор установить под потолком, то никакая циркуляция не возникнет — тёплый воздух так под потолком и останется. Именно поэтому нагревательные приборы помещают внизу комнаты. По той же причине чайник ставят на огонь, в результате чего нагретые слои воды, поднимаясь, уступают место более холодным.
Наоборот, кондиционер нужно располагать как можно выше: тогда охлаждённый воздух начнёт опускаться, и на его место будет приходить более тёплый. Циркуляция пойдёт в обратном направлении по сравнению с движением потоков при обогреве комнаты.
Тепловое излучение
Каким образом Земля получает энергию от Солнца? Теплопроводность и конвекция исключены: нас разделяет 150 миллионов километров безвоздушного пространства.
Здесь работает третий вид теплопередачи — тепловое излучение. Излучение может распространяться как в веществе, так и в вакууме. Как же оно возникает?
Оказывается, электрическое и магнитное поля тесно связаны друг с другом и обладают одним замечательным свойством. Если электрическое поле изменяется со временем, то оно порождает магнитное поле, которое, вообще говоря, также изменяется со временем (подробнее об этом будет рассказано в листке про электромагнитную индукцию). В свою очередь переменное магнитное поле порождает переменное электрическое поле, которое опять порождает переменное магнитное поле, которое опять порождает переменное электрическое поле…
В результате развития этого процесса в пространстве распространяется электромагнитная волна —«зацепленные» друг за друга электрическое и магнитное поля. Как и звук, электромагнитные волны обладают скоростью распространения и частотой — в данном случае это частота, с которой колеблются в волне величины и направления полей. Видимый свет — частный случай электромагнитных волн.
Скорость распространения электромагнитных волн в вакууме огромна: км/с. Так, от Земли до Луны свет идёт чуть больше секунды.
Частотный диапазон электромагнитных волн очень широк. Подробнее о шкале электромагнитных волн мы поговорим в соответствующем листке. Здесь отметим лишь, что видимый свет — это крохотный диапазон данной шкалы. Ниже него лежат частоты инфракрасного излучения, выше — частоты ультрафиолетового излучения.
Вспомним теперь, что атомы, будучи в целом электрически нейтральными, содержат положительно заряженные протоны и отрицательно заряженные электроны. Эти заряженные частицы, совершая вместе с атомами хаотическое движение, создают переменные электрические поля и тем самым излучают электромагнитные волны. Эти волны и называются тепловым излучением — в напоминание о том, что их источником служит тепловое движение частиц вещества.
Источником теплового излучения является любое тело. При этом излучение уносит часть его внутренней энергии. Встретившись с атомами другого тела, излучение разгоняет их своим колеблющимся электрическим полем, и внутренняя энергия этого тела увеличивается. Именно так мы и греемся в солнечных лучах.
При обычных температурах частоты теплового излучения лежат в инфракрасном диапазоне, так что глаз его не воспринимает (мы не видим, как мы «светимся»). При нагревании тела его атомы начинают излучать волны более высоких частот. Железный гвоздь можно раскалить докрасна — довести до такой температуры, что его тепловое излучение выйдет в нижнюю (красную) часть видимого диапазона. А Солнце кажется нам жёлто-белым: температура на поверхности Солнца настолько высока , что в спектре его излучения присутствуют все частоты видимого света, да ещё ультрафиолет, благодаря которому мы загораем.
Давайте ещё раз взглянем на три вида теплопередачи (рис. 3)(изображения с сайта beodom.com).
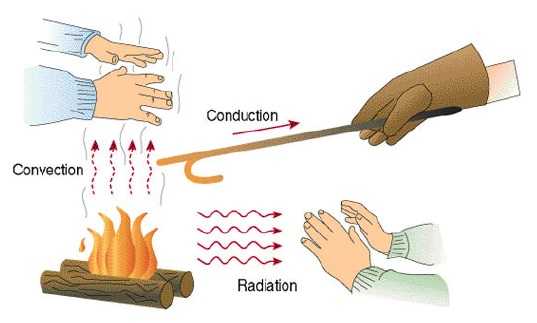
Рис. 3. Три вида теплопередачи: теплопроводность, конвекция и излучение
Звоните нам: 8 (800) 775-06-82 (бесплатный звонок по России) +7 (495) 984-09-27 (бесплатный звонок по Москве)
Или нажмите на кнопку «Узнать больше», чтобы заполнить контактную форму. Мы обязательно Вам перезвоним.
ege-study.ru
