Основные законы и понятия химии
Все законы химии базируются на атомно-молекулярном учении, в связи с чем основополагающими понятиями в химии являются понятия атома и молекулы.
Атомом называется мельчайшая частица химического элемента, сохраняющая его химические свойства.
Атом каждого элемента состоит из ядра, масса которого складывается из определенного количества протонов и нейтронов, и вращающихся вокруг него электронов, число которых равно числу протонов, т.е. заряду ядра. Заряд ядра равен порядковому номеру элемента в Периодической системе Д.И. Менделеева и является величиной, определяющей химические свойства элемента. Например, порядковый номер цинка – 30, это означает, что ядро его атома содержит 30 протонов, заряд ядра равен +30, число электронов в атоме цинка – тридцать. Атомы, обладающие одинаковым зарядом ядра (и, следовательно, тождественными химическими свойствами), но разным числом нейтронов, называются изотопами.
Элементом называется вид атомов, характеризующихся определенной величиной положительного заряда ядра.
Все открытые на Земле элементы систематизированы в таблице Д.И. Менделеева. Они подразделяются на металлы и неметаллы. Каждый элемент имеет свое название и символ (например, Na– натрий, Р – фосфор).
Все вещества делятся на простые и сложные. Для большинства из них мельчайшей частицей является молекула, которая состоит из атомов, число которых и взаимное расположение в молекуле определяют свойства вещества.
Молекула – это наименьшая частица вещества, обладающая его химическими свойствами.
Молекулы могут состоять из атомов одного или нескольких элементов.
Простое вещество – это вещество, состоящее из атомов одного элемента.
Мельчайшей частицей, сохраняющей свойства простого вещества, может быть атом, а может быть молекула. Например, простое вещество железо состоит из атомов элемента железа, а простое вещество – из двухатомных молекул, образованных атомами одного элемента – кислорода.
Атомы одного и того же элемента могут образовывать несколько простых веществ, различных по своим свойствам. Это явление называется аллотропией, а вещества – аллотропическими модификациями. Аллотропические модификации отличаются друг от друга либо различным числом атомов в молекуле, например, кислород О2
Сложное вещество, или соединение, – это вещество, состоящее из атомов разных элементов.
Вид и число атомов в молекуле вещества изображаются химической формулой. Например, формула серной кислоты – H2SO4. Это означает, что молекула этого вещества состоит из одного атома серы, двух атомов водорода и четырех атомов кислорода. Соотношение между числом атомов разных элементов в молекуле определяется валентностью этих элементов.
Валентность элемента – это способность его атомов соединяться с другими атомами в определенных соотношениях.
Валентность – сложное понятие, его современное значение будет выяснено при изучении теории строения вещества.
Наряду с валентностью употребляется понятие степень окисления.
Степень окисления – это условный заряд атома данного элемента в соединении, вычисленный, исходя из предположения, что все атомы в молекуле ионизированы, т.е. имеют заряд.
Степень окисления
может иметь положительное, отрицательное
и нулевое значения, которые обычно
ставятся над символом элемента сверху.
Например,  ,
,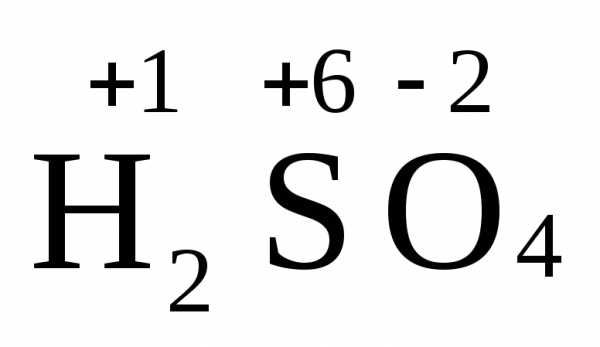

 ,
цинк
,
цинк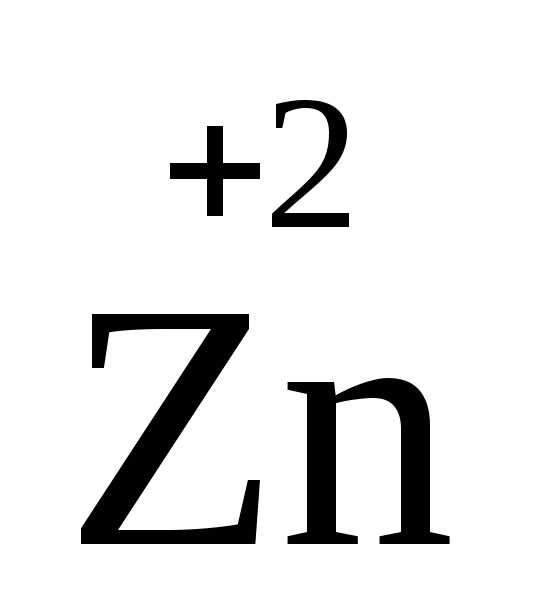 , кадмий
, кадмий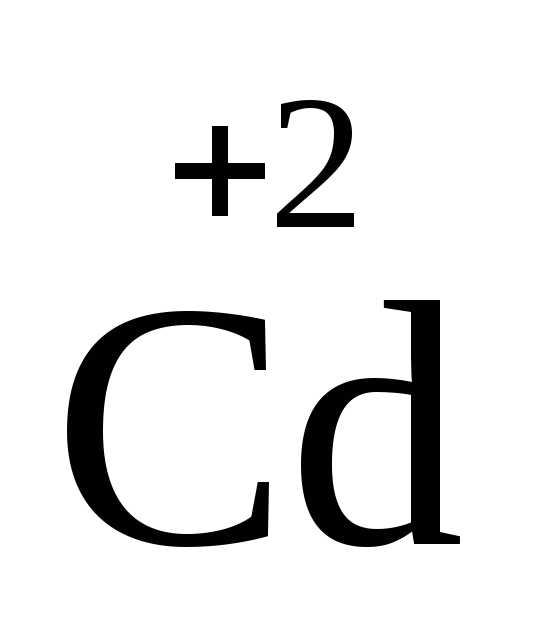 ,
алюминий
,
алюминий .
Водород проявляет степень окисления
+1 во всех соединениях, кроме гидридов,
в которых степень окисления водорода
равна –1.
Степень окисления кислорода практически
постоянна и составляет –2.
.
Водород проявляет степень окисления
+1 во всех соединениях, кроме гидридов,
в которых степень окисления водорода
равна –1.
Степень окисления кислорода практически
постоянна и составляет –2.
Большинство элементов имеет переменную степень окисления, например, .
Массы атомов и молекул очень малы (10-25-10-20) и пользоваться ими при расчетах неудобно. Поэтому в химии введены относительные величины масс атомов и молекул, которые называются атомными или соответственно молекулярными массами. В качестве единицы измерения принята атомная единица массы (сокращенно а.е.м.), равная 1/12 массы атома изотопа углерода12С.
Относительной атомной массой (или атомной массой) элемента называется масса его атома, выраженная в атомных единицах массы.
Атомные массы элементов определяются из таблицы Д.И. Менделеева, причем их значения принято округлять до целого числа. Исключение составляет масса хлора, равная 35,5.
Относительной молекулярной массой (или молекулярной массой) простого или сложного вещества называется масса его молекулы, выраженная в атомных единицах массы.
Атомные и молекулярные массы обычно приводятся без обозначения единицы измерения.
Важнейшей количественной единицей в химии является величина, называемая молем.
Моль – это количество вещества, содержащее столько молекул, атомов, ионов или других структурных единиц, сколько содержится атомов в 12 г изотопа углерода 12С.
В одном моле любого вещества содержится 6,02×1023структурных единиц. Число 6,02×1023называется числом Авогадро. ¥
Применяя понятие
«моль», необходимо в каждом конкретном
случае указывать, какие именно структурные
единицы имеются в виду. Например, следует
различать моль атомов Н, моль молекул
Н2, моль ионов Н+. В моле
атомов, молекул, ионов водорода содержится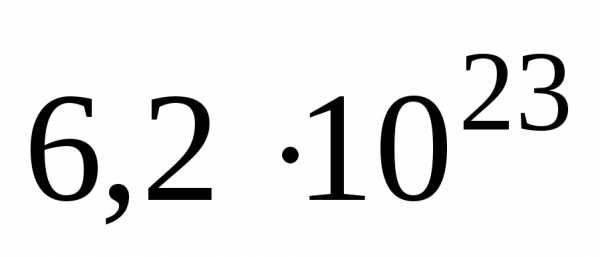 атомов, молекул, ионов водорода
соответственно.
атомов, молекул, ионов водорода
соответственно.
Масса 1 моль вещества называется молярной (или мольной) массой и выражается в г/моль.
Численно масса 1 моль любых структурных единиц равна массе этой структурной единицы, выраженной в а.е.м.
Одним из важнейших законов химии является закон постоянства состава.
Всякое химически чистое индивидуальное вещество, независимо от способа его получения, имеет постоянный качественный и количественный состав.
Исходя из представлений атомно-молекулярной теории это означает, что каждое химически чистое вещество состоит из одинаковых молекул, в состав которых входят атомы определенных элементов. При этом соотношение между числом атомов каждого элемента и, следовательно, соотношение между их массами определяются молекулярной формулой вещества и остаются постоянными независимо от количества вещества и способа его получения.
Вещества способны вступать между собой в химические реакции.
Процессы, при которых одни вещества превращаются в другие, отличающиеся от исходных своим составом и свойствами, называются химическими.
В основе химических процессов (реакций) лежит закон сохранения массы вещества.
Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Этот закон является частным случаем основополагающего закона природы – закона сохранения материи.
Закон сохранения массы вещества в химии выражается в составлении уравнения реакции, которое показывает, какие вещества и в каком количественном соотношении участвуют в данном процессе.
Химическое уравнение состоит из двух частей, соединенных знаком равенства. В левой части записываются формулы веществ, вступающих в реакцию, а в правой – формулы веществ, образующихся в результате реакции, согласно закону сохранения массы вещества. Число атомов каждого элемента в левой и правой частях уравнения должно быть одинаковым. Для этого в случае необходимости подбирают и расставляют перед формулами исходных и конечных веществ коэффициенты, которые называются стехиометрическими коэффициентами.
Так, уравнение взаимодействия гидроксида алюминия с серной кислотой
после подбора коэффициентов будет выглядеть следующим образом:
(1)
Коэффициенты в обеих частях уравнения химической реакции можно увеличивать или уменьшать в одинаковое число раз. Так, уравнение (1) можно записать следующим образом:
Примем nравным: а)2; б)1/2. Тогда уравнение (1) будет иметь вид
а) (2)
б) (3)
Все записанные уравнения удовлетворяют закону сохранения массы вещества.
Обычно расставляют минимальные целочисленные коэффициенты, причем коэффициент 1 опускается. В рассмотренном примере таким уравнением является уравнение (1). Уравнение реакции считается составленным только тогда, когда подобраны коэффициенты. Если при подборе коэффициентов не удается уравнять количество атомов в обеих частях уравнения, то это означает, что вещества, участвующие в реакции, написаны неправильно.
Химические уравнения можно складывать и вычитать как обычные алгебраические уравнения, если продукты одной реакции являются исходными веществами для другой. В этом случае расставляются удобные для сложения или вычитания коэффициенты.
Так, чтобы составить суммарное уравнение получения фосфорной кислоты из фосфора, кислорода и воды, надо составить два уравнения:
а)
б)
Чтобы исключить
промежуточное вещество 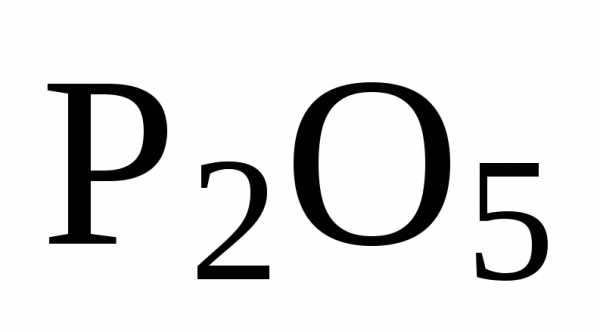 ,
надо удвоить коэффициенты в уравнении
б) и сложить оба уравнения
,
надо удвоить коэффициенты в уравнении
б) и сложить оба уравнения
+
______________________

Если в реакции участвуют газообразные вещества, то на основании уравнения реакции можно определить не только массы реагирующих газов, но их объемы. Объем газа зависит от его количества, давления и температуры.
Количественные расчеты объемов газообразных веществ, участвующих в химической реакции, базируются на законе Авогадро.
В равных объемах любых газов, взятых при одинаковой температуре и давлении, содержится одно и то же число молекул.
В соответствии с законом Авогадро одинаковое число молекул газа занимает при одних и тех же условиях одинаковый объем. С другой стороны, 1 моль любого вещества содержит (по определению) одинаковое число частиц. Отсюда следует важный вывод (следствие из закона Авогадро):
При определенных температуре и давлении 1 моль любого вещества в газообразном состоянии занимает один и тот же объем.
Поскольку объем данной массы газа зависит от давления и температуры, то при расчетах по химическим реакциям с участием газообразных веществ необходимо указывать условия, при которых находится газ. Наиболее употребительными являются так называемые «нормальные» условия (н.у.). К нормальным условиям относятся: температура 00С (273К) и давление, равное
Объем 1 моль любого газообразного вещества при нормальных условиях (н.у.) равен 22,4л.
Этот объем называется молярным или мольным объемом газа при нормальных условиях.
Вещества, способные распадаться в растворе или в расплаве на заряженные частицы (ионы), называются электролитами.
Положительно заряженные ионы называются катионами, а отрицательно заряженные – анионами.
Катионами являются ионы водорода, Н+, ион аммония,NН+4, ионы металлов, например,Na+,Ca2+,Al3+. К анионам относятся гидроксид-ион, ОН–, ионы кислотных остатков, например,Cl–,NO3–,SO42-.
Свойства ионов резко отличаются от свойств атомов соответствующих элементов. Так, натрий и калий разлагают воду с выделением водорода, а ионы Na+иK+такими свойствами не обладают.
Процесс распада молекул электролитов на ионы называется электролитической диссоциацией.
Электролитическая диссоциация является обратимым процессом, т.е. в растворе или расплаве одновременно протекают две реакции: распад молекул на катионы и анионы (КАК++ А–) и ассоциация (соединение) ионов в молекулы (К++ А–КА). Поэтому уравнение реакции электролитической диссоциации записывается следующим образом: КАК++А–; знакуказывает на обратимость процесса.
Поскольку электролитическая диссоциация – процесс обратимый, то в растворах электролитов одновременно присутствуют не только ионы, но и молекулы, не распавшиеся на ионы. Способность молекул данного электролита диссоциировать в растворе или расплаве характеризуется степенью диссоциации .
Степенью диссоциации называется отношение числа молекул (молей) электролита, распавшихся на ионы, к общему числу его молекул (молей). Степень диссоциации выражается либо в долях единицы, либо в процентах.
Все электролиты подразделяются на сильные и слабые. Сильные электролиты диссоциируют практически нацело, степень их диссоциации близка к единице (100%). В растворах сильных электролитов содержатся преимущественно ионы, недиссоциированных молекул практически нет.
Слабые электролиты характеризуются малой степенью диссоциации, поэтому в растворе присутствует значительное количество непродиссоциированных молекул.
К электролитам относятся кислоты, основания и соли.
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только ионы водорода. Образовавшийся при диссоциации кислоты анион называется кислотным остатком.
Так, при диссоциации азотной кислоты (HNO3) образуются ион водорода Н+и анионNO3–(нитрат-ион)
HNO3 Н++ NO3–.
Кислоты делятся на кислородосодержащие и бескислородные. Например, серная (H2SO4) и азотная (HNO3) кислоты – кислородосодержащие, а соляная (HCl) и сероводородная (H2S) – бескислородные.
Кислоты различают по основности. Основность кислот определяется числом атомов водорода, способных замещаться на металл.
Кислоты бывают разной силы, что характеризуется их степенью диссоциации. У сильных кислот степень диссоциации близка к единице, а у слабых – значительно меньше единицы.
Слабые кислоты диссоциируют ступенчато. Например, угольная кислота диссоциирует в две ступени:
Названия кислотных остатков, полученных при ступенчатой диссоциации кислот, образуются прибавлением приставки гидро- или дигидро- (по числу оставшихся в анионе ионов водорода) к названию кислотного остатка, полученного при полной диссоциации кислоты. Например, ион СО32-называется карбонат-ионом, а ион НСО3–– гидрокарбонат-ионом, ион РО43-называется фосфат-ионом (или ортофосфат-ионом), ионHPO42-– гидрофосфат-ионом, а ион Н2РО4–– дигидрофосфат-ионом).
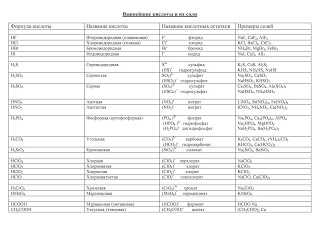
В таблице приведены формулы и названия некоторых кислот и их кислотных остатков.
Таблица
Формулы и названия кислот и кислотных остатков
Формула кислоты | Название кислоты | Кислотный остаток (анион) | Название аниона |
HCl | Сильные кислоты Соляная (хлористо-водородная) | Cl– | Хлорид |
HBr | Бромисто-водородная | Br– | Бромид |
HJ | Йодисто-водородная | J– | Иодид |
HNO3 | Азотная | NO3– | Нитрат |
H2SO4 | Серная | SO42 HSO4– | Сульфат Гидросульфат |
HF | Слабые кислоты Фтористо-водородная | F– | Фторид |
HNO2 | Азотистая | NO2– | Нитрит |
Формулы и названия кислот и кислотных остатков
H2S | Сероводородная | S2- HS– | Сульфид Гидросульфид |
H2SO3 | Сернистая | SO32- HSO3– | Сульфит Гидросульфит |
H2CO3 | Угольная | CO32- HCO3– | Карбонат Гидрокарбонат |
H2SiO3 | Кремниевая | SiO32- HSiO3– | Силикат Гидросиликат |
H3PO4 | Ортофосфорная(фосфорная) | PO43- HPO42- H2PO4– | Фосфат Гидрофосфат Дигидрофосфат |
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы (ОН–).
Основания имеют формулу Me(OH)n, где Ме – ион металла; ОН–– гидроксильная группа; n – количество гидроксильных групп, численно равное заряду иона металла (n+), например, K+OH,Ca2+(OH)2.
Запишем уравнение диссоциации основания на примере КОН
КОНК++ОН–
Названия гидроксидов образуются из слова гидроксид и названия металла: NaOH – гидроксид натрия, Ba(OH)2 – гидроксид бария. Если металл имеет переменную степень окисления, то в скобках указывается римской цифрой степень окисления металла в данном основании: Fe(OH)2 – гидроксид железа (П), Fe(OH)3 – гидроксид железа (Ш). Некоторые гидроксиды имеют специфические названия, например, гидроксид калия – едкое кали, гидроксид натрия – едкий натр, гидроксид кальция – гашеная известь.
Число гидроксильных групп в формуле основания определяет его кислотность. Например, NH4OH – однокислотное основание, Cu(OH)2 – двухкислотное.
Названия катионов, содержащих, кроме металла, гидроксильные ионы. образуются из названия металла с прибавлением приставки гидроксо-, причем, если в состав катиона входят две гидроксогруппы, то название будет включать приставку дигидроксо-. Так, катион, образующийся на первой стадии диссоциации гидроксида алюминия, Al(OH)2+, называется ионом дигидроксоалюминия, а катион, образующийся на второй стадии, Al(OH)2+ – ионом гидроксоалюминия.
Основания подразделяются на растворимые и нерастворимые, а также сильные и слабые. Так, все гидроксиды 1А группы Периодической системы элементов Д.И. Менделеева, например, NaOH, KOH, а также гидроксиды щелочно-земельных металлов, Ca(OH)2, Sr(OH)2, Ba(OH)2 – хорошо растворимые соединения и сильные электролиты. Они называются щелочами. Большинство гидроксидов других металлов плохо растворяются в воде и являются слабыми электролитами. Гидроксид аммония, NH4OH, диссоциирующий по уравнению NH4OH NH4++OH–, является слабым электролитом, но хорошо растворим в воде.
Существуют гидроксиды, способные проявлять как свойства кислот, так и свойства оснований. Такие гидроксиды называются амфотерными. К ним относятся, например, Be(OH)2, Zn(OH)2, Al(OH)3, Cr(OH)3 и др.
Солями называются электролиты, полученные при замещении ионов водорода в кислоте на ионы металла или гидроксид-ионов основания на анионы кислотного остатка.
При полном замещении образуются средние соли, например, K2SO4,Al(NO3)3,CuCO3. Средние соли состоят из ионов металла и ионов кислотного остатка, полученного при полном отщеплении всех ионов водорода в процессе диссоциации кислоты.
Названия средних солей складываются из названия кислотного остатка и названия металла. При этом, если металл имеет переменную валентность, то она указывается римской цифрой. Например, K2SO4– сульфат калия,Al(NO3)3– нитрат алюминия,CuCO3– карбонат меди (II).
При неполном замещении водорода в кислоте на металл образуются кислые соли. В этом случае кислотный остаток содержит один или два иона водорода, и соли называются в соответствии с названиями анионов, например, K2HPO4– гидрофосфат калия,KH2PO4– дигидрофосфат калия. Кислые соли образуют только многоосновные кислоты.
Основные соли являются продуктом неполного замещения гидроксид-ионов в основании на анионы кислотного остатка. В основных солях катион состоит из иона металла и одного или двух гидроксид-ионов. Если в состав катиона входит один гидроксид-ион, то к названию металла добавляется приставка гидроксо- , а если два, – то дигидроксо-, например CuOHCl– хлорид гидроксомеди (II),Al(OH)2NO3– нитрат дигидроксоалюминия. Основные соли образуют только многокислотные основания.
Помимо средних, кислых и основных солей, существуют также двойные, смешанные и комплексные соли, которые в данной работе не рассматриваются.
Кислоты, основания и соли – это электролиты. К неорганическим соединениям относится еще один класс соединений, которые не являются электролитами, – оксиды.
Оксидами называются вещества, состоящие из двух элементов, одним из которых является кислород.
Примеры оксидов: NO, NO2, Mn2O7, ZnO, K2O.
Названия оксидов образуются из слова “оксид” и названия элемента, образующего оксид, с указанием степени окисления этого элемента, которая записывается в скобках римской цифрой. Так, первые три из указанных оксидов называются: NO – оксид азота (П), NO2– оксид азота (IV), Mn2O7-оксид марганца (VII). В названиях последних трех оксидов не указывается степень окисления элемента, поскольку она постоянна для этих элементов: Al2O3– оксид алюминия, ZnO оксид цинка, K2O – оксид калия.
Оксиды по химическим свойствам подразделяются на солеобразующие и несолеобразующие, или безразличные. К солеобразующим оксидам относятся такие оксиды, которые при взаимодействии с кислотами или основаниями, а иногда и с кислотами, и с основаниями образуют соль. Безразличные оксиды не реагируют ни с кислотами, ни с основаниями. К ним относятся NO, N2O, CO.
Солеобразующие оксиды способны образовывать соли. Они делятся на основные, кислотные и амфотерные.
Основные оксиды – это оксиды, которым соответствуют основания.
Так, оксиду натрия соответствует основание NaOH, а оксиду кальция CaO – основание Ca(OH)2.
Кислотные оксиды – это оксиды, которым соответствуют кислоты.
Оксиду углерода (IV) – СО2 – соответствует угольная кислота Н2СО3, оксиду фосфора (V) – Р2О5– фосфорная кислота,H3PO4.
Кислотные оксиды иначе называются ангидридами соответствующих кислот, например, Р2О5– фосфорный ангидрид, СО2– угольный ангидрид.
Степень окисления элемента, образующего кислотный оксид, равна степени окисления этого элемента в соответствующей кислоте. Так, степень окисления углерода в СО2и Н2СО3равна +4, а степень окисления фосфора в Р2О5и Н3РО4равна +5.
Амфотерными оксидами называются оксиды, которым соответствуют амфотерные гидроксиды, проявляющие свойства как кислоты, так и основания.
Так, оксид цинка ZnO – амфотерный оксид, ему соответствует амфотерный гидроксид Zn(OH)2, оксид хрома (III) – Cr(OH)3– тоже амфотерен, ему соответствует амфотерный гидроксид Cr(OH)3. Амфотерные оксиды проявляют свойства как основных, так и кислотных оксидов.
Неорганические соединения (оксиды, кислоты, основания и соли) вступают в многочисленные реакции между собой, которые можно проследить на примере методов получения этих соединений.
studfiles.net
Лекция № 1 “Основные химические понятия и законы” – Лекции по химии – Студентам – Каталог файлов
Занятие №1. Основные химические понятия и законы. Расчёты по химическим формулам и уравнениям.
Теоретическая часть
1. Место и значение химии в системе наук.
Современная химия представляет собой систему научных дисциплин: общей,
неорганической, аналитической, органической физической, коллоидной химии,…Основой химической науки являются атомно-молекулярное учение, закон сохранения материи, периодический закон, теория химической связи и учение о химическом процессе.
Как всякая наука, химия изучает некоторую часть явлений окружающего мира. Химия играет значительную роль в научно-техническом прогрессе. Нет ни одной отрасли не связанной в той или иной мере с применением химии.
2. Основные понятия и законы химии
Химия – наука о свойствах вещества и его превращениях, она включает в себя законы и принципы, описывающие эти превращения, а так же представления и теории, позволяющие дать им объяснение.
Атомно-молекулярное учение заключается в следующем:
1. Все вещества состоят из молекул.
2. Молекулы состоят из атомов.
3. Молекулы и атомы находятся в непрерывном движении; между ними существуют силы притяжения и отталкивания.
Рассмотрим следующие определения:
Вещество – вид материи, которая обладает массой покоя.
Состоит из элементарных частиц: электронов, протонов, нейтронов, мезонов и др. Химия изучает главным образом вещество, организованное в атомы, молекулы, ионы и радикалы. Такие вещества принято подразделять на простые и сложные (хим. соединения). Простые вещества образованы
атомами одного хим. элемента и потому являются формой его существования в свободном состоянии, напр. Сера, железо, озон, алмаз. Сложные вещества образованы разными элементами и могут иметь состав постоянный (стехиометрические соединения или дальтониды) или меняющийся в некоторых пределах (нестехиометрические соединения или бертоллиды).
Молекула – наименьшая частица вещества, обладающая его химическими свойствами.
Атом – наименьшая частица химического элемента, сохраняющая все его химические свойства.
Различным элементам соответствуют различные атомы, обозначаемые символом данного элемента (Ag, Fe, Mg).
Химический элемент – это вид атомов, характеризующийся определенными зарядами ядер и строением электронных оболочек.
В настоящее время известно 118 элементов: 89 из них найдены в природе (на Земле), остальные получены искусственным путем. Атомы существуют в свободном состоянии, в соединениях с атомами того же или других элементов, образуя молекулы. Способность атомов
вступать во взаимодействие с другими атомами и образовывать химические соединения определяется его строением. Атомы состоят из положительно заряженного ядра и отрицательно заряженных электронов, движущихся вокруг него, образуя электронейтральную систему, которая
подчиняется законам, характерным для микросистем.
Ионы (от греч. ion – идущий), одноатомные или многоатомные частицы, несущие электрический заряд.
Положительные ионы называют катионами (от греч. kation, буквально – идущий вниз), отрицательные – анионами (от греч. anion, буквально идущий вверх). В свободном состоянии существуют в газовой фазе (в плазме).
Валентность (от лат. valentia – сила), способность атома присоединять или замещать определенное число других атомов или атомных групп с образованием химической связи.
Реакции химические (от лат. re- – приставка, означающая обратное действие, и actio –действие), превращения одних веществ (исходных соединений) в другие (продукты реакции) при неизменяемости ядер атомов.
Исходные вещества иногда называют реагентами, однако чаще (особенно в органической химии) термин “реагент” используют по отношению к одному, наиболее активному исходному соединению, определяющему направление химической реакции.
Химическая формула – это условная запись состава вещества с помощью химических знаков (предложены в 1814 г. Й. Берцелиусом) и индексов (индекс – цифра, стоящая справа внизу от символа. Обозначает число атомов в молекуле).
Химическая формула показывает, атомы каких элементов и в каком отношении соединены между собой в молекуле.
Простые вещества– молекулы, состоят из атомов одного и того же элемента.
Cложные вещества – молекулы, состоят из атомов различных химических элементов.
Аллотропия – явление образования химическим элементом нескольких простых веществ, различающихся по строению и свойствам.
Международная единица атомных масс равна 1/12 массы изотопа 12C – основного изотопа природного углерода.
1 а.е.м = 1/12 • m (12C) = 1,66057 • 10-27 кг
Относительная атомная масса (Ar) – безразмерная величина, равная отношению средней массы атома элемента (с учетом процентного содержания изотопов в природе) к 1/12 массы атома 12C.
Средняя абсолютная масса атома (m) равна относительной атомной массе, умноженной на а.е.м. Ar(Mg) = 24,312
m(Mg) = 24,312 • 1,66057 • 10-24 = 4,037 • 10-23 г
Относительная молекулярная масса (Mr) – безразмерная величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода 12C.
Mг = mг / (1/12 mа(12C))
mr – масса молекулы данного вещества;
mа(12C) – масса атома углерода 12C.
Mг = S Aг(э). Относительная молекулярная масса вещества равна сумме относительных
атомных масс всех элементов с учетом индексов.
Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на а.е.м.
Число атомов и молекул в обычных образцах веществ очень велико, поэтому при характеристике количества вещества используют специальную единицу измерения – моль.
Количество вещества, моль. Означает определенное число структурных элементов (молекул, атомов, ионов).
Обозначается n, измеряется в моль. Моль – количество вещества, содержащее столько же частиц, сколько содержится атомов в 12 г углерода.
Число Авогадро ди Кваренья (NA). Количество частиц в 1 моль любого вещества одно и то же и равно 6,02 • 1023. (Постоянная Авогадро имеет размерность – моль-1).
Молярная масса показывает массу 1 моля вещества (обозначается M).
M = m / υ
Молярная масса вещества равна отношению массы вещества к соответствующему количеству вещества и численно равна его относительной молекулярной массе, однако первая величина имеет размерность г/моль, а вторая – безразмерная.
M = NA • m(1 молекула) = NA • Mг • 1 а.е.м. = (NA • 1 а.е.м.) • Mг = Mг
Это означает, что если масса некоторой молекулы равна, например, 80 а.е.м. (SO3), то масса одного моля молекул равна 80 г. Постоянная Авогадро является коэффициентом пропорциональности, обеспечивающим переход от молекулярных соотношений к молярным. Все утверждения относительно молекул остаются справедливыми для молей (при замене, в случае необходимости, а.е.м. на г)
Например, уравнение реакции: 2Na + Cl2 ® 2NaCl, означает, что два атома натрия реагируют с одной молекулой хлора или, что одно и то же, два моль натрия реагируют с одним молем хлора.
3. Основные законы
Закон сохранения массы веществ (М.В.Ломоносов, 1748 г.; А.Лавуазье, 1789 г.)Масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Атомно-молекулярное учение этот закон объясняет следующим образом: в результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка (т.е. химическое превращение- это процесс разрыва одних связей между атомами и образование других, в результате чего из молекул исходных веществ получаются молекулы продуктов
реакции). Поскольку число атомов до и после реакции остается неизменным, то их общая масса также изменяться не должна. Под массой понимали величину, характеризующую количество материи. Исходя из закона сохранения массы, можно составлять уравнения химических реакций и
по ним производить расчеты. Он является основой количественного химического анализа.
Закон постоянства состава впервые сформулировал Ж.Пруст (1808 г)
Все индивидуальные химические вещества имеют постоянный качественный и количественный состав и определенное химическое строение, независимо от способа получения.
Из закона постоянства состава следует, что при образовании сложного вещества элементы соединяются друг с другом в определенных массовых соотношениях.
Пример.
CuS – сульфид меди. m(Cu) : m(S) = Ar(Cu) : Ar(S) = 64 : 32 = 2 : 1
Чтобы получить сульфид меди (CuS) необходимо смешать порошки меди и серы в массовых
отношениях 2 : 1.
Если взятые количества исходных веществ не соответствуют их соотношению в химической формуле соединения, одно из них останется в избытке.
Например, если взять 3 г меди и 1 г серы, то после реакции останется 1 г меди, который не вступил в химическую реакцию. Вещества немолекулярного строения не обладают строго постоянным составом.
Их состав зависит от условий получения.
Закон Авогадро ди Кваренья (1811 г.)
В равных объемах различных газов при одинаковых условиях (температура, давление и т.д.) содержится одинаковое число молекул. (Закон справедлив только для газообразных веществ.)
Следствия.
1. Одно и то же число молекул различных газов при одинаковых условиях занимает одинаковые объемы.
2. При нормальных условиях (0°C = 273°К , 1 атм = 101,3 кПа) 1 моль любого газа занимает объем 22,4 л.
Практическая часть
Проверьте себя, я задам эти вопросы устно (ответы в скобках – выучить!) Каждый правильный ответ оценивается в 1 балл.
1. Что такое атом?
(Атом – наименьшая частица химического элемента, сохраняющая все его химические свойства)
2. Что такое молекула?
( Молекула – наименьшая частица вещества, обладающая его химическими свойствам).
3. Что такое атомная масса?
(Относительная атомная масса (Ar) – безразмерная величина, равная отношению средней массы атома элемента (с учетом процентного содержания изотопов в природе) к 1/12 массы атома 12C)
4. Что такое относительная молекулярная масса? Как ее найти?
( Относительная молекулярная масса (Mr) – безразмерная величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода 12C. Чтобы ее посчитать, необходимо сложить атомные массы с учетом их стехиометрических коэффициентов)
5. Что такое молярная масса вещества? В каких единицах она выражается? (Молярная масса показывает массу одного моля вещества. Выражается в граммах на моль – г/моль.
6. Как вычислить количество вещества, зная массу, объём или число структурных единиц?
( n=m/M n=N/NА n=V/Vm)
Как формулируется закон Авогадро?
7. (В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул)
8. Что называется относительной плотностью одного газа по другому? (Отношение масс двух газов, занимающих равные объёмы при одинаковых условиях, называют относительной плотностью одного газа по другому и обозначают буквой D
D=M1/М2).
9. Сформулируйте закон постоянства состава.
(Состав соединений молекулярной структуры является постоянным независимо от способа получения. Состав соединений с немолекулярной структурой (атомной, ионной и металлической кристаллической решеткой) не является постоянным и зависит от способа получения).
10. Сформулируйте закон сохранения массы веществ.
(Масса веществ, вступивших в реакцию, равна массе образующихся продуктов)
lidijavk.ucoz.ru
Ну очень короткая шпаргалка по химии 8-9 класс
Вещества 1.Простые(состоят из атомов одного элемента и делятся на металлы и неметаллы) 2.Сложные (состоят из атомов разных элементов) | Порядковый номер элемента показывает 1 число протонов 2 число электронов 3 заряд ядра атома Число нейтронов = атомная масса минус порядковый номер |
Признаки химических реакций 1 изменение цвета 2 появление запаха 3 выделение газа 4 выделение тепла и света 5 выпадение и растворение осадка | Номер группы показывает число электронов на внешнем уровне Номер периода показывает число электронных уровней Главная подгруппа- длинная Побочная подгруппа- короткая |
В периоде слева направо 1 увеличивается заряд ядра 2 увеличивается число протонов 3 увеличивается число электронов на внешнем уровне 4 усиливаются неметаллические(окислительные) свойства 5 уменьшается радиус атома 6 ослабляются металлические (восстановительные ) свойства 7 число электронных уровней не меняется | В главной подгруппе сверху вниз 1 увеличивается число электронных уровней 2 увеличивается заряд ядра 3 усиливаются металлические (восстановительные )свойства 4 убывают неметаллические (окислительные) свойства 5увеличивается радиус атома 6 число электронов на внешнем уровне не меняется |
Реакции ионного обмена идут до конца в 3 случаях: образование газа ,осадка или воды | Окисление– отдача электронов Окислитель-частица, которая принимает электроны |
Оксиды делятся на 1 несолеобразующие(NO, N2O , CO) 2 кислотные– оксиды неметаллов 3 амфотерные(оксиды цинка, бериллия, алюминия) 4 основные– оксиды металлов Амфотерные оксиды и гидроксиды (гидроксиды цинка, алюминия , бериллия) взаимодействуют с кислотами и щелочами(основаниями) | Химич. свойства кислотных оксидов 1кисл. оксид+ вода=растворимая кислота 2кислотный оксид+основание= соль + вода 3 кислотный оксид+ основной оксид= соль Химич. свойства основных оксидов 1осн. оксид+ вода=растворимое основание 2основной оксид+кислота= соль + вода 3 кислотный оксид+ основной оксид= соль |
Химич. свойства оснований 1основание + кислота= соль + вода 2 Растворимое основание + растворимая соль= нерастворимое основание+ соль 3 основание + кислотный оксид=соль + вода 4 Нерастворимое основание при нагревании разлагается на оксид металла и воду | Химические свойства кислот 1Металл(до водорода)+ кислота= растворимая соль +газ водород 2основной оксид+кислота= соль + вода 3 основание + кислота= соль + вода 4.кислота+ соль= новая соль+ новая кислота(если образуется осадок или газ) |
Химическая связь 1 Металл+ неметалл – ионная 2Только металл– металлическая 3 Неметалл+ неметалл– ковалентная Неполярная –одинаковые Полярная разные неметаллы | Более активный металл вытесняет менее активный из раствора соли Две соли взаимодействуют , если образуется осадок |
Высшая положительная степень окисления = номеру группы(сколько отдадут) Отрицательная степень окисления только у неметаллов(сколько примут) |
Характеристики | Тип решетки | |||
Атомная | Ионная | Молекулярная | Металлическая | |
Вид частиц в узлах решетки | Атомы | Ионы:катионы, анионы | Молекулы | Атом-ионы |
Характер химической связи между частицами | Ковалентная | Ионная | Силы межмолекулярного взаимодействия | Металлическая связь между ионами металлов и свободными электронами |
Прочность связи | Очень прочная | Прочная | Слабая | Разной прочности |
Отличительные свойства веществ | Очень твердые, очень тугоплавкие, не растворимы в воде | Тугоплавкие, твердые, нелетучие, многие растворимы в воде. | Легкоплавкие, небольшой твердости, при обычных условиях часто газы или жидкости. | Электро-и теплопроводны, ковкие, пластичные, имеют металлический блеск |
Примеры веществ | Алмаз, кремний | NaCl, КОН, СаС12 | I2, лед Н20, «сухой лед», С02 | Cu, К, Mg, Ca. Zn, |
Химические свойства кислот 1. Действие на индикаторы: лакмус — красныйметилоранж — розовый 2. Взаимодействие с основаниями (реакция нейтрализации): h3SO4 + 2KOH = K2SO4 + 2h3O2HNO3 + Ca(OH)2 = Ca(NO3)2 + 2h3O 3. Взаимодействие с основными оксидами: CuO + 2HNO3 (под действиемt°) = Cu(NO3)2 + h3O 4. Взаимодействие с металлами: Zn + 2HCl = ZnCl2 + h32Al + 6HCl = 2AlCl3 + 3h3(металлы, стоящие в ряду напряжений до водорода, кислоты-неокислители). 5. Взаимодействие с солями (реакции обмена), при которых выделяется газ или образуется осадок: h3SO4 + BaCl2 = BaSO4? +2HC2HCl + K2CO3 = 2KCl + h3O + CO2 | Химические свойства оснований Щёлочи: 1. Действие на индикаторы: лакмус — красныйметилоранж — розовыйфенолфталеин — малиновый 2. Взаимодействие с кислотными оксидами.: 2KOH + CO2 = K2CO3 + h3OKOH + CO2 = KHCO3 3. Взаимодействие с кислотами (реакция нейтрализации): NaOH + HNO3 = NaNO3 + h3O 4. Обменная реакция с солями: Ba(OH)2 + K2SO4 = 2KOH + BaSO4?3KOH+Fe(NO3)3 = Fe(OH)3? + 3KNO3 5. Термический распад: Не распадается. Нерастворимые основания: 1. Действие на индикаторы: Нет 2. Взаимодействие с кислотными оксидами.: Не взаимодействует 3. Взаимодействие с кислотами (реакция нейтрализации): Cu(OH)2 + 2HCl = CuCl2 + 2h3O 4. Обменная реакция с солями: Нет 5. Термический распад: Cu(OH)2 –t°= CuO + h3O |
Основные оксиды: 1. Взаимодействие с водой Образуется основание:Na2O + h3O = 2NaOHCaO + h3O = Ca(OH)2 2. Взаимодействие с кислотой или основанием: При реакции с кислотой образуется соль и вода:MgO + h3SO4 (под действием температуры t°)= MgSO4 + h3OCuO + 2HCl (под действием температуры t°)= CuCl2 + h3O | Кислотные оксиды: 1. Взаимодействие с водой Образуется кислота:SO3 + h3O = h3SO4P2O5 + 3h3O = 2h4PO4 2. Взаимодействие с кислотой или основанием: При реакции с основанием образуется соль и вода:CO2 + Ba(OH)2 = BaCO3 + h3OSO2 + 2NaOH = Na2SO3 + h3O |
Оксиды- сложные вещества, состоящие из 2х элементов, один из которых кислород в степени окисления -2 CO2 N2O5 FeO
Кислоты состоят из водорода и кислотного остатка H2SO4 HCl
Основания состоят из металла и групп NaOH
Соли состоят из металла и кислотного остатка CuSO4 ,NaCl
“
”← Нурик 5-лаб Электротехника Нравственные основы воспитания школьников в современном российском образовании →
aplik.ru
Лекции по химии: Основные законы химии
Стехиометрические законы химии
1) Закон сохранения массы веществ: (М.В.Ломоносов, 1748г): масса веществ, вступивших в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Pb+O2=PbO (в реторте)
2) Закон постоянства состава: (Пруст, 1808г) – всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
3) С помощью значения относительной плотности были определены относительные молекулярные массы и уточнены составы молекул многих газообразных веществ. Молекулярная масса может быть вычислена также по уравнению состояния идеального газа или Уравнения Клапейрона-Менделеева.
или
P -давление газа в замкнутой системе
V – объем системы (м3)
m – масса газа (кг)
М – молярная масса
Т – абсолютная t° в Кельвинах
R – универсальная газовая постоянная
P = 101,325 кПа
Используемые величины:
Основные газовые законы химии:
1) Бойля–Мариотта при постоянной t°, давление, производимое данной массой газа, обратно пропорционально объему газа
t° – const.
2) Гей-Люссака при постоянном давлении объем газа изменяется прямо пропорционально абсолютной температуре
, при P – const.
3) Шарля: при постоянном объеме давление газа изменяется прямо пропорционально абсолютной температуре.
, при V – const.
4) Объединенный закон Бойля-Мариотта, Гей-Люссака и Шарля:
Парциальным давлением газа в смеси называется давление, производил бы этот газ, занимая при тех же физических условиях объем все газовой смеси.
Общее давление газовой смеси равно Σ парциальных давлений.
3. Закон кратных отношений.
Если два элемента образуют друг с другом несколько соединений, то на одну и ту же массу одного из них приходятся такие массы другого, которые относятся как небольшие целые числа.
FeO Fe2O3
w(Fe) = 78% w(O) = 22% | Fe – x O –y |
x : y – ? | x : y |
Fe : O =
FeO – простейшая формула.
4) Закон эквивалентов: (открыт в конце XVIIIв.) – вещества взаимодействуют между собой в количествах, пропорциональных их химическим эквивалентам.
Эквивалент – химическим эквивалентом элемента называется такое его количество, которое соединяется с 1 моль атомов водорода или замещает то же количество атомов водорода в химических реакциях. Химический эквивалент не является постоянной величиной, он зависит от валентности элемента.
К середине XIX века в химии сложился свой язык, который был узаконен на первом международном съезде химиков в 1860 году в г.Карлсруэ (Германия). начальные буквы их латинских наименований O – oxygenium – кислород
Каждое соединение обозначается химической формулой, которая показывает качественный и количественный состав вещества.
Na2SO4 – 2 атома Na
1 атом серы
4 атома кислородаВ практике используются 3 (три) вида формул.
1) Эмпирическая (простейшая)
H2O, NaOH, CH4, и т.д.
2) Молекулярная, которая уточняет эмпирическую и показывает сложные ионы, молекулы или фрагменты, входящие в формулу.
KAl(SO4)2 • 12H2O; (NH4)2S2O8; C6H6
3) Структурная или графическая
С6H6 C2H2 CHCH
H2O2 H – O – O – H H2SO4
Любое химическое превращение одних соединений в другие называется химической реакцией:
C2H5OH + 3O2 → 3H2O+2CO24. Закон простых объемных отношений, или «химический» закон (Гей-Люссак, 1808) – объемы вступающих в реакцию газов при одинаковых условиях относятся друг к другу, а также к объемам образующихся газообразных продуктов как небольшие целые числа.
5. Закон Авогадро: (Авогадро, 1811г.) – в равных объемах различных газов при одинаковых условиях (t˚ и давлении) содержится одинаковое число молекул. Из закона вытекают 2 следствия:
1. 1 моль любого газа при одинаковых условиях занимает один и тот же объем – равный 22,4 л. (t˚-0˚C и давление 1,01325•105 Па). В этом же объеме находится 6,023•1023 молекул газообразного вещества.
2. Массы равных объемов двух газов, взятых при одинаковом давлении и to, относятся друг к другу как их молярные массы:
, также плотности газов относятся как их относительные молекулярные массы: , Д – относительная плотность.
6. Периодический закон и периодическая система химических элементов Д.И.Менделеева.
Для правильного написания химических формул надо знать валентность элементов или степень окисления. Валентностью называется способность атомов данного элемента присоединять или замещать определенное число других атомов.
max вал. = 8.
Мы живем в эпоху научно-технического прогресса, который определяется успехами науки и техники и внедрением их достижений в народное хозяйство.
Химия внедряется во все отрасли производства. Химические процессы используются в сельском хозяйстве, в медицине, в быту. Развитие науки и техники ставит перед химиками задачу получения новых, неизвестных в природе веществ и материалов – сверхпроводников, полупроводников, диэлектриков. Это создает предпосылки для бурного развития электротехники и радиоэлектроники.
Огромными темпами развивается производство полимерных материалов, существенна роль химии в развитии ракетной техники и космонавтики, в создании «ядерного горючего» и особых материалов для реакторов и защиты от радиации.
Продуктивность сельского хозяйства резко возрастает при использовании химических удобрений и химических средств борьбы с болезнями и вредителями сельскохозяйственных растений.
В наши дни наблюдается новый этап развития химии, который направлен на создание наиболее экономичного и экологически «чистого» химического производства.
Также можете прочитать:
lech-ximiya.blogspot.com
Все правила по химии 7 класс — Юридический статус
Все правила по химии 7 класс
Химия 7 класс познакомит школьников с новой интересной наукой. Изучение химии поможет лучше понять биологию, разнообразие растений, животных, поскольку это разнообразие зависит от веществ и тех процессов, происходящих в организмах. Вещества и химические процессы изучает химия. Следовательно, чтобы понять биологию, надо изучать химию. Гипермаркет знаний дает возможность изучать химию в режиме онлайн, используя опубликованные конспекты уроков, рефераты, презентации, кроссворды, практикумы, лабораторные, кейсы и много других интересных материалов. В течение интерактивного обучения детей знакомят с основными химическими понятиями, простыми веществами, металлами и неметаллами.
Первоначальные химические понятия
Элементы Оксиген и Феррум. Простые вещества кислород и железо
Попель П. П., Крикля Л. С., Хімія: Підруч. для 7 кл. загальноосвіт. навч. закл. — К.: ВЦ «Академія», 2008. — 136 с.: іл.
Уроки химии для 7 класса,химия7 класс ГДЗ скачать, уроки по химии, физике идругим предметам в школе
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь — Образовательный форум.
edufuture.biz
Химия, 7 класс, Шиманович И.Е., 2012
Химия, 7 класс, Шиманович И.Е., 2012.
Вы приступаете к систематическому изучению нового школьного предмета — химии. Но являются ли новыми для вас термины химия, химический? Наверное, вы еще раньше не раз слышали эти слова от взрослых, по радио и телевидению, в школе. Это говорит о том, что химия и все, что с ней связано, стало неотъемлемой частью жизни человека, его повседневной деятельности.
Краткие сведения по истории химии.
Вы познакомились с некоторыми понятиями нового для вас предмета. Химия — это одна из естественных наук, т. е. наук об окружающем мире, природе и явлениях, происходящих в ней, превращениях веществ. То, что вещества способны изменяться, превращаться в другие, обладающие новыми свойствами, человек заметил еще в глубокой древности.
Костер стал первой химической лабораторией человека. После обжига глины в огне она становилась прочной, из нее можно было делать нехитрую посуду. На огне человек научился готовить пищу из мяса убитых животных, плодов растений. Здесь же человек случайно получил первые металлы — медь, олово, свинец, а также стеклянные изделия из, казалось бы, обычного песка.
Так появились первые, как мы сейчас говорим, химические ремесла — гончарное и металлургическое. Примерно 7000 лет назад человек научился выплавлять медь (рис. 26) и делать из нее различные изделия — орудия труда, предметы домашнего обихода, оружие. Этот период в истории древней цивилизации получил название медный век.
СОДЕРЖАНИЕ
От авторов 3
Как пользоваться учебником 5
Общие правила поведения и работы в кабинете химии 6
Введение
§1. Что изучает химия? 7
Лабораторный опыт 1. Изучение физических свойств веществ 10
§2. Чистые вещества и смеси 12
§3. Знакомство с химической лабораторией 18
Практическая работа 1. Приемы обращения с простейшим лабораторным оборудованием
Практическая работа 2. Разделение неоднородной смеси 20
§4. Краткие сведения по истории химии 22
Глава 1 Основные химические понятия
§5. Атомы. Химические элементы 27
§6. Относительная атомная масса химических элементов 32
§7. Молекулы. Простые вещества 36
§8. Сложные вещества 41
Лабораторный опыт 2. Ознакомление с образцами простых и сложных веществ 43
§9. Химическая формула 46
§10. Валентность 49
§11. Относительная молекулярная и относительная формульная массы 54
§12. Химическое количество вещества. Моль 58
§13. Молярная масса. Молярный объем 64
Практическая работа 3. Химическое количество вещества 69
Глава 2 Химические реакции
§14. Явления физические и химические. Признаки химических реакций 70
Лабораторный опыт 3. Признаки химических реакций 74
§15. Закон сохранения массы веществ. Химические уравнения 77
§16. Составление уравнений химических реакций 81
§17. Типы химических реакций 85
§18. Расчеты по уравнениям химических реакций 89
Практическая работа 4. Изучение признаков химических реакций и условий их протекания 93
Глава 3 Кислород
§19. Воздух как смесь газов 95
Лабораторный опыт 4. Сборка простейших приборов для получения и собирания газов 99
§20. Кислород и озон 100
§21. Получение кислорода 105
§22. Физические и химические свойства кислорода 109
Практическая работа 5. Получение кислорода и изучение его свойств 114
§23. Соединения элементов с кислородом 115
Лабораторный опыт 5. Ознакомление с образцами оксидов 116
§24. Окислительные процессы 118
Глава 4 Водород
§25. Водород как химический элемент и как простое вещество 125
§26. Химические свойства водорода 129
§27. Понятие о кислотах 133
Лабораторный опыт 6. Действие кислот на индикаторы 136
§28. Выделение водорода в реакциях кислот с металлами 138
Лабораторный опыт 7. Взаимодействие кислот с металлами 140
§29. Соли — продукты замещения атомов водорода в молекулах кислот на атомы металлов 142
§30. Получение водорода и его применение 145
Глава 5 Вода
§31. Состав и физические свойства воды 150
§32. Химические свойства воды 154
§33. Понятие об основаниях 158
Лабораторный опыт 8. Действие растворимых оснований на индикаторы 160
Практическая работа 6. Реакция нейтрализации 162
§34. Вода в природе 163
Глава 6 Основные классы неорганических соединений
§35. Оксиды 169
§36. Химические свойства оксидов 172
§37. Получение и применение оксидов 178
§38. Кислоты 181
§39. Химические свойства кислот 183
§40. Получение и применение кислот 188
§41. Основания 192
§42. Получение и применение оснований 196
Лабораторный опыт 9. Получение нерастворимого основания 199
§43. Соли 200
§44. Химические свойства солей 203
Лабораторный опыт 10. Взаимодействие солей с металлами 206
§45. Получение солей 207
§46. Взаимосвязь между классами неорганических веществ 210
Практическая работа 7. Решение экспериментальных задач 215
Ответы на расчетные задачи 217.
Бесплатно скачать электронную книгу в удобном формате и читать:
nashol.com
ГДЗ вводный курс по химии 7 класс Габриелян О.С. ФГОС

ГДЗ Химия Вводный курс 7 класс» редакции О.С. Габриелян, Остроумов И.Г., Ахлебинин А.К. является решебником к оригинальному школьному учебнику химии. Пособие содержит весь теоретический и практический материал, который включен в программу, утвержденную ФГОС. Учитывая сложность науки, школьник может столкнуться с проблемами восприятия новых знаний и быстро потерять к ним интерес. ГДЗ создан с целью облегчить процесс обучения, чтобы знания не заучивались, а выводились на основании элементарных первоначальных сведений, таких как строение атома.
В решебнике к учебнику по химии 7 класс Габриелян включены все ответы на вопросы, которые приводятся к каждому параграфу и помогут ученику сформулировать собственное мнение касательно связи химии с другими науками.
Для того, чтобы понять процесс соединения химического элемента с другими, познать виды форм его существования, решебник предлагает заглянуть и проанализировать готовые практические работы. В них четко структурирована и расписана суть каждого действия происходящего в ходе лабораторной работы.
Хоть раз воспользовавшись пособием при решении задач, подросток поймет, что его использование значительно сокращает время на домашние задания и подготовку к контрольным работам. Все основные правила, уравнения по химическим реакциям и ключевые слова выделены для лучшего зрительного запоминания. Процедуры химических реакций также проиллюстрированы и понятны для восприятия. Используя данную книгу, любой учащийся заложит отличный старт в изучении новой науки.
gdz.ru
Химия, Тетрадь для лабораторных опытов и практических работ, 7 класс, Сечко О.И., 2016
Химия, Тетрадь для лабораторных опытов и практических работ, 7 класс, Сечко О.И., 2016.
Тетрадь является приложением к учебнику «Химия 7». В ней содержатся все лабораторные опыты и практические работы, предусмотренные учебной программой. предлагаются рациональные и эффективные способы их оформления. После каждого лабораторного опыта приводятся разноуровневые задания для самостоятельного закрепления знаний. Рекомендуется учащимся 7 класса учреждений общего среднего образования.
Общие правила безопасного поведения в кабинете химии.
1. Прежде чем приступить к выполнению лабораторных опытов и практических работ, необходимо подробно изучить порядок их проведения и далее при выполнении следовать указаниям, приведенным при описании опытов.
2. Следует строго соблюдать все указания учителя по безопасному обращению с приборами и реактивами.
3. В кабинете химии запрещается:
• принимать пищу;
• пробовать реактивы на вкус;
• использовать химическую посуду для питья воды;
• брать руками твердые сыпучие реактивы; необходимо использовать для этого совки, ложечки, шпатели;
• оставлять открытыми склянки с реактивами, выливать остатки реактивов в раковину;
• самостоятельно проводить опыты, не предусмотренные практической работой;
необходимо:
• при нагревании жидкостей держать сосуд отверстием от себя и не направлять его на соседей;
• для определения веществ по запаху осторожно направить ладонью поток газа от отверстия пробирки к себе;
• использованные фильтры, реактивы, битое стекло, обрывки бумаг и т. п. собирать в специальные емкости.
СОДЕРЖАНИЕ
Предисловие
Общие правила безопасного поведения в кабинете химии
Лабораторные опыты
Лабораторный опыт № 1. Изучение физических свойств веществ
Лабораторный опыт № 2. Ознакомление с образцами простых и сложных веществ
Лабораторный опыт № 3. Признаки химических реакций
Лабораторный опыт № 4. Сборка простейших приборов для получения и собирания газов
Лабораторный опыт № 5. Ознакомление с образцами оксидов
Лабораторный опыт № 6. Действие кислот на индикаторы
Лабораторный опыт № 7. Взаимодействие кислот с металлами
Лабораторный опыт № 8. Действие растворимых оснований на индикаторы
Лабораторный опыт № 9. Получение нерастворимого основания
Лабораторный опыт № 10. Взаимодействие солей с металлами
Практические работы
Практическая работа № 1. Приемы обращения с простейшим лабораторным оборудованием
Практическая работа № 2. Разделение неоднородной смеси
Практическая работа № 3. Химическое количество вещества
Практическая работа № 4. Изучение признаков химических реакций и условий их протекания
Практическая работа № 5. Получение кислорода и изучение его свойств
Практическая работа № 6. Реакция нейтрализации
Практическая работа № 7. Решение экспериментальных задач по теме «Основные классы неорганических соединений»
Приложение.
Бесплатно скачать электронную книгу в удобном формате и читать:
nashol.com
Основы химии. Интернет-учебник.
Оглавление
Вы зашли на образовательный сайт, в основу которого был положен экспериментальный учебник по химии для 8-11 классов средней школы 1) , изданный в конце 90-х небольшим тиражом в рамках федеральной программы «Индивидуализация обучения». Учебник предназначался как для начинающих химиков, так и для выпускников школ и абитуриентов. В последующие годы материал серьезно перерабатывался и расширялся. Заготовки для следующего нашего учебника 2) превратились в 9-ю и 10-ю главы интернет-издания.
Первоначально весь материал был разбит на три уровня, но при переработке для интернет-издания число уровней сокращено до двух – базового и углубленного. Базовый уровень достаточен для того, чтобы понять, с чем имеет дело химия и успешно сдавать экзамены (в том числе ЕГЭ) именно на основе такого понимания. Углубленный уровень найдет своего читателя среди тех школьников и студентов, которые хотели бы «копнуть» химию глубже, чем позволяют рамки образовательного стандарта. Углубленный уровень мы советуем читать вместе с 1-м уровнем.
Читатель, желающий освоить только более легкий базовый уровень, может пропускать разделы 2-го уровня (они помечены звездочками (**) и напечатаны темно-синим шрифтом). При этом целостность восприятия материала не нарушается.
Интернет-издание периодически пополняется ссылками на видеоматериалы из Единой коллекции цифровых образовательных ресурсов, 100+ экспериментов по химии, Учебные видеоматериалы химического факультета МГУ, других качественных образовательных сайтов.
С помощью нашего учебника можно не только начинать изучение химии «с нуля», но и повторять предмет для подготовки к серьезным экзаменам. Студентам он поможет восполнить пробелы в школьном образовании.
Интернет-издание существенно дополнено и исправлено по сравнению с изданием 1998 г.
В книжных магазинах продается издание 2016 года (издательство «Центрполиграф», 9 глав, 416 стр), исправленное и доработанное
Издание 2014 года содержит небольшое количество опечаток, которые исправлены ЗДЕСЬ. На этой же ссылке можно посмотреть перечень книжных магазинов, в которых продается книга.
Об авторах:
Александр Викторович Мануйлов – к.х.н., ведущий научный сотрудник Института педагогических исследований одаренности детей РАО, доцент кафедры биомедицинской физики НГУ, профессор кафедры химии СУНЦ НГУ.
Владимир Иванович Родионов – к.х.н., преподаватель кафедры органической химии НГУ, начальник подразделения опытного химического производства Новосибирского института органической химии СО РАН.
1) А.В.Мануйлов, В.И.Родионов. «Химия, 8 и 11 классы. Три уровня обучения». Новосибирск: НГУ, 1998 г, 350 с.
2) А.В.Мануйлов, В.И.Родионов. «Химия, 9 и 11 классы. Три уровня обучения».
www.hemi.nsu.ru
yurist-moscow.ru
Правила –» Химия –» Правила по химии
Производством химических элементов могут заниматься только люди со скилом “ученый”. На начало игры ему известны некоторые рецепты, другие он может узнать в процессе игры любыми возможными способами. Однако, сами рецепты приготовления элементов могут быть известны любому человеку.
Производить элементы возможно только в лаборатории и только в присутствии хранителя лаборатории.
Чтобы создать элемент, нужно собрать все необходимые компоненты, прийти в лабораторию и действовать по указанию хранителя и по рецепту. Если рецепт верный и вас никто не обманул, то после отыгрыша и смешивания компонентов, ученый получает продукт.
|
Что можно сделать: 1 зидрат 2. орган 3. жир 4. антисептик 5. мыло 6. кислота 7. веселящий газ 8. глицерин 9. тротил 10. панический газ 11. парализующий газ 12. транквилизатор 13. ботекс 14. кокаин 15. слезоточивый газ 16. горючая смесь 17. искусственный орган |
Из чего: 1. труп 2. нашатырь (уксус) 3. спирт (газированная минералка) 4. стиральный порошок (сода) 5. удобрение (овсянка) 6. шалфей 7. Эссенция (аромомасло) 8. краска 9. перец |
все ингредиенты вы можете добыть на полигоне игровыми методами у различных персонажей.
зидрат может добываться только человеком со скилом добычи зидрата. никто иной добыть зидрат не может.
все остальные составы могут быть приготовлены либо медиком, либо ученым.
sincity.allrpg.info
Какие 20% знаний определяют 80% успеха на ЕГЭ по химии?
Статистика беспощадно утверждает, что даже далеко не каждому школьному “отличнику” удается сдать ЕГЭ по химии на высокий балл. Известны случаи, когда они не преодолевали нижнюю границу и даже “заваливали” экзамен. Почему? Какие существуют хитрости и секреты правильной подготовки к итоговой аттестации? Какие 20% знаний на ЕГЭ важнее остальных? Давайте разбираться. Сначала – с неорганической химией, через несколько дней – с органической.1. Знание формул веществ и их названий
Не выучив все необходимые формулы, на ЕГЭ делать нечего! В современном школьном химическом образовании – это существенный пробел. Но вы же не учите русский или английский язык, не зная азбуку? В химии есть своя азбука. Так что не ленимся – запоминаем формулы и названия неорганических веществ:
2. Применение правила противоположности свойств
Даже не зная детали тех или иных химических взаимодействий, многие задания части А и части В можно выполнить безошибочно, зная только это правило: взаимодействуют вещества, противоположные по своим свойствам, то есть, кислотные (оксиды и гидроксиды) – с основными, и, наоборот, основные – с кислотными. Амфотерные – и с кислотными, и с основными.
Неметаллы образуют только кислотные оксиды и гидроксиды.
Металлы более разнообразны в этом смысле, и все зависит от их активности и степени окисления. Например, у хрома, как известно, в степени окисления +2 – свойства оксида и гидроксида основные, в +3 – амфотерные, в +6 – кислотные. Всегда амфотерны бериллий, алюминий, цинк, а, значит, и их оксиды и гидроксиды. Только основные оксиды и гидроксиды – у щелочных, щелочно-земельных металлов, а также у магния и меди.
Также правило противоположности свойств можно применить к кислым и основным солям: вы точно не ошибетесь, если отметите, что кислая соль вступит в реакцию со щелочью, а основная – с кислотой.
3. Знание “вытеснительных” рядов
- Вытеснительный ряд металлов: металл, стоящий в ряду активностей левее вытесняет из раствора соли только тот металл, который находится правее его: Fe + CuSO4 = Cu + FeSO4
- Вытеснительный ряд кислот: только более сильная кислота вытеснит из раствора соли другую, менее сильную (летучую, выпадающую в осадок) кислоту. Большинство кислот справляется и с нерастворимыми солями: Na2CO3 + 2HCl = 2NaCl + CO2 + h3O
- Вытеснительный ряд неметаллов: более сильный неметалл (в основном, речь идет о галогенах) вытеснит более слабый из раствора соли: Cl2 + 2 NaBr = Br2 + 2 NaCl
4. Всегда спасет ситуацию четкая система знаний – но все может погубить “каша” в голове.
Не нужно читать дополнительные толстые учебники и пытаться вбить в голову массу новых сведений, если не помните основных. Выстройте сначала “скелет” из самого главного, а потом уже “наращивайте мышцы”. Лишь то, что нужно – и ничего лишнего – вы найдете в пособии “Миниатюрный курс химии для 100% успеха на ЕГЭ”. Выучите его как следует и блистайте на ЕГЭ!P.S. Если вам трудно самостоятельно весь материал разложить по полочкам и привести его в систему, то используйте готовых “помощников”, которые находятся здесь:
him-ege.blogspot.com

