1.2. Строение и характеристики атомов
Атомы различных химических элементов отличаются прежде всего по их массе, и атомная масса в какой-то мере определяет периодичность повторения химических свойств различных атомов, однако массовое число A не является однозначной характеристикой атомов любых веществ.
Действительной характеристикой, определяющей физико-химическую индивидуальность атома вещества, является его атомный номер (z) в открытой Д. И. Менделеевым Периодической Системе элементов. Называя атомный номер элемента z, мы фактически называем сам этот элемент, об атомах которого идет речь.
Например, если z = 6, нам ясно, что речь идет об углероде (С), а если z = 92, это равносильно тому, что элемент назван ураном (U), и т.д.
Поэтому атомный номер элемента z – характеристика,
Итак, массовое число A и атомный номер z элемента – пара характеристик, полностью определяющих физико-химическую индивидуальность атомов любого вещества.
Атомная теория раскрывает физический смысл этих характеристик в следующих основных положениях:
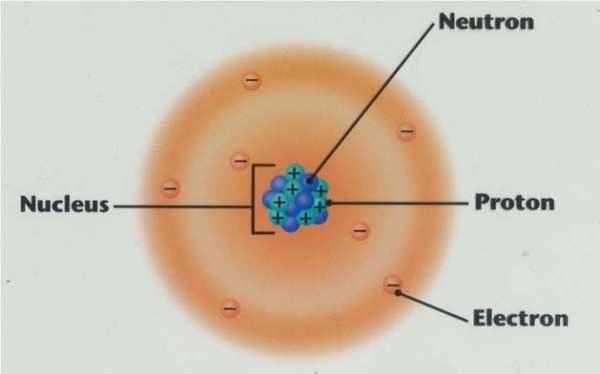
а) Все атомы состоят из положительно заряженного ядра и обращающихся вокруг него отрицательно заряженных частиц – электронов.
б) Электрический заряд электрона qe = – 1.6022 .10-19 Кл
в) Атомный номер элемента z – есть не что иное, как суммарное количество электронов в атоме.
г) Поскольку устойчивый атом любого химического элемента электронейтрален, отрицательный заряд электронных оболочек в атоме нейтрализуется равным по величине положительным зарядом ядра. Поэтому другое представление об атомном номере состоит в том, что атомный номер химического элемента – это положительный заряд ядра
д) Масса покоя одиночного электрона mе = 9.1095.10-28 г, что соответствует приблизительно 5.486.10-4 а.е.м. Разница в порядках величин масс всего атома (от единицы до сотен а.е.м.) и электронов в нём (от 5.486.10-4 до величин порядка 10-2 а.е.м.), которая, как видно из приведенных цифр, составляет четыре порядка, приводит к выводу о том, что практически вся масса атома сосредоточена в его ядре.
е) Размеры атомов, найденные в экспериментах, выполненных по различным методикам, имеют порядок 10-8 см, тогда как размеры их ядер – величины порядка 10-13 см. Эти цифры свидетельствуют о том, что ядро занимает ничтожную часть объёма атома.
Если под объёмом ядра понимать сферу, в пределах которой эффективно действуют ядерные силы, радиус этой сферы можно оценить по полуэмпирической формуле:
Rя » 1.21.10-13 А1/3
где А, а.е.м. – атомная масса элемента.
1.3. Строение ядер и свойства ядерных сил
1.3.1. Ядро любого атома имеет сложную структуру и состоит из частиц, называемых нуклонами. Известно два типа нуклонов – протоны и нейтроны.
Протоны – нуклоны массой 1 а.е.м. с положительным зарядом, равным единице, то есть элементарному заряду электрона.
Нейтроны – электронейтральные нуклоны массой 1 а.е.м.
*)
Строго говоря, массы покоя протонов и
нейтронов несколько отличаются:
m
1.3.2. Так как масса ядра практически равна A, заряд ядра – z, а массы протона и нейтрона практически равны, при таких представлениях следует принять как должное, что ядро электронейтрального устойчивого атома состоит из z протонов и (A – z) нейтронов. Следовательно, атомный номер элемента – есть не что иное как протонный заряд ядра атома, выраженный в элементарных зарядах электрона. Другими словами, z – это число протонов в ядре атома.
1.3.3. Наличие в ядре протонов (частиц с электрическим зарядом одного знака) вследствие кулоновских сил отталкивания между ними должно было бы привести к разлёту нуклонов. В реальности этого не происходит. Существование в природе множества устойчивых ядер приводит к выводу о существовании между нуклонами ядра более мощных, чем кулоновы, ядерных сил притяжения, которые, преодолевая кулоновское отталкивание протонов, стягивают нуклоны в устойчивую структуру – ядро.
1.3.4. Размеры ядер атомов, определенные по формуле (1.4), есть величины порядка 10-13см. Отсюда первое свойство ядерных сил (в отличие от кулоновых, гравитационных и других) –
Даже не зная точно, что за материальное образование представляет собой протон или нейтрон, можно оценить их эффективные размеры как диаметр сферы, на поверхности которой ядерное притяжение двух соседних протонов уравновешивается их кулоновским отталкиванием. Эксперименты на ускорителях по рассеянию ядрами электронов позволили оценить эффективный радиус нуклона Rн » 1.21 .10-13см.
1.3.5. Из короткодействия ядерных сил вытекает второе их свойство, кратко именуемое
1.3.6. Третье свойство ядерных сил – их равнодействие. Поскольку предполагается, что силы взаимодействия между нуклонами обоих видов являются силами одной природы, предполагается, что на расстояниях порядка 10-13 см два протона, два нейтрона или протон с нейтроном взаимодействуют одинаково.
on1®1p1 + –1e + n
*) Антинейтрино (n) – электронейтральная частица материи с нулевой массой покоя.
1.3.8. Итак, любое ядро считается полностью индивидуализированным, если известны две его основные характеристики – число протонов z и массовое число A, поскольку разница (A – z) определяет число нейтронов в ядре. Индивидуализированные ядра атомов принято в общем случае называть
Среди множества нуклидов (а их в настоящее время известно около 2000 – естественных и искусственных) есть такие, у которых одна из двух упомянутых характеристик одинакова, а другая – отличается по величине.
Нуклиды с одинаковым z (числом протонов) называют изотопами. Поскольку атомный номер определяет в соответствии с Периодическим Законом Д.И.Менделеева индивидуальность только химических свойств атома элемента, об изотопах всегда говорят со ссылкой на соответствующий химический элемент в Периодической Системе.
Например, 233U, 234U, 235U, 236U, 238U, 239U – все это изотопы урана, который в Периодической Системе элементов имеет порядковый номер z = 92.
Изотопы любого химического элемента, как видим, имеют равное число протонов, но различные числа нейтронов.
Нуклиды равной массы (A), но с различными зарядами z называют изобарами. Изобары, в отличие от изотопов, – нуклиды различных химических элементов.
1.3.9. Из формулы (1.4) можно оценить плотность нуклонов в ядрах и массовую плотность ядерного вещества. Считая ядро сферой с радиусом R и с количеством нуклонов в ее объёме, равным A, число нуклонов в единице объёма ядра найдём как:
Nн = A/Vя = 3А/4pR3 = 3А/4p(1.21 .10-13A 1/3)3 = 1.348 .1038 нукл/см3,
а, так как масса одного нуклона равна 1 а.е.м. = 1.66056.10-24г, то плотность ядерного вещества найдётся как:
gяв= Nmн= 1.348 .1038 .1.66056 .10-24 » 2.238 .1014г/см3.= 223 800 000 т/см3
Порядок приведенного расчёта свидетельствует о том, что плотность ядерного вещества одинакова в ядрах всех химических элементов.
Объём. приходящийся на 1 нуклон в ядре,
Vя/A = 1/N = 1/1.348 .1038 = 7.421 .10-39см3
также одинаков для всех ядер, поэтому среднее расстояние между центрами соседних нуклонов в любом ядре (которое можно условно назвать средним диаметром нуклона) будет равно
Dн = (Vя)1/3 = (7.421 .10-39)1/3 = 1.951 .10-13см.
1.3.10. О плотности расположения протонов и нейтронов в ядре атома до настоящего времени мало что известно. Поскольку протоны, в отличие от нейтронов, подвержены действию не только ядерного и гравитационного притяжения, но и кулоновского отталкивания, можно предположить, что протонный заряд ядра более или менее равномерно распределен по его поверхности.
1.4. Энергия связи и устойчивость атомов
1.4.1. Масса (m) и энергия (Е) – две формы существования материи, пропорционально взаимосвязанные между собой соотношением А.Эйнштейна
Е = mc2, (1.5)
где с – скорость света в вакууме (с = 2.997924 .108м/с)
studfiles.net
Атом и его устройство как устроен атом
June 10, 2012
Как устроен атом
Также читайте: атомная бомба
Атом представляет собой наименьшую химически неделимую часть химического элемента, которая является носителем его свойств. В состав атома входят электроны и атомное ядро, которое в свою очередь состоит из незаряженных нейтронов, а также положительно заряженных протонов. Если количество электронов и протонов совпадает, то атом является электрически нейтральным. В обратном случае он имеет либо отрицательный, либо положительный заряд и в таком случае его называют ионом.
Атомы классифицируются по числу нейтронов и протонов в ядре: число нейтронов определяет его принадлежность к какому-либо изотопу химическому элементу, число протонов — непосредственно к этому элементу. Атомы разных видов в различных количествах, которые при этом связаны некоторыми межатомными связями, формируют молекулы.
Понятие об атоме впервые было сформулировано древнегреческими и древнеиндийскими философами. В XVII и XVIII столетиях химики смогли подтвердить данную гипотезу о том, что некоторые из веществ не могут подвергаться последующему расщеплению на более мелкие элементы при помощи специальных химических методов, экспериментально. Но в конце XIX и начале XX веков физики открыли субатомные частицы, после чего ясным стал то факт, что атом на самом деле не представляет собой “неделимую частицу”. В 1860 году в немецком городе Карлсруэ состоялся международный съезд химиков, на котором был принят ряд решений об определении понятий атом и молекулы. Вследствие этого атом это самая маленькая частица химического элемента, которая входит в состав сложных и простых веществ.
Модели атомов
Модель атома Томсона. Он предложил рассматривать атом в качестве некоторого положительно заряженного тела, внутри которого заключены электроны. Данную гипотезу окончательно опроверг знаменитый ученый Резерфорд после проведения его знаменитого опыта, на котором он рассевал альфа-частицы.
Кусочки материи. Древнегреческий ученый Демокрит считал, что свойства какого-либо вещества могут быть определены его массой, формой и подобными характеристиками атомов, из которых оно состоит. Например, огонь имеет острые атомы, вследствие чего он можно обжигать, а у тел твердых они шероховаты, из-за чего они крепко сцепляются между собой, у воды они гладкие, а поэтому она может течь. Демокрти также считал, что человеческая душа состоит из атомов.
Ранняя планетарная модель атома Нагаоки. Физики из Японии Хантаро Нагаока в 1904 году предложил такую модель атома, которая была построена по прямой аналогии с Сатурном. В данной модели вокруг небольшого положительного ядра вращались электроны по орбитам и они были объединены в кольца. Но данная модель была ошибочной.
Планетарная модель атома Бора-Резерфорда. Эрнест Резерфорд в 1911 году провел несколько экспериментов, после чего он пришёл к такому выводу, что атом является неким подобием планетной системы, где электроны передвигаются по орбитам вокруг тяжёлого положительно заряженного ядра, которое находится в центре атома. Но подобное описание противоречило классической электродинамики. Согласно последней, электрон во время движения с центростремительным ускорением обязан излучать какие-то электромагнитные волны, вследствие чего терять некоторую энергию. Его расчеты указывали на то, что время, которое необходимо электрону для падения на ядро в таком атоме является абсолютно ничтожным.
Нильсу Бору для того, чтобы объяснить стабильность атомов, пришлось ввести ряд специальных постулатов, которые были сведены к тому, что электрон атом, когда он находится в некоторых энергетических состояниях, энергию не излучает (“модель атома Бора-Резерфорда”). Боровские постулаты показали то, что для описания свойств атома и его определения классическая механика является неприменимой. Последующее изучение атомного излучения повлекло за собой создание такого раздела физики, как квантовая механика, что дало возможность объяснить огромное количество наблюдаемых фактов.
Квантово-механическая модель атома
Современная модель атома представляет собой развитие планетарной модели. В ядро атома входят не имеющие заряда нейтроны и положительно заряженные протоны, а оно окружено электронами, которые имеют отрицательный заряд. Но представления квантовой механики не дают возможности утверждать, что электроны передвигаются вокруг ядра по хоть как-нибудь определённым траекториям.
Химические свойства атома описываются квантовой механикой и определяются посредствам конфигурации их электронной оболочки. Местоположение атома в таблице периодических химических элементов Менделеева определяется исходя их электрического заряда его ядра, т.е. числа протонов, а число нейтронов не оказывает принципиального влияния на химические свойства. В ядре сосредоточена основная масса атома. Масса атом измеряется в специальных атомных единицах массы, равных.
Свойства атома
Любые два атома, которые имеют одинаковое количество протонов, относятся к одному и тому же химическому элементу. Атомы с одинаковым числом протонов, но различным числом нейтронов называются изотопами этого элемента. К примеру, водородные атому содержат в себе один протон, но есть изотопы, которые не содержат нейтронов или один нейтрон (дейтерий) либо два нейтрона (тритий). Начиная с атома водорода, у которого один протон и заканчивая атомом унуноктия, в котором содержится 118 протонов, химические элементы составляют собой беспрерывный натуральный ряд по количеству протонов в ядре. С 83-го номера периодической системы начинаются радиоактивные изотопы элементов.
Массу покоя атома выражается в атомных единицах массы (дальтоне). Масса атома приблизительно равняется произведению атомной единицы массы на массовое число. Наиболее тяжелым изотопом является свинец-208, масса которого составляет 207,976 а. е. м.
Внешняя электронная атомная оболочка в том случае, если она заполнена не полностью, имеет название валентной оболочки, а ее электроны называются валентными.
lab-37.com
Строение атома: ядро, нейтрон, протон, электрон
Атом — это наименьшая частица химического элемента, сохраняющая все его химические свойства. Атом состоит из ядра, имеющего положительный электрический заряд, и отрицательно заряженных электронов. Заряд ядра любого химического элемента равен произведению Z на e, где Z — порядковый номер данного элемента в периодической системе химических элементов, е — величина элементарного электрического заряда.
Электрон — это мельчайшая частица вещества с отрицательным электрическим зарядом е=1,6·10-19 кулона, принятым за элементарный электрический заряд. Электроны, вращаясь вокруг ядра, располагаются на электронных оболочках К, L, М и т. д. К — оболочка, ближайшая к ядру. Размер атома определяется размером его электронной оболочки. Атом может терять электроны и становиться положительным ионом или присоединять электроны и становиться отрицательным ионом. Заряд иона определяет число потерянных или присоединенных электронов. Процесс превращения нейтрального атома в заряженный ион называется ионизацией.
Атомное ядро (центральная часть атома) состоит из элементарных ядерных частиц — протонов и нейтронов. Радиус ядра примерно в сто тысяч раз меньше радиуса атома. Плотность атомного ядра чрезвычайно велика. Протоны — это стабильные элементарные частицы, имеющие единичный положительный электрический заряд и массу, в 1836 раз большую, чем масса электрона. Протон представляет собой ядро атома самого легкого элемента — водорода. Число протонов в ядре равно Z. Нейтрон — это нейтральная (не имеющая электрического заряда) элементарная частица с массой, очень близкой к массе протона. Поскольку масса ядра складывается из массы протонов и нейтронов, то число нейтронов в ядре атома равно А — Z, где А — массовое число данного изотопа (см. Периодическая система химических элементов). Протон и нейтрон, входящие в состав ядра, называются нуклонами. В ядре нуклоны связаны особыми ядерными силами.
В атомном ядре имеется огромный запас энергии, которая высвобождается при ядерных реакциях. Ядерные реакции возникают при взаимодействии атомных ядер с элементарными частицами или с ядрами других элементов. В результате ядерных реакций образуются новые ядра. Например, нейтрон может переходить в протон. В этом случае из ядра выбрасывается бета-частица, т. е. электрон.
Переход в ядре протона в нейтрон может осуществляться двумя путями: либо из ядра испускается частица с массой, равной массе электрона, но с положительным зарядом, называемая позитроном (позитронный распад), либо ядро захватывает один из электронов с ближайшей к нему К-оболочки (К-захват).
Иногда образовавшееся ядро обладает избытком энергии (находится в возбужденном состоянии) и, переходя в нормальное состояние, выделяет лишнюю энергию в виде электромагнитного излучения с очень малой длиной волны — гамма-излучение. Энергия, выделяющаяся при ядерных реакциях, практически используется в различных отраслях промышленности.
Атом (греч. atomos — неделимый) наименьшая частица химического элемента, обладающая его химическими свойствами. Каждый элемент состоит из атомов определенного вида. В состав атома входят ядро, несущее положительный электрический заряд, и отрицательно заряженные электроны (см.), образующие его электронные оболочки. Величина электрического заряда ядра равна Z-e, где е — элементарный электрический заряд, равный по величине заряду электрона (4,8·10—10 эл.-ст. ед.), и Z — атомный номер данного элемента в периодической системе химических элементов (см.). Так как неионизированный атом нейтрален, то число электронов, входящих в него, также равно Z. В состав ядра (см. Ядро атомное) входят нуклоны, элементарные частицы с массой, примерно в 1840 раз большей массы электрона (равной 9,1·10-28 г), протоны (см.), заряженные положительно, и не имеющие заряда нейтроны (см.). Число нуклонов в ядре называется массовым числом и обозначается буквой А. Количество протонов в ядре, равное Z, определяет число входящих в атом электронов, строение электронных оболочек и химические свойства атома. Количество нейтронов в ядре равно А—Z. Изотопами называются разновидности одного и того же элемента, атомы которых отличаются друг от друга массовым числом А, но имеют одинаковые Z. Таким образом, в ядрах атомов различных изотопов одного элемента имеется разное число нейтронов при одинаковом числе протонов. При обозначении изотопов массовое число А записывается сверху от символа элемента, а атомный номер внизу; например, изотопы кислорода обозначаются:
Размеры атома определяются размерами электронных оболочек и составляют для всех Z величину порядка 10—8 см. Поскольку масса всех электронов атома в несколько тысяч раз меньше массы ядра, масса атома пропорциональна массовому числу. Относительная масса атома данного изотопа определяется по отношению к массе атома изотопа углерода С12, принятой за 12 единиц, и называется изотопной массой. Она оказывается близкой к массовому числу соответствующего изотопа. Относительный вес атома химического элемента представляет собой среднее (с учетом относительной распространенности изотопов данного элемента) значение изотопного веса и называется атомным весом (массой).
Атом является микроскопической системой, и его строение и свойства могут быть объяснены лишь при помощи квантовой теории, созданной в основном в 20-е годы 20 века и предназначенной для описания явлений атомного масштаба. Опыты показали, что микрочастицы — электроны, протоны, атомы и т. д.,— кроме корпускулярных, обладают волновыми свойствами, проявляющимися в дифракции и интерференции. В квантовой теории для описания состояния микрообъектов используется некоторое волновое поле, характеризуемое волновой функцией (Ψ-функция). Эта функция определяет вероятности возможных состояний микрообъекта, т. е. характеризует потенциальные возможности проявления тех или иных его свойств. Закон изменения функции Ψ в пространстве и времени (уравнение Шредингера), позволяющий найти эту функцию, играет в квантовой теории ту же роль, что в классической механике законы движения Ньютона. Решение уравнения Шредингера во многих случаях приводит к дискретным возможным состояниям системы. Так, например, в случае атома получается ряд волновых функций для электронов, соответствующих различным (квантованным) значениям энергии. Система энергетических уровней атома, рассчитанная методами квантовой теории, получила блестящее подтверждение в спектроскопии. Переход атома из основного состояния, соответствующего низшему энергетическому уровню Е0, в какое-либо из возбужденных состояний Ei происходит при поглощении определенной порции энергии Еi — Е0. Возбужденный атом переходит в менее возбужденное или основное состояние обычно с испусканием фотона. При этом энергия фотона hv равна разности энергий атома в двух состояниях: hv= Ei— Еk где h — постоянная Планка (6,62·10—27 эрг·сек), v — частота света.
Кроме атомных спектров, квантовая теория позволила объяснить и другие свойства атомов. В частности, были объяснены валентность, природа химической связи и строение молекул, создана теория периодической системы элементов.
www.medical-enc.ru
Атом — Циклопедия
Строение атома и атомного ядра [1:15] Строение атома. Химия 11 класс. Часть 1 // UrokiXimii [28:23] Строение атома. Химия 11 класс. Часть 2 // UrokiXimii [19:58]Атом — наименьшая, электронейтральная, химически неделимая частица химического элемента. Атом состоит из плотного ядра из положительно заряженных протонов и электрически нейтральных нейтронов, которое окружено облаком отрицательно заряженных электронов. Когда количество протонов равно количеству электронов, атом электрически нейтрален; в противном случае он превращается в ион, имеющий определенный электрический заряд. Атомы классифицируются в соответствии с количеством протонов и нейтронов: количество протонов определяет химический элемент, а количество нейтронов — его нуклид.
Образуя между собой связи, атомы объединяются в молекулы и большие по размеру твердые тела.
[править] Общая характеристика строения атома
Современные представления о строении атома базируются на квантовой механике. На популярном уровне строение атома можно изложить в рамках волновой модели, которая опирается на модель Бора, но учитывает также дополнительные сведения из квантовой механики.
- Атомы состоят из элементарных частиц (протонов, электронов, и нейтронов). Масса атома в основном сосредоточена в ядре, поэтому большая часть объема относительно пуста. Ядро окружено электронами. Количество электронов равно количеству протонов в ядре, количество протонов определяет порядковый номер элемента в периодической системе. В нейтральном атоме суммарный отрицательный заряд электронов равен положительному заряду протонов. Атомы одного элемента с разным количеством нейтронов называются изотопами.
- В центре атома находится крошечное, положительно заряженное ядро, состоящее из протонов и нейтронов.
Ядро атома примерно в 100 000 раз меньше, чем сам атом. Таким образом, если увеличить атом до размеров аэропорта Борисполь, размер ядра будет меньше размера шарика для настольного тенниса.
- Ядро окружено электронным облаком, которое занимает большую часть его объема. В электронном облаке можно выделить оболочки, для каждой из которых существует несколько возможных орбиталей. Заполненные орбитали составляют электронную конфигурацию, характерную для каждого химического элемента.
- Каждая орбиталь может содержать до двух электронов, характеризующихся тремя квантовыми числами: основным, орбитальным и магнитным.
- Каждый электрон на орбитали имеет уникальное значение четвертого квантового числа: спина.
Орбитали определяются специфическим распределением вероятности того, где именно можно найти электрон. Примеры орбиталей и их обозначения приведены на рисунке справа. «Границей» орбитали считается расстояние, на котором вероятность того, что электрон может находиться вне ее, меньше 90 %.
- Каждая оболочка может содержать не больше строго определенного числа электронов. Например, ближайшая к ядру оболочка может иметь максимум два электрона, следующая — 8, третья от ядра — 18.
- Когда электроны присоединяются к атому, они занимают орбиталь с низкой энергией. Только электроны внешней оболочки могут участвовать в образовании межатомных связей. Атомы могут отдавать и присоединять электроны, становясь положительно или отрицательно заряженными ионами.
- Химические свойства элемента определяются тем, с какой легкостью ядро может отдавать или получать электроны. Это зависит как от числа электронов, так и от степени заполненности внешней оболочки.
[править] Электронные оболочки и орбитали
Сложные атомы имеют десятки, а для очень тяжелых элементов, даже сотни электронов. Электронные состояния атомов формируются всеми электронами, и невозможно определить, где находится каждый из них. Однако, в так называемом одноэлектронном приближении, можно говорить об определенных энергетических состояниях отдельных электронов.
Согласно этим представлениям существует определенный набор орбиталей, которые заполняются электронами атома. Эти орбитали образуют определенную электронную конфигурацию. На каждой орбитали может находиться не более чем два электрона (принцип исключения Паули). Орбитали группируются в оболочки, каждая из которых может иметь лишь определенное фиксированное количество орбиталей (1, 4, 10 и т. д.). Орбитали разделяют на внутренние и внешние. В основном состоянии атома внутренние оболочки полностью заполнены электронами.
На внутренних орбиталях электроны сильно связаны с ядром. Чтобы вырвать электрон из внутренней орбитали, нужно предоставить ему большую энергию, до нескольких тысяч электрон-вольт. Такую энергию электрон на внутренней оболочке может получить только поглотив квант рентгеновского излучения. Энергии внутренних оболочек атомов индивидуальные для каждого химического элемента, а потому по спектру рентгеновского поглощения можно идентифицировать атом. Эту индивидуальность используют в некоторых методах рентгеновской спектроскопии, в частности в рентгенофлуоресцентном анализе, рентгеновской спектроскопии поглощения, рентгеновской фотоэлектронной спектроскопии.
На внешней оболочке электроны находятся на большем расстоянии от ядра и слабее связаны с ним. Именно эти электроны участвуют в формировании химических связей, поэтому внешнюю оболочку называют валентной, а электроны внешней оболочки — валентными электронами.
[править] Ядерные свойства
Основная масса атома сосредоточена в ядре, которое состоит из нуклонов: протонов и нейтронов, связанных между собой силами ядерного взаимодействия.
Количество протонов в ядре атома определяет его атомный номер и то, которому элементу принадлежит атом. Например, атомы углерода содержат 6 протонов. Все атомы с определенным атомным номером имеют одинаковые физические характеристики и проявляют одинаковые химические свойства. В периодической таблице элементы перечислены в порядке возрастания атомного номера.
Общее количество протонов и нейтронов в атоме элемента называется массовым числом и определяет его атомную массу, поскольку протон и нейтрон имеют массу примерно равную 1 а.е.м. Нейтроны в ядре не влияют на то, которому элементу принадлежит атом, но химический элемент может иметь атомы с одинаковым количеством протонов и разным количеством нейтронов. Такие атомы имеют одинаковый атомный номер, но разную массу, и называются изотопами элемента. Например, атомы водорода всегда содержат один протон, но существуют изотопы без нейтронов (водород-1, который иногда называют протием — самая распространенная форма), с одним нейтроном (дейтерий) и двумя нейтронами (тритий)[1]. Известные элементы составляют непрерывный натуральный ряд по числу протонов в ядре, начиная с атома водорода с одним протоном и заканчивая атомом унуноктия, в ядре которого 118 протонов.[2]
Когда пишут название изотопа, после него пишут массовое число. Например, изотоп углерод-14 содержит 6 протонов и 8 нейтронов, что в сумме составляет массовое число 14. Другой популярный метод нотации заключается в том, что атомная масса обозначается верхним индексом перед символом элемента. Например, углерод-14 обозначается, как 14C.
Атомная масса элемента, приведенная в периодической таблице, является усредненным значением массы изотопов, встречающихся в природе. Усреднения проводится в соответствии с распространенности изотопа в природе.
С увеличением атомного номера растет положительный заряд ядра, а, следовательно, кулоновское отталкивание между протонами. Чтобы удержать протоны вместе необходимо все больше нейтронов. Однако большое количество нейтронов нестабильно, и это обстоятельство накладывает ограничения на возможный заряд ядра и количество химических элементов, существующих в природе. Все изотопы элементов периодической системы, начиная с номера 83 (висмут), радиоактивны.[3][4] Химические элементы с большими атомными номерами имеют очень малый время жизни, могут быть созданы только при бомбардировке ядер легких элементов ионами, и наблюдаются лишь во время экспериментов с использованием ускорителей. По состоянию на февраль 2008 года самым тяжелым синтезированным химическим элементом является унуноктий.[5]
Многие изотопы химических элементов нестабильны и распадаются со временем. Это явление используется радиоэлементным анализом для определения возраста объектов, имеет большое значение для археологии и палеонтологии.
[править] Масса
Поскольку наибольший вклад в массу атома вносят протоны и нейтроны, полное число этих частиц в нуклидов называют массовым числом. Значение массового числа близко к атомной массе нуклида. Массу покоя нуклида часто приводят в атомных единицах массы (а.е.м.) Эта единица определяется как 1/12 часть массы покоя нейтрального атома углерода-12, которая примерно равна 1,66×10−24 г.[6] Водород-1 или протий — легкий изотоп водорода, и атом с наименьшей массой, имеет массу около 1,007825 а.е.м.[7] Масса атома примерно равна произведению массового числа на атомную единицу массы.[8] Тяжелый стабильный изотоп — свинец-208[9] с массой 207,9766521 а.е.м.</ref> Так как массы даже самых тяжелых атомов в обычных единицах (например, в граммах) очень малы, в химии для измерения количества вещества используют моли. В одном моле любого вещества содержится одно и то же число атомов (примерно 6,022×1023). Это число (число Авогадро) выбрано таким образом, что если масса элемента равна 1 а.е.м., то моль атомов этого элемента будет иметь массу 1 г. Например, атом углерода-12 имеет массу 12 а.е.м., значит, 1 моль углерода имеет массу 12 г.[10]
[править] Форма и размеры
Размер атома является величиной, трудно поддается измерению, ведь центральное ядро окружает размыта электронное облако. Для атомов, образующих твердые кристаллы, расстояние между смежными узлами кристаллической решетки может служить приближенным значением их размера. Для атомов, которые не образуют кристаллов, используют другие техники оценки, включая теоретические расчеты. Например, размер атома водорода оценивают 1,2×10−10 м. Это значение можно сравнить с размером протона (что является ядром атома водорода): 0,87×10−15 м и убедиться в том, что ядро атома водорода в 100 000 раз меньше, чем сам атом. Атомы других элементов сохраняют примерно то же соотношение. Причиной этого является то, что элементы с большим положительно-заряженным ядром притягивают электроны сильнее.
Еще одной характеристикой размеров атома является радиус Ван дер Ваальса — расстояние, на которое к данному атома может приблизиться другой атом. Межатомные расстояния в молекулах характеризуются длиной химических связей или ковалентным радиусом.
[править] Энергетические уровни
Значения энергии, которые может иметь атом, исчисляются и интерпретируются, исходя из положений квантовой механики. При этом учитываются такие факторы, как электростатическое взаимодействие электронов с ядром и электронов между собой, спины электронов, принцип неразличимости частиц. Существует определенный набор состояний, каждый из которых имеет определенное значение энергии. Состояние с наименьшей энергией называется основным состоянием. Другие состояния называются возбужденными. Атом находится в возбужденном состоянии конечное время, излучая рано или поздно квант электромагнитного поля (фотон) и переходя в основное состояние. В основном состоянии атом может находиться долго. Чтобы возбудиться, ему нужна внешняя энергия, которая может прийти к нему только из внешней среды. Атом излучает или поглощает свет только определенных частот, соответствующих разности энергий его состояний.
[править] Квантовые переходы в атоме
Между различными состояниями атомов возможны переходы, вызванные внешним возмущением, часто электромагнитным полем. Вследствие квантования состояний атома оптические спектры атомов состоят из отдельных линий, если энергия кванта света не превышает энергию ионизации. При более высоких частотах оптические спектры атомов становятся непрерывными. Вероятность возбуждения атома светом падает с дальнейшим ростом частоты, но резко возрастает при определенных характерных для каждого химического элемента частотах в рентгеновском диапазоне.
Возбужденные атомы излучают кванты света с теми же частотами, на которых происходит поглощение.
Переходы между различными состояниями атомов могут вызываться также взаимодействием с быстрыми заряженными частицами.
[править] Химические свойства
Химические свойства атома определяются в основном валентными электронами — электронами на внешней оболочке. Количество электронов на внешней оболочке определяет валентность атома.
Атомы последнего столбца периодической таблицы элементов имеют полностью заполненную внешнюю оболочку, а для перехода электрона на следующую оболочку нужно передать атому очень большую энергию. Поэтому эти атомы инертные, не склонные вступать в химические реакции, а соответствующие элементы называются инертными газами. Инертные газы сжижаются и кристаллизуются только при очень низких температурах.
Атомы первого столбца периодической таблицы элементов имеют на внешней оболочке один электрон, и являются химически активными. Их валентность равна 1. Характерным типом химической связи для этих атомов в кристаллизованном состоянии является металлическая связь.
Атомы элементов второго столбца периодической таблицы в основном состоянии имеют на внешней оболочке 2 s-электрона. Их внешняя оболочка заполнена, поэтому они должны быть инертными. Но для перехода из основного состояния с конфигурацией электронной оболочки s² в состояние с конфигурацией s¹p¹ нужно очень мало энергии, поэтому эти атомы имеют валентность 2, однако они проявляют меньшую активность.
Атомы элементов третьего столбца периодической таблицы элементов (в краткой форме) имеют в основном состоянии электронную конфигурацию s²p¹. Они могут проявлять различную валентность: 1, 3, 5. Последняя возможность возникает тогда, когда электронная оболочка атома дополняется до 8 электронов и становится замкнутой.
Атомы элементов четвертого столбца короткой формы периодической таблицы элементов основном имеют валентность 4 (например, углерод в составе углекислого газа), хотя возможна и валентность 2 (например, углерод в составе угарного газа). К этому столбцу принадлежит углерод — элемент, который образует самые разнообразные химические соединения. Соединениям углерода посвященный особый раздел химии — органическая химия. Другие элементы этого столбца — кремний, германий при обычных условиях является твердотельными полупроводниками.
Элементы пятого столбца имеют валентность 3 или 5.
Элементы шестого столбца короткой формы периодической таблицы в основном состоянии имеют конфигурацию s²p⁴ и общий спин 1. Поэтому они двухвалентные. Начиная с 3 периода, существует также возможность перехода атомов в возбужденные состояния s²p³d и sp³d², у которых валентность равна 4 и 6 соответственно.
Элементам седьмого столбца короткой формы периодической таблицы не хватает одного электрона на внешней оболочке для того, чтобы ее заполнить. Они в основном одновалентные. Однако они могут вступать в химические соединения в возбужденных состояниях, проявляя валентности 3, 5, 7.
Для переходных элементов характерно заполнение внешней s-оболочки, прежде чем полностью заполняется d-оболочка. Поэтому они в основном имеют валентность 1 или 2, но в некоторых случаях один из d-электронов участвует в образовании химических связей, и валентность становится равной трем. В образовании связей может принять участие и большее количество d-электронов. Именно элементам платиновой группы присущ широкий спектр валентностей[11] вплоть до максимального значения 8. А вот лантаноиды и актиноиды проявляют в основном валентность 3, реже 2, 4.
При образовании химических соединений атомные орбитали видоизменяются, деформируются и становятся молекулярными орбиталями. При этом происходит процесс гибридизации орбиталей — образование новых орбиталей, как специфической суммы базовых.
[править] Анализ и методы визуализации
Атомы слишком малы, чтобы их можно было наблюдать с помощью оптического микроскопа, разрешение которого не превышает десятых долей микрона. Разрешение электронного микроскопа целом сопоставимо с размерами атома, но все же получение изображений атомов в них — сложная техническая задача. Лучше отдельные атомы можно различить с помощью сканирующего туннельного микроскопа. При этом то изображение, которое видит исследователь, есть только результат компьютерной реконструкции на мониторе. Сканирующий туннельный микроскоп чувствует неровности на поверхности, в том числе неровности атомарных размеров, «на ощупь». В нем тонкий щуп сканирует поверхность в горизонтальном направлении, осуществляя такие движения в вертикальном направлении, чтобы поддерживать постоянным туннельный ток. Именно эти вертикальные смещения и записываются электроникой, которая в дальнейшем реконструирует изображение.
О существовании мельчайших частиц вещества человечество догадывалось еще с давних времен, однако подтверждение существования атомов было получено только в конце 19 века. Но почти сразу же стало понятно, что атомы, в свою очередь, имеют сложное строение, которым определяются их свойства.
Понятие атом, как и само слово, имеет древнегреческое происхождение, хотя истинность гипотезы о существовании атомов нашла свое подтверждение лишь в 20 веке.
Концепция атома как малейшей неделимой частицы материи впервые была предложена в начале I тысячелетия до н. э. и популяризована Демокритом — который, собственно, и ввел в научный оборот термин «атом». Основной идеей, которая стояла за данным понятием течение всех столетий, было представление о мире как о наборе огромного количества неделимых элементов, которые являются очень простыми по своей структуре и существуют от начала времен. В конце 19 — начале 20 веков, физики открыли первую из субатомных частиц — электрон, а несколько позже — атомное ядро, таким образом показав, что атом не является неделимым. Продвижение теории атома дал английский физик Дж. Томсон. Основным средством изучения Томсона были катодные лучи, используя их, он пришел к выводу, что атомы вещества содержат отрицательно заряженные частицы, которые получили название «электроны». В 1904 году Томсон представил первую модель строения атома — «пудинг с изюмом». В этой модели положительный заряд занимал весь объём атома и располагался там равномерно, электроны же находились внутри положительного заряда. Эрнест Резерфорд и Эрнест Марсден после опытов с бомбардировки золотой фольги альфа-частицами обнаружили, что небольшая часть альфа-частиц отражается, что идет вразрез с прогнозами модели Томсона. На основании этих результатов Резерфорд создал новую модель атома, получившую название планетарной. В этой модели положительный заряд и основная масса атома сосредоточены в небольшом ядре в центре, а отрицательно заряженные электроны вращаются вокруг ядра. Нильс Бор построил первую квантовую теорию атома водорода, которая получила название модели Бора. На смену теории Бора пришла квантовая теория, она учитывала волновые свойства электрона и других элементарных частиц.
[править] Натурфилософский атомизм
 Демокрит
ДемокритПервым начал проповедовать атомистическое учение в 5 веке до нашей эры философ Левкипп. Затем эстафету подхватил его ученик Демокрит. Сохранились лишь отдельные фрагменты их работ, из которых становится ясно, что они исходили из небольшого количества достаточно абстрактных физических гипотез:
«Сладость и горечь, жара и холод смысл определения, на самом деле [только] атомы и пустота».
По Демокриту, вся природа состоит из атомов, мельчайших частиц вещества, которые покоятся или движутся в совершенно пустом пространстве. Все атомы имеют простую форму, а атомы одного сорта тождественны; многообразие природы отражает многообразие форм атомов и многообразие способов, в которые атомы могут сцепляться между собой. И Демокрит, и Левкипп считали, что атомы, начав двигаться, продолжают двигаться по законам природы.
Наиболее тяжелым для древних греков был вопрос о физической реальности основных понятий атомизма. В каком смысле можно было говорить о реальности пустоты, если она, не имея материи, не может иметь никаких физических свойств? Идеи Левкиппа и Демокрита не могли служить удовлетворительной основой теории вещества в физическом плане, так как не объясняли, из чего состоят атомы, на также почему атомы неделимы.
Через поколение после Демокрита, Платон предложил свое решение этой проблемы: «мельчайшие частицы принадлежат не царству материи, а царству геометрии; они представляют собой различные телесные геометрические фигуры, ограниченные плоскими треугольниками».
Через тысячу лет абстрактные рассуждения древних греков проникли в Индию и были восприняты некоторыми школами индийской философии. Но если западная философия считала, что атомистическая теория должна стать конкретной и объективной основой теории материального мира, индийская философия всегда воспринимала материальный мир как иллюзию. Когда атомизм появился в Индии, то он принял форму теории, согласно которой реальность в мире есть процесс, а не субстанция, и мы присутствуем в мире как звенья процесса, а не как сгустки вещества.
То есть и Платон, и индийские философы считали примерно так: если природа состоит из мелких, но конечных по размерам, долей, то почему их нельзя разделить, хотя бы в воображении, на еще более мелкие частицы, которые стали бы предметом дальнейшего рассмотрения
Римский поэт Лукреций (96 — 55 год до н. э.) был одним из немногих римлян, которые проявляли интерес к чистой науке. В своей поэме «О природе вещей» (De rerum natura) он подробно выстроил факты, свидетельствующие в пользу атомистической теории. Например, ветер, который дует с большой силой, хотя никто не может его видеть, наверное состоит из частиц, слишком малых, чтобы их разглядеть. Мы можем чувствовать вещи на расстоянии по запаху, звуку и теплу, которые распространяются, оставаясь невидимыми. Лукреций связывает свойства вещей со свойствами их составляющих, то есть атомов: атомы жидкости малы и имеют округлую форму, поэтому жидкость течет так легко и просачивается через пористое вещество, тогда как атомы твердых веществ имеют крючки, которыми они сцеплены между собой. Так же и разнообразные вкусовые ощущения и звуки различной громкости состоят из атомов соответствующих форм — от простых и гармоничных в извилистых и нерегулярных. Учение Лукреция были осуждены церковью, поскольку он дал достаточно материалистическую их интерпретацию: например, представление о том, что Бог, запустив один раз атомный механизм, более не вмешивается в его работу, или то, что душа умирает вместе с телом.
[править] Начала научной теории атома
Одна из первых теорий о строении атома, которая имеет уже современные очертания, была описана Галилеем (1564—1642). По его теории вещество состоит из частиц, которые не находятся в состоянии покоя, а под воздействием тепла движутся во все стороны; тепло — не что иное, как движением частиц. Структура частиц является сложной, и если лишить любую часть ее материальной оболочки, то изнутри брызнет свет. Галилей был первым, кто, хотя и в фантастической форме, представил строение атома.
В 17 и 18 веках химики установили, что химические вещества вступают в реакции в определенных пропорциях, которые выражаются с помощью малых чисел. Кроме того, они выделили определенные простые вещества, которые назвали химическими элементами. Эти открытия привели к возрождению идеи о неделимых частицах. Развитие термодинамики и статистической физики показало, что тепловые свойства тел можно объяснить движением таких частиц. В конце концов были экспериментально определены размеры атомов.
Основоположником атомной теории стал Джон Дальтон. Он доказал реальность атомов, первый ввел понятие «атомный вес», рассчитав при это атомный массы некоторых элементов. В 19 веке Джон Дальтон открыл закон кратных отношений и исходя из него развил теорию, названную им «новой системой химической философии», по которой химические вещества состоят из атомов, но он предполагал, что они неразделимы.[12] Новый толчок в становлении современного понимания атома дала молекулярно-кинетическая теория.
Первая модель атома Дж. Томсона «Пудинг с изюмом» Атомная модель РезерфордаВ 1897 году Джозеф Джон Томсон, изучая катодные лучи, открыл электрон и пришел к выводу, что они есть в каждом атоме. Таким образом, было опровергнуто предположение, что атомы являются неделимыми компонентами вещества.[13] Он создал первую модель строения атома, которая получила название модели пудинга с изюмом, где отрицательно заряженные электроны плавают в однородной положительно заряженной сфере. Эта модель была изменена в 1909 году. Ганс Гейгер,
Резерфорд пришел к выводу, что в весь положительный заряд сконцентрирован в малом объёме, а большинство атомного пространства пустое. α-частица — это ионизированные атомы гелия, и электроны, входящие в состав атома не способны отклонить α-частицу. Во время опыта большинство α-частиц проходили без отклонения, но небольшая часть частиц отклонялась на значительный угол, превышающий 30 градусов, такой результат нельзя получить при расположении положительного заряда по всему объёму атома, так как электрическое поле будет недостаточно сильным. Так на смену модели Томсона пришла планетарная модель Резерфорда:
- Положительно заряженное ядро, занимающее ничтожную часть объёма, находится в центре.
- Почти вся масса и весь положительный заряд сконцентрированы в ядре
- Электроны вращаются вокруг атома. Количество электронов равно положительному заряду ядра.
На основе данной модели нельзя было объяснить существование, так как электроны двигаются с ускорением, они должны излучать электромагнитные волны и терять энергию, что приведет к тому, что электроны «упадут» на ядро, и атом прекратит существование. Но в действительности атом в невозбужденном состоянии устойчив и может существовать неограниченно долго, также он не излучается электромагнитные волны. Следует вывод, что законы классической механики неприменимы.
Нильс Бор построил первую квантовую теорию атома водорода, которая получила название модели Бора. Модель Бора сумела объяснить оптические спектры атомов. Дальнейшее ее совершенствование привело к развитию квантовой механики. Значительный вклад в становление научной атомистики сделал Жан Батист Перрен, экспериментально подтвердив теорию броуновского движения Альберта Эйнштейна. Эксперименты Генри Мозли и установленный им закон Мозли позволили связать атомный номер химического элемента с электрическим зарядом ядра. В 1913 году, исследуя ионы неона в канальных лучах, Джозеф Джон Томсон впервые открыл изотопы.
Развитие квантовой механики дало возможность объяснить не только строение атомов, но также их свойства: оптические спектры, способность вступать в химические реакции, образовывать молекулы.
В изучении этого вопроса отличился датский физик Нильс Бор. Он считал, что для микромира не работают законы, предназначенные для макроскопических тел. Законы микромира — квантовые законы, были сформулированы в его постулатах и дополнили атом Резерфорда. Первый постулат Бора гласит: атомная система может находиться только в особых стационарных, или квантовых, состояниях, каждому из которых соответствует определённая энергия E. В стационарном состоянии атом не излучает.
Согласно второму постулату Бора излучение фотонов происходит при переходе атома из стационарного состояния с большей энергией в стационарное состояние с меньшей энергией. Энергия излученного фотона равна разности энергий стационарных состояний.
[править] Квантовая теория строения атома
На смену теории Бора пришла квантовая теория, она учитывала волновые свойства электрона и других элементарных частиц. В основе квантовой теории строения атома лежат следующие положения:
- Электрон имеет корпускулярно-волновую природу. Он может вести себя как волна либо частица. Движущийся электрон проявляет волновые свойства, но как частица он обладает массой и зарядом.
- Неопределенность в измерении. Для электрона невозможно одновременно точно измерить скорость и координату, чем точнее один из показателей, тем больше неопределенность в другом.
- Электрон не движется по определённым траекториям вокруг ядра, он может находиться в любой точке пространства, но вероятность нахождения его в определённой точке не равна, наиболее вероятное пространство называют орбиталью.
- Ядро состоит из нуклонов: протонов и нейтронов, количество протонов численно равно порядковому номеру элемента, а количеств нуклонов равно массовому значению.
Данные положения формулируют квантовую теорию строения атома.
См. также: Атомная орбиталь.
- Белый М. В. (1973). Атомная физика. Киев: Высшая школа.
- Ландау Л. Д., Лившиц Е. М. (1974). Теоретическая физика. т. ИИИ. Квантовая механика. Нерелятивистская теория. Москва: Наука.
- Бронштейн М. П. (1980). Атомы и электроны (Серия «Библиотечка „Квант“»). Москва: Наука.
- Шехтер В. М., Ансельм А. А. (1984). Атом и квантовая механика (Серия: «Физика»). Москва: Знание.
- Demtröder, Wolfgang (2002). Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics (1st ed.). Springer.
cyclowiki.org
атом
Молекула (новолат. molecula, уменьшит. от лат. moles-масса), микрочастица, образованная из двух или большего числа атомов и способная к самостоятельному существованию. Имеет постоянный состав (качественный и количественный) входящих в нее атомных ядер и фиксированное число электронов и обладает совокупностью свойств, позволяющих отличать одну молекулу от других, в том числе от молекул того же состава. Молекула, как система, состоящая из взаимодействующих электронов и ядер, может находиться в различных состояниях и переходить из одного состояния в другое вынужденно (под влиянием внешних воздействий) или самопроизвольно. Для всех молекул данного вида характерна некоторая совокупность состояний, которая может служить для идентификации молекул. Как самостоятельное образование молекула обладает в каждом состоянии определенным набором физических свойств, эти свойства в той или иной степени сохраняются при переходе от молекул к состоящему из них веществу и определяют свойства этого вещества. При химических превращениях молекула одного вещества обмениваются атомами с молекулами другого вещества, распадаются на молекулы с меньшим числом атомов, а также вступают в химические реакции других типов. Поэтому химия изучает вещества и их превращения в неразрывной связи со строением и состоянием молекул
Обычно молекулой называют электрически нейтральную частицу; если молекула несет электрический заряд (положительный или отрицательный), то говорят о молекулярных ионах (катионах или анионах соответственно). В веществе положительные ионы всегда сосуществуют вместе с отрицательными. Молекулы, находящиеся в состояниях с мультиплетностью, отличной от единицы (как правило, в дублетных состояниях), называют радикалами. Свободные радикалы в обычных условиях, как правило, не могут существовать длительное время. Известны, однако, свободные радикалы сравнительно сложного строения, которые являются достаточно стабильными и могут существовать при обычных условиях.
По числу входящих в молекулу атомных ядер различают молекулы двухатомные, трехатомные и т.д. Если число атомовв молекуле превосходит сотни и тысячи, молекула называется макромолекулой. Сумма масс всех атомов, входящих в состав молекулы, рассматривается как молекулярная масса (смотри также Молекулярная масса полимера. Молекулярно-массовое распределение). По величине молекулярной массы все вещества условно делят на низко- и высокомолекулярные.
А́том (от др.-греч. ἄτομος — неделимый) — частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств.
Представление об атомах как неделимых мельчайших частицах вещества возникло еще в античные времена, но только в XVIII веке трудами А. Лавуазье, М. В. Ломоносова и других ученых была доказана реальность существования атомов.
Общая характеристика строения атома. Атом состоит из положительно заряженного ядра, окруженного облаком отрицательно заряженныхэлектронов. Размеры атома в целом определяются размерами его электронного облака и велики по сравнению с размерами _ядра атома (линейные размеры атома ~ 10~8см, его ядра ~ 10″ -10″ 13 см). Электронное облако атома не имеет строго определенных границ, поэтому размеры атома в значит. степени условны и зависят от способов их определения (см. Атомные радиусы). Ядро атома состоит из Z протонов и N нейтронов, удерживаемых ядерными силами (см. Ядро атомное). Положит. заряд протона и отрицат. заряд электрона одинаковы по абс. величине и равны е= 1,60*10-19 Кл; нейтрон не обладает элек-трич. зарядом. Заряд ядра +Ze – осн. характеристика атома, обусловливающая его принадлежность к определенному хим. элементу. Порядковый номер элемента в периодич. системе Менделеева (атомный номер) равен числу протонов в ядре.
В электрически нейтральном атоме число электронов в облаке равно числу протонов в ядре. Однако при определенных условиях он может терять или присоединять электроны, превращаясь соотв. в положит. или отрицат. ион, напр. Li+, Li2+ или О–, О2-. Говоря об атомах определенного элемента, подразумевают как нейтральные атомы, так и ионы этого элемента.
Строение атома и свойства веществ. Хим. св-ва определяются строением внеш. электронных оболочек атомов, в к-рых электроны связаны сравнительно слабо (энергии связи от неск. эВ до неск. десятков эВ). Строение внеш. оболочек атомов хим. элементов одной группы (или подгруппы) периодич. системы аналогично, что и обусловливает сходство хим. св-в этих элементов.(1) При увеличении числа электронов в заполняющейся оболочке их энергия связи, как правило, увеличивается; наиб. энергией связи обладают электроны в замкнутой оболочке. Поэтому атомы с одним или неск. электронами в частично заполненной внеш. оболочке отдают их в хим. р-циях. Атомы, к-рым не хватает одного или неск. электронов для образования замкнутой внеш. оболочки, обычно принимают их. Атомы благородных газов, обладающие замкнутыми внеш. оболочками, при обычных условиях не вступают в хим. р-ции.
Строение внутр. оболочек атомов, электроны которых связаны гораздо прочнее (энергия связи 102-104 эВ), проявляется лишь при взаимод. атомов с быстрыми частицами и фотонами высоких энергий. Такие взаимод. определяют характер рентгеновских спектров и рассеяние частиц (электронов,нейтронов) на атомах (см. Дифракционные методы). Масса атома определяет такие его физ. св-ва, как импульс, кинетич. энергия. От механических и связанных с ними магн. и электрич. моментов ядра атома зависят нек-рые тонкие физ. эффекты (ЯМР, ЯКР, сверхтонкая структура спектральных линий, см Спектроскопия).
1сноска: Электро́нво́льт (редко электроновольт; русское обозначение: эВ, международное: eV) — внесистемная единица энергии, используемая в атомной и ядерной физике, в физике элементарных частиц и в близких и родственных областях науки (биофизике, физической химии, астрофизике и т. п.). В Российской Федерации электронвольт допущен к использованию в качестве внесистемной единицы без ограничения срока с областью применения.
Ядерная модель атома
В начале 20 века в результате изучения катодных лучей были обнаружены отрицательные частицы – электроны с зарядом 1,6.10‾19 Кл, массой 9,11.10‾31 кг, открыто рентгеновское электромагнитное излучение. Обобщив эти открытия, Дж.Томсон в 1897 году предложил свою модель атома – это положительно заряженная сфера, в которую вкраплены отрицательные электроны (подобно изюму в пудинге). Если эта модель верна, тогда металлическая фольга – это пленка положительного электричества, содержащая электроны и поток α- частиц должен легко проникать через нее, не меняя направление.
В 1909 г. сотрудники англ. ученого Э. Резерфорда это проверили. 1 из 100000 α – частиц при прохождении через золотую фольгу рассеивались на большие углы и даже поворачивали обратно. Анализируя результаты эксперимента, Резерфорд сделал вывод, что масса и заряд атома сконцентрированы в малой части объема, называемой ядром. Отклоняются те α – частицы, которые сталкиваются с ядрами. Большинство же α – частиц проходит через пространство между ядрами. Модель строения атома, предложенная Э. Резерфордом, напоминала солнечную систему. Ее называют планетарной моделью. Согласно ей, в центре атома находится положительное ядро, в котором сосредоточена вся масса атома. Вокруг ядра по круговым орбитам движутся электроны. Заряд ядра и число электронов одинаковы, т.е. атом нейтральная частица.
В 1913г. английский физик Мозли измерил длины волн рентгеновских лучей, испускаемых разными металлами в катодной трубке, и построил график зависимости обратного значения квадратного корня из длины волны рентгеновских лучей от порядкового номера элемента. Этот график (рис.1) показывает, что порядковый номер отражает какую-то важную характеристику элемента. Мозли предположил, что этой характеристикой является заряд ядра атома, и что он возрастает на единицу при переходе от одного элемента к следующему за ним по порядку. Он назвал порядковый номер атомным номером – Z.
Закон Мозли:
Корень квадратный из величины, обратной длине волны рентгеновских лучей, испускаемых атомами различных элементов, находится в линейной зависимости от порядкового номера элемента.
Это закон, связывающий частоту спектральных линий характеристического рентгеновского излучения атома химического элемента с его порядковым номером.
,
где - длина волны, а – постоянная величина, Z– порядковый номер элемента (заряд ядра).
Позже стало известно, что порядковый номер равен числу протонов в ядре. Таким образом, порядковый (атомный) номер равен заряду ядра и он же определяет наличие в нем протонов (положительных частиц). А так как атомы нейтральны, то число электронов в атоме должно быть равно числу протонов. Но массы атомов оказались больше суммарной массы протонов. Для объяснения избытка массы было высказано предположение о существовании нейтронов. Эти частицы должны были иметь ту же массу, что и протон, но нулевой заряд (1,675.10–27 кг). Нейтрон был открыт сотрудником Резерфорда Чедвигом в 1932 г. Было окончательно установлено, что атом состоит из ядра и электронов, а ядро – из протонов и нейтронов. Их сумму называютнуклонным числом или массовым – А.
А = Z + N,
Z– число протонов, N– число нейтронов.
Атомы с различным числом протонов (Z) и нейтронов (N), но с одинаковым числом нуклонов А, называют изобарами. Например,
Изотопы – атомы с одинаковым числом протонов (Z), но с разным числом нуклонов
Изотоны – атомы с одинаковым числом нейтронов (N)
Таким образом, дробные значения атомных масс в периодической системе объясняются наличием изотопов для одного и того же элемента.
А́томное ядро́ — центральная часть атома, в которой сосредоточена основная его масса (более 99,9 %). Ядро заряжено положительно, заряд ядра определяет химический элемент, к которому относят атом. Размеры ядер различных атомов составляют несколько фемтометров, что в более чем в 10 тысяч раз меньше размеров самого атома.
Спектра́льная ли́ния — особенность участка спектра, выражающаяся в локальном повышении (светлые, эмиссионные линии, спектральные максимумы) или понижении (тёмные линии, линии поглощения, спектральные минимумы) уровня сигнала.
Остаточной интенсивностью называют усиление/ослабление излучения в спектральной линии по сравнению с непрерывным спектром.
Функция, характеризующая зависимость остаточной интенсивности от частоты, называется профилем линии.
Рентге́новское излуче́ние — электромагнитные волны, энергия фотонов которых лежит на шкале электромагнитных волн между ультрафиолетовым излучением и гамма-излучением, что соответствует длинам волн от 10−2 до 102 Å (от 10−12 до 10−8 м).
Фото́н (от др.-греч. φῶς, род. пад. φωτός, «свет») — элементарная частица, квант электромагнитного излучения (в узком смысле —света). Это безмассовая частица, способная существовать в вакууме только двигаясь со скоростью света.
studfiles.net
Химия для студентов: Характеристики атомов
Атомы элементов имеют следующие основные характеристики.
Энергия ионизации – минимальная энергия необходимая для полного удаления электрона из нейтрального несвязанного (газообразного) атома, находящегося в основном состоянии.
Значение Еи всегда является положительным. Энергия ионизации выражается в кДж/моль (атомов) или эВ/атом.
Сродство к электрону – энергия, выделяемая или поглощаемая при присоединении электрона к нейтральному несвязанному атому, находящемуся в газообразном состоянии, с образованием отрицательно заряженного иона.
Электроотрицательность атома (по Р. Малликену) равна полусумме энергии ионизации и сродства к электрону.
Обобщенно она характеризует способность атома притягивать к себе общие электроны при образовании химической связи.
Для элементов главных подгрупп общими являются формулы водородных соединений. Элементы главных подгрупп I – III групп образуют твердые вещества – гидриды (водород в степени окисления -1), а IV – VII групп – газообразные. Водородные соединения элементов главных подгрупп IV группы (ЭН4) – нейтральны, V группы (ЭН3) – основания, VI и VII групп (Н2Э и НЭ) – кислоты. От положения элементов в периодической системе зависят свойства атома, связанные с его электронной конфигурацией: атомный радиус – по периоду слева направо уменьшается, а в подгруппе сверху вниз возрастает; энергия ионизации – по периоду возрастает, а в подгруппе уменьшается; электроотрицательность – по периоду увеличивается, а в подгруппе уменьшается. По положению элемента в периодической системе можно прогнозировать его основные свойства как средние всех его соседей:
Элементы некоторых групп получили собственные групповые названия:
Li – Fr | щелочные элементы | |
IIA | Ca – Ra | щёлочноземельные |
IVA | O – Po | халькогены |
VIIA | F – At | галогены |
VIIIA | He – Rn | благородные газы |
IIIБ | La – Lu | лантаноиды |
IIIБ | Ac – Lr | актиноиды |
Среди элементов VIIIБ группы, разделённой на триады (Fe–Co–Ni, Ru–Rh–Pd, Os–Ir–Pt) различают семейство железа (Fe–Co–Ni) и семейство платины
(Ru–Rh–Pd–Os–Ir–Pt).
Если провести диагональ от бора (В) к астату (At) то справа вверху будут располагаться неметаллы, а слева внизу – металлы (за исключением элементов побочных подгрупп, которые все относятся к металлам). Вблизи этой диагонали будут расположены элементы с промежуточными свойствами (полупроводники): Si, Ge, As, Sb, Se, Te. Из них изготавливаются диоды, транзисторы – заменители электронных ламп.
В атомах металлов наружные электроны связаны слабо, могут отрываться от атомов и свободно блуждать между ними (металлическая связь, проводимость, блеск). В типичных неметаллах все электроны прочно связаны с атомами, свободные электроны отсутствуют, отсутствует и электрическая проводимость.Дополнение На периодическую таблицу можно взглянуть здесь: http://www.webelements.com/
chemistryostu.blogspot.com
§1.Общая характеристика атомов.
Атомная физика.
Литература:
Савельев Общий курс физики Т.3. Квантовая оптика и атомная физика
Сивухин Общий курс физики Т.5. Ч.1
Шпольский Атомная физика
Матвеев Атомная физика(глубокое изложение)
Добрецов Атомная физика
Атом (греч. неделимый) – частица вещества микроскопической массы и размеров, которая является носителем всех его физических и химических свойств.
Каждому элементу соответствует свой род атомов и все его свойства полностью определяются его строением.
Атомная физика изучает строение атома, как квантовой системы, состоящей из ядра и электронов. Кроме того необходимо добавить энергитические уровни, излучательные и безизлучательные переходы между ними, столкновения атомов, а также их поведение во внешних полях.
Развитие атомной физики.
1863 – создание периодической системы Менделеева (следствием является сложная структура атома)
1897 – открытие электрона Томсоном (е/m)
1919 – открытие протона Резерфордом
1931 – открытие нейтрона Чедвигом
Проблемы физики начала 20 века.
Законы теплового излучения
Закономерности фотоэффекта
Проблема размеров и стабильности атомов
Линейчатые спектры атомов
Поиски решения всех этих проблем в итоге привели к созданию квантовой механики – физики микромира, к которому законы классической физики не применимы.
По современным представлениям атом состоит из тяжелого ядра, обладающего положительным зарядом и окружающих его электронов, имеющих отрицательный заряд и образующих электронную оболочку. Линейные размеры атома определяются размерами его электронной оболочки.
Ион – атом, присоединивший или отдавший электроны.
Атом и соответствующие ионы с одинаковым количеством электронов образуют изоэлектронный ряд. Например:
Каждый элемент этого ряда называется водородоподобным атомом.
Ядро состоит из протонов – частиц с положительным элементарным зарядом и электрически нейтральных нейтронов.
Для большинства химических элементов существуют изотопы – разновидности этих элементов, отличающиеся массовым числом. При этом:
Различие в массах изотопов практически не сказывается на физических и химических свойствах атома. Однако эти отличаи (изотопический эффект) проявляются в случае легких атомов.
| А | Z | Np | Nn |
H(водород) | 1 | 1 | 1 | – |
D(дейтерий) | 2 | 1 | 1 | 1 |
T(тритий) | 3 | 1 | 1 | 2 |
Энергия ионизации атома – это работа, затрачиваемая на удаление одного внешнего электрона с электронной оболочки атома, находящегося в основном энергитическом состоянии на бесконечность.
1 ЭВ – внесистемная единица.
Энергия ионизации водорода
§2.Законы теплового излучения.
Вокруг любого тела существуют излучения или ЭМП, возникающие в результате испускания телом ЭМ волн за счет внутренней тепловой энергии тела. С ростом температуры плотность излучения увеличивается. Данное излучение называется тепловым.
Любое тело как излучает, так и поглощает ЭМ волны. В результате этих двух процессов может устанавливаться термодинамическое равновесие. Только в этом случае можно говорить о температуре излучения. Тепловое излучение существует при любой температуре Т > 0 K. Тепловое излучение – единственный вид излучения, который может быть равновесным. Все остальные виды излучения неравновесны, их называют люминесцирующими. Люминесценция происходит при дополнительных по отношению к нагреванию процессах. Фотолюминесценция – возникает при освещении люминофора (вещества, в котором возбуждается люминесценция)
Существует:
– УФ люминесценция
– рентгеновская люминесценция
– катодолюминесценция
– хемилюминесценция
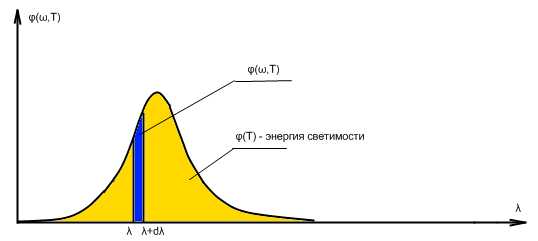
dФ – энергия излучения, испускаемого единицей поверхности тела в единицу времени в единичном интервале частот . Эта величина имеет смысл плотности потока энергии.
Ф(ω,Т) – спектральная испускательная способность тела. Эта функция – различная для различных тел, определяет плотность потока энергии, испускаемой телом, находящемся при температуре Т на частоте ω.
Поглощательная способность тела.
Отношение плотности потока энергии, поглощенной телом к плотности потока энергии, падающей на тело называется поглощательной способностью тела и обозначается
В 1859 году Кирхгоф установил следующий закон:
Отношение испускательной способности тела к его поглощательной способности не зависит от природы тела и является универсальной функцией частоты и температуры, одинаковой для всех тел.
Представим себе тело с Такое тело называют АЧТ (абсолютно черное тело). Оно поглощает всю энергию, которая на него падает, поэтому:
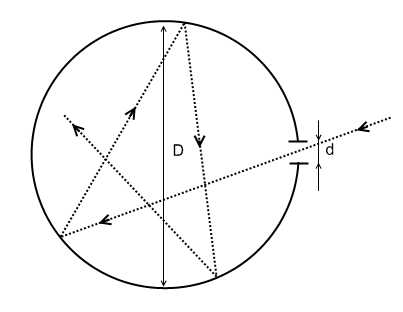
Простейшая модель АЧТ.
d << D
На опыте было установлено, что испускательная способность абсолютно черного тела ( АЧТ ) имеет следующий вид:
1893г. – Винн предложил общую формулу, согласно которой
– некоторая неизвестная функция отношения частоты к температуре.
–интегральная испускательная способность АЧТ или энергетическая светимость.
– мощность излучения единицы поверхности тела.
Где:
экспериментально установлено, что постоянная Стефана-Больцмана:
Закон Стефана-Больцмана:
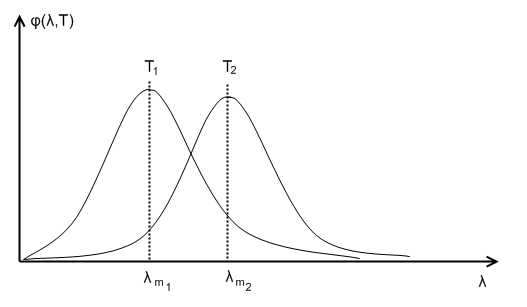
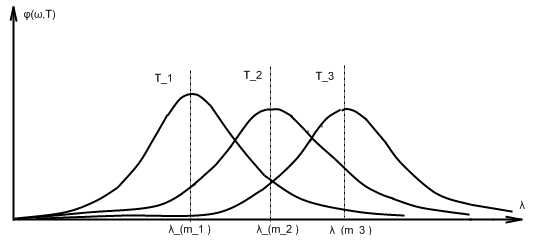
Как следствие общей формулы Винна, объясняется закон смещения Винна.
– постоянная Винна.
–длина волны λ для максимума испускательной способности .
Для доказательства рассмотрим производную
(⋆)
1896г. – Винн предложил частную формулу
где α и β – константы
– первый недостаток формулы Винна: α и β – некоторые импирические постоянные.
– второй недостаток формулы Винна: при , Т →⇒- формула Винна не работает при высоких температурах или низких частотах.
1900г. – формула Релея-Джинса:
При T=const :
Ультрафиолетовая катастрофа: формула перестает работать при высоких частотах или низких температурах.
14.12.1900г. Макс Планк предложил для испускательной способности АЧТ:
где
– постоянная Планка
–постоянная планка – это естественная единица измерения момента импульса.
Рассмотрим область высоких частот
Формула Планка переходит в частную формулу Винна:
Рассмотрим область низких частот или высоких температур
Вывод: из формулы Планка можно вывести все законы теплового излучения.
Физическое содержание формулы Планка.
Тела, испускающие тепловое излучение, могут быть представлены в виде осцилляторов, энергия которых испускается порциями (квантами), т.е. энергия испускается не непрерывно, а дискретно.
Энергия кванта
где
В теории теплового излучения пользуются также объемной испускательной способностью АЧТ
studfiles.net