9.5. Произведение растворимости
Подавляющее большинство веществ обладает ограниченной растворимостью в воде и других растворителях. Поэтому на практике часто приходится иметь дело с системами, в которых в состоянии равновесия находятся осадок и насыщенный раствор электролита.
Малорастворимые электролиты при растворении полностью диссоциируют на ионы (в растворе нет нейтральных молекул).
Например, для малорастворимого соединения Ag2CO3 можно записать следующий обратимый процесс:
Ag2CO3(к) 2Ag+(р) + CO32(р) ,
а соответствующая ему константа равновесия будет называться произведением растворимости:
.
Этот процесс является гетерогенным, поэтому константа равновесия определяется только произведением концентраций ионов в растворе и не зависит от концентрации твердого компонента.
Правила записи выражений для произведения растворимости ничем не отличаются от правил записи любых выражений для Кp.Произведение растворимости равно произведению молярных концентраций ионов, участвующих в равновесии, каждая из которых возведена в степень, равную стехиометрическому коэффициенту, при соответствующем ионе в уравнении равновесия.
ПР тесно связано с растворимостью (S моль/л). Так, для электролитов, имеющих катионы и анионы одинакового заряда (AgCl, PbS и др.), очевидно
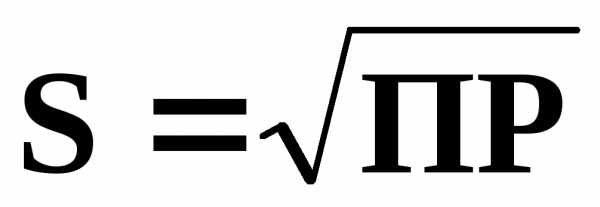
В общем случае разных зарядов катиона (n+) и аниона (m):
 или .
или .
Очевидно,
что ПР, кроме того, можно найти по
термодинамическим данным, так как
ПР = К = 
Пример 20. ПР (СаF2) = 3,9.1011. Какова растворимость СаF2 в воде (в граммах на литр и в моль на литр)?
Решение. Равновесие растворения описывается уравнением:
СаF2(Т)
Из каждого моля растворившегося СаF2 в растворе появляются 1 моль ионов Са2+ и 2 моль ионов F. Поэтому, обозначая растворимость фторида кальция, выраженную в моль на литр, через х, молярные концентрации Ca2+ и F в растворе можно записать следующим образом: [Ca2+] = х и [F] = 2 x. Выражение для произведения растворимости в данном случае имеет вид
ПР = [Ca2+] [F]2 .
Подставляя в него [Ca2+
Отсюда х = .
Следовательно, растворимость СаF2, выраженная в моль/л, равна 2,1.104.
Поскольку молярная масса СаF2 равна 78,1 г/моль, то растворимость СаF2, выраженная в г/литр, составит: 2,1.104 моль/л·78,1 г/моль = 1,6·102 г/л.
Пример 21. Какова растворимость (S) Ag2CO3 , если ПР (Ag2CO3) = 8,2.1012
Решение. Растворимость найдем по формуле:
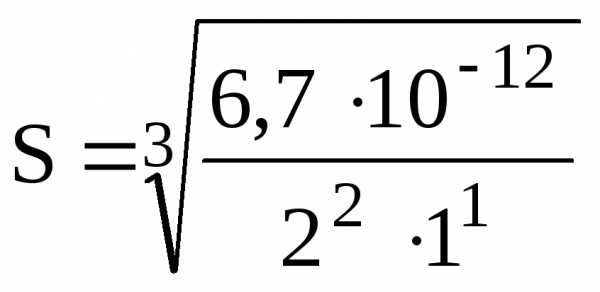 =
1,19.104 моль/л.
=
1,19.104 моль/л.
При растворении 10,6 г Na2CО3 в 1 л раствора добавляется 10,6/106 = 0,1 моль ионов CО32. Если считать, что объем раствора при этом не изменяется, и учесть, что концентрация CО32 до растворения Na2CО3 пренебрежимо мала, то равновесное значение [CО32
моль/л.
Это соответствует вдвое меньшей концентрации Ag2CO3 , то есть растворимость стала S| = 4,1.106 моль/л, а из 1 л раствора выпало в осадок
моль, или 0,32 г Ag2CO3 .
Полученные результаты показывают, что при добавлении в насыщенный раствор одноименного иона в концентрации, значительно превышающей первоначальную, труднорастворимое вещество практически полностью выпадает в осадок. Этот эффект (выпадение осадка из насыщенного раствора при добавлении одноименного иона) носит название “высаливание”
Из
выражения для ПР следует, что при
увеличении концентрации одного из ионов
электролита в его насыщенном растворе
(например, путем введения другого
электролита, содержащего тот же ион)
произведение концентраций ионов
электролита становится больше ПР. При
этом равновесие между твердой фазой и
раствором смещается в сторону образования
осадка, так как величина ПР не зависит
от концентрации. Таким образом, условием образования осадка является
превышение произведения концентраций
ионов малорастворимого электролита
над его произведением растворимости.
Пример 22.
Решение. Возможными продуктами реакции являются PbSO4 и NaNO3. Соли натрия относятся к хорошо растворимым соединениям, однако PbSO4 имеет ПР = 1,6.108. Чтобы определить, будет ли происходить осаждение PbSO4, следует вычислить произведение концентраций ионов Pb2+ и SO42 и сопоставить полученный результат с ПР.
При смешении двух растворов полный объем становится равным 0,1 + 0,4 = 0,5 л. Число моль Pb2+, содержащихся в 0,1 л раствора Pb(NO3)2 с концентрацией 3,0·103 М, равно
0,1 л·(3,0·103 моль/л) = 3,0·104 моля.
Концентрация Pb2+ в 0,5л смеси растворов должна быть равна [Pb2+]. Число моль SO42– в 0,4 л исходного раствора Na2SO4 равно:
0,4 л·(5,0·103 моль/л) = 2,0·103 моль.
Следовательно,
[SO
.
Находим произведение концентраций ионов:
[Pb2+]·[SO42] = (6,0·104)·(4,0.103) = 2,4·106.
Поскольку произведение концентраций ионов 2,4·106 больше ПР, в смеси растворов должно происходить осаждение PbSO4.
Чтобы
определить, какое количество PbSO4 выпадет в осадок, определим концентрацию
ионов Pb2+ в растворе: [Pb2+]
= 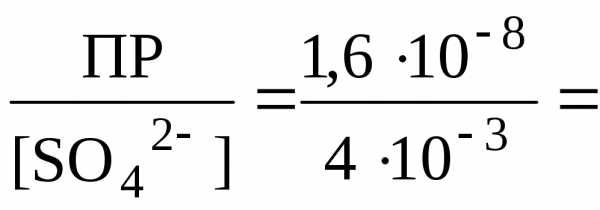
В 0,5 л содержится в 2 раза меньше 2·104 моль. Следовательно, в осадок выпадет 3·104 2·104 = 1·104 моль или m =n·М = 104·393 4·102 г.
studfiles.net
Произведение растворимости
Определение
Поместим в химический стакан какую-либо труднорастворимую соль, например, AgCl и добавим к осадку дистиллированной воды. При этом ионы Ag+
1) Переход ионов из осадка в раствор. Скорость этого процесса можно считать постоянной при неизменной температуре: V1 = K1;
2) Осаждение ионов из раствора. Скорость этого процесса V2 зависит от концентрации ионов Ag+ и Cl–. По закону действия масс:
V2 = k2
Так как данная система находится в состоянии равновесия, то
V1 = V2
k2 = k1
[Ag+]
- [Cl–] = k2 / k1 = const (при T = const)
Таким образом, произведение
концентраций ионов в насыщенном растворе труднорастворимого электролита
при постоянной температуре является постоянной величиной. Эта величина называется произведением растворимости (ПР).
В приведенном примере ПРAgCl = [Ag+] • [Cl–].
В тех случаях, когда электролит содержит два или несколько одинаковых
ионов, концентрация этих ионов, при вычислении произведения
растворимости должна быть возведена в соответствующую степень.
Например, ПРAg2S = [Ag+]2
- [S2-]; ПРPbI2 = [Pb2+] [I–]2
В общем случае выражение произведения растворимости для электролита AmBn
ПРAmBn = [A]m [B]n.
Значения произведения растворимости для разных веществ различны.
Например, ПРCaCO3 = 4,8
- 10-9; ПРAgCl = 1,56 10-10.
ПР легко вычислить, зная раcтворимость соединения при данной t°.
Пример 1
Растворимость CaCO3 равна 0,0069 или 6,9
- 10-3 г/л. Найти ПРCaCO3.
Решение
Выразим растворимость в молях:
SCaCO3 = (6,9
· 10-3) / 100,09 = 6,9 • 10-5 моль/л
MCaCO3
Так как каждая молекула CaCO3 дает при растворении по одному иону Ca2+ и CO32-, то
[Ca2+] = [ CO32-] = 6,9
следовательно, ПРCaCO3 = [Ca2+
]
- [CO32-] = 6,9 10-56,9 10-5 = 4,8 10-9
Зная величину ПР, можно в свою очередь вычислить растворимость вещества в моль/л или г/л.
Пример 2
Произведение растворимости ПРPbSO4 = 2,2
Чему равна растворимость PbSO4?
Решение
Обозначим растворимость PbSO4 через X моль/л. Перейдя в раствор, X молей PbSO4 дадут X ионов Pb2+ и X ионов SO42-, т.е.:
[Pb2+] = [SO42-] = X
ПРPbSO4 = [Pb2+] = [SO42-
] = X
X = \e(ПРPbSO4) = \e(2,2
- 10-8) = 1,5 10-4 моль/л.
Чтобы перейти к растворимости, выраженной в г/л, найденную величину умножим на молекулярную массу, после чего получим:
1,5
- 10-4 303,2 = 4,5 10-2 г/л.
Образование осадков
Если
[Ag+]
- [Cl–] < ПРAgCl – ненасыщенный раствор
[Ag+
]
- [Cl–] = ПРAgCl – насыщенный раствор
[Ag+]
- [Cl–] > ПРAgCl – перенасыщенный раствор
Осадок образуется в том
случае, когда произведение концентраций ионов малорастворимого
электролита превысит величину его произведения растворимости при данной
температуре. Когда ионное
произведение станет равным величине ПР, выпадение осадка прекращается.
Зная объем и концентрацию смешиваемых растворов, можно рассчитать,
будет ли выпадать осадок образующейся соли.
Пример 3
Выпадает ли осадок при смешении равных объемов 0,2 M растворов Pb(NO3)2 и NaCl.
ПРPbCl2
= 2,4
Решение
При смешении объем раствора возрастает вдвое и концетрация каждого из веществ уменьшится вдвое, т.е. станет 0,1 M или 1,0
- 10-1 моль/л. Таковы же будут концентрации Pb2+ и Cl–. Следовательно, [Pb2+] [Cl–]2 = 1 10-1 (1 10-1)2 = 1 10-3. Полученная величина превышает ПРPbCl2 (2,4 10-4). Поэтому часть соли PbCl2 выпадает в осадок. Из всего сказанного выше можно сделать вывод о влиянии различных факторов на образование осадков.
Влияние концентрации растворов
Труднорастворимый электролит с достаточно большой величиной ПР нельзя осадить из разбавленных растворов. Например, осадок PbCl2 не будет выпадать при смешении равных объемов 0,1 M растворов Pb(NO3)2 и NaCl. При смешивании равных объемов концентрации каждого из веществ станут 0,1 / 2 = 0,05 M или 5
- 10-2 моль/л. Ионное произведение [Pb2+] [Cl1-]2 = 5 10-2 (5 10-2)2 = 12,5 10-5. Полученная величина меньше ПРPbCl2, следовательно выпадения осадка не произойдет.
Влияние количества осадителя
Для возможно более полного осаждения употребляют избыток осадителя.
Например, осаждаем соль BaCO3: BaCl2 + Na2CO3 ® BaCO3¯ + 2NaCl. После прибавления эквивалентного количества Na2CO3 в растворе остаются ионы Ba2+, концентрация которых обусловлена величиной ПР.
Повышение концентрации ионов CO32-, вызванное прибавлением избытка осадителя (Na2CO3), повлечет за собой соответственное уменьшение концентрации ионов Ba2+ в растворе, т.е. увеличит полноту осаждения этого иона.
Влияние одноименного иона
Растворимость труднорастворимых
электролитов понижается в присутствии других сильных электролитов,
имеющих одноименные ионы. Если к ненасыщенному раствору BaSO4 понемногу прибавлять раствор Na2SO4, то ионное произведение, которое было сначала меньше ПРBaSO4 (1,1
- 10-10), постепенно достигнет ПР и превысит его. Начнется выпадение осадка.
Влияние температуры
ПР является постоянной величиной при
постоянной температуре. С увеличением температуры ПР возрастает,
поэтому осаждение лучше проводить из охлажденных растворов.
Растворение осадков
Правило произведения растворимости
важно для переведения труднорастворимых осадков в раствор. Предположим,
что надо растворить осадок BaСO3. Раствор, соприкасающийся с этим осадком, насыщен относительно BaСO3.
Это означает, что [Ba2+
]
Если добавить в раствор кислоту, то ионы H+ свяжут имеющиеся в растворе ионы CO32- в молекулы непрочной угольной кислоты:
2H+ + CO32- ® H2CO3 ® H2O + CO2
Вследствие этого резко снизится концентрация иона CO32- , ионное произведение станет меньше величины ПРBaCO3. Раствор окажется ненасыщенным относительно BaСO3 и часть осадка BaСO3
перейдет в раствор. При добавлении достаточного количества кислоты
можно весь осадок перевести в раствор. Следовательно, растворение
осадка начинается тогда, когда по какой-либо причине ионное
произведение малорастворимого электролита становится меньше величины
ПР. Для того, чтобы растворить осадок, в раствор вводят такой
электролит, ионы которого могут образовывать малодиссоциированное
соединение с одним из ионов труднорастворимого электролита. Этим
объясняется растворение труднорастворимых гидроксидов в кислотах
Fe(OH)3 + 3HCl ® FeCl3 + 3H2O
Ионы OH– связываются в малодиссоциированные молекулы H2O.
Таблица. Произведение растворимости (ПР) и растворимость при 25°С некоторых малорастворимых веществ
| Формула | Растворимость | ПР моль / л |
| AgBr | 7,94 • 10-7 | 6,3 • 10-13 |
| AgCl | 1,25 • 10-5 | 1,56 • 10-10 |
| AgI | 1,23 • 10-8 | 1,5 • 10-16 |
| Ag2CrO4 | 1,0 • 10-4 | 4,05 • 10-12 |
| BaSO4 | 7,94 • 10-7 | 6,3 • 10-13 |
| CaCO3 | 6,9 • 10-5 | 4,8 • 10-9 |
| PbCl2 | 1,02 • 10-2 | 1,7 • 10-5 |
| PbSO4 | 1,5 • 10-4 | 2,2 • 10-8 |
www.examen.ru
Химик.ПРО – Вычислить произведение растворимости
Растворимость карбоната серебра (Ag2CO3) в воде при 25 0C равна 1,16 ⋅ 10-4 моль/л. Вычислить произведение растворимости его при этой температуре.
Решение задачи
Растворимость – это способность веществ равномерно распределяться в виде атомов, молекул или ионов по всему объему растворителя.
Равновесие в рассматриваемой системе может быть представлено уравнением:
Вычислить произведение растворимости. Из условия задачи определяем, что концентрация карбонат ионов (CO32-) в насыщенном растворе равна:
C (CO32-) = 1,16 ⋅ 10-4 (г-ион/л),
а концентрация ионов серебра (Ag+) вдвое больше, то есть:
C (Ag+) = 2 ⋅ 1,16 ⋅ 10-4 = 2,32 ⋅ 10-4 (г-ион/л).
Вычислить произведение растворимости
ПР (произведение растворимости) – постоянная величина, равная произведению концентраций ионов малорастворимого электролита в его насыщенном растворе.
Отсюда:
ПР = C2(Ag+) ⋅ C(CO32-) = (2,32 ⋅ 10-4)2 ⋅ (1,16 ⋅ 10-4) = 6,24 ⋅ 10-12.
Ответ:
произведение растворимости карбоната серебра 6,24 ⋅ 10-12.
Ввиду очень малой концентрации раствора и отсутствия других растворимых веществ концентрации ионов можно принять равными их активностям.
Похожие задачи по химии
himik.pro
1
Министерство образования Российской Федерации
Владимирский Государственный Университет
Кафедра Химии
Лабораторная работа по общей и неорганической химии №12
«Произведение растворимости»
Выполнил:
Студент группы Х-111
Гынку В. А.
Проверил:
Проф. Орлин Н.А.
Владимир 2011
Основные понятия:
Произведением растворимости (ПР) называют произведение концентрации ионов труднорастворимого электролита в насыщенном растворе.
Если труднорастворимый электролит диссоциирует с образованием нескольких одинаковых ионов, то при вычислении ПР этого электролита концентрации ионов должны быть возведены в степени, равные числу одинаковых ионов в уравнении диссоциации, например:
Pb3(PO4)2 = 3Pb2+ + 2PO43-
ПР (Pb3(PO4)2) = [Pb2+]3[ PO43-]2
Для большинства труднорастворимых электролитов значения их ПР определены и содержатся в соответствующих справочниках. Эти значения ПР используются для решения задач, в частности для определения растворимости и концентрации ионов труднорастворимого соединения в его насыщенном растворе, а также для определения возможности образования осадка труднорастворимого электролита при заданных концентрациях исходных веществ. В этом случае необходимо рассчитать произведение концентрации ионов (ПК) и сравнить его с ПР.
Если ПК ионов в растворе меньше его ПР, то осадок не образуется:
ПК < ПР ( осадок не образуется)
Такой раствор является еще не насыщенным. Если ПК ионов превышает ПР, раствор становится насыщенным, а затем и пересыщенным и это ведет к выпадению осадка:
ПК > ПР ( осадок образуется)
Ненасыщенный раствор каких-либо электролитов, например AgCl, можно сделать насыщенным, если к нему прибавлять электролит с одноименным ионом.
Так, если к ненасыщенному раствору AgCl, у которого ПК < ПРAgCl ( 1,5*10-10), прибавлять понемногу KCl или HCl, то произведение [Ag+][Cl–] постепенно достигает величины ПР, раствор из ненасыщенного становится насыщенным и из раствора выпадает осадок AgCl.
Для растворения осадка нужно, наоборот, уменьшить концентрацию хотя бы одного из ионов в насыщенном растворе, чтобы ПК ионов стало меньше величины ПР.
Этого достигают, как правило, связыванием одного из ионов осадка, находящегося в растворе, с ионом добавляемого реагента в слабодиссоциирующее или летучее соединение.
Растворение труднорастворимого электролита может происходить в случаях образования:
растворимого слабодиссоциирующего соединения;
комплексного соединения;
газообразного вещества;
или в случае ОВР, приводящей к изменению степени окисления ионов труднорастворимого электролита.
Опыт №1.Условия выпадения осадка.
В две пробирки внесли по 3 капли раствора сульфата марганца (II). Затем в одну пробирку добавили 3 капли сероводородной воды, а в другую – столько же раствора сульфида аммония.
Если произведение концентрации ионов превышает произведение растворимости, раствор становится насыщенным, а затем и перенасыщенным и это ведет к выпадению осадка. Сульфат аммония в отличии от сероводородной воды диссоциирует полностью, при этом повышается концентрация ионов серы в растворе (ПК>ПР-выпадает осадок).
Вывод: Осадок выпадает в том случае, когда достигается необходимая концентрация ионов обоих веществ.
Опыт №2.Влияние одноименных ионов на выпадение осадка.
В две пробирки налили по 7-8 капель насыщенного раствора хлората калия. В одну пробирку добавили 4 капли насыщенного раствора хлорида калия, в другую столько же хлорида натрия.
В случае, когда мы добавили KCl мы наблюдали образование на стенках пробирки кристалликов калия.
При этом растворимость хлорида калия уменьшиться, т.к. выпадает осадок.
Вывод: В следствии добавления в раствор одноименных ионов, мы повышаем ПК, что способствует выпадению осадка.
Опыт № 3. Последовательность выпадения осадков малорастворимых солей.
В одной пробирке мы получили осадок PbSO4, путем взаимодействия 3-х капель раствора Na2SO4 с 3-мя каплями раствора Pb(NO3)2. В другой пробирке получили осадок PbCrO4, смешивая 3 капли K2CrO4 с 3-мя каплями раствора Pb(NO3)2. В третью пробирку налили по 3 капли Na2SO4 и K2CrO4, а потом прилили Pb(NO3)2 и по цвету выпавшего осадка мы определили вещество.
Реакции, проводимые в данном опыте:
Как видно из 3-ей реакции выпал осадок PbCrO4 желтого цвета. Это произошло из-за того, что ПР PbCrO4 < ПР PbSO4. Но если мы продолжим добавление в этот раствор Pb(NO3)2, то вскоре закончатся ионы CrO42- и выпадать в осадок будет уже PbSO4.
Вывод: в реакциях идущих с выпадением осадка первым будет выпадать тот, у которого ПР меньше.
В двух пробирках был получен гидроксид магния, осадок белого цвета, путем взаимодействия 2 капель сульфата магния с 2 каплями гидроксида натрия.
В первую пробирку добавлена 1 капля HCl. Осадок растворился.
Во вторую пробирку добавлены 2 капли NH4Cl. Осадок растворился.
Условие растворения осадка по принципу ПР заключается в следующем: осадок растворяется при ПК < ПР.
Вывод: Осадок в первой пробирке растворяется быстрее, так как в этом случае образуется вода – вещество, которое диссоциирует слабее, чем гидроксид аммония, в результате чего в первой реакции химическое равновесие более, чем во второй, смещается в сторону продуктов реакции, что и объясняет ее более быстрое протекание.
Опыт № 5. Влияние величины ПР электролита на его способность к химическому взаимодействию.
В первую пробирку мы налили 2 капли раствора FeSO4, а в другую 2 капли CuSO4, затем в каждую прилили по 3 капли (NH4)2S. Выпали осадки. К осадкам мы прилили по 6-7 капель HCl 2н. В результате этого растворился осадок CuS, а осадок FeS не растворился.
Реакции:
Это произошло из-за того, что ПР CuS < ПР FeS
Вывод: Из-за того, что для растворения ионов меди требутся небольшое число анионов хлора. Она растворяется при нормальных условиях.
Опыт №6. Получение одних малорастворимых соединений из других
В пробирку были добавлены раствор нитрата свинца (II) и раствор сульфата натрия. Получен белый осадок сульфата свинца (II).
К полученному осадку добавлен раствор сульфида аммония. Образовался черный осадок сульфида свинца.
Один осадок заменил собой другой так как ПРPbS = 6,8 * 10-29 меньше чем ПРPbSO4 = 2,2 * 10-8
Вывод: Если одно ПР> ПР другого, то при реакции замещения выпадает тот, у которого ПР меньше.
studfiles.net
ПР Химия.docx – ПР Химия
Оглавление
Пояснительная записка
Методические рекомендации
Тематический план лабораторных работ по дисциплине
Техника безопасности
Задания для лабораторных работ
Лабораторная работа №1
Изготовление моделей молекул – представителей различных классов органических
соединений
Лабораторная работа №2
Практикум по номенклатуре органических соединений
Лабораторная работа №3
Получение этилена дегидратацией этилового спирта. Взаимодействие этилена с
бромной водой, раствором перманганата калия.
Обнаружение непредельных соединений в керосине, скипидаре.
Ознакомление с образцами полиэтилена и полипропилена.
Лабораторная работа №4
Определение наличия непредельных углеводородов в бензине и керосине.
Растворимость различных нефтепродуктов друг в друге
Лабораторная работа №5
Изучение восстановительных свойств альдегидов: реакция «серебряного зеркала»,
восстановление гидроксида меди.
Взаимодействие формальдегида с
гидросульфитом натрия.
Лабораторная работа №6
Химические свойства карбоновых кислот.
Свойства жиров и сложных эфиров.
Лабораторная работа №7
Свойства моно, ди и сахаридов
Лабораторная работа №8
Свойства поли сахаридов
Лабораторная работа №9
Растворение белков в воде и их коагуляция. Обнаружение белков в курином яйце и
молоке. Цветные реакции белков.
Лабораторная работа №10
Обнаружение витаминов: А,С, Д.
Лабораторная работа №11
Приготовление растворов заданной концентрации. Решение задач то теме «
Растворы»
№ Лабораторная работа 12
Строение атома и атомного ядра. Строение электронных оболочек атомов
химических элементов
Лабораторная работа№13
Сравнение свойств простых веществ, оксидов и гидроксидов элементов III
периода.
Лабораторная работа№14
Ознакомление с образцами пластмасс, волокон, каучуков, минералов и горных
4
7
8
10
13
13
15
20
26
29
34
39
44
49
53
56
61
66
72
4
znanio.ru
ГДЗ по Химии, решебник и ответы онлайн
GDZ.RU- 1 класс
- Математика
- Английский язык
- Русский язык
- Информатика
- Литература
- Окружающий мир
- Человек и мир
- 2 класс
- Математика
- Английский язык
- Русский язык
- Немецкий язык
- Белорусский язык
- Информатика
- Литература
- Окружающий мир
- Человек и мир
- 3 класс
- Математика
- Английский язык
- Русский язык
- Немецкий язык
- Белорусский язык
- Информатика
- Литература
- Окружающий мир
- Испанский язык
- 4 класс
- Математика
- Английский язык
- Русский язык
- Немецкий язык
- Информатика
- Музыка
- Литература
- Окружающий мир
- Испанский язык
- 5 класс
- Математика
- Английский язык
- Русский язык
- Немецкий язык
- Белорусский язык
- Французский язык
- Биология
- История
- Информатика
- География
- Музыка
- Литература
- Обществознание
gdz.ru
