Ответы@Mail.Ru: Люди напомощ!
Спинсобственный момент количества движения электрона или элементарной частицы (у протона, нейтрона и электрона спин равняется 1/2 h/2p), где h-постоянная Планка.
—
Спин (от англ. spin – вращаться) – собственный момент количества движения элементарной частицы, имеющий квантовую природу и не связанный с её перемещением в пространстве как целого. Спин отвечает неотъемлемому и неизменному внутреннему вращательному состоянию, присущему частице, хотя это вращательное состояние нельзя трактовать классически – как вращение тела вокруг собственной оси. Наряду со спином, любая частица, перемещаясь как целое в пространстве (например, по замкнутой орбите) относительно некой внешней точки (центра орбиты) , имеет относительно этой точки внешний или орбитальный момент количества движения.
Спин был первоначально введен для того, чтобы объяснить экспериментально наблюдаемый факт, что многие спектральные линии в атомных спектрах состоят из двух отдельно расположенных линий. Например, первая линия серии Бальмера в атоме водорода, которая проявляется при переходах между уровнями с n = 3 и n = 2, должна наблюдаться как одиночная линия с длиной волны = 6563, однако на самом деле наблюдались две линии с расстоянием между ними = 1.4. Это расщепление первоначально связывалось с еще одной дополнительной степенью свободы электрона – вращением. Предполагалось, что электрон можно рассматривать как вращающийся волчок, и величина спин связывалась с его характеристикой вращения. На самом деле, как выяснилось позже, спин имеет квантовую природу и не связан с какими-либо перемещениями частицы в пространстве. Спин измеряется в единицах постоянной Планка и равен s, где s – характерное для каждой частицы полуцелое или целое (включая нуль) положительное число. Спин частиц может иметь только дискретный набор значений. Это одна из характерных особенностей квантовой физики. Частицы с целым спином называются бозонами, с полуцелым – фермионами.
Понятие спина применяют и к сложным, составным микрообъектам – атомам, атомным ядрам, адронам. В этом случае под спином понимают момент количества движения микрообъекта в состоянии покоя, т. е. когда орбитальный (внешний) момент количества движения отсутствует. Спины составных микрообъектов являются векторной суммой спиновых и орбитальных моментов входящих в их состав частиц – ядра и электронов в случае атома, протонов и нейтронов в случае ядра, кварков в случае протона, нейтрона и других адронов.
—————-
V. Спиновая химия и химическая радиофизика
Еще одна новая область современной химии – спиновая химия, исследующая поведение угловых моментов (спинов) электронов и ядер в химических реакциях. Спиновая химия основана на фундаментальном законе: спин электронов и ядер в адиабатических химических реакциях строго сохраняется. Разрешены только те реакции, которые не требуют изменения спина. Другими словами, все химические реакции являются спин-селективными – они разрешены только для таких спиновых состояний реагентов, у которых полный спин одинаков со спином продуктов, и полностью запрещены, если спин реагентов не равен спину продуктов.
otvet.mail.ru
Спин электрона.
При изучении спектра атома водорода
обнаружили, что они имеют дуплетную
структуру (каждая спектральная линия
расщеплена на две полоски). Чтобы
объяснить это явление предположили,
что электрон обладает собственным
механическим моментом импульса – спином
(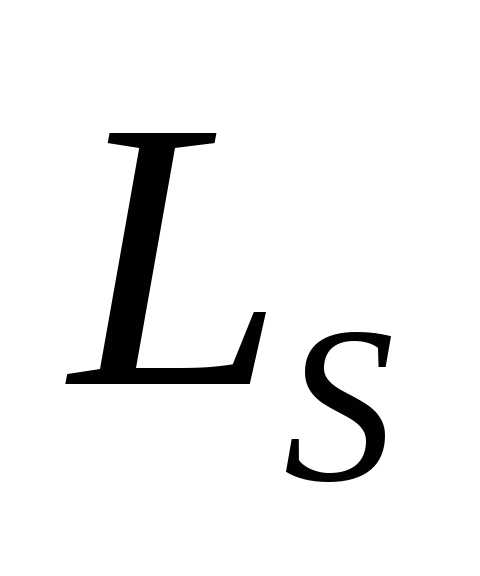 ).
Первоначально спин связывали с вращением
электрона вокруг своей оси. Впоследствии
выяснилось, что это ошибочно. Спин –
это внутреннее квантовое свойство
электрона – у него нет классического
аналога. Спин квантуется по закону:
).
Первоначально спин связывали с вращением
электрона вокруг своей оси. Впоследствии
выяснилось, что это ошибочно. Спин –
это внутреннее квантовое свойство
электрона – у него нет классического
аналога. Спин квантуется по закону:
, |
где  – спиновое квантовое число.
– спиновое квантовое число.
 спина квантуется так, что вектор
спина квантуется так, что вектор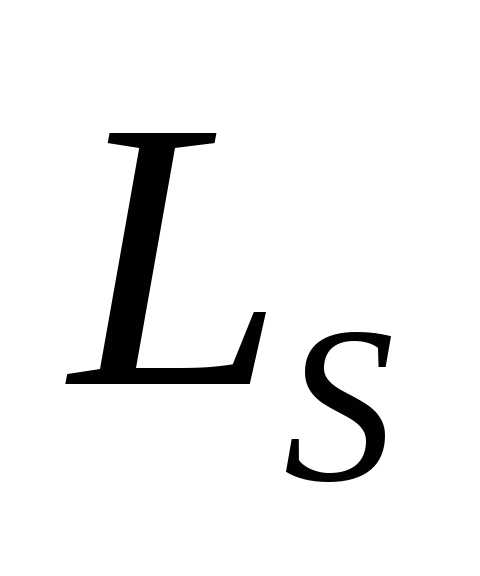 может принимать
может принимать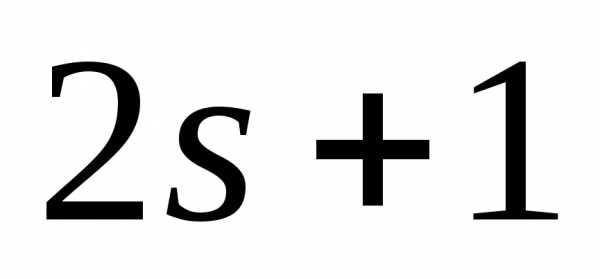 ориентаций. Так как спектральная линия
расщепляется только на две части, то
ориентаций
ориентаций. Так как спектральная линия
расщепляется только на две части, то
ориентаций только две:,
отсюда
только две:,
отсюда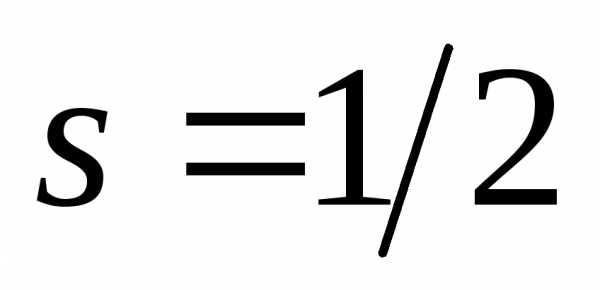 .
Проекция спина на выделенное направление
определяется выражением:
.
Проекция спина на выделенное направление
определяется выражением:
|
 .
.Таким образом, опытные данные привели к необходимости введения спина. Поэтому для полного описания состояния электрона в атоме необходимо наряду с главным, орбитальным и магнитным квантовыми числами задавать еще магнитное спиновое квантовое число.
Принцип Паули. Распределение электронов в атоме по состояниям.
Состояние каждого электрона в атоме характеризуется четырьмя квантовыми числами:
 (
(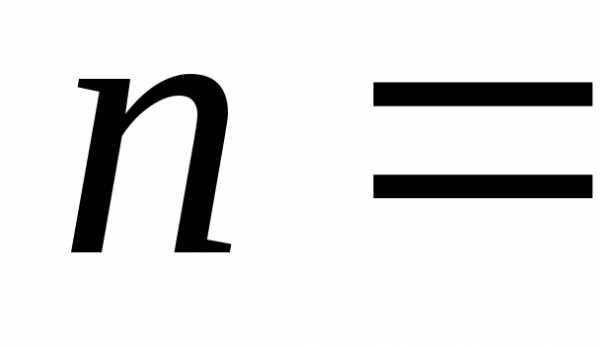
 ,
,  (
(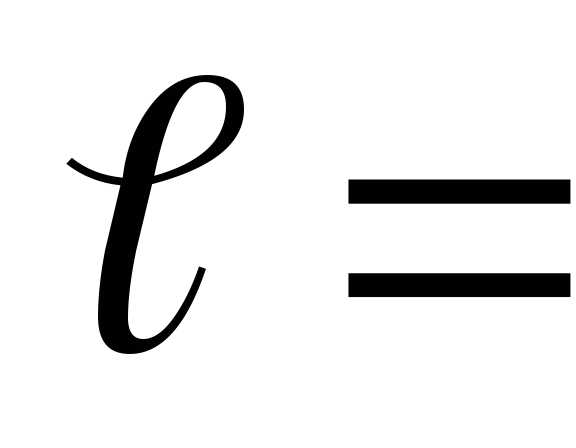 0,
1, 2,…,
0,
1, 2,…, )
– квантует орбитальный механический
момент
)
– квантует орбитальный механический
момент ,
,
 (
( 0,
0,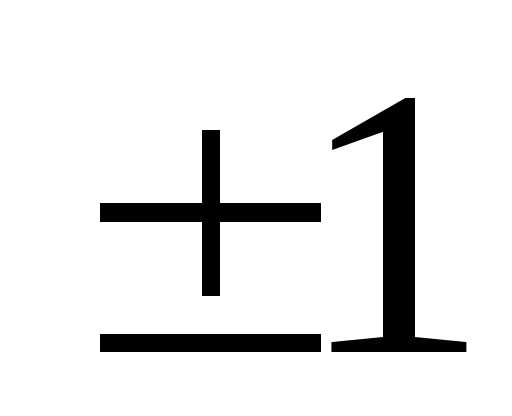 ,
, ,…,
,…,

 ,
,  (
(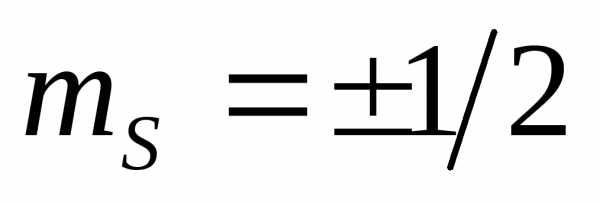 )
– квантует проекцию спина на заданное
направление
)
– квантует проекцию спина на заданное
направление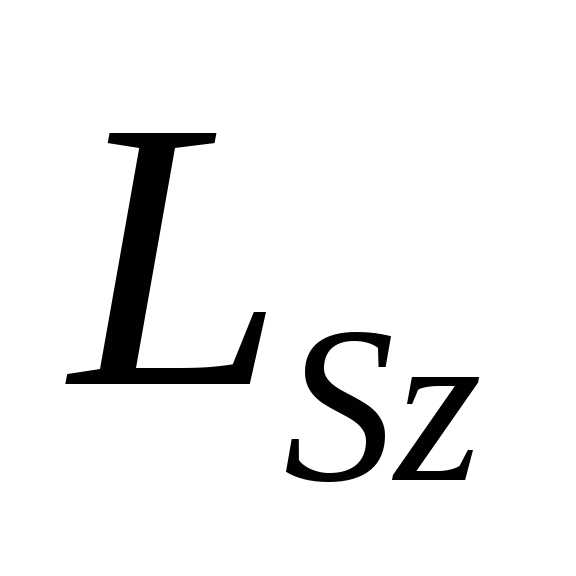 .
.
С возрастанием  растет энергия. В нормальном состоянии
атома электроны находятся на самых
низких энергетических уровнях. Казалось
бы, что все они должны быть в состоянии
1s. Но опыт показывает, что
это не так.
растет энергия. В нормальном состоянии
атома электроны находятся на самых
низких энергетических уровнях. Казалось
бы, что все они должны быть в состоянии
1s. Но опыт показывает, что
это не так.
Швейцарский физик В.Паули сформулировал
принцип: в одном и том же атоме не может
быть двух электронов с одинаковыми
квантовыми числами  ,
, ,
, ,
, .
То есть два электрона должны отличаться
по крайней мере значениями одного
квантового числа.
.
То есть два электрона должны отличаться
по крайней мере значениями одного
квантового числа.
Значению  соответствует
соответствует состояний, отличающихся значениями
состояний, отличающихся значениями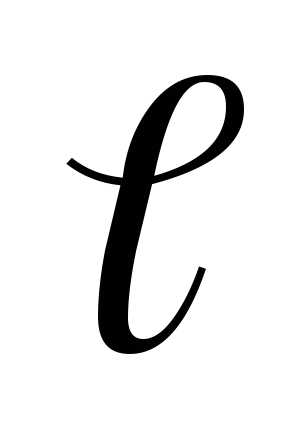
 .
Но еще
.
Но еще имеет два значения
имеет два значения и
и ,
значит всего
,
значит всего состояний. Поэтому в состояниях с
заданным
состояний. Поэтому в состояниях с
заданным могут находиться
могут находиться электронов. Совокупность электронов с
одинаковым
электронов. Совокупность электронов с
одинаковым называется слоем, а с одинаковыми
называется слоем, а с одинаковыми
 – оболочкой.
– оболочкой. Поскольку орбитальное квантовое число  принимает значения от
принимает значения от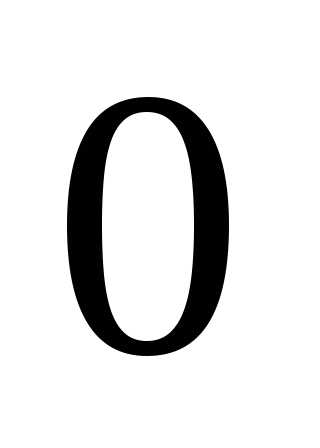 до
до ,
число оболочек в слое равно
,
число оболочек в слое равно .
Количество электронов в оболочке
определяется магнитным и спиновым
квантовыми числами: максимальное число
электронов в оболочке с заданным
.
Количество электронов в оболочке
определяется магнитным и спиновым
квантовыми числами: максимальное число
электронов в оболочке с заданным равно
равно .
Обозначение слоев и распределение
электронов по слоям и оболочкам
представлены в таблице 1.
.
Обозначение слоев и распределение
электронов по слоям и оболочкам
представлены в таблице 1.
| Символ слоя | Максимальное число электронов в оболочках
| Макс. число
электронов в слое | ||||
|
|
|
|
| |||
1 | K | 2 | 2 | ||||
2 | L | 2 | 6 | 8 | |||
3 | M | 2 | 6 | 10 | 18 | ||
4 | N | 2 | 6 | 10 | 14 | 32 | |
5 | O | 2 | 6 | 10 | 14 | 18 | 50 |
Пользуясь распределением электронов по состояниям можно объяснить периодический закон Менделеева. Каждый последующий атом имеет на один электрон больше, располагается он в состоянии с возможно меньшей энергией.
Периодическая система элементов
начинается с простейшего атома водорода.
Его единственный электрон находится в
состоянии 1s, характеризуемом
квантовыми числами ,
, и
и (ориентация спина произвольна).
(ориентация спина произвольна).
В атоме  два электрона находятся в 1sсостоянии с антипараллельными спинами.
На атоме
два электрона находятся в 1sсостоянии с антипараллельными спинами.
На атоме
У атома  3 электрона. Согласно принципу Паули
третий электрон уже не может разместиться
в целиком заполненном слое К и занимает
наинизшее энергетическое состояние с
3 электрона. Согласно принципу Паули
третий электрон уже не может разместиться
в целиком заполненном слое К и занимает
наинизшее энергетическое состояние с (L-слой), то есть 2sсостояние. Электронная конфигурация
для атома
(L-слой), то есть 2sсостояние. Электронная конфигурация
для атома :
1
:
1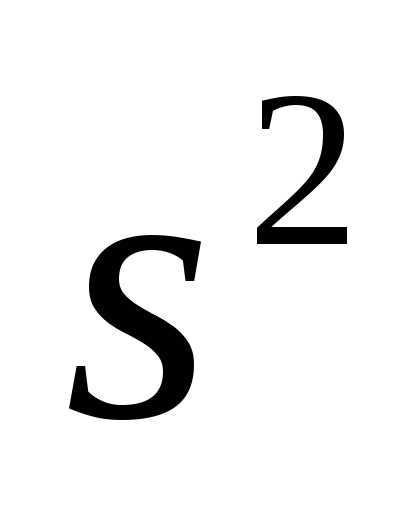 2
2 .
Атомом
.
Атомом начинается 2 период Периодической
системы Менделеева. Заканчивается 2
период инертным газом неоном. У атома
неона полностью заполнена 2pоболочка и полностью заполнен слойL.
начинается 2 период Периодической
системы Менделеева. Заканчивается 2
период инертным газом неоном. У атома
неона полностью заполнена 2pоболочка и полностью заполнен слойL.
Одиннадцатый электрон  размещается вMслое (
размещается вMслое ( ),
занимая наименьшее состояние 3s.
Электронная конфигурация для
),
занимая наименьшее состояние 3s.
Электронная конфигурация для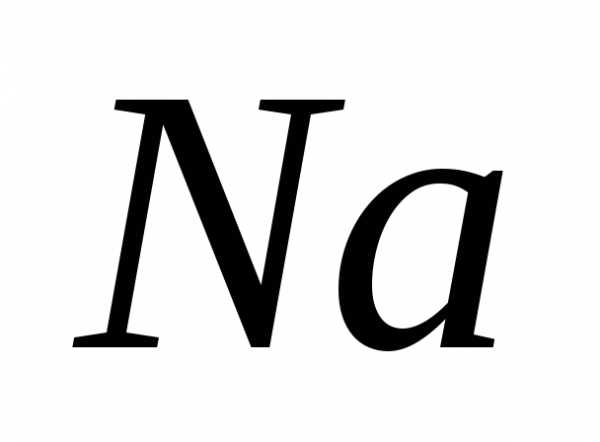 :
1
:
1 2
2 2
2 3
3 .
Электрон 3s(как и 2sу лития) является валентным, поэтому
свойства
.
Электрон 3s(как и 2sу лития) является валентным, поэтому
свойства подобны свойствам
подобны свойствам .
. завершает 3 период. Его электронная
конфигурация
завершает 3 период. Его электронная
конфигурация :
1
:
1 2
2 2
2 3
3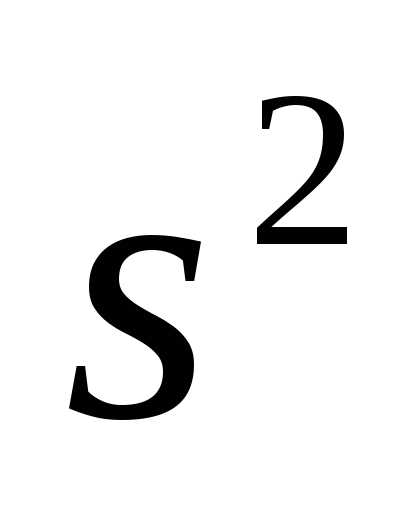 3
3 .
Начиная с атома калия в застройке
электронных оболочек происходит
отклонение. Вместо заполнения 3dоболочки, заполняется сначала 4s(
.
Начиная с атома калия в застройке
электронных оболочек происходит
отклонение. Вместо заполнения 3dоболочки, заполняется сначала 4s( :
1
:
1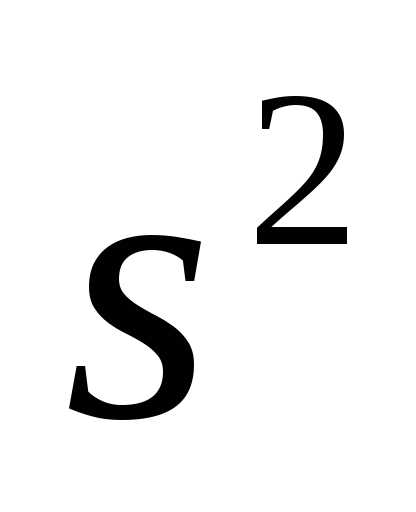 2
2 2
2 3
3 3
3 4
4 ).
Это происходит потому, что оболочка 4sэнергетически выгоднее, ближе расположена
к ядру, чем 3d. После
заполнения 4sзаполняется
3d, а затем 4р оболочка,
которая дальше от ядра, чем 3d.
).
Это происходит потому, что оболочка 4sэнергетически выгоднее, ближе расположена
к ядру, чем 3d. После
заполнения 4sзаполняется
3d, а затем 4р оболочка,
которая дальше от ядра, чем 3d.
С такими отклонениями приходится
сталкиваться и дальше. Оболочка 4f,
которая содержит 14 электронов, начинает
заполняться после того, как заполняются
5s, 5p, 6s.
В итоге у элементов 58-71 добавляющиеся
электроны садятся в 4fсостояния, а внешние электронные оболочки
у этих элементов одинаковы. Поэтому их
свойства близки. Эти элементы называют
лантанидами. Аналогично близки по
свойствам актиниды (90-103), где заполняется
5fоболочка при неизменном
7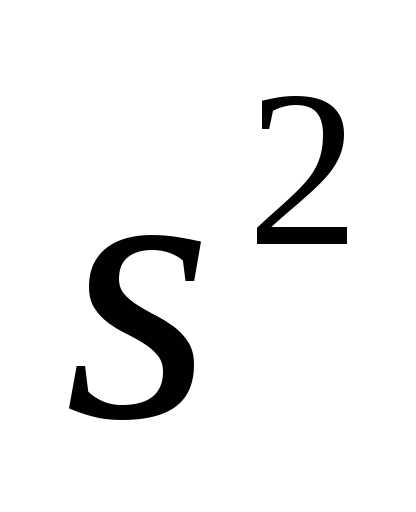 .
.
Таким образом, открытая Менделеевым периодичность в химических свойствах элементов объясняется повторяемостью в структуре внешних оболочек у атомов родственных элементов.
Валентность химического элемента равна числу электронов в sили р оболочке с максимальнымn. Еслиs,p,d,… оболочки полностью заполнены, то их спины скомпенсированы. Такие элементы являются диамагнетиками. Если оболочки не полностью заполнены, то имеются не скомпенсированные спины. Это парамагнетики.
studfiles.net
Химия школьникам: 11 класс. Спин
Спин наглядно соответствует как бы «собственным вращениям» частиц. Было бы, однако, наивно представлять себе что-то вроде волчков, вращающихся вокруг своей оси. Не нужно забывать, что частицы вовсе не шарики и вообще не тот объект, портрет которого мог бы написать самый изощренный художник. Наши наглядные представления хороши для мира «больших вещей», для макромира, но мало чем могут помочь, когда мы начинаем изучать явления микромира.
Если из ствола нарезного ружья вылетает пуля, то она на лету вращается вокруг продольной, т. е. совпадающей с направлением полета, оси. Представьте теперь себе момент охоты очень сильно закрученными пулями. Засевшая в мишени пуля сообщит ей свое вращение и мишень начнет вращаться в ту же сторону, что и пуля.
А теперь представьте себе, что мишень обстреливается электронами или другими элементарными частицами и поглощает их. Если все частицы закручены в одну сторону, то, поглощаясь, они должны сообщить вращение мишени. Так вот, чем больше спин, тем сильнее начнет вращаться мишень.
Бесплодно искать объяснение спина в каких-либо механических картинках. В опытах с мишенью мы имеем принципиальную схему того, как этот спин можно измерять. Конечно, мы коснулись лишь самой поверхности явления — за ней скрываются сложнейшие особенности законов движения и взаимодействия элементарных частиц… Однако уже эта внешняя сторона позволяет сравнивать спины различных частиц и дает тем самым некоторое представление о новом свойстве объектов микромира.
Разумеется, описанный опыт с мишенью является весьма грубым подобием реальных экспериментов.
Представьте себе, что мишень — пусть этой мишенью будет обычная копеечная монета — обстреливается из ружья, стреляющего элементарными частицами, закрученными в одну сторону. Здесь выявится замечательное обстоятельство. При равном числе попаданий целый ряд частиц — электроны, протоны, нейтроны и некоторые другие — передадут мишени одинаковый момент количества движения. У них, следовательно, одинаковый спин. Частицы света — фотоны — передадут мишени вдвое больший вращательный момент, а отдельные частицы, как, например, л-мезоны, вообще не вызовут вращения. Их спин равен нулю.
Количественное значение спина очень точно известно: он равен либо 0, либо ћ/2, либо ћ, где ћ — постоянная Планка — квант действия. У электрона спин равен ћ/2. Постоянная Планка настолько мала (число с 27 нулями после запятой), что мишень-копейка будет совершать один оборот в секунду лишь в том случае, если мы будем продолжать ее обстрел 10 000 000 000 000 000 лет, делая по тысяче «выстрелов» в секунду. Здесь ситуация примерно такая же, как если бы мы пытались вызвать вращение Луны, стреляя в нее из нарезного ружья. О «малом» или «большом» спине говорить не слишком разумно: в микромире действуют непривычные для нас масштабы. Важно, что спин существен во многих случаях, в частности при соединении атомов в молекулу.
Электрон, как показывает опыт, может быть закручен только двумя способами: вращение электрона образует либо правый, либо левый винт движения. Соответственно может, закручиваться и мишень. Говоря другими словами, возможны только две ориентации спина по отношению к любому направлению. Поэтому, если спин одного электрона фиксирован, то спин другого либо параллелен ему, либо антипараллелен.him-bio.blogspot.com
Теория спин-валентности. Типы химической связи
Чрезвычайно разнообразен окружающий нас мир. Сейчас ученые имеют представление о 15 миллионах веществ. Многие из веществ состоят из молекул, которые, в свою очередь, состоят из атомов, связанных между собой химическими связями. При этом атомов химических элементов, входящих в состав этих веществ, примерно 100. В школьном курсе химии изучаются всего примерно 50 химических элементов. Поэтому для химии чрезвычайно важно свести проблему строения молекул к химическим связям между атомами. Насколько это справедливо?
Начнем рассмотрение с самой простой молекулы, вернее, молекулярного положительного иона – h3+, т.е. системы, состоящей из двух протонов и одного электрона. Наиболее точной наукой для электронно-ядерных систем сейчас является квантовая механика: для h3+ надо написать Уравнение Шредингера и решить его. Прежде всего надо учесть кулоновское взаимодействие одного электрона с каждым их ядер (энергию притяжения электрона к ядрам) и энергию отталкивания одинаково заряженных ядер. Решения этого уравнения получены с хорошей точностью. Здесь мы имеем возможность лишь кратко прокомментировать это решение. Электрон в молекулярном ионе водорода может находиться как в основном, так и в возбужденном электронных состояниях. Но любое из этих состояний характеризуется молекулярной орбиталью. Строго говоря, никаких атомных орбиталей в молекуле не сохраняется.
Но и в молекуле h3+, и, тем более, в многоэлектронных молекулах часто стремятся молекулярную орбиталь сконструировать из атомных орбиталей валентных электронов атомов, входящих в состав молекулы. При этом количественно получается достаточно плохое решение, а вот качественный результат его очень удобен. Оказывается, что атомные орбитали (например 1s атомов водорода) в молекуле h3+ преобразуются под действием зарядов двух ядер в молекулярные орбитали. Одна молекулярная орбиталь s (связывающая молекулярная орбиталь) имеет энергию меньшую, чем исходные атомные орбитали 1s атомов водорода. Это означает, что из двух атомов водорода может образоваться устойчивая молекула водорода (и даже устойчивый молекулярный ион h3+, в котором химическая связь осуществляется одним электроном). Энергия второй молекулярной орбитали s· больше, чем энергия двух атомных орбиталей, поэтому ее называют разрыхляющей орбиталью. Все множество молекулярных орбиталей, полученное из преобразованных атомных орбиталей, вплоть до 2p-орбиталей, представлено на рисунке.
Теперь при рассмотрении электронной конфигурации достаточно простых молекул (например молекул A2, образованных химическими элементами 1-го и 2-го периода Периодической системы) необходимо все электроны разместить на молекулярных орбиталях с учетом принципа запрета Паули (на одной орбитали могут находиться не больше двух электронов с противоположно направленными спинами) и принципа минимальной энергии молекулярной системы. На рисунках представлены электронные конфигурации молекул водорода и азота.
Поскольку в методе молекулярных орбиталей атомные орбитали преобразованы в молекулярные орбитали, то нет и атомов в молекуле, а остались только ядра атомов и обобществленные электроны. Следовательно исчезли химические связи, как их понимала классическая теория химического строения. Можно, конечно, подсчитать общее число электронов на связывающих орбиталях – именно они способствуют образованию молекулы как единого целого. Можно подсчитать общее число электронов на разрыхляющих орбиталях – эти электроны ослабляют молекулу, стремятся разорвать ее на атомы.
Подсчитаем разность между всеми связывающими и разрыхляющими электронами и назовем ее “эфективная связывающая электронность” (ЭСЭ). Далее, если желательно найти общий язык с классической теорией химического строения, нужно разделить ЭСЭ на два (именно пара электронов образует одну ковалентную связь). Тогда становится достаточно просто провести корреляцию между энергией диссоциации двухатомной молекулы и кратностью химической связи. Так как в молекуле h3+ всего один электрон образует химическую связь, то приходится ввести для него кратность связи равную 0.5. В таблице 3.2.1 приведены сведения о свойствах двухатомных молекул типа A2, образованных атомами элементов первого и второго периодов.
Mетод молекулярных орбиталей позволяет объяснить закономерности в энергиях диссоциации не только молекул типа A2, но и изоэлектронных (то есть имеющих то же самое число электронов) молекул типа AB. Например, 14 электронов имеют молекулы N2, CO, BF. У молекул CO и BF схема уровней (см. рис. 3.2.1) будет несколько искажена, но эффективная связывающая электронность будет равна 6. Поэтому и прочность связей в этих молекулах будет сопоставимой с прочностью связей в молекуле N2. В методе молекулярных орбиталей находят естественное объяснение и парамагнитные свойства молекул B2, O2 (у этих молекул для электронов имеются две свободные с одинаковой энергией орбитали, по правилу Хунда на каждой из них располагается электрон, но таким образом, чтобы спины электронов были направлены в одну сторону).
Теория спин-валентности
Не имея возможности в рамках школьного курса химии изучать метод молекулярных орбиталей, при рассмотрении электронной конфигурации молекул обычно останавливаются на простом перекрывании атомных орбиталей валентных электронов у атомов. Так, если два атома водорода с атомными орбиталями 1s расположить на расстоянии re=0.74 A (межъядерное расстояние в молекуле водорода), то атомные орбитали в значительной области межъядерного пространства будут перекрываться (заштрихованная часть на рис. 3.2.3). Это значит, что каждому электрону будет выгодно находиться в заштрихованной области и при взаимодействии со “своим”, и при взаимодействии с “чужим” ядром в молекуле h3. Эта заштрихованная область как бы и представляет собой “молекулярную” орбиталь. Иногда в этой заштрихованной области рисуют две точки (изображающие электроны) либо две стрелки (направленные в противоположные стороны).
В главе 18 будет рассказано о том, что для объяснения тетраэдрического строения молекулы метана, тетраэдрической направленности валентных связей у углеродных атомов в молекулах углеводородов говорят не о том, что 2s- и 2p-атомные орбитали атомов углерода преобразуются в молекулярные орбитали с тетраэдрической пространственной направленностью, а говорят о гибридизации лишь атомных орбиталей: sp3-гибридизации в насыщенных углеводородах и sp2- или sp-гибридизации в ненасыщенных углеводородах и их производных.
Интересны в этом отношении доводы, которые используются в теории спин-валентности. Сначала утверждается, что валентность химического элемента определяется числом неспаренных электронов у его атомов. У атомов щелочных металлов это выполняется. У атомов щелочноземельных металлов, у элементов группы IIIA, у атомов углерода валентность элемента не совпадает с числом неспаренных электронов. Далее считают, что в момент образования химических связей электроны с орбитали 2s у атомов этих химических элементов переходят на орбиталь 2p. Но такой переход требует очень большой затраты энергии? Она будет компенсирована за счет образования дополнительных химических связей.
другие статьи:
- Агрегатные состояние вещества
- Строение атома – развитие моделей
- Квантовая механика и строение атома водорода
- Электронные конфигурации атомов и периодический закон
- Ядра атомов. Радиоактивность и изотопы
- Строение молекул. Типы химической связи
- Квантовая механика молекул и теория химической связи. Метод молекулярных орбиталей. Теория спин-валентности
- Окислительно-восстановительные реакции
- Химическая термодинамика
- Химическая кинетика и катализ
- Химическое равновесие. Обратимые и необратимые реакции
- Электрохимия. Свойства электролитов. Электролиз
www.himikatus.ru
Спины – Справочник химика 21
Иными словами, орбитали данного подслоя заполняются сначала по одному, затем по второму электрону. Электроны с противоположными спинами на одной и той же орбитали образуют двухэлектронное облако (спариваются) и их суммарный спин равен нулю. [c.23]Ср( ди радиоспектроскопических методов большое значение имеют методы магнитной радиоспектроскопии — ядерный магнитный резонанс (ЯМР) и электронный парамагнитный резонанс (ЭПР). Эти методы основаны на том, что в веш,естве, помеш,енном в сильное магнитное поле, индуцируются энергетические уровни ядер (ЯМР) и электронов (ЭПР), отвечающие изменению спина ядра или спина электрона. Спиновые энергетические переходы соответствуют поглощению квантов радиоволн. [c.147]
Было высказано предположение- [44, 45], что реакции цис-транс изомеризации могут протекать по двум различным путям. Первый из них должен включать крутильное колебание около двойной связи. Этот путь требует больших энергий активации, но должен иметь нормальный частотный фактор. Второй путь должен включать возбуждение двойной связи, соответствующее образованию бирадикала с двумя неспареиными электронами, благодаря чему возникает возможность свободного вращения вокруг результирующей одинарной связи. Если этиленовая молекула может почему-либо совершить переход из своего нормального (синглетного) состояния в бирадикальное (триплетное) состояние, то энергия активации может быть много меньшей. Было рассчитано, что в некоторых случаях она равна лишь 25 ккал моль [46]. Однако такие переходы являются запрещенными в квантовой механике, поскольку они включают изменение мультиплетности полного электронного спина молекулы. [c.229]
Подведем некоторые итоги сказанному. Состояние электрона в атоме может быть описано с помощью четырех квантовых чисел п, I, П11 и т.,. Они характеризуют спин, энергию электрона, объем и форму пространства, в котором вероятно его пребывание около ядра. При переходе атома из одного квантового состояния в другое, в связи с чем меняются значения квантовых чисел, происходит перестройка электронного облака. При этом атом поглощает или испускает квант энергии. [c.19]
Элементы, находящиеся в первом основном ряду таблицы периодической системы элементов, как бор, углерод и азот, имеют по четыре электронных орбиты, которые могут быть использованы для образования связей. Они известны как 2s, 2рх, 2ру, 2pz — электронные орбиты. Каждая из орбит способна удерживать два электрона с противоположными спинами. Химическая связь (образуется путем частичного перекрывания двух таких орбит, по одной от каждого атома, содержащих пару электронов противоположного спина. Так, нанример, атомы таких элементов, как бор, углерод и азот, имеющих суммарно по четыре орбиты, способны к образованию максимум четырех простых связей. [c.393]
В молекуле два электрона. Согласно принципу наименьшей энергии и принципу Паули, эти два электрона с противоположными спинами также заселяют ст Чз-орбиталь. Реакцию образования молекулы водорода из атомов в системе обозначений теории молекулярных орбиталей можно записать [c.50]
Протон На, связанный с центральным углеродным атомом, во всех случаях оказывается наименее экранированным. Его сигнал представляет собой сложный симметричный мультиплет, обусловленный расщеплением на двух парах концевых протонов. Два других сигнала принадлежат сим-протонам Нь и амги-протонам Не, каждый из них представляет собой дублет, вызванный расщеплением на центральном протоне. Различие в величинах констант спин-спинового взаимодействия /аЬ = 6—8 Гц и /ас = 10—15 Гц позволяет делать однозначное отнесение сигналов при интерпретации спектров ЯМР. си -Протоны Нь всегда менее экранированы, чем анти-протоны Не, и поэтому дают сигнал в более слабом поле. [c.108]
В соответствии с принципом Паули на одной орбитали могут находиться два электрона с противоположными спинами. Следовательно, электронная формула следующего после водорода элемента — гелия 15 . Модель атома гелия аналогична модели атома водорода, так как два -электрона образуют двухэлектронное облако [c.23]
При составлении схем распределения электронов в атоме пользуются следующими обозначениями черта — орбиталь, стрелка — электрон, направление стрелки — ориентация его спина. [c.23]
Метод ЯМР позволяет наблюдать ядра, обладающие магнитным моментом преимущественно со спином /2. Поглощаемые частоты, характерные для таких ядер и в сильных магнитных полях, лежат в области от 1 до 100 Мгц и очепь чувствительны к внутримолекулярным и межмолекулярным взаимодействиям. Хотя этот метод с точки зрения концентрации и не так чувствителен, как ЭПР, по он дает возможность измерять наличие небольших концентраций промежуточных продуктов, находящихся в равновесии с большим числом веществ [53]. [c.99]
В первой главе рассказано, как был создан газотеплозащитный скафандр. Это изобретение четвертого уровня синтезирована новая техническая система. Теперь представьте горноспасателя с внушительным резервуаром сжиженного воздуха за спиной. Воздух должен непрерывно испаряться значит в резервуаре должны быть постоянно открытые входные отверстия. Но через [c.49]
Достижение Северного полюса вполне можно уподобить шахматной партии, в которой все ходы, ведущие к благоприятному исходу, продуманы заранее, задолго до начала игры. Для меня это была старая игра — я вел ее с переменным успехом на протяжении двадцати трех лет. Правда, я постоянно терпел неудачу, но с каждым новым поражением приходило новое понимание игры, ее хитростей, трудностей и тонкостей, и с каждой новой попыткой успех придвигался чуточку ближе то, что казалось прежде невозможным или в лучшем случае крайне сомнительным, начинало представляться возможным, а затем и весьма вероятным. Я постоянно анализировал причины каждого поражения и в конце концов пришел к убеждению, что они могут быть устранены и, если фортуна не совсем повернется ко мне спиной, игра, ко- [c.214]
Конфигурация электронной оболочки иевоз( ужденного атома определяется зарядом его ядра. Электроны с одинаковым значением главного квантового числа п об-разукт квантовый слой близких по размерам облаков. Слои с га = I, 2, 3, 4,. .. обозначаются соответственно буквами К, Ь, М. N…. По мере удаления от ядра емкость слоев увеличивается и в соответствии со 31 ачением п составляет 2 (слой К), 8 (слой Ь), 18 (слой М), 32 (слой Л/). .. элект-роноЕ (см. табл. 2). Квантовые слои в свою очередь построены из подслоев, объединяющих электроны с одинаковым значением орбитального квантового числа I. А подслои составлены из орбиталей на каждой орбитали могут находиться максимум два электрона (с противоположными спинами). [c.21]
Столь различное поведение диа- и парамагнитных веществ обусловлено различным характером их внутренних магнитных полей. Как известно, вращение электронов вокруг оси создает магнитное поле, характеризуемое спиновым магнитным моментом. Если в веществе магнитные поля электронов взаимно замкнуты (скомпенсированы) и их суммарный момент равен нулю, то вещество является диамагнитным. Если же магнитные поля электронов не скомпенсированы и вещество имеет собственный магнитный момент, то оно является парамагнитным. Так, атом водорода, имеющий один электрон, па эамагнитен. Молекула же Нп диамагнитна, так как при образовании химической связи происходит взаимная компенсация спиноЕ электронов. [c.155]
Если ядра имеют отличные от нуля спины, то в это выражение включаются еще и другие постоянные множители. Если и 2 — спины ядер двухатомной молекулы, то выражение для полной вращательной суммы будет иметь вид [c.186]
Перед загрузкой куба горячим сырьем проверяют, нет ли в кубе воды, а затем вытесняют из него воздух паром, предварительно удалив конденсат из паропровода. Перед закрытием куба проверяют состояние его стенок и днища, а также правильность закладки штропов. Люки куба закрывают на все болты и струбцины. При воспламенении кокса в кубе в момент открытия люка последний немедленно закрывают и подают водяной пар в куб. Открывая верхний люк, нужно стоять спиной к ветру. [c.94]
В работах [55—56] исследовали реакции алюминийалкилов и ИСЦ с помощью метода электронного парамагнитного резонанса. Установлено, что в суспензии образуются парамагнитные частицы, в то время как выделенные твердые продукты не дают сигналов ЭПР из-за спин-решеточной релаксации ионов трехвалентного Т1. [c.217]
За исключением постоянных членов ядерных спинов и Л, это выражение снова идентично классическому результату. [c.186]
Для атомов иода g = S = для 12 2 = 1 ( 2 = 0)- Ядерные спины опускаются, так как в отношении они сокращаются. Число симметрии а = 2 m2 = 2m = 2mi можно произвести замену и окончательно написать [c.188]
Пожарные лестницы, как известно, не должны иметь дуговых спинных ограждений, и пользование такими лестницами опасно. [c.192]
Оба единичных электрона на двух различных р-орбитах (предполагается, что они имеют противоположные спины) будут взаимодействовать между собой, обеспечивая образование дополнительной связи (тг-связь). В соответствии с этим объяснением двойная связь в этилене получается из одной простой связи или ог-связи, включающей частичное накладывание гибридизованных зр -орбит обоих атомов углерода, и я-связи, образуемой за счет спаривания двух электронов в результате частичного накладывания /)-орбит. [c.395]
Концентрация акцепторных центров Сд ц 10 , спин/г [c.47]
Мы всюду пренебрегаем электронной суммой по состояниям. Основанием этому служит то, что расстояние между электронными уровнями столь велико, что при не слишком высоких температурах занятым является только один нижний электронный уровень. Сумма по состояниям для электронных состояний в случае, если занят только нижний уровень, просто равна Zgie i/ gy. Для молекул, имеющих нулевой магнитный момент (а это бывает чаще всего), gi = Для молекул, обладающих магнитным моментом и суммарным спином (таких, как О2, N0, атомы и т. п.) g = 2 + 1, где j — суммарный спин. [c.188]
В первом приближении можно считать, что различные формы внутренней энергии независимы друг от друга. В таком случае, если пренебречь влиянием электронной энергии и спинами ядер, вычисление термодинамических функций для линейных молекул можно осуществлять при помощи следующих уравнений [c.184]
Молекула гелия в невозбужденном состоянии не сущ,ествует, так как у нее одинаково число связывающ,их и разрыхляюш,их электронов. Можно показать, что и молекула Н. при одинаковых (параллельных) спинах электронов также не существует. В этом случае один из электронов находится на связывающей, другой — на разрыхляющей орбитали. [c.51]
В данном случае, ввиду отсутствия спин-спинового взаимодействия, сигналы от метиновых протонов И и Нй появляются в [c.119]
Пожалуй, наиболее ранней попыткой обнаружить присутствие свободных радикалов таким способом было каталитическое превращение смесей орто- и параводорода. В равновесии при комнатной температуре обычный водород состоит из смеси 75% орто-Нг (ядерные спины параллельны) и 25% пара-И2 (ядерные спины антинараллельны). При низких температу- [c.98]
Появившийся в уравнении (X, 37) дополнительный член 1п а всегда включается в выражение для 5др он обусловлен явлением взаимодействия вращения молекулы и спина ядра (см. след. стр.). [c.338]
Существование и некоторые особенности инверсии циклогекса-нового кольца были по дтверждены экспериментально методом ПМР. Теоретически резонанс атомов е-Н и а-Н должен пооисходить в разных полях, и можно было бы ожидать появления двух разных линий химического сдвига, вероятно, с тонкой структурой за счет спин-спинового взаимодействия. На самом деле в соответствующей области ПМР-спектра циклогексана протону отвечает лишь одна линия. Это можно объяснить только очень быстрой инверсией кресловидной формы. Тогда каждый протон половину времени экваториален, а половину — аксиален, и все они дают один общий усредненный сигнал. Но при понижении температуры инверсия должна замедляться, и действительно при температуре около —100 °С наблюдаются уже две группы полос, отвечающих экваториальным и аксиальным протонам [62, 63]. При —66,7 °С полосы сливаются. Расчет на основании этих данных показал, что скорость инверсии циклогексана составляет 105 с- при —66,7°С [63]. [c.40]
Изучение С ЯМР спектров бис(л-кротилникельгалогенидов) показало, что электронная плотность неравномерно распределена между тремя атомами углерода л-аллильной группировки и умень-щается в ряду Сз > С1 > 2 [66]. Экранирование концевых атомов углерода, С) и Сз увеличивается в ряду транс-лигандов I коррелируется с большей лабильностью л-аллильного лиганда в иодсодержащем комплексе по сравнению с хлорсодержащим. Близкие значения констант спин-спинового взаимодействия Н- С атомов углерода Сь С2 и Сз в пределах 159— 165 Гц является прямым экспериментальным доказательством р -гибридизации аллильных атомов углерода. [c.109]
Это правило [47], известное как правило сохранения спина Вигнера, хоропю выполняется только для относительно легких атомов, в которых взаимодействия между электронным орбитальным движением и электронным спином не сильные. Однако экспериментальное доказательство пока в сильной степени противоречит этому. Так, было показано [48], что неупругие соударения нормального и возбужденного атомов Не, напрпмер Не (л1 Р) + Не (11 S) – Не (li.S)4-He (n D) имеют нормальный фактор частоты. Более подробно этот вопрос освещен в работе [40]. [c.229]
Избыток энергии возбужденных частиц идет на уиеличение энергии алектронов и энергии поступательного движения самих частиц, если частицы являются атомами. В остальных случаях, кроме того, увеличивается вращательная и колебательная энергия частиц. Во всех этих случаях существуют ограничения видов энергии и возможностей ее распределения между двумя продуктами реакции. Ограничения заключаются в следующем 1) сохраняется количество движения образующихся фрагментов, что определяет распределение энергии ностуиатбльного движения (обратно пропорционально массам), 2) сохраняется общий момент количества движения, а также его компоненты вдоль некоторых фиксированных осей , 3) сохраняется общий электронный момент количества движения и, наконец, 4) сохраняется электронный спин, хотя это последнее правило маловероятно для некоторых частиц, содержащих атомы с атомным номером выше 10. [c.342]
Экспериментальные результаты, полученные при изучении этой реакции, являются прямым доказательством того, что растущая полимерная цепь образует с переходным металлом л-аллильный комплекс. Постоянство константы спин-спинового взаимодействия /а г = 13Гц свидетельствует о сохранении на протяжении всего процесса полимеризации сын-конфигурации концевого звена растущей полимерной цепи, что хорошо соответствует транс-1,4-структуре звеньев образующихся полибутадиенов. [c.117]
Первые две стадии в этой схеме вполне возможны с энергетической точки зрения и правил спина. Кроме того, КОз является известным веществом, спектр которого изучался (Шумахер и Спренгер [137]), причем было найдено, что КОз является возможным промежуточным продуктом при образовании N205 по реакции Оз с N02 (или N0). Механизм этой очень быстрой реакции таков [c.354]
Подобные результаты были получены на таких полимерах, как акрилаты [153], которые относительно плохо растворимы в мономере. При очень низкой степени превращения (нанример, 2% для бутилакрилата) полимер может начать осаждаться из раствора в виде коллоидных гелей. Можно ожидать, что строение образующегося в этом случае полимера будет сильно-препятствовать диффузии больших радикалов. Эти полимеры имеют не простую прямую цепочку полимерные цепи связаны между собой в нескольких точках. Диены, например изопрен и бутадиен, наиболее склонны к образованию таких перекрестных связей, так как образующийся полимер содержит двойные связи. Сравнительно недавно Бенсон и Норс [154] показали, что, используя смешанные растворители и меняя таким образом вязкость в значительном интервале, можно наблюдать соответствующее изменение величины А)(, в то же время кр не изменяется. Нозаки [155] показал, что если достаточно долгое время подвергать фотолизу водную эмульсию винилового мономера для образования стабильных частиц, то этп последние будут содержать долгоживущие радикалы полимера, которые могут продолжать реагировать с мономером в течение 24 час и более . Гелеобразные частицы этилендиметилакрилата дают спектры парамагнитного резонанса, показывающие, что концентрация частиц с неспаренными спинами [157] достигает 10 — Эти образцы полностью стабильны в отсутствие Ог. [c.520]
У двухатомных молекул некоторых веш,еств имеются орто-и пара-модификации, отличаюш,иеся параллельным и антипарал-лельным расположением векторов ядерных спинов. Сочетание этих векторов с векторами враш,ения молекулы приводит по законам квантовой механики к выпадению части уровней вращения. Для двухатомных молекул, состоящих из одинаковых атомов. [c.339]
chem21.info
Слово СПИН – Что такое СПИН?
Слово спин английскими буквами(транслитом) – spin
Слово спин состоит из 4 букв: и н п с
Значения слова спин. Что такое спин?
Спин
СПИН (англ. spin, букв.-вращение), собств. момент кол-ва движения элементарной частицы (электрона, протона и т. п.). Имеет квантовую природу и не связан с к.-л. перемещениями частицы…
Химическая энциклопедия
СПИН (англ. spin, букв.-вращение), собств. момент кол-ва движения элементарной частицы (электрона, протона и т. п.). Имеет квантовую природу и не связан с к.-л. перемещениями частицы…
Химическая энциклопедия. – 1988
Спин (от англ. spin — вращаться, вертеться.), собственный момент количества движения элементарных частиц, имеющий квантовую природу и не связанный с перемещением частицы как целого.
БСЭ. — 1969—1978
Спина
Спина античный город на побережье Адриатического м. у юж. рукава устья р. Пад. Предполагается, что С. основан греками. Его портом пользовались этруски с 6 по 4 в. до н. э. В ходе раскопок 20 — 30-х гг. нашего века, продолж. в 50-х гг.
dictionary_of_ancient.academic.ru
Спина. Антич. город на побережье Адриатич. м. у юж. рукава устья р. Пад. Предполаг., что С. основан греками. Его портом пользов. этруски с 6 по 4 в. до н.э. В ходе раскопок 20 — 30-х гг. нашего века, продолж. в 50-х.
drevniy_mir.academic.ru
Топ-спин
Топ-спин (от англ. Top Spin) — в видах спорта, в которых играют ракетками, вид удара, при котором удар по мячу происходит снизу вверх, придавая сильное вращение в направлении удара.
ru.wikipedia.org
Топ-спин. Основное назначение этого удара — придание мячу сильнейшего верхнего или бокового вращения (в начале 50-х годов XX в. особенно активны в использовании этого удара, как уже отмечено, были японские игроки…
Настольный теннис. — 2005
Мышцы спины
Мышцы спины. Смотри также: Поверхностные мышцы спины первого слоя Поверхностные мышцы спины второго слоя Глубокие мышцы спины Фасции спины Мышцы спины располагаются в несколько слоев, поэтому их подразделяют на глубокие и поверхностные, которые…
Атлас анатомии человека. – 2011
Мышцы спины располагаются в несколько слоев, поэтому их подразделяют на глубокие и поверхностные, которые, в свою очередь, также располагаются в два слоя.
Атлас анатомии человека. — 2005
МЫШЦЫ СПИНЫ (mm. dorsi) — располагаются в несколько слоев, имеют разное происхождение, в связи с чем делятся на собственные (аутохтонные) и преместившиеся на спину с головы и верхних конечностей (гетерохтонные).
Словарь терминов и понятий по анатомии человека. – 1990
Фасции спины
Фасции спины. Смотри также: Мышцы спины Поверхностные мышцы спины первого слоя Поверхностные мышцы спины второго слоя Глубокие мышцы спины К фасциям спины относится грудопоясничная фасция (fascia thoracolumbalis) (рис. 101, 102, 103)…
Атлас анатомии человека. – 2011
Фасции спины К фасциям спины относится грудопоясничная фасция (fascia thoracolumbalis) (рис. 101, 102, 103), представляющая собой плотное фиброзное влагалище, в котором располагаются глубокие мышцы спины.
Атлас анатомии человека. — 2005
ФАСЦИИ СПИНЫ (fascia dorsi) — соединительно-тканные оболочки, покрывающие мышцы спины. Поверхностная фасция выражена слабо, покрывает трапециевидную и широчайшую мышцы.
Словарь терминов и понятий по анатомии человека. – 1990
Спин-спиновое взаимодействие
СПИН-СПИНОВОЕ ВЗАИМОДЕЙСТВИЕ, взаимод. спиновых магн, моментов электронов и (или) ядер. Спин-спиновое взаимодействие электронов обусловливает вклад в энергию квантовой системы (атом, молекула, кристалл), к-рому отвечает составляющая гамильтониана…
Химическая энциклопедия
СПИН-СПИНОВОЕ ВЗАИМОДЕЙСТВИЕ – магн. взаимодействие междуспиновыми магн. моментами электронов, атомных ядер, парамагн. атомов иионов. Энергия С.-с. в. зависит от взаимной ориентации спинов этих частиц.
Физическая энциклопедия. – 1988
Спин-спиновое взаимодействие, взаимодействие между спиновыми магнитными моментами микрочастиц (см. Спин). Это взаимодействие является релятивистским эффектом (оно содержит множитель 1/с², где с — скорость света).
БСЭ. — 1969—1978
Спин-орбитальное взаимодействие
СПИН-ОРБИТАЛЬНОЕ ВЗАИМОДЕЙСТВИЕ, взаимодействие между магн. моментами, связанными со спиновыми и орбитальными моментами кол-ва движения электронов и ядер в квантовой системе – атоме, молекуле, кристалле и т.п.
Химическая энциклопедия
Спин-орбитальное взаимодействие — в квантовой физике взаимодействие между движущейся частицей и её собственным магнитным моментом, известным как спин. Наиболее часто встречающимся примером такого взаимодействия является взаимодействие электрона…
ru.wikipedia.org
СПИН-ОРБИТАЛЬНОЕ ВЗАИМОДЕЙСТВИЕ , взаимодействие между магн. моментами, связанными со спиновыми и орбитальными моментами кол-ва движения электронов и ядер в квантовой системе – атоме, молекуле, кристалле и т. п.
Химическая энциклопедия. – 1988
Изотопический спин
Изотопи́ческий спин (изоспи́н) — одна из внутренних характеристик (квантовое число), определяющая число зарядовых состояний адронов. В частности, протон и нейтрон (общее наименование этих элементарных частиц — нуклоны)…
ru.wikipedia.org
ИЗОТОПИЧЕСКИЙ СПИН (изоспин, I), одна из внутр. хар-к (квант. чисел) адронов, определяющая число зарядовых состояний адрона (или число ч-ц n в изотопич. мультиплете): n=2I+1. (см. ИЗОТОПИЧЕСКАЯ ИНВАРИАНТНОСТЬ).
Физическая энциклопедия. – 1988
ИЗОТОПИЧЕСКИЙ СПИН (изотопспин, изоспин; I)- неаддитивное квантовое число, характеризующее адроны, существование к-рого обусловлено изотопической инвариантностью сильного взаимодействия; И. с. одинаков для совокупности адронов…
Физическая энциклопедия. – 1988
Глубокие мышцы спины
Глубокие мышцы спины. Смотри также: Мышцы спины Поверхностные мышцы спины первого слоя Поверхностные мышцы спины второго слоя Фасции спины Подзатылочные мышцы (mm. suboccipitales) при двустороннем сокращении наклоняют голову назад…
Атлас анатомии человека. – 2011
Глубокие мышцы спины Подзатылочные мышцы (mm. suboccipitales) при двустороннем сокращении наклоняют голову назад, а при одностороннем — назад и в сторону…
Атлас анатомии человека. — 2005
Широчайшая мышца спины
Широчайшая мышца спины (лат. musculus latissimus dorsi) — поверхностная мышца, занимающая всю нижнюю часть спины, верхние пучки в начальной части прикрыты трапециевидной мышцей.
ru.wikipedia.org
Широчайшая мышца спины. Широчайшая мышца спины, m. latissimus dorsi, плоская. Мышца залегает поверхностно в нижнем отделе спины, но ее верхние пучки в начальной части прикрыты трапециевидной мышцей.
Атлас анатомии человека. – 2011
Русский язык
Спин-орбита́льный.
Орфографический словарь. — 2004
Примеры употребления слова спин
Несмотря на большое количество могучих спин, закрывающих обзор, Линдегаард перевел снаряд в штангу и спас свою команду.
- спинор
- спинтарископ
- спинушка
- спин
- спин-вектор
- спиралевидный
- спиралеобразный
wordhelp.ru
Максимальный спин молекулы подняли до 60

A. Baniodeh et al./ NPJ Quantum materials, 2018
Химики синтезировали магнитную молекулу с рекордно высоким значением спина — 60. Это циклический кластер, содержащий 10 ионов железа и 10 ионов гадолиния. Свои магнитные свойства она проявляет при температуре около 3 кельвинов, пишут ученые в NPJ Quantum Materials.
Молекулярные магниты — один из классов материалов, которые предлагают использовать при создании наноустройств для записи и хранения информации. Пока такие молекулы работают лишь при очень низких температурах, поэтому чтобы эти соединения действительно можно было использовать в реальных устройствах, необходимо увеличивать температуру, при которой они все еще обладают магнитными свойствами. Другая интересная задача, связанная с магнитными молекулами — получение соединений, в которых основное энергетическое состояние обладает как можно большим спином. Как правило, молекулы с максимальным спином представляют из себя циклические кластеры, внутри которых с помощью органических лигандов удерживаются парамагнитные ионы 4f- и 3d-металлов.
Для отдельного иона максимальный спин составляет 7/2, но если ионы соединить в молекулярный кластер и согласовать их спины таким образом, чтобы они не компенсировали друг друга, а выстраивались в одну сторону, то максимальный спин одной молекулы можно значительно превосходить спин одного иона. До настоящего дня рекорд принадлежал комплексу, содержащему 19 ионов марганца смешанной степени окисления: Mn(II) и Mn(III). В основном энергетическом состоянии спин такого кластера составляет 83/2.
Группа химиков из Саудовской Аравии, Германии и Италии под руководством Юргена Шнака (Jürgen Schnack) из Билефельдского университета и Энни Пауэлл (Annie Powell) из Хаильского университета синтезировали молекулярный кластер, у которого спин в основном состоянии еще больше и составляет 60 (это в 120 раз больше спина отдельного электрона). Нужной магнитной молекулой оказался комплекс, содержащий ионы железа и гадолиния с формулой [Fe10Gd10(Me-tea)10(Me-teaH)10(NO3)10]·20MeCN, где Me-tea — органический лиганд со структурой третичного амина общего состава (C7H14O3N)3-.
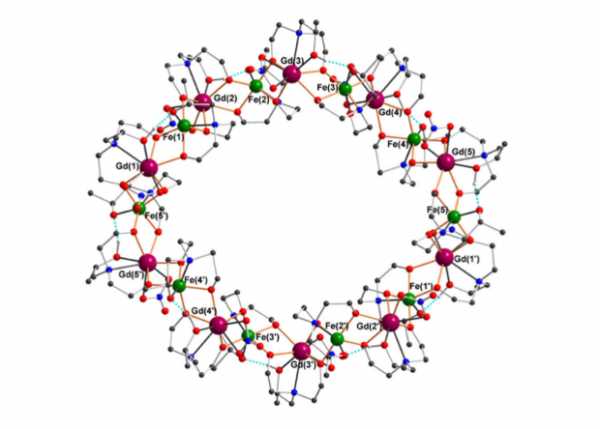
Химическая структура синтезированного кластера. Зеленым цветом обозначены ионы железа, фиолетовым — ионы гадолиния, красным — кислород, синим — азот, темно-серым — углерод, светло-серым — водород. Голубыми пунктирными линиями обозначены водородные связи
A. Baniodeh et al./ NPJ Quantum materials, 2018
Молекула имеет циклическую структуру в форме эллипса (с большим диаметром 28,4 ангстрема и малым диаметром 26,3 ангстрема). Ионы железа и гадолиния в молекуле связаны друг с другом через атомы кислорода, при этом ионы железа-III в молекуле имеют спин 5/2, а иона гадолиния-III — соответственно, 7/2.Добиться того, чтобы спины всех ионов были согласованы и ориентированы в нужном направлении, удается за счет системы обменных взаимодействий в молекуле, которые наблюдаются в парах Fe-Fe и Fe-Gd. Для двух этих пар обменная энергия отличается по модулю, а для пары ионов Gd-Gd — равна нулю. При комнатной температуре ионы между собой не взаимодействуют, и магнитные свойства наблюдаются только при температурах около 3 кельвинов, когда молекула переходит в нужное квантовое состояние.

Схема обменных связей в молекуле. Синим цветом обозначены ионы железа, красным — ионы гадолиния
A. Baniodeh et al./ NPJ Quantum materials, 2018
Ученые при этом отмечают, что квантовое состояние, при котором достигается необходимый магнитный момент, — очень неустойчивое, поэтому практически любое незначительное воздействие (повышение температуры или увеличение давления) может привести к переходу в несвязанное состояние.Основная сложность при использовании молекулярных магнитов в реальных устройствах состоит именно в том, что работают они только при очень низких температурах. Однако благодаря активным исследованиям в данной области максимальную температуру их работы удается постоянно увеличивать, и сейчас ее уже практически довели до температуры жидкого азота.
Александр Дубов
nplus1.ru

 ,
,











