Латинские названия химических элементов (Таблица)
По древней традиции, корни которой тянутся к средним векам, все химические элементы получали свои названия на латинском языке; эта традиция не нарушается и в наше время. В начале XIX столетия для химических элементов были предложены сокращенные буквенные обозначения, которыми служили или одна начальная буква латинских названий элементов, или, значительно чаще, две буквы, начальная и одна из последующих. Так образовались современные знаки (символы) химических элементов, получившие впоследствии международное признание.
Русские названия химических элементов в большинстве представляют собой их латинские названия с измененными окончаниями в соответствии с особенностями нашего языка. Но вместе с тем можно назвать много элементов, которые имеют на русском языке особые названия, отличные от латинских. Этими названиями служат или коренные русские слова, например железо (Fe), медь (Сu), ртуть (Hg), или перевод латинского названия элемента на русский язык, например водород (Н), кислород (О). Для того, чтобы в этих случаях можно было понять происхождение символов, следует сопоставить их с латинскими названиями соответствующих элементов, указанными в табл. 2-16.
Попутно в примечаниях к таблице указываются те особые названия и обозначения химических элементов, которые применяются в научной литературе ряда зарубежных стран.
Примечания к таблице:
1) Жансен и независимо от него Локьер в 1868 г. обнаружили в спектре солнца неизвестные до того времени линии; этот новый элемент был назван гелием, так как предполагалось, что он находится только на солнце. Через 27 лет Рамзаи и Клив обнаружили те же линии в спектре нового газа, полученного ими при анализе минерала клевеита; название гелий для этого элемента было сохранено.
2) Еще в конце XVIII в. было известно, что при действии серной кислоты на плавиковый шпат выделяется особая кислота, которая разъедает стекло. В 1810 г. Ампер показал, что эта кислота подобна соляной и является соединением с водородом некоторого неизвестного элемента, который он назвал фтором. В чистом виде фтор удалось получить Муассану только в 1886 г.
3) Окись магния была известна давно, ее исследовал Блэк еще в 1775 г. Деви в 1808 г. пытался получить металлический магний, но в чистом виде металл получить ему не удалось.
4) Двуокись титана была получена лабораторным путем еще в конце XVIII в., Берцелиус получал титан, но не вполне чистый. Более чистый металлический титан был получен Грегор, затем Муассаном.
5) Сернистые соединения мышьяка былп известны в древнее время.
6) В начале XIX в. была получена смесь ниобия и тантала, которая рассматривалась как новый элемент; ему было присвоено название колумбий. В Америке и Англии ниобий до сих пор носит название колумбий.
7) В виде окиси церий был получен в 1803 г.
8) Долгое время смесь празеодима и неодима считалась отдельным элементом, который назывался дидием (Di).
9) Как особый металл платина была описана в 1750 г.; до 1810 г. единственным местом добычи платины была Колумбия. Затем платина была найдена в других местах, в том числе на Урале, который до настоящего времени является наиболее богатым источником ее получения.
10) Двуокись урана, полученная впервые еще в 1789 г., была принята вначале за новый элемент. Металлический уран был получен впервые в 1842 г., его радиоактивные свойства были открыты только в 1896 г.
_______________
Источник информации: КРАТКИЙ ФИЗИКО-ТЕХНИЧЕСКИЙ СПРАВОЧНИК/ Том 1, – М.: 1960.
infotables.ru
Таблица химических элементов – Справочник химика 21
Таблица химических элементов
Из данных о строении ядра следует, что однозначным признаком химического элемента является заряд ядра 2, определяемый числом протонов в ядре и равный атомному номеру элемента в периодической таблице химических элементов Д. И. Менделеева. Относительные атомные массы элементов, приводимые в периодической таблице, представляют собой усредненные значения из отно- [c.28]
Кто из нас в студенческие годы или даже в зрелом возрасте не задумывался над тем, почему Таблица химических элементов Д. И. Менделеева не может вместить в себя лантаноиды и актиноиды Выходит, одни химические элементы для нее “сынки”, а другие — “пасынки” Нет, естественной ее можно назвать только с натяжкой.
Таблица химических элементов Л. Мейера [c.38]
Анализ первой таблицы химических элементов Д. И. Менделеева [c.52]
Тем временем поиски продолжались. В 1913 г. К. Фаянс и, независимо от него, Ф. Содди дали первую формулировку Правила радиоактивного смещения. Имеется в виду смещение в таблице химических элементов. Кроме того, К. Фаянс ввел термин “плеяда” для атомов одного и того же химического зле мента, а Ф. Содди предложил назвать их “изотопами”, (Его рука оказалась “легче” — термин “изотопы” неплохо устроился в научной терминологии). Хотя оба эти термина по объему смысла дублируют термин “вид атомов”. Так, ато-“мы подвида, под сфабрикованным названием “изотопы” все крепче привязывались к Таблице химических элементов, теряя свой суверенитет.
Хотя закон радиоактивных смещений рассматривается применительно к таблице химических элементов, по своей [c.98]
Нет возможности, да и нет смысла анализировать их в данной работе. Все они (круговые, мозаичные, пирамидальные, лестничные, радиальные, спиральные и др.) являются разными рекомбинациями все той же таблицы химических элементов Д. И. Менделеева. Эти изображения, как и таблица, не выходят за пределы плоских фигур и базируются все на тех же двух основаниях, которые использовал Д. И. Менделеев. Ни одна из них не вытекает как следствие из построения, все они являются плодами импровизации и фантазии.
ПЕРИОДИЧЕСКАЯ СИСТЕМА АТОМОВ КАК ОСНОВА ПОНИМАНИЯ ТАБЛИЦЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ В СВЕТЕ УЧЕНИЯ ОБ ИНДИВИДУАЛЬНЫХ, СПЕЦИФИЧЕСКИХ И ОБЩИХ ИХ ХАРАКТЕРИСТИКАХ [c.5]
Полудлинная форма таблицы химических элементов Л. Мейера [c.83]
Исследование таблицы химических элементов теперь почти завершено и маловероятно, чтобы был открыт совершенно новый элемент — металл с выдающимися свойствами. [c.217]
Современная таблица химических элементов составлена таким образом, что при переходе от какого-либо атома к следующему заряд увеличивается на единицу и к оболочке добавляется один электрон. Заряд ядра определяет порядковый номер элемента.
Чтобы уяснить причину замеченного сходства, обратимся к таблице химических элементов Менделеева, где [c.247]
В таблице химические элементы сгруппированы по максимальной чувствительности обнаруживания их в пробах. Для элементов, принадлежащих по чувствительности к разным группам, одинаковые почернения спектральных линий в баллах отвечают различному процентному содержанию. [c.135]
Какие же границы можно провести в периодической таблице химических элементов Какие имеются в таблице области, объединяющие наиболее близкие между собой химические элементы
В 1870 г. Д. И. Менделеев [26] предсказал возможность обнаружения в природе элемента с порядковым номером 87, который должен разместиться в периодической таблице химических элементов в первой группе 10-го ряда. Предсказанный для него атомный вес лежал в пределах 210—230. Элемент должен образовывать окисел МегО и быть аналогом цезия. Первое сообщение об открытии 87-го элемента появилось в 1925 г. [9]. Вплоть до 1937 г. многие исследователи пытались искать этот элемент в различных природных объектах минералах, золе сигар, сена и грибов, в свекловичной патоке, в морской и минеральных водах. Для этой цели применялись разные физические методы магнито-оптический [49], рентгеновские [74—76, 100, 101] и метод анализа катодных лучей [52]. Однако все эти работы не привели к убедительным доказательствам существования элемента 87 в природе впоследствии стала понятна причина этих неудач — элемент 87 не имеет ни стабильных, ни долгоживущих радиоактивных изотопов.
Открытие зависимости формы соединений от атомного веса и уточнение атомных весов элементов дали возможность Менделееву составить в 1870 г. новую таблицу химических элементов, названную м естественной системой элементов. [c.305]
Как показали исследования, различия между изотопами определяются числом нейтронов в ядрах атомов. Число нейтронов может изменяться на несколько единиц, тогда как число электронов, связанных с ядром, остается постоянным. Рассмотрим это на примере атома углерода. Атом углерода содержит 6 протонов и 6 нейтронов. Заряд ядра зависит от числа протонов и, следовательно, равен шести. Такой атом обозначим бС , где 6 порядковый номер в таблице химических элементов, а 12 — массовое число. Однако наряду с этим существует и другой углерод с порядковым номером 6, но имеющий в ядре 7 нейтронов — бС . Следовательно, заряд его остался прежним, а атомный вес увеличился на единицу (точнее — на массу одного нейтрона). Природный углерод представляет собой смесь двух изотопов бС и вС . В настоящее время искусственно получены изотопы бС> и бС”. Эти изотопы радиоактивны и неустойчивы. Период полураспада для бС равен 21 мин.
После открытия периодического закона таблица химических элементов пополнилась новыми элементами. Это были, во-первых, элементы, предсказанные Менделеевым (галлий, скандий, германий), некоторые редкоземельные элементы, предсказать которые было довольно трудно, и, наконец, инертные газы, о существовании которых в природе можно было только догадываться (Д. И. Менделеев, Н. А. Морозов), не подозревая, впрочем, о степени их инертности. [c.79]
Встреченная вначале недоверчиво большинством ученых периодическая система в 80-х годах прошлого столетия получила всеобщее признание. В этот период некоторые иностранные ученые (Лотар Мейер, Ньюлендс),не имея на то достаточных оснований,поставили вопрос о соавторстве в ее открытии. Не может быть, однако, никакого сомнения в приоритете Д. И. Менделеева. До него многие авторы пытались составлять таблицы химических элементов и объединять элементы в группы, но никто до Д. И. Менделеева не формулировал периодического закона. Точно так же никто до Д. И. Менделеева не дерзал на основании сопоставления свойств различных элементов исправлять атомные веса, а тем болое предугадывать существование и свойства еще не открытых э.лементов. [c.48]
Известно несколько вариантов кодовых таблиц химических элементов, в большинстве которых используется прямой код. Так, в инструкции РЖМ рекомендуется располагать элементы по алфавиту, связывая отверстия перфокарты с группами периодической системы элементов Д. И. Менделеева. При этом иногда кодируются не все элементы, например не фиксируются галогены. По системе размещения химических элементов, принятой РЖМ, элементы с близкими свойствами располагаются друг с другом, и для их кодирования неизбежно частное использование щелевого выреза, что неудобно в работе. [c.11]
VI групп, примыкающие к диагонали бор — астат,— типичные полупроводники (т. е. их электрическая проводимость с повышением температуры увеличивается, а не уменьшается). Характерная черта этих элементов — образование амфотерных гидроксидов (с. 151). Наиболее многочисленны d-металлы. В периодической таблице химических элементов Д. И. Менделеева они расположены между S- и р-элементами и получили название переходных металлов. У атомов d-элементов происходит достройка d-орбиталей. Каждое семейство состоит из десяти d-элементов. Известны четыре d-семейства 3d, 4d, 5d, и 6d. Кроме скандия и цинка, все переходные металлы могут иметь несколько степеней окисления. Максимально возможная степень окисления d-металлов +8 (у осмия, например, OsOj). С ростом порядкового номера максимальная степень окисления возрастает от III группы до первого элемента VIII группы, а затем убывает. Эти элементы — типичные металлы. Химия изоэлектронных соединений d-элементов весьма похожа. Элементы разных периодов с аналогичной электронной структурой d-слоев образуют побочные подгруппы периодической системы (например, медь — серебро — золото, цинк — кадмий — ртуть и т. п.). Самая характерная особенность d-элементов — исключительная способность к комплексообра-зованию. Этим они резко отличаются от непереходных элементов. Химию комплексных соединений часто называют химией переходных металлов. [c.141]
Об этом же говорит лингвистический анализ сложного греческого термина изотоп — одинаковоместный (“изос” — одинаковый, “топос” — место) [4, с. 261]. Конкретнее — одинаковоместный в таблице химических элементов, т. е. находящийся в одной клетке с другими атомами. А, как нам известно, каждая клетка таблицы закреплена за одним (конкретным) химическим элементом. И опять получается то же самое изотопы — это атомы одного химического элемента. (Братья — дети одной семьи). Зачем два названия одному и тому же понятию — вид атомов [c.84]
Попытки построения единой системы химических элементов вещества и антивещества были предприняты Е. И. Ахумо-вым. В 1962 г. в развитие его идей появляется статья [14], в которой приводится “расширенный вариант Периодической системы элементов Д. И. Менделеева, включающий атомы, составленные из античастиц”. Система состоит из двух зеркальных половин. Подход чисто формальный. По существу, вторая зеркальная половина общей системы химических элементов вещества и антивещества является симметричной только таблице химических элементов вещества, а не выражением физической симметрии строения атомов. Такое решение проблем не может быть научно убедительным, так как не раскрывает генетической сути перехода материи из вещества в антивещество и обратно. Но концептуально она верна. Генетическая же ее суть может быть понята только на уровне атомных переходов, на примере построения “сопряженных” систем атомов вещества и антивещества, что мы и видим на рис. 13. Квадранты I и II этой системы являются, по существу, единым “шахматным полем”, где действуют единые (сквозные) правила игры. [c.135]
Формально Д. Н. Трифонов признает, что взгляд на Периодическую систему, как на нечто законченное, глубоко ошибочен, ибо оказывается отражением слишком упрощенного понимания явления периодичности . Такое заявление автора можно было бы только приветствовать, если бы он сам следовал ему на деле. В действительности же, его вполне устраивает Периодическая таблица, надо только наглухо закрыть ее верхнюю границу . Такой вывод с определенностью вытекает из следующего заявления Д. Н. Трифонова … всю предшествующую историю системы можно рассмат-ривагь как цепь последовательных шагов, направленных на все более детальное упорядочение множества химических элементов. Менделеевский Опыт системы,.. был первым звеном в этой длинной цепи. На ее другом конце мы видим современную структуру системы . Автор однозначно определил свою позицию относительно другого конца — это таблица химических элементов. Он даже склонен канонизировать [c.167]
Таблица химических элементов была составлена Мейером в 1870 г. вслед за Менделеевым). По словам самого Мейера, эта таблица в существенном идентична данной Менделеевым [Семшин В. И. Периодическая система химических элементов Д. И. Менделеева. — М Наука, 1972, с. 40 Кемпбелл Дж. Современная общая химия. Т. 1. — М. Мир. 1975].- Прим. перев. [c.343]
К переходным элементам периодической таблицы химических элементов Д. И. Менделеева относят те из них, у которых заполняется предвнешняя й-оболочка. За исключением цинка, кадмия и ртути, все они имеют недостроенную -оболочку. Цинк, кадмий и ртуть относят к переходным элементам, поскольку они близки им по ряду свойств. Отличаются же они проявлением единственной степени окисления + 2 и в этом отношении похожи на з-элемен-ты — щелочноземельные металлы, с которыми они находятся в одной группе. Как отмечалось в предыдущей главе, переходные элементы побочной подгруппы III группы также имеют одну степень окисления +3. Все же остальные переходные элементы отличает разнообразие проявляемых степеней окисления, обилие окислительновосстановительных реакций, широкое изменение кислотно-основных свойств в соединениях. Наличие неспаренных й-электронов приводит к проявлению широкого круга магнитных, электрических и оптических свойств этих элементов. [c.154]
Автор указывает положение переходных металлов в соответствии с развернутой (длинной) формой периодической таблицы (табл. 5.1). В принятой таблице химических элементов Д. И. Менделеева (воспроизведенной иа форзаце книги) переходные металлы расположены иначе железо и платиновые металлы занимают правую часть таблицы (У1Пб группа), медь, цинк, галлий и родственные им металлы — левую часть, а титан, ванадий, хром и марганец со своими аналогами находятся в средней части (группы 1Уб, Уб, У1б, УИб). О природе переходных металлов см. также разд. 16.2. — Прим.. перев. [c.543]
От этого недостатка свободна так называемая укороченная периодическая таблица химических элементов. Она построена из неукороченной” таблицы с иГзъятием из нее лантаноидов и актиноидов и переносом концов восемнадцатиэлементных периодов (по восемь элементов) под начало этих же периодов. Таким образом, медь (Си), серебро (Ag) и золото (Аи) попадают под соответствующие щелочные элементы — медь под калий, серебро под рубидий и золото под цезий. Аналогично дело обстоит и с остальными перенесенными элементами. Поскольку до переноса они располагались в концах восемнадцатиэлементных периодов, то естественно, что они по своим свойствам отличаются от тех элементов, под которые попадают после переноса. Поэтому перенесенные элементы располагают не точно под теми элементами той группы, в которую они попадают, а несколько сбоку. Таким образом, возникают группы элементов, расположенных в вертикальных столбцах, и каждая группа состоит из двух подгрупп главной и побочной. Так, в первую группу попадают щелочные металлы и подгруппа меди (Си, Ад, Аи). Во вторую группу входят бериллий, магний и щелочноземельные металлы, а также элементы подгруппы цинка (2п, С(1, Hg), затем в третью группу — подгруппы бора (В, А1, Оа, 1п, Т1) и подгруппа скандия (5с, У, Ьа, Ас) и т. д. Совершенно естественно, что в седьмую группу попадают галогены (Р, С1, Вг, I, А1) и столь отличные от них по свойствам элементы подгруппы марганца (Мп, Тс, Ке). Особый интерес вызывает к себе восьмая группа. Очевидно, в нее должны входить инертные газы и элементы подгруппы железа (Ре, Ки, Об). Вне какой-либо группы остаются элементы кобальт и никель, родий и палладий, иридий и платина. Ранее считали, что железо, кобальт, никель и платиновые металлы (рутений, родий, палладий и осмий, ири- нй, платина) образуют восьмую группу, а инертные газы вы- [c.11]
Пример первого из них рассмотрен в работе Ю. Б. Ру-мера и А. И. Фета [11], едва ли не единственной в своем роде. В ней авторы приходят к таблице химических элементов, полученной без использования модели Резерфорда, из общих принципов симметрии, разработанных в теории адронов . Рассматривая атом как бесструктурную частицу (как бы не имеющую ядра и электронных оболочек) и применяя к нему общие принципы физики симметрии (кулоновское поле в развиваемую теорию входит неявно), Ю. Б. Румер и А. И. Фет показывают, что состояния такого бесструктурного атома должны изображаться векторами пространства, где определено некоторое представление группы Spin (4) . В результате математически очень сложного вывода получается модель, описывающая совокупность состояний бесструктурного атома , причем эта модель без сколь-либо заметных отклонений соответствует структуре периодической системы элементов. Чрезвычайно существенно, что исходным пунктом рассуждений является представление об атоме как [c.36]
chem21.info
Периодическая таблица химических элементов Википедия
Периодическая таблица химических элементовПериоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от их заряда атомного ядра. Система является графическим выражением периодического закона, открытого русским учёным Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от их атомного веса (в современных терминах, от атомной массы). Всего предложено несколько сотен[1] вариантов изображения периодической системы (аналитические кривые, таблицы, геометрические фигуры и т. п.). В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
История открытия[ | ]
К середине XIX века были открыты 63 химических элемента, и попытки найти закономерности в этом наборе предпринимались неоднократно. В 1829 году Дёберейнер опубликовал найденный им «закон триад»: атомная масса многих элементов близка к среднему арифметическому двух других элементов, близких к исходному по химическим свойствам (стронций, кальций и барий; хлор, бром и иод и др.). Первую попытку расположить элементы в порядке возрастания атомных весов предпринял Александр Эмиль Шанкуртуа (1862), который создал “Теллуров винт”, разместив элементы на винтовой линии и отметил частое циклическое повторение химических свойств по вертикали. Обе указанные модели не привлекли внимания научной общественности.
В 1866 году свой вариант периодической системы предложил химик и музыкант Джон Александр Ньюлендс, модель которого («закон октав») внешне немного напоминала менделеевскую, но была скомпрометирована настойчивыми попытками автора найти в таблице мистическую музыкальную гармонию. В этом же десятилетии появились ещё несколько попыток систематизации химических элементов; ближе всего к окончательному варианту подошёл Юлиус Лотар Мейер (1864). Однако главное отличие было в том, что за основу периодичности была взята валентность, которая не является единственной и постоянной для отдельно взятого элемента, в результате чего такая таблица не может претендовать на полноценное описание физики элементов и не отражала периодического закона.

ru-wiki.ru
Периодическая таблица химических элементов – новый взгляд. – Периодическая таблица химических элементов. – Шангин Юрий Александрович – Статьи

По-видимому, периодическому закону
будущее не грозит разрушением,
а только надстройка и развитее обещается.
Д. И. Менделеев.
Трактовка эксперимента – это дело вкуса.
Петр Капица.
Периодическая таблица химических элементов является общепринятым способом отображения Периодического закона. В литературе описано несколько сотен форм периодической таблицы. В том числе в виде пирамид, диаграмм, спиралей, различных объёмных фигур и др. Естественно, что во всех случаях используется один и тот же фактический материал, но изложенный в различных формах и сочетаниях. Элементы располагают в порядке возрастания заряда ядер их атомов, а химические свойства элементов обычно объясняют, базируясь на строении электронных оболочек атомов и распределении в них валентных электронов.
Целью всех этих работ является стремление создать таблицу такой формы, в которой расположение элементов позволяло бы наиболее просто, доступно, а главное обоснованно видеть логику их размещения по группам и периодам. Ведь именно наглядность таблицы делает её убедительной и позволяет прогнозировать показатели новых, в том числе и пока неизвестных, элементов, базируясь на свойствах уже известных. В настоящее время чаще всего используется «Длиннопериодная форма периодической системы химических элементов», утверждённая в 1989 г. Международным союзом теоретической и прикладной химии (IUPAC) в качестве основной, в которой все элементы поделены на 18 групп (табл. 1). В этом варианте компоновки таблицы лантаноиды и актиноиды вынесены из её «основной» части, и в виде «отдельной» таблички отнесены к третьей группе элементов. Автор использовал таблицу IUPAC в качестве базовой.
В данной статье предлагается ещё один вариант таблицы, в форме, которая, по мнению автора, более наглядна и обоснована, чем другие. По крайней мере, она наглядней тех вариантов, которые автор смог найти в литературе. Полезность предлагаемой таблицы заключается в том, что она позволяет прогнозировать строение валентных оболочек атомов малоизученных и даже пока ещё не синтезированных элементов более наглядно и обоснованно, чем существующие таблицы, а также уточняет расположение в таблице нескольких лантаноидов и актиноидов (табл. 2).
Статья написана, на основе данных взятых из литературы и электронных носителей информации [1- 14].
В современных периодических таблицах в качестве основного критерия, определяющего группу, в которой размещается элемент, являются его химические свойства и количество электронов, располагающихся на внешнем энергетическом уровне. Именно находящиеся на нем электроны обычно называют валентными, то есть электронами, определяющими поведение атома в химических реакциях. Электроны, находящиеся на внутренних оболочках, реже принимают во внимание. При этом исходят из того, что электроны внутренних оболочек имеют, большей частью, меньшую энергию, чем электроны внешней оболочки. Однако известно, что некоторые электроны внутренних оболочек с подуровней d и f могут иметь энергию большую, чем электроны подуровня s внешней оболочки, что делает их валентными.
В отличие от имеющихся в литературе периодических таблиц, предлагаемая таблица содержит, в качестве дополнительной информации, сведения о СУММАРНОМ количестве валентных электронов. К валентным электронам автор относит электроны находящиеся не только на верхнем энергетическом уровне, но и находящиеся на незавершенных внутренних слоях. Введение именно этого показателя позволило увидеть в таблице то, что без него заметить было сложно.

При составлении таблицы 2, автор обратил внимание на то, что СУММАРНОЕ количество валентных электронов на внешней оболочке атомов плюс валентных электронов на ближайших внутренних оболочках в атомах всегда равно либо номеру группы, в которой располагается элемент, либо номеру группы минус десять. Исключением являются инертные газы.
Лантаноиды, актиноиды и суперактиноиды по указанному признаку (суммарному числу валентных электронов) органично вписываются в соответствующие группы шестого и седьмого периодов предлагаемой таблицы, На этом основании они перенесены из дополнения к таблице в её основную часть.

Первые пять периодов предлагаемой таблицы полностью совпадают с длиннопериодной таблицей утвержденной IUPAC. Шестой и седьмой периоды предлагаемой таблицы увеличены и разделены на две части (А и В) каждый. Размер этих периодов увеличен для того, что бы в них могли разместиться лантаноиды и актиноиды. Кроме того, появился восьмой период для суперактиноидов.
Показатели элементов, находящихся в частях «В» шестого и седьмого периодов предлагаемой таблицы, по суммарному количеству валентных электронов и их расположению на внешних и на незавершенных внутренних электронных слоях атомов коррелируют с аналогичными показателями элементов предыдущих периодов, несмотря на то, что в таблицу введены лантаноиды и актиноиды.
Эти две группы элементов обычно располагают в виде отдельной таблички, помещаемой ниже «основной» части таблицы. Это обусловлено двойственностью их показателей. С одной стороны, если располагать лантаноиды и актиноиды в соответствии с величинами зарядов атомных ядер, они должны бы изначально находиться в «основной» части таблицы. С другой стороны, все лантаноиды имеют валентность 3+, а некоторые из них, кроме того, ещё 2+ или 4+, что не вписывается в общую логику существующей таблицы 1. Ну и, кроме того, в «основной» части таблицы рекомендованной IUPAC для них попросту нет места. В результате их выделили в отдельную табличку, целиком относящуюся к третьей группе элементов.
У актиноидов разброс валентностей ещё больше, чем у лантаноидов, и они, по этому показателю, тоже не вписываются в «основную часть» периодической таблицы 1. Видимо поэтому, их также отнесли к третьей группе элементов.
Но, если в качестве одной из характеристик элементов рассматривать СУММАРНОЕ количество валентных электронов, то картина меняется. С учетом этого фактора, все лантаноиды и актиноиды логично укладываются в соответствующие группы увеличенных шестого и седьмого периодов.
Однако, этот же добавленный показатель суммарного количества валентных электронов делает необходимым по-другому разместить элементы внутри увеличившихся периодов, разделив их на две части. Первые 13 элементов лантаноидов и актиноидов размещаются в верхних частях периодов (А), а два оставшихся в нижних (В). При таком размещении, во всех группах периодической таблицы, у большей части элементов, включая лантаноиды и актиноиды, прослеживаются монотонные зависимости изменения конфигураций валентных оболочек.
Расстановка элементов в периодической таблице с учетом суммарного количества валентных электронов потребовала перемещения некоторых элементов в другие группы. В частности, иттербий (70) и нобелий (102) переместились из 16 группы во 2-ю, а лютеций (71) и лоуренсий (103) из 17 группы в третью.
Автор считает такое перемещение правомерным, потому что после перемещения этих элементов конфигурации их валентных оболочек стали логично вписываться в монотонные ряды изменения этого показателя внутри соответствующих групп (таблицы 3 и 4).

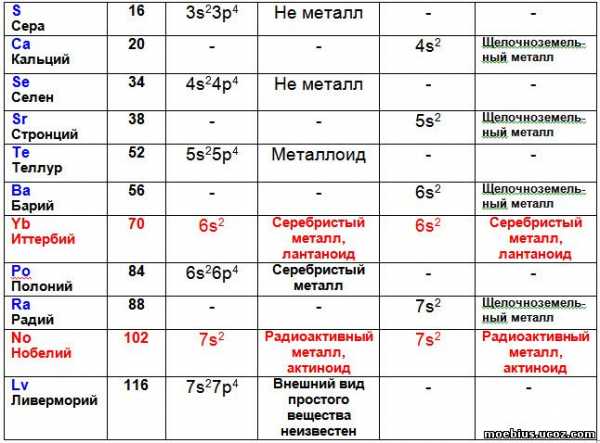
В таблице 3 видно, что иттербий и нобелий, судя по строению их валентных оболочек, должны располагаться не в 16, а во второй группе периодической системы. Возможно, что в последующем правомерность такого перемещения будет подтверждена, если будет установлено, что иттербий и нобелий имеют свойства щелочноземельных металлов.
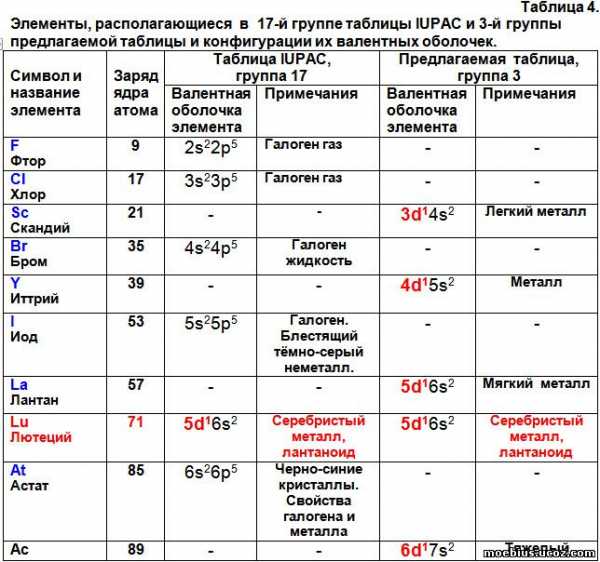
В таблице 4 видно, что лютеций и лоуренсий, судя по строению их валентных оболочек и химическим свойствам, не должны располагаться в 17-й группе периодической системы. А в третьей группе их расположение логично и обосновано.
После вышеуказанных перестановок элементов, в нижних частях (В) 6-го и 7-го периодов отсутствуют элементы первой группы, а в верхних частях (А) этих же периодов отсутствуют три последних элемента.
Вероятных причин этого может быть несколько. Во-первых, надо иметь в виду, что существующая сегодня модель строения атома, это – всего лишь «модель» такого сложного природного явления, каким является атом. Поэтому к существующей сегодня модели атома, вероятно, не следует относиться как к не подлежащей сомнению истине. Возможно также, что она прекрасно подходит для объяснения показателей элементов природного происхождения, но не полностью подходит для искусственно синтезированных и радиоактивных элементов.
Во- вторых, не исключено, что есть элементы, которые пока невозможно даже синтезировать в земных условиях, но которые, возможно, совершенно естественным образом существуют в условиях другой гравитации, давления, других магнитных полей и ещё каких- нибудь факторов, о которых мы даже не подозреваем.
В предлагаемой форме Периодической таблицы видно, что максимальное суммарное количество валентных электронов у большинства из известных химических элементов не превышает десяти. Исключениями являются 5 лантаноидов и 5 актиноидов. Вследствие этого, во всех периодах предлагаемой таблицы, кроме 6-А и 7-А, отсчет количества валентных электронов, начиная с 11 группы, снова начинается с единицы.
Предлагаемая таблица позволяет увидеть интересную связь между величинами зарядов ядер атомов элементов и суммарным количеством валентных электронов у них. Во всяком случае, автор не нашел в литературе описание таких зависимостей. У элементов, имеющих заряд ядра атома выражаемый четным числом, суммарное количество валентных электронов тоже всегда четное и равно либо номеру группы периодической системы, в которой располагаются элементы, либо номеру группы минус десять. Эти элементы всегда находятся в группах, имеющих четные номера.
У химических элементов, имеющих заряд ядра, выражаемый нечетным числом все вышеперечисленные признаки, выражаются нечетными цифрами. Вышесказанное относится также к лантаноидам, актиноидам и, по-видимому, к суперактиноидам.
Эти зависимости слишком многочисленны, что бы быть случайными. Не исключено также, что этот фактор (четный – нечетный) каким-то образом проявляется, например, на строении молекул веществ или комплексных соединений, в которые входят эти элементы. Можно так же предположить, что подобная связь между величинами зарядов ядер атомов элементов и суммарным количеством валентных электронов у них является одной из закономерностей строения атомов.
Если посмотреть, как изменяются конфигурации валентных оболочек элементов внутри групп, после того как в «основную» таблицу включили лантаноиды и актиноиды, то увидим следующее.
1) Конфигурации валентных оболочек всех элементов 1, 2, 3, 16, 17 и 18-й групп образуют правильные, монотонно изменяющиеся ряды.
Например, элементы второй группы – Иттербий (70 – лантаноид) и Нобелий (102 – актиноид) по строению валентных оболочек составляют общий ряд с Бериллием (4), Магнием (12), Кальцием (20), Стронцием (38), Барием (56) и Радием (88). На основании этого можно предположить, что когда будет получен элемент с зарядом ядра атома 120, то он будет иметь два валентных электрона, расположенных на орбитали 8s², потому что будет логическим продолжением этого ряда.
Аналогично, элементы третьей группы – Скандий (21), Иттрий (39), Лантан (57), Лютеций (71- лантаноид), Актиний (89) и Лоуренсий (103 – актиноид), по строению их валентных оболочек образуют один монотонно изменяющийся ряд. Литературные данные о строении валентной оболочки Лоуренсия противоречивы: в одном случае они указаны как 7s² 7p¹, а в другом – как 6d¹7s². Автор включил в предлагаемую периодическую таблицу второй вариант, поскольку он совпадает с логикой изменения валентных оболочек всех остальных элементов третьей группы новой таблицы. Можно предположить, что когда будет получен элемент с зарядом ядра атома 121 (суперактиноид), то он будет иметь три валентных электрона, расположенных на орбиталях 7d¹ 8s², потому что будет продолжением этого ряда.
2) Конфигурации валентных оболочек элементов 7, 11, 12, 13, 14, и 15-й групп образуют монотонно изменяющиеся ряды, за исключением лантаноидов и актиноидов. В 4-ой группе имеется только одно исключение – Церий (58 – лантаноид).
3) Конфигурации валентных оболочек элементов расположенных в 5, 6, 8, 9 и 10-ой группах, разделяются на несколько подгрупп.
3.1) Элементы пятой группы, по идентичности строения валентных оболочек, делятся на четыре подгруппы:
– Ванадий (23), Тантал (73) и Дубний (105).
– Ниобий (41).
– Празеодим (59 – лантаноид).
– Протактиний (91 – актиноид).
Вероятно, идентичную протактинию валентную оболочку будет иметь элемент 123 – Ubt (унбитрий).
3.2) Элементы шестой группы, по идентичности строения валентных оболочек, делятся на четыре подгруппы:
– Хром (24), и Молибден (42).
– Неодим (60 – лантаноид).
– Вольфрам (74) и Сиборгий (106).
– Уран (92 – актиноид).
Вероятно, идентичную урану валентную оболочку будет иметь элемент 124 – Ubg (унбиквадий).
3.3) Элементы восьмой группы, по идентичности строения валентных оболочек, делятся на три подгруппы:
– Железо (26), Осмий (76) и Хассий (108).
– Рутений (44).
– Самарий (62 – лантаноид) и Плутоний (94- актиноид).
Вероятно, идентичную самарию и плутонию валентную оболочку будет иметь элемент 126 – Ubh.
3.4) Элементы девятой группы, по идентичности строения валентных оболочек, делятся на три подгруппы:
– Кобальт (27), Иридий (77) и Мейтнерий (109).
– Европий (63 – лантаноид) и Америций (95 – актиноид).
Вероятно, идентичную европию и америцию конфигурацию валентной оболочки будет иметь элемент 127.
3.5) Элементы десятой группы, по идентичности строения их валентных оболочек, делятся на четыре подгруппы:
– Никель (28).
– Палладий (46).
– Платина (78) и Дармштадтий (110).
– Гадолиний (64 – лантаноид) и Кюрий (96 – актиноид).
Вероятно, идентичную гадолинию и кюрию валентную оболочку будет иметь элемент 128.
Таким образом, после перенесения лантаноидов и актиноидов в «основную» часть таблицы группы стали более полными, а часть добавленных элементов, по конфигурации своих валентных оболочек, логично вписалась в новую таблицу.
Однако в предлагаемой периодической таблице имеются области, где, как и во всех других вариантах периодических таблиц, горизонтальное направление расположения элементов более значимо и показательно, чем вертикальное. Это относится к пятому периоду таблицы, а также к верхним строкам 6-го и 7-го периодов, где располагается большая часть лантаноидов и актиноидов.
Картина изменения строения валентных оболочек элементов внутри периодов, после того как в «основную» таблицу включили лантаноиды и актиноиды, выглядит следующим образом.
Первые пять периодов остались без изменений. Шестой и седьмой периоды увеличились на 15 элементов каждый и стали занимать по две строки – «А» и «В». Восьмой период, условно, увеличен на 6 элементов.
Рассматривая периоды с точки зрения строения электронных оболочек составляющих их элементов, мы видим, что периоды 4, 5, 6-В и 7-В состоят из двух частей каждый. Одна часть (левая) включает элементы с первой по 10-ю группу, а вторая часть (правая) с 11 по 18-ю группу. Во всех этих периодах, элементы 1-й и 2-й групп имеют валентные электроны только на s– орбиталях внешнего энергетического слоя. У большинства элементов, находящихся в группах с 3-й по 10-ю, идет монотонное заполнение электронами d-орбитали ближайшего к наружному энергетического слоя.
Большинство элементов 11-й и 12-й групп имеют валентные электроны только на s– орбиталях внешнего энергетического слоя. С 13-й по 18-ю группу у большинства элементов идет монотонное заполнение электронами p– орбитали наружного энергетического слоя. Лантаноиды и актиноиды, находящиеся в периодах 6-В и 7-В также вписываются в эту схему строения валентных оболочек.
Электронные конфигурации атомов элементов входящих в периоды 6-А и 7-А значительно отличаются от выше рассмотренных. Количество валентных электронов, у них может достигать пятнадцати. Это обусловлено тем, что в валентные оболочки большинства из находящихся в них элементов вовлечены электроны с f– орбиталей внутренних слоев.
Валентные оболочки первых трех групп периода 6-А и четырех групп периода 7-А, такие же, как у соответствующих им элементов тех же групп периодов 6-В и 7-В. В эти группы входят как обычные элементы, так и лантаноиды и актиноиды. У всех последующих элементов этих периодов идет постепенное заполнение валентными электронами 4f– орбиталей в периоде 6-А и 5f– орбиталей в периоде 7А. Кроме того, у некоторых из элементов наряду с f– орбиталями, новые валентные электроны появляются и на d-орбиталях.
Возможно, валентные оболочки элементов периода 8-А, могут быть близки по своему строению к элементам тех же групп периодов 6-А и 7-А.
В пятом периоде имеется несколько элементов, конфигурации валентных оболочек которых не вписываются в ряды монотонно изменяющихся параметров электронных оболочек соответствующих групп. Это: Ниобий (41), Рутений (44), Родий (45) и Палладий (46). Указанные примеры ещё раз подтверждают давно известный факт, что общие закономерности периодической таблицы не являются абсолютными.
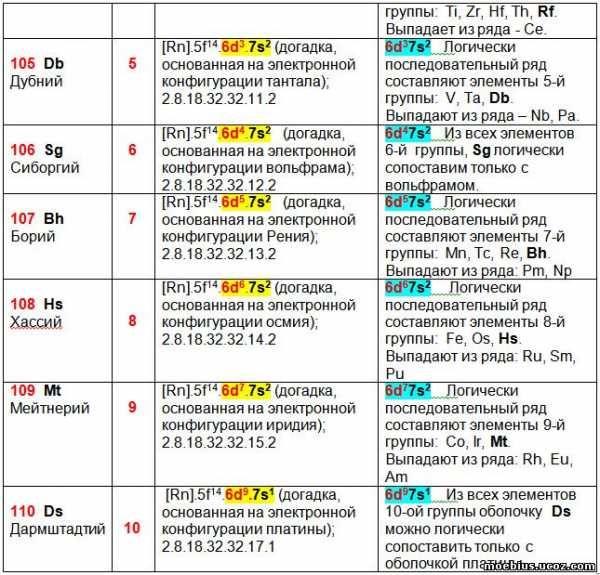
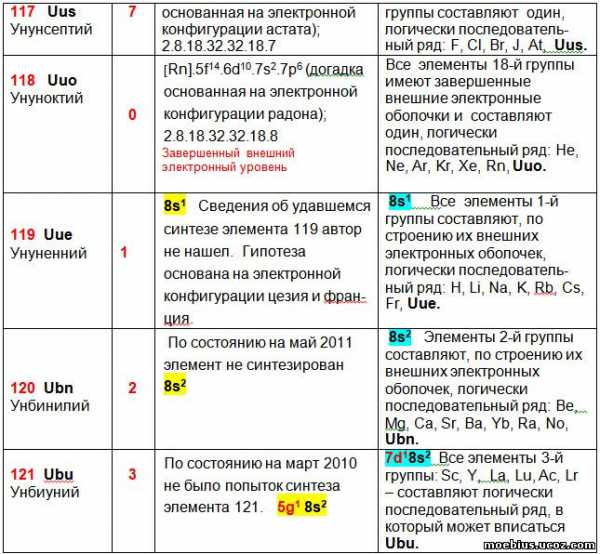
Считается, что реальная польза от любой формы периодической таблицы определяется возможностью её применения для прогнозирования каких-либо показателей новых элементов и уточнения показателей уже известных. С целью проверки возможности использования предлагаемой периодической таблицы для прогнозирования строения валентных оболочек новых элементов, построена таблица 5. В этой таблице сравниваются гипотетические варианты строения валентных оболочек имеющиеся в литературе с гипотетическими вариантами строения оболочек, получаемыми в соответствии с логикой предлагаемой новой таблицы.
В таблице 5 приведены прогнозируемые валентные оболочки малоизученных, искусственно синтезированных элементов. У некоторых из них, например, у Ха́ссия (Hs -108), Мейтнерия (Mt – 109) и Дармштадтия (Ds – 110) – неизвестен даже внешний вид простых веществ. Значительная часть элементов, например, Унбиуний (Ubu – 121), Унбитрий (Ubt – 123) и Унбипентий (Ubp – 125) пока не синтезирована.
Тем не менее, в литературе имеются гипотезы строения электронных оболочек этих элементов, которые приведены в столбце 3, таблицы 5. Все эти гипотезы базируются на использовании в качестве прототипов хорошо изученных элементов, относящихся к той же группе периодической системы, но имеющих меньший заряд ядра. При этом, в качестве прототипа использован только один элемент, находящийся в периоде предшествующем прогнозируемому элементу, как наиболее близкий ему по свойствам. Наглядно и просто сравнить электронную оболочку лантаноидов и актиноидов с другими элементами групп в которых они могут находиться, существующие периодические таблицы (в том числе и таблица IUPAC) не позволяют.
В столбце 4 таблицы 5 приведены гипотетические валентные оболочки атомов, прогнозируемые в соответствии с логикой предлагаемой в данной статье периодической таблицы.
Таблица 5
Сравнение гипотетических вариантов строения электронных оболочек атомов элементов, приведенные в литературе и следующие из логики предлагаемой периодической таблицы. В таблице рассматриваются элементы, показатели которых не считаются окончательно установленными.


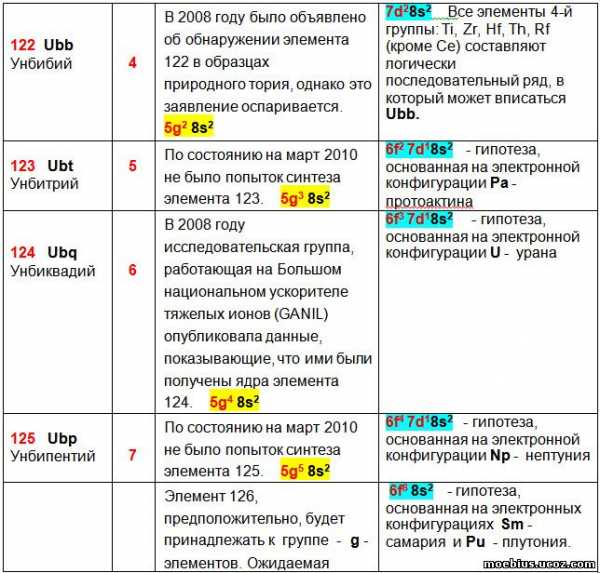
В таблице 5 видно, что с 103 по 120 элемент строение гипотетических электронных оболочек в столбцах 3 и 4 полностью совпадает.
Однако, этот одинаковый конечный результат достигнут разными способами. В столбце 4 строение гипотетических валентных оболочек новых элементов является логическим продолжением строения ВСЕХ других элементов группы (1, 2, 3, 16, 17 и18-я группы), или хотя бы нескольких элементов (4, 5, 7, 8, 9, 11, 12, 13, 14 и 15-я группы). По мнению автора, это является более наглядным и убедительным, чем использование в качестве прототипа всего одного элемента, как это сделано в столбце 3.
В столбце 4, исключением являются 6-я и 10-я группы. В 6-ой группе конфигурацию оболочки Sg (Сиборгий- 106) можно сравнить только с вольфрамом, а в 10-й группе аналогичную зависимость можно провести между Ds (Дармштадтий – 110) и платиной.
У элементов 121 – 126 гипотезы конфигураций валентных оболочек, приведенные в столбцах 3 и 4, отличаются. В обоих случаях внешние электронные оболочки всех этих элементов приходятся на орбитали 8s2. Однако гипотезы строения ближайших к ним внутренних орбиталей разные.
В столбце 3 гипотезы строения электронных оболочек построены на предположении, что элементы 121 – 126 будут принадлежать к новой группе – g-элементам. В этом случае, ожидаемая электронная конфигурация у них может быть [Uuo] 5g6 8s2, хотя из-за близости энергий, электроны, вероятно, смогут переходить с 5g-орбитали на 7d-орбиталь.
В столбце 4 гипотезы строения электронных оболочек элементов 121 – 126 рассматриваются как возможный вариант продолжения увеличения количества энергетических слоев у аналогичных элементов тех же групп, расположенных в периодической таблице выше них.
В Ы В О Д Ы.
1. Создан вариант периодической таблицы химических элементов, в котором ВСЕ элементы логично и обоснованно распределены по восемнадцати группам, в соответствии с СУММАРНЫМ количеством валентных электронов, находящихся как на верхнем, так и на незавершенных внутренних энергетических уровнях их атомов.
2. Установлено, что максимальное суммарное количество валентных электронов у любого из известных химических элементов не превышает пятнадцати. Численно оно равно либо номеру группы, в которой располагается элемент, либо номеру группы минус десять.
3. Показано, что лантаноиды и актиноиды по суммарному количеству валентных электронов, органично вписываются в соответствующие группы шестого и седьмого периодов предлагаемой периодической таблицы. На основании этого они перенесены из дополнения к таблице в её основную часть. Обновленные шестой и седьмой периоды увеличены и разделены на две части (А и В) каждый. Первые 13 элементов лантаноидов и актиноидов размещаются в верхних частях периодов (А), а два оставшихся элемента – в нижних (В).
4. Изменена расстановка некоторых элементов по группам с учетом суммарного количества валентных электронов. В результате четыре элемента: иттербий(70), лютеций(71), нобелий(102) и лоуренсий(103) – переместились из 16 и 17 групп во вторую и третью.
При этом конфигурации валентных оболочек перемещенных элементов логично вписались в монотонно изменяющиеся ряды этого показателя внутри соответствующих групп. Таким образом, предлагаемая таблица позволяет более обоснованно и логично распределить элементы по группам.
5. Установлено, что у элементов, имеющих заряд ядра атома выражаемый четным числом, суммарное количество валентных электронов всегда четное, а у элементов, имеющих заряд ядра атома выражаемый нечетным числом – нечетное.
6. Предлагаемая периодическая таблица обладает предсказательной силой. Она позволяет обоснованно и наглядно прогнозировать конфигурации электронных оболочек ещё не изученных и даже не синтезированных элементов. Спрогнозированные с её помощью гипотезы электронных оболочек элементов с зарядами ядер атомов от 103 до 120 совпадают с гипотезами других исследователей.
Литература и другие источники, использованные
при составлении таблицы.
1. Современная периодическая система элементов Д.И.Менделеева
2. Периодическая система химических элементов — Циклопедия
3. «Список химических элементов по электронной конфигурации» Электронные формулы атомов химических элементов
4. «Таблица валентностей элементов» Таблица валентностей химических элементов. DPVA.info …
5. Химическая энциклопедия в 5 томах. Изд. Советская Энциклопедия, под ред. д. х. н. Кнунянца, год изд.: 1988-1998, с. 3120.
6. Периодическая система элементов — Периодическая система химических…
7. / Раритетные издания / Популярная библиотека химических элементов
8. Интерактивная таблица Менделеева
9. Некрасов Б. В. Курс общей химии. М., Госхимиздат. 1952. – 997с.
10. Григорович В. К. Металлическая связь и структура металлов. М.: Наука, 1988. – 296 с.
11. Потапов К. И. Спиральные модели периодической системы. СПб.: 2011. – 79 с.
12. Потеряхин В.А. Система химических элементов (история и современные проблемы). Уфа: гос. издат. науч.- техн. литерат. «Реактив». 1999. – 216 с.
13. Корольков Д.В., Скоробогатов Г.А. Основы теоретической химии. М.: Академия, 2004. – 352 с.
14. Строганов А. И., Сенин А. В. Строение электронных оболочек атомов и периодическая система элементов Д.И. Менделеева. Учебное пособие. Челябинск: Южно – Урал. гос. универ. 1999. – 35 с.
Шангин Юрий Александрович,
Санкт- Петербург,
E-mail: [email protected]
01 июня 2014г.
moebius.ucoz.com
Периодическая система химических элементов Википедия
Периодическая таблица химических элементовПериоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от их заряда атомного ядра. Система является графическим выражением периодического закона, открытого русским учёным Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от их атомного веса (в современных терминах, от атомной массы). Всего предложено несколько сотен[1] вариантов изображения периодической системы (аналитические кривые, таблицы, геометрические фигуры и т. п.). В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
История открытия[ | ]
К середине XIX века были открыты 63 химических элемента, и попытки найти закономерности в этом наборе предпринимались неоднократно. В 1829 году Дёберейнер опубликовал найденный им «закон триад»: атомная масса многих элементов близка к среднему арифметическому двух других элементов, близких к исходному по химическим свойствам (стронций, кальций и барий; хлор, бром и иод и др.). Первую попытку расположить элементы в порядке возрастания атомных весов предпринял Александр Эмиль Шанкуртуа (1862), который создал “Теллуров винт”, разместив элементы на винтовой линии и отметил частое циклическое повторение химических свойств по вертикали. Обе указанные модели не привлекли внимания научной общественности.
В 1866 году свой вариант периодической системы предложил химик и музыкант Джон Александр Ньюлендс, модель которого («закон октав») внешне немного напоминала менделеевскую, но была скомпрометирована настойчивыми попытками автора найти в таблице мистическую музыкальную гармонию. В этом же десятилетии появились ещё несколько попыток систематизации химических элементов; ближе всего к окончательному варианту подошёл Юлиус Лотар Мейер (1864). Однако главное отличие было в том, что за основу периодичности была взята валентность, которая не является единственной и постоянной для отдельно взятого элемента, в результате чего такая таблица не может претендовать на полноценное описание физики элементов и не отражала периодического закона.

ru-wiki.ru
Периодическая система химических элементов | Virtual Laboratory Wiki
Периоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от массового числа атомов (или их атомной массы). Всего предложено несколько сот[1] вариантов изображения периодической системы (аналитических кривых, таблиц, геометрических фигур и т. п.). В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
История открытия Править
Д. И. Менделеев
По легенде, мысль о системе химических элементов пришла к Менделееву во сне, однако известно, что однажды на вопрос, как он открыл периодическую систему, учёный ответил: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово».
Написав на карточках основные свойства каждого элемента (их в то время было известно 63, из которых один — дидим Di — оказался в дальнейшем смесью двух вновь открытых элементов, празеодима и неодима), Менделеев начинает многократно переставлять эти карточки, составлять из них ряды сходных по свойствам элементов, сопоставлять ряды один с другим. Итогом работы стал отправленный в 1869 году в научные учреждения России и других стран первый вариант системы («Опыт системы элементов, основанной на их атомном весе и химическом сходстве»), в котором элементы были расставлены по девятнадцати горизонтальным рядам (рядам сходных элементов, ставших прообразами групп современной системы) и по шести вертикальным столбцам (прообразам будущих периодов). В 1870 году Менделеев в «Основах химии» публикует второй вариант системы («Естественную систему элементов»), имеющий более привычный нам вид: горизонтальные столбцы элементов-аналогов превратились в восемь вертикально расположенных групп; шесть вертикальных столбцов первого варианта превратились в периоды, начинавшиеся щелочным металлом и заканчивающиеся галогеном. Каждый период был разбит на два ряда; элементы разных вошедших в группу рядов образовали подгруппы.
Сущность открытия Менделеева заключалась в том, что с ростом атомной массы химических элементов их свойства меняются не монотонно, а периодически. После определённого количества разных по свойствам элементов, расположенных по возрастанию атомного веса, свойства начинают повторяться. Например, натрий похож на калий, фтор похож на хлор, а золото похоже на серебро и медь. Разумеется, свойства не повторяются в точности, к ним добавляются и изменения. Отличием работы Менделеева от работ его предшественников было то, что основ для классификации элементов у Менделеева была не одна, а две — атомная масса и химическое сходство. Для того, чтобы периодичность полностью соблюдалась, Менделеевым были предприняты очень смелые шаги: он исправил атомные массы некоторых элементов, несколько элементов разместил в своей системе вопреки принятым в то время представлениям об их сходстве с другими (например, таллий, считавшийся щелочным металлом, он поместил в третью группу согласно его фактической максимальной валентности), оставил в таблице пустые клетки, где должны были разместиться пока не открытые элементы. В 1871 году на основе этих работ Менделеев сформулировал Периодический закон.
Научная правдивость Периодического закона и естественность периодической системы получают подтверждение очень скоро: в 1875—1886 годах были открыты галлий (экаалюминий), скандий (экабор) и германий (экасилиций), для которых Менделеев, пользуясь периодической системой, предсказал не только возможность их существования, но и, с поразительной точностью, целый ряд физических и химических свойств.
В начале XX века с открытием строения атома было установлено, что периодичность изменения свойств элементов определяется не атомным весом, а зарядом ядра, равным атомному номеру и числу электронов, распределение которых по электронным оболочкам атома элемента определяет его химические свойства.
Дальнейшее развитие периодической системы связано с заполнением пустых клеток таблицы, в которые помещались всё новые и новые элементы: благородные газы, природные и искусственно полученные радиоактивные элементы. Седьмой период периодической системы до сих пор не завершён, проблема нижней границы таблицы Менделеева остаётся одной из важнейших в современной теоретической химии.
Структура периодической системы Править
Распространённее других являются 3 формы таблицы Менделеева: «короткая» (короткопериодная), «длинная» (длиннопериодная) и «сверхдлинная». В «сверхдлинном» варианте каждый период занимает ровно одну строчку. В «длинном» варианте лантаноиды и актиноиды вынесены из общей таблицы, делая её более компактной. В «короткой» форме записи, в дополнение к этому, четвёртый и последующие периоды занимают по 2 строчки; символы элементов главных и побочных подгрупп выравниваются относительно разных краёв клеток.
Ниже приведён длинный вариант (длиннопериодная форма), утверждённый Международным союзом теоретической и прикладной химии (IUPAC) в качестве основного.
Короткая форма таблицы, содержащая восемь групп элементов[3], была официально отменена ИЮПАК в 1989 году. Несмотря на рекомендацию использовать длинную форму, короткая форма продолжила приводиться в большом числе российских справочников и пособий и после этого времени. Из современной иностранной литературы короткая форма исключена полностью, вместо неё используется длинная форма. Такую ситуацию некоторые исследователи связывают в том числе с кажущейся рациональной компактностью короткой формы таблицы, а также с инерцией, стереотипностью мышления и невосприятием современной (международной) информации.[4]
В 1969 году Теодор Сиборг предложил расширенную периодическую таблицу элементов. Нильсом Бором разрабатывалась лестничная (пирамидальная) форма периодической системы. Существует и множество других, редко или вовсе не используемых, но весьма оригинальных, способов графического отображения Периодического закона.[5]
Значение периодической системы Править
Периодическая система Д. И. Менделеева стала важнейшей вехой в развитии атомно-молекулярного учения. Благодаря ей сложилось современное понятие о химическом элементе, были уточнены представления о простых веществах и соединениях.
Прогнозирующая роль периодической системы, показанная ещё самим Менделеевым, в XX веке проявилась в оценке химических свойств трансурановых элементов.
Появление периодической системы открыло новую, подлинно научную эру в истории химии и ряде смежных наук — взамен разрозненных сведений об элементах и соединениях появилась стройная система, на основе которой стало возможным обобщать, делать выводы, предвидеть.
- ↑ В книге В. М. Потапов, Г. Н. Хомченко «Химия», М. 1982 (стр. 26) утверждается, что их более 400.
- ↑ Элементы, номера которых указаны в скобках, синтезированы искусственно (элемент 117 ещё не синтезирован).
- ↑ Пример короткой формы таблицы.
- ↑ Р.С.Сайфуллин, А.Р.Сайфуллин, «Новая таблица Менделеева», Химия и жизнь, 2003, № 12, стр. 14—17. (В виде PDF-файла — 6,0 МБ — на сайте «Единой Коллекции цифровых образовательных ресурсов…».)
- ↑ Например, в 1997 году Б. Ф. Маховым была опубликована книга «Симметричная квантовая Периодическая система элементов», в которой границами горизонтальных рядов, периодов и диад служат элементы со спектральным термом 1s0. Координатами конкретного элемента в таблице принят набор из четырёх квантовых чисел. См. Б. Ф. Махов. Новая периодизация Периодической системы.
- Агафошин Н. П. Периодический закон и периодическая система элементов Д.И. Менделеева. — М.: Просвещение, 1973. — 208 с.
- Макареня А. А., Рысев Ю. В. Д. И. Менделеев. — М.: Просвещение, 1983. — 128 с.
- Макареня А. А., Трифонов Д. Н. Периодический закон Д.И. Менделеева. — М.: Просвещение, 1969. — 160 с.
- Eric R. Scerri. The Periodic Table: Its Story and Its Significance. — Нью-Йорк: Oxford Univercity Press, 2007. — 368 с. — ISBN 978-0-19-530573-9
Эта страница использует содержимое раздела Википедии на русском языке. Оригинальная статья находится по адресу: Периодическая система химических элементов. Список первоначальных авторов статьи можно посмотреть в истории правок. Эта статья так же, как и статья, размещённая в Википедии, доступна на условиях CC-BY-SA .
ru.vlab.wikia.com
