Образцы решения задач по химии.





ВНИМАНИЕ!!!
УЧАЩИЕСЯ 9 КЛАССОВ!!!
Для успешной сдачи экзамена по химии в некоторых билетах вам необходимо будет решить задачу. Предлагаем вам рассмотреть, разобрать и закрепить в памяти решение типовых задач по химии.
Задача на вычисление массовой доли вещества, находящегося в растворе.
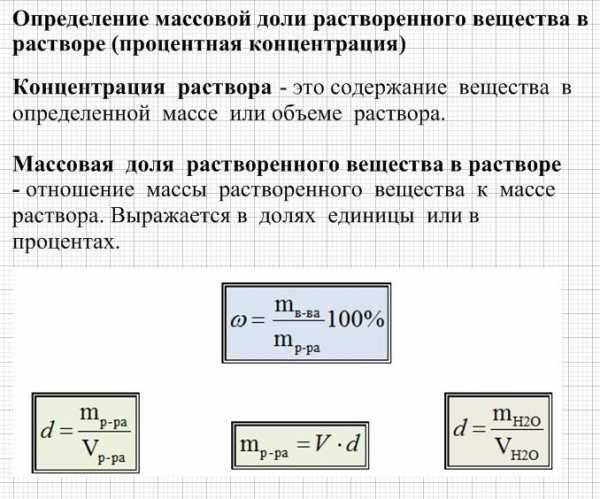
В 150 г воды растворили 50г фосфорной кислоты. Найдите массовую долю кислоты в полученном растворе.
Записываем известные величины в условие задачи.
Дано: m(h3O) = 150г, m(h4PO4) = 50г
А так же записываем, что нам необходимо найти в результате решения задачи.
Найти : w (h4PO4) – ?
Приступаем к решению задачи.
Решение: 1). Находим массу получившегося раствора. Для этого просто сложим массу воды и массу прилитой к ней фосфорной кислоты.
m(раствора) = 150г + 50 г = 200 г
2). Для решения нам необходимо знать формулу массовой доли. Записываем формулу массовой доли вещества в растворе.
w (вещества) = * 100%
Подставляем в формулу массу фосфорной кислоты из условия задачи и рассчитанную массу раствора. и производим математические подсчеты.
w (h4PO4) = * 100%= 25%
Записываем ответ.
Ответ: w (h4PO4) =25%
Задача на вычисление количества вещества одного из продуктов реакции, если известна масса исходного вещества.
Вычислите количество вещества железа, которое получится в результате взаимодействия водорода с 480г оксида железа(III).
Записываем известные величины в условие задачи.
Дано: m(Fe2O3) = 4
Так же записываем, что необходимо найти в результате решения задачи.
Найти : n (Fe) – ?
Приступаем к решению задачи.
Решение: 1). Для решения подобных задач сперва нужно записать уравнение реакции, описанной в условии задачи.
2). Затем запишем формулу количества вещества.
n = , где n- количество вещества, m – масса этого вещества, а M – молярная масса вещества.
По условию задачи нам не известна масса получившегося железа, т. е. в формуле количества вещества нам неизвестны две величины. Поэтому мы будем искать количество вещества по количеству вещества оксида железа (III). Количества вещества железа и оксида железа(III) следующим отношением.
= ;где 2- стехиометрический коэффициент из уравнения реакции, стоящий перед железом, а 1 – коэффициент, стоящий перед оксидом железа(III).
отсюда n (Fe)= 2 n (Fe2O3)
3). Находим количество вещества оксида железа(III).
n (Fe2O3) = = 3 моль, где 480г – масса оксида железа (III), 160 – молярная масса оксида железа (III), которую мы вычисляем на основании относительных атомных масс железа и кислорода, а также учитывая количество этих атомов в оксиде железа (III): М(Fe2O3)= 2х 56 + 3х 16=112 + 48 = 160
4). Находим количество вещества железа, получившегося в ходе реакции.
n (Fe) = 2 : 3 моль = 6 моль
Запишем ответ.
Ответ: n (Fe) = 6 моль
Задача на вычисление объема полученного газа, если известна масса исходного вещества.
Какой объем водорода образуется при взаимодействии соляной кислоты с 54 г алюминия?
Записываем условие задачи.
Дано: m(Al) = 54г
А так же записываем, что нам необходимо найти в результате решения задачи.
Найти : V (h3) – ?
Приступаем к решению задачи.
Решение: 1) записываем уравнение реакции по условию задачи.
2 Al + 6 HCl 2 AlCl3 +3 h3
2). Запишем формулу объема вещества.
V = Vm *n, где V – объем вещества, Vm – молярный объем газа при нормальных условиях (н. у.) величина постоянная и равная 22, 4 *n – количество вещества данного газа.
V (Н2) = Vm * n (Н2)
3). Но в этой формуле нам неизвестно количество вещества водорода.
4). Найдем количество вещества водорода по количеству вещества алюминия по следующему соотношению.
= ; отсюда n (h3) = 3 n (Al): 2 , где 3 и 2 – стехиометрические коэффициенты, стоящие соответственно перед водородом и алюминием.
5). Найдем количество вещества алюминия по формуле количества вещества n =
n (Al) =
n (Al) = = 2 моль
6). А теперь высчитаем получившееся в ходе реакции количество вещества водорода по формуле n (h3) = 3 n (Al).
n (h3) = 3 х 2= 6 моль
7). Найдем полученный объем водорода по формуле V (Н2) = Vm * n (Н2)
V (Н2) =22, 4 * 6 моль= 134 ,4 л
Запишем ответ.
Ответ: V (Н2) =134 ,4 л
Задача на вычисление количества вещества (или объема) газа, необходимого для реакции с определенным количеством вещества (или объемом) другого газа.
Какое количество вещества кислорода потребуется для взаимодействия с 8 моль водорода при нормальных условиях?
Запишем условия задачи.
Дано: n (h3) = 8моль
А так же запишем, что необходимо найти в результате решения задачи.
Найти : n(O2) – ?
Приступаем к решению задачи.
Решение: 1). Запишем уравнение реакции, следуя условию задачи.
2 h3 + О2 2 h3О
2). Количество вещества водорода и количество вещества кислорода связывает следующее соотношение :
= ; где 2 и 1 – стехиометрические коэффициенты, стоящие перед водородом и кислородом соответственно в уравнении реакции.
3). Отсюда 2 n (O2)= n (h3)
А количество вещества кислорода равно : n (O2)= n (h3):2
4). Нам остается подставить в полученную формулу данные из условия задачи.
n (О2) = 8моль :2 = 4 моль
5). Запишем ответ.
Ответ: n (О2) = 4 моль
infourok.ru
Научиться решать задачи по химии легко: следуем инструкции
от 01.01.2017 года
Настоящее пользовательское (лицензионное) соглашение (далее – “Соглашение”) заключается между Обществом с ограниченной ответственностью “АЛЕКТА” (далее – “Лицензиар”), и Пользователем (физическим лицом, выступающем в роли конечного потребителя Продукта) совместно именуемые “Стороны”.
Пожалуйста, внимательно ознакомьтесь с текстом настоящего Соглашения. Оно представляет собой публичную оферту и, после его принятия Вами, образует соглашение между Вами (Пользователем) и Лицензиаром о предмете и на условиях, изложенных в тексте Соглашения.
Принимая настоящее Соглашение, Вы соглашаетесь с положениями, принципами, а также соответствующими условиями лицензионного соглашения, изложенными ниже.
1. ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ
1.1. Программный продукт — экземпляры программы для ЭВМ “ХиШник”, состоящей
из Серверной части (свидетельство о государственной регистрации базы данных
№2014621526) и Клиентского приложения (свидетельство о государственной
регистрации программы для ЭВМ № 2014661592), права на использование которой
предоставляются в соответствии с настоящим Соглашением.
1.2. Серверная часть — часть Программного продукта, размещенная в сети Интернет и
используемая для хранения данных в базе данных Лицензиара под наименованием
“ХиШник” (далее также – “база данных”), а также для хранения, обработки,
передачи данных Пользователя между базой данных и клиентским приложением.
1.4. Пользовательское (лицензионное) соглашение – текст настоящего Соглашения со всеми дополнениями, изменениями, приложениями к нему, размещенный на сайте Лицензиара и доступный в сети интернет по адресу: http://www.hishnik-school.ru
прохождение регистрации и (или) авторизации на Сайте Лицензиара в установленном им порядке;
внесение платежа за предоставление права на использование Программного продукта;
начало использования Пользователем Программного продукта в любой иной форме.
1.7. Пользователь – физическое лицо, которое устанавливает на компьютер или мобильное устройство Клиентское приложение и использует его.
1.8. Неисключительная лицензия — лицензионный договор, предусматривающий предоставление права использования Программного продукта с сохранением за Лицензиаром права заключения лицензионного договора с другими лицами.
1.9. Роль – набор функций, которые доступны в Программном продукте Пользователю. Настоящим Соглашением предусмотрены следующие роли:
1.9.1. Администратор – сотрудник образовательного учреждения, осуществляющий регистрацию и предоставление доступа к Программному продукту Пользователям – участникам образовательного процесса в образовательном учреждении.
1.9.2. Преподаватель – сотрудник образовательного учреждения, организующий и осуществляющий образовательный процесс посредством использования функций Программного продукта.
1.9.3. Репетитор – преподаватель, дающий частные уроки, может проводить как индивидуальные, так и групповые занятия посредством использования функций Системы вне рамок Образовательного учреждения.
1.9.4. Учащийся – обучающийся в Образовательном учреждении и (или) вне его, получающий и проверяющий свои знания посредством Системы.
1.10. Профиль – запись в базе данных, содержащая идентифицирующие сведения о Пользователе и его роли.
1.11. Демонстрационный режим – режим использования Программного продукта для целей ознакомления с его функциональными возможностями.
1.12. Продуктивный режим – режим использования Программного продукта для целей применения в образовательном процессе.
1.13. Регистрационный ключ – набор цифр и букв, посредством которого Пользователь получает право использования Программного продукта в Продуктивном режиме с полным доступом к Серверной части.
1.14. Логин – уникальный идентификатор Пользователя в базе данных.
1.15. Пароль – набор цифр и букв, посредством которого и совместно с Логином Пользователь получает доступ в Клиентское приложение Программного продукта.
1.16. Интернет сайт Лицензиара – http://www.hishnik-school.ru.
1.17. Контент – все объекты, размещенные на Сайте и в Программном продукте, в том числе элементы дизайна, текст, графические изображения, иллюстрации, видео, скрипты, программы, музыка, звуки и другие объекты и их подборки.
2. ПРЕДМЕТ СОГЛАШЕНИЯ
2.1. Лицензиар предоставляет Пользователю право использования Программного продукта “ХиШник” на условиях простой (неисключительной) лицензии в пределах и способами, указанными в настоящем Соглашении, а Пользователь обязуется уплатить Лицензиару вознаграждение за предоставление права использования Программного продукта в соответствии с условиями настоящего Соглашения.
2.2. Лицензиар гарантирует, что он является правообладателем исключительных прав на Программный продукт и имеет права на заключение Соглашения. Лицензиару в настоящий момент в соответствии с тем знанием, которым он обладает, не известны права третьих лиц, нарушаемые данным Соглашением.
2.3. Пользователь не вправе полностью или частично предоставлять (передавать) права третьим лицам, полученные им по Соглашению, в том числе продавать, тиражировать, копировать Программный продукт, предоставлять доступ третьим лицам, отчуждать иным образом, в т.ч. безвозмездно, без получения на все вышеперечисленные действия предварительного письменного согласия Лицензиара.
2.4. Соглашение предоставляет Пользователю право использования Программного продукта с сохранением за Лицензиаром права выдачи лицензий другим лицам. Пользователь может использовать экземпляр Программного продукта только в пределах тех прав и теми способами, которые предусмотрены Соглашением. Предоставляемое Пользователю Лицензиаром право на использование Программного продукта действует в течение срока действия Соглашения.
2.5. Программный продукт “ХиШник”, состоящий из Серверной части и Клиентского приложения, представляет собой программу для ЭВМ, предназначенную для осуществления образовательного процесса.
2.6. Право использования Программного продукта (неисключительная лицензия), предоставляемое Пользователю в соответствии с настоящим Соглашением, включает право на использование Программного продукта в двух режимах:
2.6.1. Демонстрационный режим, ограниченный правом установки на компьютер или мобильное устройство, запуска, настройки Клиентского приложения и ограниченного доступа к Серверной части, для целей ознакомления с функциональными возможностями Программного продукта.
2.6.2. Продуктивный режим, ограниченный правом установки на компьютер или мобильное устройство, запуска, настройки Клиентского приложения и полного доступа к Серверной части, для целей применения Программного продукта в образовательном процессе.
2.7. Право использования Программного продукта предоставляется:
2.7.1. В демонстрационном режиме – с момента установки Клиентского приложения на компьютер или мобильное устройство.
2.7.2. В продуктивном режиме – с момента поступления денежных средств на счет Лицензиара.
2.8. Права на использование Программного продукта считаются предоставленными Пользователю:
2.8.1. В демонстрационном режиме – в момент установки Клиентского приложения на компьютер или мобильное устройство.
2.8.2. В продуктивном режиме – в момент направления Пользователю на электронную почту письма с регистрационным ключом.
2.9. Право использования Программного продукта предоставляется как на территории Российской Федерации, так и на территории всех иных стран мира, если не противоречит национальному законодательству этих стран.
2.10. Требования к компьютерам (оборудованию), необходимому для функционирования Клиентского приложения размещены в сети Интернет на сайте Лицензиара.
3. СТОИМОСТЬ И ПОРЯДОК ОПЛАТЫ
3.1. Размер вознаграждения Лицензиара за предоставление Пользователю прав на продуктивное использование Программного продукта размещен на Сайте Лицензиара.
3.2. Вознаграждение Лицензиара за предоставление прав продуктивного использования Программного продукта не облагаются НДС на основании подпункта 26 пункта 2 статьи 149 Налогового кодекса РФ.
3.3. Оплата предоставленных прав за продуктивное использование Программного продукта по настоящему Соглашению производится Пользователем в форме ежегодных платежей.
3.4. Способ оплаты по Соглашению: безналичное перечисление Пользователем денежных средств в валюте Российской Федерации (рубль) на расчетный счет Лицензиара способами, обозначенными на Сайте Лицензиара. При этом обязанность Пользователя в части оплаты вознаграждения по Соглашению считается исполненной со дня зачисления денежных средств банком на счет Лицензиара.
3.5. Лицензиар имеет право на одностороннее изменение условий и размера вознаграждения по настоящему Соглашению. Актуальный размер вознаграждения публикуется на Сайте Лицензиара.
4. СРОК ДЕЙСТВИЯ СОГЛАШЕНИЯ
4.1. Настоящее Соглашение вступает в силу с момента его заключения в соответствии с п.2.7.
4.2. Срок предоставления права продуктивного использования Программного продукта в соответствии с Соглашением составляет 1 (Один) год с момента авторизации Пользователя посредством Регистрационного ключа. Соглашение считается заключенным на тех же условиях на новый срок, равный 1 (Одному) году, при условии осуществления Пользователем полной оплаты за продление права продуктивного использования Программного продукта. Количество пролонгаций не ограничивается.
4.3. Предоставление права демонстрационного использования Программного продукта не ограничен по сроку.
4.4. Расторжение настоящего Соглашения возможно в соответствии с условиями, указанным в действующем законодательстве РФ.
5. ПРАВА И ОБЯЗАННОСТИ СТОРОН
5.1. Пользователь обязуется:
5.1.1. Соблюдать права Лицензиара на Программный продукт и не использовать Программный продукт иными способами кроме тех, что предусмотрены настоящим Соглашением.
5.1.2. Не предпринимать попыток получения исходного кода Программного продукта для дальнейшего его использования, а также не извлекать материалы базы данных.
5.1.3. Своевременно уплачивать Лицензиару вознаграждение за предоставление Пользователю права продуктивного использования Программного продукта в порядке и сроки, установленные настоящим Соглашением.
5.1.4. Указывать достоверную информацию, в том числе свой адрес электронной почты и иные данные, запрашиваемые Лицензиаром. При этом в случае указания Пользователем недостоверной информации, все возможные риски, которые могут возникнуть в связи с выполнением настоящего Соглашения, Пользователь принимает на себя.
5.1.5. Строго придерживаться и не нарушать условий Соглашения, а также обеспечить конфиденциальность коммерческой и технической информации Лицензиара.
5.1.6. Не устанавливать Программный продукт на компьютерах (оборудованиях), не соответствующих техническим требованиям для функционирования Программного продукта.
5.1.7. Заботиться о том, чтобы права Лицензиара на Программный продукт не были нарушены третьими лицами на территории действия настоящего Соглашения, и обязан сообщить Лицензиару обо всех ставших ему известными нарушениях.
5.2. Пользователь вправе:
5.2.1. Использовать Программный продукт только посредством установки (записи) Клиентского приложения Программного продукта на компьютер или мобильное устройство и его настройки для осуществления ознакомительного или образовательного процесса с помощью базы данных.
5.2.2. Использовать Программный продукт для любых целей Пользователя, за исключением ограничений, определенных Соглашением.
5.3. Лицензиар обязуется:
5.3.1. Обеспечить технические условия функционирования Серверной части и Клиентского приложения для использования Программного продукта Пользователем, в том числе обеспечить возможность получения и/или предоставить дистрибутив (установочные файлы) Клиентского приложения, с помощью которого осуществляется использование Программного продукта.
5.3.2. Защищать данные Пользователя, которые стали известны Лицензиару в связи с исполнением Сторонами своих обязательств в соответствии с настоящим Соглашением.
5.3.3. Уведомлять Пользователя о невозможности использования Программного продукта в связи с выполнением сервисных работ не менее чем за 48 (Сорок восемь) часов путем отправки сообщения на электронную почту, указанную при регистрации.
5.3.4. Воздерживаться от каких-либо действий, способных затруднить осуществление Пользователя предоставленного ему права использования Программного продукта в установленных Соглашением пределах.
5.3.5. Предоставлять новые версии (обновления) Программного продукта путем их размещения в сети Интернет на сайте Лицензиара либо в системе Google Play с возможностью скачивания.
5.3.6. Информировать Пользователя о новых версиях (обновлениях) Программного продукта, посредством направления уведомления на адрес электронной почты Пользователя, указанный при регистрации и (или) авторизации на Сайте Лицензиара.
5.3.7. Обеспечивать круглосуточный прием обращений в Службу поддержки по адресу электронной почты: [email protected].
5.3.8. Осуществлять обработку поступивших обращений и консультации через Службу поддержки, в период с 5:00 до 14:00 по московскому времени с понедельника по пятницу, за исключением выходных и праздничных дней.
5.4. Лицензиар вправе:
5.4.1. Производить сервисные работы, которые могут повлечь перерывы в работе Клиентского приложения.
5.4.2. В случае нарушения Пользователем условий (способов) использования прав на Программный продукт в соответствии с настоящим Соглашением, лишить Пользователя лицензии на использование прав на Программный продукт путем закрытия доступа к Программному продукту.
5.4.3. Изменять в одностороннем порядке условия настоящего Соглашения в установленном порядке.
5.4.4. Отказаться в одностороннем порядке от исполнения Соглашения в порядке, предусмотренном применимым правом и/или настоящим Соглашением;
5.4.5. Осуществлять иные права, предусмотренные применимым правом, а также настоящим Соглашением.
6. ПОРЯДОК ИСПОЛЬЗОВАНИЯ ПРОГРАММНОГО ПРОДУКТА
6.1. Пользователю для использования Программного продукта предлагается установить (записать в память ЭВМ) и запустить Клиентское приложение Лицензиара, экземпляр которого скачивается Пользователем самостоятельно одним из следующих способов:
в сети Интернет на сайте Лицензиара;
в системе Google Play;
с флэш-накопителя, предоставленного Лицензиаром (опция).
6.2. После установки (записи в память ЭВМ) и запуска Клиентского приложения Лицензиара Пользователю предоставляется право использования Программного продукта в Демонстрационном режиме.
6.3. Для использования Программного продукта в Продуктивном режиме Пользователю необходимо в Клиентском приложении ввести Регистрационный ключ, который Лицензиар направляет Пользователю на адрес электронной почты, указанный на Сайте Лицензиара в запросе на предоставление доступа. Пользователь самостоятельно осуществляет использование Программного продукта путем запуска и настройки Клиентского приложения.
6.4. Программный продукт предоставляется Пользователю по принципу “as is” (“как есть”), что подразумевает: Пользователю известны важнейшие функциональные свойства продукта, в отношении которого предоставляются права на использование, Пользователь несет риск соответствия Программного продукта его желаниям и потребностям, а также риск соответствия условий и объема предоставляемых прав своим желаниям и потребностям. Лицензиар не несет ответственность за какие-либо убытки или ущерб, независимо от причин их возникновения (включая особый, случайный или косвенный ущерб; убытки, связанные с недополученной прибылью, прерыванием коммерческой или производственной деятельности, утратой деловой информации, небрежностью, или какие-либо иные убытки), возникшие вследствие использования или невозможности использования Программного продукта.
6.5. Программный продукт предназначен для личных, образовательных и иных не связанных с осуществлением предпринимательской деятельности нужд физических лиц. Использование Программного продукта в коммерческих целях не допускается.
7. ОТВЕТСТВЕННОСТЬ СТОРОН
7.1. За невыполнение или ненадлежащее выполнение обязательств по настоящему Соглашению Стороны несут ответственность в соответствии с действующим законодательством, если иное не установлено Соглашением.
7.2. Стороны освобождаются от ответственности за неисполнение (ненадлежащее исполнение) Соглашения, если такое неисполнение (ненадлежащее исполнение) явилось следствием действий обстоятельств непреодолимой силы, наступление которых Стороны не могли предвидеть и предотвратить. Сторона, для которой надлежащее исполнение обязательства стало невозможным ввиду действия обстоятельств непреодолимой силы, обязана незамедлительно уведомить об этом другую Сторону. Стороны вправе ссылаться на действия обстоятельств непреодолимой силы лишь при условии, что они сделали все возможное в целях предотвращения и/или минимизации негативных последствий действия указанных обстоятельств.
7.3. Лицензиар не гарантирует абсолютную бесперебойность использования Программного продукта и не дает гарантию того, что произведенные третьими лицами программы для ЭВМ или любые другие средства, используемые при работе Программного продукта, абсолютно защищены от компьютерных вирусов и других вредоносных компонентов. Лицензиар обязуется осуществить все разумные меры для защиты информации Пользователя и обеспечения бесперебойного использования Программного продукта.
7.4. Пользователь самостоятельно отвечает за содержание информации, передаваемой им или иным лицом по сети Интернет и хранимой в памяти сервера Лицензиара, в том числе за ее достоверность и правомерность ее хранения и распространения.
7.5. В случае привлечения Лицензиара к ответственности или наложения на него взыскания в связи с допущенными Пользователем нарушениями прав третьих лиц, а равно установленных законодательством запретов или ограничений, Пользователь обязан в полном объеме возместить убытки Лицензиара.
7.6. В случае нарушения Пользователем условий и ограничений настоящего Соглашения, он является нарушителем исключительного права на Программный продукт. За нарушение авторских прав на Программный продукт Пользователь несет ответственность в соответствии с законодательством Российской Федерации.
7.7. Совокупная кумулятивная ответственность Лицензиара перед Пользователем в отношении требований любого рода, возникающих из настоящего Соглашения, не будет превышать сумму вознаграждения по данному Соглашению, фактически выплаченного Пользователем за Программный продукт, в отношении которого возникло требование, в течение 12 (двенадцати) месяцев, предшествующих возникновению требования. Вышеуказанные ограничения ответственности применяются даже в том случае, если с помощью вышеуказанного способа защиты права не удается добиться его основной цели.
8. ПЕРСОНАЛЬНЫЕ ДАННЫЕ
8.1. Информация, предоставленная Пользователем является конфиденциальной.
8.2. Предоставляя свои персональные данные Лицензиару, Пользователь соглашается на их обработку, как с использованием средств автоматизации, так и без использования средств автоматизации, в частности сбор, хранение, передачу третьим лицам и использование информации Лицензиаром в целях исполнения обязательств перед Пользователем в соответствии с настоящим Соглашением; получения Пользователем персонализированной рекламы; проверки, исследования и анализа данных, позволяющих поддерживать и улучшать Программный продукт.
8.3. Лицензиар обязуется не разглашать полученную от Пользователя информацию. Не считается нарушением предоставление Лицензиаром информации, в том числе персональные данные Пользователя третьим лицам, действующим на основании договора с Лицензиаром, в целях исполнения настоящего Соглашения.
8.4. Не считается нарушением обязательств по неразглашению информации предоставленной Пользователем, в том числе персональные данные Пользователя, в целях обеспечения соблюдения требований действующего законодательства Российской Федерации (в том числе в целях предупреждения и/или пресечения незаконных и/или противоправных действий Пользователей).
8.5. Пользователь не имеет права передавать свои Логин и Пароль третьим лицам.
8.6. Пользователь обязуется обеспечивать конфиденциальность своего Логина и Пароля и несет ответственность за использование Логина и Пароля третьими лицами. Ни при каких обстоятельствах Лицензиар не несет ответственность за использование третьими лицами Логина и пароля Пользователя.
8.7. В случае несанкционированного доступа к логину и паролю и/или персональной странице Пользователя, или распространения логина и пароля Пользователь обязан незамедлительно сообщить об этом Лицензиару посредством заполнения формы обратной связи, представленной на Сайте.
8.8. Лицензиар не несет ответственности за использование кем бы то ни было общедоступных персональных данных Пользователей.
9. ИСКЛЮЧИТЕЛЬНЫЕ ПРАВА НА КОНТЕНТ
9.1. Все объекты, размещенные на Сайте и в Программном продукте, в том числе элементы дизайна, текст, графические изображения, иллюстрации, видео, скрипты, программы, музыка, звуки и другие объекты и их подборки (далее — Контент), являются объектами исключительных прав Лицензиара, все права на эти объекты защищены.
9.2. Кроме случаев, установленных настоящим Соглашением, а также действующим законодательством Российской Федерации, Контент не может быть скопирован (воспроизведен), переработан, распространен, отображен во фрейме, опубликован, скачан, передан, продан или иным способом использован целиком или по частям без предварительного разрешения правообладателя, кроме случаев, когда правообладатель явным образом выразил свое согласие на свободное использование Контента любым лицом.
9.3. Использование Пользователем Контента, доступ к которому получен исключительно для личного некоммерческого использования, допускается при условии сохранения всех знаков авторства или других уведомлений об авторстве, сохранения имени автора в неизменном виде, сохранении произведения в неизменном виде.
9.4. Любое использование Контента, кроме разрешенного в настоящем Соглашении или в случае явно выраженного согласия правообладателя на такое использование, без предварительного письменного разрешения правообладателя, категорически запрещено.
10. ПРОЧИЕ УСЛОВИЯ
10.1. Все споры и разногласия, возникающие в связи с исполнением и (или) толкованием настоящего Соглашения, разрешаются Сторонами путем переговоров. При невозможности урегулирования Сторонами возникших разногласий путем переговоров, спор подлежит разрешению в арбитражном суде по месту нахождения ответчика с обязательным соблюдением претензионного порядка урегулирования споров и разногласий. Срок ответа на претензию 30 (тридцать) календарных дней с момента ее поступления в письменной форме или в электронном виде.
10.2. Ни одно из положений настоящего Соглашения не является и не может рассматриваться как передача (отчуждение) исключительных прав на интеллектуальную собственность Лицензиара.
10.3. В случае поступления от Пользователя замечаний к Программному продукту, предоставляемому в рамках настоящего Соглашения, такие замечания подлежат рассмотрению Лицензиаром по его желанию и необязательны для учета.
10.4. Условия настоящего Соглашения распространяются на последующие версии Программного продукта, которые являются его обновлениями. Заключения иных соглашений в отношении обновлений Программного продукта не требуется.
10.5. Во всем ином, что не предусмотрено настоящим Соглашением, Стороны руководствуются действующим законодательством РФ.
11. АДРЕС, РЕКВИЗИТЫ ЛИЦЕНЗИАРА
ООО “АЛЕКТА”
Юридический адрес: 630090, г. Новосибирск, Проспект академика Лаврентьева 2/2.
Почтовый адрес: 630090, г. Новосибирск, Проспект академика Лаврентьева 2/2.
ОГРН 1025403657135
ИНН 5408128408
КПП 540801001
ОКВЭД 72.19, 62.01, 62.02, 68.20.2;
ОКПО 26335100;
ОКАТО 50401384000;
ОКФС 16;
ОКОПФ 65.
Служба поддержки:
Телефон: +7 (383) 363-07-86
E-mail: [email protected]
www.hishnik-school.com
Глинка Н.Л. Задачи и упражнения по общей химии
Глинка Н.Л. Задачи и упражнения по общей химии. Учебное пособие для вузов / Под ред. В.А. Рабиновича и Х.М. Рубиной. – 23-е изд., исправленное – Л.: Химия, 1985. – 264 с., ил.
Глава I. ПРОСТЕЙШИЕ СТЕХИОМЕТРИЧЕСКИЕ РАСЧЕТЫ
1. Эквивалент. Закон эквивалентов
Задачи 1-27
2. Основные газовые законы
Задачи 28-40
3. Парциальное давление газа
Задачи 41-52
4. Моль. Закон Авогадро. Мольный объем газа
Задачи 53-79
5. Определение молекулярных масс веществ в газообразном состоянии
Задачи 80-98
6. Вывод химических формул. Расчеты по химическим формулам и уравнениям
Задачи 99-139
Глава II. ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Задачи 140-160
Задачи 161-174
Глава III. СТРОЕНИЕ АТОМА. РАДИОАКТИВНОСТЬ
1. Электронная структура атомов. Зависимость свойств элементов от строения их атомов
Задачи 175-205
2. Строение атомных ядер. Радиоактивность. Ядерные реакции
Задачи 206-227
Глава IV. ХИМИЧЕСКАЯ СВЯЗЬ
1. Типы химической связи. Способы образования ковалентной связи
Задачи 228-253
2. Полярность молекул. Геометрическая структура молекул
Задачи 254-267
3. Ионная связь. Поляризация ионов
Задачи 268-278
4. Водородная связь. Межмолекулярное взаимодействие
Задачи 279-282
Глава V. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
1. Энергетика химических реакций. Химико-термодинамические расчеты
Задачи 283-300
Задачи 301-324
2. Скорость химической реакции. Химическое равновесие
Задачи 325-360
Задачи 361-390
Глава VI. РАСТВОРЫ
1. Способы выражения содержания растворенного вещества в растворе. Растворимость
Задачи 391-457
2. Энергетические эффекты при образовании растворов
Задачи 458-462
3. Физико-химические свойства разбавленных растворов неэлектролитов
Задачи 463-501
Глава VII. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
1. Слабые электролиты. Константа и степень диссоциации
Задачи 502-528
2. Сильные электролиты. Активность ионов
Задачи 529-535
3. Ионное произведение воды. Водородный показатель
Задачи 536-558
4. Произведение растворимости
Задачи 559-579
5. Обменные реакции в растворах электролитов. Гидролиз солей
Задачи 580-607
Глава VIII. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. ОСНОВЫ ЭЛЕКТРОХИМИИ
1. Степень окисленности. Окисление и восстановление
Задачи 608-618
2. Окислители и восстановители
Задачи 619-623
3. Составление уравнений окислительно-восстановительных реакций
Задачи 624-631
Задачи 632-640
4. Эквиваленты окислителей и восстановителей
Задачи 641-649
5. Химические источники электрической энергии. Электродные потенциалы
Задачи 650-671
6. Направление протекания окислительно-восстановительных реакций
Задачи 672-685
7. Электролиз
Задачи 686-715
Глава IX. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
1. Определение состава комплексного иона
Задачи 716-722
2. Номенклатура комплексных соединений
Задачи 723-728
3. Равновесия в растворах комплексных соединений
Задачи 729-738
4. Магнитные и оптические свойства комплексных соединений. Пространственная структура комплексных соединений
Задачи 739-756
Глава X. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ. СПЛАВЫ
Задачи 757-768
Глава XI. ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ. СВОЙСТВА ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
1. Общие закономерности
Задачи 769-780
2. Водород
Задачи 781-807
3. Галогены
Задачи 808-833
4. Элементы подгруппы кислорода
Задачи 834-877
5. Элементы подгруппы азота
Задачи 878-911
Задачи 912-942
6. Углерод и кремний
Задачи 943-967
7. Металлы первой группы периодической системы
Задачи 968-1003
8. Металлы второй группы периодической системы. Жесткость воды
Задачи 1004-1043
9. Элементы третьей группы периодической системы
Задачи 1044-1067
10. Металлы четвертой, пятой, шестой и седьмой групп периодической системы
Задачи 1068-1088
Задачи 1089-1108
11. Благородные газы. Металлы восьмой группы
Задачи 1109-1139
reshchem.ucoz.ru
Методы решения задач по химии. Задачи на вывод химической формулы вещества
Разделы: Химия
С задачами на вывод химической формулы вещества учащиеся встречаются при прохождении программы химии с 8 по 11 классы. К тому же, данный тип задач довольно часто встречается в олимпиадных заданиях, контрольно – измерительных материалах ЕГЭ (части В и С). Диапазон сложности данных задач достаточно широк. Как показывает опыт, у школьников часто возникают затруднения уже на первых этапах решения при выводе молярной массы вещества.
В данной разработке предлагаются задачи на нахождение формулы вещества, исходя из разных параметров в условиях. В представленных задачах приведены различные способы нахождения молярной массы вещества. Задачи составлены таким образом, чтобы учащиеся могли освоить оптимальные методы и различные варианты решения. Наглядно демонстрируются наиболее общие приёмы решений. Для учащихся предлагаются решённые задачи по принципу нарастания сложности и задачи для самостоятельного решения.
Таблица 1
Вывод химической формулы вещества: |
Номер задачи |
Вычисление молярной массы вещества |
Задачи для самостоятельного решения |
– на основании массовых долей (%) атомов элементов |
1 |
M, где n – число атомов |
Определить химическую формулу соединения, имеющего состав: натрий – 27,06%; азот – 16,47 %; кислород – 57,47%. Ответ: NaNO3 |
– на основании массовых долей (%) атомов элементов и плотности соединения |
2 |
М (CхНу) = D(Н2) ·М (Н2) |
Относительная плотность паров органического кислородсодержащего соединения по кислороду равна 3, 125. Массовая доля углерода равна 72%, водорода – 12 %. Выведите молекулярную формулу этого соединения. Ответ:C6H12О |
– по плотности вещества в газообразном состоянии |
3 |
М (в-ва) = ρ · М (газообр. в-ва) |
Относительная плотность паров предельного альдегида по кислороду равна 1,8125. Выведите молекулярную формулу альдегида. Ответ: C3Н6О |
– на основании массовых долей (%) атомов элементов и массе соединения |
4 |
М находится по соотношению, |
Углеводород содержит 81,82 % углерода. Масса 1 л. этого углеводорода (н.у.) составляет 1,964 г. Найдите молекулярную формулу углеводорода. |
– по массе или объёму исходного вещества и продуктам горения |
5 |
М (в-ва)=Vm·ρ |
Относительная плотность паров кислородсодержащего органического соединения по гелию равна 25,5. При сжигании 15,3 г. этого вещества образовалось 20,16 л. СО2 и 18,9 г. Н2О. Выведите молекулярную формулу этого вещества.Ответ: C6H14О |
Приводится пример решения задачи № 6 на применение уравнения Менделеева – Клайперона
Задача № 1
Массовая доля кислорода в одноосновной аминокислоте равна 42,67%. Установите молекулярную формулу кислоты.
Дано: |
Решение: M кислоты = 75 (г/моль) |
Вывести формулу соединения |
Вернуться к табл.1
Задача № 2
Относительная плотность углеводорода по водороду, имеющего состав: w(С) = 85,7 %; w (Н) = 14,3 %, равна 21. Выведите молекулярную формулу углеводорода.
Дано: |
Решение:
М (CхНу)= 21 · 2 = 42
m (Н) = 42г. /100% · 14,3 %= 6 г. Ответ: истинная формула вещества C3Н6. |
Вывести формулу соединения |
Вернуться к табл.1
Задача № 3
Определите молекулярную формулу алкана, если известно, что его пары в 2,5 раза тяжелее аргона.
Дано: |
Решение: |
Вывести формулу алкана |
Вернуться к табл.1
Задача № 4
Массовая доля углерода в соединении равна 39,97 %, водорода 6, 73 %, кислорода 53,30 %. Масса 300 мл. (н.у.) этого соединения равна 2,41 г. Выведите молекулярную формулу этого вещества.
Дано: |
Решение: |
Вывести формулу соединения |
Вернуться к табл.1
Задача № 5
Какова молекулярная формула углеводорода, имеющего плотность 1,97 г/л, если при сгорании 4,4 г. его в кислороде образовалось 6,72 л. СО2 и 7,2 г. Н2О.
Дано: |
Решение: Составляем пропорции: |
Вывести формулу |
Вернуться к табл.1
Задача № 6
Соединение содержит 62,8% S и 37,2% F. Масса 118 мл данного соединения при 70 и 98,64 КПа равна 0,51 г. Вывести формулу соединения.
Дано: |
Решение:
n(S) : n(F) = 62,80/32 : 37,2/19 = 1,96 : 1,96 = 1 : 1
M= (0, 51 · 8,31 · 280)/(98,64 ·103·118 ·10-6) = =101,95 г/моль.
Следовательно, формула соединения S2 F2 Ответ: S2F2 |
Вывести формулу соединения |
Вернуться к табл.1
Поделиться страницей:xn--i1abbnckbmcl9fb.xn--p1ai
Основные типы расчетных задач по химии | Учеба-Легко.РФ
Основные типы расчетных задач по химии


Расчетные задачи делят на две категории:
– задачи, связанные с использованием формул веществ;
– расчеты по уравнениям реакций.
Среди задач первой категории в зависимости от искомой величины выделяют следующие типы.
- Вычисление массы вещества по его количеству и обратный расчет.
- Определение массовой доли элемента в веществе по его молекулярной массе и наоборот.
- Расчет объемов и объемных долей газов с использованием газовых законов (Авогадро, Бойля – Мариотта, Гей-Люссака, Менделеева – Клапейрона).
- Вывод формул соединений по количественному составу.
Задачи второй категории, как правило, основаны на применении закона сохранения массы вещества. Эти задачи также подразделяются на несколько типов.
- Задачи на вычисление количеств, масс и объемов исходных веществ по количеству, массе и объему продуктов реакции и обратные расчеты.
- Расчет количеств, масс и объемов продуктов реакции, если один из реагентов взят в избытке.
- Вычисления количеств, масс и объемов продуктов реакции, если один из реагентов содержит примеси.
- Задачи на определение выхода продукта реакции от теоретически возможного.
- Вычисления по уравнениям реакций, протекающих в растворах и требующих учета концентрации реагентов.
- Термохимические расчеты.
Элементы расчетов в перечисленных типах задач в различных сочетаниях используются при решении комбинированных задач, которые обычно предлагаются на выпускных и вступительных экзаменах, олимпиадах и конкурсах.
Лекция добавлена 15.11.2012 в 14:39:22
uclg.ru
Основные формулы для решения задач по химии
05-Авг-2012 | комментарий 381 | Лолита Окольнова
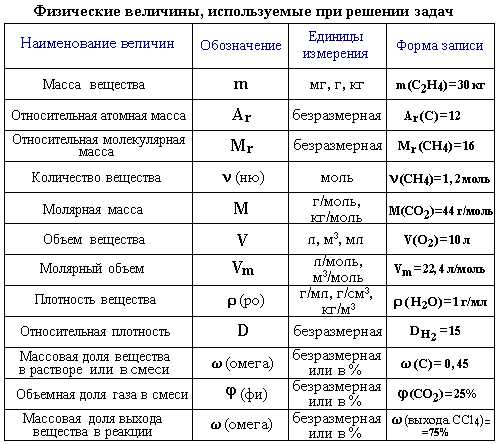
Все, все основные задачи по химии решаются с помощью
нескольких основных понятий и формул.
У всех веществ разная масса, плотность и объем. Кусочек металла одного элемента может весить во много раз больше, чем точно такого же размера кусочек другого металла.
Моль (количество моль)
обозначение: моль, международное: mol — единица измерения количества вещества. Соответствует количеству вещества, в котором содержится NA частиц (молекул, атомов, ионов)Поэтому была введена универсальная величина — количество моль. Часто встречающаяся фраза в задачах — «было получено… моль вещества»
NA = 6,02 · 1023
NA — число Авогадро. Тоже «число по договоренности». Сколько атомов содержится в стержне кончика карандаша? Порядка тысячи. Оперировать такими величинами не удобно. Поэтому химики и физики всего мира договорились — обозначим 6,02 · 1023 частиц (атомов, молекул, ионов) как 1 моль вещества.
1 моль = 6,02 · 1023 частиц
Это была первая из основных формул для решения задач.
Молярная масса вещества
Молярная масса вещества — это масса одного моль вещества.
Обозначается как Mr. Находится по таблице Менделеева — это просто сумма атомных масс вещества.
Например, нам дана серная кислота — H2SO4. Давайте посчитаем молярную массу вещества: атомная масса H =1, S-32, O-16.
Mr(H2SO4)=1•2+32+16•4=98 г\моль.
Вторая необходимая формула для решения задач —
формула массы вещества:
Т.е., чтобы найти массу вещества, необходимо знать количество моль (n), а молярную массу мы находим из Периодической системы.
Закон сохранения массы — масса веществ, вступивших в химическую реакцию, всегда равна массе образовавшихся веществ.
Если мы знаем массу (массы) веществ, вступивших в реакцию, мы можем найти массу (массы) продуктов этой реакции. И наоборот.
Третья формула для решения задач по химии —
объем вещества:
Откуда взялось число 22.4? Из закона Авогадро:
в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (н.у.) имеет один и тот же объём Vm = 22,413 996(39) л
Т.е., если в задаче нам даны нормальные условия, то, зная количество моль (n), мы можем найти объем вещества.
Итак, основные формулы для решения задач по химии
Число Авогадро NA
6,02 · 1023 частиц
Количество вещества n (моль)
n=m\Mr
n=V\22.4 (л\моль)
Масса веществаm (г)
m=n•Mr
Объем вещества V(л)
V=n•22.4 (л\моль)
или вот еще удобная табличка:

Это формулы. Часто для решения задач нужно сначала написать уравнение реакции и (обязательно!) расставить коэффициенты — их соотношение определяет соотношение молей в процессе.
_________________________________________________________________________________________________
Еще вам могут понадобиться:
- в ЕГЭ это вопрос А27
- А28
- задачи части С — 4 и 5
Категории: |
Обсуждение: “Основные формулы для решения задач по химии”
distant-lessons.ru
Химия 8 класс – задачи, уроки
Все уроки химии: 8 класс, 9 класс, 10 – 11 класс
1) Габриелян О.С. «Химия 8 класс» — уроки Вурдиханова В.Р.
2) Видео-уроки химии 8 класс (теория, практика, решение задач) — ютуб канал “День знаний”.
- Задачи по химии с решениями. 8 класс
- Задача 1. Определение числа молей и молекул в газе
- Задача 2. Определение относительной молекулярной массы нитробензола
- Задача 3. Определение количества вещества в сульфате натрия
- Задача 4. Определение числа молекул в капле воды
- Задача 5. Определение числа элементарных частиц
| Уроки химии 8 класс. Полный курс. По темам учебника «Химия. 8 класс» автора Габриелян О.С. Автор уроков Вурдиханов В.Р. | |
|---|---|
| ТЕМА УРОКА | ССЫЛКА НА УРОК |
| §1. Предмет химии. Вещества | >>>>>>>>>> |
| §2. Превращение веществ. Роль химии в нашей жизни | >>>>>>>>>> |
| §3. Краткий очерк истории развития химии | >>>>>>>>>> |
| §4. Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов. | >>>>>>>>>> |
| §5. Химические формулы. Относительная и молекeкулярная массы. | >>>>>>>>>> |
| §6. Основные сведения о строении атома. | >>>>>>>>>> |
| §7. Изменения в составе ядер химических элементов | >>>>>>>>>> |
| §8. Строение электронных оболочек атомов. | >>>>>>>>>> |
| §9. Изменение числа электронов на внешнем энергетическом уровне атомов химических элементов. | >>>>>>>>>> |
| §10. Взаимодействие атомов элементов между собой. Ковалентная неполярная связь. | >>>>>>>>>> |
| §11. Ковалентная полярная химическая связь. | >>>>>>>>>> |
| §12. Металлическая химическая связь. | >>>>>>>>>> |
| §13. Простые вещества. Металлы. | >>>>>>>>>> |
| §14. Простые вещества. Неметаллы. | >>>>>>>>>> |
| §15. Количество вещества. Моль. | >>>>>>>>>> |
| §16. Молярный объем газов. | >>>>>>>>>> |
| §17. Степени окисления. | >>>>>>>>>> |
| §18. Важнейшие классы бинарных соединений — оксиды. | >>>>>>>>>> |
| §19. Основания. | >>>>>>>>>> |
| §20. Кислоты. | >>>>>>>>>> |
| §21. Соли. | >>>>>>>>>> |
| §22. Кристаллические решетки. | >>>>>>>>>> |
| §23. Чистые вещества и смеси. | >>>>>>>>>> |
| §24. Массовая и объемная доли компонентов смеси. | >>>>>>>>>> |
| §25. Физические явления в химии. | >>>>>>>>>> |
| §26. Химические реакции. | >>>>>>>>>> |
| §27. Химические уравнения. | >>>>>>>>>> |
| §28. Расчеты по химическим уравнениям. | >>>>>>>>>> |
| §29. Реакции разложения. | >>>>>>>>>> |
| §30. Реакции соединения. | >>>>>>>>>> |
| §31. Реакции замещения. | >>>>>>>>>> |
| §32. Реакции обмена. | >>>>>>>>>> |
| §33. Типы химических реакций на примере свойств воды. | >>>>>>>>>> |
| §34. Растворение. Растворимость веществ в воде. | >>>>>>>>>> |
| §35. Электролитическая диссоциация. | >>>>>>>>>> |
| §36. Основные положения теории электролитической диссоциации. | >>>>>>>>>> |
| §37. Ионные уравнения. | >>>>>>>>>> |
| §38. Кислоты, их классификация и свойства. | >>>>>>>>>> |
| §39. Основания, их классификация и свойства. | >>>>>>>>>> |
| §40. Оксиды, их классификация и свойства. | >>>>>>>>>> |
| §41. Соли, их классификация и свойства. | >>>>>>>>>> |
| §42. Генетическая связь между классами веществ. | >>>>>>>>>> |
| §43. Окислительно-восстановительные реакции. | >>>>>>>>>> |
| Видео-уроки химии. 8 класс. Ютуб канал “День знаний”. | |
|---|---|
| ТЕМА УРОКА | ССЫЛКА НА УРОК |
| Периодическая система химических элементов Д.И.Менделеева. Учимся пользоваться. | >>>>>>>>>> |
| Валентность. Часть 1. Учимся определять валентность элементов по формулам. | >>>>>>>>>> |
| Валентность. Часть 2. Составляем формулы по валентности. | >>>>>>>>>> |
| Коэффициенты в уравнениях химических реакций. | >>>>>>>>>> |
| Моль. Молярная масса. Решение задач по химии. Часть 1. | >>>>>>>>>> |
| Моль. Молярная масса. Задачи по химии. Часть 2. | >>>>>>>>>> |
| Степень окисления. Учимся определять степень окисления по формулам. | >>>>>>>>>> |
| Массовая доля. Расчеты по химическим формулам. Задачи по химии. | >>>>>>>>>> |
| Молярный объем газов. Решаем задачи на молярный объем. | >>>>>>>>>> |
| Строение и состав атома. Изотопы, изобары, нуклиды, нуклоны. | >>>>>>>>>> |
| Электронная оболочка атома. Квантовые числа. Электронные орбитали. | >>>>>>>>>> |
| Электронные формулы атомов (практика). Учимся составлять электронные формулы атомов. | >>>>>>>>>> |
| Решение цепочек превращений по химии. | >>>>>>>>>> |
| Виды химической связи: ионная, ковалентная полярная и неполярная, донорно-акцепторная. | >>>>>>>>>> |
| Водородная связь. Типы и свойства водородной связи. | >>>>>>>>>> |
| Химические уравнения. Как составлять химические уравнения. | >>>>>>>>>> |
| Учимся составлять формулы средних солей и давать им названия. Неорганика. | >>>>>>>>>> |
| Признаки химических реакций. Химические и физические явления. | >>>>>>>>>> |
| Химические свойства веществ. Общие представления. | >>>>>>>>>> |
| Оксиды. Классификация, номенклатура, физические свойства. | >>>>>>>>>> |
| Химические свойства основных и кислотных оксидов. | >>>>>>>>>> |
| Химические свойства амфотерных оксидов. Амфотерность. | >>>>>>>>>> |
| Классификация неорганических кислот. | >>>>>>>>>> |
| Химические свойства неорганических кислот. | >>>>>>>>>> |
| Классификация гидроксидов. Основания. Неорганическая химия. | >>>>>>>>>> |
| Химическая формула. Химический элемент. Вещество. Первоначальные понятия в химии. | >>>>>>>>>> |
| Как научиться решать задачи по химии. В чем особенность химических задач. | >>>>>>>>>> |
| Как определить причину непонимания химии и восполнить пробел в знаниях. | >>>>>>>>>> |
| Ряд активности металлов. Часть 1. Основные понятия и правила использования. | >>>>>>>>>> |
| Ряд активности металлов. Часть 2. Особенности строения и отличия от ПСХЭ Менделеева. | >>>>>>>>>> |
| Ряд активности металлов. Часть 3. Решение задач. | >>>>>>>>>> |
Поделитесь с друзьями:
zadachi-po-ximii.megapetroleum.ru
