Задания ЕГЭ по химии ЕГЭ с разбором. / Химия / ЕГЭ :: Бингоскул
За 2-3 месяца невозможно выучить (повторить, подтянуть) такую сложную дисциплину, как химия.
Изменений в КИМ ЕГЭ 2019 г. по химии нет.
Не откладывайте подготовку на потом.
- Приступив к разбору заданий сначала изучите теорию. Теория на сайте представлена для каждого задания в виде рекомендаций, что необходимо знать при выполнении задания. Кодификатор по химии направит в изучении основных тем и определяет какие знания и умения потребуются при выполнении заданий ЕГЭ по химии. Для успешной сдачи ЕГЭ по химии – теория важнее всего.
- Теорию нужно подкреплять практикой, постоянно решая задания. Так как большинство ошибок из-за того, что неправильно прочитал упражнение, не понял, что требуют в задаче. Чем чаще ты будешь решать тематические тесты, тем быстрее поймёшь структуру экзамена. Тренировочные задания разработанные на основе демоверсии от ФИПИ дают такую возможность решать и узнавать ответы. Но не спешите подглядывать. Сначала решите самостоятельно и посмотрите, сколько баллов набрали.
Баллы за каждое задание по химии
- 1 балл — за 1-6, 11-15, 19-21, 26-28 задания.
- 2 балла — 7-10, 16-18, 22-25, 30, 31.
- З балла — 35.
- 4 балла — 32, 34.
- 5 баллов — 33.
Всего: 60 баллов.
Структура экзаменационной работы состоит из двух блоков:
- Вопросы, предполагающие краткий ответ (в виде цифры или слова) – задания 1-29.
- Задачи с развернутыми ответами – задания 30-35.
На выполнение экзаменационной работы по химии отводится 3,5 часа (210 минут).
На экзамене будет три шпаргалки. И в них нужно разбираться
- Таблица Менделеева,
- Таблица растворимости,
- Ряд напряжения металлов.
Это 70% информации, которая поможет успешно сдать экзамен по химии. Остальные 30% – умение пользоваться представленными шпаргалками.
- Если хочешь получить больше 90 баллов, нужно тратить на химию очень много времени.
- Чтобы сдать успешно ЕГЭ по химии, нужно много решать: вариантов, тренировочных заданий, даже если они покажутся легкими и однотипными.
- Правильно распределять свои силы и не забывать об отдыхе.
Дерзайте, старайтесь и всё у вас получится!
bingoschool.ru
Задания ЕГЭ по химии по темам (по номерам заданий)
Задания ЕГЭ по темам (номерам задания).
- Первая часть (указывается только ответ, без решения)
1. Электронная конфигурация атома
2. Закономерности изменения химических свойств элементов. Характеристика элементов
3. Электроотрицательность, степень окисления и валентность химических элементов
4. Характеристики химических связей. Зависимость свойств веществ от их состава и строения
5. Классификация и номенклатура неорганических веществ
6. Химические свойства веществ
7. Свойства оснований, амфотерных гидроксидов, кислот и солей. Ионный обмен и диссоциация
8. Свойства неорганических веществ
9. Свойства неорганических веществ
10. Взаимосвязь неорганических веществ
11. Классификация и номенклатура органических веществ
12. Теория строения органических соединений. Типы связей в молекулах органических веществ. Изомеры. Гомологи
13. Свойства углеводородов. Получение углеводородов
14. Свойства кислородосодержащих соединений. Получение кислородосодержащих соединений
15. Свойства азотсодержащих органических соединений. Белки, жиры, углеводы
16. Характерные химические свойства углеводородов. Механизмы реакций
17. Свойства спиртов, альдегидов, кислот, сложных эфиров, фенола
18. Взаимосвязь углеводородов и кислородосодержащих органических соединений
19. Классификация химических реакций в неорганической и органической химии
20. Скорость реакции, ее зависимость от различных факторов
21. Реакции окислительно-восстановительные
22. Электролиз расплавов и растворов
23. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
24. Обратимые и необратимые химические реакции. Химическое равновесие
25. Качественные реакции органических и неорганических соединений
26. Химическая лаборатория. Химическая промышленность. Полимеры
27. Расчёты с использованием понятия «массовая доля вещества в растворе»
28. Расчеты объемных отношений газов при химической реакции. Тепловой эффект
29. Расчет массы или объёма вещества по параметрам одного из участвующих в реакции веществ
- Вторая часть (оформляется подробным решением на бланках ответов)
30. Окислительно-восстановительные реакции
31. Реакции ионного обмена
32. Взаимосвязь различных классов неорганических веществ: описание реакций
33. Взаимосвязь органических соединений
34. Расчеты массовой доли химического соединения в смеси
35. Нахождение молекулярной формулы вещества
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
www.yoursystemeducation.com
Задания ЕГЭ по химии тест » HimEge.ru
Чтобы пройти тест из типовых заданий ЕГЭ по химии, кликните на задание из списка.
Задания 1. Электронная конфигурация атома
Задания 2. Закономерности изменения химических свойств элементов и Общая характеристика металлов, переходных элементов и неметаллов
Задания 4. Характеристики ковалентной, ионной, металлической и водородной связей
Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
Задания 5. Классификация и номенклатура органических и неорганических веществ
Задания 6. Химические свойства простых веществ − металлов и неметаллов
Задания 7. Свойства оксидов
Задания 8. Свойства оснований, амфотерных гидроксидов и кислот
Свойства солей
Электролитическая диссоциация электролитов в водных растворах
Реакции ионного обмена
Задания 9. Взаимосвязь неорганических веществ
Задания 11. Свойства неорганических веществ
Задания 12. Классификация органических и неорганических соединений
Задания 13. Теория строения органических соединений
Задания 14. Свойства углеводородов
Задания 15. Свойства предельных одноатомных и многоатомных спиртов, фенола
Свойства альдегидов, сложных эфиров.
Основные способы получения углеводородов и кислородосодержащих соединений
Задания 16. Свойства азотсодержащих органических соединений. Белки, жиры, углеводы
Задания 17. Взаимосвязь углеводородов и кислородосодержащих органических соединений
Задания 18. Характерные химические свойства углеводородов
Задания 20. Классификация химических реакций в неорганической и органической химии
Задания 21. Скорость реакции, ее зависимость от различных факторов
Задания 22. Электролиз расплавов и растворов
Задания 23. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
Задания 24. Обратимые и необратимые химические реакции. Химическое равновесие
Задания 25. Качественные реакции на неорганические вещества и ионы. Качественные реакции органических соединений
Задания 26. Правила работы в лаборатории. Методы разделения смесей и очистки веществ. Качественные реакции
Задания 27. Вычисление массы/ массовой доли вещества в растворе
Задания 28. Расчеты объемных отношений газов при химических реакциях. Тепловой эффект химической реакции
Задания 29. Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ
Задания с развернутым ответом
Задания 30. Реакции окислительно-восстановительные.
Задания 31. Взаимосвязь различных классов неорганических веществ: составление реакций
Задания 32. Взаимосвязь органических соединений
Задания 33. Расчетные задачи на примеси, избыток-недостаток, выход от теоретически возможного, массовую долю растворенного вещества, массовую долю химического соединения в смеси
himege.ru
Задания по химии
Задания по химии- Смесь фторида натрия и хлорида натрия
- При термическом разложении метана
- Найдите молекулярную формулу
- Горение метана в кислороде
- Плотность 40%-ного раствора HNO3
- Смеси газов оксида углерода
- В 0,1 М растворе уксусной кислоты степень
- Какая из двух солей MgCl2 или ZnCl2
- Какая масса хромистого железняка
- Рассчитайте потенциал покоя
- Какое число ионов калия
- Какую массу 2,5-динитрофенола
- Напишите структурные формулы
- Найдите ошибки, допущенные
- Определить типы гибридизации
- Рассчитать количество тепла
- Из 3,31 г. нитрата металла
- Написать константу реакции
- Почему реакция PbCrO4 + Na2SO4
- Масса анилина, полученного из
- Вычислите объем (н.у.) фосфина
- Составить последовательно уравнения
- При гидролизе какой соли
- Какие из попарно перечисленных
- Na2SiO3 напишите гидролиз
- В схеме химической реакции
- Определите объём углекислого
- Для получения сернистого газа
- На восстановление 240 г. оксида магния
- При электролизе раствора NaCl
- Какой объем газа выделится на аноде
- С какими веществами может реагировать
- Найдите объем водорода
- Рассчитать титр и нормальность
- Какой объем занимают 4 моль алюминия
- Определите массу одной молекулы
- Какова масса 10 моль воды
- Какое количество вещества содержится
- При обработке 15 г. технической
- Как подтвердить качественный состав
- Решить цепочку по химии
- Сколько потребуется бромида калия
- Сколько ионов образуется
- Какой объем раствора нитратной кислоты
- Вычислить массу осадка, полученного
- Написать уравнения диссоциации
- Рассчитать молярные доли глюкозы
- Написать уравнение в молекулярном виде
- Некоторое количество металла
- При восстановлении водородом
- Смешали два раствора гидроксида калия
- Углерод химическим количеством 6 моль
- Какую массу оксида марганца (IV)
- В некотором сплаве на 7 атомов меди
- Чему равна массовая доля азота
- Вычислите массу фенолята натрия
- Допишите уравнения практически
- С какими из перечисленных ниже веществ
- Предложите пять различных способов
- Предложите три различных способа
- 5,6 г КОН растворили в 10 л воды
- Составьте уравнения реакций
- Алкен имеет нормальное строение
- Определите pH 0,4%-ного раствора
- Какая масса фосфорной кислоты
- Записать уравнения в молекулярном
- Расставить коэффициенты с помощью
- Фосфор -> оксид фосфора
- KMnO4 + h3O + Na2SO3
- Написать молекулярные формулы
- Напишите уравнение реакций
- Вычислить молярную массу
- Имеется смесь Cu, C, Fe2O3 с молярным
- Из баллона со сжатым водородом
- В раствор, содержащий 14,64 г.
- Определить эквивалентные массы
- При растворении 8 г. CuSO4 в 192 г
- Стандартная энтальпия растворения
- Сравнить H реакций восстановления
- Дать характеристику фосфору
- Сколько мл 10%-ого раствора Na2CO3
- Уравняйте методом электронного баланса
- Расшифровать вещества x1, x2, x3
- Определить молярность раствора
- Вычислить процентную и моляльную
- X1 -> CaHPO4 -> Ca(h3PO4)2
- Рассчитайте молярную массу эквивалента
- При нагревании 20,06 г. металла
- Какой объем аммиака необходим
- В опытных условиях в результате
- При растворении 0,39 г сплава магния
- Массовая часть фосфора в одном
- Описать с позиций метода валентных
- Определить массу полученной соли
- Написать молекулярное, полное ионное
- Указать какие из перечисленных солей
- К 0,6 л. 6 %-го раствора серной кислоты
- Реакция протекает в растворе
- При 293 К реакция заканчивается
- Константа равновесия реакции
- В каком направлении будет
- Структурная формула соединения
- Даны вещества: вода, соляная кислота
- Напишите уравнения реакций
- Чем сходны и чем отличаются
- Какое количество вещества
- Спиртовой раствор этилацетата
- Составьте молекулярные и ионные
- Рассчитать молярные массы
- Используя метод электронного баланса
- Рассчитайте массу бензола
- Составьте электронный баланс
- Запишите процессы, происходящие
- Решить цепочку уравнений
- Составьте полное молекулярные
- Определите массу тетрахлорида углерода
- С помощью каких веществ можно
- Напишите диссоциацию гидросульфида
- Водород получен при взаимодействии
- В закрытом сосуде вместимостью
- В сосуде вместимостью X литров
- К 0,8 л раствора CaCl2
- К раствору содержащему 12,6 г
- Определите какой тип связи у MgCl2
- Составить структурную формулу пептида
- Каково соотношение между энтальпией
- Сколько граммов СuSO4*5h3O надо
- Уравнять методом электронного баланса
- На взаимодействие с 80 г. некоторого
- Исходя из констант диссоциации
- К 100 мл. крови для изменения pH
- Ионное уравнение гидроксида кальция
- Напишите формулы веществ
- При взаимодействии магния с серной
- Давление насыщенного пара
- Рассчитайте pH буферного раствора
- Составить уравнения в ионно
- К 0,01 М раствору h3SO4 медленно
- Как измениться pH если вдвое разбавить
- В 3,5 л насыщенного раствора иодата
- Вычислить объем углекислого газа
- Написать уравнения реакций в схеме
- Для нейтрализации 50 мл раствора
- Температурный коэффициент скорости
- Гидроксид Азота (V) + Гидроксид кальция
- При температуре 100 °С скорость первой
- Определите массу медного купороса
- В газовой фазе протекает обратимая
- Рассчитайте pH буферной смеси
- P = P2O5 = h4PO4 = K3PO4 = Ba3(PO4)2
- Составить ионно-молекулярные уравнения
- Написать уравнения реакций
- Рассчитать концентрацию сульфат ионов
- При взаимодействии 2,3 г натрия
- Вычислите массу хлора, содержащегося
- Решить цепочки химических реакций
- Газообразное вещество содержит 85,7%
- Фосфид кальция Ca3P2 реагирует
- Осуществить цепочку превращений
- Составьте структурные формулы
- Составьте молекулярные уравнения
- Укажите степень окисления всех
- Выведите формулы гидроксидов
- Составьте названия средних солей
- Этиловый спирт + конц. серная кислота
- Водный раствор с массовой долей спирта
- Раствор KIO3, в 500 см3 которого
- Две реакции при 283 К протекают
- Используя справочные данные
- Вычислить потенциал водородного
- Написать кинетическое уравнение
- Единица измерения скорости химической
- Во сколько раз увеличится скорость
- Рассчитать молярную концентрацию
- Как изменится при понижении
- Температура кипения диэтилового эфира
- К 300 мл раствора HCl с концентрацией
- Написать выражение константы
- К раствору Na2CO3 добавили следующие
- Равновесная концентрация первого
- Как изменится pH чистой воды
- Вычислить объем хлора, выделившегося
- Водород получен при взаимодействии
- Смешивают попарно растворы следующих
- Составить молекулярные и ионные
- Концентрация ионов железа в насыщенном
- Вычислить константы диссоциации
- В закрытом сосуде вместимостью 4 л
- В сосуде вместимостью 5 литров сожгли
- Выразите ионными уравнениями реакции
- Изобразите пространственную структуру
- арг-про-гли-фен
- Напишите уравнения реакций
- На реакцию 58,8 г смеси алюминия, меди
- Какой продукт будет преобладающим
- Осмотическое давление раствора
- Вычислить осмотическое давление
- Какова степень окисления серы
- Рассчитайте pH 0,025 М водного раствора
- Написать уравнения в молекулярной
- Склянку с 96% серной кислотой
- Какое количества электричества
- Какие из веществ могут проявлять
- На восстановление оксида метала массой
- Написать в молекулярной форме
- Энтальпия реакции сгорания глюкозы
- Изобразите пространственную структуру
- При расчёте pH слабого электролита
- S->h3S ->SO2->h3SO3->K2SO3
- Дать характеристику калию
- Рассчитайте энтальпию образования
- Напишите уравнения диссоциации электролитов
- Написать в молекулярной и ионно
- Внешний и предвнешний энергетические
- Составить молекулярные, полные
- Составьте молекулярные, полные
- Вычислите pH 0,01-молярного раствора
- Избытком хлороводородной кислоты
- Составьте ионные и молекулярные
- На нейтрализацию 0,943 г фосфористой
- Составьте молекулярные и ионно
- Запишите кинетические уравнения
- Определить давление насыщенного пара
- Вычислить pH и степень гидролиза соли
- Химический состав воздушно-сухой пробы
- Закончить уравнение реакции
- Определить температуру кипения
- Рассчитать константу, степень и pH
- Подберите коэффициенты ионно
- Вычислите молярную и нормальную
- Реакции выражаются приведенными
- Какие из ионов металлов могут проявлять
- Написать полные и сокращенные ионные
- Исходя из значений
- Как необходимо изменить температуру
- Составить координационную формулу
- При нагревании смеси кристаллической
- Вычислите процентную концентрацию
- Сколько литров 20%-ного раствора
- Смесь, содержащую нитрат натрия массой
- Укажите, какие из солей SnCl2, Na2SO4
- Укажите валентные энергетические
- Не производя вычислений, укажите
- Напишите уравнения реакции гидролиза
- Давление насыщенного пара
- Вычислить активность ионов Fe3+ и Сl-
- Рассчитать активность ионов Ca2+ и Сl-
- Вычислить ионную силу и активность
- Относительная молекулярная масса
- Имеется 0,5 кг раствора гидроксида калия
- Равновесие системы установилось
- В равновесии находится система
- Какую массу KMnO4 надо взять
- Доказать с помощью уравнений скоростей
- Определите химические элементы
- Составить молекулярные, ионные
- Написать уравнения реакций гидролиза
- При смешивании двух солей образуются
- При полном сгорании углеводорода
- Имеется бесцветное кристаллическое
- Используя метод электронного
- В каких соединениях проявляется
- С атомом и ионами каких элементов
- При сгорании 3,6 углеводорода
- Определить молекулярную формулу
- Какой объем оксида углерода (IV)
- Какой объем ацетилена можно получит
- Рассчитайте массу тетрахлорида
- С атомами каких элементов атом
- Пользуясь значениями относительных
- На сколько градусов повысится
- Кажущаяся степень диссоциации хлорида
- Описать с позиции метода ВС
- Рассчитать во сколько раз растворимость
- Какие углеводороды получатся
- В каком объеме 0,3 М раствора
- Вычислить процентную концентрацию
- Морская вода содержит 5% соли
- Напишите уравнения реакций с помощью
- C2H6 – C2h5 – C2h3
- По значениям стандартных энтальпий
- Смешали 0,15 моль HCl и 0,05 моль KOH
- Рассчитать концентрацию ионов К+ и А-
- Образуется ли осадок при смешении
- Приведите по три гомолога и назовите их
- Напишите по 3 уравнения реакций
- Напишите структурные формулы веществ
- Составить ионно-молекулярные
- Рассчитайте массу аммиака
- Рассчитать константу, степень и pH
- Что произойдет при сливании растворов
- Для нейтрализации 30 мл 0,1 н. раствора
- Вычислить массовую долю гидроксида
- Закончить уравнение реакции А
- Закончить уравнение реакции А
- Можно ли при стандартных условиях
- Хватит ли раствора массой 120 г
- Уравнять реакцию Hg2(NO3)2 + Fe(NO3)2
- Причины изучения скорости химической
- При растворении аммиака в воде
- Уравнять реакцию KMnO4 + Na2SO3 + h3O
- Составьте полные уравнения реакций
- Подберите коэффициенты в следующих
- Какие из приведенных реакций
- Указать, в каких из следующих реакций
- Где применяют ацетилен?
- Тепловой эффект реакции сгорания
- Три свинцовых пластины опустили
- Составьте схему, напишите уравнения
- Составьте схему работы гальванического
- Сколько граммов h3SO4 образуется около
- Вычислите изотонический коэффициент
- Закончить уравнение реакции и расставить
- Какие из инов металлов могут проявлять
- После растворения цемента массой
- Металл Au находится в контакте
- В 1 л раствора содержится 0,1 моль
- Вычислить произведение растворимости
- Выпадет ли осадок при смешивании равных
- Рассчитать pH насыщенного раствора
- Раствор питьевой соды используется
- Составить схемы двух ГЭ, в одном из
- Гальванический элемент составлен
- Докажите наличие сульфата кальция
- Не прибегая к другим реактивам
- При взаимодействии 1,3 г технического
- На сжигание гомолога бензола массой
- Составить ОВР
- Деталь из металла Cu соединена
- Составьте молекулярные и ионно
- Произведение растворимости CuSO3
- Металл Ag покрыт металлом Au
- Какие из указанных металлов Al, Sn, Ni
- Уравнения реакций гидролиза сульфида
- Уравнение химической реакции
- Сколько граммов нитрата калия следует
- Рассчитайте молярную концентрацию
- Рассчитать молярную массу эквивалента
- При сгорании 1,19 г металла образовалось
- Вычислить массу этиленгликоля
- Во сколько раз изменится скорость
- В какой из двух молекул преобладает
- Как метод валентных связей объясняет
- Запишите полную форму сокращенных
- Вычислите массовую долю
- Определить массу вещества
- При пропускании тока силой
- Определить время, необходимое
- Определить время, необходимое
- При электролизе водного раствора
- Раствор содержит ионы Fe+2, Cu+2, Bi+3
- Рассчитать при T = 298K и pH = 4
- В каком направлении будут перемещаться
- ЭДС элемента, состоящего из медного
- Вычислите изменение энтропии
- Написать уравнения электродных
- Определить массу чистого хрома
- Вычислить количество электричества
- Вычислите массу серной кислоты
- Навеску сплава, состоящего из меди
- Составить схемы электролиза и написать
- Составить электронные уравнения
- Пользуясь шкалой стандартных
- Составить схемы двух гальванических
- Написать электронно-ионные уравнения
- Почему алканы горят без образования
- Указать в каком направлении могут
- Рассчитайте массовые доли NaCl и KCl
- При восстановлении водородом смеси
- Какой объем раствора, содержащего NaCl
- При растворении 4.86 г неэлектролита
- Сколько мл 0,1 н раствора HNO3
- Определите молярную и нормальную
- Сколько граммов вещества нужно взять
- Кирпично-красные кристаллы розеосоли
- Указать внутреннею и внешние сферы
- Изменение энергии Гиббса для процесса
- Вычислить временную жесткость воды
- Сколько карбоната натрия надо прибавить
- Для умягчения водопроводной воды
- Напишите электронные формулы
- (Nh5)2U2O7 + 4HCl
- Европий проявляет степень окисления
- В 2 литрах воды растворили
- Степень ионизации муравьиной кислоты
- Электродный потенциал никелевого
- Какие процессы протекают на электродах
- Реакция протекает по уравнению
- Взаимодействие бериллия с водой
- Напишите уравнения реакций
- В каких из приведённых случаев
- Составьте электронную формулу
- Какую валентность и степень окисления
- Рассчитайте тепловой эффект реакции
- Напишите уравнения следующих реакций
- Реакция между газообразными веществами
- Составьте структурную формулу
- Напишите уравнение реакции бутанол-1
- При обработке 20 г. смеси меди
- Массовая доля углерода в алкане равна
- Для окислительно-восстановительных
- Составить уравнения реакций
- Координационную формулу комплексного
- Напишите ионное и молекулярное
- Реакции этилена с бромной водой
- При прокаливание 200 гр карбоната
- Ионно-молекулярное уравнение гидролиза
- 1-бром-2,2,2-трифтор-1-хлорэтана
- Вычислите эквивалент и эквивалентную
- Какая масса сульфида меди (II)
- Напишите уравнение реакции
- Рассчитайте молярную массу
- Графическая формула карбоната
- Во сколько раз концентрация ионов
- Из сочетания частиц Co3+, Nh4, NO2 и К+
- При какой температуре наступит
- Составьте по три молекулярных
- Эквивалентная масса трехвалентного
- Для 10 М раствора аммиака при 20
- Напишите выражение для константы
- В радиатор автомобиля налили 9 л воды
- К 200 мл раствора HCl с массовой долей
- В 200 мл воды растворили 0.6 г Ch4COOH
- Рассчитайте pH и pOH раствора
- Закончить уравнения и решить как ОВР
- Электронные формулы кремния и железа
- Найти значение константы скорости
- Описать с учетом 4 квантовых чисел
- Осуществите химические превращения
- Составить в молекулярном и ионном
- На восстановление 1,8 г оксида металла
- От чего зависит растворимость
- Составьте уравнения химических
- Химические превращения в указанной
- Молекулярные и ионные уравнения
- Определите дельта G в нулевой
- Через раствор, содержащий соли железа
- В 150 г воды растворили 11,2 г лития
- При постепенном прибавлении раствора
- Как изменится скорость этих реакций
- Используя метод валентных связей
- Рассчитать концентрацию ионов
- Температура кипения ацетона
- Определите массу
- Константа скорости реакции
- Вычислить концентрацию ионов
- Исходные концентрации оксида углерода
- Если комплескообразователями являются
- Реакция идет по уравнению
- Вычислите процентную, моляльную
- Написать выражение для константы
- Укажите формулы веществ
- Укажите формулы веществ, которые
- Сколько граммов кристаллогидрата
- Рассчитайте нормальную и моляльную
- При какой температуре замерзнет раствор
- Давление пара воды при 80С равно
- Какое количество электричества
- Составить молекулярное уравнение
- Получить гидрофосфат натрия
- С помощью каких реакций можно
- Вычислите массу гидроксида цинка
- При действии на 9 г. смеси, состоящей
- В реакцию с соляной кислотой вступило
- Имеется смесь Cu, C, FeO в отношении
- Указать продукты, образующиеся при
- Привести примеры комплексных
- Какой объем водорода выделится
- Cu – CuO – CuCl2 – Cu(OH)2 – CuO – CuSO4
- Имеется смесь кальция, оксида кальция
- Цинковую пластинку массой 80 г
- Смешали 50 г. раствора гидроксида
- Электролиз раствора K2SO4 проводили
- При термическом разложении 8,06 г смеси
- Вычислите равновесные концентрации
- Смесь медных и алюминиевых опилок
- При увеличении температуры
- В какую сторону при понижении давления
- Подберите коэффициенты
- При взаимодействии 6,3 г железа
- Вычислите pH и pOH раствора
- Укажите окислитель и восстановитель
- Оксид трехвалентного элемента
- В пропанол поместили металлический
- Составьте электронные уравнения
- В пяти пробирках находятся
- Тепловой эффект какой реакции
- При некоторой температуре константа
- Вычислите степень диссоциации
- Как изменяются степень полярности
- Сколько времени необходимо проводить
- Температура кипения раствора
- После длительного хранения на воздухе
- Осуществите превращения: сероводород
- Приведите примеры реакций
- Из данного перечня веществ выберите те
- Составить структурную формулу
- Выбрать, какие из перечисленных веществ
- Осуществить превращения: ацетилен
- Напишите уравнения химических реакций
- Приведены схемы гальванических
- Какие продукты образуются на аноде
- Анионы кислородсодержащих кислот
- Какой объем 0,2 М раствора серной
- Укажите возможные виды
- Массовые доли кремния и водорода
- Через водный раствор медного купороса
- Какая масса хлорной извести
- Медно – калийное удобрение содержит
- Определите равновесные количества
- При охлаждении реакционной смеси
- Исходная концентрация вещества А равна
- Степень диссоциации раствора Nh5OH
- Скорость реакции A + 2B → C
- Составьте координационную формулу
- Сколько времени нужно пропускать ток
- Подберите коэффициенты методом
- Вычислите э.д.с. гальванического
- Окислительно-восстановительные реакции
- Какую ковалентную связь называют
- Чему равна молярная масса эквивалента
- Раствор сахара С12Н22О11 в воде
- Рассчитайте изменение энтропии
- Как изменится скорость прямой реакции
- Исходные концентрации NО и Сl2
- На основании электронных схем
- Имеется смесь двух солей
- При смешении растворов CrCl3
- Возможен ли процесс
- Закончить уравнение
- Определите термодинамическую
- Выражаются следующими ионными
- Концентрация ионов H+ в растворе
- При какой молярной концентрации
- HI, NaOH, Nh5OH, h4PO4, Ca3(PO4)2
- Найти массу кислоты если
- Подберите коэффициенты в окислительно
- Смешали 2 раствора азотной кислоты
- С атомом и ионами положительными
- Гидролиз в ионной и молекулярной
- Осмотическое давление крови
- Определить тип гибридизации
- Учитывая, что алюминий образует
- Сколько граммов ртути в виде ионов
- Описать с позиции метода MO
- Написать формулу комплексного
- При прохождении через раствор соли
- Определите давление этана в сосуде
- Какая масса технического железа
- Определите вид химической связи
- Определите объем газа
- Парамагнитный или диамагнитный ион
- В каком из контактов
- Сколько литров фтора надо пропустить
- Технический бикарбонат содержит
- Составьте уравнения реакций получения
- Какая масса йода выделится
- Укажите, какое вещество является
- Избытком гидроксида калия
- Константы равновесия гетерогенной
- Рассчитайте степень диссоциации
- Электронная конфигурация ClO4-
- При электролизе раствора сульфата меди
- Металл Fe находится в контакте
- Металл Ni покрыт металлом Au
- Выражаются следующими ионно
- Какие из указанных металлов Pb, Be, Fe
- Реакция горения метилового спирта
- Составьте электронные уравнения
- Напишите уравнение гидролиза солей
- Найти степень окисления элементов
- Плотность раствора с массовой долей
- К раствору K2Cr2O7 добавили избыток
- Какой объем раствора KMnO4
- Определите pH водных растворов
- Через раствор хлорида магния в течение
- Какие значения могут принимать
- Напишите уравнения электродных
- Рассчитайте ЭДС гальванической пары
- Рассчитать pH муравьиной кислоты
- Какие процессы протекают на цинковых
- Какой объем раствора кислоты требуется
- Уравнения реакций взаимодействия
- К 25 мл 0,2 н раствора HCl прибавили
- Какая из двух солей при равных
- Напишите все квантовые числа
- Написать выражение для скорости
- S-SO2-SO3-h3SO4-K2SO4-BaSO4
- Определите массу осадка
- При электролизе раствора поваренной
- Расставьте коэффициенты в уравнениях
- Не производя вычислений, установить
- Вычислить изменение стандартного
- Вычислить изменение стандартной
- Вычислите тепловой эффект и напишите
- Реакций взаимодействия в растворах
- Растворимость в воде O2 и N2
- Рассчитать растворимость электролита
- Через раствор NaOH объемом
- Масса 1 дм3 смеси азота и водорода
- Укажите тип гибридизации атомных
- Рассчитать активные концентрации ионов
- Используя ПР
- Подсчитать электрохимический эквивалент
- C каким элементами может
chemer.ru
Трудные задания ЕГЭ по химии
Как показали результаты репетиционного экзамена по химии, наиболее трудными оказались задания, направленные на проверку знаний химических свойств веществ. К числу таких заданий можно отнести задание С3 – «Цепочка органических веществ», С2 – «Реакции между неорганическими веществами и их растворами».
При решении задания С3 «Цепочка органических веществ» учащийся должен написать пять уравнений химических реакций, среди которых одно является окислительно-восстановительным.
Рассмотрим составление одного из таких окислительно-восстановительных уравнений:
СН3СНО X1
Чтобы составить уравнение окислительно-восстановительной реакции с участием органических веществ, нужно научиться определять степень окисления в органическом веществе по его структурной формуле. Для этого нужно иметь знания о химической связи, знать, что такое электроотрицательность.
Структурная формула помогает оценить смещение электронов по каждой из связей. Так атом углерода метильной группы (–СН3) сместит электрон по каждой из связей к себе. Таким образом, степень окисления углерода метильной группы будет равна (-3). Атом углерода карбонильной группы (СО) отдаст 2 электрона атому кислорода, но частично компенсирует недостачу, приняв 1 электрон от атома водорода. Следовательно, его степень окисления будет равна +1:
В продукте реакции степень окисления углерода метильной группы не изменится. Карбонильная группа атомов превратится в карбоксильную с замещенным водородом на натрий, вследствие щелочной среды (-СООNa). Атом углерода карбоксильной группы сместит два электрона в сторону карбонильного кислорода и один электрон в сторону кислорода замещенной гидроксильной группы. Таким образом, степень окисления атома углерода карбоксильной группы будет равна (+3):
Следовательно, одна молекула этаналя отдает 2 электрона:
С+1-2е=С+3
Рассмотрим теперь процессы, происходящие с перманганатом натрия. Обращает внимание, что в схеме дан перманганат натрия, а не калия. Свойства перманганата натрия должны быть аналогичны свойствам перманганта калия, который в зависимости от кислотности среды способен давать различные продукты:
Так как в нашем случае перманганат натрия используется в щелочной среде, то продуктом реакции будет манганат ион – MnO42-.
Определим степень окисления иона марганца в перманганате калия NaMnO4 пользуясь правилом равенства числа положительных и отрицательных зарядов в нейтральной структурной единице вещества. Четыре кислорода каждый по (-2) дадут восемь отрицательных зарядов, так как степень окисления у калия +1, то у марганца будет +7:
Na+1Mn+7O4-2
Записав формулу манганата натрия Na2MnO4, определим степень окисления марганца:
Na2+1Mn+6O4-2
Таким образом, марганец принял один электрон:
Mn+7+1e=Mn+6
Полученные уравнения позволяют определить множители перед формулами в уравнении химической реакции, которые называют коэффициентами:
С+1-2е=С+3 ·1
Mn+7+1e=Mn+6 ·2
Уравнение реакции приобретет следующий вид:
2NaMnO4+CH3CHO+3NaOH=CH3COONa+2Na2MnO4+2H2O
Задание С2 требует от участника ЕГЭ знание свойств разнообразных свойств неорганических веществ, связанных с протеканием как окислительно-восстановительных реакций между веществами, находящимися как в одном, так и в различных агрегатных состояниях, так и обменных реакций протекающих в растворах. Такими свойствами могут быть некоторые индивидуальный свойства простых веществ и их соединений, например, реакция лития или магния с азотом:
2Li+3N2=2Li3N
2Mg+N2=Mg2N2
горение магния в углекислом газе:
Mg+CO2=MgO+CO
2Mg+CO2=2MgO+C
Особую трудность у учащихся вызывают сложные случаи взаимодействия растворов веществ солей подвергающихся гидролизу. Так для взаимодействия раствора сульфата магния с карбонатом натрия можно записать целых три уравнения возможных процессов:
MgSO4+Na2CO3=MgCO3+Na2SO4
2MgSO4+2Na2CO3+H2O=(MgOH)2CO3¯+2Na2SO4+CO2
2MgSO4+2Na2CO3+2H2O=2Mg(OH)2¯+2Na2SO4+2CO2
Традиционно трудны для написания уравнения с участием комплексных соединений. Так растворы амфотерных гидроксидов в избытке щелочи обладают всеми свойствами щелочей. Они способны вступать в реакции с кислотами и кислотными оксидами:
Na[Al(OH)4]+HCl=NaCl+Al(OH)3¯+H2O
Na[Al(OH)4]+2HCl=NaCl+Al(OH)2Cl+2H2O
Na[Al(OH)4]+3HCl=NaCl+Al(OH)Cl2+3H2O
Na[Al(OH)4]+4HCl=NaCl+AlCl3+4H2O
Na[Al(OH)4]+CO2=NaHCO3+Al(OH)3¯
2Na[Al(OH)4]+CO2=Na2CO3+2Al(OH)3¯+H2O
Растворы солей, имеющие кислую реакцию среды, вследствие гидролиза, способны растворять активные металлы, например, магний или цинк:
Mg+MgCl2+2H2O=2MgOHCl+H2
На экзамене желательно помнить об окислительных свойствах солей трехвалентного железа:
2FeCl3+Cu=CuCl2+2FeCl2
Могут пригодиться знания об аммиачных комплексах:
CuSO4+4NH3=[Cu(NH3)4]SO4
AgCl+2NH3=[Ag(NH3)2]Cl
Традиционно вызывают затруднения, связанные с проявлением основных свойств раствором аммиака. В результате чего могут протекать обменные реакции в водных растворах:
MgCl2+2NH3+2H2O=Mg(OH)2+2NH4Cl
В заключение приведем серию уравнений химических реакций, которые нужно знать участникам ЕГЭ по химии:
Кислотные оксиды (кроме SiO2) реагируют с водой, как амфотерным оксидом с образованием кислот:
P2O5 + 3H2O = 2H3PO4
SO3 + H2O = H2SO4
Для получения азотной кислоты азот оксид азота (IV) должен быть доокислен, например кислородом воздуха:
4NO2 + O2 + 2H2О = 4HNO3
Лабораторный способ получения хлороводорода: к твердому хлориду натрия приливают концентрированную серную кислоту:
NaCl + H2SO4 = NaHSO4 + HCl
Для получения бромоводорода из бромида натрия, концентрированная серная кислота не подойдет, так как выделяющийся бромоводород будет загрязнен парами брома. Можно использовать концентрированную фосфорную кислоту:
NaBr+ H3PO4 = NaH2PO4 + HBr
Кислоты реагируют с металлами, стоящими в ряду напряжений до водорода:
Fe + 2 HCl = FeCl2 + H2
И их оксидами:
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Обратите внимание на валентность переходных элементов в солях.
Щелочные и щелочноземельные металлы взаимодействуют с водой:
K + H2O = KOH + ½ H2
В условиях избытка кислоты могут образовываться и кислые соли:
2Н3РО4 + 2Na = 2NaH2PO4 + Н2
Органические кислоты также проявляют кислотные свойства:
2СН3СООН + 2Na = 2CH3COONa + Н2
СНзСООН + NaOH = CH3COONa + Н2О
Комплексные гидроксиды реагируют с кислотами с образованием солей и воды:
Na[Al(OH)4] + HCl = AlCl3 + 4H2O + NaCl
LiOH + HNO3 = LiNO3 + H2O
Многоосновные кислоты в реакции с гидроксидами могут образовывать кислые соли:
Н3РО4 + КОН = КН2РО4 + Н2О
Продуктом реакции аммиака с фосфорной кислотой может также быть кислая соль:
NH3 + H3PO4 = NH4H2PO4
Обратим внимание на свойства оснований, их взаимодействие с кислотами:
2Н3РО4 + ЗСа(ОН)2 = Са3(РО4)2¯ + 6Н2О
с кислотными оксидами:
Ca(OH)2 + CO2 = CaCO3¯ + H2O
2Ca(OH)2 + CO2=(СaOH)2CO3+H2O
Реакция гидроксидов с кислотными оксидами может приводить и к кислым солям:
KOH + CO2 = KHCO3
Основные оксиды реагируют с амфотерными оксидами:
CaO + H2O = Ca(OH)2
Средние соли в воде реагируют с кислотными оксидами с образованием кислых солей:
CaCO3 + CO2 + H2O = Ca(HCO3)2
Более сильные кислоты вытесняют более слабые из их солей:
CH3COONH4 + HCl = CH3COOH + NH4Cl
K2CO3 + H2SO4 = K2SO4 + H2O + CO2
Кислоты в присутствии серной кислоты реагируют со спиртами с образованием сложных эфиров:
CH3COOH + C2H5OH = CH3COOC2H5 + H2O
Более сильное основание вытесняет более слабое из его солей:
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl
MgCl2 + KOH = MgOHCl + KCl
NH4С1 + NaOH = NaCl + NH3 + H2O
Чтобы получить из основной соли получить среднюю соль нужно подействовать кислотой:
MgOHCl + HCl = MgCl2 + H2O
Гидроксиды металлов (кроме щелочных металлов) разлагаются при нагревании в твердом виде до оксидов:
2Al(OH)3 = Al2O3 + 3H2O
2Fe(OH)3 = Fe2O3 + 3H2O
Гидрокарбонаты при нагревании разлагаются до карбонатов:
2KHCO3 = K2CO3 + H2O + CO2
Нитраты обычно разлагаются до оксидов (обратите внимание на повышение степени окисления переходного элемента находящегося в промежуточной степени окисления):
2Fe(NO3)2 = Fe2O3 + 4NO2 + 0,5O2
2Fe(NO3)3 ® Fe2O3 + 6NO2 + 1,5 O2
2Cu(NO3)2 = 2CuO + 4NO2 + О2
Нитраты щелочных металлов разлагаются до нитритов:
NaNO3 = NaNO2 + ½ O2
Карбонаты металлов (кроме щелочных) разлагаются до оксидов:
CaCO3 = CaO + CO2
При составлении уравнений реакций ионного обмена пользуйтесь таблицей растворимости:
K2SO4 + BaCl2 = BaSO4¯ + 2KCl
[C6H5-NH3]C1 + AgNО3 = [C6H5NH3]NO3 + AgCl¯
Электролиз расплавов солей:
2KCl = 2K + Cl2
Электролиз растворов солей металлов, стоящих в ряду напряжения после водорода:
2HgSO4 + 2H2O = 2Hg + О2 + 2H2SO4
1) на катоде: Hg2+ + 2e = Hg°
2) на аноде: 2Н2О – 4е = О2 + 4Н+
Электролиз раствора сульфата натрия
1) на катоде: 2H2O + 2e = H2 + 2OH–
2) на аноде: 2H2O – 4e = O2 + 4H+
3) Составлено общее уравнение электролиза:
2H2O = 2H2 + O2
до водорода:
СаI2 + 2Н2О = Н2 + I2 + Са(ОН)2
1) на катоде: 2Н2О + 2e = 2ОН + Н2
2) на аноде: 2I– – 2e = I2
Сравните свойства одноэлементных и кислородсодержащих анионов.
Химические реакции, возможные при электролизе сульфата хрома (III):
1)Сг3+ + e = Сг2+
2) Cr2+ + 2e = Сг°
3) Сг3+ + 3 e= Сг°
4) 2Н+ + 2e = Н2
Электролиз водных растворов солей карбоновых кислот:
2CH3COONa + 2H2O = CH3CH3 + 2CO2 + H2 + 2NaOH
Пример взаимного гидролиза солей:
A12(SO4)3 + 3K2CO3 + 3H2O = 2A1(OH)3 + 3CO2
maratakm.narod.ru
Разбор задания №11 ЕГЭ по химии
Задания данного типа направлены на химические свойства металлов, неметаллов и их соединений, солей, кислот, оксидов и щелочей. Подобные тесты решаются методом исключения посредством логики.Итак, попробуем провести ход рассуждений следующим образом, исключим варианты ответов, которые точно не подходят!
Алюминий:
1) Fe2O3, HNO3 (р-р), NaOH
Алюминий вытеснит железо из оксида, будучи более активным металлом, этот процесс называется алюмотермия:
Fe2O3 + 2Al → 2Fe + Al2O3
Согласно таблице алюминий реагирует с разбавленной HNO3!
Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
Алюминий растворяется в щелочах, образуя алюминаты:
2Al + 2NaOH → 2NaAlO2 + 3H2
Рассмотрим другие варианты и исключим их:
2) Fe, HNO3, H2
Очевидно что алюминий и железо, будучи металлами не будут реагировать между собой, исключаем этот вариант!
3) HI, Fe, SO2
Аналогичным образом исключаем и этот вариант!
4) C2H5OH, H2O, Cl2
Вода реагирует с алюминием только при нагревании и при удалении оксидной пленки!
5) CaCl2, KOH, HCl
Кальций более активный металл чем алюминий, поэтому алюминий не сможет его вытеснить!
Кислород:
Кислород не сможет окислить соединения, чьи элементы уже в своих высших степенях окисления:
1) Fe2O3, HNO3 (р-р), NaOH
Кислород не окислит высший оксид железа, железо и так окислено до +3!
2) Fe, HNO3, H2
Азотная кислота сама по себе сильный окислитель, а азот в своей максимальной степени окисления +5.
3) HI, Fe, SO2
Кислоты не окислители могут окисляться кислородом:
4HI + O2 → 2I2 + 2H2O
Железо окисляется на воздухе как и большинство металлов и горит в атмосфере кислорода:
3Fe + 2O2 → Fe3O4
Оксид серы (IV) не является высшим оксидом, поэтому он тоже может окислиться сильнее:
2SO2 + O2 → 2SO3
4) C2H5OH, H2O, Cl2
Вода с кислородом не реагирует, это и так оксид водорода!
5) CaCl2, KOH, HCl
Щелочи не способны окисляться водородом, металл в них и так окислен!
Сера:
1) Fe2O3, HNO3 (р-р), NaOH
Сера не прореагирует с оксидом железа, так имеет сходство с кислородом (в той-же группе), к тому же вытеснить кислород она не способна (ниже по группе).
2) Fe, HNO3, H2
При обычных условиях сера реагирует со всеми щелочными и щелочноземельными металлами, медью, ртутью, серебром (при нагревании сера реагирует и с другими металлами (Zn, Al, Fe), и только золото не взаимодействует с ней ни при каких условиях):
Fe + S = FeS
Сера играет роль восстановителя, причем из неметаллов с серой не реагирует только азот, йод и благородные газы. С азотной кислотой она реагирует при кипячении с получением H2SO4:
S + 6HNO3 → H2SO4 + 6NO2 + 2H2O
Окислительные свойства сера проявляет и с водородом, с которым реагирует при нагревании:
H2 + S → H2S
3) HI, Fe, SO2
Очевидно что сера не будет реагировать со своим оксидом.
4) C2H5OH, H2O, Cl2
Сера инертна к вода, как и кислород.
5) CaCl2, KOH, HCl
Cера не будет взаимодействовать с хлоридом кальция, равно как и с HCl.
Калий:
1) Fe2O3, HNO3 (р-р), NaOH
Натрий более активный метал чем калий, поэтому последний не вытеснить его из соединений.
2) Fe, HNO3, H2
Калий и железо не взаимодействуют, оба металлы.
3) HI, Fe, SO2
Аналогично предыдущему пункту исключим этот.
4) C2H5OH, H2O, Cl2
При взаимодействии калия с спиртом образуются алкоголяты. Катионами алкоголятов могут быть щелочные, щелочноземельные металлы и, при определенных условиях алюминий):
C2H5OH + K → C2H5OK + H2↑
Щелочные металлы (активные металлы) взаимодействуют с водой:
2K + 2H2O → 2KOH + H2↑
Большинство металлов реагируют с галогенами. Каждый галоген является самым сильным окислителем в своем периоде. Окислительные свойства галогенов отчетливо проявляются при их взаимодействии с металлами. При этом образуются соли:
2K + Cl2 → 2KCl
5) CaCl2, KOH, HCl
Калий не будет взаимодействовать с своей щелочью.
www.chem-mind.com
Задания по химии. 11 класс
Задача 1
На промышленном предприятии произошла утечка ацетилена. Для определения взрывоопасности получившейся ацетиленово-воздушной смеси 20 л ее пропустили через подкисленный серной кислотой раствор перманганата калия. В результате 11.3 г перманганата калия восстановилось. Опасна ли концентрация ацетилена в воздухе, если такие смеси взрываются при содержании ацетилена в интервале 2.0-81% (в объемных долях)?
Решение:
Взаимодействие кислого раствора перманганата калия с ацетиленом протекает по уравнению
2 KMnO4 + C2H2 + 3H2SO4 = 2MnSO4 + K2SO4 + 2CO2 + 4H2O
По уравнению реакции x = (11.3·22.4)/316 = 0.8 л, таким образом, объемная доля ацетилена 0.8/20 = 0.04 или 4%. Смесь взрывоопасна.
Задача 2
Сплавлением оксида железа (III) с окислительно-щелочной смесью (на основе КОН) была получена соль, содержащая 28.3 % (масс.) железа. После удаления других продуктов реакции, указанная соль была перенесена в заполненный воздухом закрытый сосуд объемом 1 л (н.у.). В сосуд также добавили воду, в количестве, необходимом для её полного гидролиза. В результате давление в сосуде увеличилось на 0.192 атм. Какая соль была подвергнута гидролизу и какое количество (г) исходного оксида железа (III) было израсходовано? (Объемом, занимаемым реагентами и водой в сосуде можно пренебречь).
Решение:
1. Определим соль железа, получаемую сплавлением оксида железа (III) с окислительно-щелочной смесью. В результате такого процесса получается феррат щелочного металла (в нашем случае калия), в котором железо находится в своей максимальной степени окисления +6. Запишем уравнение возможной реакции:
Fe2O3 + 3KNO3 + 4KOH → 2K2FeO4 + 3KNO2 + 2H2O. (1)
Массовая доля железа в феррате калия составляет 28.28 % (масс) ((56·100)/198), что хорошо согласуется с условием задачи. Итак, содержащая железо соль – феррат калия.
2. Запишем уравнение гидролиза K2FeO4:
4K2FeO4 +10Н2О → 4Fe(OH)3 + 3O2↑+ 8KOH. (2)
Из уравнения (2) видно, что в результате гидролиза K2FeO4 выделяется кислород.
Рассчитаем мольный состав воздуха объемом 1 л находящийся при нормальных условиях (Т=273 К, р=1 атм) полагая, что состав воздуха (по объемным процентам) составляет: N2 – 78%; O2 – 21% и CO2 – 1%. Принимая состояние этих газов близких к идеальному, можно рассчитать:
n(N2) = 0.78 (л)/22.4 (л/моль) = 0.0348 моль; n(О2) = 0.21 (л)/22.4 (л/моль) = 0.0094 моль; n(СО2) = 0.01 (л)/22.4 (л/моль) = 0.00045 моль.
Поскольку в воздухе содержится СО2, то он будет поглощаться продуктами гидролиза (в частности, КОН) и поэтому его необходимо исключить при определении состава конечной газовой смеси.
По уравнению состояния идеального газа определим число молей газовой смеси после проведения гидролиза K2FeO4:
n(N2 + O2) = pV/RT = (101325·(1+0.192)·10-3)/8.314·273=0.0532 моль.
Количество выделившегося в результате гидролиза K2FeO4 равно:
n(O2)гидролиз = n(N2 + O2) — n(N2)исх. — n(О2)исх. = 0.0532 — 0.0348 — 0.0094 = 0.0090 моль.
3. По уравнению реакции (2) находим количество K2FeO4, подвергнутого гидролизу:
из 4 моль K2FeO4 образуется 3 моль О2,
из x1 моль K2FeO4 образуется 0.009 моль О2,
отсюда х1 = 0.012 моль.
4. По уравнению реакции (1) находим количество Fe2O3, затраченное на получение 0.012 моль K2FeO4:
из 1 моль Fe2O3 образуется 2 моль K2FeO4,
из x2 моль Fe2O3 образуется 0.012 моль K2FeO4,
отсюда х2 = 0.006 моль, что составляет 0.96 г.
Ответ: K2FeO4; m(Fe2O3)=0.96 г.
Задача 3
Предложите схему реакций, позволяющих получить 2-хлор-4-нитробензойную кислоту из неорганических веществ.
Решение:
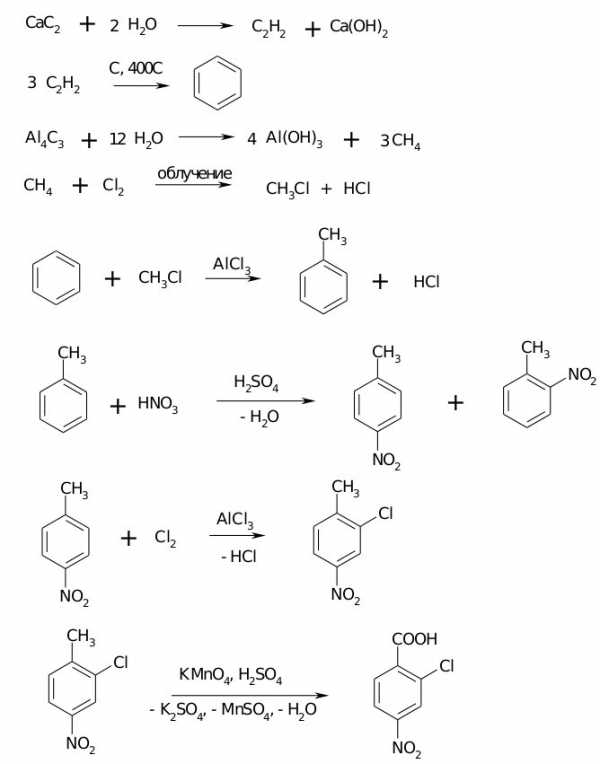
Задача 4
Соединение Х получено в результате реакции между хлоридом кобальта (II), аммиаком, хлоридом аммония и окислителем. Химический анализ вещества Х дал следующие результаты (% масс.): Со – 25.3; N – 24.0; Н – 5.14 и Cl – 45.6. Обработка 1.00 г Х раствором нитрата серебра дает 0.614 г хлорида серебра. Выведите формулу Х и назовите соединение. Докажите строение и нарисуйте структуру (или структуры) Х. Изобразите структуру соединения Y, которое получится, если вместо аммиака использовать H2NCH2CH2NH2. Назовите соединение Y. К какому классу относятся соединения Х и Y?
Решение:
Определим брутто-формулу вещества Х. Из условия задачи следует, что в 100 г вещества Х содержится 25.3 г Со, 24.0 г N, 5.14 г. Н и 45.6 г Сl. Отсюда можно рассчитать мольное соотношение компонентов в веществе Х:
n(Co)/n(N)/n(H)/n(Cl)=(25.3/59):(24.0/14):(5.14/1):(45.6/35.5)=0.43:1.71:5.14:1.28
или
n(Co)/n(N)/n(H)/n(Cl)=1:4:12:3.
Таким образом, простейшая формула вещества Х может быть записана как:
CoN4H12Cl3.
Вещество такого состава получается при взаимодействии CoCl2 с NH3(водн.), NH4Cl и окислителем (в качестве последнего могут выступать перекись водорода или кислород воздуха). Для химии кобальта характерно образование комплексных соединений, среди которых основную группу составляют соединения с координационным числом у кобальта равным 6. Исходя из этого можно записать реакцию получения соединения Х, имеющего состав CoN4H12Cl3:
CoCl2 + NH4Cl + 3NH3 + (0.5H2O2) → [Co(NH3)4Cl2]Cl + Н2О. (1)
Соединение [Co(NH3)4Cl2]Cl называется: хлорид тетраамминдихлорокобальта (III).
2. Доказательством строения вещества Х является реакция с AgNO3:
[Co(NH3)4Cl2]Cl + AgNO3 → [Co(NH3)4Cl2]NO3 + AgCl. (2)
Из уравнения (2) следует, что 0.614 г AgCl действительно образуется из 1 г [Co(NH3)4Cl2]Cl: 1/233.5=0.614/143.5=0.0043. Отсюда следует, что во внешней координационной сфере комплексного соединения состава CoN4H12Cl3 имеется только один атом хлора, что подтверждает наше предположение о том, что вещество Х – это хлорид тетраамминдихлорокобальта (III).
У соединения [Co(NH3)4Cl2]Cl возможно два изомера:
Хлорид цис-тетраамминдихлорокобальта (III) и хлорид транс-тетраамминдихлорокобальта (III).
3. Если вместо NH3 использовать H2NCH2CH2NH2 (1,2-диаминоэтан, этан-1,2-диамин), то получится соединение хлорид ди(этан-1,2-диамин)дихлорокобальта (III) (Y), цис— и транс-изомеры которого представлены двумя оптическими изомерами (энантиомерами):

4. Рассмотренные соединения относятся к классу комплексных соединений. Соединение Y называется хелатом. Лиганд H2NCH2CH2NH2 называется хелатирующим или хелатообразующим.
Задача 5
При обработке нитрующей смесью ароматического вещества А, молекулярная формула которого C8H10, образуются преимущественно два вещества, В и В’, с молекулярной формулой C8H9O2N. При окислении вещества А подкисленным водным раствором KMnO4 образуется вещество С с молекулярной формулой С7H6O2. Окисление в тех же условиях веществ В и В’ дает изомерные вещества D и D’. Установите строение веществ А, B, B’, C, D и D’. Приведите полные уравнения реакций.
Решение:
Вещество А может иметь следующие структурные формулы:
Так как при окислении А образуется соединение с меньшим числом атомов углерода – С7Н6О2, или C6H5COOH, вещество А представляет собой этилбензол (формула I).
Описанные в условии задачи превращения можно выразить следующими схемами:
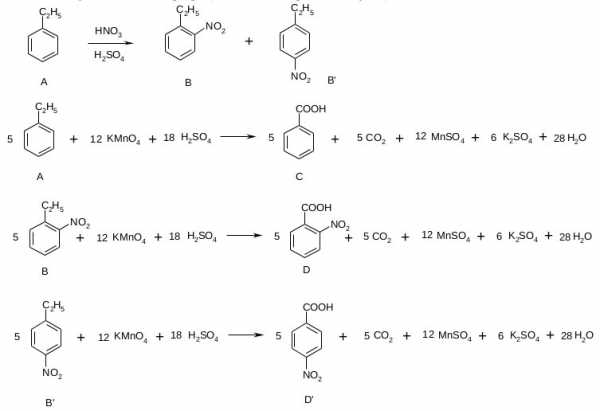
Задача 6
В объемном отношении 3:3:4 смешали 0.3 н., 0.1 М и 0.6 н. растворы ортофосфорной кислоты. Вычислить концентрацию ионов водорода в полученном растворе, принимая во внимание, что степень диссоциации кислоты по первой ступени в нем равна 20%. Чему равен рН полученного раствора? Диссоциацию кислоты по остальным ступеням можно не учитывать.
Решение:
Перейдем от нормальной концентрации исходных растворов к молярной. Поскольку фактор эквивалентности H3PO4 равен 1/3, имеем
СМ = СН/3.
Таким образом, в отношении 3:3:4 смешали соответственно 0.1 М, 0.1 М и 0.2 М растворы ортофосфорной кислоты
Допустим, что взяты 3 л 0.1 М, 3 л 0.1 М и 4 л 0.2 М растворов H3PO4. Тогда в конечном растворе (10 л) будет содержаться 1.4 моль H3PO4. В итоге получается раствор 0.14 М (СМ=n(H3PO4)/V(р-р)=1.4моль/10 л=1.4 моль/л (М)).
Если учитывать диссоциацию H3PO4 только по первой стадии:
H3PO4 ↔ H2PO4— + Н+,
то следует, что из каждого подвергшегося диссоциации моля H3PO4 образуется 1 моль ионов водорода. Так как степень диссоциации равна 20%, в растворе диссоциирует 0.028 моль/л H3PO4 и поэтому концентрация ионов водорода равна 0.028 моль/л.
По определению рН=-lg[H+]. Отсюда рН=-lg0.028=1.55
Ответ: СМ(H+)=0.028 моль/л; рН=1.55.
Задача 7
Из бензола и других необходимых реагентов получите 4-бром-3-нитробензойную кислоту (A) и 4-бром-2-нитробензойную кислоту (B). Обоснуйте выбор последовательности превращений и назовите все промежуточные продукты. Затем получите из кислот A и В сложные эфиры, используя этиловый спирт.
Решение:
Получение продукта А:
На первой стадии происходит алкилирование по Фриделю-Крафтсу, затем бромирование по Фриделю-Крафтсу. Далее окисление до бензойной кислоты и нитрование. На последней стадии происходит согласованная ориентация реакции нитрования (А). Реакция этерификации:
Получение продукта B:
На первой стадии происходит алкилирование по Фриделю-Крафтсу, затем бромирование по Фриделю-Крафтсу. Далее происходит нитрование 4-бромтолуола (несогласованная ориентация). Нитропродукт окисляется до бензойной кислоты (B). Реакция этерификации:
Вконтакте
Google+
Одноклассники
olimpotvet.ru
