Решение задач на растворы
Разделы: Математика, Химия
Цели урока: Рассмотреть алгоритм решения задач на растворы: познакомиться с приемами решения задач в математике и химии, рассмотреть биологическое значение воды как универсального растворителя, развить практические умения решать задачи, расширить знания учащихся о значении этих веществ в природе и деятельности человека, сформировать целостную картину о взаимосвязи предметов в школе.
Ход урока
Организационный момент
Учитель математики: Здравствуйте! Сегодня мы проводим необычный урок – урок на перекрестке наук математики и химии.
Учитель химии: Здравствуйте, ребята! Мы с вами увидим, как математические методы решения задач помогают при решении задач по химии.
А чтобы сформулировать тему урока, давайте проделаем небольшой эксперимент.
(Наливаю в 2 хим. стакана воду, добавляю в оба одинаковое количество сульфата меди.) Что получилось? (Растворы). Из чего состоит раствор? (Из растворителя и растворённого вещества). А теперь добавим в один из стаканов ещё немного сульфата меди. Что стало с окраской раствора? (Он стал более насыщенным). Следовательно, чем отличаются эти растворы? (Массовой долей вещ-ва).
Учитель математики: А с математической точки зрения – разное процентное содержание вещества.
Итак, тема урока “Решение задач на растворы”.
Цель урока: Рассмотреть алгоритм решения задач на растворы, познакомить с приемами решения задач в математике и химии, расширить знания о значении этих растворов в быту, сформировать целостную картину о взаимосвязи предметов в школе.
Девиз: “Только из союза двух работающих вместе и при помощи друг друга рождаются великие вещи” Антуан де Сент-Экзюпери.
Учитель математики: Для урока необходимо повторить понятие процента.
– Что называют процентом? (1/100 часть числа).
– Выразите в виде десятичной дроби 17%, 40%, 6%.
– Выразите в виде обыкновенной дроби 25%, 30%, 7%.
– Установите соответствие:
| 40% | 1/4 |
| 25% | 0,04 |
| 80% | 0,4 |
| 4% | 4/5 |
Одним из основных действий с процентами – нахождение % от числа.
Как найти % от числа? (% записать в виде дроби, умножить число на эту дробь.)
– Найти 10% от 30 (10%=0,1 30·0,1=3).
– Вычислите:
1) 20% от 70;
2) 6% от 20;
3) х% от 7.
Учитель химии
– Что такое раствор? (Однородная система, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия.)
– Приведите примеры растворов, с которыми вы встречаетесь в повседневной жизни. (уксус, нашатырный спирт, раствор марганцовки, перекись водорода и др.)
Часто понятие “раствор” мы связываем, прежде всего, с водой, с водными растворами. Есть и другие растворы: например спиртовые раствор йода, одеколона, лекарственные настойки.
Хотя именно вода является самым распространённым соединением и “растворителем” в природе.
3/4 поверхности Земли покрыто водой.
Человек на 70% состоит из воды.
В сутки человек выделяет 3 литра воды и столько же нужно ввести в организм.
Овощи – 90% воды содержат (рекордсмены – огурцы - 98%)
Рыба 80% (рекордсмен у животных – медуза 98%)Хлеб – 40%
Молоко – 75%
– Что такое массовая доля растворенного вещества? (Отношение массы растворенного вещества к общей массе раствора.)
– Вспомните формулу для вычисления массовой доли растворенного вещества и производные от нее (w = m (р.в.)/m (р-ра ) ; m (р.в.)= m (р-ра) · w ; m (р-ра) = m (р.в.)/ w )
– По какой формуле можно рассчитать массу раствора? (m(р-ра) = m (р.в.) + m (р-ля)).
Учитель химии предлагает решить учащимся задачу:
Задача №1. Перед посадкой семена томатов дезинфицируют 15%-ным раствором марганцовки. Сколько г марганцовки потребуется для приготовления 500 г такого раствора? (Ответ: 40 г.)
Учитель математики.
– Давайте посмотрим на эту задачу с точки зрения математики. Какое правило на проценты вы применили при решении этой задачи? (Правило нахождения процента от числа.)
15% от 500;
500·0,15=75 (г) – марганцовки.
Ответ: 75 г.
– Как видите, задачи, которые вы встречаете на химии, можно решать на уроках математики без применения химических формул.
Задачам на растворы в школьной программе уделяется очень мало времени, но эти задачи встречаются на экзаменах в 9 и 11 классах. В этом году на экзамене в 9 классе была задача на смешивание растворов, и она оценивалась в 6 баллов.
Задача №2. При смешивании 10%-го и 30%-го раствора марганцовки получают 200 г 16%-го раствора марганцовки. Сколько граммов каждого раствора взяли?
Можно ли решить эту задачу так быстро?
О чем говорится в этой задаче? (о растворах)
Что происходит с растворами? (
Решение:
| Раствор | %-е содержание | Масса раствора (г) | Масса вещества (г) |
1 раствор |
10% = 0,1 |
х |
0,1х |
16% = 0,16 |
200 |
0,16 · 200 |
0,1х + 0,3(200-х) = 0,16 · 200
0,1х + 60 – 0,3х = 32
-0,2х = -28
х = 140
140 (г) – 10% раствора
200 – 140 = 60 (г) – 30% раствора.
Ответ: 140 г, 60 г.
Учитель математики. Рассмотрим еще один раствор – это уксусная кислота. Водный раствор уксусной кислоты, полученный из вина (5-8%) называют винным уксусом. Разбавленный (6-10%) раствор уксусной кислоты под названием “столовый уксус” используется для приготовления майонеза, маринадов и т.д. Уксусная эссенция 80% раствор. Ее нельзя применять без разбавления для приготовления пищевых продуктов. “Столовый уксус”, используют для приготовления маринадов, майонеза, салатов и других пищевых продуктов. Очень часто при приготовлении блюд под руками оказывается уксусная эссенция. Как из нее получить столовый уксус. Поможет следующая задача.
Задача №3. Какое количество воды и 80%-го раствора уксусной кислоты следует взять для того, чтобы приготовить 200 г столового уксуса (8%-ый раствор уксусной кислоты.)
Решение:
Раствор |
%-е содержание |
Масса раствора (г) |
Масса вещества (г) |
Уксусная кислота |
80%=0,8 |
х |
0,8х |
Смесь |
8%=0,08 |
200 |
0,08 · 200 |
0,8х = 0,08 · 200
0,8х = 16
х = 16 : 0,8
х = 20
20 (г) – уксусной кислоты
200 – 20 = 180 (г) – воды.
Ответ: 20 г, 180 г.
Учитель химии. А сейчас мы решим экспериментальную задачу.
Приготовить 20 г 5%-го раствора поваренной соли. (Расчётная часть). Затем выполняем практическую часть. (Напомнить правила Т-Б).
2. Экспериментальная часть (Соблюдать правила техники безопасности).
- Уравновесить весы.
- Взвесить необходимое количество соли.
- Отмерить мерным цилиндром воду.
- Смешать воду и соль в стакане.
Учитель математики. Проведем проверочную работу, в которую включили задачи из сборника для подготовке к экзаменам в 9-м классе.
Проверочная работа
| При смешивании 15%-го и 8% -го раствора кислоты получают 70 г 10%-го раствора кислоты. Сколько граммов каждого раствора взяли? | При смешивании 15%-го и 60% -го раствора соли получают 90 г 40%-го раствора соли. Сколько граммов каждого раствора взяли? |
| 1р 15% = 0,15 х 0,15х |
1р 15%=0,15 х 0,15х |
| 2р 8% = 0,08 70 – х 0,08(70 – х) |
2р 60% = 0,6 90 – х 0,6(90 – х) |
| см 10% = 0,1 70 0,1 · 70 |
3р 40% = 0,4 90 0,4 · 90 |
| 0,15х + 0,08(70 – х) = 0,1 · 70 0,15х + 5,6 – 0,08х = 7 0,07х = 7 – 5,6 0,07х = 1,4 х = 1,4:0,07 х = 20 20(г) – 15%-го раствора. 70 – 20 = 50 (г) – 8% раствора Ответ: 20 гр., 50 г. |
0,15х + 0,6(90 – х) = 0,4 · 90 0,15х + 54 – 0,6х = 36 -0,45х = 36 – 54 -0,45х =-18 х = 18 : 0,45 х = 40 40 (г) -15% раствора. 90 – 40 = 50 (г) – 60% раствора. Ответ: 40 гр., 50 г. |
Подведение итогов урока
Учитель химии.
– Посмотрите на содержание всех решенных сегодня задач. Что их объединяет? (Задачи на растворы.)
– Действительно, во всех задачах фигурируют водные растворы; расчеты связаны с массовой долей растворенного вещества; и если вы обратили внимание, задачи касаются разных сторон нашего быта.
Учитель математики.
– Посмотрите на эти задачи с точки зрения математики. Что их объединяет? (Задачи на проценты.)
При решении всех этих задач мы используем правило нахождения процента от числа.
Оценки за урок.
Домашнее задание.
Важное место в рационе питания человека, а особенно детей занимает молоко и молочные продукты. Решим такую задачу:
Задача №1. Какую массу молока 10%-й жирности и пломбира 30%-й жирности необходимо взять для приготовления 100 г 20%-го новогоднего коктейля?
Решение:
%-е содержание |
Масса раствора (г) |
Масса вещества (г) |
|
Молоко |
10% = 0,1 |
х |
0,1х |
Коктейль |
20% = 0,2 |
100 |
0,2 · 100 |
0,1х + 0,3(100-х) = 0,2 · 100
0,1х + 30 – 0,3х = 20
-0,2х = -10
х = 50
50(г) – молока
100 – 50 = 50(г) – пломбира.
Ответ:50 г молока, 50 г пломбира.
Задача №3. Для засола огурцов используют 7% водный раствор поваренной соли (хлорида натрия NaCl). Именно такой раствор в достаточной мере подавляет жизнедеятельность болезнетворных микроорганизмов и плесневого грибка, и в то же время не препятствует процессам молочнокислого брожения. Рассчитайте массу соли и массу воды для приготовления 1 кг такого раствора?
Рефлексия. (Синквейн)
Раствор
Разбавленный, водный
Растворять, смешивать, решать
Растворы широко встречаются в быту.
Смеси
Наш урок подошел к концу. Сейчас каждый из вас оставит на парте тот смайлик, какое настроение вы приобрели на уроке.
Спасибо за урок!
Процент
Лист к уроку
Презентация
xn--i1abbnckbmcl9fb.xn--p1ai
Задачи по химии на тему “Растворы”
Выполнила студентка гр.ВХМС-31 Боякова Алена
Условия задач по теме «Растворы» (5 задач)
Требуется приготовить 1 кг 15%-го раствора аммиака. Сколько нужно взять для этого 25%-го раствора аммиака и воды?
К 80 г раствора соли неизвестной концентрации прибавили 40 г воды. Вычислите массовую долю соли в исходном растворе, если после разбавления она стала равной 18%.
Из 400 г 20%-го раствора соли упариванием удалили 100 г воды. Чему стала равна массовая доля соли в полученном растворе?
В результате упаривания 450 г 10%-го раствора хлорида кальция его массовая доля увеличилась вдвое. Вычислите массу испарившейся воды.
Имеются два раствора аммиака с массовой долей 25% и 5%. Сколько граммов каждого раствора надо взять, чтобы получить 125 г 10%-го раствора аммиака?
Пример решенной задачи по теме растворы:
Задача для примера решения
Сколько граммов воды надо испарить из 800 г 15%-го раствора вещества, чтобы увеличить его массовую долю на 5%?
ДАНО:
ω(в-ва)=15%=0,15
m(p-pa)=800г
ω'(в-ва)=(15+5)%=20%=0,2
НАЙТИ:
mисп.(H2O)=?
РЕШЕНИЕ:
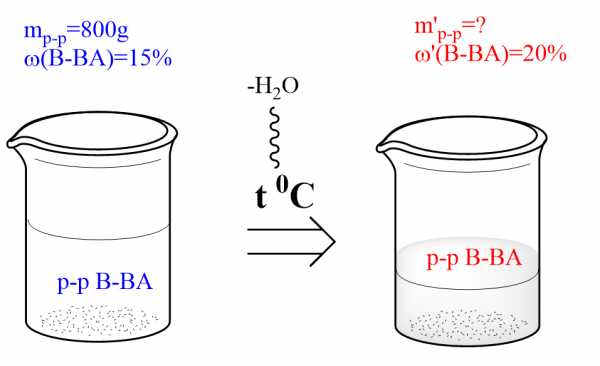
1)Найдем массу растворенного вещества в исходном растворе:
m(в-ва)=ω(в-ва)⋅m(p−pa)=0,15⋅800г=120г
2) Поскольку испаряется только вода, масса вещества остается неизменной: m(в-ва) = m'(в-ва)=120г
3) Зная массу растворенного вещества и его массовую долю, найдем массу полученного раствора:
m′(р-ра)=m(в-ва))ω(в-ва)=120г0,2=600г
Масса испаренной воды – разность масс полученного и исходного растворов:
mисп.(h3O)= m(р-ра) – m'(р-ра) = 800г – 600г = 200г
ОТВЕТ: необходимо испарить 200г воды
Список используемой литературы:
1. И.Г. Хомченко «Сборник задач и упражнений по химии для средней школы»
Москва. Новая волна – 2008г.
2. ЕГЭ – Химия 2011 под редакцией А.А. Ковериной. Москва Национальное образование
2011 г.
infourok.ru
Методика решения типовых задач “В9” по химии на тему “Растворы”
Задача 1.
Массовая доля растворенных солей в некотором образце морской воды составляет 3,3%. Определите массу солей, содержащихся в 100,0 л такой воды (р = 1,12 г/мл). Ответ: … г (запишите число с точностью до целых).
Дано:
объем раствора морской воды: Vр-ра — 100,0 л;
массовая доля солей : (НNO3) = 3,3%
плотность раствора: pр-ра = 1,12 г/мл.
Найти: массу солей: mсолей = ?
Решение :
В первую очередь необходимо от объема раствора перейти к его массе, используя плотность. При этом следует учесть, что объем указан в литрах, а плотность в г/мл. Переведем значение
объема в единицы измерения, соответствующие плотности.
Vр-ра = 100 л = 100000 мл
mр-ра = Vр-ра . рр-ра = 100000 . 1,12 = 112000г.
Далее используем соотношение для определения массовой доли.
Ответ: mсолей = 3696 г.
Задача 2.
Масса серной кислоты, содержащейся в 2 л ее водного 30%-ного раствора (р = 1,22 г/мл), равна … г (запишите число с точностью до целых).
Дано:
объем раствора: Vр-ра — 2 л;
массовая доля раствора серной кислоты:(H2SO4) = 30%
плотность раствора: pр-ра = 1,22 г/мл.
Найти: массу серной кислоты: m(H2SO4) = ?
Решение :
В первую очередь необходимо от объема раствора перейти к его массе, используя плотность. При этом следует учесть, что объем указан в литрах, а плотность в г/мл. Переведем значение объема в единицы измерения, соответствующие плотности.
Vр-ра = 2 л = 2000 мл
mр-ра = Vр-ра . рр-ра = 2000 . 1,22 = 2440г.
Далее используем соотношение для определения массовой доли.
Ответ: m(H2SO4) = 732 г.
Задача 3.
Масса сахарозы, содержащейся в 1 л ее водного 50%-ного раствора (р = 1,23 г/мл) равна….. г (запишите число с точностью до целых).
Дано:
объем раствора: Vр-ра — 1 л;
массовая доля раствора сахарозы: (С12Н22О11) = 50%
плотность раствора: pр-ра = 1,23 г/мл.
Найти: массу сахарозы: m(С12Н22О11) = ?
Решение :
В первую очередь необходимо от объема раствора перейти к его массе, используя плотность. При этом следует честь, что объем указан в литрах, а плотность в г/мл. Переведем значение объема в единицы измерения, соответствующие плотности.
Vр-ра = 1 л = 1000 мл
mр-ра = Vр-ра . рр-ра = 1000 . 1,23 = 1230 г.
Далее используем соотношение для определения массовой доли.
Ответ: m(12Н22О11) = 615 г.
Задача 4.
Масса этанола, содержащегося в 2 л его 56%-ного водного раствора (р = 0,900 г/мл) равна … г (запишите число с точностью до целых).
Дано:
объем раствора: Vр-ра — 2 л;
массовая доля раствора этанола:(С2Н6О) = 56%
плотность раствора: pр-ра = 0,900 г/мл.
Найти: массу сахарозы: m(С2Н6О)) = ?
Решение :
В первую очередь необходимо от объема раствора перейти к его массе, используя плотность. При этом следует учесть, что объем указан в литрах, а плотность в г/мл. Переведем значение
объема в единицы измерения, соответствующие плотности.
Vр-ра = 2 л = 2000 мл
mр-ра = Vр-ра . рр-ра = 2000 . 0,900 = 1800 г.
Далее используем соотношение для определения массовой доли.
Ответ: m(С2Н6О) = 1008 г.
Задача 5.
Массовая доля соляной кислоты, полученной растворением 33,6 л (н.у.) хлороводорода в 1,5 л воды, равна … % (запишите число с точностью до сотых).
Дано:
объем раствора: Vр-ра = 1,5 л;
объем хлороводорода: V(HCl) = 33,6 л;
Найти: массовую долю раствора хлороводорода:(HCl) = ?
Решение:
М(HCl) = 36,5 г/моль.
m(H2O) = 1500 мл . 1г/мл = 1500 г
В первую очередь необходимо найти массу газообразного хлороводорода, растворенного в 1,5 л воды.
m(HCl) = n(HCl) . M(HCl) = V(HCl)/Vm. M(HCl) = 33,6 л/22,4л/моль . 36,5 г/моль = 54,75 г.
2. Находим массу раствора:
mр-ра = m(H2O) + m(HCl) = 1500 г + 54, 75 г = 1554,75 г.
3. Далее используем соотношение для определения массовой доли.
Ответ: (HCl) = 3,52%.
buzani.ru
Химик.ПРО -Растворы | Решение задач по химии бесплатно
Растворы
Растворимость карбоната серебра (Ag2CO3) в воде при 25 0C равна 1,16 ⋅ 10-4 моль/л. Вычислить произведение растворимости его при этой температуре.
Добавлено 11/12/2014Вычислить массовую долю нитрата серебра (AgNO3) в растворе, полученном при растворении соли массой 40 грамм в воде (h3O) количеством 20 моль.
Добавлено 26/11/2014Чему равна масса раствора соли 19-процентного (в граммах), в котором содержится 95 грамм соли?
Добавлено 13/10/2014К какому объёму воды следует добавить 1 миллилитр соляной кислоты (HCl) с молярной концентрацией 0,1 моль/л, чтобы получить раствор с рОН 11?
Добавлено 1/04/2014Какой объем раствора азотной кислоты (HNO3) концентрированного с массовой долей равной 60 % и плотностью раствора 1,37 г/см3 необходимо взять для приготовления 800 см3 раствора с молярной концентрацией вещества, равной 2 моль/л?
Добавлено 27/01/2014Какой из двух гидроксидов является более сильным основанием: Ba(OH)2 или Mg(OH)2; Ca(OH)2 или Fe(OH)2; Cd(OH)2 или Sr(OH)2? Почему?
Добавлено 25/01/2014В воде массой 1000 г растворили 2 моль сульфата калия. Вычислите массовую долю растворенного вещества.
Добавлено 15/12/2013Найдите массовую долю соли в полученном растворе, если к раствору хлорида кальция (CaCl2) массой 140 грамм с массовой долей 10% добавили 10 грамм этой же соли и 25 миллилитров воды (h3O).
Добавлено 13/12/2013Для образования средней соли к 40 миллилитрам раствора серной кислоты (h3SO4) с плотностью 1,025 г/мл добавили 43,2 миллилитра 7,4-процентного раствора гидроксида калия (KOH) с плотностью 1,06г/мл. Рассчитайте массовую долю серной кислоты в растворе.
Добавлено 27/11/2013Сколько миллилитров раствора с массовой долей хлорида бария (BaCl2) 4% и плотностью 1,02 г/см3 следует прибавить к раствору серной кислоты (h3SO4) для образования 11,65 грамм сульфата бария (BaSO4)? Хлорид бария серная кислота
Добавлено 7/10/2013himik.pro
Интегрированный урок (математика + химия) по теме “Растворы. Решение ситуационных задач на растворы”
Разделы: Математика, Химия
Пояснительная записка
Ситуационные задачи, позволяющие обучать школьников решать жизненные проблемы с помощью предметных знаний, относятся к понятию методических ресурсов. Они позволяют представить предметные и метапредметные результаты образования в комплексе умений и навыков, основанных на предметных и межпредметных знаниях за счёт усвоения разных способов деятельности, методов работы с информацией.
Ситуационные задачи – это задачи, позволяющие ученику осваивать интеллектуальные операции последовательно в процессе работы с информацией: ознакомление — понимание — применение — анализ — синтез — оценка. Ситуационные задачи близки к проблемным задачам и направлены на выявление и осознание способа деятельности. При решении ситуационной задачи учитель и учащиеся преследуют разные цели: для учащихся — найти решение, соответствующее данной ситуации; для учителя — освоение учащимися способа деятельности и осознание его сущности.
Специфической чертой многих ситуационных задач, является множественность допустимых способов решений. Зачастую для решения ситуационной задачи учащимся требуется знание нескольких учебных предметов. Межпредметные связи математики с химией имеют достаточно большие потенциальные возможности, основанные на математических моделях химических процессов.
Цель урока: познакомить с приемами решения ситуационных задач в математике и химии, расширить знания о значении этих растворов в быту, сформировать целостную картину о взаимосвязи предметов в школе.
Задачи:
Образовательные:
- Актуализировать понятие процента, массовой доли вещества и концентрации вещества.
- Познакомить с нестандартным способом решения задач на смешивание двух растворов разной концентрации.
Развивающие:
- Развивать способности самостоятельного выбора метода решения задач.
- Учиться обобщать, анализировать и конкретизировать знания.
- Развивать научное мировоззрение, творческое мышление посредством создания проблемной ситуации.
Воспитательные:
- Продолжить развивать умение работать в парах;
- Воспитывать уважение к мнению других членов коллектива;
- Формировать чувство ответственности за свою работу.
Оборудование:
- Минеральные удобрения в твердом виде, весы, разновесы, химические стаканы, вода.
- Оргтехника.
Тип урока: урок объяснение нового материала.
Методы обучения: частично-поисковый, репродуктивный, словесно – наглядно – практический.
Деятельность учителей:
Планируют работу учащихся заранее, осуществляет оперативный контроль, оказывают помощь, поддержку и вносят коррективы в их деятельность.
Ход урока
При изучении наук
примеры полезнее правил.
Исаак Ньютон
I. Организационный этап.
Учитель математики: Здравствуйте! Сегодня мы проводим необычный урок – урок на перекрестке наук математики и химии.
Учитель химии: Здравствуйте, ребята! Мы с вами увидим, как математические методы решения задач помогают при решении задач по химии.
II. Мотивационно-информационный этап. Постановка проблемы.
Учитель математики: каждый ребенок любит молочный коктейль – это не только очень вкусный, но и очень полезный напиток. Кальций, содержащийся в молочном коктейле, служит для формирования опорно-двигательной системы, зубов, волос и ногтей каждого человека. Какую массу молока 3% жирности и пломбира 30% жирности необходимо взять для приготовления 100г 20% праздничного коктейля?
Учитель химии:
– Я вижу удивление в ваших глазах, вы не знаете, как это сделать? Прежде всего, посмотрите на этот напиток с точки зрения химии.
– Что представляет собой молоко с точки зрения химии?
– Что означает жирность молока?
– Исходя из ваших ответов и глядя на эпиграф урока, сформулируйте тему урока и цель.
Итак, тема нашего урока “Растворы. Решение ситуационных задач на растворы”.
Цель. Обобщить и систематизировать знания о массовой доле вещества, процентах и способах решения ситуационных задач в математике и химии.
III этап. Планирование решения проблемы и достижения цели урока. Актуализация знаний учащихся.
А теперь давайте составим последовательность наших шагов для достижения цели урока.
Вспомним всё, что мы уже знаем по этой теме.
Учитель химии
– Из чего состоит раствор? (Из растворителя и растворённого вещества)
– Что такое массовая доля растворенного вещества? (Отношение массы растворенного вещества к общей массе раствора.)
– Вспомните формулу для вычисления массовой доли растворенного вещества
% = mв-ва *100%/mр-ра
Учитель математики:
– А с математической точки зрения? (Разное процентное содержание вещества).
– Для урока необходимо повторить понятие процента.
– Что называют процентом? (1/100 часть числа.)
– Установите соответствие
40% 1/4 25% 0,04 80% 0,4 4% 4/5
Одним из основных действий с процентами – нахождение процента от числа.
– Как найти процент от числа? (% записать в виде дроби, умножить число на эту дробь.)
– Найти 10% от 30 (10%=0,1, 30*0,1=3)
– Вычислите 1) 20% числа 300; 2) число, 12% которого равны 24.
IV этап. Первичное закрепление.
Учитель химии предлагает решить учащимся задачу:
Задача №1. Перед посадкой семена томатов дезинфицируют 15% раствором марганцовки. Сколько граммов марганцовки потребуется для приготовления 500 г такого раствора?
Учитель математики.
– Давайте посмотрим на эту задачу с точки зрения математики. Какое правило на проценты вы применили при решении этой задачи? (Правило нахождения процента от числа.)
15% от 500
500*0,15=75(г)- марганцовки.
Ответ: 75 г.
– Как видите, задачи, которые вы встречаете на химии, можно решать на уроках математики без применения химических формул.
V этап. Включение в систему знаний и повторений
Практическая работа “Приготовление растворов удобрений”
Учитель химии: На улице весна и, в связи с увеличением светового дня, все комнатные растения нуждаются в подкормке. То есть сегодня мы польем наши цветы в кабинете удобрениями. Но для начала растворы удобрений надо приготовить. Итак, предельной дозой мочевины считается концентрация 0,25%, калийной селитры – 0,2%, сульфата магния – 0,5%. Нужно приготовить по 500г каждого раствора (Дети готовят растворы и поливают комнатные растения в кабинете).
1.Рассчитаем массы каждого уравнения
2.Измерим массу каждого удобрения на весах в нужном количестве
3.Поместим удобрения в химический стакан, зальем водой, перемешаем.
4.Польем цветы в кабинете.
VI этап. Творческое применение и добывание знаний в новой ситуации
Учитель математики: Давайте решим задачу на смешивание растворов разных концентраций.
При смешивании 10%-го и 30%-го раствора марганцовки получают 200 г 16%-го раствора марганцовки. Сколько граммов каждого раствора взяли?
– О чем говорится в этой задаче? (о растворах) – Что происходит с растворами? (смешивают)
– Чему равна масса нового раствора? (При смешивании растворов масса нового раствора становится равной сумме смешанных растворов).
– Чему равна масса вещества нового раствора? (Масса растворенного вещества при смешивании двух растворов суммируется).
Решение:
| Раствор | %-е содержание | Масса раствора (г) | Масса вещества (г) |
| 1 раствор 2 раствор | 10% = 0,1 30% = 0,3 | х 200-х | 0,1х 0,3(200-х) |
| Смесь | 16% = 0,16 | 200 | 0,16*200 |
0,1х + 0,3(200-х) = 0,16*200
0,1х + 60 – 0,3х = 32
-0,2х = -28
х = 140
140(г)- 10% раствора
200 – 140 = 60(г)-30% раствора.
Ответ: 140 г (10% раствор) и 60 г (30% раствор).
Учитель химии:
– А сейчас пришло время решить задачу на приготовление молочного коктейля. Какую массу молока 5% жирности и пломбира 30% жирности необходимо взять для приготовления 100г 20% праздничного коктейля?
Решение с использованием площадей равновеликих прямоугольников:
Обозначим x г массу первого раствора, тогда масса второго (100 – x)г. Составим уравнение:
10x = 15 (100 – x)
10x = 1500 – 15x
25x =1500
x = 60
Ответ: 60 г молока и 40 г пломбира.
VII этап. Самостоятельная работа с проверкой.
Решите задачу:
Для засола огурцов используют 7% водный раствор поваренной соли (хлорида натрия NaCl). Именно такой раствор в достаточной мере подавляет жизнедеятельность болезнетворных микроорганизмов и плесневого грибка, и в то же время не препятствует процессам молочнокислого брожения. Рассчитайте массу соли и массу воды для приготовления 1 кг такого раствора?
VIII этап. Рефлексия.
Сегодня вы решили проблему, работая вместе, помогая друг другу. Так и в жизни, для того чтобы решить сложную проблему, нужна взаимопомощь. А теперь закончим предложения
- Сегодня на уроке я узнал…
- Вызвало затруднение…..
- Мне это пригодится….
Оценки за урок.
IX этап. Домашнее задание. Решите задачу:
Для проведения опыта научный сотрудник химической лаборатории смешал 4% и 10% растворы некоторого химического вещества и получил 75 г 8% раствора этого вещества. Сколько граммов 4% и сколько граммов 10% раствора было взято?
Итоги урока:
Учитель химии
Какие методы решения химических задач мы сегодня рассмотрели?
Учитель математики
Предлагаем дома решить данную задачу разными способами.
xn--i1abbnckbmcl9fb.xn--p1ai
Задачи по теме Растворы
Задачи по теме «Растворы и растворимость»
Вычисление массовой доли вещества в растворе
- Натрий сульфат массой 8 г растворили в воде массой 192 г. Определите массовую долю натрий сульфата в полученном растворе.
- Вычислите массы хлорида натрия и воды, необходимых для приготовления 200 г раствора с массовой частью соли 5%
- В результате выпаривания раствора массой 80 г получили твердый остаток хлорида калия массой 16 г. Вычислите массовую долю хлорида каля в растворе.
Вычисление массовой доли газообразного вещества в растворе
- Гидроген хлорид объемом 179,3 л растворили в воде массой 708 г. Вычислите массовую часть гидроген хлорид в полученном растворе.
- В 400 мл воды растворили 33,6 л хлороводорода. Определите массовую долю соляной кислоты в растворе
Вычисление массовой доли вещества в растворе при смешивании
1) при добавлении растворенного вещества
- Вычислите массовую часть хлорида натрия в растворе, который образуется при растворении 5 г соли в 245 г раствора с массовой частью хлорида натрия 10%
- К раствору массой 120 г с массовой долей ортофосфатной кислоты 15% добавили ортофосфатную кислоту массой 40 г. Определите массовую долю вещества в полученном растворе.
- К раствору гидрокарбоната натрия массой 200 г с массовой долей соли 10% добавили 5г гидрокарбоната натрия. Определите массовую долю соли.
2) при изменении количества растворителя
- Вычислите массовую часть гидроксида натрия в растворе, который образуется при добавлении 150 г воды к раствору гидроксида натрия массой 450 г с массовой долей щелочи 5%.
- Уксусная эссенция – это 80% раствор уксусной кислоты в воде. Сколько эссенции надо взять, чтобы получить 190 г 50% раствора?
- Какую массу раствора с массовой долей карбоната натрия 25% необходимо добавить к воде массой 500 г, чтобы получить раствор с массовой долей карбоната натрия 5%?
3) при смешивании двух растворов
- Определите массовую часть сульфатной кислоты в растворе, который образуется при смешивании 200 г раствора с массовой частью кислоты 40% и 300 г раствора с массовой частью этой же кислоты 20%.
- Смешали 250 г 10% и 750 г 15% растворов глюкозы. Вычислите массовую долю глюкозы в полученном растворе.
- Смешали растворы нитратной кислоты массой 80 г с массовой долей кислоты 20% и массой 120 г с массовой долей 10%. Определите массовую часть нитратной кислоты в полученном растворе.
- Вычислите массу раствора сульфатной кислоты с массовой долей 50%, которую необходимо добавить в раствор сульфатной кислоты массой 400 г с массовой долей 10%, чтобы получить раствор с массовой долей вещества 30%
- Необходимо приготовить 60г 50% раствора нитратной кислоты. Какую массу 20% и 80% растворов нитратной кислоты надо взять для этого?
- В лаборатории есть только 10% и 50% растворы сульфатной кислоты. Какую массу каждого раствора надо взять, чтобы приготовить 40 г 30% раствора.
Вычисление массовой доли вещества в растворе, который образуется вследствие химического взаимодействия растворенного вещества с растворителем
- Определите массовую часть вещества в растворе, которое образовалось в результате растворения оксида натрия массой 93 г в 507 г воды.
- К раствору массой 120 г с массовой долей ортофосфатной кислоты 15% добавили оксид фосфора (V) массой 14,2 г. Определите массовую долю вещества в растворе.
- Вычислите массу раствора с массовой долей гидроксида калия 7,93%, в котором необходимо растворить 47 г оксида калия, чтобы получить раствор с массовой частью гидроксида калия 7,93%.
Вычисление массовой доли вещества в растворе, который образуется вследствие химического взаимодействия растворенного вещества с растворителем, если в результате выделяется газообразный продукт
- Определите массовую долю вещества в растворе, который образуется в результате растворения 4,6 г натрия в воде массой 75, 6 г.
Задачи с использованием понятия «плотность раствора»
- Рассчитайте массовую долю нитратной кислоты в растворе, 1 литр которого содержит 224 г кислоты, а плотность раствора равна 1,12 г/мл.
- Определите массовую часть нитратной кислоты в растворе, который образуется в результате добавления воды массой 400 г в раствор нитратной кислоты объемом 200 мл с массовой частью кислоты 63% (ρ = 1,4 г/мл)
Вычисление объемной части растворенного вещества
- К воде массой 40 г прилили ацетон объемом 100 мл и плотностью 0,79 г/мл и получили раствор плотностью 0,88 г/мл. Определите объемную часть ацетона в растворе.
Вычисление коэффициента растворения и задачи с использованием коэффициента растворимости
- В 270 г насыщенного раствора при температуре 150С содержится 70 г хлорида аммония. Определите коэффициент растворимости хлорида аммония
- Коэффициент растворимости соли при температуре 500С составляет – 40, а при 100С – 15. Определите массу осадка, полученного вследствие охлаждения раствора массой 70 г от 500С до 100С
- Какую массу воды и кухонной соли надо взять для приготовления 300 г насыщенного раствора при 800С. Растворимость хлорида натрия при данной температуре составляет 38,1 г на 100 г воды.
Вычисление молярной концентрации
- В воде растворили гидроксид калия массой 11,2 г, объем довели до 200 мл. Вычислите молярную концентрацию полученного раствора.
- Рассчитайте молярную концентрацию300 мл раствора сульфата натрия с массовой долей 5% и плотностью раствора 1,03 г/мл
- Рассчитайте молярную концентрацию 96% раствора этилового спирта в воде (ρ = 1,56 г/мл).
Задачи с использованием понятия «кристаллогидрат»
- Определите массовую часть сульфата купрума (ІІ) в растворе, который образуется в результате растворения медного купороса массой 25 г в воде массой 175 г.
- Определите массы медного купороса и раствора сульфата меди для приготовления раствора массой 420 г с массовой долей растворенного вещества 16%.
- Определите массу воды, в которой необходимо растворить 27,8 г железного купороса, чтобы получить раствор с массовой частью сульфата феррума (ІІ) 3,8%.
Перерасчеты количественных характеристик растворов
- Определите массовую долю хлорида кальция в растворе, молярная концентрация которого составляет 1,4моль/л, а плотность равна 1,12 г/мл.
- Коэффициент растворимости хлорида купрума (ІІ) при температуре 200С составляет 74,5г. Вычислите массовую долю хлорида купрума в насыщенном растворе данной температуры.
- Найдите молярную концентрацию 30% серной кислоты, плотность раствора которой 1,22 г/мл.
nafleshku.com.ua
| Категория: Химия | Добавил: (18.12.2016) Просмотров: 1 | Рейтинг: 0.0/0 |
xn—-8sbhepth3ca.xn--p1ai
